-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Vitamin K a jeho význam v laboratorní medicíně
Vitamin K and its importance in laboratory medicine
Vitamin K belongs to the group of the fat-soluble vitamins and there are three forms of vitamin K – K1, K2, K3. Vitamin K acts as cofactor of post-translational carboxylation of glutamic acid to γ-carboxyglutamic acid, which is important for binding of calcium ions by coagulation factors, protein C and protein S. It participates in functions of other proteins interacting with calcium ions e.g. osteocalcin and matrix Gla protein. Vitamin K1 plays a role especially in blood coagulation while vitamin K2 affects bone remodeling and calcium homeostasis. An anticancer effect is described at all of forms of vitamin K, however the best results in vitro and in vivo were described by vitamin K3 for now. Daily intake of vitamin K1 in a Western diet is sufficient for blood coagulation, whereas daily intake of vitamin K2 is insufficient for covering carboxylation of vitamin K dependent proteins. Insufficient carboxylation of vitamin K dependent proteins is associated with higher risk of osteoporosis fracture´s occurrence, and excessive calcification of vascular walls due to calcium paradox. Vitamin K is absorbed from the gastrointestinal tract in the presence of bile salts and pancreatic lipase, and in plasma is transported by lipoproteins. The reference range of vitamin K1 can be found in the literature whereas the reference range of vitamin K2 has been not published. Vitamin K can be determined by chromatografic methods.
Key words:
vitamin K1, vitamin K2, osteoporosis, cancer, diabetes mellitus, cardiovascular diseases, HPLC.
Autoři: K. Dunovská; E. Klapková; J. Čepová; R. Průša
Působiště autorů: Ústav lékařské chemie a klinické biochemie 2. LF UK a FN Motol, Praha
Vyšlo v časopise: Klin. Biochem. Metab., 26, 2018, No. 1, p. 27-34
Souhrn
Vitamin K patří mezi vitaminy rozpustné v tucích a existují jeho tři základní formy – K1, K2 a K3. Vitamin K působí jako kofaktor post-translační karboxylace kyseliny glutamové na γ-karboxyglutamovou. Tato karboxylace je důležitá pro vazbu vápenatých iontů koagulačními faktory, pro protein C a protein S. Podílí se také na karboxylaci dalších bílkovin např. osteokalcinu a matrix Gla proteinu. Vitamin K1 se účastní především krevní koagulace, zatímco vitamin K2 se podílí na kostní remodelaci a kalciové homeostázi. Antikancerózní efekt je popisován u všech forem vitaminu K, avšak prozatím nejlepší výsledky in vitro a také in vivo byly pozorovány u vitaminu K3. Vitamin K1 přijatý běžnou pestrou stravou dostatečně pokryje požadavky koagulačních faktorů. Zhruba u 9 z 10 lidí nepostačuje příjem vitaminu K2 ze stravy na pokrytí dostatečné karboxylace ostatních vitamin K dependentních proteinů. Nedostatečná karboxylace vitamin K dependentních proteinů je spojována s vyšším rizikem výskytu osteoporotických zlomenin a nadměrnou kalcifikací cévní stěny v důsledku kalciového paradoxu. Vitamin K je transportován ve vazbě na lipoproteiny a jeho absorpce v trávicí soustavě je závislá na množství přijatého tuku společně s vitaminy. Fyziologické hodnoty vitaminu K1 byly publikovány narozdíl od vitaminu K2. Vitamin K je možné stanovit chromatografickými metodami.
Klíčová slova:
vitamin K1, vitamin K2, osteoporóza, nádorové onemocnění, diabetes mellitus, kardiovaskulární choroby, HPLC.Úvod
Vitamin K označuje skupinu sloučenin, které se vyznačují společným 2-metyl-1,4-naftochinonovým jádrem. Podle odlišných struktur postranních řetězců rozlišujeme jednotlivé formy vitaminů K – vitamin K1, vitamin K2 a vitamin K3. Vitamin K působí jako kofaktor γ-glutamylkarboxylázy, která je důležitá pro post-translační modifikace vitamin K dependentních proteinů [1-2].
V literatuře je popsáno fyziologické rozmezí vitaminu K1, které se však v jednotlivých pramenech liší. Kazda [3] uvádí fyziologické rozmezí vitaminu K1 0,13 – 1,19 µg/l. Sadowski [4] uvádí 0,11 – 1,01 µg/l. Kraemer [5] publikoval fyziologické rozmezí vitaminu K1 0,1 – 3,2 µg/l. Jediná na trhu dostupná komerční souprava pro stanovení vitaminu K1 uvádí fyziologické rozmezí vitaminu K1 0,22 – 2,28 µg/l [6]. Pro vitamin K2 fyziologické rozmezí není v odborné literatuře publikováno.
Nejpoužívanější publikované metody na stanovení jednotlivých forem vitaminu K jsou metody vysokoúčinné kapalinové chromatografie (HPLC), která v posledních letech využívá spojení s hmotnostní detekcí. Tato kombinace nabízí přesnější a citlivější analýzu a zároveň řeší problémy s nedostatečným oddělením jednotlivých forem vitaminu K [6-15].
Struktura a formy vitaminu K
Vitamin K1 (fylochinon) má fytylový postranní řetězec. Vitamin K1 je žlutá olejovitá látka, která je rozpustná v acetonu, benzenu a některých dalších organických rozpouštědlech. Vitamin K1 je málo rozpustný v metanolu a ve vodě je nerozpustný. Vitamin K2 (menachinon) má v postranním řetězci opakující se isoprenové jednotky. V literatuře bývá menachinon označován písmeny MK-n, kde písmena MK označují zkratku pro menachinon a písmeno n představuje počet isoprenových jednotek v postranním řetězci, které mohou dosahovat hodnot 1 – 15. Vitamin K2 je žlutá krystalická látka, která je méně rozpustná v organických rozpouštědlech než vitamin K1 a taktéž je nerozpustná ve vodě. Poslední formou vitaminu K je vitamin K3 (menadion), který nemá žádný postranní řetězec. Vitamin K3 je citrónově žlutá krystalická látka, která se rozpouští v organických rozpouštědlech, např. chloroformu. Na rozdíl od vitaminu K1 a K2 je vitamin K3 částečně rozpustný ve vodě. Struktura jednotlivých vitaminů K je uvedena na obr. 1 až 3 [1,13,16].
Vitamin K1 se vyskytuje hlavně v listové zelenině, kde se nachází v zeleném pletivu usazen v chloroplastu. Potraviny bohaté na tento vitamin jsou např. brokolice, špenát, kapusta, salát, rostlinný olej (zejména řepkový a sójový). Nacházíme jej také v červených řasách, sinicích nebo v margarínu. Jeho množství v zelenině by mělo pokrýt doporučený denní příjem [1-2].
Vitamin K2 byl zjištěn v sýru, masu, tvarohu, játrech, vejcích a zvířecím tuku. Nejvíce bohatou potravinou na vitamin K2 je tzv. natto, což je fermentovaná sója, která vzniká produkcí bakterií Bacillus subtilis, poddruh natto. Natto je konzumováno zejména v Japonsku. Bakterie působící v lidských střevech a produkující vitamin K2 patří do rodu Bacteroides a Firmicutes, dále také Enterobacter, Eubacterium, Veillonella. Bakterie ve střevním traktu syntetizují hlavně MK-10 a MK-11, v menší míře také MK-7, MK-8, MK-9 a MK-12. Prozatím není jasné, jaké množství vitaminu K2 jsou schopné syntetizovat.
Ze stravy získáváme nejvíce MK-4 a MK-7. MK-7 se vyskytuje ve fermentovaných potravinách (natto, sýr). MK-4 získáváme konzumací masa ze zvířat, která jsou živena rychle rostoucími travami, v nichž se vyskytuje vitamin K1. Tato zvířata jsou schopná ve svých organismech konvertovat vitamin K1 na MK-4. Zatím není jasný princip konverze [16,17].
V 60. letech byla popsána konverze vitaminu K1 na MK-4 vyskytující se u ptáků. Princip konverze však není úplně jasný. Byly popsány dva teoretické postupy konverze. U prvního by měl být odštěpen postranní řetězec fylochinonu a vznikla by toxická forma vitaminu K – menadion (vitamin K3). Ta by byla částečně detoxifikována játry či trávicí soustavou a byla by vyloučena močí z organismu. A částečně by k ní byly připojeny isoprenové jednotky, čímž by vznikla forma MK-4. Druhý princip bere v úvahu denaturaci fytylového postranního řetězce fylochinonu a následnou posttranslační modifikaci (prenylaci = připojení geranylgeranyl (isoprenoid) k C-terminálnímu cysteinu cílového proteinu) MK-4. V obou teoriích se vyskytují značné nejasnosti např. ve vyřešení transportu vitaminu K3 krví nebo v rychlosti připojení isoprenových jednotek. Bylo zjištěno, že přeměna vitaminu K1 na MK-4 probíhá rozdílně mezidruhově (např. krysy konvertují vitamin K1 méně než holubi) [2]. Z dostupné literatury vyplývá, že s největší pravděpodobností jsou i lidé schopni konverze vitaminů K, kde bylo měřením prokázáno, že při příjmu vitaminu MK-7 se zvyšuje v krvi současně i koncentrace MK-4. Avšak některé publikace ukázaly [16-18], že vyšší příjem vitaminu K1 ve stravě zvýší koncentraci vitaminu K2 v mateřském mléce, nikoliv v krvi. Vyšší formy vitaminu K2 jako MK-9 či MK-10 ve stravě nalézáme vzácně. Vitamin K3 se přirozeně nevyskytuje a je pouze syntetický. Pokud je vitamin K3 podán, dochází u něj in vivo k alkylaci na některou formu vitaminu K2. Vitamin K3 je oproti vitaminům K1 a K2 rozpustný i ve vodě (160 mg/l), a proto ho lze vstřebat i v nepřítomnosti žlučových kyselin [2].
Metabolismus vitaminu K
Jednotlivé typy vitaminu K se neliší pouze rozdílnou strukturou postranního řetězce, ale i transportem v těle, absorpcí ze stravy, uložením zásob nebo účinností. Absorpce MK-4 ze stravy je nízká, jeho účinnost je zhruba desetkrát nižší než u vitaminu K1, zatímco MK-7 svojí účinností převyšuje vitamin K1 až 17x. Vitamin K3 má srovnatelnou účinnost s MK-4 [1].
Vitamin K1 se vstřebává ze střeva a jeho absorpce silně závisí na celkovém množství přijatého vitaminu K1 a také na množství přijatého tuku. Bylo popsáno, že při nižším příjmu vitaminu K1 je absorpce mnohem účinnější, s rostoucím příjmem tuku jeho absorpce dále vzrůstá. Vitamin K1 je ve střevě začleněn do chylomikronů a odtud je transportován přes lymfu až do krve, kde dochází k jeho velmi rychlé spotřebě. Chylomikrony jsou rozrušeny lipoproteinovou lipázou a tak může být vitamin K1 využit okolními tkáněmi. Vitamin K1 je hlavní cirkulující forma vitaminu K, avšak v těle není skladován ve velkém množství. Tělo si skladuje vitamin K zhruba v poměru 1 : 9 ve prospěch vitaminu K2 oproti vitaminu K1. Největší zásobárnou vitaminu K v těle jsou játra, avšak zde dochází k rychlé spotřebě, proto musí docházet k neustálému doplňování ze stravy. V některých tkáních byly stanoveny koncentrace vitaminu K1. V játrech společně se srdcem a slinivkou byly zjištěny koncentrace zhruba 4,51 ng/g tkáně. V mozku, ledvinách a plicích nedosahovaly koncentrace 0,90 ng/g tkáně. Nízká koncentrace vitaminu K1 v plazmě reflektuje nízkou tkáňovou zásobu. Obdobné rozložení koncentrací je i u formy MK-4, kde v mozku a ledvinách byly zjištěny koncentrace zhruba 2,67 ng/g, zatímco ve slinivce dosahovala koncentrace MK-4 zhruba 9,78 ng/g [1,19].
Vitamin K2 má podobnou transportní dráhu jako vitamin K1 kromě toho, že se transportuje na LDL a HDL lipoproteinových částicích až do cílových tkání [1].
Vitamin K1 a vitamin K2 se dále liší dobou působení. Zatímco vitamin K1 a MK-4 mají biologický poločas 1 až 1,5 hodiny, vitaminy K2 s delším postranním řetězcem mají delší poločas působení a tudíž mohou být déle využívány [1]. Autoři Schurgers et al. [20] publikovali studii, ve které byli schopni naměřit hladiny vitaminu MK-7 v organismu delší dobu po užití než hladiny vitaminu K1. Dobrovolníkům mezi 25 až 35 lety podávali v jedné dávce vitamin K1 a MK-7. Hladinu obou vitaminů sledovali po dobu 96 hodin. Oba vitaminy zaznamenaly maximum zhruba po 4 hodinách a poté následoval jejich pokles. MK-7 na rozdíl od vitaminu K1 snižoval svoji hladinu mnohem pomaleji a mohl být detekován i po 96 hodinách [20].
Játra jsou důležitým orgánem pro katabolismus vitaminu K, v nichž jsou polyisoprenoidní řetězce zkracovány a prochází ω-oxidací s následnou β-oxidací, která vede ke dvěma hlavním aglykonovým metabolitům s délkou postranního řetězce s 5 nebo 7 uhlíkovými atomy. Po konjugaci s kyselinou glukoronovou jsou metabolity exkretovány do žluče a moče zejména ve formě glukuronidů. V moči tyto metabolity lze detekovat a je možné je posuzovat jako nepřímé testy koncentrace vitaminu K v organismu [13].
Vitamin K se nachází v organismu v nízkých koncentracích, a proto dochází k jeho recyklaci. Vitamin K je v těle transformován enzymem γ-glutamylkarboxylázou (hydrochinon-reduktázou; GGCX; EC 4.1.1.90) na redukovanou formu – epoxid. Ten aktivuje glutamátový zbytek na karbanion, který reaguje neenzymově s CO2 na γ-karboxyglutamát. GGCX se skládá ze 758 aminokyselin. Mezi 99. a 450. aminokyselinou je přítomna disulfidická vazba. GGCX pětkrát prochází membránou endoplazmatického retikula (ER), kde N-konec je přítomen v cytoplazmě, zatímco C-konec se nachází v lumenu ER. V lumenu ER je aktivní místo pro deprotonaci a dochází zde ke karboxylaci. Gen pro GGCX je uložen na chromozomu 2p12, o velikosti zhruba 13 kb obsahující 15 exonů. Pokud dojde k mutaci genu pro GGCX, může mít postižený jedinec problémy s koagulací, souhrnně nazývané vitamin K dependentní deficit koagulačních faktorů, nebo se může jednat o nekrvácivý stav tzv. pseudoxanthoma elasticum (PXE)-like syndrom, kde nastává aberantní mineralizace měkkých tkání zejména v oblasti očí, kůže a kardiovaskulárním systému. K tomuto stavu dochází vlivem snížené karboxylace matrix Gla protein (MGP) [21-22]. Vitamin K epoxid se redukuje pomocí vitamin K-epoxid-reduktázy (EC 1.1.4.1) na chinon. Vitamin K-epoxid-reduktáza je citlivá na přítomnost warfarinu. Chinon je dále redukován pomocí vitamin K-chinon-reduktázy (EC 1.6.5.2), která je taktéž citlivá na přítomnost warfarinu, nebo pomocí chinonreduktázy (nesensitivní na warfarin, EC 1.6.5.5) na aktivní hydrochinon. Při přítomnosti warfarinu dochází k tomu, že se vitamin K epoxid neredukuje, přičemž dochází k jeho akumulaci v těle a vyloučení. Pokud je stravou přijímáno dostatečné množství vitaminu K (chinonu), lze obejít senzitivní enzymy na warfarin cestou warfarin-nesenzitivní reduktázy, kdy dochází k přeměně na hydrochinon. Cyklus dále pokračuje využitím vitaminu K a vyloučením epoxidu. Užívání kumarinových přípravků jako je například warfarin vede k zabránění karboxylace. Tím dochází ke snížení aktivace koagulačních proteinů a takto neúčinné faktory se hromadí v krvi jako PIVKA (= proteins induced by vitamin K absence). Při užívání kumarinových léčiv během těhotenství hrozí kostní abnormality plodu např. fetální warfarinový syndrom, který se projevuje zejména nasální hypoplasií a chondroplasií [21-23].
Funkce vitaminu K
Vitamin K působí jako kofaktor pro enzym γ-glutamylkarboxyláza, který katalyzuje posttranslační γ-karboxylaci kyseliny glutamové (Glu) v poloze 17, 21 a 24 na γ-karboxyglutamovou kyselinu (Gla). Tato karboxylace je důležitá nejen pro správnou funkci koagulační kaskády, ale také pro osteokalcin a MGP. Pokud je osteokalcin dostatečně karboxylovaný, lépe váže vápenaté ionty do kostní hmoty. V desetileté studii, které se účastnilo 72 327 žen ve věku 38 – 63 let, bylo prokázáno snížení rizika zlomenin kyčle až o 30 % při pravidelném užívání vitaminu K, avšak autoři přesně nespecifikovali, o jakou formu vitaminu K se jedná [2,18].
Dostatečná karboxylace je také důležitá u MGP. MGP je malý protein s molekulovou hmotností 14,7 kDa. MGP obsahuje 84 aminokyselinových reziduí a 5 Gla reziduí. S karboxylací MGP souvisí kalcifikace cévní stěny. Při nedostatečné karboxylaci MGP dochází k tvz. „kalciovému paradoxu“, kdy se nadměrně ukládají vápenaté ionty do cévní stěny na úkor kostní hmoty. V důsledku tohoto paradoxu jsou ohroženy dva systémy: cévní systém s rizikem rozvoje aterosklerózy a kostra s rizikem rozvoje osteoporózy [2, 24]. V Rotterdamské studii byl posuzován vliv vitaminu K1 a vitaminu K2 na rozvoj kardiovaskulárního onemocnění. V této studii bylo prokázáno, že příjem více než 250 μg vitaminu K1 za den nemá žádný protekční vliv na kardiovaskulární systém, zatímco příjem 25 μg vitaminu K2 (směs forem MK-4 až MK-10) za den redukuje riziko kardiovaskulárního onemocnění až o 57 % [25]. Vliv vitaminu K2 na karboxylaci MGP byl prokázán v placebo studii, kde při užívání 180 μg MK-7 byl pokles nedostatečně karboxylovaného MGP (ucMGP) o 31 % oproti placebu. Dokonce při zvýšení dávky MK-7 na 360 μg došlo k větší redukci ucMGP o 46 % oproti skupině s placebem [18]. Matrix Gla protein má důležitou roli i mimo inhibici kalcifikace. Exprese MGP souvisí s některými typy nádorů. Byl popsán přímý vztah mezi expresí MGP a nádorovou vaskularizací. Zvýšená exprese MGP byla popsána u některých rakovinových onemocnění např. rakovina prsu a ovárií, karcinomy ledvin, varlat a prostaty aj. Naopak snížená exprese matrix Gla proteinu byla popsána u kolorektálního adenokarcinomu a rakoviny plic [24].
Vitamin K2 podporuje v mozku některé enzymy, které produkují sulfatidy. Postupně s věkem dochází ke snížení hladiny vitaminu K2 i sulfatidů. Oba tyto poklesy souvisí s rozvojem stařecké neurologické degenerace. Až u 93 % pitev pacientů s raným stádiem Alzheimerovy choroby byla pozorována v mozku jak nižší hladina vitaminu K2, tak sulfatidů [2].
U vitaminu K2 byl in vitro pozorován antikancerózní efekt. Prozatím se jako nejúčinnější antikancerózní forma jeví vitamin K3, ale jeho použití je nejasné vzhledem k jeho toxicitě a případným alergickým reakcím, které vyvolává po podání. Bylo však publikováno, že vitamin K3 je možné podávat v nízkých koncentracích současně s vyššími dávkami vitaminu C. Tato kombinace i přes nízkou koncentraci vitaminu K3 se jeví jako dostatečně antikancerózní, kdy dokáže zpomalit či zastavit nádorový růst. Prozatím tato kombinace vitaminů byla úspěšně testována na zvířecím modelu. Pokud by vitamin K3 v této kombinaci nevyvolával alergické reakce, mohl by být zařazen mezi léčiva. Autoři Nakaya et al. [26] ve své publikaci potvrdili účinnost vitaminu K2 na některé buněčné linie vyskytující se při karcinomu ovárií. Vitamin K2 má oproti vitaminu K3 výhodu, že nevyvolává alergické reakce, a tudíž může být použit i ve vyšších dávkách. Vitamin K2 funguje jako inhibitor růstu lidských ovariálních rakovinových buněk PA-1. Zatímco na růst buněk SK-OV-3 nemá vitamin K2 žádný efekt. Vitamin K2 indukuje apoptózu blastických buněk u pacientů s myelodysplastickým syndromem. Tento účinek byl úspěšně potvrzen v publikacích, zabývajících se tímto tématem [2, 26].
Deficit vitaminu K bývá spojován s vyšším rizikem výskytu diabetu mellitu. Autoři popisují možný vliv osteokalcinu na inzulinovou citlivost. Na myším modelu bylo prokázáno, že „knockout“ genu pro osteokalcin způsobí obezitu. Z metabolického hlediska tyto myši vykazují hyperglykémii, nízkou hladinu inzulinu, nízký počet β-buněk, nízkou senzitivitu inzulinu a nízkoenergetické výdaje. Zatímco pokusné myši, které měly „knockout“ na genu zárodečných kmenových buněk fosfatázy, vykazovaly nárůst hladiny osteokalcinu, zvýšení glukózové tolerance a inzulinové senzitivity. U myší, kterým byl podán infuzně rekombinatní osteokalcin, docházelo ke zlepšení glukózové tolerance a zvýšení sekrece inzulinu. Pokud byl rekombinatní osteokalcin podán myším na dietě bohaté na tuky, docházelo u nich k poklesu hmotnosti a redukci inzulinové rezistence. Při prokázání korelace osteokalcinu a inzulinové rezistence u zvířecího modelu bylo třeba ověřit, zda by nízká hladina osteokalcinu i u lidí mohla souviset s vyšším rizikem výskytu diabetu. Autoři Ngarmukos et al. [27] ve své publikaci uvedli, že nízká hladina osteokalcinu předpovídá rozvoj diabetu. Autoři Beulens et al. [28] publikovali, že vitamin K dokáže redukovat inzulinovou rezistenci. Vliv na inzulin byl pozorován po podání vitaminu K1 i vitaminu K2. Oproti tomu autoři Zwakenber et al. [29] ve své publikaci uvedli, že není asociace mezi hladinou osteokalcinu a rizikem výskytu diabetu typu II. Toto tvrzení je dokázáno na desetileté studii s 1635 účastníky, z nichž je 833 diabetiků. U těchto účastníků stanovovali celkový osteokalcin (tOC), nedostatečně karboxylovaný osteokalcin (ucOC), % ucOC a vazebný test na hydroxyapatit. U diabetiků byl pozorován vyšší: body mass index (BMI), obvod pasu, výskyt hypertenze a naopak nižší míra fyzické aktivity. U nediabetiků byl vyšší příjem alkoholu. V této publikaci byly sestaveny tři různé modely, u kterých byla prokazována asociace osteokalcinu s rizikem výskytu diabetu mellitu typu II. tOC, ucOC ani % ucOC nebyly asociovány s rizikem výskytu diabetu mellitu typu II v žádném ze tří typů modelů. Dle dotazníku stravování nebyla zjištěna korelace mezi % ucOC a příjmem vitaminu K. Tato publikace je jedinečná nejen svým rozsahem účastníků, ale i tím, že jsou zde zahrnuti nejen ženy, ale i muži.
U vitaminu K byl pozorován pozitivní účinek na kostní hmotu, kde působí na osteokalcin v průběhu jeho karboxylace a dále působí na zvýšení osteoblastické aktivity. Vitamin K působí na diferenciaci stromálních buněk transformujících se v osteoblasty, u nichž zároveň inhibuje jejich přeměnu v adipocyty. Na kostní novotvorbě se také podílí inhibicí osteoklastů, které odbourávají kostní hmotu. Hlavní formou, která působí na osteokalcin, je MK-7. Bylo prokázáno, že pravidelné užívání MK-7 vede ke zvýšení karboxylovaného osteokalcinu, a tím ke snížení rizika rozvoje osteoporózy. Prozatím v žádné publikaci nebyla jasně stanovena doporučená denní dávkování pro jednotlivé formy vitaminu K [2].
Nedávná publikace ukazuje, že vitamin K2 by mohl být využit jako potenciální cíl v léčbě bakteriálních agens. Menachinon je složkou elektronových transportních řetězců u většiny anaerobních bakterií, mykobakterií a Gram-pozitivních bakterií. Lysocin E je cyklický lipopeptid produkovaný Lysobacter sp. Lysocin E přímo interaguje s menachinony a je prvním antibiotikem zacíleným právě na tuto komponentu. V přítomnosti lysocinu E u Staphylococcus aureus dochází k bakteriolýze, úniku draselných iontů přes membránu a prudkému poklesu membránového potenciálu. Na zvířecích modelech nebyla prokázána toxicita lysocinu E [30].
Klíčová role vitaminu K spočívá v koagulaci, kde působí zejména na faktory srážení II, VII, IX a X, dále na proteiny C, Z a S. Protein S působí neuroprotektivně během ischemie a stimuluje fagocytózu. Deficit proteinu S je asociován s osteopenií a osteonekrózou. Z pohledu hematologie se nedostatek vitaminu K klinicky projevuje zejména krvácivou diatézou [31].
Gas6 (the cell growth regulating growth arrest specific gene 6 protein, specifický protein 6 zastavující růst) byl poprvé popsán ve fibroblastech. Gas6 je zastoupen v endoteliích, hladkém cévním svalstvu, kostní dřeni a buňkách centrální nervové soustavy. Složení aminokyselin proteinu Gas6 se ve 44 % shoduje s aminokyselinovým složením proteinu S. Gas6 se skládá z různých domén: Gla doména, která ke své funkci vyžaduje γ-karboxylaci; čtyř EGF-like (epidermální růstový faktor) domén; SHBG (pohlavní hormony vázající globulin) doménu, která obsahuje vazebné místo pro receptory TAM (Tyro3, Axl, Mer) rodiny. TAM jsou tyrosinkinázové receptory představující distribuci makrofágů a dendritických buněk. Gas6 a jeho receptory regulují zejména vrozenou imunitu, zahajují protizánětlivé odpovědi přes inhibici produkce cytokinů po antigen-prezentující buňky. Gas6 má vliv i na koagulaci, kde se účastní adheze trombocytů k endotelu. Také se účastní stabilizace krevní zátky (trombu). Aktivace Toll-like receptorů snižuje produkci Gas6 i proteinu S, a tím je usnadněna produkce prozánětlivých cytokinů mikrofágy. Koncentrace Gas6 v plazmě je zvýšená u lidí se zánětem včetně sepse. Zvýšená hladina Gas6 koreluje s orgánovou dysfunkcí a závažností onemocnění [32].
Vitamin K dokáže regulovat sekreci interleukinu-6 a prostaglandinů, které doprovázejí infekční onemocnění. Vysoké dávky MK-4 jsou asociovány se sníženými hladinami proinfekčních markerů (př. C-reaktivní protein, interleukin-6) [33].
Jednotlivé funkce vitaminu K jsou shrnuty v Tabulce 1. Funkce vitamin K dependentních proteinů a důsledky jejich inhibice jsou přehledně uvedeny v Tabulce 2.
Tab. 1. Overview of vitamin K functions in the body 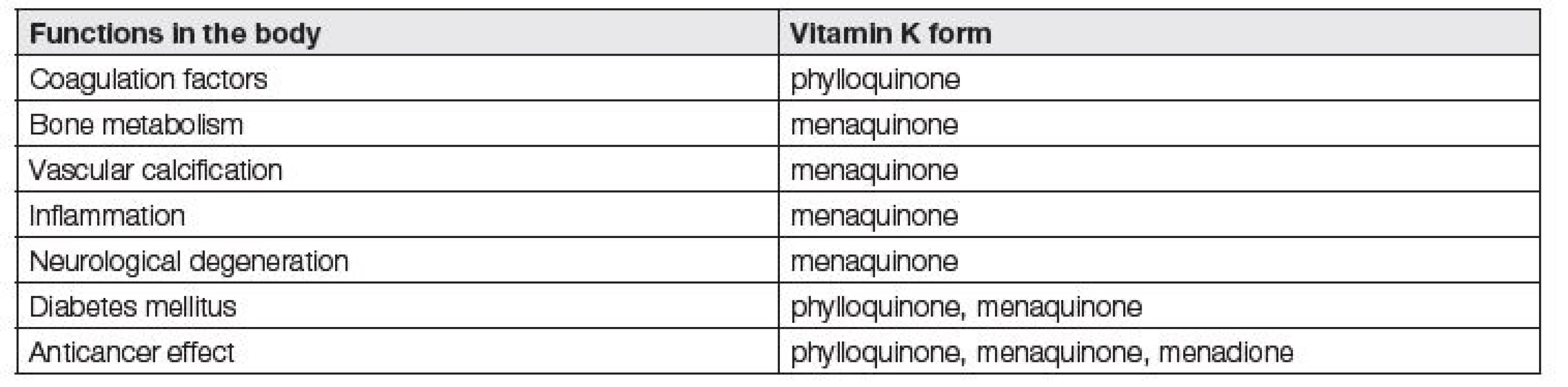
Tab. 2. Function of vitamin K dependent proteins and its inhibition 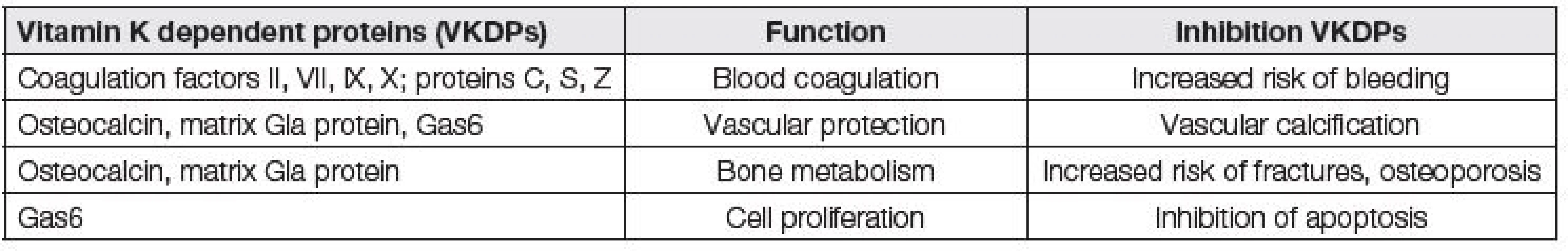
Laboratorní metody stanovení vitaminu K
Stanovení jednotlivých forem vitaminu K je obtížné vzhledem k jejich nízké koncentraci v séru a také protože jsou velmi málo polární látky. Proto nejpoužívanější metody stanovení vitaminu K v posledních letech jsou metody vysokoúčinné kapalinové chromatografie s využitím kombinace s hmotnostním detektorem. Chromatografické postupy se mezi sebou liší mobilní fází, použitým vnitřním standardem a také přípravou vzorku pro chromatografickou separaci.
Na trhu je prozatím dostupný pouze jediný kit na stanovení vitaminu K1 od firmy Immundiagnostik, ve kterém firma uvádí limit detekce 0,15 µg/l. Stanovení s použitím tohoto kitu se provádí pomocí vysokoúčinné kapalinové chromatografie s fluorescenční detekcí a postkolonovou zinkovou redukcí. Příprava vzorku dle manuálu soupravy patří ke snazším postupům, avšak největší nevýhodou pro použití kitu je nedostatečné oddělení elucí vitaminu K1 a vnitřního standardu. Další nevýhodou je stanovení pouze jedné formy vitaminu K [6]. Autoři Wang et al. [7] a Paroni et al. [8] ve svých publikacích stanovovali vitamin K1 pomocí HPLC metody s fluorescenční detekcí a postkolonovou zinkovou redukcí. Obě tyto publikace použily komerčně dodaný vnitřní standard od firmy Immundiagnostik. Oba kolektivy autorů vyvinuly metody, které dostatečně oddělovaly formy vitaminu K od vnitřního standardu. V publikaci autorů Paroni et al. dosáhli limitu kvantifikace 0,2 nmol/l (tz. 0,09 µg/l) pro vitamin K1. V publikaci autorů Kamao et al. [9] stanovovali kromě vitaminu K1 i formu MK-4 a MK-7. V této publikaci byl použit analog vitaminu K jako vnitřní standard. Použili metodu HPLC s fluorescenční detekcí, avšak se jim nepodařilo dostatečně oddělit formy MK-4 a MK-7 od interferujících složek nacházejících se ve vzorku. Marinova et al. [10] stanovovali vitaminy K1 a MK-4, kde byl opět použit analog vitaminu K jako vnitřní standard. Autoři použili metodu HPLC s fluorescenční detekcí. Pro obě dvě stanovované formy vitaminu K byla stanovena mez detekce 0,015 µg/l. Autoři Ahmed et al. [11] publikovali HPLC metodu s chemiluminiscečním detektorem, díky které stanovili formy K1, MK-4 a MK-7. Vnitřní standard byl použit 2-metyl-3-pentadecyl-1,4-naftochinon. Autorům se podařilo uspokojivě oddělit jednotlivé formy vitaminu a vnitřního standardu. Tato metoda je doporučena pro klinické měření ohledně kostního metabolismu, i přesto, že detekční limity jednotlivých forem vitaminu K přesahují 1,4 µg/l.
V posledních letech jsou popisována stanovení různých forem vitaminu K pomocí metody kapalinové chromatografie s hmotnostní detekcí (LC-MS) kvůli lepší citlivosti a selektivitě. Autoři Tsugawa et al. [12] stanovovali vitamin K1, MK-4 a MK-7 pomocí HPLC s chemickou ionizací za atmosférického tlaku s tandemovou hmotnostní detekcí (LC-ACPI-MS). V publikaci autorů Karl et al. [13] byla popsána metoda LC-APCI-MS na stanovení vitaminu K1 a 10 forem vitaminu K2 (MK4 až MK-13) ve stolici. Tato metoda vykazuje nízký limit detekce. Metodu LC-APCI-MS využili již v roce 2008 autroři Song et al. [14], kteří stanovovali v plazmě vitamin K1 s publikovaným limitem detekce 0,3 µg/l. Autoři Riphagen et al. [15] stanovovali pomocí LC-MS vitamin K1, MK-4 a MK-7, kde jako vnitřní standardy byly použity izotopově značené vitaminy. Autoři použili poměrně jednoduchý postup přípravy vzorku, kde se ale pravděpodobně uplatňují velké matriční efekty, zejména u formy MK-7, u které mez detekce dosahuje 4,4 nmol/l (tz. 2,9 µg/l), čímž se tato metoda pro klinické použití u pacientů stává nevhodnou.
Hladinu vitaminu K lze v séru odvodit i nepřímo – např. imunochemickým stanovením nedostatečně karboxylovaného osteokalcinu, nedostatečně karboxylovaného defosforylovaného MGP v moči nebo neúčinných prekurzorů koagulačních faktorů tzv. PIVKA v plazmě. Dalším nepřímým ukazatelem pro vyšetření hladin vitaminu K je protrombinový čas nebo vyšetření polymorfismů genu komplexu vitaminu K epoxid reduktázy podjednotky 1 pomocí komerčně dostupné soupravy [14, 34, 35].
Prozatím nebyly publikovány studie, které by pro přímé stanovení vitaminu K využívaly imunochemické metody. Možnosti přímého a nepřímého stanovení hladin vitaminu K jsou uvedeny v tabulce 3.
Tab. 3. Options for determining vitamin K levels 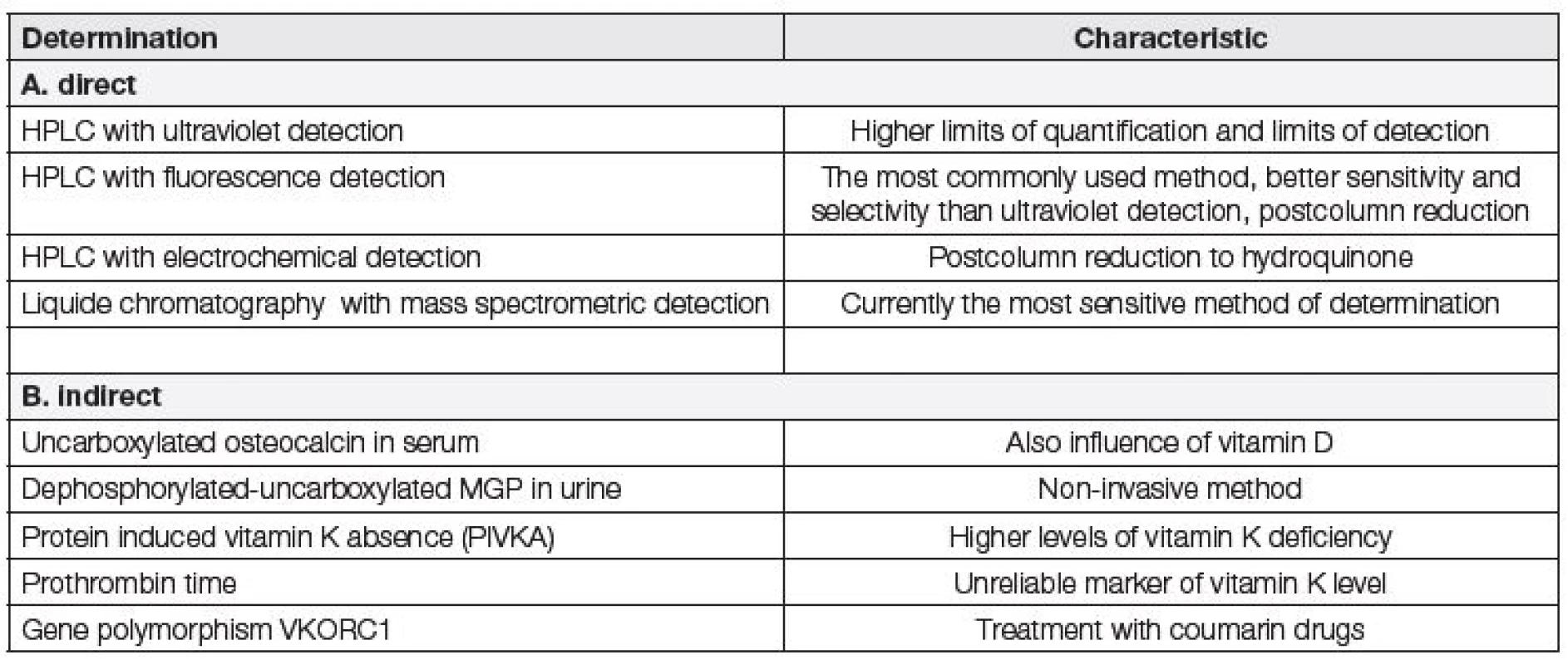
Závěr
Vitamin K se dostává do povědomí nejen odborné společnosti, ale i laiků, kteří se zajímají o zdravý životní styl. Bylo již prokázané, že vitamin K má kromě vlivu na hemokoagulaci a kostní metabolismus mnoho dalších významných funkcí. Vitamin K by se mohl uplatnit při léčbě některých nádorových onemocnění, při prevenci diabetu mellitu a prevenci neurodegenerativních onemocnění. Vitamin K hraje důležitou roli u pacientů užívajících antikoagulační přípravky, které ovlivňují cyklus vitaminu K. Přípravky obohacené o vitamin MK-7 jsou již využívány jako podpůrné doplňky stravy pro pacienty s rizikem osteoporózy. Stále aktuální otázkou je, jaké množství menachinonů je produkováno střevními bakteriemi. Vitamin K je posledním z vitaminů rozpustných v tucích, který se stanovuje pouze v rámci výzkumu. V České republice zatím není žádná laboratoř, která by formy vitaminu K rutinně stanovovala. Hlavní prioritou pro stanovení vitaminu K by měla být nenáročnost přípravy vzorku. V dostupných publikacích se autoři shodují na použití extrakce na pevné fázi a minimálně jednom sušení pod proudem dusíku. Budou nutné studie k určení doporučených dávek vitaminu K2 pro jednotlivá onemocnění a ke stanovení doporučených hodnot vitaminu K, zejména formy MK-7.
Seznam použitých zkratek:
BMI index tělesné hmotnosti
Gas6 specifický protein 6 zastavující růst
GGCX γ-glutamylkarboxyláza
Gla γ-karboxyglutamová kyselina
Glu glutamová kyselina
HDL vysokodenzitní lipoprotein
HPLC vysokoúčinná kapalinová chromatografie
LC-ACPI-MS kapalinová chromatografie s chemickou ionizací za atmosférického tlaku s tandemovou hmotnostní detekcí
LC-MS kapalinová chromatografie s tandemovou hmotnostní detekcí
LDL nízkodenzitní lipoprotein
MGP matrix Gla protein
MK-n menachinon, n – počet izoprenových jednotek v postranním řetězci
PIVKA protein induced vitamin K absence, proteiny koagulačních faktorů vzniklé při nepřítomnosti vitaminu K
tOC celkový osteokalcin
ucMGP nedostatečně karboxylovaný matrix Gla protein
ucOC nedostatečně karboxylovaný osteokalcin
VKDPs vitamin K dependentní proteiny
Tato práce je podpořena projektem MZ, ČR – RVO, FN v Motole 00064203.
Střet zájmů: Autoři prohlašují, že nejsou ve střetu zájmů.
Do redakce došlo 14. 7. 2017
Adresa pro korespondenci:
Ing. Kateřina Dunovská
Ústav lékařské chemie a klinické biochemie
Fakultní nemocnice v Motole
V Úvalu 84
150 06 Praha 5
e-mail: dunovska.katka@seznam.cz
Zdroje
1. Food and Agriculture Organization of the United Nations/World Health Organization. Human vitamin and mineral requirements. Report of a joint FAO/WHO expert consultation 2001, Bangkok, Thajsko, 286 stran.
2. Masterjohn, C. On the trail of the elusive X-factor: A sixty-two-year-old mystery finally solved. 2008, http://www.westonaprice.org/health-topics/abcs-of-nutrition/on-the-trail-of-the-elusive-x-factor-a-sixty-two-year-old-mystery-finally-solved/ (25.5.2017)
3. Kazda, A. Kritické stavy: metabolická a laboratorní problematika. 1.vyd., Galén. Praha, 2012, 346 s. ISBN: 978-80-7262-763-9.
4. Sadowski, J. A., Hood, S. J., Dallal, G. E., Garry, P. J. Phylloquinone in plasma from elderly and young adults: factors influencing its concentration. Am. J Clin. Nutr., 1989, 50(1), p. 100-108.
5. Kraemer, C. M. Vitamin K, Medscape Reference. 2015. http://emedicine.medscape.com/article/2088738-overview (9.6.2017)
6. Immundiagnostik, A.G. Vitamin K1 HPLC Kit: For the determination of vitamin K1 in plasma and serum. 2008, 26 stran. (návod na použití kitu pro stanovení vitaminu K1).
7. Wang, L. Y., Bates, C. J., Ya, L., Harrington, D. J., Shearer, M. J., Prentice, A. Determination of phylloquinone (vitamin K1) in plasma and serum by HPLC with fluorescence detection. Clin. Chim. Acta, 2004, 347(1-2), p. 199-207.
8. Paroni, R., Faioni, E. M., Razzari, C., Fontana, G., Cattaneo, M. Determination of vitamin K1 in plasma by solid phase extraction and HPLC with fluorescence detection. J Chromatogr. B, 2009, 877(3), p. 351-354.
9. Kamao, M., Suhara, Y., Tsugawa, N., Okano, T. Determination of plasma vitamin K by high-performance liquid chromatography with fluorescence detection using vitamin K analogs as internal standards. J Chromatogr. B, 2005, 816(1–2), p. 41-48.
10. Marinova, M., Lütjohann, D., Westhofen, P., Watzka, M., Breuer, O., Oldenburg, J. A validated HPLC method for the determination of vitamin K in human serum – first application in pharmacological study. Open Clin. Chem. J, 2011, 4, p. 17-27.
11. Ahmed, S., Kishikawa, N., Nakashima, K., Kuroda, N. Determination of vitamin K homologues by high-performance liquid chromatography with on-line photoreactor and peroxyoxalate chemiluminescence detection. Anal. Chim. Acta, 2007, 591(2), p. 148-154.
12. Tsugawa, N., Shiraki, M., Suhara, Y., Kamao, M., Tanaka, K., Okano, T. Vitamin K status of healthy Japanese women: Age-related vitamin K requirement for gamma-carboxylation of osteocalcin. Am. J Clin. Nutr., 2006, 83, p. 380-386.
13. Song, Q., Wen, A., Ding, L., Dai, L., Yang, L., Qi, X. HPLC-APCI-MS for determination of vitamin K1 in human plasma: Method and clinical application. J Chromatogr. B, 2008, 875, p. 541-545.
14. Fusaro, M., Gallieni, M., Rizzo, M. A. et al. Vitamin K plasma levels determination in human health. Clin. Chem. Lab. Med., 2017, 55(6), p. 789-799.
15. Riphagen, I. J., van der Molen, J. C., van Faassen, M. et al. Measurement of plasma vitamin K1 (phylloquinone) and K2 (menaquinones-4 and -7) using HPLC-tandem mass spectrometry. Clin. Chem. Lab. Med., 2016, 54(7), p. 1201-1210.
16. Walther, B., Karl, P. J., Booth, S. L., Boyaval, P. Menaquinones, bacteria, and the food supply: the revalence of dairy and fermented food products to vitamin K requirements. Adv. Nutr., 2013, 4(4), p. 463-473.
17. Sato, T., Schurgers, L. J., Uenishi, K. Comparison of menaquinone-4 and menaquinone-7 bioavailability in healthy women. Nutr. J, 2012, 11(93), p. 1-4.
18. Gröber, U., Reichrath, J., Holick, M. F., Kisters, K. Vitamin K: an old vitamin in a new perspective. Dermato-Endocrinology, 2014, 6(1), e968490.
19. Thrailkill, K. M., Jo, C.-H., Cockrell, G. E., Moreau, C. S., Lumpkin, C. K., Fowlkes, J. L. Determinants of undercarboxylated and carboxylated osteocalcin concentrations in type 1 diabetes. Osteoporosis International: A Journal Established as Result of Cooperation between the European Foundation for Osteoporosis and the National Osteoporosis Foundation of the USA, 2012, 23(6), p. 1799–1806.
20. Schurgers, L. J., Teunissen, K. J., Hamulyák, K., Knapen, M. H., Vik, H., Vermeer, C. Vitamin K-containing dietary supplements: comparison of synthetic vitamin K1 and natto-derived menaquinone-7. Blood, J Am. Soc. Hematol., 2007, 109(8), p. 3279-3283.
21. Stafford, D. W. The vitamin K cycle. Journal of Thrombosis and Haemostasis, 2005, 3, p. 1873 – 1878.
22. Tie, J. K., Stafford, D. W. Structural and fuctional insights into enzymes of the vitamin K cycle. Journal of Thrombosis and Haemostasis, 2015, 14, p. 236 – 247.
23. Prithviraj, D., A, S., Paul, A. M. Fetal warfarin syndrome. Journal of evolution and medical and dental sciencies, 2014, 3(16), p. 4262-4268.
24. Gheorghe, S. R., Crăciun, A. M. Matrix Gla Protein in Tumoral Pathology. Clujul Medical, 2016, 89, (3), p. 319-321.
25. Geleijnse, J. M., Vermeer, C., Grobbee, D. E. et al. Dieetary intake of menaquinone is associated with a reduced risk of coronary heart disease: The Rotterdam study. J Nutr., 2004, 134(11), p. 3100-3105.
26. Nakaya, K., Masuda, Y., Aiuchi, T., Itabe, H. Vitamin K2 as a chemotherapeutic agent for treating ovarian cancer. Ovarian Cancer – Clinical and Therapeutic Perspectives, 2012, p. 259-274. http://www.intechopen.com/books/ovarian-cancer-clinical-and-therapeutic-perspectives/vitamin-k2-as-a-chemotherapeutic-agent-for-treating-ovarian-cancer (6.6.2017)
27. Beulens, J. W. J., van der A, D. L., Grobbee, E., Sluijs, I., Spijkerman, A. M. W., van der Schouw, Y. T. Dietary phylloquinone and menaquinones intakes and risk of type 2 diabetes. Diabet. Care, 2010, 33(8), p. 1699-1705.
28. Ngarmukos, C., Chailurkit, L., Chanprasertyothin, S., Hengprasith, B., Drotara, P., Ongphiphadhanakul, B. A reduced serum level of total osteocalcin in men predicts the development of diabetes in a long-term follow-up kohort. Clin. Endocrionol., 2013, 77, p. 42-46.
29. Zwakenberg, S. R., Gundberg, C. M., Spijkerman, A. M. W., van der A, D. L., van der Schoul, Y. T., Beulens, J. W. J. Osteocalcin Is Not Associated with the Risk of Type 2 Diabetes: Finding from the EPIC-NL Study. PLoS ONE, 2015, 10(9), e0138693.
30. Paudel, A., Hamamoto, H., Panthee, S., Sekimizu, K. Menaquinone as a potential target of antibacterial agents. Drug Discoveries and Therapeutics, 2016, 10(3), p. 123-128.
31. Penka, M., Buliková, A., a kolektiv. Neonkologická hematologie. 2. doplněné a zcela přepracované vydání., Grada. Praha, 2009. ISBN 978-80-247-2299-3.
32. Stalder, G., Que, Y. A., Calzavarini, S. et al. Study of early elevated Gas6 plasma level as a predictor of mortality in a prospective cohort of patiens with sepsis. PLoS ONE, 2016, 11(10), p. 1-13.
33. Ferland, G. The discovery of vitamin K and its clinical applications. Ann. Nutr. Metabol., 2012, 61(3), p. 213-218.
34. Cui, R., He, J., Zhang, F. et al. Diagnostic value of protein induced by vitamin K absence (PIVKAII) and hepatoma-specific band of serum gamma-glutamyl transferase (GGTII) as hepatocellular carcinoma markers complementary to alpha-fetoprotein. British Journal of Cancer, 2003, 88(12), p. 1878-1882.
35. http://www.viennalab.com/products/pharmacogenetics/pgx-thrombo_stripassay (9. 6. 2017)
Štítky
Biochémia Nukleárna medicína Nutričný terapeut
Článek Odešel doc. Kollár
Článok vyšiel v časopiseKlinická biochemie a metabolismus
Najčítanejšie tento týždeň
2018 Číslo 1
-
Všetky články tohto čísla
- Analytický systém online extrakce na pevné fázi ve spojení s tandemovou spektrometrií a jeho klinické využití
- Úvodní studie měření FGF 23 metodou LIAISON FGF 23
- Limitácie využitia sliny ako diagnostickej tekutiny v klinickej praxi
- Vitamin K a jeho význam v laboratorní medicíně
- Pár řádků o problémech a záhadách hodnocení kvality vědecké práce
- Stanovení karbohydrát-deficientního transferinu (CDT) různými analytickými technikami
- Stabilizace glukózy v krevní plazmě citrátem – pro a proti
-
Česká diabetologická společnost ČLS JEP, Česká nefrologická společnost a Česká společnost klinické biochemie ČLS JEP
Doporučené postupy při diabetickém onemocnění ledvin - Odešel doc. Kollár
- Stanovisko výboru České společnosti pro aterosklerózu k doporučením ESC/EAS pro diagnostiku a léčbu dyslipidemií z roku 2016
- Těhotenská hypercholesterolemie - málo známý fenomén způsobený zvýšenou endogenní syntézou cholesterolu
- Klinická biochemie a metabolismus
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Stanovení karbohydrát-deficientního transferinu (CDT) různými analytickými technikami
- Stabilizace glukózy v krevní plazmě citrátem – pro a proti
- Vitamin K a jeho význam v laboratorní medicíně
- Analytický systém online extrakce na pevné fázi ve spojení s tandemovou spektrometrií a jeho klinické využití
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy




