-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Histopatologická diagnostika kolitid: diferenciálně-diagnostický přístup a interpretace
Histopathological diagnosis of colitis: differential diagnosis and interpretation
Non-neoplastic inflammatory conditions of a large bowel mucosa are commonly encountered in bioptic practice. Their interpretation yields many challenges especially due to their limited and often non-specific and overlapping morphological spectrum. However, an accurate assessment of colonic biopsy still represents an important part of multidisciplinary diagnostic process and identification and subsequent interpretation of proper morphological pattern should be in a competence of any routine pathologist. This article provides systematic approach to histopathological assessment of inflammatory diseases of colonic mucosa, focusing mainly on diagnoses other than inflammatory bowel disease (IBD).
Keywords:
Biopsy – Colitis – inflammation – histopathology – differential diagnosis
Autori: Ondřej Fabián 1,2; Kateřina Kamaradová 3,4
Pôsobisko autorov: Pracoviště klinické a transplantační patologie, Institut klinické a experimentální medicíny, Praha 1; Ústav patologie a molekulární medicíny 3. LF UK a FTN, Fakultní Thomayerova nemocnice, Praha 2; AeskuLab Patologie k. s., Praha 3; Fingerlandův ústav patologie, Fakultní nemocnice Hradec Králové 4
Vyšlo v časopise: Čes.-slov. Patol., 58, 2022, No. 1, p. 11-26
Kategória: Přehledový článek
Zánětlivá onemocnění tlustého střeva patří mezi častou problematiku v rutinní bioptické praxi. Jejich interpretace může být náročná s ohledem na omezené a značně překryvné spektrum morfologických změn, kterými se mohou jednotlivá onemocnění manifestovat. Adekvátně posouzená biopsie střevní sliznice však stále představuje důležitý článek multidisciplinárního diagnostického řetězu a rozpoznání základních morfologických vzorců nenádorových střevních onemocnění by tak mělo patřit do výbavy každého patologa. Tento doškolovací text si klade za cíl přiblížit systematický přístup k histopatologickému hodnocení kolitid a zaměřuje se zejména na onemocnění jiná než nespecifické střevní záněty (IBD).
Súhrn
Zánětlivá onemocnění tlustého střeva patří mezi častou problematiku v rutinní bioptické praxi. Jejich interpretace může být náročná s ohledem na omezené a značně překryvné spektrum morfologických změn, kterými se mohou jednotlivá onemocnění manifestovat. Adekvátně posouzená biopsie střevní sliznice však stále představuje důležitý článek multidisciplinárního diagnostického řetězu a rozpoznání základních morfologických vzorců nenádorových střevních onemocnění by tak mělo patřit do výbavy každého patologa. Tento doškolovací text si klade za cíl přiblížit systematický přístup k histopatologickému hodnocení kolitid a zaměřuje se zejména na onemocnění jiná než nespecifické střevní záněty (IBD).
Klíčová slova:
zánět – Biopsie – histopatologie – diferenciální diagnóza – kolitida
Zánětlivá onemocnění tlustého střeva představují podstatnou část rutinní bioptické praxe specializovaných i periferních patologických pracovišť. Jejich velmi limitované, mnohdy nespecifické a často i značně překryvné morfologické spektrum klade na patology nároky zejména stran adekvátní interpretace nálezu a následné diferenciálně-diagnostické rozvahy. Ta se neobejde bez pečlivé korelace s klinickým stavem pacienta, jeho anamnézou, laboratorními výsledky, endoskopickým nálezem, výsledky mikrobiologického vyšetření a mnohdy i nálezem na zobrazovacích metodách či genetickým vyšetřením. Nezbytný je tak určitý vhled patologa do klinické problematiky a schopnost hledět za hranice svého mikroskopu. Pečlivě vyhodnocená střevní biopsie i v dnešní době představuje důležitý článek multidisciplinárního diagnostického řetězu a schopnost interpretovat základní morfologické vzorce nenádorových střevních onemocnění by mělo patřit do výbavy každého praktikujícího patologa.
Tento doškolovací text si klade za cíl přiblížit systematický přístup k histopatologickému hodnocení kolitid a zaměřuje se zejména na onemocnění jiná než nespecifické střevní záněty (zánětlivá střevní onemocnění; IBD), které jsou předmětem samostatného sdělení „Fabián O, Kamarádová K. Morfologie zánětlivých střevních onemocnění (IBD)“ v tomto čísle časopisu.
FYZIOLOGICKÝ HISTOLOGICKÝ OBRAZ SLIZNICE TLUSTÉHO STŘEVA
Diagnostika střevních zánětů a jiných nenádorových procesů není založená pouze na rozpoznání patologických struktur, které ve střevní sliznici normálně nejsou přítomny, ale velmi často spočívá i na pečlivém posouzení mírných kvantitativních odchylek jinak fyziologických komponent střevní sliznice. Detailní znalost fyziologického obrazu je tak pro správnou mikroskopickou diagnostiku zásadní. Ne nadarmo je jedním z častých úskalí histopatologického hodnocení kolitid nadhodnocování normálního nálezu.
Kolická sliznice je tvořená třemi vrstvami - lamina epithelialis, lamina propria mucosae a lamina muscularis mucosae. Povrch sliznice je rovný, bez slizničních klků. Směrem do hloubky sliznice vybíhá v Lieberkühnovy krypty, které jsou pravidelné a paralelně uspořádané a vzdálenost mezi nimi je konstantní. Probíhají od povrchu sliznice až k hranici s lamina muscularis mucosae. V místech přechodů různých typů sliznic (např. oblast Bauhinské chlopně), nad lymfatickými folikuly či v místech chirurgických anastomóz bývají krypty běžně defigurované a v těchto místech není vhodné posuzovat případnou poruchu architektoniky. Zvýšené opatrnosti bychom měli dbát i v rektu, kde jsou krypty fyziologicky méně pravidelné (1-4). Povrch sliznice i krypty kryjí enterocyty a pohárkové buňky. V pravostranném tlustém střevě je pohárkových buněk v poměru k enterocytům méně než v levostranném (5). V hloubce krypt nacházíme ještě neuroendokrinní buňky, nezralé kmenové buňky a Panethovy buňky. Přítomnost Panethových buněk je v pravostranném tlustém střevě fyziologická, od lienární flexury distálněji jsou považovány za metaplastický proces. Tato fyziologická hranice však podléhá značené interpersonální variabilitě (5). Epitelie spočívají na tenké bazální membráně, jejíž normální tloušťka nepřesahuje 5 μm (6). Lamina propria mucosae je tvořená řídkým kolagenním vazivem, ve kterém se i za normálního stavu nacházejí lymfocyty, plazmatické buňky, makrofágy a v menší míře i eosinofily a žírné buňky. Tato fyziologická zánětlivá celulizace může být poměrně hojná, zejména v pravostranném tlustém střevě, a neměla by nás automaticky vést k diagnóze „mírné chronické nespecifické kolitidy“. Zánětlivé elementy jsou nejpočetnější superficiálně pod povrchovým epitelem a směrem k bázi lamina propria jejich počet klesá (1). To platí zejména pro plazmatické buňky, neboť přítomnost početnějších plazmocytů u báze lamina propria je považována za patologický jev, který nazýváme bazální plazmocytózou (blíže viz sekce Chronická aktivní/neaktivní kolitida). Lymfocyty se běžně vyskytují i ve výstelce krypt a v povrchovém epitelu, ve kterém by jejich počet v tlustém střevě neměl přesáhnout 5 lymfocytů / 100 enterocytů (7). Eosinofily se nacházejí obvykle disperzně v lamina propria a ojediněle je můžeme zastihnout i v epitelu, zejména v pravostranném tlustém střevě. Fyziologická horní hranice jejich počtu pro tlusté střevo dosud není přesně stanovená, na rozdíl od jícnu, kde je kritériem 15 eosinofilů / 1 zorné pole mikroskopu s velkým zvětšením (HPF) (8). Řada studií navíc dokládá jejich poměrně výrazné sezónní a geografické kolísání (9,10). Makrofágy v základním barvení hematoxylinem a eosinem většinou vidíme jen pokud v cytoplazmě obsahují fagocytovaný materiál. Nejčastěji se ve sliznici setkáme s mukofágy, které jsou do určité míry fyziologický nález, zejména v rektu. Za normálních okolností by se ve střevní sliznici neměly nacházet prakticky žádné neutrofily (11). Za patologický proces je arbitrárně považována přítomnost alespoň tří neutrofilů shlukujících se mimo lumen cévy (1,12). Přítomnost neutrofilů obecně značí akutní proces nebo aktivitu zánětu u chronického onemocnění. Nejprve se objevují v lamina propria a s narůstající aktivitou onemocnění následně prostupují do povrchového epitelu a dále pak do výstelky krypt, což označujeme pojmem kryptitida. Postupně pak dochází k destrukci kryptové výstelky a insudaci neutrofilů do lumen krypty s její dilatací a tvorbou kryptového pseudoabscesu. V anglické literatuře se častěji setkáváme s výrazem kryptový absces (crypt abscess), čistě z patogenetického hlediska se však o skutečný absces nejedná. Jde o empyém krypty, a proto termín pseudoabsces považujeme za vhodnější. V neposlední řadě zbývá zdůraznit, že kryptitida a kryptové pseudoabscesy představují obecné známky aktivity zánětu a nejsou nijak patognomické pro IBD, kde bývají často skloňovány.
DIFERENCIÁLNĚ-DIAGNOSTICKÝ ALGORITMUS KOLITID
Jak již bylo podotknuto, histopatologie kolitid je do určité míry nespecifická a jednotlivé morfologické vzorce mají tendenci se překrývat. Klíčovým krokem v histopatologickém hodnocení je proto rozpoznání dominantního mikroskopického znaku každé morfologické skupiny (obr. 1 a 2). Zároveň je zapotřebí mít na paměti, že téměř žádná diagnostická jednotka není omezena výhradně na jeden jediný morfologický vzorec. Každá morfologická kategorie tak obsahuje širší spektrum více a méně pravděpodobných diagnostických jednotek. Následný postup se pak odvíjí od rozpoznání dalších dílčích histopatologických znaků, a především pak pečlivé korelace s klinickými údaji.
Obr. 1. Morfologické vzorce kolitid a jejich diferenciální diagnóza (Převzato a modifikováno z: Moore M, Feakins RM, Lauwers GY. Non-neoplastic colorectal disease biopsies: evaluation and differential diagnosis. J Clin Pathol 2020; 73(12): 783-792).
CMV = cytomegalovirus; GVHD = reakce štěpu proti hostiteli; IBD = zánětlivá střevní onemocnění; LCH = histiocytóza z Langerhansových buněk; MMF = mykofenolát mofetil; SCAD = segmentální kolitida asociovaná s divertikulózou; TBC = tuberkulóza; VEO-IBD = zánětlivá střevní onemocnění s velmi časným nástupem (very early onset inflammatory bowel disease).
S ohledem na jeho veliké rozměry bylo schéma v plném rozlišení umístěno i jako e-Supplementum na webové stránky časopisu ČS patologie (http://www.cspatologie.cz/supplementa.php).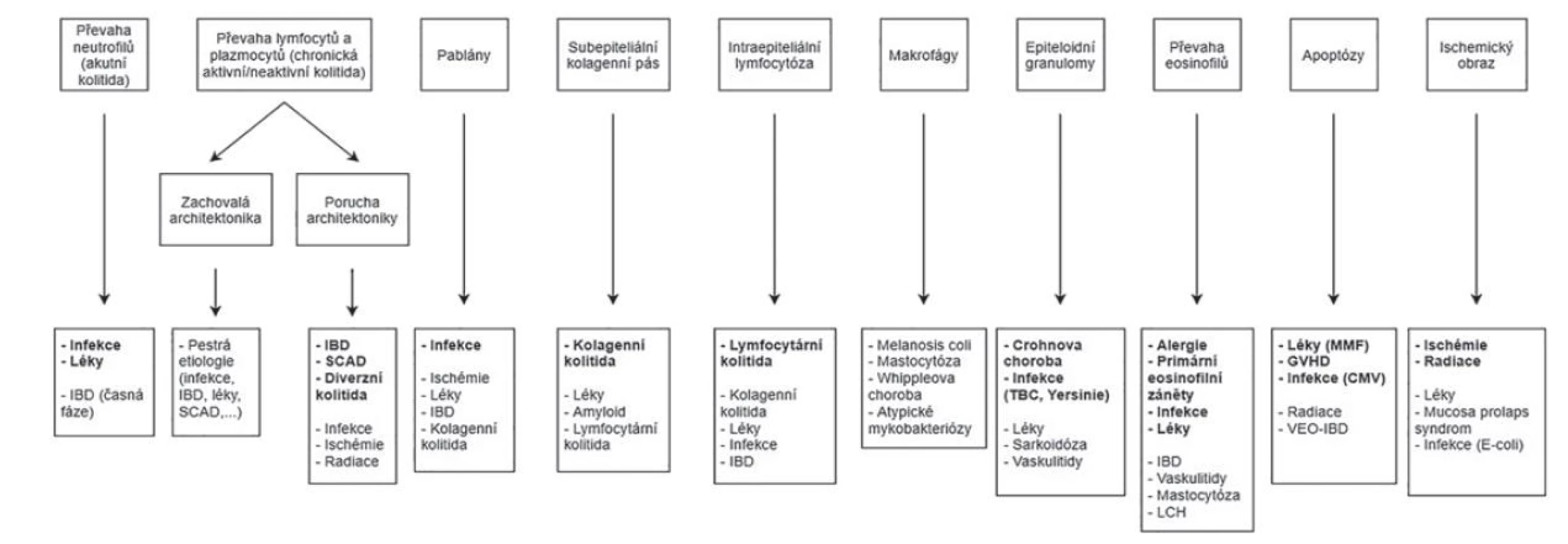
Obr. 2. Histopatologický diagnostický algoritmus kolitid (Převzato a modifikováno z: Moore M, Feakins RM, Lauwers GY. Non-neoplastic colorectal disease biopsies: evaluation and differential diagnosis. J Clin Pathol 2020; 73(12): 783-792).
GVHD = reakce štěpu proti hostiteli; IBD = zánětlivá střevní onemocění; LCH = histiocytóza z Langerhansových buněk; SCAD = segmentální kolitida asociovaná s divertikulózou; TBC = tuberkulóza; VEO-IBD = zánětlivá střevní onemocění s velmi časným nástupem (very early onset inflammatory bowel disease).
S ohledem na jeho veliké rozměry bylo schéma v plném rozlišení umístěno i jako e-Supplementum na webové stránky časopisu ČS patologie (http://www.cspatologie.cz/supplementa.php).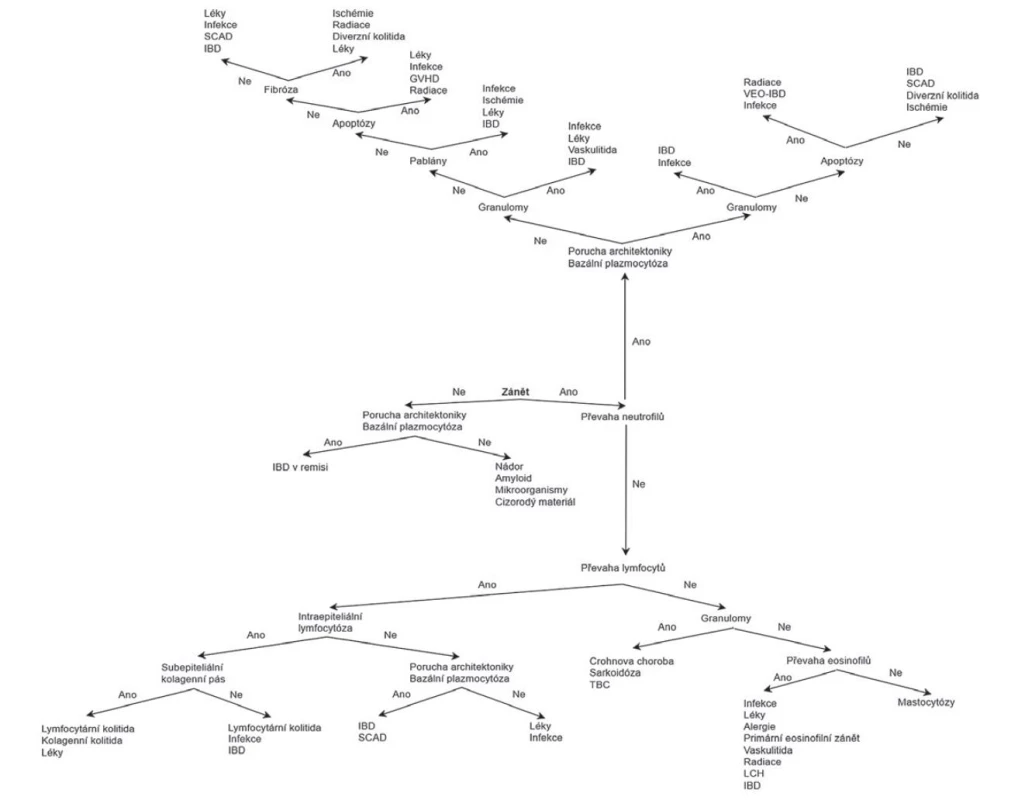
ZMĚNY ZPŮSOBENÉ PŘÍPRAVOU PŘED ENDOSKOPIÍ
Samotná příprava střeva před endoskopickým výkonem vyvolává mikroskopické změny, které někdy bývají mylně zaměněny za infekční kolitidu, IBD nebo i dokonce nádorový proces. Mezi nejčastější nálezy patří stromální edém, drobné petechiální hemoragie, přítomnost ojedinělých intraepiteliálních neutrofilů v povrchovém epitelu, redukce hlenotvorby a oploštění povrchového epitelu. Vzácný nebývá ani mírně zvýšený počet apoptóz v kryptách. Při insuflaci střeva může dojít k natlačení plynu do lamina propria a prázdné dutiny vyplněné plynem mohou věrně imitovat tukovou tkáň (tzv. pseudolipomatóza) nebo mohou být zaměněny za pneumatosis coli či lymfangiektázie (1,13). Některé agresivnější vyprazdňovací roztoky mohou vyvolat i obraz mírné fokálně aktivní kolitidy (14).
AKUTNÍ SELF-LIMITED KOLITIDA
Self-limited kolitidou rozumíme akutní kolitidu krátkého trvání s tendencí ke spontánní úpravě (odtud výraz „self-limited“). Ve většině případů se jedná o infekční proces, obvykle bakteriální. Diagnóza bývá stanovená na klinické, respektive mikrobiologické úrovni a nevyžaduje bioptické ověření. V klinicky nejasných případech (protrahovaný průběh, slabší odpověď na antibiotickou terapii) však pacient může dospět až k endoskopii s odběrem bioptických vzorků. V mikroskopickém obraze pak dominuje zánět akutního charakteru s převahou neutrofilů a stromálním edémem (obr. 3). Běžný je nález kryptitidy i kryptových pseudoabscesů, přítomny mohou být i slizniční defekty. Zánět má typicky sestupný gradient s maximem superficiálně a intenzitou klesající směrem k bázi lamina propria. Povrchový epitel i výstelka krypt vykazují cytologické nepravidelnosti reaktivního charakteru. Protože jde o akutní proces, nejsou přítomny známky chronicity jako například porucha architektoniky sliznice, bazální plazmocytóza či fibrotizace, které by nás směřovaly k jiné diagnóze (zejména IBD) (11,15).
Obr. 3. Akutní self-limited kolitida. V lamina propria kolické sliznice je přítomná zánětlivá celulizace akutního charakteru s převahou neutrofilů. Dobře patrná je kryptitida a jeden kryptový pseudoabsces. Sliznice nevykazuje známky chronicity a má zachovalou architektoniku (hematoxylin a eosin; 200x). 
Kromě infekcí se mikroskopickým obrazem akutní kolitidy mohou prezentovat i některé léky indukované kolitidy, případně i časná IBD, kterou patolog v akutní fázi rozpoznat nedokáže (histopatologická diagnóza IBD stojí především na nálezu charakteristických znaků chronicity). Na druhou stranu, ne každá bakteriální infekce nabývá obrazu akutní self-limited kolitidy. Infekční etiologii procesu je tak nutné zvažovat v rámci širší diferenciální diagnózy i u kolitid s jinou morfologií. Za zmínku stojí například infekce Clostridium difficile s typickou morfologií pablánové kolitidy, či ischemicko-hemoragický obraz u infekce enterohemoragickou E-coli. Samostatnou kapitolou je pak široké spektrum infekcí vyvolávajících granulomatózní typ zánětu. V případě virových infekcí je pak dobré pátrat po intranukleárních nebo intracytoplazmatických virových inkluzích. Řada těchto infekcí mívá protrahovaný průběh a patolog by na ně měl myslet, zejména u imunosuprimovaných pacientů, osob s rizikovou cestovatelskou anamnézou, případně u pacientů s nejasnou proktitidou (11). Kompletní přehled všech infekčních kolitid nicméně překračuje rozsah tohoto článku.
FOKÁLNĚ AKTIVNÍ KOLITIDA
Fokálně aktivní kolitida je histopatologický popisný termín ložiskově aktivní kolitidy nepříznačné morfologie. Bývá asociována s řadou různých onemocnění od infekcí přes IBD, alergická onemocnění, léková poškození až po funkční poruchy typu dráždivého tračníku. Mikroskopicky ji charakterizují ložiskové aktivní zánětlivé změny v podobě kryptitidy i kryptových pseudoabscesů bez jakékoliv další signifikantní abnormality. Aktivita zánětu může nabývat variabilní intenzity od jednoho izolovaného fokusu až po vícero drobných ložisek. Zároveň nejsou přítomny známky chronicity jako například porucha architektoniky sliznice, čímž se fokálně aktivní kolitida odlišuje od fokálně aktivní chronické kolitidy (16).
Tzv. bazální fokálně aktivní kolitida bývá doprovázená zvýšeným počtem apoptóz a vídáme ji u lékových poškození (16,17).
LÉKY INDUKOVANÉ KOLITIDY
Podobně jako v jiných odvětvích patologie i zde platí pravidlo, že léky mohou vyvolat kolitidu prakticky jakékoliv morfologie a není neobvyklé, že se jeden konkrétní lék prezentuje více různými histopatologickými obrazy, a naopak jeden morfologický obraz je společný pro více různých léků (tab. 1). Podat ucelený přehled všech lékových poškození není v silách tohoto doškolovacího článku. Omezíme se proto na konstatování, že možnost lékového poškození by měla být zvažována v případě nejasné kolitidy jakékoliv morfologie. Nicméně, u některých léků je mikroskopický obraz specifičtější a daný lék se tak stává důležitou součástí širší diferenciální diagnózy příslušného morfologického vzorce. Za zmínku stojí například morfologie apoptotické kolonopatie u pacientů na terapii imunosupresivním přípravkem mykofenolát mofetilem (MMF kolitida). V některých případech můžeme na léky indukované poškození usuzovat z nálezu krystalů nebo pigmentů (např. kayexalát nebo přípravky obsahující železo) (18). S ohledem na jejich stále častější používání v klinické praxi bychom neměli zapomínat ani na kolitidy indukované blokátory koinhibičních receptorů T-lymfocytů (anti-PDL1 nebo anti-CTLA4 terapie). Mikroskopický nález bývá variabilní, většinou nabývá obrazu akutní self-limited kolitidy nebo chronické aktivní kolitidy mimikující IBD. Vzácné nejsou ani početnější apoptózy či intraepiteliální lymfocytóza (IEL) (19,20).
Tab. 1. Morfologické vzorce lékového poškození sliznice tlustého střeva (Převzato z: Marginean EC. The Ever-Changing Landscape of Drug-Induced Injury of the Lower Gastrointestinal Tract. Arch Pathol Lab Med 2016; 140(8): 748-758). 
NSAID = nesteroidní antiflogistika; SSRI = selektivní inhibitory zpětného vychytávání serotoninu; TNF = tumor necrosis factor. Diaphragm disease je vzácná, ale téměř patognomická komplikace užívání nesteroidních antiflogistik. Diagnóza bývá obvykle stanovená na endoskopické úrovni nálezem intraluminální slizniční membrány, nejčastěji v terminálním ileu. Mikroskopický obraz bývá necharakteristický. Sliznice většinou vykazuje poruchu architektoniky a v lamina propria je smíšená zánětlivá celulizace variabilní intenzity a fibrotizace, která často zasahuje i do submukózy. Časté jsou i mělké povrchové eroze (18).
CHRONICKÁ AKTIVNÍ/NEAKTIVNÍ KOLITIDA
Chronická kolitida je zcela nespecifický histopatologický popisný termín, pod kterým se ukrývá široké spektrum diagnóz od protrahovaných infekcí přes IBD až po léky indukované kolitidy. Jelikož jde o jednoznačně nejčastější morfologický vzorec v bioptické praxi, vždy bychom měli pátrat po dalších dílčích mikroskopických znacích, které nám umožní nález blíže diagnosticky zařadit a nemuseli se omezovat pouze na popisný a v zásadě nicneříkající závěr v podobě „aktivní/neaktivní chronické kolitidy“.
Z histopatologického pohledu chronickou kolitidu charakterizuje převaha kulatobuněčné celulizace (lymfocytů a plazmatických buněk) v zánětlivém infiltrátu. Přítomnost neutrofilů pak značí aktivitu procesu, jehož intenzita stoupá od nečetných, stromálně lokalizovaných neutrofilů přes kryptitidu a kryptové pseudoabscesy až po slizniční defekty. Z diagnostického pohledu je pak důležitá především přítomnost narušené architektoniky sliznice (obr. 4) a bazální plazmocytózy. Jde o znaky chronicity poměrně typické (ačkoliv zdaleka ne 100% specifické) pro IBD a jejich přítomnost je tak nápomocná v odlišení od protrahovaných infekcí. Bazální plazmocytóza, jak již bylo zmíněno výše, je definována jako zvýšený počet plazmatických buněk při bázi lamina propria. Za normálních okolností plazmatické buňky respektují fyziologický sestupný gradient a směrem od povrchu sliznice do hloubky jejich počet klesá. V případě, kdy je tento gradient narušen a my detekujeme plazmatické buňky i u báze lamina propria, těsně nad lamina muscularis mucosae, mluvíme o bazální plazmocytóze. Její nález patří mezi silné indikátory IBD a zároveň se jedná o jeden z nejčasnějších znaků IBD, který se může objevit už po 14 dnech po vypuknutí onemocnění (21,22). Bazální plazmocytózu snáze rozpoznáme v levostranném tlustém střevě, vpravo je s ohledem na fyziologicky početnější lymfoplazmocytární celulizaci obtížnější případný gradient posoudit. Poruchou architektoniky pak rozumíme jakékoliv narušení fyziologického tvaru a uspořádání krypt. Krypty mohou být variabilně větvené, angulované, atypicky probíhající, dilatované a vzácná není ani atrofie krypt s jejich zkrácením a redukcí počtu (11). Jak již bylo zmíněno výše, posuzovat architektoniku sliznice není vhodné v místech přechodů různých typů sliznic, nad lymfatickými agregáty nebo v místech chirurgických anastomóz a zvýšené opatrnosti bychom měli dbát i v rektu. Bližší popis morfologie IBD je diskutován v doškolovacím článku „Fabián O, Kamarádová K. Morfologie zánětlivých střevních onemocnění (IBD)“ v tomto čísle časopisu.
Obr. 4. Ulcerózní kolitida. Morfologický vzorec intenzivní chronické aktivní kolitidy. Přítomná je pokročilá porucha architektoniky sliznice s defigurací, větvením a redukcí počtu krypt. V lamina propria je intenzivní chronická zánětlivá celulizace se známkami aktivity zánětu v podobě kryptových pseudoabscesů (hematoxylin a eosin; 100x). 
SEGMENTÁLNÍ KOLITIDA ASOCIOVANÁ S DIVERTIKULÓZOU (SCAD)
SCAD je zánětlivé onemocnění tlustého střeva doprovázející divertikulózu, které může na mikroskopické úrovni věrně imitovat IBD. Mikroskopický nález bývá sice značně variabilní, velmi často však nabývá právě chronického IBD-like obrazu včetně bazální plazmocytózy, poruchy architektoniky sliznice, transmurálně se šířícího zánětu, fibroobliterativních změn na cévách a fibrotizace. Někdy jsou přítomny i epiteloidní granulomy, vždy však jeví těsnou vazbu na stěnu divertiklů (23). Diagnóza SCAD tak stojí především na pečlivé klinicko-patologické korelaci. Většinou jde totiž o segmentální onemocnění postihující nejčastěji colon sigmoideum a zásadní je i endoskopický údaj o přítomnosti divertiklů (11).
DIVERZNÍ KOLITIDA
Diverzní kolitida je iatrogenně způsobená kolitida postihující uměle vyřazený segment střeva, který není v kontaktu se střevním obsahem. Většinou se rozvíjí několik měsíců po přechozím chirurgickém výkonu (6). Mikroskopický obraz bývá opět značně variabilní, charakteristickým znakem je však hustý lymfoplazmocytární infiltrát s nápadnou nodulární hyperplázií lymfatické tkáně. Jelikož diverzní kolitida často vykazuje i IBD-like znaky, bývá její odlišení od IBD mnohdy obtížné, a to zejména s ohledem na fakt, že diverzní kolitidu často rozvíjejí pacienti s IBD po resekčních výkonech s následnou stomií. Právě přítomnost denzního chronického zánětu a lymfoidní hyperplázie při relativně slabé aktivitě zánětu favorizuje diverzní kolitidu oproti IBD. V případě kombinace lymfoidní hyperplázie a nápadnějších známek aktivity zánětu s prominentní kryptitidou či kryptovými pseudoabscesy lze zvážit souběh obou onemocnění (24). To se týká zejména ulcerózní kolitidy, Crohnova choroba mívá ve vyřazeném úseku tlustého střeva tendenci přecházet spíše do vyhaslého obrazu s převažující fibrotizací a minimem aktivního zánětu (25,26).
PABLÁNOVÁ KOLITIDA
Pablána (pseudomembrána) je vrstva buněčné drti, fibrinu a neutrofilů ulpívající na povrchu slizničního defektu (obr. 5). Při jejím nálezu vstupuje do diferenciální diagnózy zejména bakteriální infekce Clostridium difficile. Histopatologický obraz lze rozdělit do tří typů v závislosti na časovém zasazení. Typ I představuje ranou fázi onemocnění. Pablány se tvoří zatím jen v krátkých úsecích na povrchu drobných erozí v mezikryptovém prostoru. Charakteristický je tzv. spray fenomén, jehož vzhled se připodobňuje sopečné erupci, kdy komponenty pablány „tryskají“ z drobného defektu na povrch. V přilehlé lamina propria dominuje edém, překrvení cév a přítomny jsou shluky stromálních neutrofilů. Fokálně může být přítomna i kryptitida. V další fázi onemocnění (typ II) pak dochází k dilataci krypt, které se vyplňují hlenem, fibrinem a neutrofily. Postupně dochází k rozpadu krypt a tvorbě rozsáhlejších slizničních defektů, které se na povrchu kryjí pablánami. V pozdní fázi (typ III) pak dochází ke kompletnímu zániku krypt a pablány pokrývají střevo souvislou kompaktní vrstvou (27,28). Toho dělení, které se na první pohled může jevit zbytečně detailní, má svůj význam. Diferenciální diagnóza se totiž liší právě v závislosti na dané fázi onemocnění. Typ I může připomínat akutní kolitidu nebo časný solitární rektální vřed (27). Typ II a III pak může imponovat jako ischemická kolitida, která pablány také někdy může rozvinout. Ischémii favorizuje přítomnost hyalinizace, stromálních hemoragií nebo nekróz postihujících celou tloušťku sliznice a slabší zánětlivá celulizace (29). Myslet bychom měli i na možnost mykotické kolitidy, zejména u imunosuprimovaných pacientů. Standardem by tak mělo být barvení PAS nebo jeho vhodná alternativa. Vzácně se obrazem pablánové kolitidy může prezentovat i IBD (samozřejmě až po pečlivém klinickém vyloučení klostridiové superinfekce) nebo kolagenní kolitida (30,31).
Obr. 5. Pablánová kolitida. Na povrchu sliznice je zastižen mělký defekt, do kterého je zakotvena pablána tvořená fibrinem, hlenem, buněčným detritem a neutrofily. V přilehlé lamina propria je směsná zánětlivá celulizace s účastí neutrofilů, lymfocytů i plazmocytů a krypty vykazují cytologické nepravidelnosti reaktivního charakteru (hematoxylin a eosin; 200x). 
ISCHEMICKÁ KOLITIDA
Etiologické spektrum ischémie střeva je široké a příčiny mohou být okluzivní (trombóza či embolie mezenteriálních cév, operační výkony na břišní aortě, traumata) i neokluzivní (hypoperfúze střeva při šokovém stavu, chronická zácpa,...) (15). V akutní fázi v mikroskopickém obrazu dominuje edém, prokrvácení a insudace fibrinu do lamina propria. Následně se začínají objevovat mělké eroze, které progredují do hlubších slizničních defektů. Krypty dilatují, vyplňují se hlenem, neutrofily a deskvamovanými epiteliemi a postupně dochází k jejich rozpadu. Okolní vitální epitelie vykazují reaktivní cytologické nepravidelnosti, které mohou být poměrně nápadné. Zánětlivá celulizace bývá směsná, často s převahou neutrofilů. Její intenzita bývá variabilní, obvykle však v poměru k ostatním výše zmíněným patologickým změnám nebývá nápadná a reflektuje tak primárně nezánětlivou příčinu onemocnění (obr. 6). V submukóze bývá výrazný edém a překrvení. Častým nálezem jsou i trombózy ve slizničních a submukózních cévách. V případě náhle vzniklé a závažné ischémie se pak rozvíjí kompletní nekróza sliznice, případně i hlubších vrstev střevní stěny. S postupem času pak začnou převažovat reparativní procesy s fibrotizací až hyalinizací stromatu a atrofií krypt. Krypty jsou malé, nahloučené a jejich výstelka je oploštělá (11,15,29). Predilekční lokalizací pro ischemické poškození střeva bývá obvykle oblast přechodu dvou cévních zásobení, typicky lienální flexura nebo ileocékální oblast (32). Někteří autoři však toto tvrzení rozporují a dané oblasti považují naopak za rezistentní k ischémii z důvodu dvojího cévního zásobení. Za rizikové oblasti považují spíše levostranné tlusté střevo. Oba tábory se nicméně shodují na tom, že ischemická kolitida téměř nikdy nepostihuje rektum. Ischemický obraz v rektální lokalizaci by nás měl vést k úvaze spíš nad syndromem slizničního prolapsu nebo radiační kolitidou (u pacientů po ozařování pro nádory malé pánve). Absence rektálního postižení je i důležitým odlišovacím znakem od ulcerózní kolitidy, zejména v případech doprovázených intenzivnější zánětlivou celulizací, při kterých může být odlišení ischemické kolitidy od IBD obtížnější (33,34). Myslet bychom měli i na možnost ischémie střeva na podkladě mikroangiopatie u pacientů s diabetes mellitus (35).
Obr. 6. Ischemická kolitida. Na povrchu sliznice je zastižena mělká eroze s fibrinem a neutrofily na spodině defektu. Přilehlé krypty jsou mírně defigurované a epitelie krypt vykazují cytologické nepravidelnosti reaktivního charakteru. V okolní lamina propria je nevýrazná, převážně kulatobuněčná zánětlivá celulizace a fibrotizace (hematoxylin a eosin; 200x). 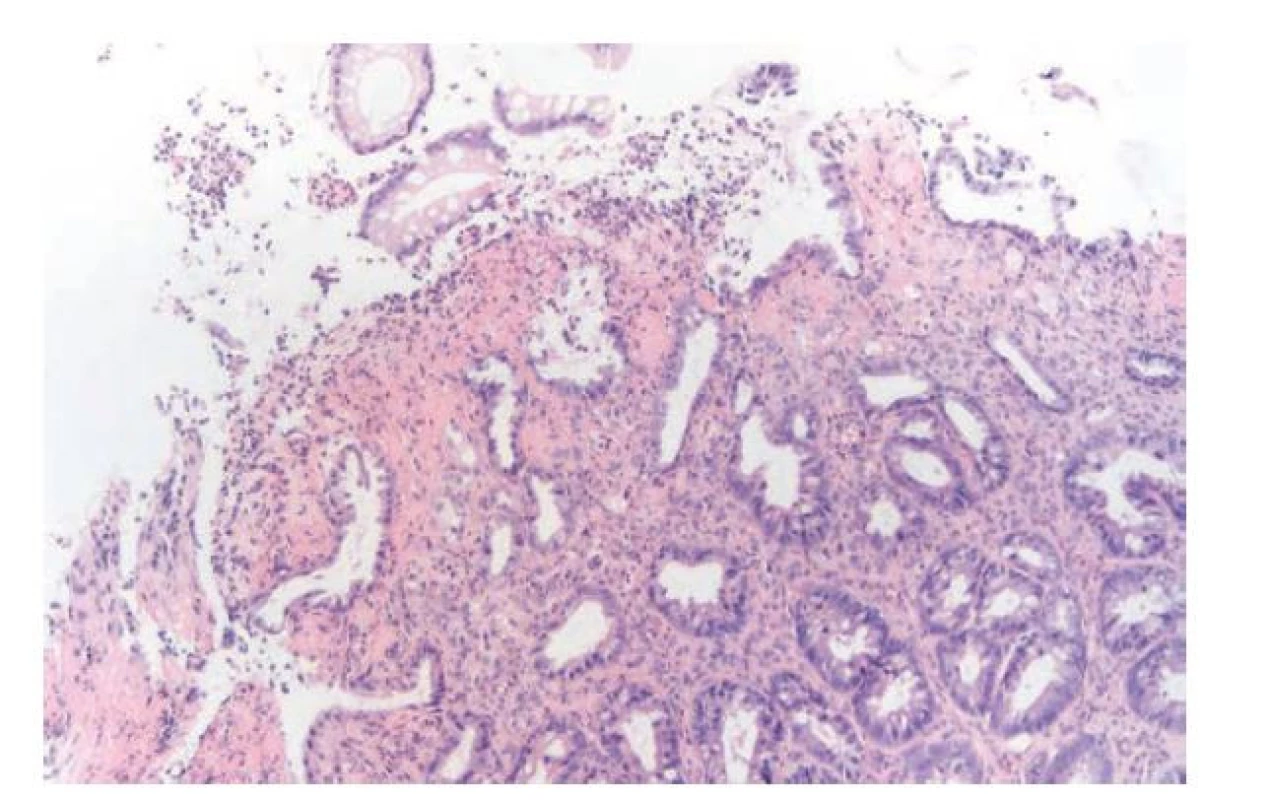
V některých případech může být ischemická kolitida doprovázená tvorbou pablán. Ty obvykle vznikají v případě postižení jen povrchových vrstev sliznice, nebo jsou známkou reperfúzního poškození. Na rozdíl od pablánové kolitidy z jiných, obvykle infekčních příčin (zejm. infekce Clostridium difficile) si však stále uchovávají svůj segmentální charakter a v okolí jsou patrné další znaky charakteristické pro ischemickou kolitidu jako hyalinizace stromatu nebo atrofie krypt (29). Nutné je myslet i na enterohemoragickou E-coli, která se velmi často prezentuje ischemicko-hemoragickým obrazem (36). Z léky indukovaných kolitid stojí na prvním místě nesteroidní antiflogistika, u kterých mikroskopický obraz také často imponuje ischemicky a často bývá doprovázený nápadnými reaktivními cytologickými nepravidelnostmi kryptové výstelky. U adolescentů a mladých dospělých bychom neměli opomíjet ani možnost užívání nelegálních drog, zejména kokainu (37-39). Obraz ischemické kolitidy pak může být u mladších pacientů i součástí projevů systémových imunitních onemocnění (systémový lupus erytematodes, dermatomyositida) (40). V neposlední řadě by pak ischemický obraz měl vést k úvaze i nad intestinální vaskulitidou, postižené cévy se totiž v endoskopické biopsii málokdy zachytí. O intestinálních vaskulitidách je blíže pojednáno v sekci o eosinofilních a granulomatózních kolitidách, ucelený výklad této problematiky však překračuje rámec tohoto článku.
Neutropenická enterokolitida je závažné onemocnění imunosuprimovaných pacientů, obvykle infekční příčiny, postihující především oblast terminálního ilea a céka. Vzhledem k periferní cytopenii bývá u těchto pacientů zánětlivá celulizace chudá a mikroskopický obraz imponuje spíše ischemicky. Onemocnění má tendenci rychle progredovat a nezřídka vyústí až v transmurální nekrózu střeva s jeho perforací (41).
Fibrotizující kolonopatie je onemocnění vznikající jako komplikace u pacientů s pankreatickou insuficiencí, léčených vysokými dávkami substitučních enzymů. Projevuje se fibrotizací zejména v submukóze, někdy i s přesahem do přilehlých vrstev střevní stěny. Postiženo bývá hlavně terminální ileum a pravostranné tlusté střevo. Makroskopicky může onemocnění věrně imitovat Crohnovu chorobu včetně přítomnosti striktur a někdy i obrazu dlažebních kostek (42).
RADIAČNÍ KOLITIDA
Radiační kolitida se vyznačuje podobným mikroskopickým obrazem jako ischemická kolitida. V akutní fázi dominuje stromální edém a v zánětu převažují neutrofily a často i eosinofily. Epitelie vykazují reaktivní změny, které bývají často nápadné, se ztrátou polarity buněk. Přítomny bývají i eroze nebo ulcerace. Dalším charakteristickým znakem jsou početnější apoptózy, proto bychom radiační kolitidu měli zvažovat i v diferenciální diagnóze apoptotických kolonopatií. Vzácné nebývají ani slizniční teleangiektázie nebo i fibrinoidní nekróza stěny cév. V chronické fázi pak dominuje fibrotizace až hyalinizace, narušená architektonika sliznice a fibroobliterativní změny na cévách. Hyalinóza stromatu a stěn cév může být tak výrazná, že je někdy zapotřebí provést specializovaná barvení k vyloučení amyloidózy. Dalším charakteristickým znakem je přítomnost postradiačních cytologických atypií. Jádra buněk jsou zvětšená a hyperchromní, někdy až bizarní a pleomorfní a mohou věrně imitovat těžce dysplastické nebo maligní nádorové buňky. Atypie však nacházíme nejenom v epitelu, ale i ve stromálních elementech lamina propria, což je důležitý odlišovací znak od skutečné dysplázie epitelu. Buňky si navíc stále udržují nízký nukleocytoplazmatický poměr (7,43,44).
SYNDROM SLIZNIČNÍHO PROLAPSU (MUCOSAL PROLAPSE SYNDROME)/SOLITÁRNÍ REKTÁLNÍ VŘED
Syndrom slizničního prolapsu je zastřešující klinický termín pro více patologických stavů, pro které je společným jmenovatelem prolaps rektální sliznice. Ten bývá většinou zevní, méně často pak vnitřní v podobě intususcepce (tzv. okultní prolaps). Příčinou často bývají různé nádorové i nenádorové tumorózní léze (hamartogenní či nádorové polypy, hemoroidy) nebo je prolaps způsobený funkčně (např. zvýšený tonus rektálního svěrače). Do skupiny syndromu slizničního prolapsu patří i solitární rektální vřed, který, jak už název napovídá, se projevuje jako izolovaná ulcerace na sliznici rekta, většinou na její ventrální straně, obvykle u mladých pacientů (45). Z mikroskopického pohledu je charakteristická narušená architektonika krypt s jejich protažením, angulací a dilatací. Dilatace krypt mívá často kosočtverečný tvar se zúžením u špičky báze (tzv. diamond shaped crypts), která je pro syndrom slizničního prolapsu poměrně patognomická (46). Povrch sliznice bývá obvykle erodovaný a povleklý fibrinem a neutrofily. Okolní epitel vykazuje známky regenerace a v lamina propria je edém, překrvení cév a fibrotizace. Zánět obvykle nebývá výrazný. Lamina muscularis mucosae bývá hypertrofická a vysílá vertikálně orientované snopce hladké svaloviny mezi krypty. Mikroskopický obraz je tak podobný zejména ischemické nebo časné pablánové kolitidě (47).
KOLAGENNÍ KOLITIDA
Kolagenní a lymfocytární kolitida představují dvě jednotky, které jsou morfologickým korelátem klinického syndromu mikroskopické kolitidy. Tu charakterizují chronické vodnaté průjmy u pacientů s normálním endoskopickým, rentgenologickým i laboratorním nálezem. Diagnóza je v těchto případech stanovená až na základě histopatologického vyšetření. Většinou postihuje pacienty středního až staršího dospělého věku a příčina onemocnění je často neznámá (6).
Z mikroskopického pohledu je kolagenní kolitida definována přítomností zesíleného subepiteliálního kolagenního pásu, přesahujícího tloušťku 10 μm. Maximální tloušťka bývá variabilní a může dosahovat až ke 100 μm. Liší se i spektrum jednotlivých typů kolagenů v subepiteliálním pásu, který oproti fyziologické bazální membráně neobsahuje pouze kolagen IV, ale i kolagen I, II a VI (6,48). Poměrně charakteristický nález je odlučování (detachment) povrchového epitelu. V lamina propria bývá lymfoplazmocytární zánětlivá celulizace, někdy s příměsí eosinofilů, přítomnost početnějších neutrofilů však není typická (obr. 7). Někdy můžeme pozorovat nevýraznou kryptitidu, nicméně nález prominentní kryptitidy, početných kryptových pseudoabscesů nebo narušené architektoniky sliznice by měl vést k úvaze nad jiným onemocněním (49,50). Případně lze zvážit i souběh dvou různých chorob, doložená je totiž asociace kolagenní i lymfocytární kolitidy s IBD. Mohou IBD přecházet a představovat tak určitý morfologický subtyp jejich primomanifestace, nebo se naopak rozvinout až s odstupem času v léčeném terénu (zvažován je i možný negativní efekt anti-TNF terapie) (51,52).
Obr. 7. Kolagenní kolitida. A: Kolická sliznice má zachovalou architektoniku. V lamina propria je zcela minimální, pouze superficiálně lokalizovaná kulatobuněčná zánětlivá celulizace, ve většině rozsahu je sliznice bez zánětu, pouze s edémem stromatu. Subepiteliálně je zastižen zesílený kolagenní pás a v těchto místech je patrné i odloučení povrchového epitelu (hematoxylin a eosin; 200x). B: Zelený trichrom znázorňující výše popsaný kolagenní pás (Massonův zelený trichrom; 200x). 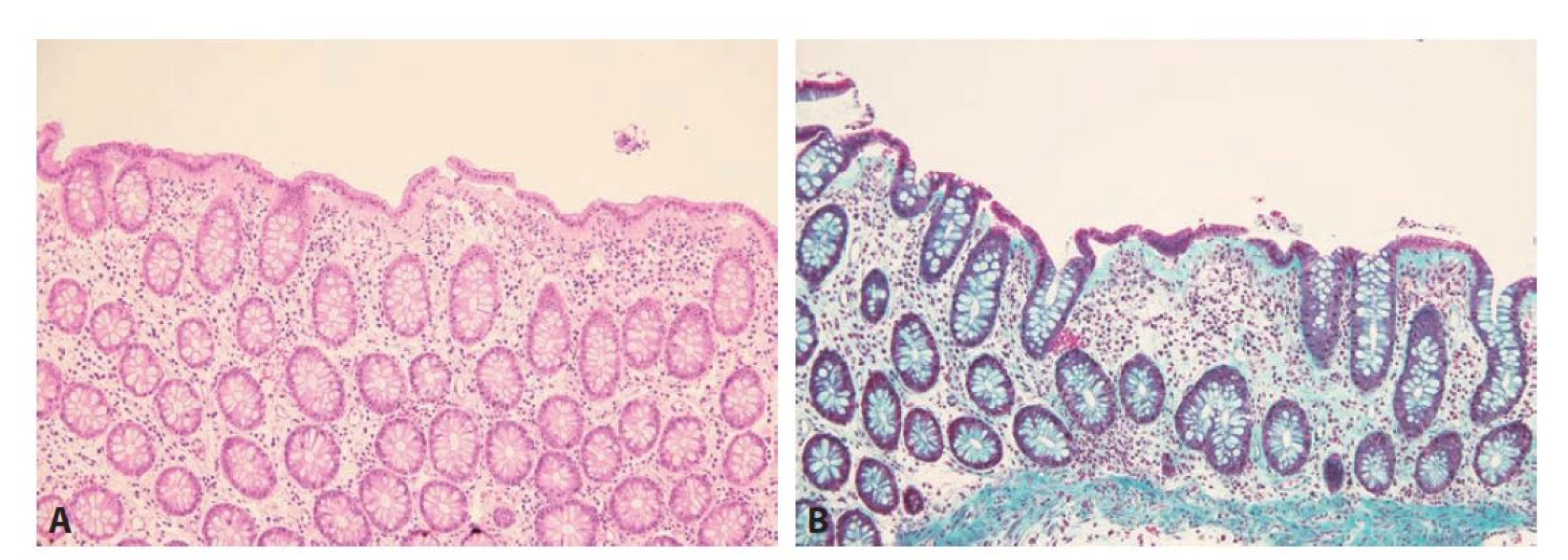
V posledních letech bylo u kolagenní kolitidy definováno několik atypických variant (tab. 2). Patří mezi ně inkompletní/borderline kolagenní kolitida, definována tloušťkou subepiteliálního pásu v rozmezí 5-10 μm. Doposud není jasné, zda se jedná o samostatnou nozologickou jednotku či jen časnou formu konvenční kolagenní kolitidy, případně o chybu odběru (53,54). Mezi další varianty patří kolagenní kolitida s přítomností pablán (54) nebo s početnými makrofágy v lamina propria včetně jejich mnohojaderných forem (tzv. kolagenní kolitida s obrovskými buňkami) (55).
Tab. 2. Histopatologické varianty lymfocytární a kolagenní kolitidy. 
IEL = intraepiteliální lymfocytóza; IBD = zánětlivá střevní onemocnění; KK = kolagenní kolitida; LK = lymfocytární kolitida. V diferenciální diagnóze je pak nezbytné odlišit kolagenní kolitidu od amyloidózy použitím specializovaných barvení (56).
LYMFOCYTÁRNÍ KOLITIDA
Lymfocytární kolitida stojí na průkazu patologické intraepiteliální lymfocytózy (IEL) přesahující 20 lymfocytů / 100 enterocytů doprovázené zánětem v lamina propria. Právě přítomnost zánětu a dalších známek poškození střevní sliznice v kombinaci s typickým klinickým zasazením odlišuje lymfocytární kolitidu od prosté kolické IEL, které je z etiologického hlediska zcela nespecifickým jevem doprovázejícím řadu onemocnění (lékové poškození, hojící se infekce, vrozené poruchy imunity, autoimunitní procesy postihující jiné orgány,...) (57). Zapotřebí je zdůraznit, že početní kritéria pro IEL byla stanovena pro přehledné barvení hematoxylinem a eosinem (6,58). Použití imunohistochemie je v těchto případech nevhodné, protože počty intraepiteliálních lymfocytů s ohledem na daná diagnostická kritéria nadhodnocuje a může tak vést k falešně pozitivním výsledkům (59,60). Ostatně, toto pravidlo platí i pro hodnocení IEL v jiných částech trávicí trubice a důležité je zejména u céliakie (která je morfologického pohledu de facto lymfocytární duodenitidou). IEL by dále neměla být hodnocena nad lymfatickými folikuly, kde je její přítomnost fyziologická (2). Povrchový epitel v místech IEL obvykle vykazuje degenerativní změny, depleci hlenotvroby a bývá oploštěný. V lamina propria je lymfoplazmocytární zánětlivá celulizace variabilní intenzity. Podobně jako v případě kolagenní kolitidy i zde platí, že výraznější příměs neutrofilů není pro lymfocytární kolitidu typická a měla by vést k úvaze nad jiným onemocněním (obr. 8) (61).
Obr. 8. Lymfocytární kolitida. Kolická sliznice se zachovalou architektonikou a kulatobuněčnou zánětlivou celulizací mírné intenzity v lamina propria. V povrchovém epitelu i ve výstelce krypt jsou patrny početné intraepiteliální lymfocyty a povrchový epitel vykazuje regresivní změny a depleci hlenotvorby (hematoxylin a eosin; 100x). 
Lymfocytární kolitida se stejně jako kolagenní kolitida může prezentovat atypickou morfologií. Inkompletní/borderline lymfocytární kolitida je definována IEL v rozmezí 10-19 lymfocytů / 100 enterocytů (zvlášť v tomto případě nelze dostatečně zdůraznit nutnost odpovídajícího klinického zasazení) (50). Tzv. kryptová lymfocytární kolitida se vyznačuje nápadnou IEL ve výstelce krypt, zatímco povrchový epitel zůstává intaktní (62). Stejně jako v případě kolagenní kolitidy, i lymfocytární kolitida může být doprovázena výskytem mnohojaderných histiocytů (lymfocytární kolitida s obrovskými buňkami) (63). V některých případech lze zastihnout i zesílený subepiteliální kolagenní pás, který by však neměl přesáhnout tloušťku 10 μm, pak bychom nález označili za kolagenní kolitidu (kterou přítomnost IEL nevylučuje). Je tedy zřejmé, že mezi lymfocytární a kolagenní kolitidou existují určité překryvy, a doposud není zcela jasné, zda se jedná o dvě samostatné jednotky nebo plynulé spektrum jednoho onemocnění (64).
Lymfocytární kolitida bývá často asociována s lymfocytárními záněty v jiných částech trávicí trubice (např. lymfocytární gastritidou) nebo s céliakií (65-67). Připomínáme i výše zmíněnou asociaci s IBD.
MASTOCYTÁRNÍ ENTEROKOLITIDA
Mastocytární enterokolitida je vzácné onemocnění prezentující se chronickými průjmy, příznaky dolního dyspeptického syndromu a normálním endoskopickým nálezem. Mělo by tak být zvažováno především v diferenciální diagnóze dráždivého tračníku. Histologicky je definováno zvýšeným množstvím žírných buněk v lamina propria, přesahující počet 20 buněk / 1 HPF. Jelikož jsou žírné buňky v základním barvení HE často špatně viditelné, bývá mikroskopický obraz mnohdy normální. Na onemocnění je proto nutné aktivně pomýšlet a v indikovaných případech provést imunohistochemický průkaz CD117 nebo tryptázy (histochemický průkaz metachromatických granul například toluidinovou modří není vhodný, protože detekuje jen zralé formy mastocytů). V některých případech bývají žírné buňky doprovázeny vyšším množstvím eosinofilů, proto bychom tuto jednotku měli zvažovat i v diferenciální diagnóze eosinofilních střevních zánětů (obr. 9) (68,69). Zároveň je nutné mít na paměti, že diagnóza mastocytární enterokolitidy, podobně jako například lymfocytární či kolagenní kolitidy, vyžaduje odpovídající klinický kontext. Zvýšené množství mastocytů totiž běžně doprovází IBD, radiační kolitidu i jiná onemocnění (70-72). Nezbytné je i klinické vyloučení systémové mastocytózy, kde je kritérium intestinálního postižení jen 15 žírných buněk / 1 HPF. Ve většině případů však bývá infiltrace nápadnější, s tendencí ke shlukování mastocytů, početnými eosinofily v okolí a často i narušenou architektonikou sliznice (73,74). Mastocyty navíc v těchto případech vykazují aberantní imunofenotyp s expresí antigenu CD25 (75,76).
Obr. 9. Mastocytární enterokolitida. A: Sliznice tenkého střeva vykazuje mírnou defiguraci krypt. V lamina propria je směsná zánětlivá celulizace s účastí lymfocytů, plazmatických buněk, neutrofilů a dále i početných žírných buněk a eosinofilů (hematoxylin a eosin; 200x).
B: Pozitivita početných žírných buněk v imunohistochemickém průkazu antigenu CD117 (200x).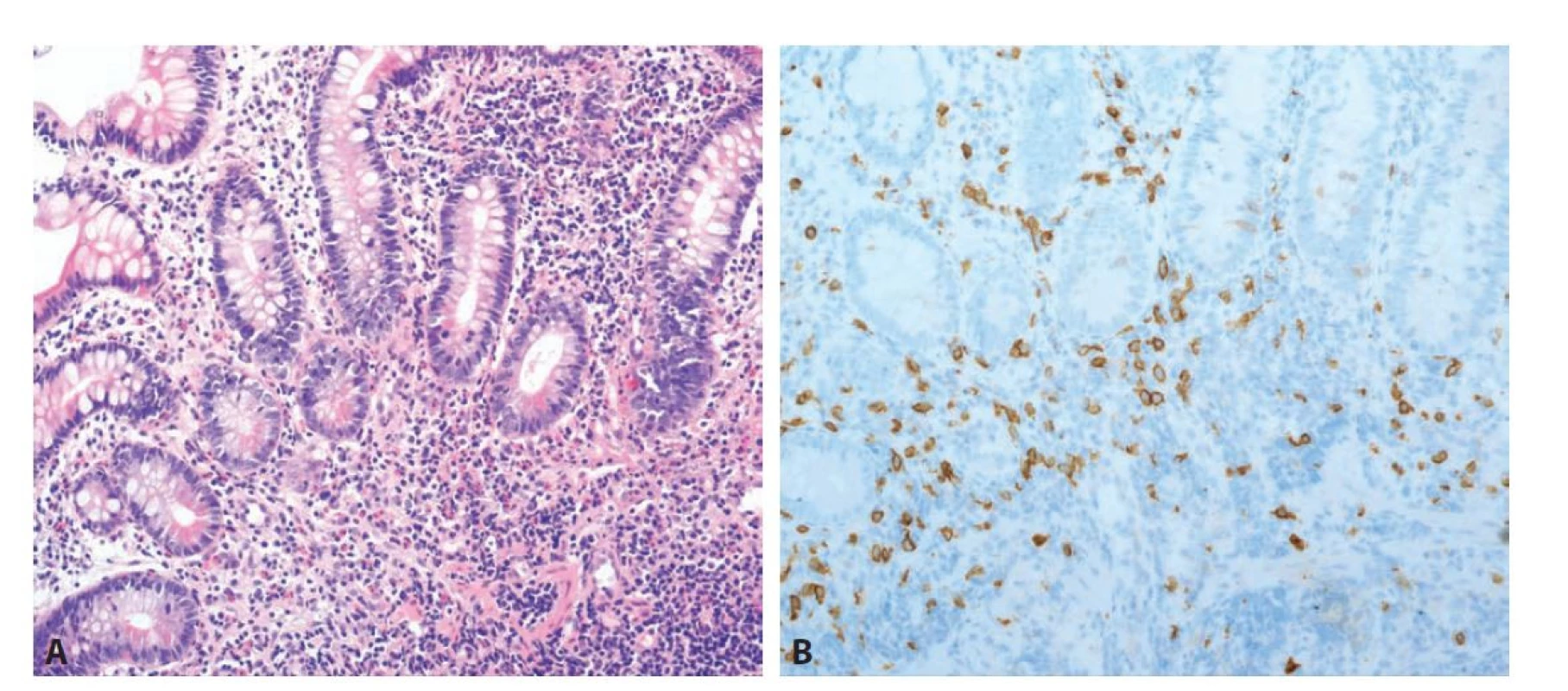
MELANOSIS COLI A JINÉ INFILTRACE MAKROFÁGY
Jak již bylo zmíněno v úvodu článku, mukofágy v lamina propria jsou do určité míry fyziologickým jevem, případně mohou představovat resorpční reakci na rupturu krypty. Nezbytné je odlišení od pěnitých makrofágů u pacientů s Whippleovou chorobou nebo atypickými mykobakteriózami za pomocí specializovaných barvení (PAS, Ziehl-Neelsen). K rozlišení těchto dvou chorob může napomoct i přítomnost slizničních lymfangiektázií nebo tukových vakuol, které jsou charakteristické pro Whippleovu chorobu a u mykobakterióz je nevídáme (77). Lipofágy se v lamina propria mohou objevit v rámci slizničních xanthomů. Větší množství lipofágů roztroušených na více místech sliznice bývá odrazem zhojené kolitidy z předchozí doby nebo je můžeme nacházet v okolí nádorů. Endoskopicky imponují jako drobné žlutavé tečky na sliznici a daný endoskopický obraz bývá připodobňován slepičí kůži (chicken skin mucosa) (5).
Melanosis coli je patologům i endoskopistům dobře známá jednotka charakterizovaná přítomností makrofágů s hnědavým pigmentem v cytoplazmě, který odpovídá ceroidu (obr. 10). Predilekční lokalitou je cékum a rektum a udávaná je souvislost s chronickým užíváním laxativ (5). Podobný morfologický obraz má i syndrom hnědého střeva (brown bowel syndrome), u kterého jde o střádání lipofuscinu v cytoplazmě nikoliv makrofágů, ale stromálních buněk lamina propria a někdy i hladkosvalových buněk lamina muscularis propriae. Nález bývá popisován u pacientů s malabsorpčními syndromy (nejspíše jako následek hypovitaminózy E) (42).
Obr. 10. Melanosis coli. Melanosis coli s přítomností početných pigmentovaných makrofágů v lamina propria (hematoxylin a eosin; 200x). 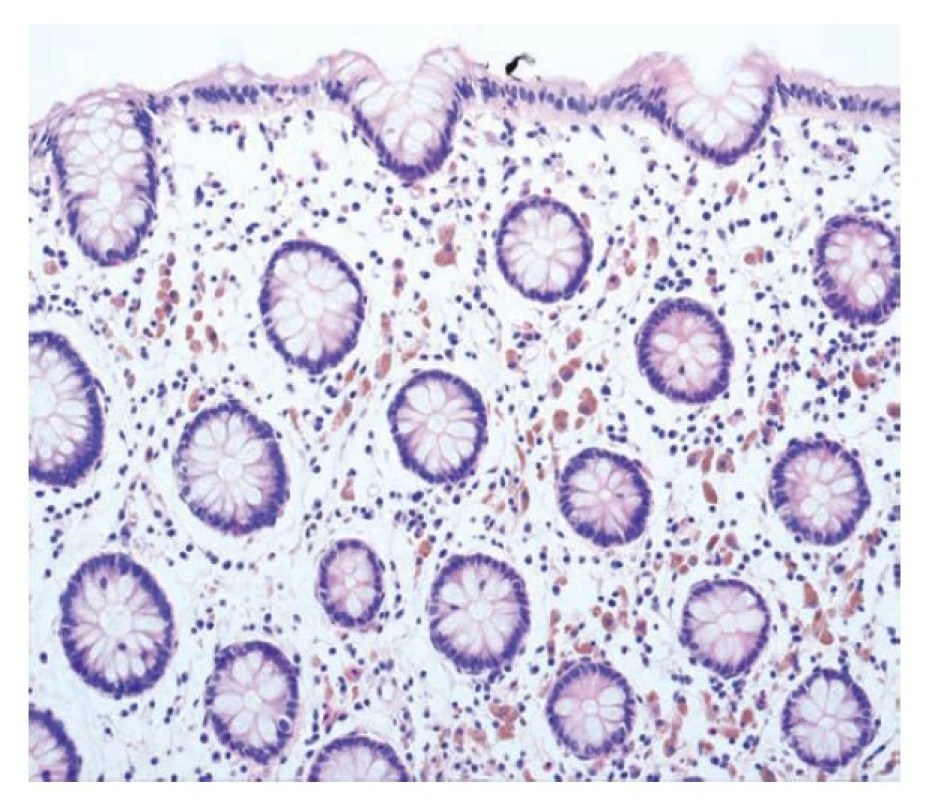
GRANULOMATÓZNÍ KOLITIDA
Epiteloidní granulom je definován jako shluk nejméně pěti epiteloidních makrofágů (1). Etiologické spektrum granulomatózních zánětů je široké a liší se s ohledem na morfologii granulomů i jejich lokalizaci v rámci jednotlivých etáží trávicí trubice. Při nálezu granulomatózního zánětu bychom měli v první řadě vyloučit, zda se nejedná o reakci charakteru z cizích těles, kterou můžeme vídat v okolí destruovaných krypt nebo jako reakci na sterkorální materiál na spodině slizničních defektů (tzv. kryptolytické a koprofagické granulomy). Granulomy z cizích těles obvykle mívají odlišnou morfologii než imunitně podmíněné granulomy, často se jedná jen o shluky nebo izolované mnohojaderné buňky bez přítomnosti plně vyvinutého granulomu. Jejich nález je zcela nespecifický a není asociovaný s žádnou konkrétní etiologií. Granulom může někdy imitovat i tangenciálně zastižená báze krypty, stěna cévy nebo sklerotické germinální centrum. V případě obrovskobuněčné reakce bez zjevné vazby na slizniční defekty nebo krypty je dobré pátrat po přítomnosti vajíček parazitů nebo krystalech léků (78). Pokud jsme si jistí imunitně podmíněným granulomem, další diferenciálně diagnostický postup se odvíjí od morfologie granulomu, nálezu v okolní sliznici, lokalitě onemocnění a zejména pak pečlivé klinicko-patologické korelaci (tab. 3 a 4). V tomto textu se zaměříme na granulomatózní procesy tlustého střeva a terminálního ilea.
Tab. 3. Nejčastější příčiny granulomatózních kolitid. 
CGD = chronická granulomatózní choroba; CVID = běžná variabilní imunodeficience;
GIT = gastrointestinální trakt; NSAID = nesteroidní antiflogistika;
SCAD = segmentální kolitida asociovaná s divertikulózou; TBC = tuberkulóza.Tab. 4. Histopatologické typy granulomatózního zánětu a nejčastější etiologie. 
Granulom bez nekrózy
Nález dobře formovaného kompaktního granulomu bez nekrózy v ileální nebo kolické lokalizaci staví na první místo v diferenciální diagnóze Crohnovu chorobu (obr. 11). V případě, kdy máme důvodné podezření na IBD a jiná diagnóza je málo pravděpodobná, vylučuje nález granulomu ulcerózní kolitidu a je pro Crohnovu chorobu prakticky diagnostický (22). Morfologie granulomů jde od nenápadných mikrogranulomů až po objemné granulomy, často i s početnými mnohojadernými histiocyty. Vzácnosti nebývá ani nález asteroidních nebo Schaumannových inkluzí. Granulomy se mohou se vyskytovat ve kterékoliv vrstvě střevní stěny. Jejich nález nicméně není u Crohnovy choroby pravidlem, procento pozitivních případů se dle dostupných publikací pohybuje v rozmezí od 15 % až po 60 % (78-80). V případě, kdy diagnózu IBD nelze s jistotou potvrdit a zvažujeme i jiná onemocnění, otevírá pak nález granulomů širokou diferenciální diagnózu infekčních i neinfekčních onemocnění. V těchto případech bývá nápomocný i nález v okolní kolické sliznici. Absence výraznějšího zánětu v okolí staví do popředí intestinální sarkoidózu. Ta je v oblasti trávicího traktu vzácná a častěji než střevo postihuje žaludek. Intenzivnější zánětlivé změny při sarkoidóze vídáme spíše jen v blízkosti slizničních defektů, které mohou sarkoidózu někdy doprovázet. Charakteristická (i když zdaleka ne patognomická) je přítomnost asteroidních a Schaumanových inkluzí, které by neměly být zaměněny s cizorodým fagocytovaným materiálem (81). Zvážit bychom měli i lékové postižení, ačkoliv granulomatózní obraz u léky indukovaných kolitid bývá překvapivě vzácný (78). Popisován je například u pacientů na imunomodulační terapii (82). Především u dětí bychom pak neměli zapomínat, že granulomatózní záněty trávicího traktu se často objevují u pacientů s vrozenými poruchami imunity jako je chronická granulomatózní choroba, kde je nápomocný nález pigmentovaných makrofágů v okolí, běžná variabilní imunodeficience (CVID), na kterou vzbudí podezření absence plazmatických buněk, nebo Heřmanského-Pudlákův syndrom (83-85).
Obr. 11. Granulomatózní kolitida. Kolická sliznice má zachovalou architektoniku. V lamina propria je jen velmi mírná chronická zánětlivá celulizace bez známek aktivity zánětu. V dolní části obrázku je zastižen dobře formovaný epiteloidní granulom bez přítomnosti nekrózy. V diferenciální diagnóze přichází v úvahu zejména Crohnova choroba, vyloučit však nelze ani jiné příčiny ne-nekrotizujících granulomatózních kolitid jako např. intestinální sarkoidózu (hematoxylin a eosin; 200x). 
Tab. 5. Etiologie granulomatózních zánětů GIT dle lokalizace. 
GIT = gastrointestinální trakt; HP = Helicobacter pylori; SCAD = segmentální kolitida asociovaná s divertikulózou; TBC = tuberkulóza. Granulom s eosinofilním zánětem v okolí
Hojná eosinofilní celulizace na pozadí granulomatózního procesu by vždy měla vést k úvaze nad parazitární, případně mykotickou etiologií. Léčená IBD ve fázi hojení bývá také často doprovázená početnými eosinofily. V úvahu přichází i léky indukovaná kolitida. Pneumatosis coli může indukovat granulomatózní reakci charakteru z cizích těles a častá bývá i doprovodná eosinofilní celulizace (78). Jde nejspíš o podobný jev jako reaktivní eosinofilní pleuritida u pacientů s pneumothoraxem.
Nekrotizující granulom
Nekrotizující granulomatózní kolitida staví na první místo infekci. Centrální kaseózní nekróza je charakteristická pro tuberkulózu (TBC) a měla by vést k cílenému průkazu mykobakterií metodou Ziehl-Neelsen, případně PCR. Nicméně, kaseózní nekróza v případě intestinální TBC nebývá pravidlem a často jsou přítomny menší granulomy bez nekrózy (78). Intestinální TBC může vyvolat obraz granulomatózní terminální ileitidy či kolitidy zcela neodlišitelný od Crohnovy choroby, včetně striktur, fisur a transmurálního prostupu zánětu (86). Klinické vyloučení infekcí je proto standardní součástí diagnostického algoritmu u všech pacientů s podezřením na IBD. V případě klinicky nejasného onemocnění by pak specializovaná histopatologická barvení k vyloučení infekcí měla být provedena vždy, ať už je morfologie granulomu jakákoliv. Nález granulomů s centrálním hnisáním pak odpovídá granulomatózně-hnisavému zánětu, který je charakteristický pro infekci Yersinia enterocolitica a řadu antropozoonóz (brucelóza, tularémie, bartonelóza a další) (78).
Granulom s nekrotickým pozadím
V případě nálezu nekrózy nikoliv přímo v granulomu, ale v okolní kolické sliznici bychom měli myslet na možnost invazivní mykotické infekce (78). Samostatnou kapitolou jsou pak intestinální vaskulitidy. Ve střevní lokalizaci se granulomatózním obrazem prezentují čtyři nejčastější jednotky. Eosinofilní granulomatóza s polyangiitidou (dříve syndrom Churga a Straussové) bývá často doprovázená početnými eosinofily v okolí. Vodítkem může být i klinický údaj o asthma bronchiale nebo periferní eosinofilii (87). Granulomatóza s polyangiitidou (dříve Wegenerova granulomatóza) častěji postihuje respirační trakt a charakteristický je extenzivní nekrotizujcí proces v okolí (88). Je dobré mít na paměti i Behçetovu chorobu, neboť často postihuje oblast terminálního ilea s tvorbou aftózních lézí, oválných ulcerací a granulomů, přičemž vlastní postižení cév, jak už bylo zmíněno výše, se v biopsii často nezachytí. Onemocnění tak věrně imituje Crohnovu chorobu a pomocným vodítkem je klinický údaj o orálních a genitálních ulceracích či recidivujících iridocyklitidách (89). Vzácně se ve střevě může vyskytnout i obrovskobuněčná arteritida (90).
EOSINOFILNÍ KOLITIDA
Eosinofilní záněty trávicího traktu jsou charakterizovány mikroskopickým nálezem dominující eosinofilní celulizace v zánětlivém infiltrátu a dělí se na primární a sekundární. Primární zůstávají omezeny na trávicí trakt a patří mezi ně eosinofilní ezofagitida, gastritida, enteritida, gastroenteritida a kolitida. U části pacientů se prokáže alergická příčina onemocnění (obvykle potravinová), v mnoha případech však příčina zůstává neznámá. Periferní eosinofilie nebývá pravidlem (91,92). Sekundární eosinofilní záněty pak přicházejí jako druhotná reakce na jiná onemocnění nebo jako součást systémových eosinofilních procesů. Na druhou stranu, ne každá potravinová alergie se nutně projeví eosinofilním typem zánětu. Čistě IgE mediované potravinové alergie jako jsou orání alergický syndrom nebo gastrointestinální anafylaxe (případně další, extraintestinální reakce) mívají obvykle akutní průběh a v bioptické praxi se s nimi nesetkáváme. Do rukou patologa se dostávají spíše onemocnění zprostředkované buněčnou imunitou nebo smíšené IgE a buněčně mediované alergie, jejichž průběh bývá protrahovaný. S ohledem na více zúčastněných imunitních drah tak eosinofilní charakter zánětu není nutně pravidlem. V řadě případů se potravinové alergie prezentují necharakteristickým mikroskopickým obrazem a čistě z morfologického pohledu tak nepatří do skupiny eosinofilních kolitid. Částí svojí komplexní patogenezy by sem spadaly i potravinové enteropatie včetně céliakie (obr. 12) (42).
Obr. 12. Klasifikace patologických potravinových reakcí GIT.
GIT = gastrointestinální trakt.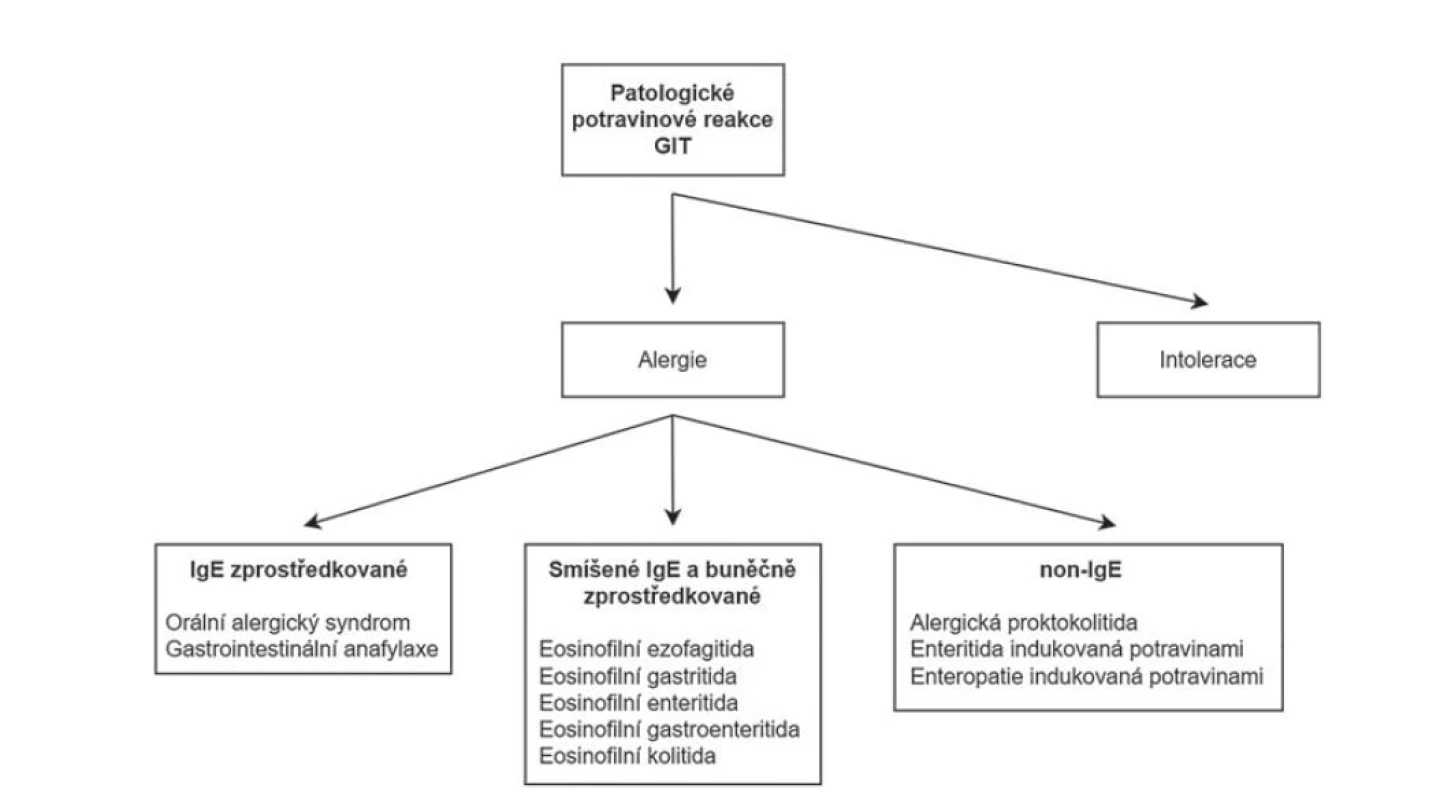
Diagnostika eosinofilních zánětů trávicího traktu tedy stojí na histopatologickém průkazu eosinofilní zánětlivé celulizace (obr. 13). Jak již bylo zmíněno výše, pro střevo doposud neexistuje přesně stanovená hranice patologicky zvýšeného počtu eosinofilů. V praxi se často používá hranice 20 eosinofilů / 1 HPF (93), kritérium však není spolehlivé vzhledem ke kolísajícímu počtu eozinofilů v různých etážích střeva, s nejvyšším podílem na fyziologické celulizaci v terminálním ileu a pravostranném kolon, kde jejich počet průměrně přesahuje 25 eosinofilů / HPF (94). Spíše bychom tedy měli vycházet ze známek aktivace eosinofilů v podobě jejich intraepiteliálního prostupu, shlukování, degranulace, prostupu do hlubších vrstev střevní stěny či tvorby eosinofilních „abscesů“ (kryptových i stromálních) (95,96). Dále bychom neměli zapomínat, že eozinofily představují běžnou součást chronické zánětlivé celulizace a často i ve velkém množství. Je proto zapotřebí rozlišovat, zda eosinofily tvoří výhradní nebo téměř výhradní buněčný typ, nebo jsou jen jednou z komponent směsného chronického zánětu a jejich přítomnost tak není specifická. Hojné eosinofily běžně vídáme například u léčené IBD a opírat hodnocení čistě jen o jejich zvýšený počet by vedlo k velmi častým falešně pozitivním výsledkům (15).
Obr. 13. Eosinofilní kolitida. V lamina propria kolické sliznice je zánětlivá celulizace s převažující účastí velmi početných eosinofilů, které jeví tendenci ke shlukování a místy prostupují do výstelky krypt (hematoxylin a eosin; 200x). 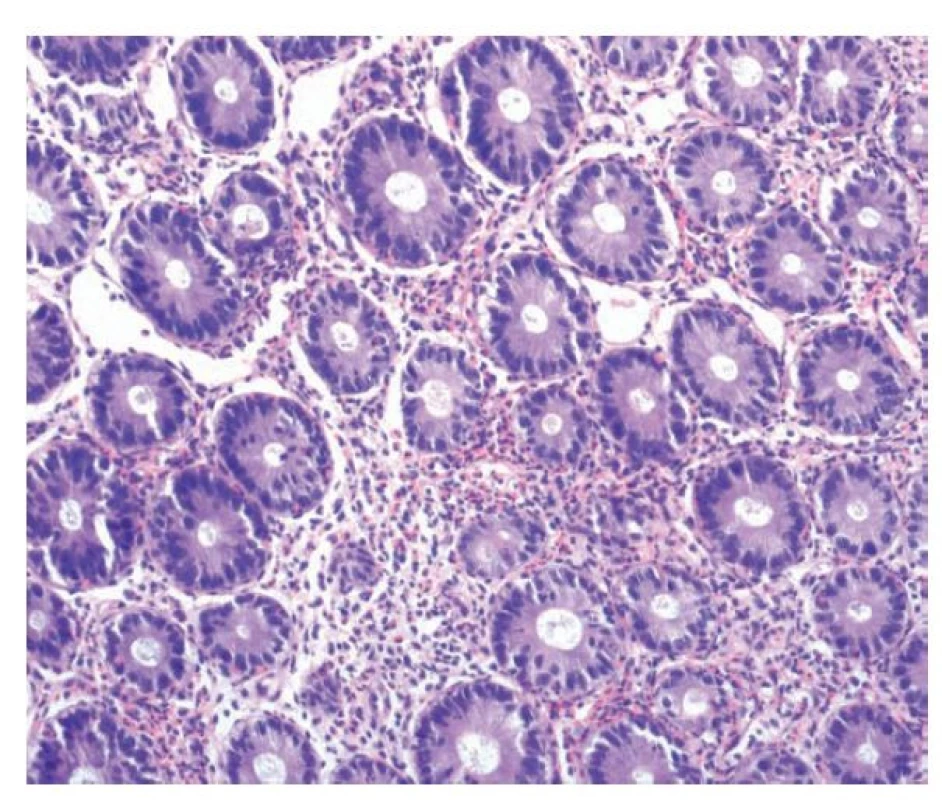
Eosinofilní gastroenteritida je onemocnění z definice postihující oblast žaludku a tenkého střeva, přičemž ostatní části trávicího traktu (jícen, tlusté střevo) mohou být postiženy nekonstantně (92). Jde o chorobu především mladých dospělých pacientů, věková distribuce je však široká. Alergická etiologie se prokáže u části pacientů. Mikroskopicky je přítomný eosinofilní zánět, jehož charakteristiky byly popsány výše. Zánět může postihovat sliznici, hlubší vrstvy střevní stěny i serózu, podle čehož chorobu dělíme na slizniční, murální a serózní, případně i transmurální (difúzní) formu. První dvě se obvykle projevují průjmy a bolestmi břicha, případně zvracením, pro serózní formu je typický recidivující ascites a častá bývá i periferní eosinofilie (92). Eosinofilní kolitida pak postihuje tlusté střevo. Častá bývá u kojenců, u kterých mívá alergickou příčinu (obvykle alergie na bílkovinu kravského mléka), v řadě případů nebývá IgE mediovaná a postihuje zejména rektum jako tzv. alergická proktokolitida. Eosinofilní kolitida adolescentů a dospělých je zatím vágněji definovaná, imunitní mechanismy nejsou spolehlivě objasněny a alergická etiologie se prokáže jen někdy (96). Vzácně mohou primární eosinofilní záněty postihnout žaludek nebo tenké střevo i izolovaně, jako eosinofilní gastritida či enteritida, mnohem častěji však přichází v rámci eosinofilní gastroenteritidy (96). Tzv. perikryptální eosinofilní enterokolitida je zvláštní typ eosinofilního zánětu trávicího traktu, u kterého eosinofily obklopují hluboké partie krypt a někdy infiltrují i přilehlou lamina muscularis mucosae. Onemocnění se objevuje zejména u pacientů se systémovými chorobami pojiva (97).
Pod sekundární eosinofilní kolitidy spadají parazitární infekce (např. helmitózy) (98), některé léky indukované kolitidy (např. antiepileptika nebo některá antibiotika) (99,100), vaskulitidy (např. výše zmíněná eosinofilní granulomatóza s polyangiitidou) (11) nebo přicházejí v rámci idiopatického hypereosinofilního syndromu (15). Z méně častých příčin pak stojí za zmínku i histiocytóza z Langerhansových buněk (11). Řeč byla i o mastocytárních onemocněních, u kterých bývají žírné buňky v přehledném barvení špatně viditelné a často je doprovázejí právě četné eosinofily (15). V neposlední řadě je nutné mít na paměti, že eosinofilie může mít i klonální původ a být projevem myeloproliferativních onemocnění (101).
APOPTOTICKÁ KOLONOPATIE
Apoptotická kolonopatie je zastřešující popisný termín pro skupinu onemocnění, charakterizovaných zvýšeným počtem apoptóz v epitelu. Mohou být dominující nebo i jedinou morfologickou změnou, nebo mohou doplňovat celkový zánětlivý obraz. V biopsii je apoptotická tělíska snadné přehlédnout, proto je dobré mít o této jednotce povědomí a v konkrétních případech na ni aktivně pomýšlet. Pod pojmem apoptotická kolonopatie se totiž ukrývá skupina poměrně charakteristických a často závažných onemocnění (tab. 6).
Tab. 6. Diferenciální diagnostika apoptotických kolonopatií. 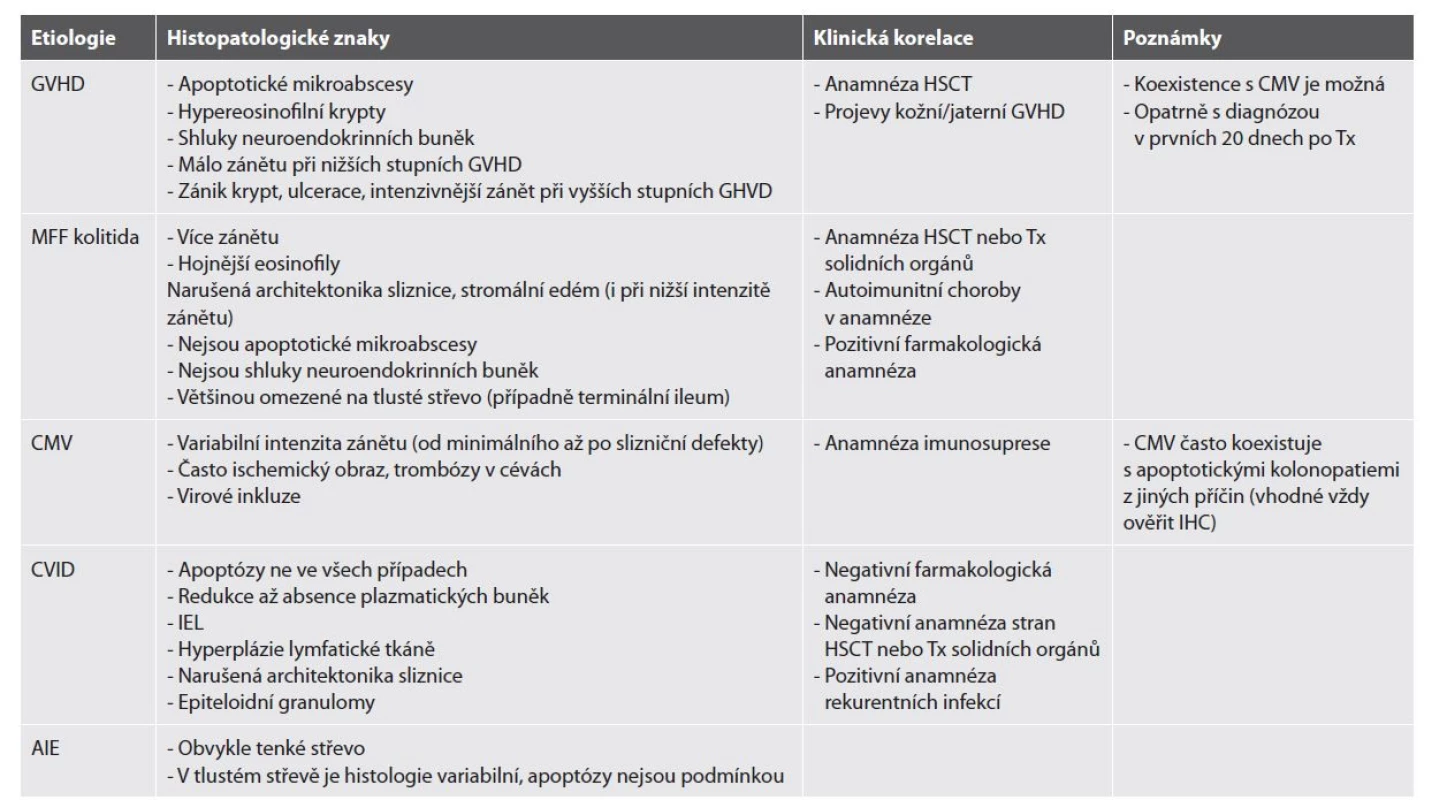
AIE = autoimunitní enteropatie; CMV = cytomegalovirus; CVID = běžná variabilní imunodeficience; GHVD = reakce štěpu proti hostiteli; HSCT = transplantace hematopoetických kmenových buněk; IEL = intraepiteliální lymfocytóza; IHC = imunohistochemie; MFF = mykofenolát mofetil; Tx = transplantace. Histopatologická diagnóza se opírá o záchyt zvýšeného množství apoptotických tělísek ve výstelce krypt a/nebo v povrchovém epitelu, za které je arbitrárně považováno více než 5-6 apoptóz / 10 krypt nebo záchyt více než jedné apoptózy na bioptický fragment (102,103). Apoptotická tělíska lze rozpoznat jako opticky prázdné měchýřky kolísající velikosti obsahující pyknotické jádro nebo buněčnou drť. Tím se odlišují od intraepiteliálních lymfocytů, které mohou svojí bledou cytoplazmou apoptózy někdy imitovat. Ty jsou však pravidelné, uniformní velikosti a s okrouhlým jádrem.
Zvýšený počet apoptóz představuje dominantní znak intestinální reakce štěpu proti hostiteli (GHVD). Apoptózy se nejprve objevují ve výstelce krypt, později i v povrchovém epitelu. U GVHD nižších stupňů jsou často jedinou patologickou změnou. Závažnější GVHD se pak projevuje početnými apoptózami, které splývají až v tzv. apoptotické mikroabscesy definované jako shluk 5 a více apoptotických tělísek. V lamina propria bývá lymfoplazmocytární zánětlivá celulizace variabilní intenzity. Dalším charakteristickým znakem jsou krypty lemované atrofickým epitelem se zvýšenou eosinofilií cytoplazmy (tzv. hypereosinofilní krypty). Postupně dochází až k rozpadu krypt a tvorbě slizničních defektů. V této fázi je okolní lamina propria obvykle prostoupena intenzivním zánětem, často i s příměsí hojnějších neutrofilů (104) (tab. 7). Dalším znakem charakteristickým pro GVHD jsou shluky neuroendokrinních buněk. Ve skutečnosti jde o rezidua zaniklých krypt, jelikož neuroendokrinní buňky jsou oproti enterocytům více rezistentní k imunitní reakci proti hostiteli a často ve sliznici přetrvávají jako jediný přeživší buněčný typ (104). Z lékových poškození stojí na prvním místě MMF kolitida. Oproti intestinální GVHD se MMF kolitida prezentuje intenzivnějším zánětem v lamina propria, často s hojnější příměsí neutrofilů, a častý bývá i nápadný stromální edém a porucha architektoniky sliznice. Jedním z nejčastějších onemocnění, které se na mikroskopické úrovni projevují obrazem apoptotické kolonopatie, je cytomegalovirová (CMV) infekce. Tu většinou doprovází hojnější zánětlivá celulizce ve stromatu. Zánět bývá aktivní, s přítomností početnějších neutrofilů a často i hlubokými slizničními defekty. Vzácné nebývají ani trombózy v cévách sliznice a submukózy. Diagnostické jsou pak virové inkluze, které nacházíme nejčastěji v endoteliích cév, méně pak ve stromálních buňkách. V epitelu jsou CMV inkluze vzácné. Inkluze bývají většinou jaderné, propůjčující buňce notoricky známý vzhled sovích očí. Mohou však být lokalizovány i v cytoplazmě, kde mají častěji morfologii eosinofilních globulí bez periferního projasnění, které vídáme v jádře (obr. 14). Vzhledem k faktu, že CMV infekce často přichází jako superinfekce u imunosuprimovaných pacientů, bývá jeho přítomnost běžná i v terénu apoptotických kolonopatií z jiných příčin (např. pacienti po transplantaci solidních orgánů či hematopoetických kmenových buněk). Nález početnějších apoptóz by tak měl vést k cílenému (obvykle imunohistochemickému) vyloučení CMV u kolitidy jakékoliv morfologie (104). CMV může nasedat i na predisponovaný zánětlivý terén u jinak imunokompetentních pacientů. Typickým příkladem jsou pacienti s IBD. Jelikož apoptózy do mikroskopického obrazu IBD nepatří, měl by jejich nález vždy vést k cílenému vyloučení případné CMV superinfekce. Výjimku tvoří pacienti s IBD s velmi časným nástupem (VEO-IBD), pro které jsou apoptózy naopak běžným nálezem (105). Autoimunitní enteropatie je onemocnění postihující především tenké střevo. V tlustém střevě bývá morfologie zánětu více variabilní, od izolovaného nálezu početnějších apoptóz až po intenzivní aktivní zánět s kryptitidou, kryptovými pseudoabscesy, destrukcí krypt a často i intraepiteliální lymfocytózou (106). Apoptózy můžeme vídat i jako reakci na přípravu střeva před endoskopickým výkonem, zde však bývají izolované, málo početné a omezené jen na povrchový epitel (104). Obrazem apoptotické kolonopatie se mohou projevovat i některé vrozené poruchy imunity, o kterých je pojednáno níže, a také akutní celulární rejekce u pacientů po transplantaci tenkého střeva (107).
Tab. 7. Histopatologický grading akutní intestinální GVHD. 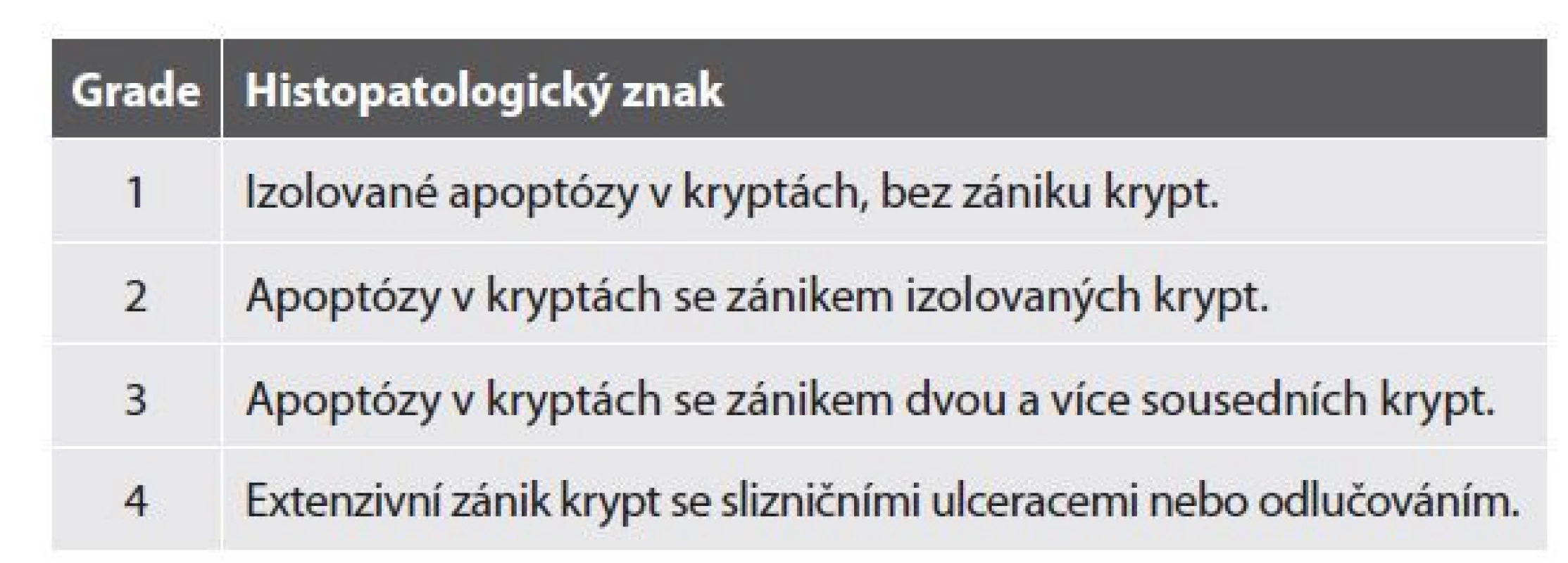
GVHD = reakce štěpu proti hostiteli. Obr. 14. Cytomegalovirová enteritida. A: V lamina propria sliznice tenkého střeva je výrazný edém a disperzní směsná zánětlivá celulizace. Slizniční klky jsou vlivem edému a zánětu snížené a rozšířené. Na více místech jsou pak patrné početné cytomegalovirové inkluze, postihující převážně endotelie slizničních kapilár a méně pak stromální elementy (hematoxylin a eosin; 100x). B: Imunohistochemický průkaz CMV v početných buněčných elementech (100x). 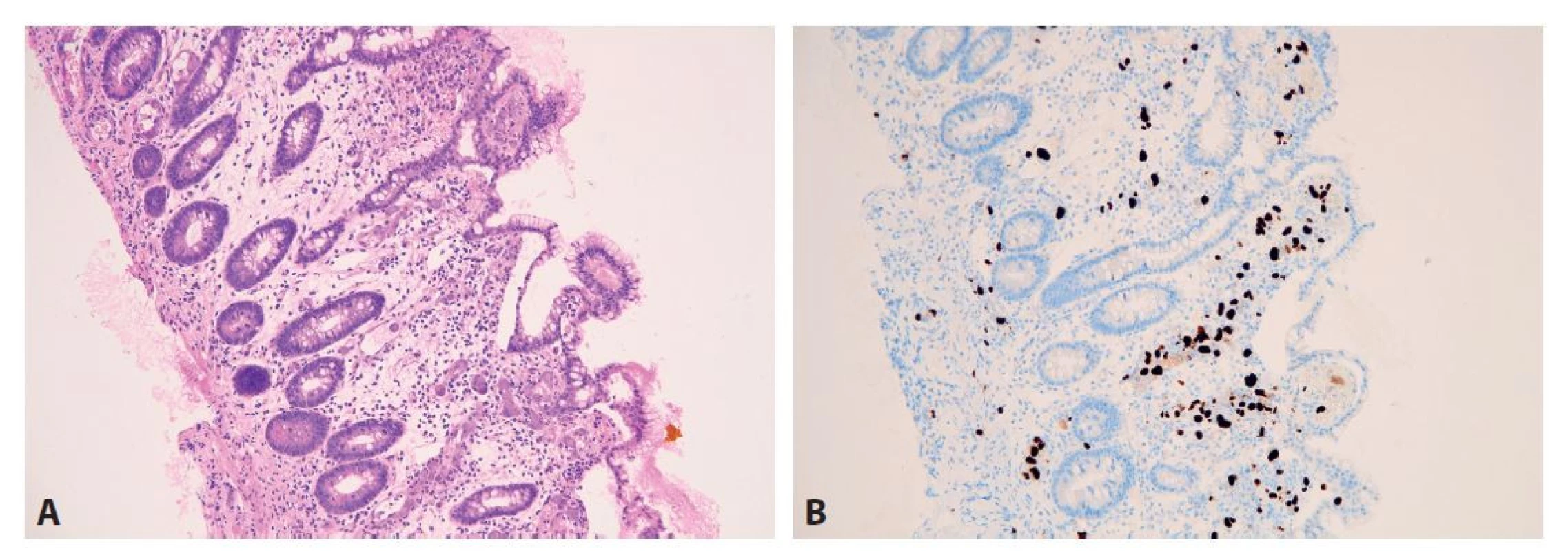
POSTIŽENÍ STŘEVA PŘI VROZENÝCH PORUCHÁCH IMUNITY
Řadu primárních poruch imunity doprovází zánětlivé změny v trávicím traktu, které jsou přímým důsledkem narušené imunitní dráhy a postihnout mohou kteroukoliv část trávicí trubice. Na možnost primárního imunodeficitu by tak mělo být pomýšleno při jakémkoliv nejasném chronickém průjmovitém onemocnění, zejména v dětském věku. Histopatologický nález může být zcela variabilní, pomocnými znaky však bývá řídkost slizničních lymfocytů („prázdná lamina propria“), nápadná lymfonodulární hyperplázie nebo přítomnost granulomů. Pojednat uceleně o všech primárních poruchách imunity a jejich intestinálních manifestacích překračuje hranice tohoto článku, za zmínku však stojí CVID. Jedná se o skupinu onemocnění s variabilní klinickou prezentací, které se mohou manifestovat i v dospělém věku. Histopatologický obraz má tendenci imitovat IBD, zejména Crohnovu chorobu, včetně přítomnosti granulomů. Odlišovacím znakem je hlavně úbytek plazmatických buněk, která je pro CVID charakteristická (z důvodu vrozeného defektu vedoucímu k poruše vyzrávání B lymfocytů). Pro IBD jsou naopak typické hojné plazmatické buňky a bazální plazmocytóza (42).
ZÁVĚR
Sliznice střeva má velmi limitované spektrum morfologických změn, kterými je schopno reagovat na poškození z mnoha různých příčin. Mikroskopie je často nespecifická a vykazuje výrazné přeryvy mezi jednotlivými skupinami. Identifikování správné vyvolávající příčiny nebo přinejmenším vyslovení odpovídající diferenciálně-diagnostické rozvahy závisí na rozpoznání dominantního morfologického vzorce poškození a pečlivé klinicko-patologické korelaci, která je pro následující terapeutický management zásadní.
PROHLÁŠENÍ
Autor práce prohlašuje, že v souvislosti s tématem, vznikem a publikací tohoto článku není ve střetu zájmů a vznik ani publikace článku nebyly podpořeny žádnou farmaceutickou firmou. Toto prohlášení se týká i všech spoluautorů.
Adresa pro korespondenci:
MUDr. Ondřej Fabián, Ph.D.
Pracoviště klinické a transplantační patologie Institut Klinické a Experimentální Medicíny
Vídeňská 1958/9
140 21, Praha 4
e-mail: ondrej.fabian@ikem.cz
Zdroje
1. Feakins RM, British Society of Gastroenterology. Inflammatory bowel disease biopsies: updated British Society of gastroenterology reporting guidelines. J Clin Pathol 2013; 66(12): 1005–1026.
2. Jenkins D, Balsitis M, Gallivan S, et al. Guidelines for the initial biopsy diagnosis of suspected chronic idiopathic inflammatory bowel disease. The British Society of gastroenterology initiative. J Clin Pathol 1997; 50(2): 93–105.
3. Assarzadegan N, Montgomery E, Pezhouh MK. Colitides: diagnostic challenges and a pattern based approach to differential diagnosis. Diagn Histopathol 2017; 23(12): 536-543.
4. Jouret-Mourin A, Faa G, Geboes K. Colitis: A Practical Approach to Colon and Ileum Biopsy Interpretation (2nd ed). Berlin: Springer; 2018.
5. Montgomery E, Voltaggio L. Biopsy Interpretation of the Gastrointestinal Tract Mucosa: Non-Neoplastic (Biopsy Interpretation Series) (2nd ed). Philadelphia, PA: Lippincott Williams & Wilkins; 2011.
6. Pardi DS, Kelly CP. Microscopic colitis. Gastroenterology 2011; 140(4): 1155–1165.
7. Odze RD, Goldblum JR. Odze and Goldblum surgical pathology of the GI tract, liver, biliary tract, and pancreas (3rd ed). Philadelphia, PA: Saunders/Elsevier; 2015.
8. Liacouras CA, Furuta GT, Hirano I, et al. Eosinophilic esophagitis: updated consensus recommendations for children and adults. J Allergy Clin Immunol 2011; 128(1): 3-20.
9. Polydorides AD, Banner BF, Hannaway PJ Yantiss RK. Evaluation of site-specific and seasonal variation in colonic mucosal eosinophils. Hum Pathol 2008; 39(6): 832–836.
10. Pascal RR, Gramlich TL, Parker KM Gansler TS. Geographic variations in eosinophil concentration in normal colonic mucosa. Mod Pathol 1997; 10(4): 363–365.
11. Moore M, Feakins RM, Lauwers GY. Non-neoplastic colorectal disease biopsies: evaluation and differential diagnosis. J Clin Pathol 2020; 73(12): 783-792.
12. Levine DS, Haggitt RC. Normal histology of the colon. Am J Surg Pathol 1989; 13(11): 966 – 984.
13. Leriche M, Devroede G, Sanchez G, Rossano J. Changes in the rectal mucosa induced by hypertonic enemas. Dis Colon Rectum 1978; 21(4): 227-236.
14. Driman DK, Preiksaitis HG. Colorectal inflammation and increased cell proliferation associated with oral sodium phosphate bowel preparation solution. Hum Pathol 1998; 29(9): 972-978.
15. Khor TS, Fujita H, Nagata K, Shimizu M, Lauwers GY. Biopsy interpretation of colonic biopsies when inflammatory bowel disease is excluded. J Gastroenterol 2012; 47(3): 226-248.
16. Greenson JK, Stern RA, Carpenter SL, Barnett JL. The clinical significance of focal active colitis. Hum Pathol 1997; 28(6): 729–733.
17. Shetty S, Anjarwalla SM, Gupta J, Foy CJ, Shaw IS, Valori RM, Shepherd NA. Focal active colitis: a prospective study of clinicopathological correlations in 90 patients. Histopathology 2011; 59(5): 850–856.
18. Marginean EC. The Ever-Changing Landscape of Drug-Induced Injury of the Lower Gastrointestinal Tract. Arch Pathol Lab Med 2016; 140(8): 748-758.
19. Baroudjian B, Lourenco N, Pages C, et al. Anti-PD1-induced collagenous colitis in a melanoma patient. Melanoma Res 2016; 26(3): 308-311.
20. Chen JH, Pezhouh MK, Lauwers GY, Masia R. Histopathologic features of colitis due to immunotherapy with anti-PD-1 antibodies. Am J Surg Pathol 2017; 41(5): 643-654.
21. Villanacci V, Antonelli E, Reboldi G, Salemme M, Casella G, Bassotti G. Endoscopic biopsy samples of naïve “colitides” patients: role of basal plasmacytosis. J Crohns Colitis 2014; 8(11): 1438–1443.
22. Magro F, Langner C, Driessen A, et al. European consensus on the histopathology of inflammatory bowel disease. J Crohns Colitis 2013; 7(10): 827-851.
23. Goldstein NS, Leon-Armin C, Mani A. Crohn’s colitis-like changes in sigmoid diverticulitis specimens is usually an idiosyncratic inflammatory response to the diverticulosis rather than Crohn’s colitis. Am J Surg Pathol 2000; 24(5): 668–675.
24. Geraghty JM, Talbot IC. Diversion colitis: histological features in the colon and rectum after defunctioning colostomy. Gut 1991; 32(9): 1020–1023.
25. Edwards CM, George B, Warren B. Diversion colitis—new light through old windows. Histopathology 1999; 34(1): 1–5.
26. Asplund S, Gramlich T, Fazio V, Petras R. Histologic changes in defunctioned rectums in patients with inflammatory bowel disease: a clinicopathologic study of 82 patients with long-term follow-up. Dis Colon Rectum 2002; 45(9): 1206–1213.
27. Price AB, Davies DR. Pseudomembranous colitis. J Clin Pathol 1977; 30(1): 1–12.
28. Price AB. Histopathology of clostridial gut disease in man. In: Borriello SP, ed. Clostridia in gastrointestinal disease (1st ed). Boca Raton: CRC; 1985.
29. Dignan CR, Greenson JK. Can ischemic colitis be differentiated from C. difficile colitis in biopsy specimens? Am J Surg Pathol 1997; 21(6): 706–710.
30. Farooq PD, Urrunaga NH, Tang DM, von Rosenvinge EC. Pseudomembranous colitis. Dis Mon 2015; 61(5): 181–206.
31. Yamazaki T, Shirai Y, Tada T, Sasaki M, Sakai Y, Hatakeyama K. Ischemic colitis arising in watershed areas of the colonic blood supply: a report of two cases. Surg Today 1997; 27(5): 460-462.
32. Carlson RM, Madoff RD. Is ‘‘ischemic’’ colitis ischemic? Dis Colon Rectum 2011; 54(3): 370 – 373.
33. MacDonald PH. Ischaemic colitis. Best Pract Res Clin Gastroenterol 2002; 16(1): 51–61.
34. Nikolic AL, Keck JO. Ischaemic colitis: uncertainty in diagnosis, pathophysiology and management. ANZ J Surg 2018; 88(4): 278 - 283.
35. Patel S, Voltaggio L. A practical approach to colitis. Diagn Histopathol 2011; 17(9): 376–385.
36. Villanacci V, Casella G, Bassotti G. The spectrum of drug-related colitides: important entities, though frequently overlooked. Dig Liver Dis 2011; 43(7): 523–528.
37. Boutros HH, Pautler S, Chakrabarti S. Cocaine - induced ischemic colitis with small-vessel thrombosis of colon and gallbladder. J Clin Gastroenterol 1997; 24(1): 49-53.
38. Rashid A, Hamilton SR. Necrosis of the gastrointestinal tract in uremic patients as a result of sodium polystyrene sulfonate (Kayexalate) in sorbitol: an underrecognized condition. Am J Surg Pathol 1997; 21(1): 60-69.
39. Byrnes K, Khararjian A, Mannan AASR, Arnold M, Voltaggio L. Young-Onset Ischemic Colitis: A Condition of Elusive Etiology Frequently Associated With Immune Dysregulation. Int J Surg Pathol 2020; 28(4): 361-366.
40. Xia R, Zhang X. Neutropenic enterocolitis: A clinico-pathological review. World J Gastrointest Pathophysiol 2019; 10(3): 36–41.
41. Russo P, Ruchelli ED, Piccoli DA. Pathology of Pediatric Gastrointestinal and Liver Disease (2nd ed). Berlin: Springer; 2014.
42. Leupin N, Curschmann J, Kranzbuhler H, Maurer CA, Laissue JA, Mazzucchelli L. Acute radiation colitis in patients treated with short-term preoperative radiotherapy for rectal cancer. Am J Surg Pathol 2002; 26(4): 498–504.
43. Hasleton PS, Carr N, Schofield PF. Vascular changes in radiation bowel disease. Histopathology 1985; 9(5): 517–534.
44. Martin CJ, Parks TG, Biggart JD. Solitary rectal ulcer syndrome in Northern Ireland. 1971 - 1980. Br J Surg 1981; 68(10): 744–747.
45. Warren BF, Dankwa EK, Davies JD. ’Diamond - shaped’ crypts and mucosal elastin: helpful diagnostic features in biopsies of rectal prolapse. Histopathology 1990; 17(2): 129–134.
46. Saul SH, Sollenberger LC. Solitary rectal ulcer syndrome. Its clinical and pathological underdiagnosis. Am J Surg Pathol 1985; 9(6): 411–421.
47. Rubio CA. A simple method to evaluate the thickness of collagen in collagenous colitis. Scand J Gastroenterol 2000; 35(2): 223–224.
48. Langner C, Aust D, Ensari A, et al. Histology of microscopic colitis-review with a practical approach for pathologists. Histopathology 2015; 66(5): 613–626.
49. Guagnozzi D, Landolfi S, Vicario M. Towards a new paradigm of microscopic colitis: incomplete and variant forms. World J Gastroenterol 2016; 22(38): 8459–8471.
50. Saad E, Shobar R, Mutlu EA. Collagenous colitis development occurs after long standing mucosal healing in IBD with TNF-α inhibitors, and could be due to exaggerated healing response from excess TNF-α inhibition. Med Hypotheses 2019; 123 : 90-94.
51. Geboes K. Lymphocytic, collagenous and other microscopic colitides: pathology and the relationship with idiopathic inflammatory bowel diseases. Gastroenterol Clin Biol 2008; 32(8-9): 689–694.
52. Bjørnbak C, Engel PJH, Nielsen PL Munck LK. Microscopic colitis: clinical findings, topography and persistence of histopathological subgroups. Aliment Pharmacol Ther 2011; 34(10): 1225–1234.
53. Rasmussen J, Engel PJH, Wildt S Fiehn AMK, Munck LK. The temporal evolution of histological abnormalities in microscopic colitis. J Crohns Colitis 2016; 10(3): 262–268.
54. Treanor D, Gibbons D, O’ Donoghue DP, Sheahan K. Pseudomembranes in collagenous colitis. Histopathology 2001; 38 : 83–84.
55. Libbrecht L, Croes R, Ectors N, Staels F, Geboes K. Microscopic colitis with giant cells. Histopathology 2002; 40(4): 335–338.
56. García-González R, Fernández FA, Garijo MF, Val-Bernal JF. Amyloidosis of the rectum mimicking collagenous colitis. Pathol Res Pract 1998; 194(10): 731–735.
57. Lamps LW, Lazenby AJ. Colonic epithelial lymphocytosis and lymphocytic colitis: descriptive histopathology versus distinct clinicopathologic entities. Adv Anat Pathol 2000; 7(4): 210–213.
58. Lazenby AJ, Yardley JH, Giardiello FM, Jessurun J, Bayless TM. Lymphocytic (“microscopic”) colitis: a comparative histopathologic study with particular reference to collagenous colitis. Hum Pathol 1989; 20(1): 18–28.
59. Fiehn A-MK, Engel U, Holck S, Munck LK, Engel PJH. CD3 immunohistochemical staining in diagnosis of lymphocytic colitis. Hum Pathol 2016; 48 : 25–31.
60. Fiehn A-MK, Clausen LN, Engel U, Wildt S, Munck LK, Kristensson M, Engel PJH. Is revision of cutoff values needed when using CD3 immunohistochemical staining in histopathologic diagnosis of lymphocytic colitis? Hum Pathol 2019; 84 : 115–123.
61. Ayata G, Ithamukkala S, Sapp H, et al. Prevalence and significance of inflammatory bowel disease-like morphologic features in collagenous and lymphocytic colitis. Am J Surg Pathol 2002; 26(11): 1414–1423.
62. Rubio CA, Lindholm J. Cryptal lymphocytic coloproctitis: a new phenotype of lymphocytic colitis? J Clin Pathol 2002; 55(2): 138–140.
63. Brown IS, Lambie DLJ. Microscopic colitis with giant cells: a clinico-pathological review of 11 cases and comparison with microscopic colitis without giant cells. Pathology 2008; 40(7): 671–675.
64. Fernández-Bañares F, Salas A, Esteve M. Pitfalls and errors in the diagnosis of collagenous and lymphocytic colitis. J Crohns Colitis 2008; 2(4): 343–347.
65. Green PH, Yang J, Cheng J, Lee AR, Harper JW, Bhagat G. An association between microscopic colitis and celiac disease. Clin Gastroenterol Hepatol 2009; 7(11): 1210–1216.
66. Marteau P, Lavergne-Slove A, Lemann M, et al. Primary ileal villous atrophy is often associated with microscopic colitis. Gut 1997; 41(4): 561–564.
67. Leung ST, Chandan VS, Murray JA, Wu TT. Collagenous gastritis: histopathologic features and association with other gastrointestinal diseases. Am J Surg Pathol 2009; 33(5): 788–798.
68. Jakate S, Demeo M, John R, Tobin M, Keshavarzian A. Mastocytic enterocolitis: increased mucosal mast cells in chronic intractable diarrhea. Arch Pathol Lab Med 2006; 130(3): 362–367.
69. Ramsay DB, Stephen S, Borum M, Voltaggio L, Doman DB. Mast cells in gastrointestinal disease. Gastroenterol Hepatol (NY) 2010; 6(12): 772–777.
70. Raithel M, Winterkamp S, Pacurar A, Ulrich P, Hochberger J, Hahn EG. Release of mast cell tryptase from human colorectal mucosa in inflammatory bowel disease. Scand J Gastroenterol 2001; 36(2): 174–179.
71. Schwab D, Raithel M, Hahn EG. Evidence for mast cell activation in collagenous colitis. Inflamm Res 1998; 47(Suppl 1): S64–65.
72. Blirando K, Milliat F, Martelly I, Sabourin JC, Benderitter M, Francois A. Mast cells are an essential component of human radiation proctitis and contribute to experimental colorectal damage in mice. Am J Pathol 2011; 178(2): 640–651.
73. Griffin PM, Olmstead LC, Petras RE. Escherichia coli O157:H7-associated colitis. A clinical and histological study of 11 cases. Gastroenterology 1990; 99(1): 142–149.
74. Pardanani A. Systemic mastocytosis in adults: 2011 update on diagnosis, risk stratification, and management. Am J Hematol 2011; 86(4): 362–371.
75. Hahn HP, Hornick JL. Immunoreactivity for CD25 in gastrointestinal mucosal mast cells is specific for systemic mastocytosis. Am J Surg Pathol 2007; 31(11): 1669-1676.
76. Doyle LA, Sepehr GJ, Hamilton MJ, Akin C, Castells MC, Hornick JL. A clinicopathologic study of 24 cases of systemic mastocytosis involving the gastrointestinal tract and assessment of mucosal mast cell density in irritable bowel syndrome and asymptomatic patients. Am J Surg Pathol 2014; 38(6): 832-843.
77. Lepidi H, Fenollar F, Gerolami R, et al. Whipple’s Disease: Immunospecific and Quantitative Immunohistochemical Study of Intestinal Biopsy Specimens. Hum Pathol 2003; 34(6): 589-596.
78. Brown I, Kumarasinghe MP. Granulomas in the gastrointestinal tract: deciphering the Pandora’s box. Virchows Arch 2018; 472(1): 3-14.
79. Rotterdam H, Korelitz BI, Sommers SC. Microgranulomas in grossly normal rectal mucosa in Crohn’s disease. Am J Clin Pathol 1977; 67(6): 550–554.
80. Lorenzi L, Bisoffi Z, Bortesi L, Zamboni G, Liut F, Villanacci V. Schaumann bodies in Crohn’s disease: a case report and review of the literature. J Crohn’s Colitis 2012; 6(7): 800 – 803.
81. Ghrenassia E, Mekinian A, Chapelon-Albric C, et al. Digestive-tract sarcoidosis: French nationwide case-control study of 25 cases. Medicine (Baltimore) 2016; 95(29): e4279.
82. Gonzalez RS, Salaria SN, Bohannon CD, Huber AR, Feely MM, Shi C. PD-1 inhibitor gastroenterocolitis: case series and appraisal of ‘immunomodulatory gastroenterocolitis’. Histopathology 2017; 70(4): 558–567.
83. Alimchandani M, Lai JP, Aung PP, et al. Gastrointestinal histopathology in chronic granulomatous disease: a study of 87 patients. Am J Surg Pathol 2013; 37(9): 1365–1372.
84. Hussain N, Quezado M, Huizing M, Geho D, White JG, Gahl W, Mannon P. Intestinal disease in Hermansky-Pudlak syndrome: occurrence of colitis and relation to genotype. Clin Gastroenterol Hepatol 2006; 4(1): 73–80.
85. Daniels JA, Lederman HM, Maitra A, Montgomery EA. Gastrointestinal tract pathology in patients with common variable immunodeficiency (CVID): a clinicopathologic study and review. Am J Surg Pathol 2007; 31(12): 1800–1812.
86. Sood A, Midha V, Singh A. Differential diagnosis of Crohn’s disease versus ileal tuberculosis. Curr Gastroenterol Rep 2014; 16(11): 418.
87. Franco DL, Ruff K, Mertz L, Lam-Himlin DM, Heigh R. Eosinophilic granulomatosis with polyangiitis and diffuse gastrointestinal involvement. Case Rep Gastroenterol 2014; 8(3): 329–336.
88. Haworth SJ, Pusey CD. Severe intestinal involvement in Wegener’s granulomatosis. Gut 1984; 25(11): 1296–1300.
89. Skef W, Hamilton MJ, Arayssi T. Gastrointestinal Behçet’s disease: a review. World J Gastroenterol 2015; 21(13): 3801–3812.
90. Colombat M, Imbert A, Bruneval P, Chatelain D, Gontier MF. Giant cell arteritis localized to the colon associated with Crohn’s disease. Histopathology 2001; 38(1): 21–24.
91. Yan BM, Shaffer EA. Primary eosinophilic disorders of the gastrointestinal tract. Gut 2009; 58(5): 721–732.
92. Rothenberg ME. Eosinophilic gastrointestinal disorders (EGID). J Allergy Clin Immunol 2004; 113(1): 11–28.
93. Machida HM, Catto Smith AG, Gall DG, Trevenen C, Scott RB. Allergic colitis in infancy: clinical and pathologic aspects. J Pediatr Gastroenterol Nutr 1994; 19(1): 22–26.
94. Matsushita T, Maruyama R, Ishikawa N, et al. The number and distribution of eosinophils in the adult human gastrointestinal tract: a study and comparison of racial and environmental factors. Am J Surg Pathol 2015; 39(4): 521-527.
95. Assarzadegan N, Montgomery E, Pezhouh MK. Colitides: diagnostic challenges and a pattern based approach to differential diagnosis. Diagn Histopathol 2017; 23(12): 536 – 543.
96. Hurrell JM, Genta RM, Melton SD. Histopathologic diagnosis of eosinophilic conditions in the gastrointestinal tract. Adv Anat Pathol 2011; 18(5): 335–348.
97. Clouse RE, Alpers DH, Hockenbery DM, DeSchryver-Kecskemeti K. Pericrypt eosinophilic enterocolitis and chronic diarrhea. Gastroenterology 1992; 103(1): 168–176.
98. Huang L, Appleton JA. Eosinophils in helminth infection: Defenders and Dupes. Trends Parasitol 2016; 32(10): 798–807.
99. Anttila VJ, Valtonen M. Carbamazepine-Induced eosinophilic colitis. Epilepsia 1992; 33(1): 119–121.
100. Lange P, Oun H, Fuller S, Turney JH. Eosinophilic colitis due to rifampicin. Lancet 1994; 344(8932): 1296–1297.
101. Roufosse F, Weller PF. Practical approach to the patient with hypereosinophilia. J Allergy Clin Immunol 2010; 126(1): 39-44.
102. Washington K, Jagasia M. Pathology of graft-versus-host disease in the gastrointestinal tract. Hum Pathol 2009; 40(7): 909–917.
103. Shulman HM, Kleiner D, Lee SJ, et al. Histopathologic diagnosis of chronic graft-versus - host disease: National Institutes of Health Consensus Development Project on Criteria for Clinical Trials in Chronic Graft-versus-Host Disease: II. Pathology Working Group Report. Biol Blood Marrow Transplant 2006; 12(1): 31 – 47.
104. Karamchandani DM, Chetty R. Apoptotic colopathy: a pragmatic approach to diagnosis. J Clin Pathol 2018; 71(12): 1033-1040.
105. Masia R, Peyton S, Lauwers GY, Brown I. Gastrointestinal biopsy findings of autoimmune enteropathy: a review of 25 cases. Am J Surg Pathol 2014; 38(10):1319–1329.
106. Conrad MA, Carreon CK, Dawany N, Russo P, Kelsen JR. Distinct Histopathological Features at Diagnosis of Very Early Onset Inflammatory Bowel Disease. J Crohns Colitis 2019; 13(5): 615-625.
107. Lee RG, Nakamura K, Tsamandas AC, et al. Pathology of human intestinal transplantation. Gastroenterology 1996; 110(6): 1820 - 1834.
Štítky
Patológia Súdne lekárstvo Toxikológia Gastroenterológia a hepatológia Neurológia
Článek 'PATOLOGIE GITČlánek 'HEMATOPATOLOGIEČlánek 'NEUROPATOLOGIEČlánek 'GYNEKOPATOLOGIEČlánek 'NEFROPATOLOGIEČlánek 'KARDIOPATOLOGIEČlánek 'HEPATOPATOLOGIEČlánek 'PATOLOGIE ORL OBLASTIČlánek 'PULMOPATOLOGIEČlánek 'UROPATOLOGIEČlánek 'HISTORIE PATOLOGIEČlánek DOPIS REDAKCI
Článok vyšiel v časopiseČesko-slovenská patologie
Najčítanejšie tento týždeň
2022 Číslo 1- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Kombinace metamizol/paracetamol v léčbě pooperační bolesti u zákroků v rámci jednodenní chirurgie
- Neuromultivit v terapii neuropatií, neuritid a neuralgií u dospělých pacientů
- Antidepresivní efekt kombinovaného analgetika tramadolu s paracetamolem
- Parazitičtí červi v terapii Crohnovy choroby a dalších zánětlivých autoimunitních onemocnění
-
Všetky články tohto čísla
- Histopatologická diagnostika nenádorových onemocnění trávicího traktu
- Při volbě patologie nebylo třeba dlouhého váhaní
- 'PATOLOGIE GIT
- 'HEMATOPATOLOGIE
- 'NEUROPATOLOGIE
- 'GYNEKOPATOLOGIE
- 'NEFROPATOLOGIE
- 'KARDIOPATOLOGIE
- 'HEPATOPATOLOGIE
- 'PATOLOGIE ORL OBLASTI
- 'PULMOPATOLOGIE
- 'UROPATOLOGIE
- 'HISTORIE PATOLOGIE
- Histopatologická diagnostika kolitid: diferenciálně-diagnostický přístup a interpretace
- Morfologie zánětlivých střevních onemocnění (IBD)
- Zemřel MUDr. Jiří Kudrmann (24. 10. 1928 – 21. 1. 2022)
- Nekonvenční typy dysplastických změn ve sliznici gastrointestinálního traktu – přehled morfologie jednotlivých podtypů
- Penilní parafinom: kazuistika
- Transplantace dělohy v léčbě ženské neplodnosti z pohledu patologa
- Prof. MUDr. Boris Habanec, DrSc., 90letý.
- Životné jubileum prof. MUDr. Lukáša Planka, CSc.
- DOPIS REDAKCI
- Česko-slovenská patologie
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Morfologie zánětlivých střevních onemocnění (IBD)
- Histopatologická diagnostika kolitid: diferenciálně-diagnostický přístup a interpretace
- Nekonvenční typy dysplastických změn ve sliznici gastrointestinálního traktu – přehled morfologie jednotlivých podtypů
- Penilní parafinom: kazuistika
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



