-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Účinnost a snášenlivost tafluprostu 0,0015% bez konzervačních látek v léčbě glaukomu a oční hypertenze
Efficacy and Tolerability of Preservative-free Tafluprost 0.0015 % in the Treatment of Glaucoma and Ocular Hypertension
Aim:
The aim of the study was to evaluate the efficacy, safety and local tolerability of preservative-free tafluprost 0.0015% (Taflotan®) in patients with glaucoma and ocular hypertension.Materials and methods:
Multicentric, prospective observation study was performed in the Czech Republic from October 2010 to April 2011. A total of 78 centers participated and 754 patients were included. After the doctor’s decision to start the treatment with Taflotan®, the patient’s demographic data, previous treatment, intraocular pressure and the reason for switching the medication were recorded. At the follow-up visit after 6–12 weeks, the intraocular pressure, local tolerability (a 5-level scale), the patient’s and doctor’s satisfaction (a 4-level scale), and the patient’s preference were recorded.Results:
Altogether, data of 496 patients were evaluated. The majority of them were women (64.9 %). The patients’ mean age was 58.5 years. The most common diagnosis was primary open angle glaucoma (79.2 %), followed by ocular hypertension (7.3 %), normal tension glaucoma (4.2 %), and pseudoexfoliation glaucoma (3.6 %). In 140 patients, tafluprost 0.0015% was the first antiglaucomatous medication started, 261 patients switched from another monotherapy, and 95 patients were treated with fixed - or nonfixed combinations before starting tafluprost 0.0015%. The most common reason for switching to Taflotan® was local intolerability to the current antiglaucomatous therapy (most often irritation of the eye and hyperemia). The intraocular pressure decreased significantly from 19.9 ± 4.5 mm Hg to 16.3 ± 3.0 mm Hg (p < 0.001). The subjective tolerability of the antiglaucomatous therapy improved rapidly, with 57.4 % of patients rating the tolerability of Taflotan® as “very good” and 34.5 % as “good”. In addition, 94.4 % of patients and 96.0 % of ophthalmologists were “very satisfied” or “satisfied” with the treatment. At the final visit, 79.8 % of patients preferred Taflotan® to the previous treatment.Conclusion:
Taflotan® significantly decreased the intraocular pressure. It was well tolerated even in patients with previous intolerability to another antiglaucomatous therapy, including prostaglandins. The patients’ and ophthalmologists’ satisfaction with Taflotan® was high.Key words:
tafluprost, intraocular pressure, prostaglandin analogs, local tolerability, hyperemia, preservatives
Autoři: M. Karhanová; P. Mlčák; Z. Fryšák; K. Marešová
Působiště autorů: Oční klinika LF UP a FN, Olomouc, přednosta Doc. MUDr. Jiří Řehák, CSc., FEBO
Vyšlo v časopise: Čes. a slov. Oftal., 68, 2012, No. 4, p. 150-155
Kategorie: Původní práce
Souhrn
Cíl studie:
Zhodnotit účinnost, bezpečnost a lokální snášenlivost tafluprostu 0,0015% bez konzervačních látek (Taflotan®) v léčbě pacientů s glaukomem a oční hypertenzí.Materiál a metoda:
Multicentrická prospektivní observační studie probíhala v České republice od října 2010 do dubna 2011. Celkem se zúčastnilo 78 center, zařazeno bylo 754 pacientů. Po rozhodnutí lékaře o nasazení přípravku Taflotan® byla zaznamenána demografická data pacienta, předchozí terapie, nitrooční tlak a důvod ke změně léčby. Při návštěvě za 6–12 týdnů byl hodnocen nitrooční tlak, lokální snášenlivost (pětistupňové skóre), spokojenost pacienta i lékaře (čtyřstupňové skóre) a preference pacienta.Výsledky:
Do výsledného hodnocení bylo zařazeno 496 pacientů. Většinu tvořily ženy (64,9 %). Průměrný věk pacientů byl 58,5 let. Nejčastější diagnózou byl primární glaukom s otevřeným úhlem (79,2 %), dále nitrooční hypertenze (7,3 %), normotenzní glaukom (4,2 %) a pseudoexfoliační glaukom (3,6 %). U 140 pacientů se jednalo o první nasazenou antiglaukomatózní medikaci, 261 pacientů bylo převedeno z jiné monoterapie a 95 pacientů před nasazením tafuprostu 0,0015% užívalo kombinovanou terapii. Nejčastějším důvodem pro změnu terapie na Taflotan® byla lokální nesnášenlivost stávající antiglaukomatózní terapie (nejčastěji iritace oka a hyperémie). Nitrooční tlak signifikantně poklesl z 19,9 ± 4,5 mmHg na 16,3 ± 3,0 mmHg (p < 0,001). Subjektivní snášenlivost, antiglaukomatózní terapie se výrazně zlepšila, 57,4 % pacientů hodnotilo snášenlivost Taflotanu® jako „velmi dobrou“ a 34,5 % jako „dobrou“. 94,4 % pacientů a 96,0 % lékařů se vyjádřilo jako „velmi spokojen“ či „spokojen“ s léčbou. Při výstupní kontrole 79,8 % pacientů preferovalo Taflotan® před svou původní terapií.Závěr:
Taflotan® vedl k signifikantnímu snížení nitroočního tlaku. Byl dobře snášen, a to i u pacientů s předchozí nesnášenlivostí jiné antiglaukomatózní terapie – včetně prostaglandinů. Spokojenost pacientů i lékařů s Taflotanem® byla vysoká.Klíčová slova:
tafluprost, nitrooční tlak, analoga prostaglandinů, lokální snášenlivost, hyperémie, konzervační látkyÚVOD
Glaukom je celosvětově druhou nejčastější příčinou slepoty. Dle odhadů by měl počet lidí postižených glaukomem do roku 2020 dosáhnout až 79,6 milionů (18). Jde o onemocnění multifaktoriální, které je definováno progresivní ztrátou retinálních gangliových buněk vedoucí k atrofii zrakového nervu a defektům v zorném poli. Za hlavní rizikový faktor vzniku a progrese onemocnění je v současné době považován zvýšený nitrooční tlak (NOT). Jde také o jediný faktor, který jsme schopni jednoznačně léčebně ovlivnit (14). V léčbě glaukomu se uplatňují jak postupy konzervativní, tak chirurgické. V každém případě jde o léčbu dlouhodobou, která vyžaduje dobrou spolupráci pacienta. Celosvětově získávají vedoucí postavení v konzervativní léčbě glaukomu analoga prostaglandinů (PGA) – pro jejich výborný účinek na snížení nitroočního tlaku, aplikaci 1x denně, nízký výskyt nežádoucích účinků a minimální systémová rizika (3). Donedávna byly k dispozici čtyři prostaglandinové deriváty – (unoproston, latanoprost, travoprost, bimatoprost). Jako zatím poslední byl uveden na trh tafluprost 0,0015%. Na konci července 2009 byl schválen již v 21 zemích Evropy (17), v České republice je k dispozici od dubna 2010. V únoru 2012 prošel úspěšně schvalovacím procesem FDA (Food and Drug Administration) jako první prostaglandin bez konzervačních látek k léčbě glaukomu a oční hypertenze.
Cílem práce bylo zhodnotit účinnost, bezpečnost a lokální snášenlivost tafluprostu 0,0015% (Taflotan®) bez konzervačních látek v léčbě pacientů s glaukomem a oční hypertenzí v podmínkách běžné klinické praxe.
METODIKA
Design studie
Jednalo se o multicentrickou prospektivní observační studii, která probíhala v České republice od října 2010 do dubna 2011. Celkem se zúčastnilo 78 center. Počet zařazených pacientů v jednotlivých centrech se pohyboval od 2 do 25. Jednalo se o pacienty s glaukomem či oční hypertenzí, kteří dle rozhodnutí lékaře vyžadovali změnu lokální antiglaukomatózní medikace, popřípadě nebyli ještě léčeni vůbec. Po rozhodnutí lékaře o nasazení tafluprostu 0,0015% bez konzervačních látek a zařazení pacienta do studie byla zaznamenána demografická data pacienta, hodnota nitroočního tlaku, předchozí terapie a důvod ke změně léčby. Při výstupní návštěvě za 6–12 týdnů byly hodnoceny následující parametry: hodnota nitroočního tlaku, lokální snášenlivost pomocí pětistupňové škály (velmi dobrá, dobrá, uspokojivá, méně uspokojivá, neakceptovatelná), spokojenost pacienta i lékaře pomocí čtyřstupňové škály (velmi spokojen, spokojen, méně spokojen, nespokojen) a preference pacienta. Byly zaznamenány všechny vedlejší nežádoucí účinky. Pacienti byli podrobně dotázáni, zda došlo k nějakým neočekávaným událostem po změně léčby. Všechny vedlejší nežádoucí účinky byly evidovány.
Analýza dat a statistické hodnocení
Údaje každého zařazeného pacienta byly zaznamenány do předem připravených formulářů, které obdrželo každé centrum před začátkem studie. Pro výsledné hodnocení byl každému pacientovi přidělen šestimístný kód pro jeho identifikaci. Data byla převedena do elektronické podoby a podrobena detailní deskriptivní analýze (přehled dat, tabulky rozdělení četnosti, statistické výsledky – průměr, směrodatná odchylka, medián, kvartily, zaznamenané extrémní hodnoty). Kvalita dat pacientů, kteří byli zařazeni do výsledného zpracování, byla hodnocena jako vysoká.
VÝSLEDKY
Demografická data a charakteristika souboru
Vstupně bylo do studie zařazeno a k výslednému hodnocení odesláno 754 vyplněných formulářů. Z výsledné analýzy bylo vyloučeno 258 pacientů. Důvodem vyloučení bylo nejčastěji nedodržení časového intervalu mezi vstupní a výstupní kontrolou (n = 224), rozdílná léčba pravého a levého oka (n = 18), chybějící data vstupní či výstupní kontroly (n = 2), nevěrohodná data (n = 13) a léčba tafluprostem 0,0015% již před zařazením do studie (n = 1). Do výsledného hodnocení bylo tedy zařazeno 496 pacientů. Většinu tvořily ženy (64,9 %). Průměrný věk pacientů byl 58,5 let. Nejčastější diagnózou byl glaukom s otevřeným úhlem (79,2 %), dále nitrooční hypertenze (7,3 %), normotenzní glaukom (4,2 %) a pseudoexfoliační glaukom (3,6 %). Demografická data pacientů jsou shrnuta v tabulce 1.
Tab. 1. Demografická data pacientů (n = 496) zařazených do výsledného hodnocení 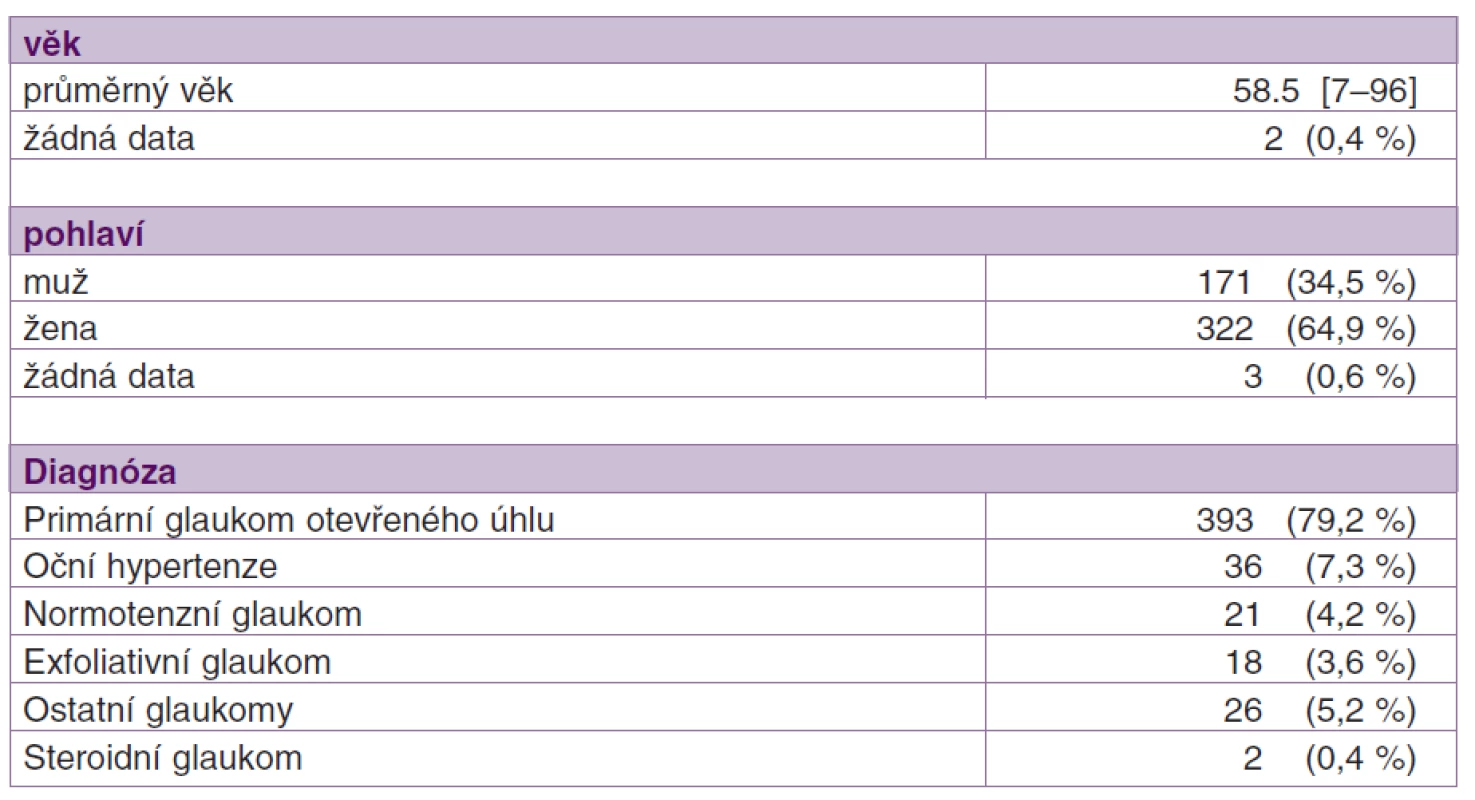
Předchozí antiglaukomatózní léčba a důvody pro změnu terapie
U 140 pacientů se jednalo o první nasazenou antiglaukomatózní medikaci. Jinou monoterapii užívalo 261 pacientů, nejčastěji PGA (n = 146) či betablokátory (n = 92). Kombinovanou antiglaukomatózní terapii užívalo 95 pacientů. Detaily jsou uvedeny v tabulce 2.
Tab. 2. Antiglaukomatózní terapie před nasazením tafluprostu 0,0015% bez konzervačních látek 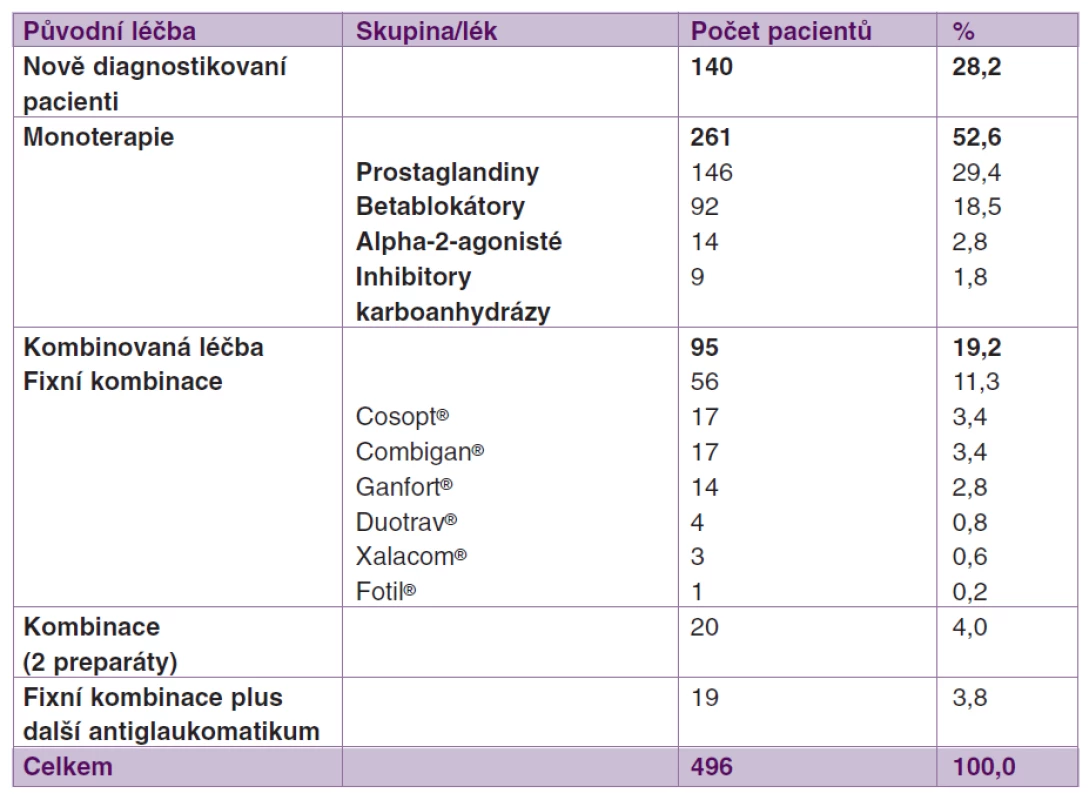
Nejčastějším důvodem pro změnu terapie na tafluprost 0,0015% bez konzervačních látek byla lokální nesnášenlivost stávající antiglaukomatózní terapie (n = 241; 67,7 %), nejčastěji iritace oka a hyperémie. Dalším důvodem byla nedostatečná účinnost předchozí léčby (n = 123; 34,6 %). Přehled všech důvodů pro změnu terapie na tafluprost 0,0015% bez konzervačních látek, či pro jeho přidání ke stávající terapii je uveden v grafu 1.
Graf 1. Důvody pro změnu medikace na tafluprost 0,0015% bez konzervačních látek. 
Změny nitroočního tlaku (NOT)
Vstupní průměrný NOT (± SD) u všech pacientů zařazených do studie byl 19,9 ± 4,5 mmHg. Při výstupní kontrole za 6–12 týdnů po změně medikace NOT signifikantně poklesl na 16,3 ± 3,0 mmHg (p < 0,001, graf 2). Výstupní hodnoty NOT byly ve srovnání se vstupními nižší u 796 očí (80,2 %), stejné u 89 očí (9,0 %) a vyšší u 107 očí (10,8 %). U 76,3 % očí bylo dosaženo hodnoty NOT ≤ 18 mmHg, u 50,8 % očí ≤ 16 mmHg, u 25,1 % očí ≤ 14 mmHg a u 12,1 % očí ≤ 12 mmHg.
Graf 2. V celém souboru došlo ke snížení průměrné hodnoty NOT (± SD) z 19,9 + 4,5 mmHg na 16,3 + 3,0 mmHg. 
U 139 pacientů byl tafluprost 0,0015% první nasazenou antiglaukomatózní medikací. V této podskupině se NOT snížil (± SD) z 22,6 ± 4,2 mmHg na 16,5 ± 2,9 mmHg (graf 3). Výstupní hodnoty NOT byly ve srovnání se vstupními nižší u 271 očí (97,5 %), stejné u 5 očí (1,8 %) a vyšší u 2 očí (0,7 %).
Graf 3. U pacientů nově léčených tafluprostem 0,0015% jako první antiglaukomatózní terapií došlo ke snížení NOT (± SD) z 22,6 ± 4,2 mmHg na 16,5 ± 2,9 mmHg. 
V podskupině pacientů převedených na tafluprost 0,0015% bez konzervačních látek z jiné monoterapie (n = 256) se NOT snížil ze vstupní průměrné hodnoty (± SD) 18,6 ± 4,1 mmHg na 16,1 ± 3,0 mmHg (graf 4). Po převedení z původní léčby alfa-2-agonisty (n = 14) došlo k poklesu NOT z 19,5 ± 5,8 mmHg na 15,4 ± 2,8 mmHg, z betablokátorů (n = 90) z 20,2 ± 3,6 mmHg na 16,4 ±2,7 mmHg, z inhibitorů karboanhydrázy (n = 7) z 20,4 ± 5,0 mmHg na 16,1 ± 3,3 mmHg, z analog prostaglandinů (n = 145) z 17,4 ± 3,7 na 15,9 ± 3,2 mmHg.
Graf 4. Hodnoty NOT (± SD) u pacientů převedených z monoterapie na tafluprost 0,0015% bez konzervačních látek – dle jednotlivých podskupin 
Tafluprost 0,0015% bez konzervačních látek byl použit také jako aditivní terapie k již stávající antiglaukomatózní léčbě. U 4 pacientů byl přidán ke stávající monoterapii (2x betablokátor, 2x ICA). Vstupně byla průměrná hodnota NOT v této podskupině pacientů 22,8 ± 4,2 mmHg, při výstupní kontrole došlo ke snížení NOT na 17,1 ± 2,6 mmHg. Aditivní efekt tafluprostu 0,0015% na snížení NOT byl prokázán i po jeho přidání ke stávající fixní kombinaci u 9 pacientů (4x Cosopt, 4x Combigan, 1x Fotil). V této podkupině se NOT snížil ze vstupních hodnot 24,1 ± 3,0 mmHg na 18,0 ± 2,2 mm Hg.
Snášenlivost léčby a spokojenost pacientů
Subjektivní lokální snášenlivost byla hodnocena pacientem pomocí pětistupňové škály: „velmi dobrá” (1), „dobrá” (2), „uspokojivá” (3), „méně uspokojivá” (4), „neakceptovatelná” (5). Hodnocení bylo provedeno vstupně před změnou terapie a při výstupní kontrole. Kompletní data stran subjektivního hodnocení snášenlivosti byla k dispozici u 357 pacientů. Při vstupním vyšetření byla průměrná hodnota lokální snášenlivosti 3,0 (± 1,2), což odpovídá hodnocení „uspokojivá”. Při výstupní kontrole za 6–12 týdnů po nasazení tafluprostu 0,0015% bez konzervačních látek se zlepšila lokální snášenlivost v průměru na hodnotu 1,5 (± 1,7), což odpovídá hodnocení v rozmezí „velmi dobrá” a „dobrá”. Subjektivní snášenlivost antiglaukomatózní terapie v celém souboru pacientů se výrazně zlepšila, 57,4 % pacientů hodnotilo snášenlivost Taflotanu® jako „velmi dobrou” a 34,5 % jako „dobrou” (graf 5).
Graf 5. Subjektivní snášenlivost antiglaukomatózní terapie na začátku studie a při výstupní kontrole (po nasazení tafluprostu 0,0015% bez konzervačních látek) 
V podskupině pacientů, kde byl tafluprost 0,0015% první nasazenou antiglaukomatózní medikací, hodnotilo 90 % pacientů snášenlivost jako „velmi dobrou“ či „dobrou“. Zlepšení snášenlivosti léčby bylo patrno zejména v podskupině pacientů původně léčených jinými analogy prostaglandinů (graf 6). Při vstupní kontrole udávalo „velmi dobrou“ snášenlivost jen 3,4 % pacientů, při výstupní kontrole 53,1 %.
Graf 6. Hodnocení snášenlivosti po změně medikace z původní monoterapie analogy prostaglandinů na tafluprost 0,0015% bez konzervačních látek 
Při výstupní kontrole se většina pacientů (94,4 %) i lékařů (96,0 %) vyjádřila jako „velmi spokojen” či „spokojen” s léčbou tafluprostem 0,0015% bez konzervačních látek, 79,8 % pacientů by ho preferovalo před svou původní terapií.
Nežádoucí účinky a důvody přerušení léčby
Léčba tafluprostem 0,0015% bez konzervačních látek byla velmi dobře tolerována. Nežádoucí účinky byly zaznamenány pouze u 15 pacientů (3 %). Jednalo se převážně o lokální nežádoucí účinky (tab. 3). Léčbu tafluprostem 0,0015% bez konzervačních látek během sledovaného období přerušilo jen 16 pacientů. Nejčastějším důvodem byla účinnost (n = 5), lokální nesnášenlivost (n = 4) a potíže s aplikací z jednorázové pipety (n = 3). V léčbě pokračovalo celkem 96,8 % pacientů (tab. 4).
Tab. 3. Nežádoucí účinky zaznamenané během léčby tafluprostem 0,0015% bez konzervačních látek 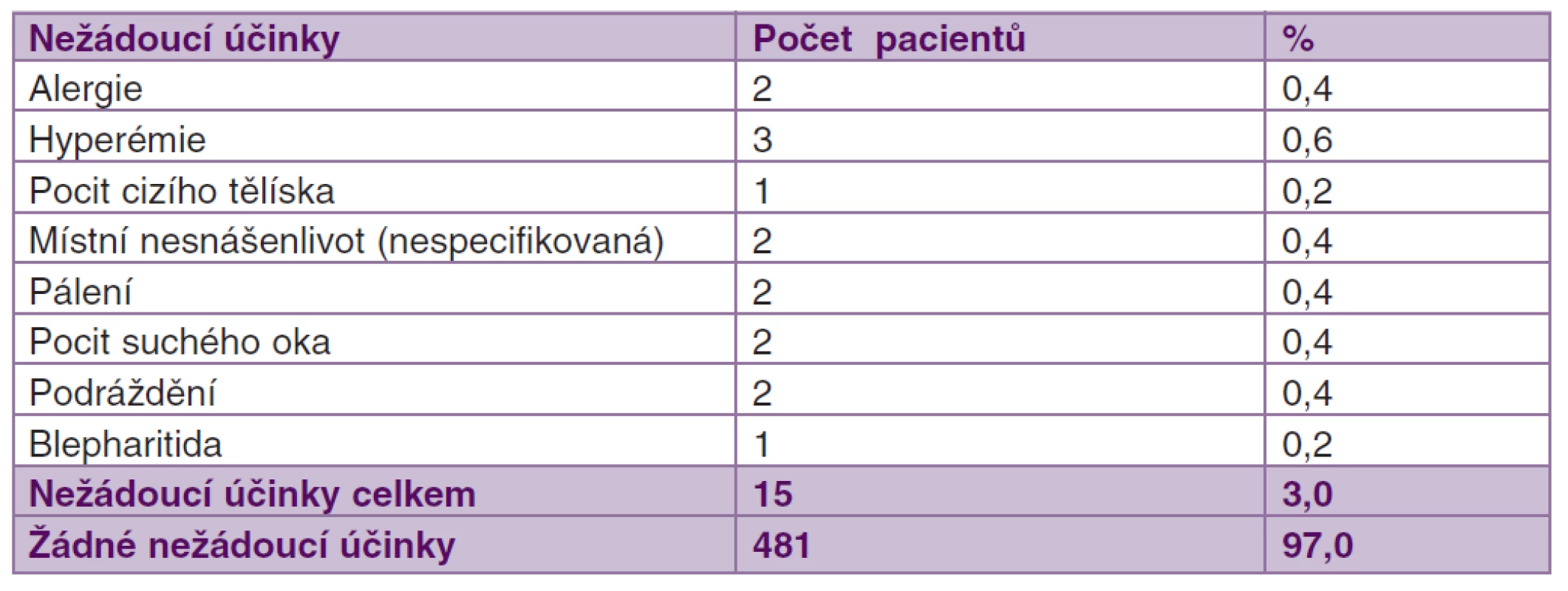
Tab. 4. Důvody předčasného ukončení terapie tafluprostem 0,0015% bez konzervačních látek 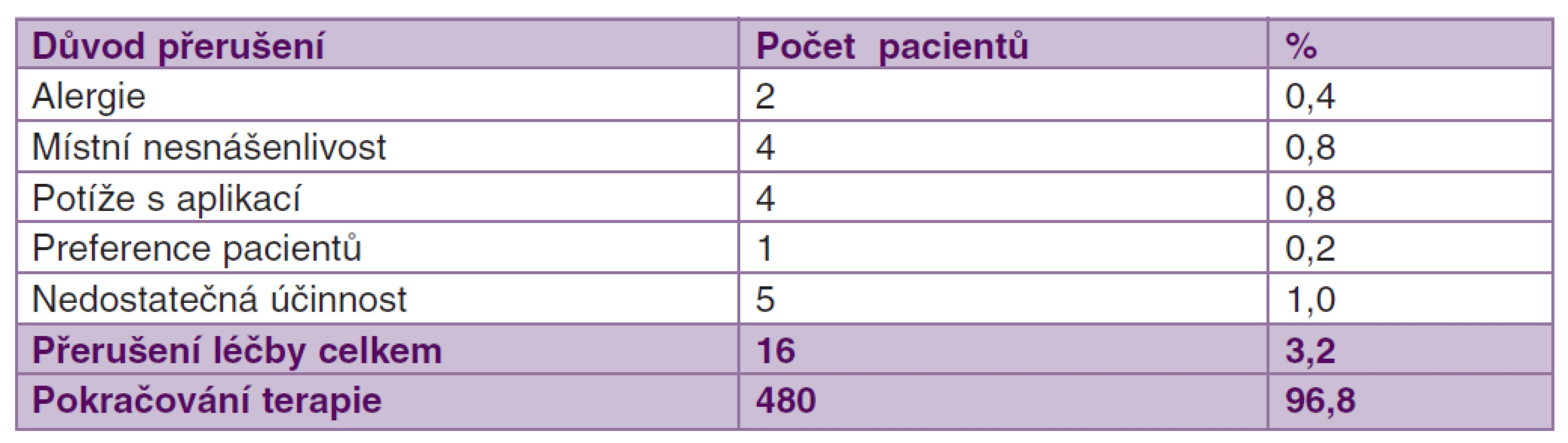
DISKUSE
Prostaglandiny snižují NOT zvýšením odtoku komorové tekutiny uveosklerální cestou. Lokální aplikace prostaglandinových analogů (PGA) způsobí rozšíření prostor mezi svazky ciliárního svalu a vede i k remodelaci extracelulární matrix (24). Prostaglandinový receptor s nejvyšší afinitou k PGA je FP receptor. PGA včetně tafluprostu vedou k efektivnímu a stabilnímu snížení NOT s minimálními vedlejšími systémovými účinky. Lokální nežádoucí účinky PGA jsou spíše kosmetického rázu – překrvení spojivky, zvýšená pigmentace duhovky a kůže kolem očí, zvýšený růst řas.
Velká pozornost je v oftalmologii věnována problematice konzervačních látek v očních kapkách. V mnohých studiích je poukázáno na to, že dlouhodobá lokální aplikace antiglaukomatik s konzervačními látkami může vést ke změnám na spojivce a k poruše slzného filmu (5, 8, 13). Nejčastější konzervační látkou užívanou v očních kapkách je benzalkonium chlorid (BAK) (23). BAK působí proapoptoticky, prozánětlivě, způsobuje poškození slzného filmu emulzifikací lipidové vrstvy a ztrátu pohárkových buněk (1, 4, 12, 16). Vážnějším důsledkem dlouhodobé aplikace BAK může být zvýšená tendence k fibrotizaci v důsledku chronické zánětlivé reakce. Toto je spojeno zejména s větším rizikem možného selhání antiglaukomových operací (2). Dalším důležitým aspektem, ke kterému bychom měli přihlédnout při nasazování antiglaukomatózní terapie, je fakt, že u pacientů s glaukomem byla prokázána vysoká prevalence syndromu suchého oka (OSD – ocular surface disease). Dle studie Leunga (15) mělo projevy OSD až 59 % pacientů s glaukomem minimálně v jednom oku. Ve studii Erba (6) byl syndrom suchého oka diagnostikován u 52,6 % pacientů s glaukomem. V obou studiích se zvyšoval výskyt OSD s množstvím lokálně aplikovaných kapek s konzervačními látkami.
Tafluprost 0,0015% je první a v současné době jediný analog prostaglandinů bez konzervačních látek, který je k dispozici k léčbě pacientů s glaukomem a oční hypertenzí. Jde o prostaglandinový F2-alfa analog. Jeho vazebná afinita k FP receptoru je 12x vyšší než u latanoprostu a nemá potenciál k vazbě na jiné receptory (20). Pro srovnání, afinita travoprostu k FP receptoru je udávána 2,8x vyšší než latanoprostu (19).
Hamacher (9) prokázal, že nepřítomnost benzalkonium chloridu nemá vliv na účinnost tafluprostu 0,0015%. Ve skupině pacientů léčených tafluprostem 0,0015% bez BAK došlo k ekvivalentnímu snížení NOT jako ve skupině léčených tafluprostem 0,0015% s BAK.
Účinnost i dobrá snášenlivost tafluprostu 0,0015% byla prokázána v několika rozsáhlých zahraničních studiích (7, 9, 10, 21, 22). Naše studie měla obdobný design jako studie německých autorů (7), kteří hodnotili efekt a snášenlivost tafluprostu 0,0015% bez konzervačních látek celkem u 2123 pacientů. Také v jejich souboru byla nejčastějším důvodem pro změnu terapie na tafluprost 0,0015% bez konzervačních látek lokální nesnášenlivost antiglaukomatózní terapie (41,1 %). Na konci studie zaznamenali autoři výrazné zlepšení lokální snášenlivosti (původně bylo s medikací „spokojeno“ a „velmi spokojeno“ 28,3 %, na konci studie 85,7 % pacientů).
Hommer (11) porovnával změnu NOT, subjektivních symptomů i objektivního nálezu na předním segmentu oka a snášenlivost léčby celkem u 118 pacientů po změně léčby z prostaglandinů s konzervačními látkami na tafluprost 0,0015% bez konzervačních látek. Došlo k výraznému snížení střední a těžké hyperémie z původních 43,2 % na 1,9 %.
V naší studii jsme potvrdili výsledky zahraničních autorů. Zvýšila se snášenlivost lokální antiglaukomové terapie i subjektivní spokojenost pacientů. Zlepšení lokální snášenlivosti a tím pádem i zlepšení compliance pacienta se mohlo podílet i na pozorované redukci NOT po změně terapie.
Naše studie nebyla zaslepená. Její observační design dobře reflektuje poměry v běžné klinické praxi. Na druhé straně nedovoluje zaznamenat všechny proměnné. V naší studii jsme nevyžadovali žádnou vymývací fázi. Vyplývá to z faktu, že vymývací fáze jednotlivých antiglaukomatik se liší, nejdelší je udávaná u PGA (4 týdny). V naší studii jsme hodnotili změnu NOT za 6–12 týdnů.
Na základě výsledků zahraničních studií a naší studie lze shrnout, že tafluprost 0,0015% bez konzervačních látek se zdá být dobrou volbou pro všechny pacienty, kteří mají problémy se snášenlivostí lokální antiglaukomatózní medikace, včetně prostaglandinů s konzervačními látkami. Profit z léčby tímto preparátem by mohli mít také všichni pacienti se subjektivními či objektivními známkami suchého oka.
ZÁVĚR
Léčba tafluprostem 0,0015% bez konzervačních látek (Taflotan®) se v naší observační studii ukázala jako účinná, bezpečná a velmi dobře snášená. Došlo ke snížení průměrného NOT jak ve skupině pacientů nově léčených pro glaukom, tak ve skupině pacientů převedených z jiné terapie. Za velký přínos považujeme prokázané zlepšení snášenlivosti lokální terapie. To bylo prokázáno i u pacientů na předchozí terapii analogy prostaglandinů s konzervačními látkami. Změna lokální antiglaukomatózní léčby na tafluprost 0,0015% bez konzervačních látek může být velkým přínosem zejména pro pacienty se subjektivními očními symptomy. Tato změna může vést i ke zlepšení adherence pacienta k léčbě.
Do redakce doručeno dne: 31. 5. 2012
Do tisku přijato dne: 30. 8. 2012
MUDr. Marta Karhanová, FEBO
Oční klinika LF UP a FN Olomouc
I.P. Pavlova 6
77520 Olomouc
e-mail: marta.karhanova@fnol.cz
Zdroje
1. Baudouin, C.: Side effects of antiglaucomatous drugs on the ocular surface. Curr Opin Ophthalmol, 1996; 7 : 80–86.
2. Baudouin, C., Labbé, A., Liang, H. et al.: Preservatives in eyedrops: the good, the bad and the ugly. Prog Retin Eye Res, 2010; 29 : 312–334.
3. Bean, G.W., Camras, C.B.: Commercially available prostaglandin analogs for the reduction of intraocular pressure: similarities and differences. Surv Ophthalmol, 2008; 53(1): 69–84.
4. Brasnu, E., Brignole-Baudouin, F., Riancho, L. et al.: In vitro effects of preservative-free tafluprost and preserved latanoprost, travoprost, and bimatoprost in a conjunctival epithelial cell line. Curr Eye Res, 2008; 33 : 303–312.
5. Detry, Morel, M.: Side effects of glaucoma medications. Bull Soc Belge Ophthalmol, 2006; 299 : 27–40.
6. Erb, C., Gast, U., Schremmer, D.: German register for glaucoma patients with dry eye. Basic outcome with respect to dry eye. Graefes Arch Clin Exp Ophthalmol, 2008; 246 : 1593–601.
7. Erb, C., Lanzl, I., Seidova, S.F. et al.: Preservatives-free tafluprost 0,0015% in the treatement of patiens with glaucoma and ocular hypertension. Adv Ther, 2011; 28(7): 575–585.
8. Fechtner, R.D., Godfrey, D.G., Budenz, D. et al.: Prevalence of ocular surface complaints in patients with glaucoma using topical intraocular pressure-lowering medications. Cornea, 2010; 29 : 618–621.
9. Hamacher, T., Airaksinen, J., Saarela, V. et al.: Efficacy and safety levels of preserved and preservative-free tafluprost are equivalent in patients with glaucoma or ocular hypertension: results from a pharmacodynamics analysis. Acta Ophthalmol Suppl (Oxf), 2008; 242 : 14–19.
10. Hommer, A., Mohammed Ramez, O., Burchert, M. at al.: IOP-lowering efficacy and tolerability of preservative-free tafluprost 0.0015% among patients with ocular hypertension or glaucoma. Curr Med Res Opin, 2010; 26 : 1905–1913.
11. Hommer, A., Kimmich, F.: Switching patiens from preserved prostaglandin-analog monoterapy to preservative-free tafluprost. Clin Ophthal, 2011; 5 : 623–631.
12. Kahook, M.Y., Noecker, R.: Quantitative analysis of conjunctival goblet cells after chronic application of topical drugs. Adv Ther, 2008; 25 : 743–751.
13. Kuppens, E.V., van Best, J.A., Sterk, C.C. et al.: Decreased basal tear turnover in patiens with untreated primary open-angle aglaucoma. Am J Ophthalmol, 1995; 120 : 41–46.
14. Leske, M.C., Heijl, A., Hussein, M. et al.: Factors for glaucoma progression and the effect of treatment: the Early Manifest Glaucoma Treatment Trial. Arch Ophthalmol, 2003; 121 : 48–56.
15. Leung, E.W., Kedeiros, F.A., Weinreb, R.N.: Prevalence of ocular surface disease in glaucoma patients. J Glaucoma, 2008; 17 : 350–355.
16. Martone, G., Frezzotti, P., Tosi, G.M. et al.: An in vivo confocal microscopy analysis of effects of topical antiglaucoma therapy with preservative on corneal innervation and morphology. Am J Ophthalmol, 2009; 147 : 725–735.
17. Pantcheva, M.B., Seibold, K.S., Awadallah, N.S. et al.: Tafluprost: a novel prostaglandin analog for treatment of glaucoma. Adv Ther, 2011; 28(9): 707–715.
18. Quigley, H.A., Broman, A.T.: The number of people with glaucoma worldwide in 2010 and 2020. Br J Ophthalmol, 2006; 90 : 262–267.
19. Sharif, N.A., Kelly, C.R., Crider, J.Y. et al.: Ocular hypotensive FP prostaglandin (PG) analogs, PG receptor, subtype binding affinities and selectivities, and agonist potencies at FP and other PG receptors in cultured cells. J Ocul Pharmacol Ther, 2003; 19, 501–515.
20. Takagi, Y., Nakajima, T., Shimazaki, A. et al.: Pharmacological characteristics of AFP-168 (tafluprost), a new prostanoid FP receptor agonist, as an ocular hypotensive drug. Exp. Eye Res, 2004; 78 : 767–776.
21. Traverso, C.E., Ropo, A., Papadia, M. et al.: A phase II study on the duration and stability of the intraocular pressure-lowering effect and tolerability of tafluprost compared with latanoprost. J Ocul Pharmacol Ther, 2010; 26 : 97–104.
22. Uusitalo, H., Pillunat, L.E., Ropo, A. et al.: Efficacy and safety of tafluprost 0.0015% versus latanoprost 0.005% eye drops in open-angle glaucoma and ocular hypertension: 24-month results of a randomized, double-masked phase III study. Acta Ophthalmol, 2010; 88 : 12–19.
23. Výborný, P., Sičáková, S.: Denní dávka benzalkonium chloridu – významné kritérium v léčbě glaukomu. Čes a Slov Oftal, 2011; 67(2): 63–66.
24. Weinreb, R.N., Toris, C.B., Gabelt, A.T. et al.: Effects of prostaglandins on the aqueous humor outflow pathways. Surv Ophthalmol, 2002; 47(1): 53–64.
Štítky
Oftalmológia
Článok vyšiel v časopiseČeská a slovenská oftalmologie
Najčítanejšie tento týždeň
2012 Číslo 4- Cyklosporin A v léčbě suchého oka − systematický přehled a metaanalýza
- Pomocné látky v roztoku latanoprostu bez konzervačních látek vyvolávají zánětlivou odpověď a cytotoxicitu u imortalizovaných lidských HCE-2 epitelových buněk rohovky
- Konzervační látka polyquaternium-1 zvyšuje cytotoxicitu a zánět spojený s NF-kappaB u epitelových buněk lidské rohovky
- Dlouhodobé výsledky lokální léčby cyklosporinem A u těžkého syndromu suchého oka s 10letou dobou sledování
- Syndrom suchého oka
-
Všetky články tohto čísla
- Využití fotodynamické terapie v léčbě myopických neovaskulárních membrán
- Krvácania pod vnútornú hraničnú membránu sietnice liečené pars plana vitrektómiou
- Rohovková cizí tělíska u dětí
- Perforované zátky v liečbe stenózy slzných bodov
- Účinnost a snášenlivost tafluprostu 0,0015% bez konzervačních látek v léčbě glaukomu a oční hypertenze
- Choroidálny melanóm v štádiu T1 – porovnanie plánu ožiarenia pri stereotaktickej rádiochirurgii a pri protónovej terapii
- Extrasklerálne prerastanie malígneho melanómu choroidey po endoresekcii
- Česká a slovenská oftalmologie
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Krvácania pod vnútornú hraničnú membránu sietnice liečené pars plana vitrektómiou
- Perforované zátky v liečbe stenózy slzných bodov
- Účinnost a snášenlivost tafluprostu 0,0015% bez konzervačních látek v léčbě glaukomu a oční hypertenze
- Extrasklerálne prerastanie malígneho melanómu choroidey po endoresekcii
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



