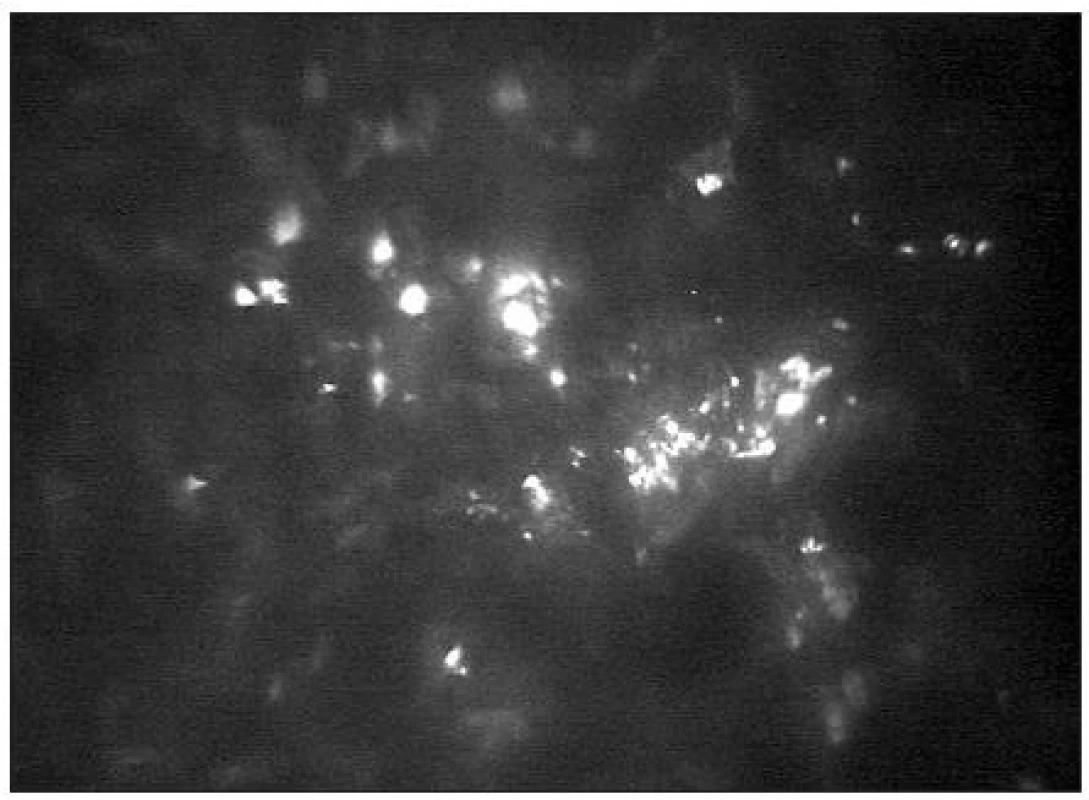
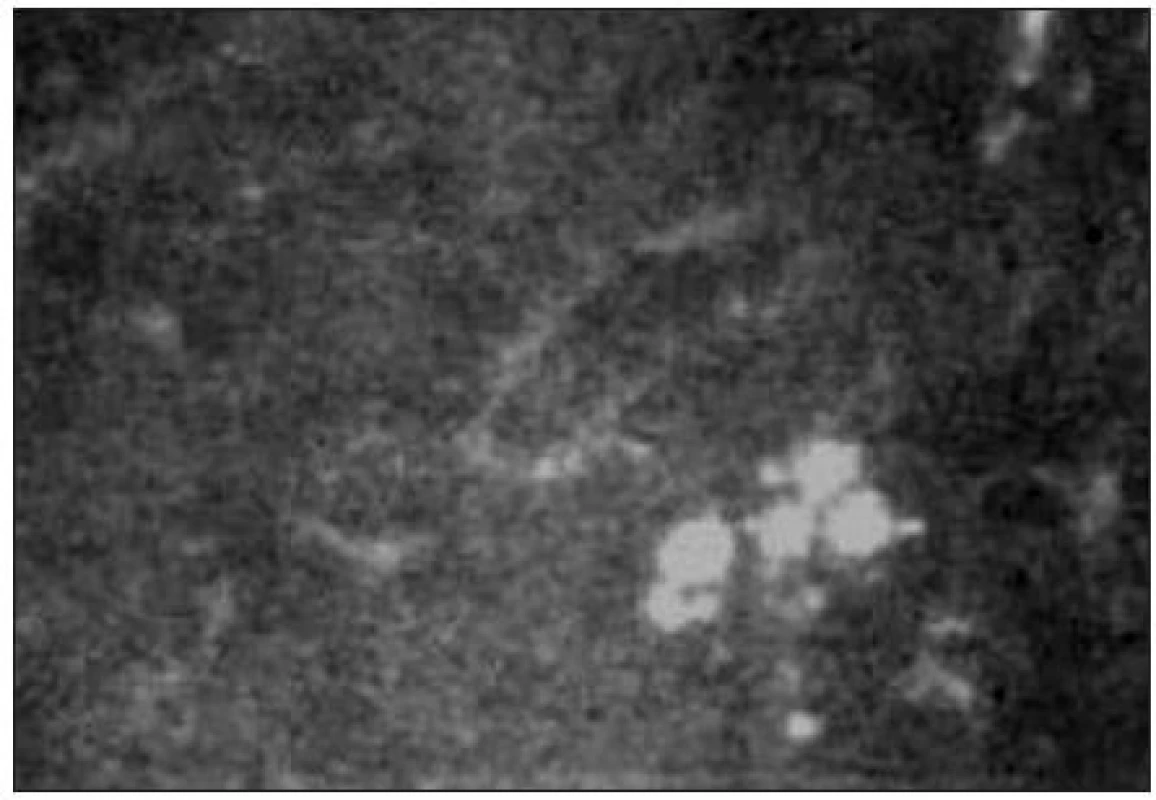
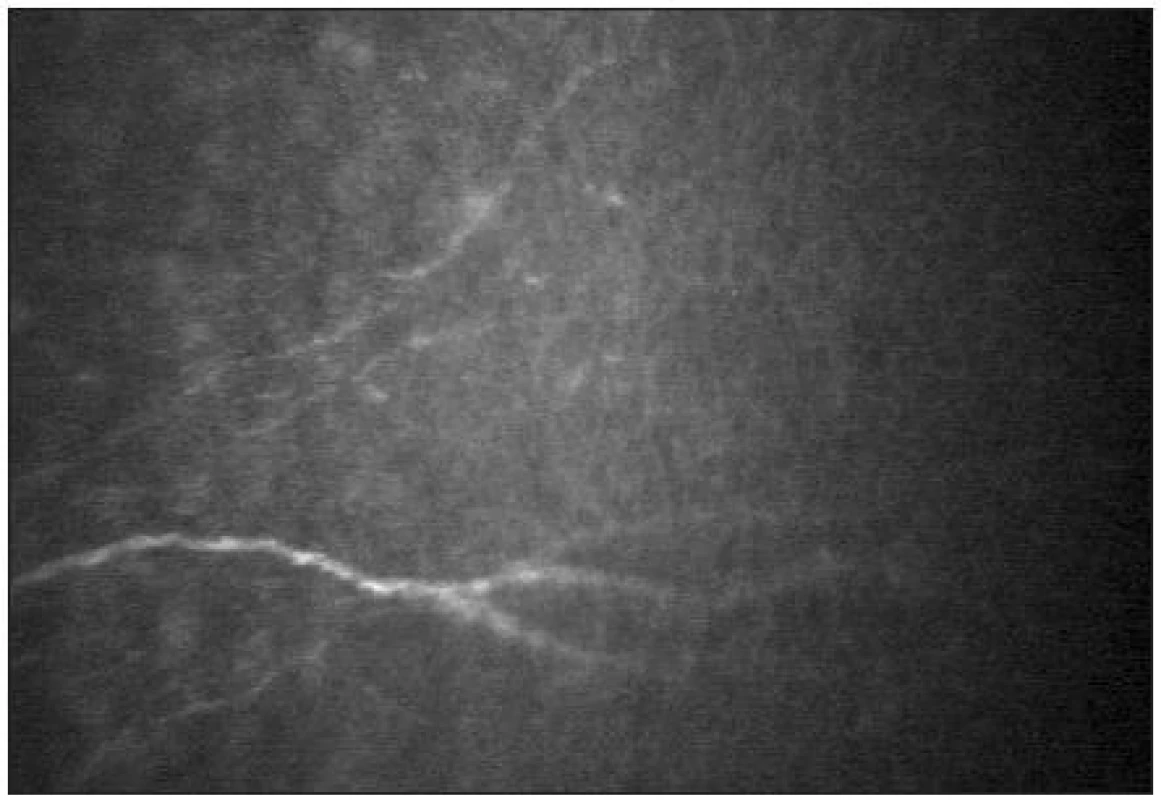
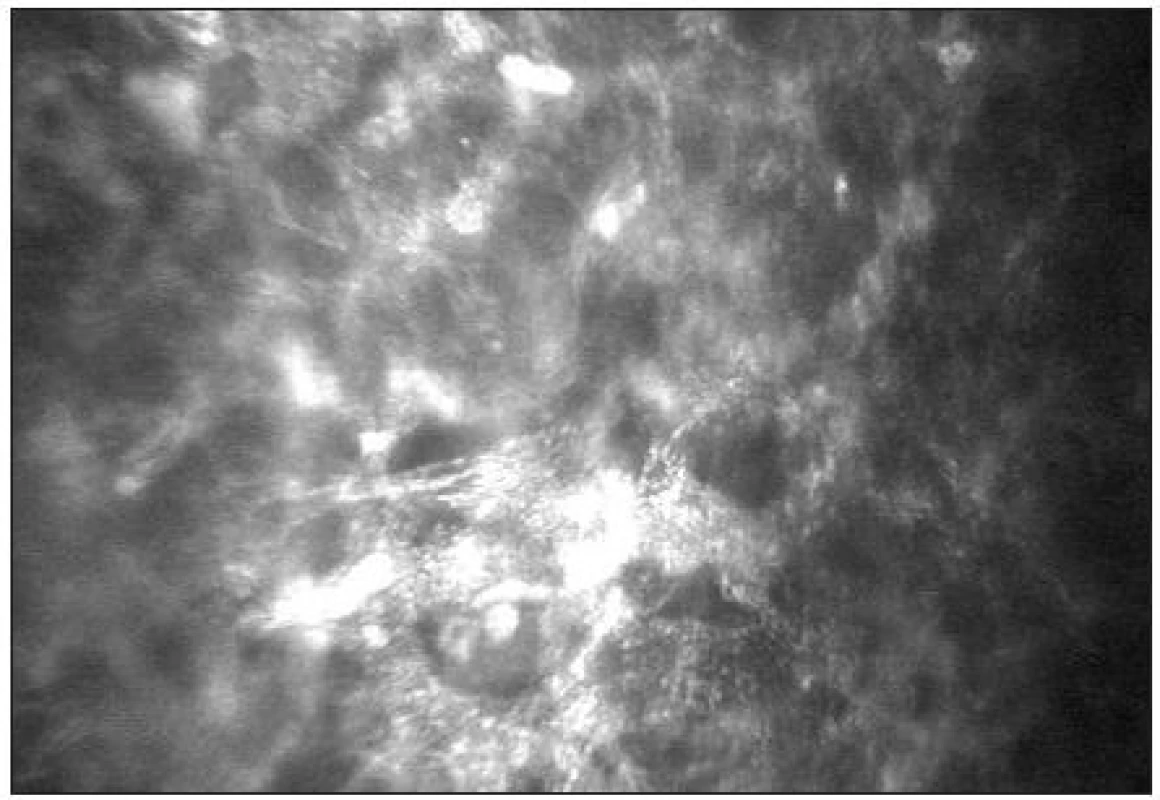
-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Využití konfokální mikroskopie rohovky v klinické praxi
Autoři: L. Pirnerová; M. Horáčková; E. Vlková; Z. Hlinomazová; V. Trnková; E. Strmeňová
Působiště autorů: Oční klinika LF MU a FN Brno, přednosta prof. MUDr. Eva Vlková, CSc.
Vyšlo v časopise: Čes. a slov. Oftal., 66, 2010, No. 6, p. 239-247
Kategorie: Souborný referát
Úvod
Konfokální mikroskopie představuje moderní neinvazivní, semikontaktní vyšetřovací metodu umožňující znázornit jednotlivé vrstvy rohovky „in vivo” ve vysokém rozlišení (od epitelu až po endotel). Využívána je k diagnostice a sledování ultrastrukturálních změn u pacientů s rohovkovými dystrofiemi, keratitidami, keratokonem, sledování regeneračních procesů po rohovkových refrakčních zákrocích, rohovkových transplantacích atd.
Historie konfokální mikroskopie
Vynález konfokálního mikroskopu je obecně přisuzován Marvinu Minskemu, který vytvořil funkční mikroskop v roce 1955. Vývoj konfokálního mikroskopu byl výrazně ovlivněn snahou o zobrazení biologických jevů v živých tkáních. Minsky si kladl za úkol zobrazení neurologických drah v mozku. Jeho původní princip používal malý otvor umístěný před zirkoniovým obloukem jakožto zdrojem světla. Minsky nevytvořil skutečný obraz, ale výstup z fotonásobiče byl přetvářen do obrazové podoby armádním osciloskopem, bez možnosti záznamu. Obrazová kvalita tohoto výstupu byla však velmi nízká z důvodu nekvality osciloskopu. V roce 1955 neměl Minsky dostatečné technologické možnosti, aby plně demonstroval potenciál konfokální mikroskopie. Techniky digitálního zpracování obrazu byly poprvé využity na počátku 80. let 20. století výzkumníky ve Woods Hole Oceanographic Institute. Použitím tzv. video mikroskopu se jim podařilo zobrazit buněčné struktury jako mikrotubuly, které nelze optickými mikroskopy znázornit [42].
Na principu konfokálního zobrazení vyvinutého Minskym a patentovaného v roce 1957 jsou založeny všechny moderní konfokální mikroskopy (Confoscan 4 Nidek Technologies, P4 Tomey Corporation, HRT II Heidelberg atd.).
Princip metody
Confoscan je speciální mikroskopický systém využívající oscilující štěrbinu mikroskopické konfigurace pro analýzu buněčných vrstev přední části oka – rohovky.
Halogenová lampa vytváří paprsek, který prochází úzkou štěrbinou a následně přes horní část poloviční čočky na rohovku. Odražená část světla od jednotlivých struktur rohovky prochází zpět spodní částí čočky a spodní štěrbinou. Následně je obraz snímán vysoce citlivou CCD (Charge-Coupled Device) kamerou (obr. 1) a je počítačově analyzován [21].
Obr. 1. <i>(s povolením Nidek Technologies)</i> 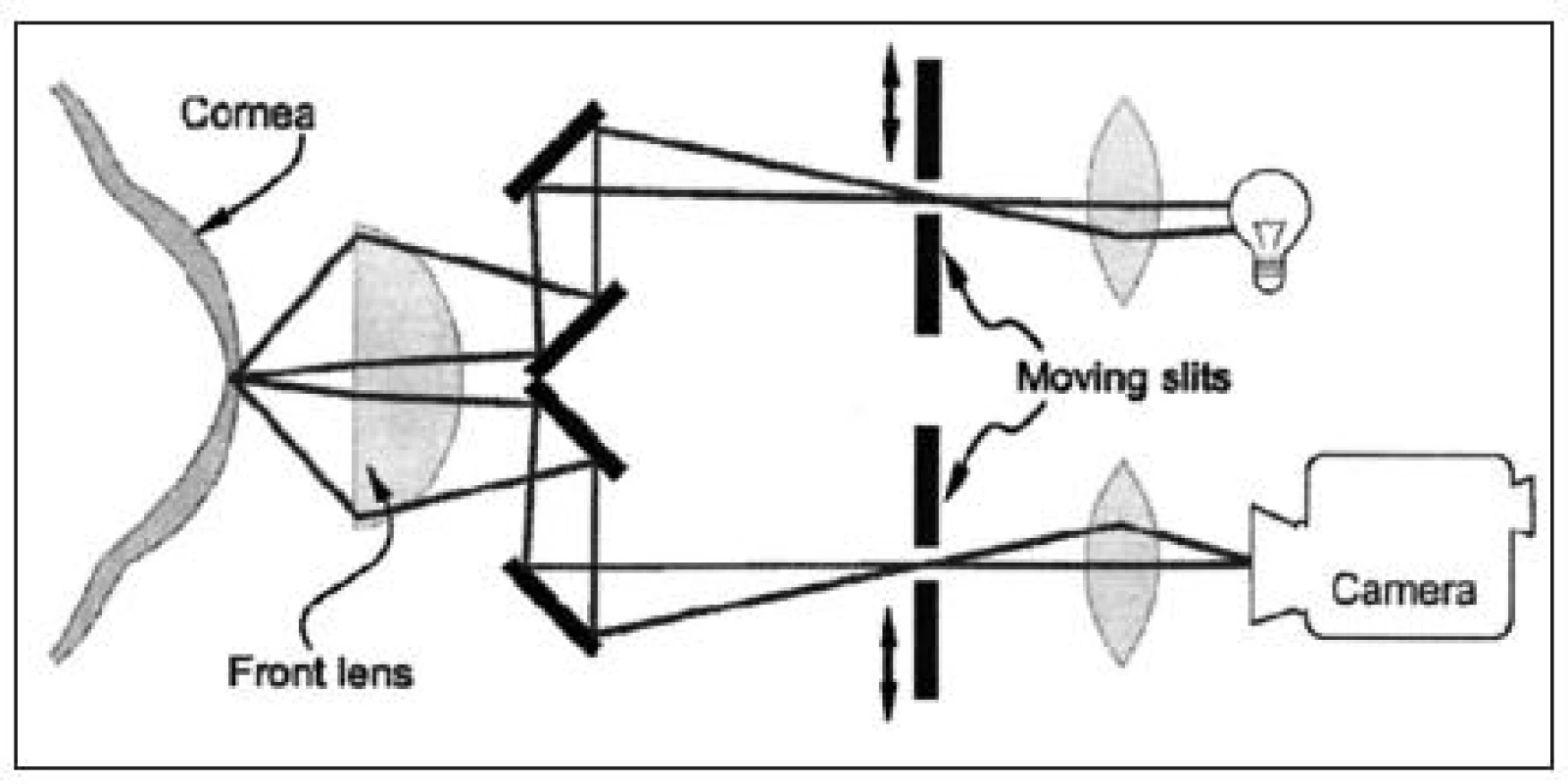
Při snímání sondou (40x) je využit princip imerze – DIP (distance immersion principle), kdy je čirý sterilní gel nanesen na přední část vyšetřovací čočky k zajištění homogenního optického prostředí. Fokální vzdálenost od rohovky je asi 1,92 mm (obr. 2). Vyšetřením získáváme 40krát zvětšené obrazové pole 460 x 345 μm v jednotlivých rohovkových vrstvách. Tloušťka řezu závisí na nastavení přístroje, nejčastěji 5 μm (teoreticky možno i 1 μm). Každým vyšetřením je získáno 350 obrazů jednotlivých vrstev rohovky [21].
Obr. 2. <i>(s povolením Nidek Technologies)</i> 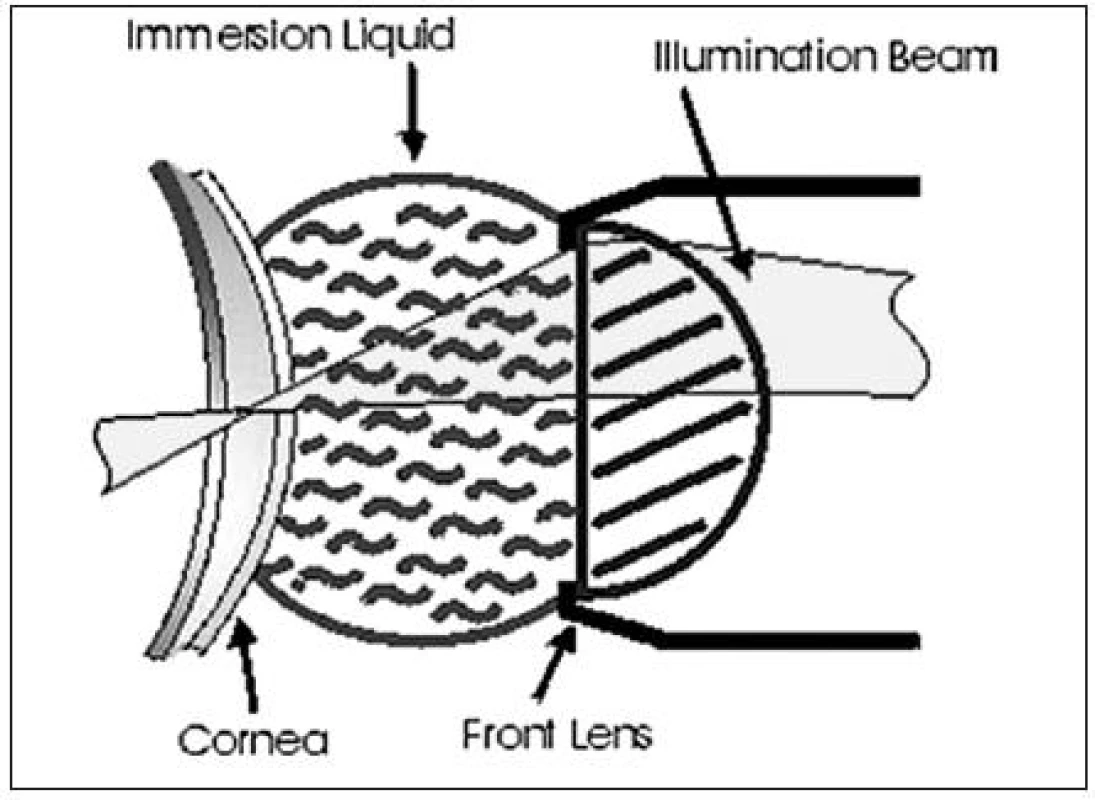
Grafickým zobrazením reflektivity jednotlivých vrstev rohovky je Z-křivka, kde na ose x je znázorněna vzdálenost jednotlivých struktur a na ose y úroveň reflektivity (obr. 3). Endoteliální vrstva je charakterizována nejvyšší reflektivitou, stroma představuje nejnižší a epitel je zastoupen středními hodnotami. Analýzou této křivky lze určit uložení jednotlivých struktur a patologií včetně tloušťky rohovky [21].
Obr. 3. <i>(s povolením Nidek Technologies)</i> 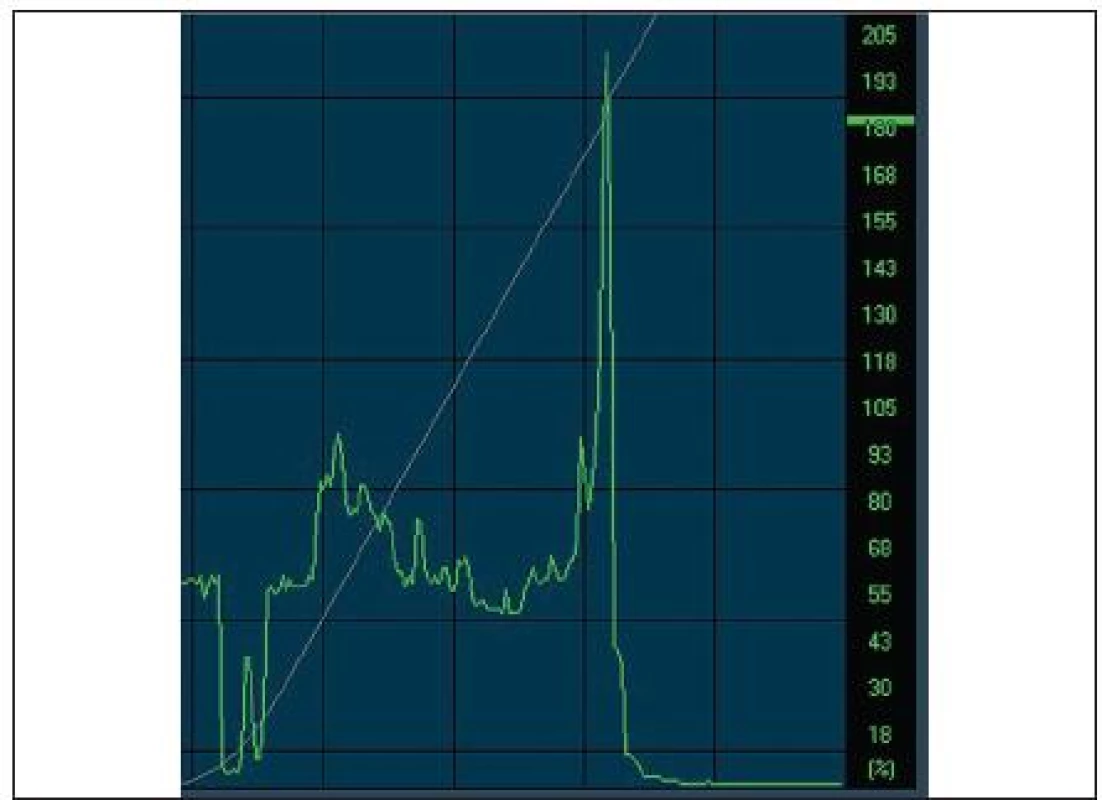
Pro snímání endoteliální vrstvy rohovky je používána samostatná nekontaktní sonda (20x). Počítačový program umožňuje analýzu počtu endoteliálních buněk, včetně pleomorfismu a polymegetismu (obr. 4). Vzdálenost vyšetřovací sondy od rohovky je 12 mm.
Obr. 4. <i>(s povolením Nidek Technologies)</i> 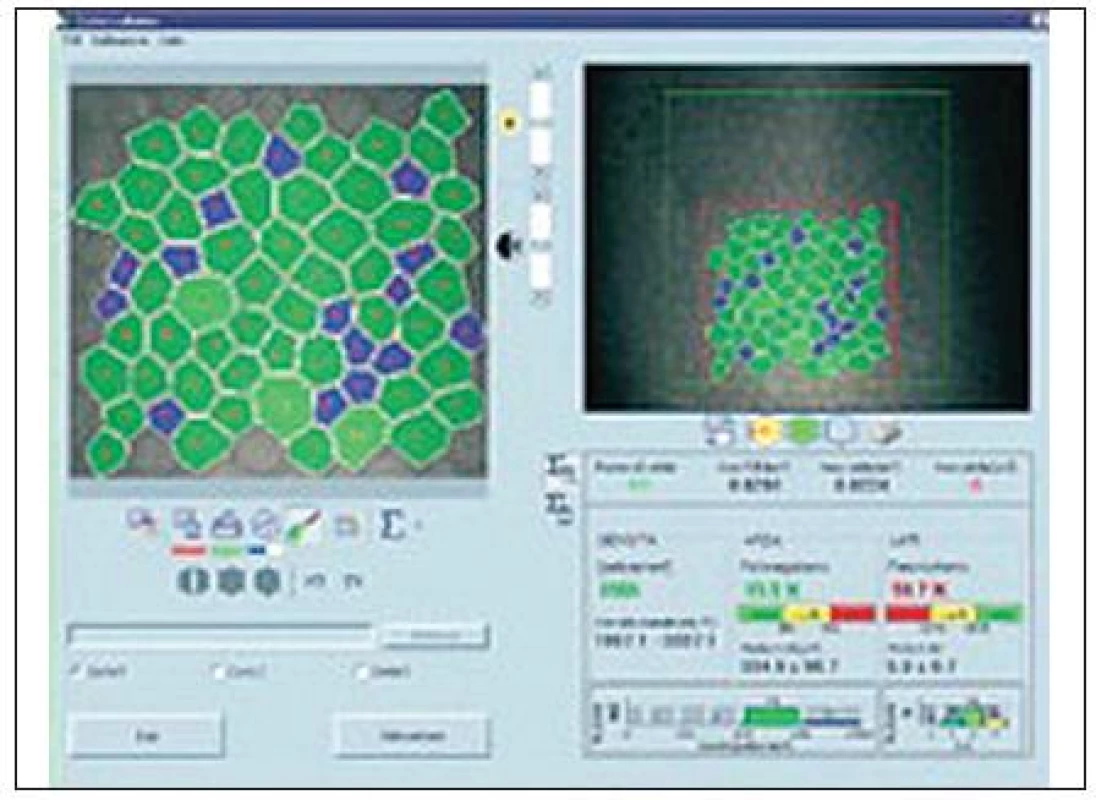
Vyšetření konfokálním rohovkovým mikroskopem
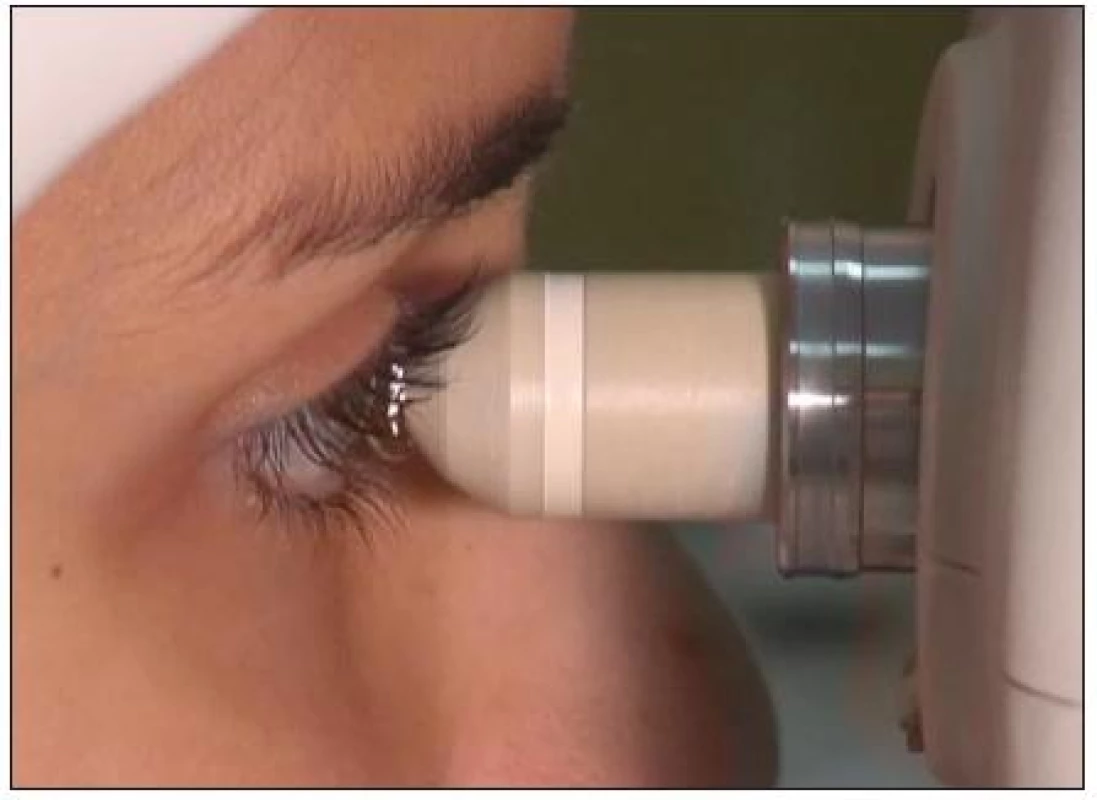
Vlastní snímání je prováděno v topické anestezii rohovky po aplikaci gelu na přední část vyšetřovací čočky (obr. 5). Mezi limitující faktory vyšetření patří nespolupráce pacienta, časová náročnost vyšetření a erudice vyšetřujícího.
Fyziologická rohovka v obrazech konfokálního mikroskopu
Epitel
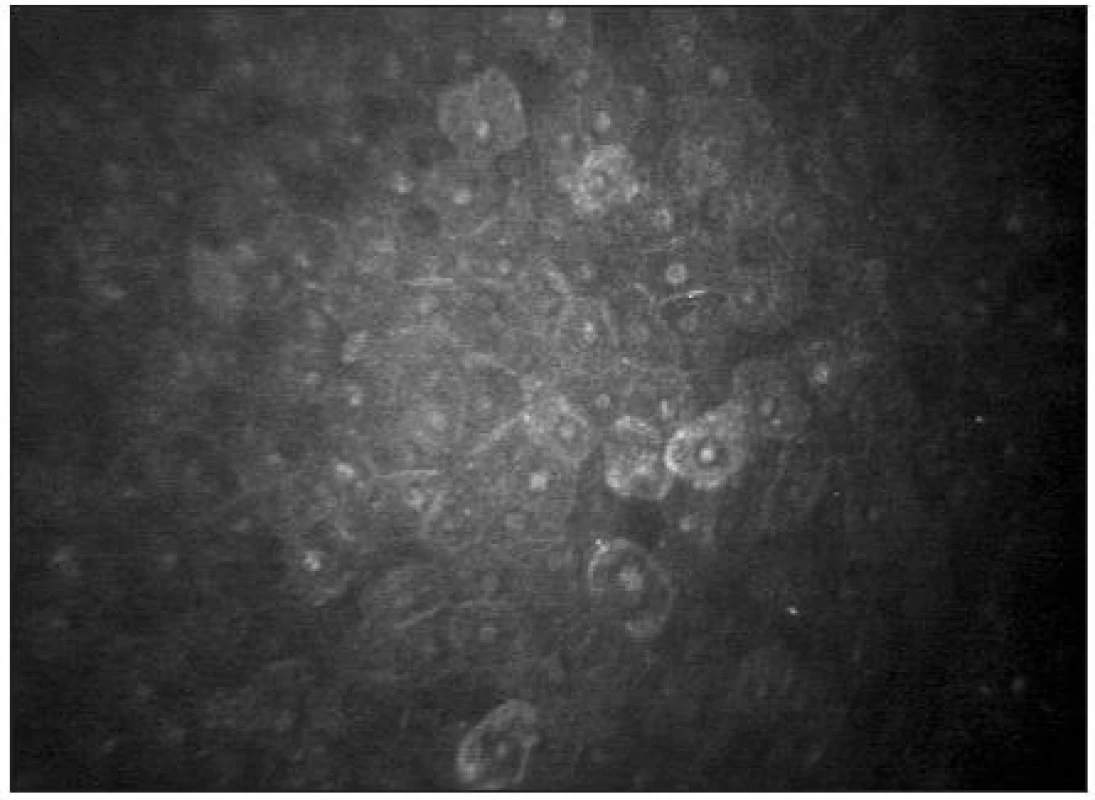
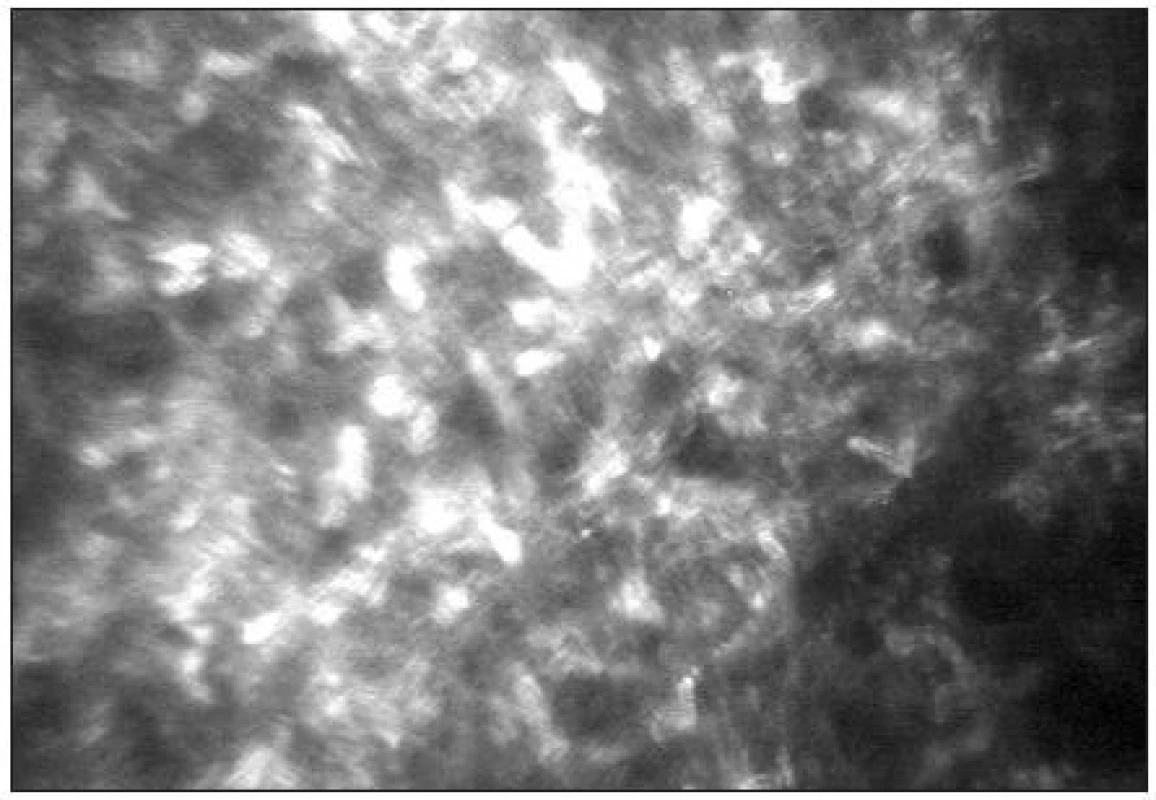
Epitel lidské rohovky je tvořen 5 až 6 buněčnými vrstvami. V povrchové vrstvě lze popsat ploché polygonální buňky (velikost 40–50 μm) s jasnými jádry obklopenými tmavou cytoplasmou (obr. 6). Průměrná hustota buněk kolísá od 600–1200 bb/mm2 [39, 25]. Následuje intermediální vrstva s variabilní velikostí a tvarem buněk (průměrné velikosti 20–40 μm) bez viditelných jader (obr. 7) s hustotou 5000–5500 bb/mm2 [5]. Nejníže uloženou vrstvu představuje bazální vrstva epitelu (obr. 8) s cylindrickými buňkami (velikosti 8–15 μm) a hustotou 6000–9000 bb/mm2 [39,32].
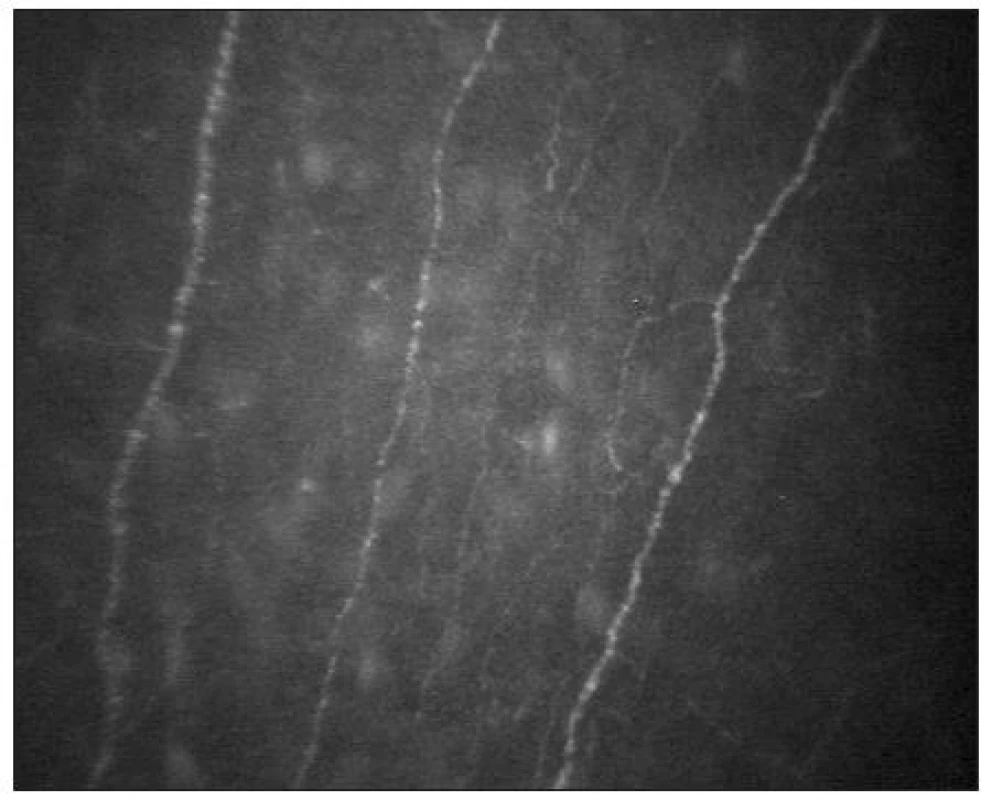
Subbazální nervový plexus
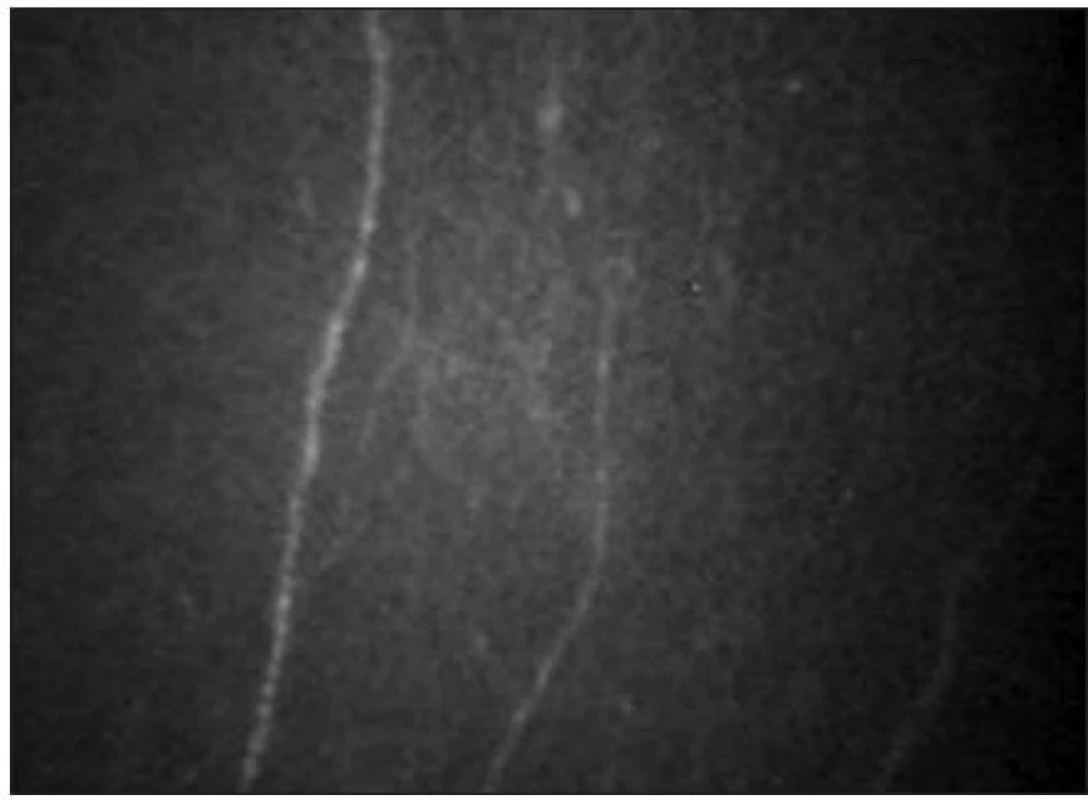
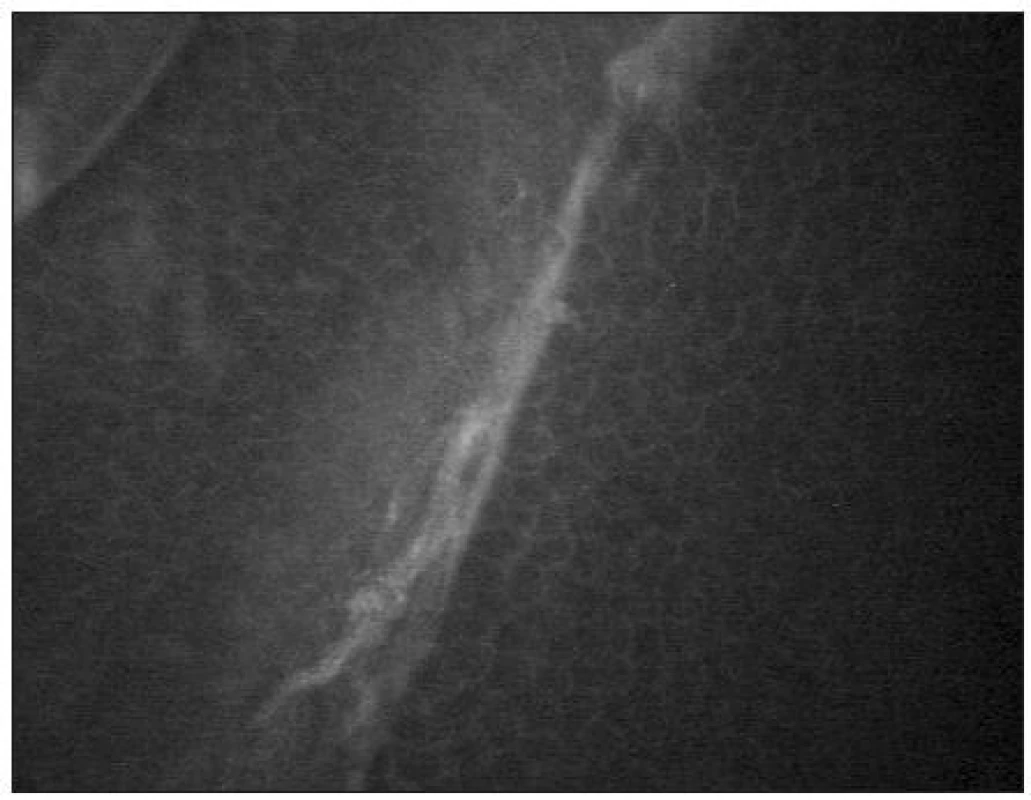
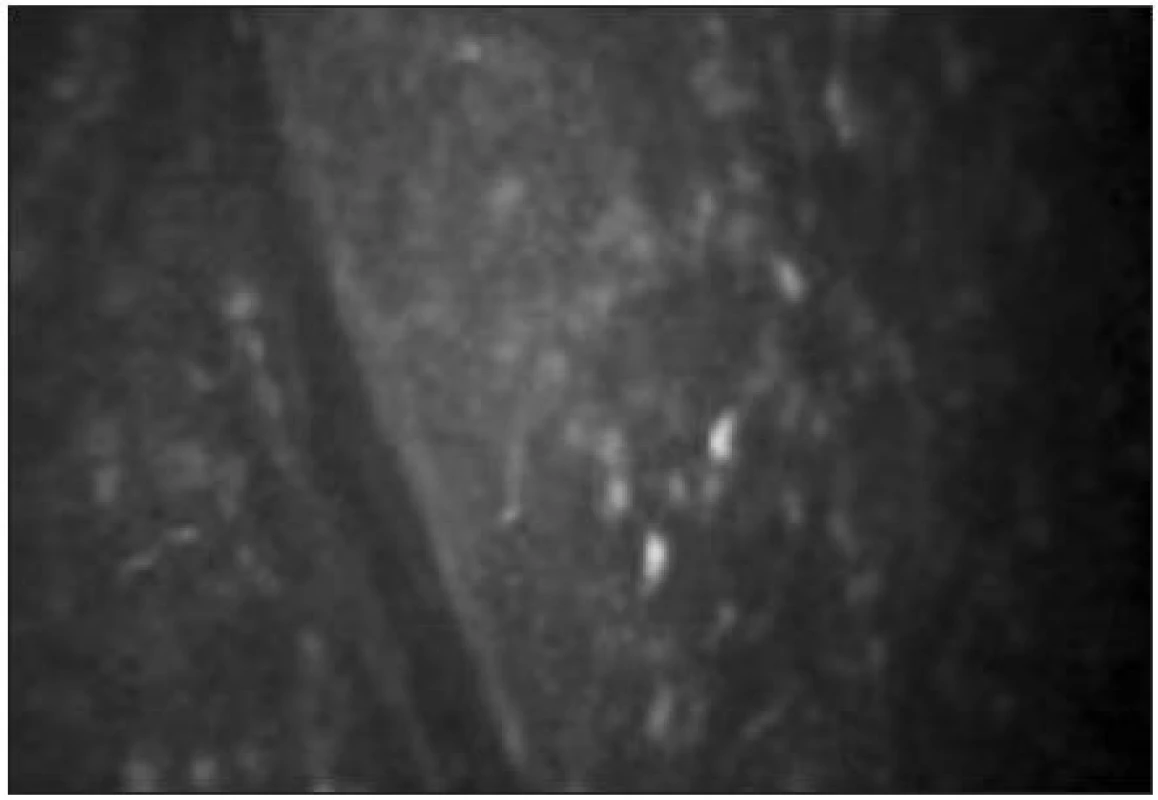
Pod bazální vrstvou epitelu lze zachytit subbazální nervový plexus (obr. 9). Vlákna jsou jemná (tloušťky 2–4 μm) a paralelně uspořádaná.
Bowmanova membrána
Bowmanova membrána představuje amorfní vrstvu ležící pod bazální vrstvou epitelu. Její tloušťka je přibližně 10 μm a je tvořena kolagenními vlákny [28]. U fyziologických rohovek se při vyšetření neznázorňuje.
Subepiteliální nervový plexus
Pod Bowmanovou membránou se nachází subepiteliální nervový plexus (obr. 10). Tloušťka subepiteliálních nervových vláken se pohybuje mezi 3–7 μm [21]. Nervová vlákna mají charakter na vláknu navlečených perel.
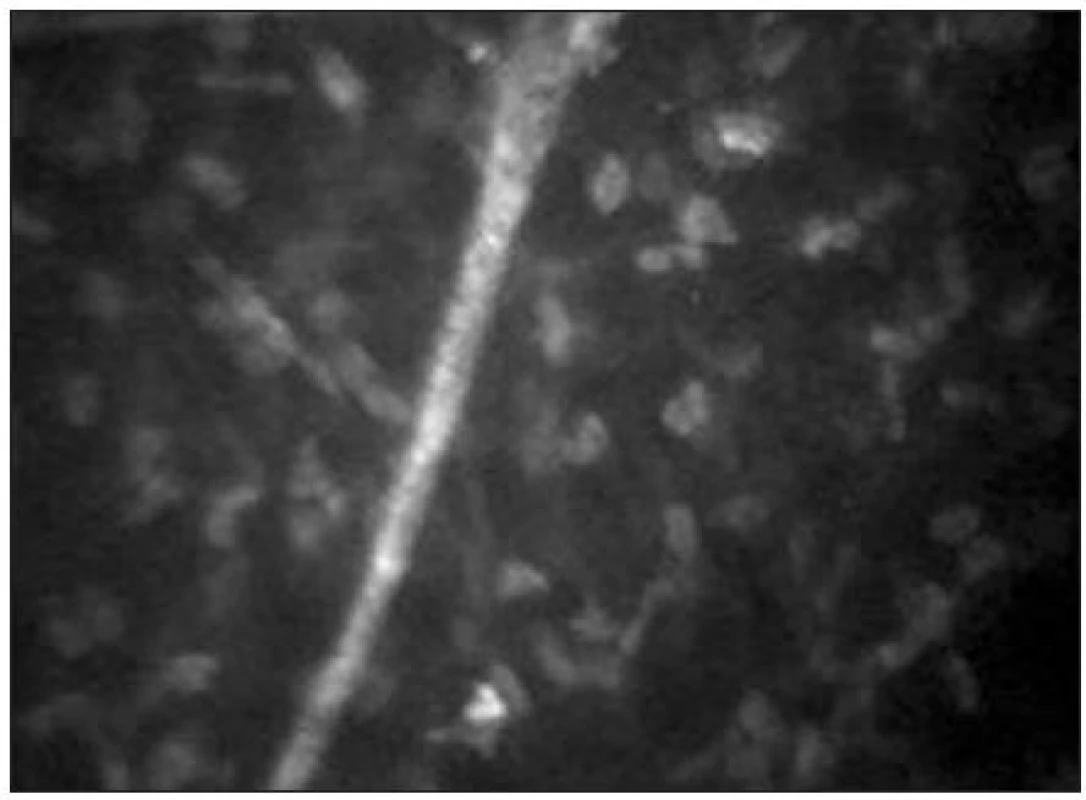
Stroma
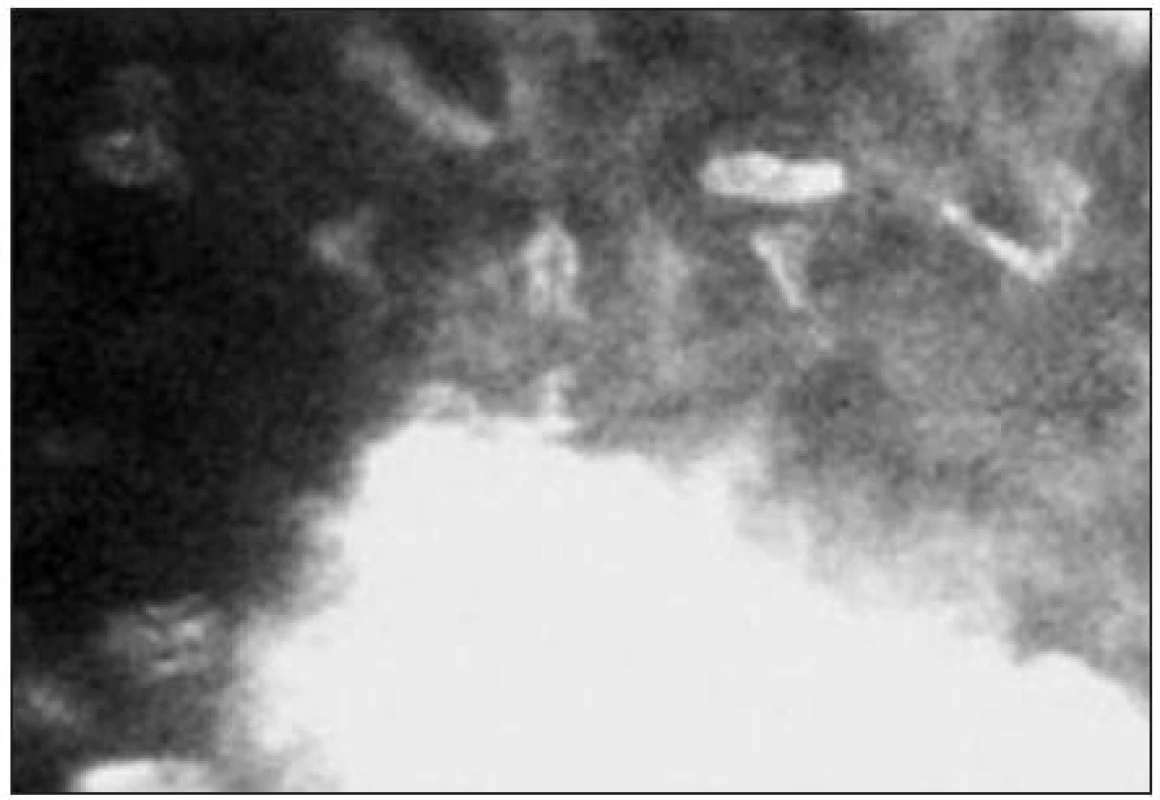
Stromální vrstva představuje přibližně 80–90 % tloušťky rohovky. Je tvořeno extracelulární matrix (kolagenem typu I, III, V, VI), keratocyty, stromálním nervovým plexem a glykosaminoglykany. Jádra keratocytů se tvarově liší v jednotlivých vrstvách rohovky. V předním stromatu je jejich tvar rohlíčkovitý a hustota je zde největší (obr. 11). Směrem do středního stromatu se hustota keratocytů snižuje a tvar jader se mění na oválný. Je zde možné také zachytit tlustá stromální vlákna s bifurkacemi, často typického tvaru Y (obr. 12). Jejich tloušťka kolísá od 4–14 μm. V zadním stromatu je hustota keratocytů nejmenší (obr. 13) [21]. Keratocyty s hyperreflexními jádry jsou považovány za metabolicky aktivní. Jejich zvýšenou aktivitu nacházíme typicky u rohovek se záněty a při hojících procesech např. po refrakčních zákrocích (obr. 14).
Descementská membrána
Descementská membrána (6–10 μm) je u fyziologických rohovek transparentní a neznázorňuje se. Její vizualizace je popisována u starších pacientů [10].
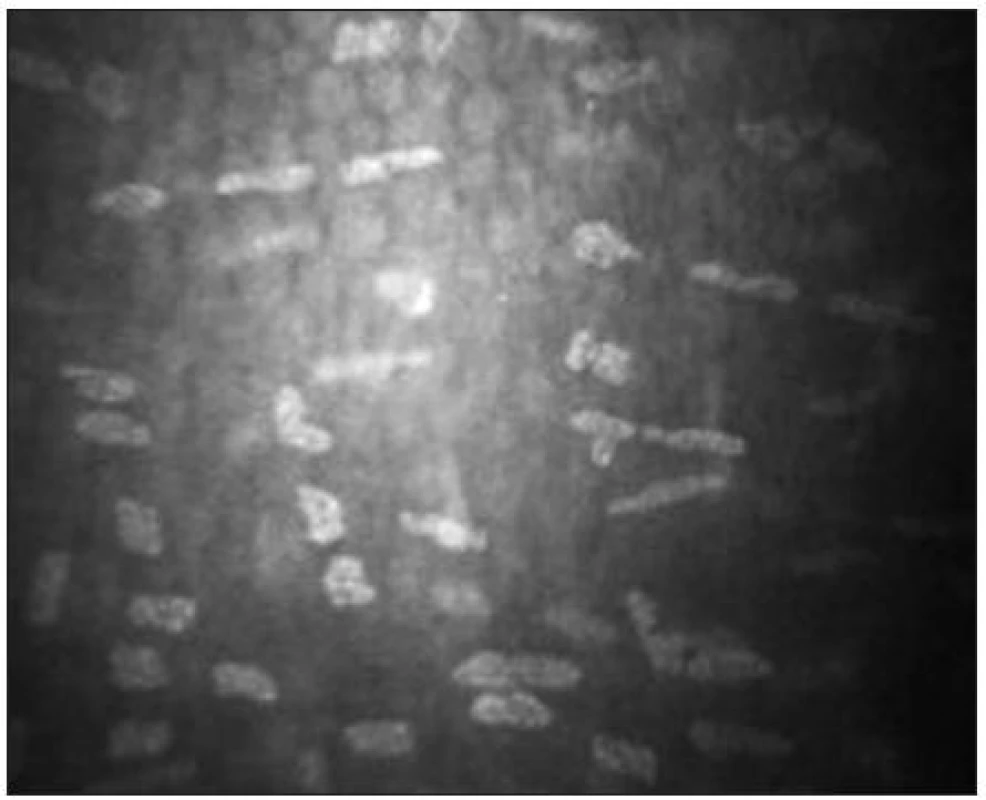
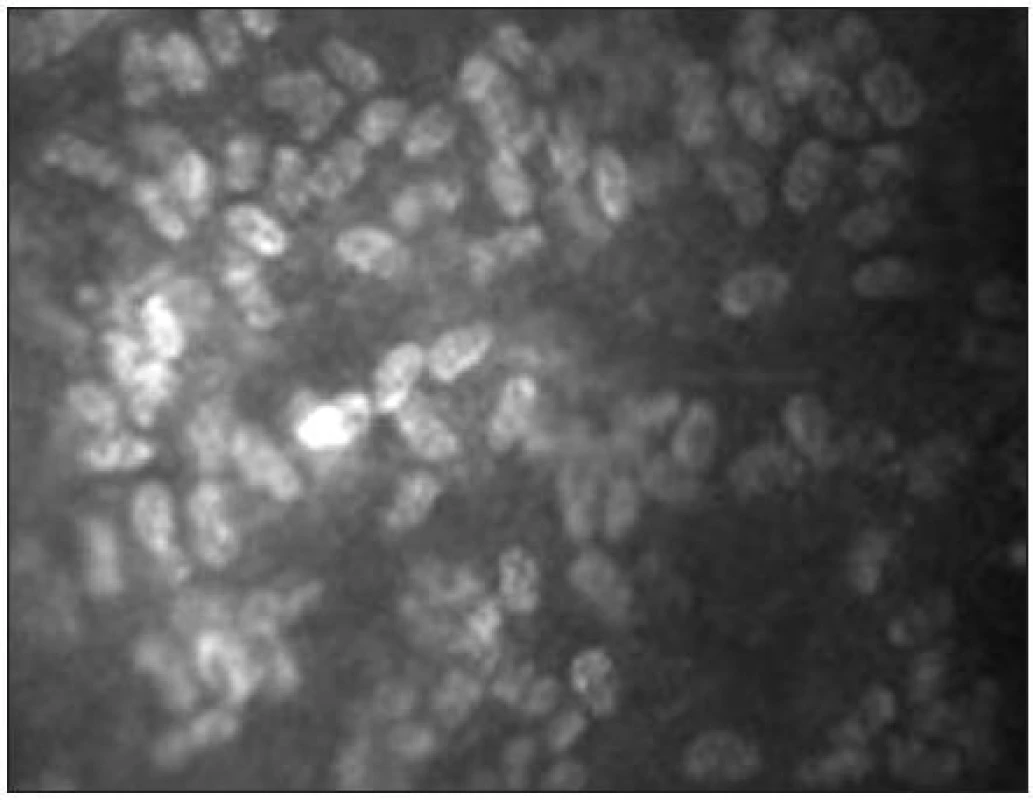
Endotel
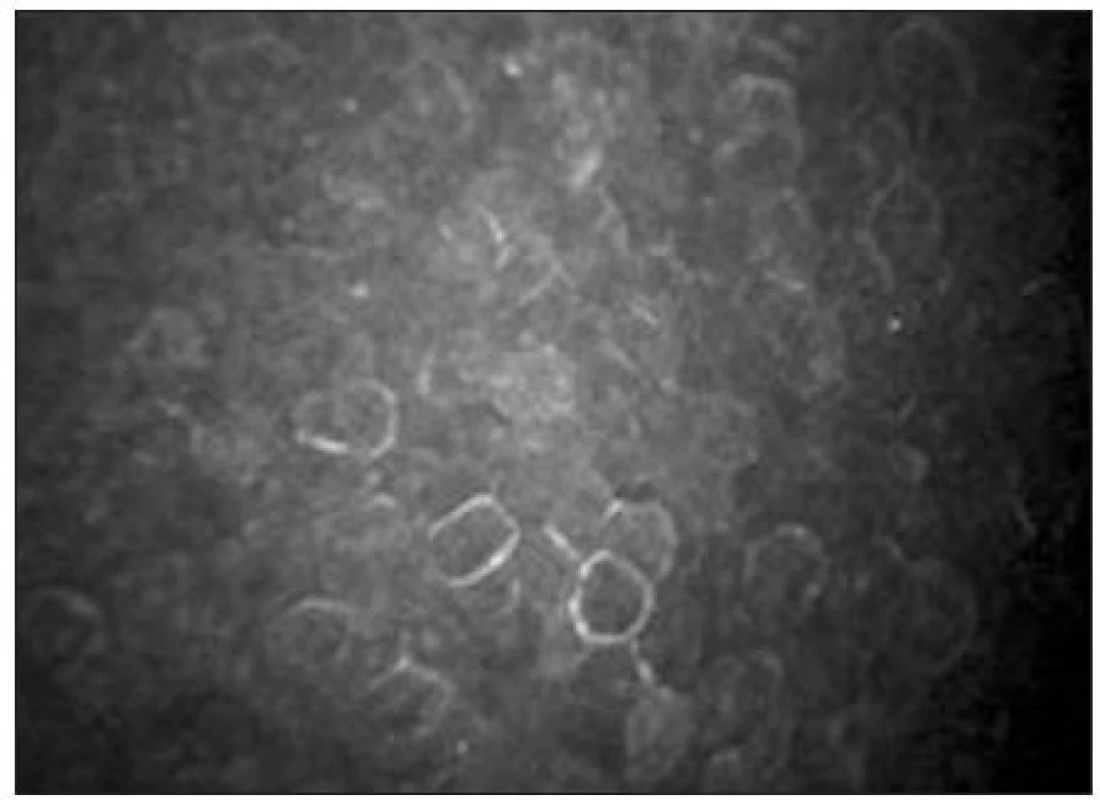
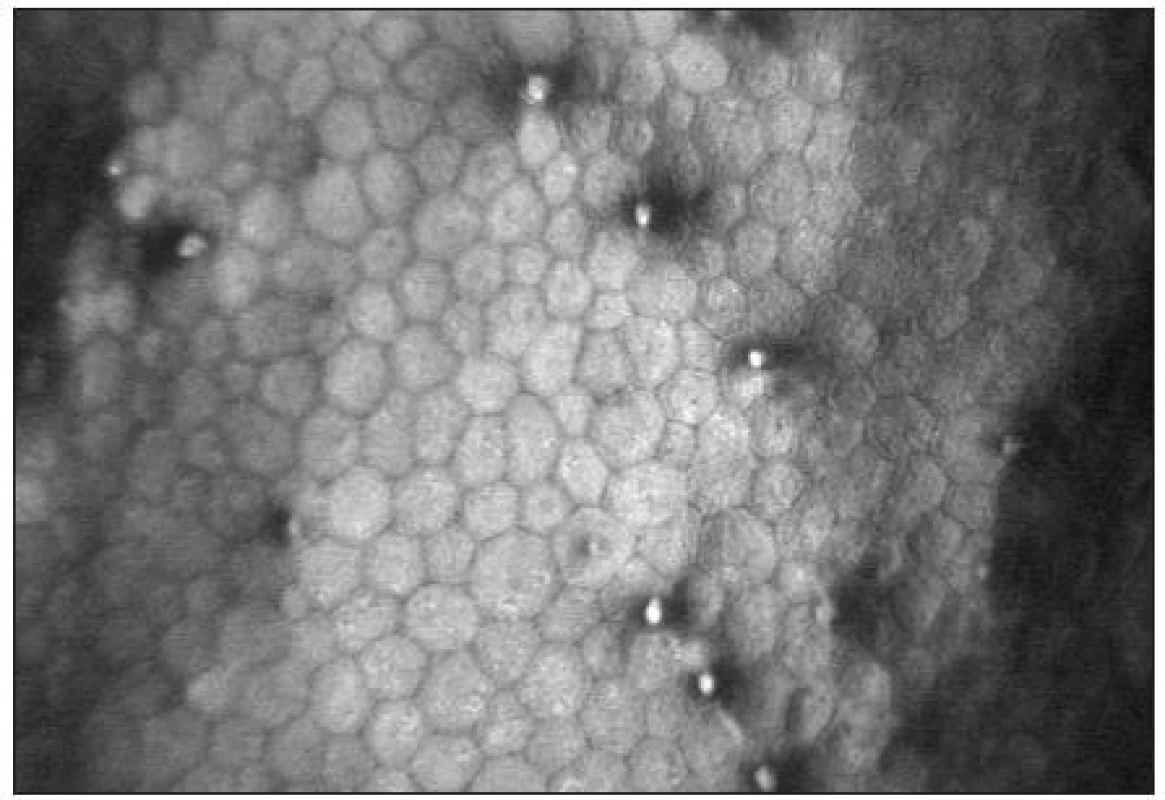
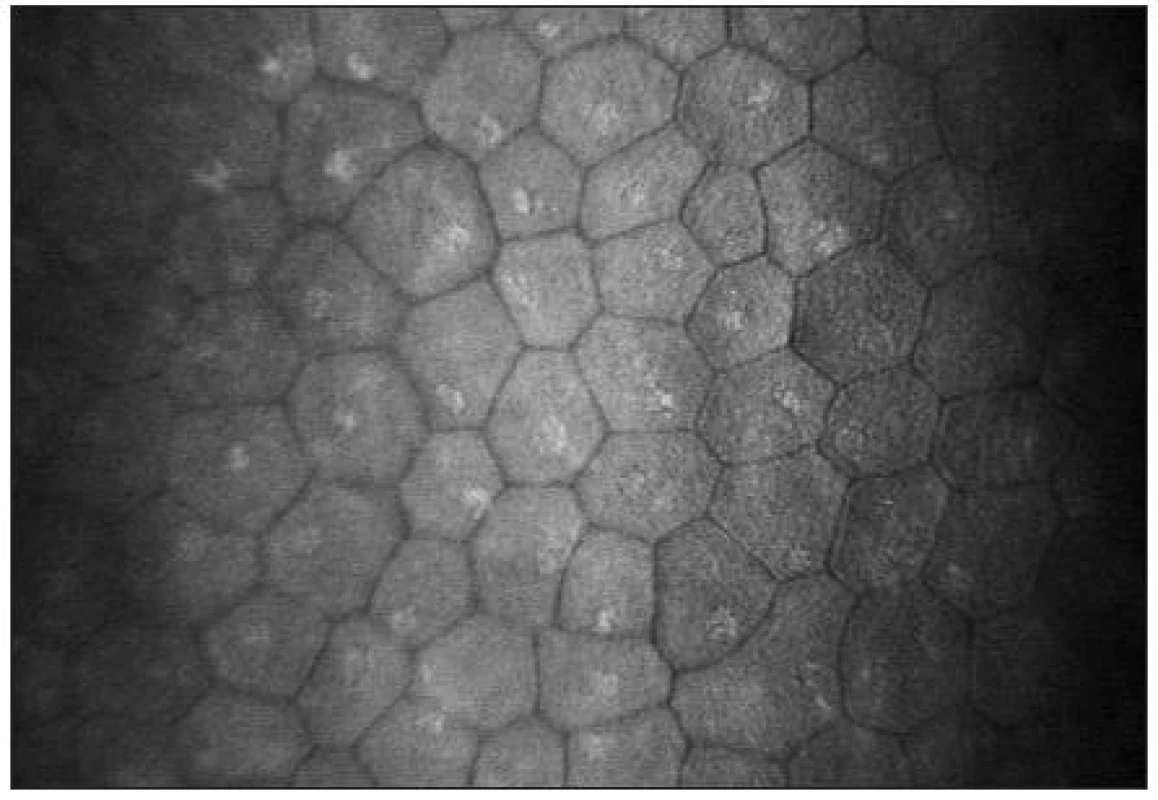
Endoteliální monovrstva je tvořena tmavě ohraničenými buňkami hexagonálního tvaru. Jejich tloušťka je přibližně 4 μm a průměr 20 μm [38]. Buněčná jádra jsou zřídka viditelná (obr. 15). Hustota endoteliálních buněk se pohybuje mezi 2500–3000 bb/mm2. S věkem dochází k postupné redukci počtu buněk (průměrně o 0,6 % ročně) a nárůstu polymegetismu [7,15].
Klinické využití konfokální mikroskopie
Konfokálním mikroskopem lze znázornit rohovkové struktury a změny, které nejsou pozorovatelné biomikroskopicky štěrbinovou lampou. Umožňuje tak diagnostiku nejrůznějších onemocnění rohovky, např. rohovkových dystrofií, sledování ultrastrukturálních změn u pacientů s keratokonem, po corneal cross-linkingu (CXL), rohovkových refrakčních zákrocích (PRK, LASIK …), transplantacích rohovky, u dlouhodobých nositelů kontaktních čoček, pacientů s diabetes mellitus a neuropatiemi. Je pomocnou metodou při zjišťování etiologie a monitorování průběhu léčby u infekčních keratitid. Konfokální mikroskopie našla své uplatnění i mimo obor oftalmologie, zejména v diabetologii a neurologii.
A) Diagnostika rohovkových dystrofií
Rohovkové dystrofie představují skupinu nezánětlivých onemocnění rohovky. Jedná se často o oboustranné, progredující onemocnění zhoršující zrakovou ostrost [18].
1. Epitelové rohovkové dystrofie:
Coganova mikrocystická dystrofie (obr. 16) – dystrofie bazální membrány epitelu. Je řazena k nejčastěji se vyskytujícím rohovkovým předním dystrofiím. V obrazech z konfoscanu jde o ztluštělá místa bazální membrány obklopená epitelem rohovky [7].
2. Stromální rohovkové dystrofie:
Granulární dystrofie (obr. 17) – charakteristická ukládáním eozinofilních depozit hyalinu ve stromatu rohovky. V obrazech z konfokálního mikroskopu lze popsat světlé denzní struktury uložené v předním a středním stromatu (hloubka 50–250 μm), bez postižení endoteliální vrstvy [20].
Mřížková dystrofie (obr. 18) – charakteristická ukládáním depozit amyloidu do stromatu rohovky. Časté jsou poruchy hemidezmozomů a ruptury Bowmanovy membrány [7]. V obrazech konfoscanu lze depozita diagnostikovat jako světlé mikrogranulární reflexní opacity, nejčastěji ve středním stromatu [21].
Centrální krystalová dystrofie Schnyderova (obr. 19) – histologicky jde o depozita cholesterolu a neutrálních tuků, způsobující destrukci Bowmanovy membrány [7]. Diagnostika je dána klinickým obrazem, hloubku postižení nám umožňuje určit konfokální mikroskopie. Charakteristickou změnou je akumulace subepiteliálních krystalických depozit vysoké reflektivity zasahující až do středního stromatu (hloubky 200–250 μm). Subepiteliání nervový plexus nebývá detekován a stromální nervová vlákna jsou abnormálně větvená [21].
3. Endotelové rohovkové dystrofie:
Fuchsova dystrofie (obr. 20, 21) – charakteristická patologickými výchlipkami Descementské membrány. Konfokální mikroskopie umožňuje diagnostikovat různá stadia onemocnění, a to i v případě rohovkového edému, kde spekulární mikroskop již neumožňuje vizualizaci endotelu [13].
B) Vizualizace rohovkových mikrodepozit
Metoda umožňuje vizualizaci patologických mikrodepozit u Fabryho choroby, hyperlipidémie, amiodaronových depozit atd. Amiodaronová depozita lze zachytit jako vysoce reflektivní body v oblasti epitelu a u pokročilých nálezů i v oblasti stromatu [21]. Dobře zachytitelná jsou i mikrodepozita po refrakčních zákrocích (obr. 22).
C) Diagnostika infekčních keratitid
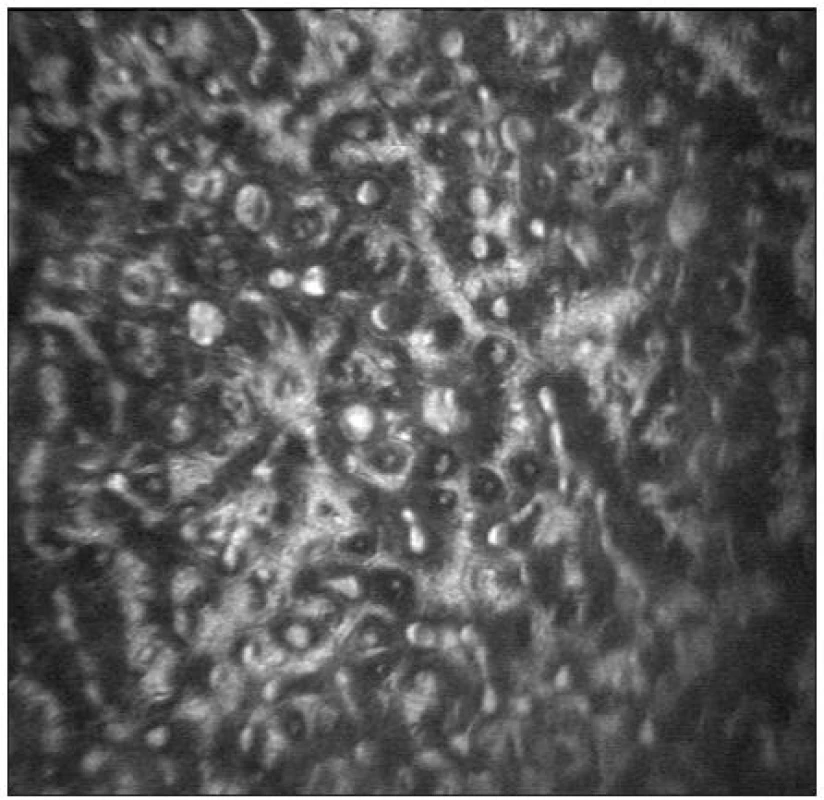
Infekční keratitidy jsou zánětlivá onemocnění rohovky způsobená různými etiologickými agens. Konfokální mikroskopie je pomocnou metodu v diagnostice a sledování účinnosti terapie akutních či chronických stadií těchto onemocnění. Napomáhá diferenciálně diagnosticky rozlišit bakteriální, mykotická či protozoální agens. Kontrastní hyfy v oblasti epitelu či stromatu jsou konfokálním mikroskopem zachytitelné např. u aspergilové keratitidy [41] či jiných mykotických infekcí. Popisována je i diagnostika akantamébové keratitidy, kdy metoda umožňuje vizualizaci hyperreflexních mikrocyst ovoidního tvaru (obr. 23) v oblasti epitelu a předního stromatu rohovky [1, 3, 17, 22, 29, 35]. Vzhledem k obtížné vyšetřitelnosti pacienta v akutních stadiích onemocnění má tato metoda význam spíše pro dlouhodobé hodnocení účinnosti léčby. Sledovány mohou být i změny inervace a přítomnost vysoce reflektivních dendritických buněk pavoukovitého tvaru u pacientů s herpetickými keratitidami [8]. Pro bakteriální keratitidy je charakteristická hyperreflexe postižených rohovkových struktur a přítomnost oválných leukocytů (velikosti 12–15 μm) na úrovni bazální vrstvy epitelu či subbazálně (obr. 25).
D) Ultrastrukturální změny rohovky u pacientů s keratokonem a sledování změn po corneal cross-linkingu
Keratoconus je nezánětlivé ektatické onemocnění rohovky. V 96 % případů se jedná o oboustranné, často asymetrické onemocnění. Nejčastěji se manifestuje v 2. až 3. dekádě života. Je charakteristické vyklenováním a protenčováním rohovky (nejčastěji paracentrálně dole), které vede k myopizaci a vzniku nepravidelného astigmatismu. Etiologie tohoto onemocnění není přesně známa. Přepokládá se, že ztečení a ektazie rohovky je výsledkem interlamelárního a interfibrilárního sesuvu (prokluzování) kolagenu stromatu rohovky způsobenou ztrátou koheze mezi kolagenními fibrilami a nekolagenní matrix s alterací proteoglykanů [23].
U pacientů s keratokonem lze konfokálním mikroskopem ve vrstvě epitelu zachytit elongaci a distorzi buněk [21]. Jizvení v oblasti Bowmanovy vrstvy, anomální větvení a celkový úbytek hustoty nervových vláken (obr. 24) bývají dalšími známkami tohoto onemocnění [20, 27]. Ve stromatu často nalézáme vertikální, horizontální či retikulární mikrostrie (obr. 25), snížení hustoty a abnormální morfologii keratocytů [37, 11]. Endotel u většiny pacientů vykazuje normální nález. Výjimečně lze zachytit zvýšený polymegetismus a pleomorfismus buněk.
Corneal cross – linking (CXL) je velmi slibná metoda léčby keratokonu. Efektivně zastavuje progresi keratokonu a oddaluje nutnost transplantace rohovky.
Principem metody je fotopolymerizační reakce. Při zákroku je rohovka nasycena riboflavinem (0,1%), který slouží jako fotosenzibilizátor. Po jeho stimulaci ultrafialovým zářením o vlnové délce 365 nm se uvolní reaktivní sloučeniny kyslíku (především kyslíkový radikál), který vstupuje do reakce s aminoskupinami kolagenu (oxidační deaminace) a vytvoří kovalentní můstky (zesíťování), což způsobí zpevnění rohovky.
Časné období po CXL je charakterizováno prořídnutím keratocytů a houbovitým edémem v oblasti předního a středního stromatu (obr. 26). Zadní stroma ani endotel nevykazují žádné změny. Počínající repopulaci stromatu aktivovanými keratocyty lze zaznamenat přibližně od 3. měsíce po zákroku (obr. 27) a je následována regenerací nervových vláken [9].
E) Sledování reaktivních a regeneračních procesů po refrakčních rohovkových zákrocích
Konfokální mikroskopie představuje vhodnou metodou ke sledování reaktivních procesů v jednotlivých rohovkových vrstvách po fotorefrakční keratektomii (PRK), laser in situ keratomileusis (LASIK) atd. Zachytitelné jsou změny hustoty a aktivace keratocytů, regenerace nervových vláken, výskyt mikrodepozit atd. Počítačovou analýzou lze určit přesnou tloušťku rohovkové lamely po LASIKu.
Po PRK nacházíme pooperačně největší změny ve vrstvě epitelu a předním stromatu rohovky. V časném období lze pozorovat stromální edém s úbytkem keratocytů a jejich následnou aktivaci s maximem v prvních třech měsících po zákroku (obr. 28). Po LASIKu je oblastí zájmu zejména intrastromální rozhraní (obr. 29), kde lze zachytit mikrodepozita, mikrostrie a v přilehlém stromatu zvýšenou aktivaci a repopulaci keratocytů jako po PRK. Regenerace subepiteliálních a subbazálních nervových vláken je u obou zmíněných metod dlouhodobá [30]. Popisována je rychlejší po LASIKu [21] a kompletně obnovena a srovnatelná s předoperačním nálezem až po 2 letech od zákroku [2]. Využití nachází tato metoda i při měření tloušťky rohovkové lamely, která bývá dle některých studií tenčí než je plánovaná hodnota [1, 31, 40].
F) Sledování ultrastrukturálních změn po transplantacích rohovky (perforujících, lamelárních atd.)
Konfokální mikroskopie se jeví jako vhodná vyšetřovací metoda při sledování změn počtu buněk v endoteliální monovrstvě (obr. 30), rychlosti obnovy hluboké a povrchové inervace po keratoplastikách, rejekčních reakcí atd. [4].
Na základě desetiletého sledování pacientů po perforujících keratoplastikách bylo zjištěno, že úbytek buněk v endoteliální monovrstvě činí až 67 Ī 18 % [21]. Zvyšuje se i jejich pleomorfismus a polymegetismus. Pokles počtu těchto buněk je až sedmkrát vyšší než u fyziologických rohovek s maximem během prvních let po zákroku. Největší ztráty endotelových buněk byly popsány u rohovek transplantovaných pro bulózní keratopatii a naopak nejnižší u rohovek s keratokonem [26]. Stanovení počtu endoteliálních buněk je důležitým faktorem pro indikaci následných chirurgických zákroků (např. operaci katarakty, polishingu zadní kapsuly a refrakční zákroky). Obnova inervace rohovky po keratoplastikách je dlouhodobá. Stromální vlákna lze během prvních měsíců po zákroku pozorovat v periferní oblasti štěpu. Regenerace subbazálního nervového plexu je u většiny vyšetřovaných zachytitelná až po dvou letech. Rychlost reinervace je ovlivněna věkem a předoperační diagnózou pacienta. Starší pacienti a pacienti s primární diagnózou rohovkové dystrofie či bulózní keratopatie vykazují vyšší abnormality ve stromální inervaci, kdy jsou vlákna tenčí a abnormálně zakřivená [33]. Snížena může být i hustota keratocytů. Častým nálezem jsou tmavé strie.
G) Sledování změn rohovkových struktur u dlouhodobých nositelů kontaktních čoček
Dlouhodobé mechanické působení kontaktních čoček na povrch rohovky, prostupnost čoček pro kyslík a působení chemických látek roztoků vede ke změně imunitního stavu rohovky a zvyšuje riziko vzniku infekce. U více než 50 % uživatelů kontaktních čoček lze konfokálním mikroskopem sledovat výskyt Langerhansových buněk, typicky na úrovni intermediální a bazální vrstvy epitelu. U většiny dlouhodobých nositelů čoček jsou buňky povrchové vrstvy epitelu menší ve srovnání s normálními rohovkami. Pozorovatelná je i zvýšená hustota těchto buněk jak v centrální části rohovky, tak periferně. Struktura buněk intermediální a bazální vrstvy epitelu bývá normální. Snížení jejich počtu je možné zaznamenat v periferii rohovky. Výjimkou není ani přítomnost hyperreflexních stomálních mikrodepozit, úbytek endoteliálních buněk, zvýšení jejich pleomorfismu či polymegetismu [21] a snížení hustoty keratocytů [6] způsobené apoptózou po uvolnění zánětlivých mediátorů v rohovkové tkáni [16]. Zachytitelné mohou být i změny morfologie a distribuce nervových vláken.
H) Pozorování změn jednotlivých rohovkových struktur u pacientů s diabetes mellitus a neuropatiemi
V řadě studií je u pacientů s diabetes mellitus popisováno ztluštění stromálních nervových vláken [24] a změna morfologie subepiteliálních nervových vláken [34]. Endoteliální vrstva vykazuje úbytek buněk [14] a zvýšení polymegetismu [19]. Uváděné ztráty jsou o 5 % (u pacientů s DM II) a o 11 % (u pacientů s DM I) vyšší proti zdravé populaci [36].
Rohovka představuje jednu z nejvíce inervovaných tkání těla. Konfokální mikroskopie umožňuje znázornit průběh, množství a větvení nervových vláken rohovky a pomoci tak v diagnostice a sledování účinnosti léčby neuropatií.
Diskuse
Snaha vyšetřit fyziologickou a patologickou rohovku na buněčné úrovni vedla v posledních desetiletích k rychlému rozvoji nových vyšetřovacích metod, včetně konfokální mikroskopie. Význam má v diagnostice a vizualizaci patologických změn a regeneračních procesů rohovky, které nejsou sledovatelné při biomikroskopickém vyšetření štěrbinovou lampou. Cílem práce je stručné seznámení s principem metody a zhodnocení využití konfokální mikroskopie v klinické praxi. Tato zobrazovací metoda umožňuje diagnostiku rohovkových dystrofií (např. Coganovy mikrocystické dystrofie, centrální krystalové Schnyderovy dystrofie, granulární dystrofie, mřížkové dystrofie, Fuchsovy endoteliální dystrofie, atd.), sledování ultrastrukturálních změn rohovky u keratitid (bakteriálních, mykotických, virových atd.), keratokonu a regeneračních procesů po corneal cross-linkingu, fotorefrakční keratektomii, keratoplastikách atd. V práci jsou prezentovány naše zkušenosti a obrazová dokumentace pořízená konfokálním rohovkovým mikroskopem firmy Nidek Technologies, který využívá systém oscilující štěrbiny mikroskopické konfigurace a následnou analýzou je umožněno stanovit uložení jednotlivých patologií, tloušťky rohovky, včetně počtu endotelií. Budoucnost této vyšetřovací metody je i mimo obor oftalmologie, a to např. v onkologii při diagnostice a určování rozsahu nádorového onemocnění a jeho reakce na chemoterapii či radioterapii, dále v neurologii a diabetologii. Technologicky lze v brzké době očekávat možnost vytvoření trojrozměrného obrazu rohovky, což by rovněž přispělo k diagnostice a sledování účinnosti léčby např. neuropatií.
Závěr
Konfokální mikroskopie je moderní metoda umožňující vyšetřit lidskou rohovku na mikroskopické úrovni a významně pomoci v diagnostice a sledování různých rohovkových patologií. Rychlým rozvojem vyšetřovací technologie, zlepšováním kvality obrazu a komplexnějším zpracováním dat bude touto metodou jistě v budoucnu možné sledovat téměř všechny buněčné organely, struktury jádra a určit tak jejich úlohu v patogenezi jednotlivých onemocnění rohovky.
MUDr. Lenka Pirnerová
Oční klinika LF MU a FN Brno
Jihlavská 20
625 00 Brno
e-mail: lpirnerova@fnbrno.cz
tel.: 532 233 302
Zdroje
1. Auran, J.D., Starr, M.B., Koester, Ch. J., et al.: In vivo scanning slit confocal microscopy of acanthamoeba keratitis. A Case Report Cornea, 1994, 13, 2 : 183–185.
2. Calvillo, M.P., Mc Laren, J.W., Hodge, D.O., et al.: Corneal reinnervation after LASIK: prospective 3-year longitudinal study. IOVS, 2004, 45 : 3991–3996.
3. Cavanagh, H.D., McCulley, J.P.: In vivo confocal microscopy and acanthamoeba keratitis. Am J Ophthalmol, 1996, 121, 2 : 129–142.
4. Cavanagh,H.D., Petroll, W.M., Alizadeh H, et al.: Clinical and diagnostic use of in vivo confocal microscopy in patiens with corneal disease. Ophthalmology, 1993, 100, 10 : 1444–1454.
5. Eckard, A., Stave, J., Guthoff, R.F.: In vivo investigations of the corneal epithelium with the confocal Rostock Laser Scanning Microscope (RLSM). Cornea, 2006, 25, 2 : 127–131.
6. Efron, N., Perez-Gomez, I., Morgan, P.B.: Confocal microscopic observations of stomal keratocytes during extended contact lens wear. Clin Exper Optom, 2002, 85, 3 : 156–160.
7. Efron, N., Perez-Gomez, I., Mutalib, H.A. et al.: Confocal microscopy of the normal human cornea. Cont Lens Anterior Eye, 2001, 24, 1 : 16–24.
8. Guthoff, R.F., Zhivov,A. , Stachs,O.: In vivo confocal microscopy, an inner vision of the cornea - a major review. Clin Exper Ophthalmol, 2009, 37, 1 : 100–117.
9. Hlinomazová Z., Loukotová V., Vlková E., Pirnerová L. et al.: Změny rohovkových struktur po CCL v obraze konfokálního mikroskopu. In: Sborník abstrakt XVI. výročního sjezdu ČOS s mezinárodní účastí. Ed. Nukleus HK, 2008, 12–13, ISBN 978-800-87009-53–6.
10. Hollingsworth, J., Perez-Gomez, I., Mutalib, H.A., et al.: A population based study of the normal cornea using an in vivo slit scanning confocal microscope. Opt Vis Sci, 2001, 78, 10 : 706–711.
11. Hollingsworth, J.G., Efron, N., Tullo, A.B.: In vivo corneal confocal microscopy in keratoconus. Ophthalmic Physiol Opt, 2005, 24, 3 : 254–260.
12. Chew, S.J., Beuerman, R.W, Roger,W. et al.: Early diagnosis of infectious keratitis with in vivo real time confocal microscopy. CLAO Journal, 1992, 18, 3 : 197–201.
13. Chiou, A.G., Kufman, S.C., Beuerman, R.W., et al.: Confocal microscopy in cornea guttata and Fuchsę endotelial dystrophy. Br J Ophthalmol, 1999, 83, 2 : 185–189.
14. Inoue, K., Kato, S., Inoue, Y. et al.: The corneal endothelium and thickness in type II diabetes mellitus. Jpn J Ophthalmol, 2002, 46, 1 : 65–69.
15. Joyce, N.C.: Proliferative capacity of the corneal endotelium. Progress in Retinal and Eye Research. 2003, 22 : 3, 359–389.
16. Kallinikos, P., Morgan, P., Efron, N.: On the etiology of keratocyte loss during contact lens wear. Invest Ophthalmol Vis Sci, 2004, 45 : 3011–3020.
17. Kaufman, S.C., Musch, D.C., Belin, M.W., et al.: Confocal microscopy: a report by the American Academy of Ophthalmology. Ophthalmology, 2004, 111, 2 : 396–406.
18. Kuchyňka, P. et al.: Oční lékařství. Grada publishing, 2007, 218–222, ISBN 978-80-247-1163-8.
19. Lee, J.S., Oum, B.S., Choi, H.Y., et al.: Differences in corneal thickness and corneal endothelium related to durativ in diabetes. Eye, 2006, 20 : 315–318.
20. Mannion, L. S., Tromans, C., O’Donnell, C. P.: Nerve structure and function in keratoconus. A Case Report. Eye & Contact Lens. Science & Clinical Practice. 2007, 33, 2 : 106–108.
21. Mastropasqua, L., Nubile, M.: Confocal microscopy of the cornea. SLACK Incorporated, 2002 : 1–112, ISBN 1-55642-611-9.
22. Mathers, W.D., Sutphin, J.E., Folberg, R., et al.: Outbreak of keratitis presumed to be caused by Acanthamoeba. Am J Ophthalmol, 1996, 121, 2 : 129–142.
23. Meek, K.M.,Tuft S.C., Huang Y., et al. Changes in collagen orientation and distribution in keratoconus corneas Inv Ophthalmol Vis Sci, 2005, 46 : 1048–1956.
24. Mocan, M.C., Durukan, I., Irkec, M. et al.: Morphologic alterations of both the stromal and subbasal nerves in the corneas of patiens with diabetes. Cornea, 2006, 25, 7 : 769–773.
25. Mustonen, R.K., Mc Donald, M.B., Srivannaboon, S. et al.: Normal human corneal cell populations evaluated by in vivo scanning slit confocal microscopy. Cornea, 1998, 17, 5 : 485–492.
26. Obata, H., Ishida, K., Murao, M., Miyata, K., et al.: Corneal endotelial cell damage in penetrating keratoplasty. Jpn J Ophthalmol, 1991, 35, 4 : 411–416.
27. Patel, D.V., McGhee, CH. N. J.: Mapping the corneal sub-basal nerve plexus in keratoconus by in vivo laser scanning confocal microscopy. Investigative Ophthalmol Vis Sci, 2006, 47 : 1348–1351.
28. Patel, S., Reinstein, D.Z., Silverman, R.H. et al.: The shape of Bowman’s layer in the human cornea. J Refract Surg, 1998, 14, 6 : 636–640.
29. Pfister, D.R., Cameron, J.D., Krachmer, J.H., et al.: Confocal microscopy findings of acanthamoeba keratitis. Am J Ophthalmol, 1996, 121, 2 : 119–128.
30. Pirnerová L., Horáčková M., Hlinomazová Z., et al.: Ultrastrukturální změny rohovky po PRK a LASIK v obrazech konfokálního mikroskopu, In: Sborník abstrakt XVII. výročního sjezdu České oftalmologické společnosti. Praha, 2009, 85–86, ISBN 978-80-254-5321-6.
31. Pisella, P.J., Auzerie, O., Bokobza, Y. et al. : Evaluation of corneal stromal changes in vivo after laser in situ keratomileusis with confocal microscopy. Ophthalmology, 2001, 108, 10 : 1744–1750.
32. Popper, M., Morgado, A.M., Quadrado, M.J., et al.: Corneal cell density measurement in vivo by scanning slit confocal microscopy. Method and validation. Ophthalmic Res, 2004, 36, 5 : 270–6.
33. Richter, A., Slowik, C., Somodi, S., et al.: Corneal reinnervation following penetrating keratoplasty. Correlation of esthesiometry and confocal microscopy Ger J Ophthalmol, 1996, 5, 6 : 513–517.
34. Rosenberg, M.E., Tervo, M., Immonen, I.J., et al.: Corneal structure and sensitivity in type I diabetes mellitus. Invest Ophthalmol Vis Sci, 2000, 41 : 2915–21.
35. Rosenberg, M.E., Tervo, T.M., Muller, L.J., et al.: In vivo confocal microscopy after herpes keratitis. Cornea, 2002, 21, 3, 265–269.
36. Roszkowska, A.M., Tringali, C.G., Colosi, P., et al.: Corneal endothelium evaluation in type I and type II diabetes mellitus. Ophthalmologica, 1999, 213, 4 : 258–261.
37. Somodi,S., Hahnel, C., Slowik, C., et al.: Confocal in vivo microscopy and confocal laser-scanning fluorescence microscopy in keratoconus. Ger J Ophthalmol, 1996, 5, 6 : 518–625.
38. Tavakoli, M.,Hossain, P., Malik, R. : Clinical applications of corneal confocal microscopy. Clin Ophthalmol, 2008, 2 : 435–445.
39. Tomii, S., Kinoshita, S.: Observations of human corneal epithelium by tandem scanning confocal microscope. Scanning, 1994, 16, 3 : 305–306.
40. Vesaluoma, M., Pérez–Santonja, J., Petroll, W.M. et al.: Corneal stromal changes induced by myopic LASIK. Invest. Ophthalmol Vis Sci, 2000, 41 : 369–376.
41. Winchester, K., Mathers, W. D. , Sutphin, J.E. et al.: Diagnosis of acanthamoeba keratitis in vivo with confocal microscopy. Cornea, 1995, 14, 1 : 10–17.
42. http://www.microscopyu.com/articles/confocal/confocalintro basics.html
Štítky
Oftalmológia
Článok vyšiel v časopiseČeská a slovenská oftalmologie
Najčítanejšie tento týždeň
2010 Číslo 6- Cyklosporin A v léčbě suchého oka − systematický přehled a metaanalýza
- Dlouhodobé výsledky lokální léčby cyklosporinem A u těžkého syndromu suchého oka s 10letou dobou sledování
- Účinnost a bezpečnost 0,1% kationtové emulze cyklosporinu A v léčbě těžkého syndromu suchého oka − multicentrická randomizovaná studie
- Pomocné látky v roztoku latanoprostu bez konzervačních látek vyvolávají zánětlivou odpověď a cytotoxicitu u imortalizovaných lidských HCE-2 epitelových buněk rohovky
- Konzervační látka polyquaternium-1 zvyšuje cytotoxicitu a zánět spojený s NF-kappaB u epitelových buněk lidské rohovky
-
Všetky články tohto čísla
- Využití konfokální mikroskopie rohovky v klinické praxi
- Corneal cross-linking – moderná metóda liečby keratokónusu
- Rohovkové aberace vyššího řádu u zdravého oka a jejich změny s věkem
- Klinické sledovanie účinnosti a bezpečnosti generického produktu UNILAT v terapii glaukómu a vnútroočnej hypertenzie
- Hluboká perforující trabekulektomie – až šestileté výsledky
- Kompenzácia zrakového postihnutia u detí prostredníctvom optických pomôcok
- Zemřel MUDr. Bohuslav Navrátil
- Česká a slovenská oftalmologie
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Rohovkové aberace vyššího řádu u zdravého oka a jejich změny s věkem
- Využití konfokální mikroskopie rohovky v klinické praxi
- Corneal cross-linking – moderná metóda liečby keratokónusu
- Hluboká perforující trabekulektomie – až šestileté výsledky
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy