-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Krvácení do aterosklerotického plátu u symptomatické a asymptomatické progredující stenózy vnitřní karotidy – pilotní studie
Intraplaque hemorrhage in symptomatic and asymptomatic progressive internal carotid artery stenosis – a pilot study
Aim: Intraplaque hemorrhage (IPH) belongs to potential mechanisms of plaque instability subsequently leading to ischemic stroke. Study aims to compare the IPH occurrence in patients with symptomatic (SS), asymptomatic stable (AS) and asymptomatic progressive (AP) internal carotid artery (ICA) stenosis ≥ 50%.
Materials and methods: Serial duplex ultrasound (DUS) in a 6-month period and MRI using axial 3DT1_MPRAGE sequence were used for IPH detection in patients with ICA stenosis. Stenoses in patients with ipsilateral ischemic stroke / transient ischemic attack within the previous 4 weeks or acute ischemic lesion on diffusion-weighted MRI sequencies were evaluated as symptomatic. Stenoses with progression of > 10% since last DUS examination were evaluated as progressive. Echolucent part of atherosclerotic plaque > 8 mm2 on DUS and hyperintensity on 3DT1_MPRAGE-MRI were evaluated as IPH. Differences in IPH occurrence between SS, AS and AP ICA stenoses were statistically evaluated.
Results: A total of 52 patients (33 males, mean age 69.2 ± 9.0 years) with 59 ICA stenoses were enrolled in the prospective study during 15 months; 13 ICA stenoses were evaluated as SS, 27 as AS and 19 as AP. IPH was detected using DUS/ MRI in 6 (46%) / 4 (30%) of SS, 12 (44%) / 8 (30%) of AS, and 11 (58%) / 11 (58%) of AP ICA stenoses (P > 0.05 in all cases). IPH was detected using combination of both methods in 3 (23%) of SS, 4 (15%) of AS, and 7 (36%) of AP ICA stenoses (P > 0.05 in all cases).
Conclusion: IPH was more frequently detected in asymptomatic progressive than asymptomatic stable ICA stenoses. No significant differences were found between occurrence of IPH in symptomatic than in asymptomatic progressive ICA stenoses. A total of 200 patients will be enrolled in the ongoing study.
The authors declare they have no potential conflicts of interest concerning drugs, products, or services used in the study.
The Editorial Board declares that the manuscript met the ICMJE “uniform requirements” for biomedical papers.
有症状和无症状进行性颈内动脉狭窄的斑块内出血–一项初步研究
目的:斑块内出血(IPH)属于斑块不稳定进而导致缺血性卒中的潜在机制。该研究旨在比较有症状(SS),无症状稳定(AS)和无症状进行性(AP)颈内动脉(ICA)狭窄≥50%的患者的IPH发生率。
材料和方法:将6个月的串行双工超声(DUS)和使用轴向3DT1_MPRAGE序列的MRI用于ICA狭窄患者的IPH检测。将同侧缺血性卒中/前4周内短暂性缺血性发作或弥散加权MRI序列的急性缺血性病变的患者进行症状评估。自上次DUS检查以来进展> 10%的狭窄被评估为进展性。在DUS上动脉粥样硬化斑块的回声部分> 8 mm2和在3DT1_MPRAGE-MRI上的高强度被评估为IPH。统计评估SS,AS和AP ICA狭窄之间IPH发生的差异。
结果:前瞻性研究共纳入52例患者(33例男性,平均年龄69.2±9.0岁),其59例ICA狭窄在15个月内进入研究。 13种ICA狭窄评估为SS,27种评估为AS,19种评估为AP。使用DUS / MRI检测到IPH在SS的6(46%)/ 4(30%),AS的12(44%)/ 8(30%)和AP的11(58%)/ 11(58%)中被检测到ICA狭窄(在所有情况下P> 0.05)。使用这两种方法的组合,在3个SS中(23%),4个AS(15%)和7个(36%)AP ICA狭窄中检测到IPH(在所有情况下P> 0.05)。
结论:无症状进行性IPH比无症状稳定ICA狭窄更为常见。在有症状的IPH与无症状的进行性ICA狭窄之间发生IPH之间没有发现显着差异。共有200名患者将参加正在进行的研究。
关键词:颈内动脉–狭窄–超声–斑块内出血
Keywords:
ultrasound – internal carotid artery – Stenosis – intraplaque hemorrhage
Autori: M. Roubec 1,2; D. Školoudík 1,2; T. Hrbáč 3; J. Havelka 4; T. Jonszta 4; R. Herzig 5
Pôsobisko autorov: Neurologická klinika, Komplexní cerebrovaskulární centrum, LF Ostravské Univerzity a FN Ostrava 1; Centrum vědy a výzkumu, Fakulta zdravotnických věd, UPOL, Olomouc 2; Neurochirurgická klinika LF Ostravské Univerzity a FN Ostrava 3; Radiologický ústav, FN Ostrava 4; Neurologická klinika, Komplexní cerebrovaskulární centrum, LF UK a FN Hradec Králové 5
Vyšlo v časopise: Cesk Slov Neurol N 2019; 82(6): 638-643
Kategória: Původní práce
doi: https://doi.org/10.14735/amcsnn2019638Súhrn
Cíl: Krvácení do aterosklerotického plátu (intraplaque hemorrhage; IPH) patří k potenciálním mechanizmům rozvoje nestability plátu, jež může vést k ischemickému iktu. Studie se zaměřuje na výskyt IPH v populaci pacientů se symptomatickou (SS), asymptomatickou stabilní (AS) a asymptomatickou progredující (AP) stenózou a. carotis interna (ACI) ≥ 50 %.
Materiál a metodika: Pro detekci IPH u pacientů se stenózou ACI byla použita série vyšetření duplexní sonografií (DS) v 6měsíčních intervalech a vyšetření MR s využitím axiálních sekvencí 3DT1_MPRAGE. Stenózy u pacientů s ipsilaterálním ischemickým iktem nebo tranzitorní ischemickou atakou v posledních 4 týdnech nebo nálezem akutní ischemické léze na difuzí vážených sekvencích MR byly hodnoceny jako symptomatické a stenózy s progresí o > 10 % od poslední DS pak jako progredující. Echolucentní část aterosklerotického plátu > 8 mm2 na DS a hyperintenzita na sekvenci 3DT1_MPRAGE MR byly zhodnoceny jako IPH. Rozdíly ve výskytu IPH mezi SS, AS a AP stenózami ACI byly statisticky zhodnoceny.
Výsledky: Celkem bylo v rozmezí 15 měsíců zařazeno do prospektivní studie 52 pacientů (33 mužů, průměrný věk 69,2 ± 9,0 let) s celkem 59 stenózami ACI; 13 stenóz bylo hodnoceno jako SS, 27 jako AS a 19 jako AP. IPH bylo detekováno pomocí DS/ MR u 6 (46 %) / 4 (30 %) SS, 12 (44 %) / 8 (30 %) AS a u 11 (58 %) / 11 (58 %) AP stenóz ACI (ve všech případech p > 0,05). Záchyt IPH při kombinaci obou metod byl u 3 (23 %) SS, 4 (15 %) AS a u 7 (36 %) AP stenóz ACI (ve všech případech p > 0,05).
Závěr: IPH bylo častěji pozorováno u asymptomatické progredující než u asymptomatické stabilní stenózy ACI. Nebyl nalezen žádný statisticky signifikantní rozdíl mezi výskytem IPH u symptomatické a progredující asymptomatické stenózy ACI. Do probíhající studie bude celkem zařazeno 200 pacientů.
Klíčová slova:
vnitřní karotida – stenóza – ultrazvuk – krvácení do plátu
Úvod
Ateroskleróza a její komplikace, především akutní koronární příhoda a CMP, jsou příčinou vice než 50 % úmrtí nejen v ČR, ale i celosvětově [1]. K nejčastějšímu výskytu aterosklerotických plátů a hemodynamicky významných stenóz patří oblast karotické bifurkace a odstupu a. carotis interna (ACI) [2]. Stenóza ACI nad 50 % pak náleží k častým příčinám ischemické CMP (iCMP), přičemž trombembolizmus z karotického plátu zapříčiňuje 10–15 % z nich [3].
Tíže (procento) karotické stenózy hraje velmi významnou úlohu při plánování preventivní léčby iCMP. Nicméně zvýšené riziko iCMP není závislé jen na tíži stenózy ACI, ale také na dalších faktorech, vč. některých charakteristik aterosklerotického plátu. Složení aterosklerotického plátu se zdá být zásadní pro jeho stabilitu a riziko rozvoje iCMP [4]. Krvácení do aterosklerotického plátu (intraplaque hemorrhage; IPH) je v současnosti považováno za jeden z nejdůležitějších potenciálních mechanizmů rozvoje nestabilních plátů se zvýšeným rizikem trombembolizmu [5]. IPH je pravděpodobně nejčastěji způsobeno rupturou v novotvořeném cévním řečišti plátu.
Za nestabilní aterosklerotický plát je považován takový plát, který je spojen se zvýšeným rizikem jeho ruptury, tvorbou trombu na povrchu plátu, trombózou tepny v místě plátu nebo trombembolií do distálního arteriálního řečiště a následným vznikem iCMP. Klíčovou otázkou současnosti je, jak spolehlivě detekovat takový nestabilní aterosklerotický plát a určit jeho rizikovost pro zvolení optimální preventivní terapie.
K morfologickému hodnocení aterosklerotických plátů lze využít kromě histologie také neinvazivní, běžně dostupné diagnostické metody – MR a duplexní sonografii (DS). Pomocí MR lze detekovat IPH, charakter lipidového jádra, přítomnost trombu na plátu, fibrózní obsah v aterosklerotickém plátu. Vyšetření DS pak umožňuje zhodnotit echogenitu, IPH, kalcifikace nebo povrchové nepravidelnosti [3]. Recentní studie pak prokázaly, že přítomnost IPH v karotickém plátu patří z morfologických charakteristik k nejsilnějším prediktorům ipsilaterální iCMP [5].
Účelem prezentované prospektivní observační studie je potvrdit hypotézu, že IPH vede k progresi a symptomatičnosti karotické stenózy. Primárním cílem pilotní fáze studie bylo srovnat zastoupení IPH u pacientů se symptomatickou stenózou (SS) ACI, pacientů s asymptomatickou progredující (AP) a asymptomatickou stabilní stenózou (AS) ACI ≥ 50 %. Sekundárním cílem bylo srovnat MR a DS v diagnostice IPH a detekovat rizikové faktory IPH v karotickém plátu.
Materiál a metodika
Pacienti
Do pilotní fáze prospektivní observační studie byli během 15 měsíců (srpen 2017–říjen 2018) konsekutivně zařazeni pacienti se stenózou ACI 50–99 % detekovanou při vyšetření DS v rámci studie Atherosclerotic Plaque Characteristics Associated with a Progression Rate of the Plaque in Carotids and a Risk of Stroke (ANTIQUE). Do studie ANTIQUE byli pacienti zařazováni od srpna 2015 [6].
Vstupní kritéria byla následující: 1. muž nebo žena; 2. ve věku 25–80 let; 3. detekovaná stenóza ACI 50–99 % při vyšetření DS; 4. podpis informovaného souhlasu.
Vylučujícími kritérii byly: 1. okluze ACI; 2. implantovaný kardiostimulátor nebo klaustrofobie jako kontraindikace provedení MR krku a mozku; 3. nekontrolovatelné pohyby hlavy a krku.
U všech zařazených pacientů byla provedena neurologické a fyzikální vyšetření, DS krčních tepen se zaměřením na vyhodnocení struktury aterosklerotického plátu v UZ B-obraze a MR krku a mozku (s maximálním odstupem 14 dní mezi vyšetřením DS a MR).
Duplexní sonografie karotických tepen
Pacienti s asymptomatickou karotickou stenózou ≥ 50 % zařazení do studie ANTIQUE absolvovali sérii čtyř vyšetření karotických tepen DS v 6měsíčních intervalech. Stenóza s progresí ≥ 10 % dle hodnocení North American Symptomatic Carotid Endarterectomy Trial (NASCET) [7] mezi libovolnými dvěma vyšetřeními DS, avšak bez klinických známek iCMP nebo tranzitorní ischemické ataky (TIA) či známek ischemie na MR mozku v povodí dané tepny byla hodnocena jako AP stenóza. Stenóza se změnami méně než 10 % během sledování a bez klinických známek iCMP nebo TIA či známek ischemie na MR mozku v povodí dané tepny byla vyhodnocena jako AS stenóza. Stenózy u pacientů s ipsilaterální iCMP nebo TIA během posledních 4 týdnů nebo s akutní ischemickou lézí na MR mozku byly vyhodnoceny jako SS. Symptomatika tak byla hodnocena retrospektivně a pacienti byli vyšetřeni až po proběhlé příhodě. U většiny symptomatických pacientů bylo provedeno jen jedno vyšetření DS před zařazením do studie.
Pro vyšetření DS byly použity UZ přístroje ESAOTE MyLab Twice (Esaote, Janov, Itálie) a lineární sonda s emisní frekvencí 5–12 MHz. U všech pacientů byly změřeny úhlově korigovaná maximální systolická rychlost (peak systolic velocity), konečná diastolická rychlost (end-diastolic velocity), průměrná průtoková rychlost (mean flow velocity), velikost (šířka) aterosklerotického plátu, reziduální průměr tepny v místě stenózy, průměry tepny jak v oblasti stenózy, tak distálně za stenózou.
Vyhodnocení složení aterosklerotického plátu v karotické tepně bylo provedeno v B-obraze. Byly hodnoceny echogenita (echolucentní, nízce echogenní, echogenní, hyperechogenní, kalcifikovaný plát), homogenita (homogenní, heterogenní) a povrch plátu (hladký, nepravidelný, ulcerovaný). Echolucentní (anechogenní) část aterosklerotického plátu > 8 mm2 byla hodnocena jako IPH (obr. 1). Vyšetření DS bylo provedeno u všech pacientů dvěma zkušenými sonografisty (D. Š. a M. R.).
Obr. 1. Echolucentní (anechogenní) část aterosklerotického plátu > 8 mm2 hodnocená jako krvácení do aterosklerotického plátu na duplexní sonografi i.
Fig. 1. Echolucent part of atherosclerotic plaque > 8 mm2 on duplex ultrasound evaluated as intraplaque hemorrhage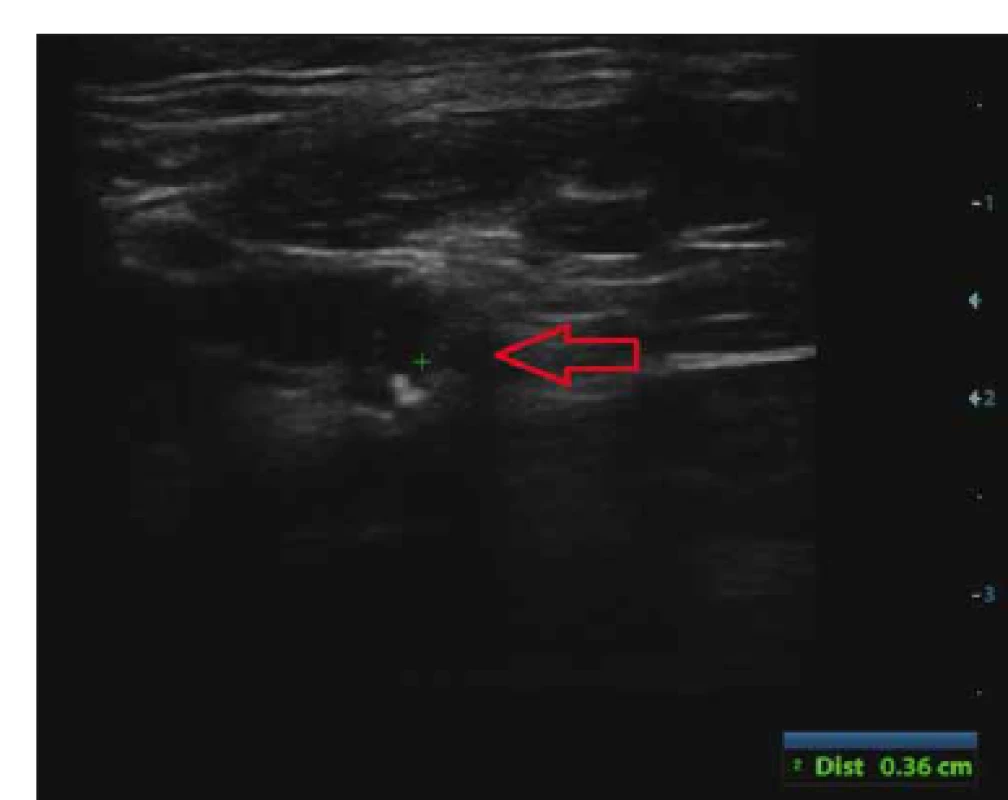
Obr. 2. Hyperintenzita na 3D T1_MPRAGE krčních obrazech MR hodnocená jako krvácení do aterosklerotického plátu.
Fig. 2. Hyperintensity on 3D T1_MPRAGE-MRI evaluated as intraplaque hemorrhage.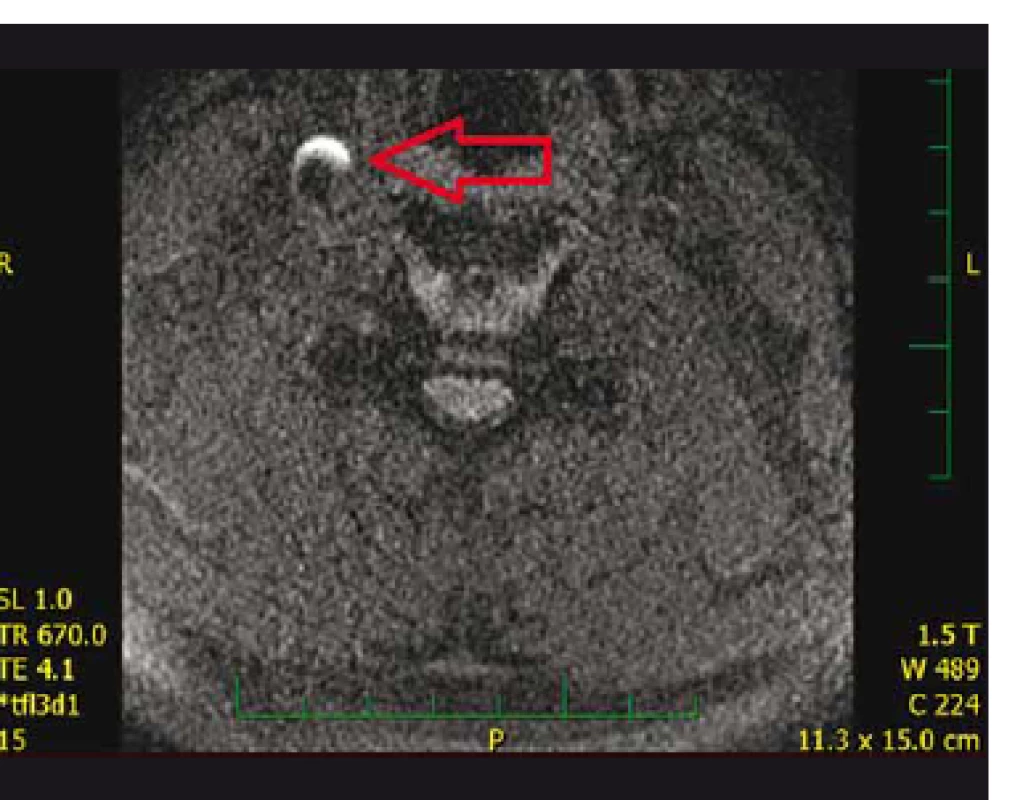
Magnetická rezonance
Vyšetření MR bylo provedeno v rozmezí 14 dní od vyšetření DS na přístroji Siemens 1.5 T Avanto (Siemens, Erlangen, Německo). U všech pacientů byla provedena vyšetření MR karotických tepen a vyšetření MR mozku.
Protokol vyšetření karotických tepen se skládal ze 4 sekvencí:
- 1T1-vážené_TSE_FatSat sekvence, axiální řezy (čas echa [echo time; TE] 19 ms, repetiční čas [repetition time; TR] 600 ms; šířka vrstvy [slice thickness; ST] 3 mm; velikost matrix [matrix size] 230 × 256; distanční faktor [gap] 0,3 mm; zobrazovaná oblast [field of view; FOV] 256 mm; fáze FOV [FOV phase] 100 %; Turbo factor [TF] 2; počet excitací [number of excitations; NEX] 2; délka sekvence 3 : 50 min).
- 3D T1_MPRAGE sekvence, axiální řezy, IPH senzitivní (TE 4 ms; TR 670 ms; inverzní čas [inversion time; TI] 370 ms, ST 1 mm; matrix size 192 × 256; gap 0 mm; FOV 180 mm; FOV phase 75; Q3 NEX 3; délka sekvence 5 : 49 min).
- T2-vážené TSE sekvence, axiální řezy (TE 72 ms; TR, 4580 ms; ST, 4 mm; matrix size 294 × 384; gap 0,4 mm; FOV 230 mm; FOV phase 100, TF 14; Q3 NEX 2; délka sekvence 3 : 18 min).
- 3D TOF sekvence, axiální řezy (TE 7 ms; TR 24 ms; ST 1 mm; matrix size, 198 × 384; gap 0 mm; FOV 200 mm; FOV phase 75 %; Q3 NEX 1; délka sekvence 2 : 43 min).
Protokol vyšetření MR mozku se skládal také ze 4 sekvencí:
- T2-vážené spin echo sekvence (TE 100 ms; TR 4 310 ms; ST 5,0 mm; matrix size, 192 × 256; gap 0,5 mm; FOV 250 mm; FOV phase 75 %; echo train length [ETL] 9; Q3 NEX 1).
- difúzí-vážené (diffusion-weighted; DWI) sekvence (TE 130 ms; TR 4 500 ms; b faktor DW sekvencí 0 a 1 000 s/ mm2; ST 5,0 mm; gap 1 mm; matrix size 192 × 192; FOV 255 mm; FOV phase 100 %; NEX 4; šířka pole [bandwidth] 1240 Hz/ pixel) s mapou ADC (apparent diffusion coefficient).
- T2*-vážené gradient-recalled echo sekvence na detekci krvácení, vč. mikrokrvácení.
- Fluid-attenuated inversion recovery (FLAIR) sekvence (TE 109 ms; TR 8 000 ms; TI 2 500 ms; ST 5,0 mm; matrix size 256 × 151; gap 0,5 mm; FOV 250 mm; FOV phase 77 %; NEX 1; ETL 5).
Hyperintenzity na 3D_T1_MPRAGE krčních obrazech MR byly hodnoceny jako IPH (obr. 2). Hyperintenzní ložiska na DWI obrazech MR mozku byla hodnocena jako čerstvá ischemie.
Klinická vyšetření a demografická data
Všichni pacienti byli vyšetřeni neurologem se zhodnocením neurologického deficitu pomocí škály National Institutes of Health Stroke Scale (NIHSS). Soběstačnost byla zhodnocena pomocí modifikované Rankinovy škály (mRS). Byla zaznamenána následující anamnestická data: věk, pohlaví, strana stenózy ACI, procento stenózy ACI dle DS a CTA, anamnéza arteriální hypertenze, diabetu mellitu, hyperlipidemie, fibrilace síní a jakékoliv iCMP či TIA v anamnéze. Dále byly zaznamenány údaje o užívání protidestičkové terapie a statinu, anamnéza kouření a množství denní konzumace alkoholu (1 jednotka = 0,5 l 12° piva nebo 1,5 dl vína nebo 0,5 dl destilátu) [8].
Etické principy
Studie byla provedena ve shodě s Helsinskou deklarací z roku 1975 (a jejími revizemi z let 2004 a 2008). Studie byla schválena lokální etickou komisí FN Ostrava (605/ 2014-FNO). Všichni pacienti podepsali informovaný souhlas s účastí ve studii. Studie byla registrována před zařazením prvního pacienta na: www.clinicaltrials.gov (Identified: NCT02360137).
Statistika
Normalita rozložení dat byla testována Shapir-Wilkovým testem. Data s normálním rozložením jsou prezentována formou průměru a směrodatné odchylky, ostatní data formou mediánu, průměru a směrodatné odchylky. Kategorické proměnné byly porovnávány pomocí Fisherova přesného testu, kontinuální proměnné pomocí Mann-Whitneyho U testu. Následující proměnné byly použity v univariantní a multivariantní logistické regresní analýze (metoda Enter): věk, pohlaví, strana stenózy, procento stenózy, arteriální hypertenze, diabetes mellitus, hyperlipidemie, infarkt myokardu, fibrilace síní, iCMP/ TIA v anamnéze, kouření, denní dávka alkoholu, užívání protidestičkových léků a statinu.
Statistická signifikance byla definována hodnotou p < 0,05. Následně byla provedena korekce dle Bonferroniho pro zhodnocení vlivu všech 14 parametrů na výskyt IPH s p < 0,0036. Data byla analyzována pomocí software SPSS v.22.0 software (IBM, Armonk, NY, USA).
Výsledky
Do studie bylo během 15 měsíců zařazeno 52 pacientů (33 mužů, průměrný věk 69,2 ± 9,0 let); celkem bylo vyhodnoceno 59 stenotických tepen, z nichž bylo 27 AS, 19 AP a 13 SS. Vyšetření DS a MR bylo provedeno u všech 52 zařazených.
Demografická data zařazených pacientů jsou uvedena v tab. 1. Mezi jednotlivými skupinami nebyly statisticky významné rozdíly v žádném parametru mimo výskytu iCMP/ TIA v anamnéze, které se vyskytovaly signifikantně častěji u pacientů se SS. Jeden pacient s AS a jeden pacient s AP měli v anamnéze fibrilaci síní, po farmakologické verzi v minulosti verzi u obou pacientů s trvajícím sinusovým rytmem, v době zařazení do studie byli oba na protidestičkové léčbě klopidogrelem v dávce 75 mg/ den. Oba pacienti byli asymptomatičtí, fibrilace síní tedy jejich zařazení do studijní skupiny a vyhodnocení výsledků neovlivnila.
Tab. 1. Demografická data. 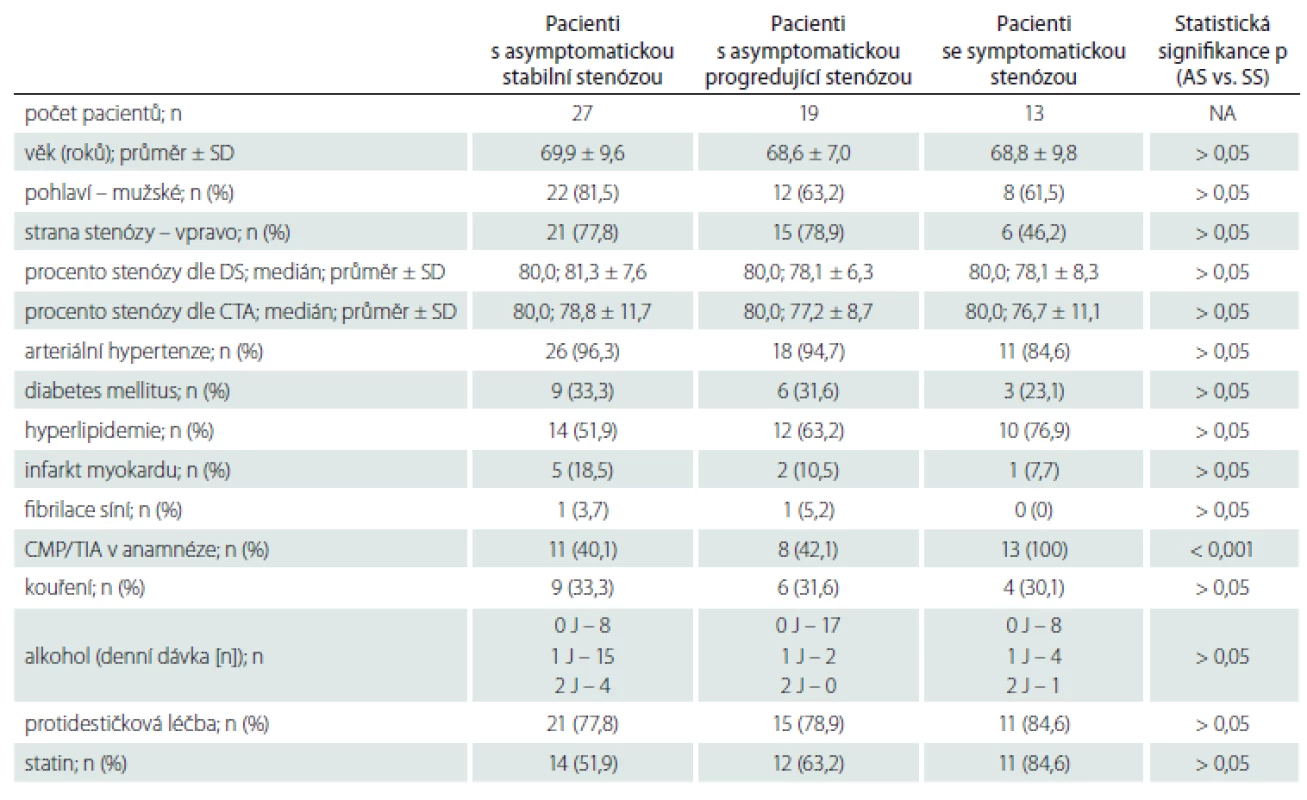
DS – duplexní sonografie; J – jednotka; n – počet; NA – nehodnoceno; SD – směrodatná odchylka; TIA – tranzitorní ischemická ataka Nálezy IPH na DS a MR u pacientů s AS, AP a SS uvádíme v tab. 2. Statisticky signifikantního rozdílu ve výskytu IPH mezi pacienty s AS a SS nebylo dosaženo žádnou z metod. Nález IPH na MR a při kombinaci DS + MR u AP však ukazuje pozitivní trend oproti pacientům s AS (p = 0,073, resp. 0,159). Shoda v hodnocení přítomnosti/nepřítomnosti IPH byla u 36 (61,0 %) pacientů.
Tab. 2. Nálezy krvácení do plátu na DS a MR u pacientů s různými typy stenózy 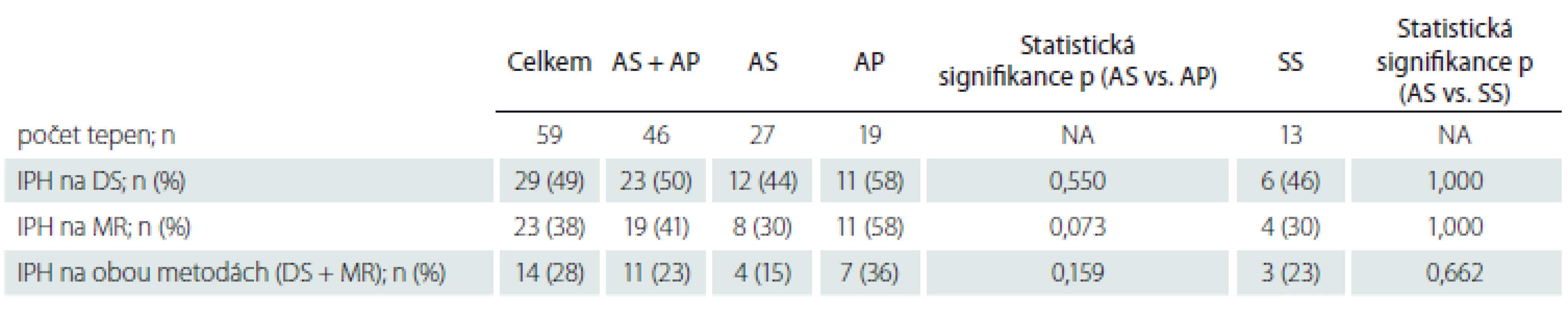
AP – asymptomatická progredující stenóza; AS – asymptomatická stabilní stenóza; DS – duplexní sonografie; IPH – krvácení do plátu; n – počet; SS – symptomatická stenóza Zastoupení jednotlivých sledovaných faktorů u pacientů s výskytem IPH a bez IPH na DS, MR nebo obou použitých metodách uvádíme v tab. 3–5. Rozdíl ve výskytu žádného ze sledovaných faktorů nedosáhl statistické signifikance po Bonferroniho korekci. Trend vyššího výskytu IPH byl zaznamenán u pacientů s diabetem mellitem a ve vyšším věku.
Tab. 3. Zastoupení sledovaných faktorů u pacientů s a bez krvácení do plátu na obou metodách (MR i DS). 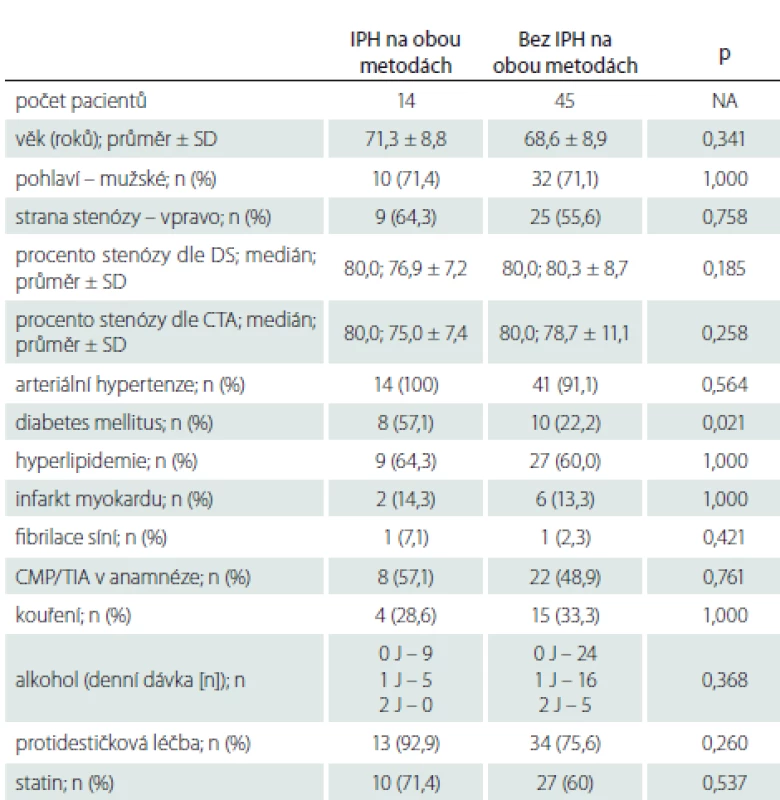
DS – duplexní sonografi e; IPH – krvácení do plátu; J – jednotka; n – počet; SD – směrodatná odchylka; TIA – tranzitorní ischemická ataka Tab. 4. Zastoupení jednotlivých sledovaných faktorů u pacientů s a bez krvácení do plátu na MR. 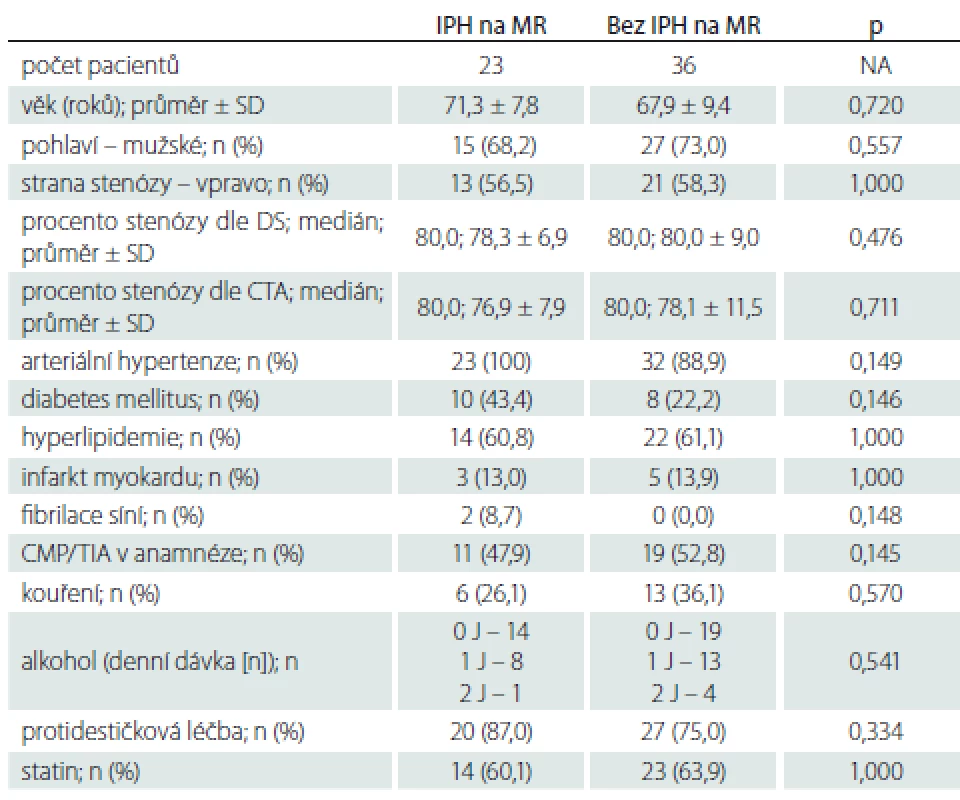
IPH – krvácení do plátu; J – jednotka; n – počet; SD – směrodatná odchylka; TIA – tranzitorní ischemická ataka Tab. 5. Zastoupení jednotlivých sledovaných faktorů u pacientů s a bez krvácení do plátu na DS 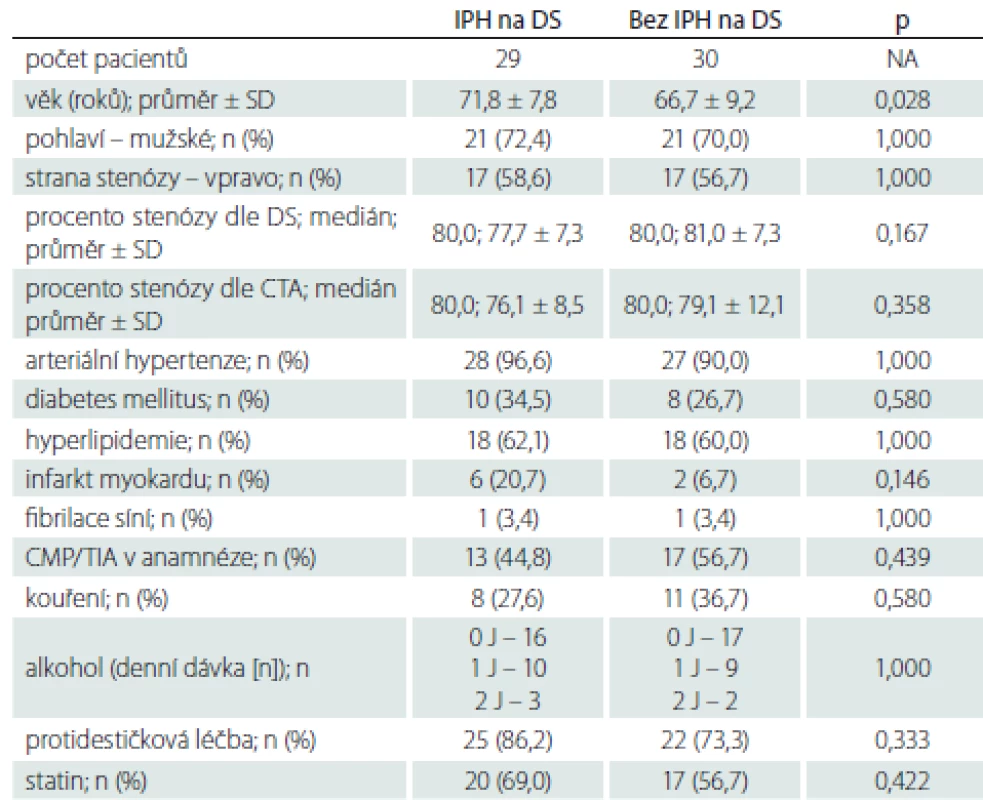
DS – duplexní sonografie; IPH – krvácení do plátu; J – jednotka; n – počet; SD – směrodatná odchylka; TIA – tranzitorní ischemická ataka Multivariantní logistická regresní analýza neprokázala u žádného ze sledovaných faktorů signifikantní vliv na výskyt IPH detekovaného pomocí DS, MR nebo obou metod.
Diskuze
Pilotní výsledky prezentované studie sice neprokázaly signifikantní rozdíl ve výskytu IPH mezi pacienty se symptomatickou a asymptomatickou stenózou karotidy, ale ukázaly, že pravděpodobně existuje rozdíl ve výskytu IPH mezi pacienty se stabilní a progredující stenózou karotidy. Navíc shoda detekce IPH mezi DS a MR byla pouze u 61 % pacientů. To lze vysvětlit možnou záměnou IPH za lipidové jádro a naopak u výrazně hypoechogenních plátů. Obdobná studie porovnávající výskyt IPH na DS a MR ke srovnání nebyla zatím provedena. Většina studií se věnovala vztahu MR nálezu k symptomaticitě či histologickým nálezům. Přímé srovnání tak není možné provést.
V publikovaných histopatologických studiích nález IPH silně koreloval s nálezy na MR [6,9,10] a DS [11]. Byla nalezena silná korelace mezi výskytem IPH a budoucími ischemickými příhodami při prospektivním sledování [12]. Lusby et al ve starší histopatologické studii [13] popsali IPH u signifikantně většího procenta pacientů se symptomatickou stenózou oproti pacientům se stenózou asymptomatickou (93 vs. 27 %). Nálezy IPH v jiných MR studiích byly popsány u 30–36 % stenóz ≥ 50 % [14,15].
V prezentované pilotní studii bylo detekováno IPH pomocí MR v obdobném procentu u SS (30 %) jako u asymptomatických stenóz (AS + AP 41 %). V recentně publikované retrospektivní studii také nebyla nalezena korelace mezi histologicky verifikovaným výskytem IPH v plátu a prediktivním rizikem ipsilaterálního iktu u pacientů podstoupivších karotickou endarterektomii pro symptomatickou stenózu [16].
Žádná relevantní data k výskytu IPH u stabilních vs. progredujících stenóz nebyla dosud publikována [17]. V naší studii pozorujeme statisticky nesignifikantně vyšší výskyt IPH u pacientů s AP (36 vs. 15 % u AS). Obdobně v dříve publikovaných studiích byl výskyt IPH vyšší u stenóz, u nichž došlo následně k iktu či TIA [12], IPH je tedy pravděpodobně jedním z hlavních mechanizmů progrese plátu. Tato hypotéza musí být potvrzena v dalších studiích.
Všichni pacienti v naší studii s recentním iktem či TIA, tedy se symptomatickou stenózou, byli vyšetřeni v rozmezí 4 týdnů od příznaků. Nižší výskyt IPH u těchto retrospektivně symptomatických stenóz (23 %) ve srovnání s AP (36 %) může být způsoben rupturou plátu a vymizením („vyplavením“, resorpcí) IPH. Otázkou je, proč nalézáme IPH i u AS stenóz, i když v malém procentu (v naší studii 15 % při kombinaci nálezu MR a DS).
Relativně malý počet zařazených pacientů v pilotní studii je pravděpodobně důvodem, že žádný ze sledovaných faktorů nebyl prokázán jako nezávislý prediktor IPH. Nesignifikantní trend byl nalezen u vyššího věku a diabetu mellitu. Nicméně nejsilnějším rizikovým faktorem jak iCMP, tak aterosklerózy je arteriální hypertenze [18–20]. V našem souboru bylo pro arteriální hypertenzi léčeno více než 90 % pacientů. Nicméně kromě samotného výskytu arteriální hypertenze může hrát výraznou roli také její kompenzace. Dosud však nebyly provedeny žádné studie posuzující vliv kompenzace krevního tlaku na vznik IPH.
Závěr
Nález IPH na DS i MR byl nesignifikantně častější u pacientů s AP stenózou ve srovnání s pacienty s AS stenózou nebo pacientů se SS. Shoda v nálezu IPH mezi DS a MR byla v 61 % případů. Pro průkaz signifikantního rozdílu v přítomnosti IPH mezi jednotlivými typy stenóz a pro posouzení vlivu jednotlivých faktorů je plánováno zařadit do studie celkem 200 pacientů.
Podpořeno z programového projektu Ministerstva zdravotnictví ČR s reg. č. 16-30965A, 17-31016A a částečně MZ ČR – RVO (FNHK, 00179906), Univerzitou Karlovou (PROGRES Q40) a Univerzitou Palackého (JG_2019_004).
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
MUDr. Martin Roubec, Ph.D.
Neurologická klinika
LF Ostravské Univerzity
a FN Ostrava
17. listopadu 1790/5
708 52 Ostrava
e-mail: martin.roubec@fno.cz
Přijato k recenzi: 26. 8. 2019
Přijato do tisku: 3. 10. 2019
Zdroje
-
Thrift AG, Thayabaranathan T, Howard .G et al. Global stroke statistics. Int J Stroke 2017; 12(1): 13–32. doi: 10.1177/ 1747493016676285.
-
Phan TG, Beare RJ, Jolley D et al. Carotid artery anatomy and geometry as risk factors for carotid atherosclerotic disease. Stroke 2012; 43(6): 1596–1601. doi: 10.1161/ STROKEAHA.111.645499.
-
Aboyans V, Ricco JB, Bartelink ME et al. 2017 ESC Guidelines on the diagnosis and treatment of peripheral arterial diseases, in collaboration with the European Society for Vascular Surgery (ESVS): document covering atherosclerotic disease of extracranial carotid and vertebral, mesenteric, renal, upper and lower extremity. Eur Heart J 2018; 39(9): 763–816. doi: 10.1093/ eurheartj/ ehx095.
-
Kešnerová P, Viszlayová D, Školoudík D. Detekce nestabilního karotického plátu v prevenci ischemické cévní mozkové příhody. Cesk Slov Neurol N 2018; 81/ 114(4): 378–391. doi: 10.14735/ amcsnn2018378.
-
Treiman GS, McNally JS, Kim SE et al. Correlation of carotid intraplaque hemorrhage and stroke using 1.5 T and 3 T MRI. Magn Reson Insights 2015; 8 (Suppl 1): 1–8. doi: 10.4137/ MRI.S23560.
-
Roubec M, Školoudík D, Herzig R et al. Intraplaque hemorrhage in symptomatic and asymptomatic progressive carotidartery stenosis – pilot study. Eur J Neurol 2018; 25 (Supp 1): P12.
-
North American Symptomatic Carotid Endarterectomy Trial. Methods, patient characteristics, and progress. Stroke 1991; 22(6): 711–720. doi: 10.1161/ 01.str.22.6.711.
-
Herzig R, Urbánek K, Vlachová I et al. The role of chronic alcohol intake in patients with spontaneous intracranial hemorrhage: a carbohydrate-deficient transferrin study. Cerebrovasc Dis 2003; 15(1–2): 22–28. doi: 10.1159/ 000067118.
-
Puppini G, Furlan F, Cirota N et al. Characterisation of carotid atherosclerotic plaque: comparison between magnetic resonance imaging and histology. Radiol Med 2006; 111(7): 921–930. doi: 10.1007/ s11547-006-0091-7.
-
den Hartog AG, Bovens SM, Koning W et al. Current status of clinical magnetic resonance imaging for plaque characterisation in patients with carotid artery stenosis. Eur J Vasc Endovasc Surg 2013; 45(1): 7–21. doi: 10.1016/ j.ejvs.2012.10.022.
-
Reilly LM, Lusby RJ, Hughes L et al. Carotid plaque histology using real-time ultrasonography. Clinical and therapeutic implications. Am J Surg 1983; 146(2): 188–193. doi: 10.1016/ 0002-9610(83)90370-7.
-
Altaf N, Daniels L, Morgan PS et al. Detection of intraplaque hemorrhage by magnetic resonance imaging in symptomatic patients with mild to moderate carotid stenosis predicts recurrent neurological events. J Vasc Surg 2008; 47(2): 337–342. doi: 10.1016/ j.jvs.2007.09.064.
-
Lusby RJ, Ferrell LD, Ehrenfeld WK et al. Carotid plaque hemorrhage. Its role in production of cerebral ischemia. Arch Surg 1982; 117(11): 1479–1488. doi: 10.1001/ archsurg.1982.01380350069010.
-
Lovett JK, Gallagher PJ, Hands LJ et al. Histological correlates of carotid plaque surface morphology on lumen contrast imaging. Circulation 2004; 110(15): 2190–2197. doi: 10.1161/ 01.CIR.0000144307.82502.32.
-
Singh N, Moody AR, Gladstone DJ, et al. Moderate carotid artery stenosis: MR imaging – depicted intraplaque hemorrhage predicts risk of cerebrovascular ischemic events in asymptomatic men. Radiology 2009; 252(2): 502–508. doi: 10.1148/ radiol.2522080792.
-
Howard DP, van Lammeren GW, Rothwell PM et al. Symptomatic carotid atherosclerotic disease: correlations between plaque composition and ipsilateral stroke risk. Stroke 2015; 46(1): 182–189. doi: 10.1161/ STROKE AHA.114.007221.
-
Nosáľ V, Kurča E, Turčanová-Koprušáková M et al. Nestabilný karotický plát. Neurológia 2009; 4(1): 31–34.
-
Bots ML, Breslau PJ, Briet E et al. Cardiovascular determinants of carotid artery disease. The Rotterdam Elderly Study. Hypertension 1992; 19 (6 Pt 2): 717–720. doi: 10.1161/ 01.hyp.19.6.717.
-
Mathiesen EB, Joakimsen O, Bonaa KH. Prevalence of and risk factors associated with carotid artery stenosis: the Tromsø Study. Cerebrovasc Dis 2001; 12 : 44–51. doi: 10.1159/ 000047680.
-
O’Leary DH, Polak JF, Kronmal RA et al. Distribution and correlates of sonographically detected carotid artery disease in the Cardiovascular Health Study. The CHS Collaborative Research Group. Stroke 1992; 23(12): 1752–1760. doi: 10.1161/ 01.str.23.12.1752.
Štítky
Detská neurológia Neurochirurgia Neurológia
Článok vyšiel v časopiseČeská a slovenská neurologie a neurochirurgie
Najčítanejšie tento týždeň
2019 Číslo 6- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Kombinace metamizol/paracetamol v léčbě pooperační bolesti u zákroků v rámci jednodenní chirurgie
- Neuromultivit v terapii neuropatií, neuritid a neuralgií u dospělých pacientů
- Antidepresivní efekt kombinovaného analgetika tramadolu s paracetamolem
-
Všetky články tohto čísla
- Střelná poranění mozku
- Predstavujú ticagrelor a prasugrel alternatívu v protidoštičkovej liečbe ischemických CMP? ANO
- Představují tikagrelor a prasugrel alternativu v protidestičkové léčbě ischemických CMP? NE
- Predstavujú ticagrelor a prasugrel alternatívu v protidoštičkovej liečbe ischemických CMP?
- Klinické syndromy z oblasti cervikálního plexu
- Neurorehabilitace poruch chůze s využitím funkční elektrické stimulace – aktuální poznatky z randomizovaných klinických studií
- Úskalí při respektování autonomie u pacientů s Parkinsonovou nemocí
- Současný management pacientů s degenerativní kompresí krční míchy
- Krvácení do aterosklerotického plátu u symptomatické a asymptomatické progredující stenózy vnitřní karotidy – pilotní studie
- Porovnání perioperačního měření tlaku ve vaku aneuryzmatu a v mateřské tepně u prasklých a neprasklých aneuryzmat
- Významné rizikové faktory pádu v osobnej anamnéze u hospitalizovaných pacientov s neurologickým ochorením
- Systematická analýza klinické efektivity stabilizace sakroiliakálního skloubení v rámci terapie bolestí zad
- Spinální meningiomy – 92 pacientů operovaných na našem pracovišti
- Civilní a válečná střelná poranění hlavy
- Mění se při Parkinsonově nemoci tloušťka cévnatky?
- Epidurální aplikace kortikoidů Část 1 – Profil pacientů před aplikací
- Chirurgická terapie oboustranné farmakorezistentní Menièrovy choroby
- Mechanická trombektómia v liečbe akútnej ischemickej cievnej mozgovej príhody v detskom veku
- Konzervativní management prasklé Galassi III arachnoideální cysty střední jámy lební
- Rekonstrukce lícního nervu štěpem z nervus auricularis magnus při resekci recidivujícího bazaliomu parotideomasseterické krajiny
- Doporučení pro mechanickou trombektomii akutního mozkového infarktu – verze 2019
- Analýza dat v neurologii LXXVIII. Směsné míry korelace u vícerozměrných souborů kvantitativních a kvalitativních dat
- Osmdesátiny doc. MU Dr. Jiřího Bauera, CSc.
- Doc. MU Dr. Eugen Eiben, CSc.
- Recenze knih
- Česká a slovenská neurologie a neurochirurgie
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Klinické syndromy z oblasti cervikálního plexu
- Doporučení pro mechanickou trombektomii akutního mozkového infarktu – verze 2019
- Mechanická trombektómia v liečbe akútnej ischemickej cievnej mozgovej príhody v detskom veku
- Střelná poranění mozku
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



