-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Homocysteín a sclerosis multiplex
Homocysteine and Multiple Sclerosis
Multiple sclerosis (MS) is a chronic inflammatory autoimunne disorder that affects central nervous system. The etiology of MS remains unknown. Genetic predisposition combined with environmental factors seem to be involved. Recently, homocysteine has been proposed as a potentially important player in MS pathogenesis, not only during disease development but during disease progression as well. Among the MS-linked psychiatric problems, the association between hyperhomocysteinemia (hyperHCy) and depression and cognitive dysfunction is the most researched. HyperHCy might be inherited or acquired. The most common cause of acquired HCy includes vitamin B12 and folate deficiency, chronic renal failure, hypothyreoidism and chronic drug exposure. Therefore, it is important to identify these comorbidities or risk factors early, as they may impact on the pathogenesis and course of MS.
Key words:
multiple sclerosis – homocysteine – depression – cognitive impairment
The authors declare they have no potential conflicts of interest concerning drugs, products, or services used in the study.
The Editorial Board declares that the manuscript met the ICMJE “uniform requirements” for biomedical papers.
Autoři: M. Cingelová; L. Procházková; J. Martinková; P. Kukumberg
Působiště autorů: II. Neurologická klinika LF UK a UN Bratislava
Vyšlo v časopise: Cesk Slov Neurol N 2013; 76/109(5): 565-569
Kategorie: Přehledný referát
Souhrn
Sclerosis multiplex (SM) je chronické zápalové autoimunitné ochorenie centrálneho nervového systému, ktorého etiológia nie je doteraz úplne objasnená. Predpokladá sa účasť genetickej predispozície v kombinácii s vplyvom vonkajších i vnútorných faktorov. V poslednom období sa do popredia dostáva úloha homocysteínu v patogenéze tohto závažného ochorenia. Niektoré štúdie dokázali vplyv hyperhomocysteinémie nielen na vznik samotného ochorenia SM, ale aj na jeho progresiu. Z psychiatrických symptómov u SM je najviac preskúmaná asociácia hyperhomocysteinémie k depresii a ku kognitívnej dysfunkcii. Príčina hyperhomocysteinémie môže byť vrodená i získaná. Medzi najčastejšie získané príčiny patrí deficit vitamínu B12, kyseliny listovej, chronické zlyhanie obličiek, hypotyreóza a chronická expozícia niektorým látkam. Je dôležité tieto komorbidity či rizikové faktory včasne rozpoznať, nakoľko môžu výrazne zasiahnuť do patogenézy SM a jej priebehu.
Klíčová slova:
sclerosis multiplex – homocysteín – depresia – kognitívne poruchyZoznam skratiek
HCy homocysteín
hyperHCy hyperhomocysteinémia
SAM S ‑ adenozylmetionín
MTHFR metyléntertrahydrofolát ‑ reduktáza
SM sclerosis multiplex
MM mozgomiechový mok
Úvod
Homocysteín je aminokyselina, predstavujúca produkt demetylácie pre organizmus esenciálneho metionínu [1]. Podlieha autooxidácii, čo vyúsťuje do produkcie reaktívnych zmesí podieľajúcich sa na bunkovej toxicite. Homocysteín sa jednoznačne zúčastňuje fundamentálnych mechanizmov rôznych ochorení ako aterotrombóza, oxidatívny stres, apoptóza a bunková proliferácia [2,3].
Epidemiologické štúdie demonštrujú pozitívny, na dávke závislý vzťah medzi koncentráciou HCy v plazme a rizikom vzniku neurodegeneratívnych ochorení [4,5]. V posledných rokoch sa do popredia záujmu dostáva úloha homocysteínu u sclerosis multiplex.
Metabolizmus homocysteínu
Homocysteín predstavuje produkt demetylácie metionínu, ktorý je v krvi v 80 % viazaný najmä na albumín, a zvyšok sa vyskytuje vo voľnej forme ako oxidovaný homocysteín alebo zmiešaný disulfid homocysteínu [6]. Demetyláciou S ‑ adenozylmetionínu (SAM) pomocou metyl ‑ transferáz vzniká S ‑ adenozyl ‑ homocysteín, ktorý sa hydrolyzuje na homocysteín. Odburávanie HCy sa uskutočňuje cez jeho spätnú remetyláciu na metionín. Kofaktormi tejto reakcie sú kyselina listová, vitamíny B12 a B6. Alebo dochádza k transsulfurácii HCy na cysteín pomocou cystationín‑β ‑ syntetázy, kde slúži vitamín B6 - pyridoxín ako kofaktor [7,8]. Udržiavanie fyziologicky nízkych hladín HCy sa realizuje buď cestou jeho zníženej formácie a/ alebo jeho promptným odstránením. Nevyhnutnými pre tento proces sú kofaktory enzymatických reakcií a dostatočná aktivita enzýmov v remetylačnej a transsulfuračnej dráhe (obr. 1) [8,9].
Obr. 1. Schématické znázornenie metabolizmu homocysteínu. SAM – S-adenozylmetionín, SAH – S-adenozyl-homocysteín, EnK – endogénne komponenty (DNA, RNA, fosfolipidy, melín...), ExK – exogénne komponenty (liečivá, toxíny, fytochemikálie...), COMT – katechol-O-metyltransferáza, THF – tetrahydrofolát, MTHFR – metyléntetrahydrofolátreduktáza 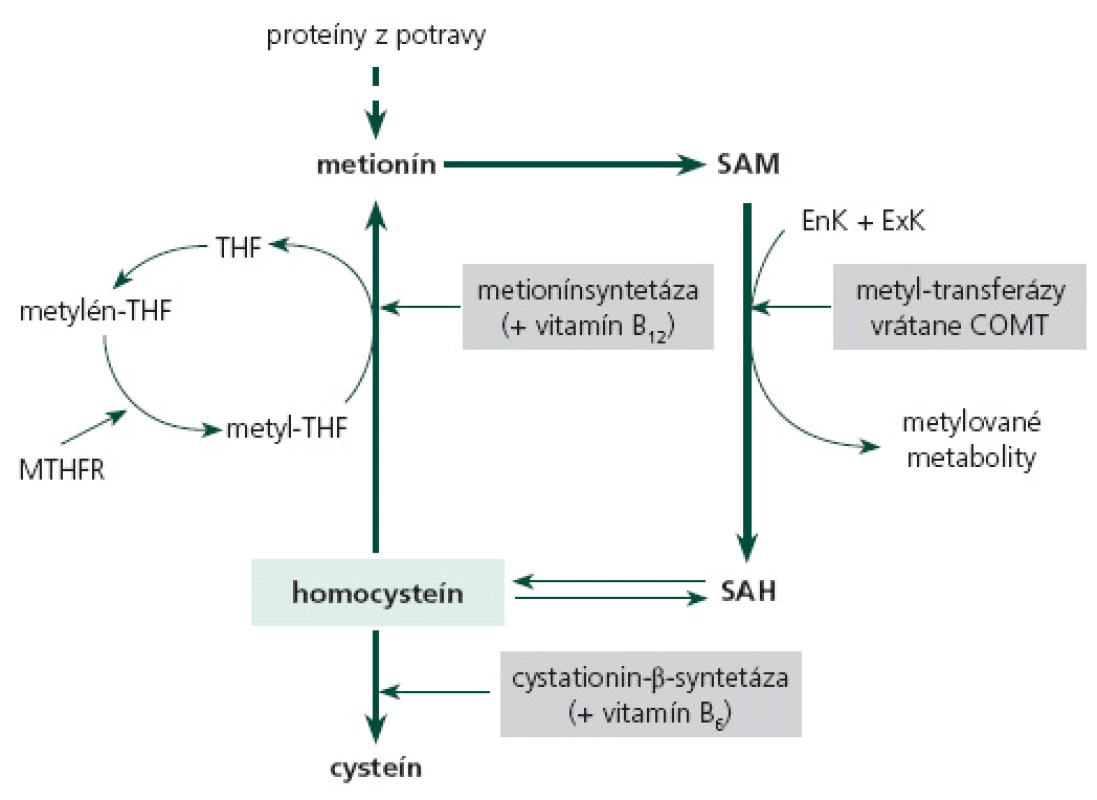
Podľa dodnes akceptovaného konsenzu z roku 1998 je horná hranica normy pre koncentráciu plazmatického HCy15 µmol/ l. Mierna hyperHCy zahŕňa plazmatické hladiny medzi 16 a 30 µmol/ l, stredne ťažká hyperHCy je v rozmedzí 31 – 100 µmol/ l a pri hodnotách > 100 µmol/ l sa jedná o ťažkú hyperHCy [10]. Avšak viaceré veľké epidemiologické štúdie dokázali, že aj koncentrácie HCy nižšie ako 15 µmol/ l sa spájajú s vyšším vaskulárnym rizikom [11,12]. Podľa najnovších názorov sa dokonca odporúča za hornú hranicu normy HCy pokladať 12 µmol/ l [13,14].
Etiológia hyperhomocysteinémie
Príčiny hyperHCy môžu byť vrodené a získané (tab. 1) [15]. Najčastejšou genetickou abnormitou metabolizmu HCy, ktorá spôsobuje hyperHCy, je substitúcia cytozínu za tymín na nukleotide 677 (677C → T)v géne, ktorý kóduje vyššie spomenutý enzým MTHFR. Takto zmenený enzým je termolabilný a má sotva polovičnú aktivitu v porovnaní s normálnou formou MTHFR. Uvedená mutácia sa v homozygotnej forme vyskytuje asi u 10 – 12 % kaukazskej populácie. Ostatné genetické príčiny hyperHCy sú extrémne zriedkavé. Získané príčiny zvýšeného HCy zahŕňajú najmä karenčný deficit kofaktorov (folátu a vitamínu B12), chronické zlyhanie obličiek, hypotyreózu a chronickú expozíciu niektorým liečivám a xenobiotikám [8].
Tab. 1. Príčiny hyperhomocysteinémie. 
Homocysteín a sclerosis multiplex
Sclerosis multiplex (SM) je chronické zápalové demyelinizačné ochorenie centrálneho nervového systému. Etiológia nie je doteraz úplne objasnená, ale predpokladá sa účasť genetickej predispozície v kombinácii s vplyvom vonkajších faktorov. Okrem neurologických príznakov je charakterizovaná kognitívnymi a afektívnymi poruchami.
Predstavy o patogenéze SM sa vyvíjali od jej popisu v polovici 19. storočia a zďaleka nie sú pri konci. Dnes je známe, že na patogenéze SM sa celkom nepochybne podieľajú zápalové aj neurodegeneratívne deje. Je možné, že ich kombinácia je individuálne rozdielna v závislosti na genetických i environmentálnych faktoroch. Štúdie realizované prostredníctvom zobrazovacích metód ukázali, že neurodegeneratívne zmeny sú prítomné už vo včasných štádiách SM [16], čo by mohlo viesť k tomu, že SM bude v budúcnosti klasifikovaná ako „nové“ neurodegeneratívne ochorenie [17]. Súvislosť medzi zvýšenou koncentráciou homocysteínu v plazme a niektorými neurodegeneratívnymi ochoreniami, ako i SM je predmetom mnohých výskumov [18 – 25].
Ramsaransing et al detekovali signifikantne vyššiu koncentráciu HCy v plazme u pacientov so SM v porovnaní s kontrolnou skupinou (zdraví ľudia). Podobne i Russo et al potvrdili hyperHCy až u 60 % pacientov so SM. Jednalo sa prevažne o vrodenú homocysteinémiu, nakoľko len malé percento z 94 pacientov s SM trpelo pridruženými ochoreniami (7,4 % pacientov: DM, ischemická kardiomyopatia, hlboká žilová trombóza, esenciálna hypertenzia), 25 pacientov boli fajčiari [22,24]. V zhode s týmito nálezmi boli i výsledky práce Ashtariho s kolektívom v roku 2005, porovnávali plazmatickú koncentráciu HCy u 35 pacientov so SM s 30 zdravými jedincami. Všetci boli vo veku 18 – 50 rokov. Pacienti mali sekundárne progresívnu a relapsujúco ‑ remitujúcu formu a žiaden z nich nemal anamnézu IM, TIS, neuropatie či homocystinúrie a renálneho zlyhania. Miera disability bola hodnotená prostredníctvom EDSS skóre. Výsledky štúdie demonštrovali signifikantne vyššiu hladinu HCy u pacientov so SM ako v kontrolnej skupine a zároveň signifikantne vyššiu koncentráciu u pacientov s vyšším stupňom disability (EDSS skóre). Tým potvrdili pozitívny efekt HCy na patofyziológiu SM [26].
Okrem týchto zistení Baig et al detekovali zvýšenú koncentráciu HCy u pacientov so SM nielen v plazme, ale i v mozgomiechovom moku (MM), pri súčasne zníženej hladine vitamínu B12 v plazme a MM [18].
Besler et al síce zaznamenali hyperHCy v plazme u pacientov so SM v aktívnej fáze ochorenia pri súčasnom deficite folátov a vitamínu B12, neboli však signifikantne významné [19]. V kontraste sú rezultáty sledovania Ramsaransinga et al, ktorí síce detekovali hyperHCy u pacientov so SM, ale nedokázali rozdiel medzi jednotlivými formami SM, ani vzťah HCy k progresii ochorenia [22].
Iným štúdiám sa nepodarilo preukázať jednoznačnú asociáciu medzi HCy a SM [27,28].
Mechanizmus spájajúci HCy a SM nie je ešte dostatočne preskúmaný. Existuje niekoľko hypotéz.
Jedna z možných je, že HCy iniciuje a zvyšuje rozvoj zápalu znížením produkcie apolipoproteínu A1 (Apo A ‑ 1), ktorý má protizápalové vlastnosti [29,30].
Nedávne štúdie zdôrazňujú dôležitú úlohu post‑translačných modifikácií myelín bázického proteínu (MBP) (vrátane metylácie) v patogenéze demyelinizačných ochorení. K ich inhibícii dochádza pri hyperHCy. Hypometylácia arginínu na MBP spôsobuje zníženie hydrofobicity MBP, môže viesť k zníženiu jeho štrukturálnej stability a zvýšenej degenerácii myelínovej pošvy [31].
HCy podporuje excitotoxicitu prostredníctvom stimulácie NMDA ‑ receptorov a poškodením neuronálnej DNA, čo vedie k apoptóze. HCy môže byť konvertovaný na kyselinu homocysteínovú, ktorá má tiež toxický efekt na neuróny cerebrálneho kortexu. Preto zvýšená hladina HCy v plazme má neurodegeneratívny efekt a môže byť rizikovým faktorom pre progresiu disability SM [32,33].
Multisystémová toxicita HCy sa pripisuje jeho spontánnym reakciám s mnohými biologicky dôležitými molekulami, primárne proteínami [34]. HCy neenzymaticky pridáva voľné cysteinylové reziduá k proteínom, môže rozštiepovať ich disulfidické väzby s následným zničením ich štruktúry [35]. Výsledkom je proteínová homocysteinylácia, ktorá spôsobuje stratu alebo degradáciu biologických funkcií mediátorov imunitného systému, enzýmov, receptorov, rastových faktorov a štrukturálnych proteínov [34,35]. Z toho vyplýva, že chronická hyperHCy u pacientov so SM môže mať negatívny efekt na reguláciu imunitného systému. A čo viac, oxidatívne poškodenie sprostredkované HCy generovanými voľnými radikálmi je ďalšou možnou príčinou toxicity HCy na CNS u pacientov so SM [36].
Ramsaransing et al uvažovali o ďalšom možnom mechanizme, ktorý je zodpovedný za eleváciu HCy v plazme u pacientov so SM. Na základe poznatkov, že u SM dochádza k aktivácií astrocytov a poškodeniu hematoencefalickej bariéry, podporované i nálezmi zvýšenej hladiny astrogliálneho proteínu S 100 v plazme u pacientov so SM [37], sa domnievajú, že HCy je taktiež produkovaný astrocytmi. Astrocytmi produkovaný HCy tak prispieva k zvýšeniu koncentrácie plazmatického HCy [38,22].
Homocysteín a psychické zmeny
V posledných rokoch sa do popredia dostáva úloha HCy v patogenéze depresie a neurodegeneratívnych ochorení vrátane SM. Výsledky štúdií sú však kontroverzné.
Bottiglieri et al zaznamenali, že HCy je signifikantne vyšší u pacientov s depresiou, čo viedlo k domnienke, že vzostup HCy u týchto pacientov indikuje zlyhanie metylácie HCy na metionín v dôsledku nedostatku metylových skupín z metyl ‑ folátu [39]. V zhode s týmito rezultátmi sú výsledky Tolmunena et al, ktorí vyššiu koncentráciu plazmatického HCy detekovali u depresívnych mužov v strednom veku [40]. Taktiež štúdia homocysteínu Hordaland verifikovala ich vyššiu asociáciu u pacientov s koncentráciou HCy > 15 µmol/ l, u ktorých je 2-krát vyššie riziko vzniku depresie v porovnaní s pacientmi s koncentráciou HCy < 9 µmol/ l. Navyše nositelia genotypu MTHFR 677 TT majú o 70 % vyššie riziko depresie ako s genotypom CC [41].
V protiklade sú početné epidemiologické štúdie populácií rôznych etník, ktoré naopak nenašli koreláciu medzi HCy a depresiou [41].
Mechanizmus, ktorý vysvetľuje asociáciu HCy s depresiou, nie je dodnes presne známy. Predpokladá sa niekoľko možností. Po prvé, zvýšená hladina plazmatického HCy predstavuje zvýšené riziko cerebrovaskulárnych ochorení [42], s ktorými je spojený aj vyšší výskyt depresie v staršom veku. Sledovaná asociácia nie je príčinou, ale dôsledkom cerebrovaskulárneho ochorenia [43]. Po druhé, HCy sa môže podieľať na vzniku depresie svojím priamym neurotoxickým efektom. Po tretie, zvýšená koncentrácia HCy v plazme je markerom dysfunkcie metabolizmu metionínu. Metionín je prekurzor SAM, ktorý je donorom metylových skupín početných metylačných reakcií v mozgu. Mnohé z nich sú priamo zahrnuté do syntézy a metabolizmu aminokyselín [39]. SAM je zapojený do syntézy dopamínu, noradrenalínu a serotonínu, ktoré fungujú aj ako neurotransmitery a hrajú dôležitú úlohu v patogenéze depresie a anxiety [44]. Preto pri deficite folátov a vitamínu B12, následnej hyperHCy, a znížení SAM dochádza k redukcii serotonergnej a/ alebo neurotransmiterovej funkcie [45].
Psychiatrická komorbidita SM je veľmi častá. Najčastejšie sa stretávame s už spomínanou depresiou, ktorú pozorujeme u 45 – 55 % pacientov [46].
Doteraz len Triantafyllou et al sledovali spojitosť medzi HCy, SM a depresiou. Ich výsledky dokázali, že pacienti so SM a hyperHCy sú obzvlášť náchylní k rozvoju depresívnej symptomatológie. Pacienti s vyššou hladinou HCy v plazme dosiahli vyššie Beck Depression Inventory (BDI) skóre v porovnaní s pacientmi s nižšími koncentráciami. Prevalencia depresie bola vyššia u pacientov so SM a hyperHCy v porovnaní s pacientmi, ktorí mali normálnu koncentráciu HCy. Nepotvrdili súčasne prítomný deficit folátov a vitamínu B12, ani rozdielnosti vo veku, EDSS skóre, v dĺžke trvania ochorenia medzi komparatívnymi skupinami [47].
Medzi ďalšiu častú psychiatrickú komorbiditu u SM patria kognitívne poruchy. Ich prevalencia je pomerne vysoká. Mierne kognitívne poruchy sú bežné u pacientov so SM aj vo včasnom štádiu [48]. Celkovo 45 – 65 % pacientov má závažný deficit pri neuropsychologickom testovaní [49].
Asociácia medzi hyperHCy a kognitívnymi poruchami bola dokázaná pri rozličných neurologických ochoreniach. Dopad hyperHCy na kognitívne funkcie u pacientov so SM však doteraz nie je známy. Russo et al svojimi výsledkami potvrdili signifikantne významnú asociáciu medzi HCy a kognitívnymi poruchami u pacientov so SM. A zároveň detekovali nezávislý vzťah medzi hyperHCy, vekom, EDSS skóre a progresiou [50].
Tieto zaujímavé poznatky by mohli byť podnetom pre ďalšie výskumy zamerané na štúdium podskupiny SM pacientov s hyperHCy so zhodnotením možností ich aplikácie do terapeutických a preventívnych postupov.
Záver
Sclerosis multiplex je závažné neurologické ochorenie, ktoré sa manifestuje širokou škálou neurologických a psychiatrických príznakov. V našich zemepisných šírkach patrí medzi najčastejšie chronické zneschopňujúce neurologické ochorenie mladých dospelých so závažnými socio ‑ ekonomickými dôsledkami.
Psychiatrická komorbidita SM je veľmi častá. Môže byť primárnej alebo sekundárnej povahy, odráža neurologické postihnutie alebo funkčný stres spojený s chronickým, invalidizujúcim ochorením. Jej včasná identifikácia a monitorovanie je veľmi dôležitou súčasťou celkového manažmentu SM.
V súčasnosti sa množia dôkazy podporujúce teóriu, že HCy a oxidatívny stres môžu mať význam v patogenéze SM. Niektoré štúdie preukázali patofyziologický vzťah hyperHCy nielen na vznik samotného ochorenia SM, ale aj na jeho progresiu. Z psychiatrických symptómov SM je najviac preskúmaná asociácia hyperHCy k depresii a ku kognitívnej dysfunkcii. Nie je doteraz jasné, či sa jedná o duálny vplyv hyperHCy na vznik SM a zároveň na vznik neuropsychiatrických prejavov, akými sú depresia a kognitívne poruchy, alebo ide o jeden z prejavov SM, na ktoré má vplyv hyperHCy. V budúcnosti sú preto potrebné mnohé prospektívne a intervenčné štúdie, ktoré by overili efekt liečby na redukciu hyperHCy s priaznivým dopadom na primárne ochorenie, alebo vznik komorbiditných ochorení. Nemenej významné by bolo v spolupráci s hematológmi sledovať a korigovať prípadnú hyperhomocysteinémiu u pacientov s SM.
Komorbidita výrazne ovplyvňuje zdravotný stav a kvalitu života pacienta so SM a zvyšuje náklady na zdravotnícku a ošetrovateľskú starostlivosť. Pri včasnom rozpoznaní faktorov, ktoré majú úlohu v patogenéze SM, vplyv na progresiu ochorenia a vznik komorbiditných ochorení, je možné im predchádzať, alebo zmierniť ich následky.
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
MUDr. Miriam Cingelová
II. neurologická klinika LF UK a UN v Bratislavě
Limbová 5
833 05 Bratislava
e-mail: miriamcingelova@post.sk
Prijato k recenzii: 21. 3. 2011
Prijato do tlače: 8. 3. 2013
Zdroje
1. Čaprnda M, Rašlová K. Súčasný pohľad na homocysteín vo svete poznatkov klinických štúdií. Interná Med 2006; 6(6): 344 – 347.
2. Weiss N, Keller C, Hoffmann U, Loscalzo J. Endothelial dysfunction and atherothrombosis in mild hyperhomocysteinemia. Vasc Med 2002; 7(3): 227 – 239.
3. Austin RC, Lentz SR, Werstuck GH. Role of hyperhomocysteinemia in endothelial dysfunction and atherothrombotic disease. Cell Death Differ 2004; 11 (Suppl 1): S56 – S64.
4. Mattson MP, Shea TB. Folate and homocysteine metabolism in neural plasticity and neurodegenerative disorders. Trends Neurosci 2003; 26(3): 137 – 146.
5. Parnetti L, Bottiglieri T, Lowenthal D. Role of homocysteine in age‑related vascular and non‑vascular diseases. Aging 1997; 9(4): 241 – 257.
6. Durand P, Prost M, Loreau N, Lussier ‑ Cacan S, Blache D. Impaired homocysteine metabolism and atherothrombotic disease. Lab Invest 2001; 81(5): 645 – 672.
7. Finkelstein JD. The metabolism of homocysteine: pathways and regulation. Eur J Pediatr 1998; 157 (Suppl 2): S40 – S44.
8. Valkovič P, Blažíček P, Benetin J, Kukumberg P. Homocysteín, levodopa a Parkinsonova choroba. Cesk Slov Neurol N 2006; 69/ 102(3): 183 – 188.
9. Selhub J. Homocysteine metabolism. Annu Rev Nutr 1999; 19 : 217 – 246.
10. Welch GN, Loscalzo J. Homocysteine and atherothrombosis. N Engl J Med 1998; 338(15): 1042 – 1050.
11. Morris SM, Jacques PF, Rosenberg IH, Selhub J, Bowman BA, Gunter EW et al. Serum total homocysteine concentration is related to self ‑ reported heart attack or stroke historyamong men and women in the NHANES III. J Nutr 2000; 130(12): 3073 – 3076.
12. Perry IJ, Refsum H, Morris RW, Ebrahim SB, Ueland PM, Shaper AG. Prospective study of serum total homocysteine concentration and risk of stroke in middle ‑ aged British men. Lancet 1995; 346(8987): 1395 – 1398.
13. Haynes WG. Hyperhomocysteinemia, vascular function and atherosclerosis: effects of vitamins. Cardiovasc Drugs Ther 2002; 16(5): 391 – 399.
14. Stanger O, Herrmann W, Pietrzik K, Fowler B, Geisel J, Dierkes J et al. DACH ‑ LIGA homocystein (german, austrian and swiss homocysteine society): consensus paper on the rational clinical use of homocysteine, folic acid and B ‑ vitamins in cardiovascular and thrombotic diseases: guidelines and recommendations. Clin Chem Lab Med 2003; 41(11): 1392 – 1403.
15. Sachdev P. Homocysteine and neuropsychiatric disorders. Rev Bras Psiquiatra 2004; 26(1): 49 – 55.
16. Havrdová E. Roztroušená skleróza. Neurol Prax 2008; 4 : 193.
17. Obeid R, Kostopoulos P, Knapp JP, Kasoha M, Becker G, Fassbender K et al. Biomarkers of folate and vitamin B12 are related in blood and cerebrospinal fluid. Clin Chem 2007; 53 : 326 – 333.
18. Baig SM, Ali Qureshi G. Homocysteine and vitamin B12 in multiple sclerosis. Biogenic Amines 1995; 11(6): 479 – 485.
19. Besler HT, Comoglu S. Lipoprotein oxidation, plasma total anti oxidant capacity and homocystein level in patients with multiple sclerosis. Nutr Neurosci 2003; 6(3): 189 – 196.
20. Salemi G, Gueli MC, Vitale F, Battaglieri F, Guglielmini E, Ragonese P et al. Blood lipids, homocysteine, stress factors, and vitamins in clinically stable multiple sclerosis patients. Lipids Health Dis 2010; 9 : 19.
21. Masoud SA, Fakharian EN. Relationship between homocysteine blood level and multiple sclerosis. Inter J Med Med Sciences 2009; 1(5): 230 – 232.
22. Ramsaransing GS, Fokkema MR, Teelken A, Arutjunyan AV, Koch MK, DeKeyser J. Plasma homocysteine levels in multiple sclerosis. J Neurol Neurosurg Psychiatry 2006; 77(2): 189 – 192.
23. Reynolds E. Vitamin B12, folic acid and the nervous system. Lancet Neurol 2006; 5(11): 949 – 960.
24. Russo C, Morabito F, Piromalli LF. Hyperhomocysteinemia in multiple sclerosis. Eur J Neurol 2003; 10 (Suppl): 104.
25. Tajouri L, Martin V, Gasparini C, Ovcaric M, Curtain R, Lea RA et al. Genetic investigation of methylene tetra hydro folate Reductase (MTHFR) and Catecol ‑ 0 - methyl transferase (COMT) in multiple sclerosis. Brain Res Ball 2006; 69(3): 327 – 331.
26. Ashtari F, Abari Sh, Salehi Nejad V. Serum homocysteine level in patients with multiple sclerosis. J Res Med Sci 2005; 10(5): 302 – 304.
27. Goodkin DE, Jacobsen DW, Galvez N, Daughtry M,Secic M, Green R. Serum cobalamin deficiency is uncommon in multiple sclerosis. Arch Neurol 1994; 51 : 1110 – 1114.
28. Rio J, Montalban J, Tintore M, Codina A, Malinau MR. Serum homocystein levels in multiple sclerosis. Arch Neurol 1994; 51 : 1181.
29. Dalal S, Parkin SM, Homer ‑ Vanniasinkam S, Nicolaou A. Effect of homocysteine on cytokine production by human endothelial cells and monocytes. Ann Clin Biochem 2003; 40 : 534 – 541.
30. Liao D, Tan H, Hui R, Li Z, Jiang X, Gaubatz Jet al. Hyperhomocysteinemia decreases circulating high‑density lipoprotein by inhibiting apolipoprotein A ‑ I protein synthesis and enhancing HDL cholesterol clearance. Circ Res 2006; 99 : 598 – 606.
31. Kim JK, Mastronardi FG, Wood DD, Lubman DM, Zand R, Moscarello MA. Multiple sclerosis: an important role for post‑translational modifications of myelin basic protein in pathogenesis. Mol Cell Proteomics 2003; 2(7): 453 – 462.
32. Lipton SA, Kim KW, Choi YB, Kumar S, D’Emilia DM, Rayudu PV et al. Neurotoxicity associated with dual actions of homocysteine at the N ‑ methyl ‑ D ‑ aspartate receptor. Proc Natl Acad Sci USA 1997; 94 : 5923 – 5928.
33. Diaz ‑ Arrastia R. Homocysteine and Neurologic disease. Arch Neurol 2000; 57(10): 1422 – 1428.
34. Krumdieck CL, Prince CW. Mechanisms of homocysteine toxicity on connective tissues: implications for the morbidity of aginig. J Nutr 2000; 130 : 365 – 368.
35. Jakubowski H. Homocysteine thiolactone: metabolic origin and protein homocysteinylation in humans. J Nutr 2000; 130 : 377 – 381.
36. Au ‑ Yeung KK, Woo CW, Sung FL, Yip JC, Siow YL. Hyperhomocysteinemia activates nuclear factor ‑ kappa B in endothelial cells via oxidative stress. Circ Res 2004; 94(1): 28 – 36.
37. Petzold A, Brassat D, Mas P, Rejdak K, Keir G, Giovannoni G et al. Treatment response in relation to inflammatory and axonal surrogate marker in multiple sclerosis. Mult Scler 2004; 10 : 281 – 283.
38. Benz B, Grima G, Do KQ. Glutamate‑induced homocysteic acid release from astrocytes: possible implication in glia ‑ neuron signaling. Neuroscience 2004; 124(2): 377 – 386.
39. Bottiglieri T, Laundry M, Crellin R, Toone BK, Carney MW, Reynolds EH. Homocysteine, folate methylation, and monoamine metabolism in depression. J Neurol Neurosurg Psychiatry 2000; 69 : 228 – 232.
40. Tolmunen T, Hintikka J, Voutilainen S, Ruusunen A,Alfthan G, Nyyssonen K et al. Association between depressive symptoms and serum concentration of homocysteine in men: a population study. Am J Clin Nutr 2004; 80 : 1574 – 1578.
41. Bjelland I, Tell GS, Vollest SE, Refsum H, Ueland PM. Folate, vitamin B12, homocysteine, and the MTHFR 677 → T polymorphism in anxiety and depression: the Hordaland Homocysteine Study. Arch Gen Psychiatry 2003; 60(6): 618 – 626.
42. Wald DS, Law M, Morris JK. Homocysteine and cardiovascular disease: evidence on causality from a meta‑analysis. BMJ 2002; 325 : 1202 – 1209.
43. Thomas AJ, O’Brien JT, Davis S, Ballard C, Barber R, Kalaria RN et al. Ischemic basis for deep white matter hyperintensities in major depression. A neuropathological study. Arch Gen Psychiatry 2002; 59 : 785 – 792.
44. Almeida OP, Lautenschlager N, Flicker L, Leedman P,Vasikaran S, Gelavis A et al. Association between homocysteine, depression, and cognitive function in community ‑ dwelling older women from Australia. J Am Geriatr Soc 2004; 52(2): 327 – 328.
45. Bottiglieri T. Homocysteine and folate metabolism in depression. Prog Neuro Psychopharmacol Biol Psychiatry 2005; 29 : 1103 – 1112.
46. Havrdová E, Čechová Z. Roztroušená skleróza a depresia. Psychiatr Prax 2005; 6(5): 224 – 226.
47. Triantafyllou N, Evangelopoulos ME, Kimiskidis VK, Kararizou E, Boufidou F, Fountoulakis KN et al. Increased plasma homocysteine levels in patients with multiple sclerosis and depression. Ann Gen Psychiat 2008; 7 : 17.
48. Faiss JH. Cognitive dysfunction in different stages in multiple sclerosis ‑ presentation of 3 cases. J Neurol 2007; 254 (Suppl): II77 – II79.
49. Brassington JC, Marsh NV. Neuropsychological aspects of multiple sclerosis. Neuropsychol Rev 1998; 8(2): 43 – 77.
50. Russo C, Morabito F, Louise F, Piromalli A, Battaglia L, Vinci A et al. Hyperhomocysteinemia is associated with cognitive impairment in multiple sclerosis. J Neurol 2008; 255 : 64 – 69.
Štítky
Detská neurológia Neurochirurgia Neurológia
Článok vyšiel v časopiseČeská a slovenská neurologie a neurochirurgie
Najčítanejšie tento týždeň
2013 Číslo 5- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Kombinace metamizol/paracetamol v léčbě pooperační bolesti u zákroků v rámci jednodenní chirurgie
- Metamizol v kostce a v praxi – účinné neopioidní analgetikum pro celé věkové spektrum
- Fixní kombinace paracetamol/kodein nabízí synergické analgetické účinky
- Kombinace tramadol/paracetamol zmírňuje bolest v oblasti bederní páteře a může tak zmírnit i depresi
-
Všetky články tohto čísla
- Wilsonova nemoc
- Nová antikoagulancia v prevenci kardioembolických iktů u pacientů s nevalvulární fibrilací síní
- Homocysteín a sclerosis multiplex
- Kvantifikace postižení u pacientů s lumbální spinální stenózou
- Multiformní glioblastom – přehled nových poznatků o patogenezi, biomarkerech a perspektivách léčby
- Současné možnosti využití magnetické rezonance v diagnostice normotenzního hydrocefalu
- Neurologické komplikace dengue – možné nebezpečí pro střední Evropu
- Přesnost farmakogenetických algoritmů pro výpočet denní dávky warfarinu
- Interrater variabilita v hodnocení míry atrofie hipokampů pomocí Scheltensovy škály
- Porovnání peroperační radiační expozice při otevřené a miniinvazivní transpedikulární fixaci hrudní a bederní páteře
- Erratum
- Test 3F Dysartrický profil – normativní hodnoty řeči v češtině
- Operační léčba syndromu supinátorového kanálu
- Strategie diagnostiky, terapie a dispenzarizace pacientů s hemangioblastomy v CNS z pohledu neurochirurga
- Synkopy, hluchota a slepota u karcinomu prsu – kazuistika
- Gitelmanův syndrom provázený manifestní tetanií – kazuistika
- Konzumace marihuany jako rizikový faktor ischemické cévní mozkové příhody – kazuistika
- Tumoriformní varianta roztroušené sklerózy – dvě kazuistiky
- Souběžný výskyt mutace v genu ZNF9 (myotonická dystrofie typu 2) a v genu CLCN1 (myotonia congenita) v jedné rodině – kazuistika
- Webové okénko
-
Analýza dat v neurologii
XLI. Simpsonův paradox
- Česká a slovenská neurologie a neurochirurgie
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Wilsonova nemoc
- Multiformní glioblastom – přehled nových poznatků o patogenezi, biomarkerech a perspektivách léčby
- Tumoriformní varianta roztroušené sklerózy – dvě kazuistiky
- Test 3F Dysartrický profil – normativní hodnoty řeči v češtině
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



