-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Mikrobióm v súvislosti s metabolickým syndrómom a možnosti terapeutického využitia jeho ovplyvnenia
Microbiome in connection with metabolic syndrome and the therapeutic potential of its influencing
Several fields of medicine have been concerned with the role of the microbiome in maintaining the balance in the human body and its changes in the pathogenesis of diseases in recent years. The intestinal microbiome seems to play a key role in the regulation of metabolic pathways, inflammation and intestinal permeability. The aim of this review is to assess the importance of the intestinal microbiome in metabolic syndrome and the therapeutic or preventive potential of its manipulation.
Key words:
metabolic syndrome • microbiome • probiotics • prebiotics • fecal transplant
Autoři: Miriam Tutková; Jana Rudá-Kučerová
Vyšlo v časopise: Čes. slov. Farm., 2018; 67, 71-80
Kategorie: Přehledy a odborná sdělení
Souhrn
Úlohou mikrobiómu v udržovaní rovnováhy v ľudskom tele a zároveň jeho zmenami pri patogenéze chorôb sa v posledných rokoch zaoberajú viaceré odvetvia medicíny. Zdá sa, že črevný mikrobióm hrá kľúčovú rolu v regulácii metabolických ciest, metabolického zápalu a ovplyvňovaní črevnej permeability. Cieľom tejto práce je poukázať na význam črevného mikrobiómu pri metabolickom syndróme a využitiach jeho ovplyvnenia v jeho prevencii alebo terapii.
Kľúčové slová:
metabolický syndróm • mikrobióm • probiotiká • prebiotiká • transplantácia stolice
Úvod
Ľudské telo ako ekosystém hostí viac ako bilión mikróbov, ktorých genóm je približne 150-krát väčší ako ľudský1). Kolonizácia čreva mikróbmi začína po pôrode a životné prostredie vo včasných mesiacoch života dieťaťa hrá zásadnú rolu vo vývoji zdravého mikrobiómu. Na zložení črevného mikrobiómu sa podieľajú viaceré faktory ako pohlavie, vek, imunitný systém, užívanie antibiotík, ale podstatnú rolu hrá tiež predovšetkým diéta a zložky, obsiahnuté v prijímanej potrave2, 3). Dôležitosť mikrobiómu v úlohe ľudského zdravia a chorôb je známa už niekoľko desiatok rokov. V posledných rokoch sa začalo čoraz viac hovoriť o účasti mikrobiómu na kontrole metabolizmu a jeho podiele v patogenéze metabolického syndrómu, diabetu typu 2 a obezity4).
Interakcia mikrobiómu a hostiteľa
Vďaka novým molekulárnym technológiám a metódam, ako je sekvenovanie DNA, sa podarilo oveľa lepšie pochopiť komplexitu a zloženie mikrobiómu. Mikrobióm obsahuje približne 1150 rôznych bakteriálnych druhov, z toho prevahou sú anaeróby5). Väčšinu zastupujú grampozitívne baktérie, kdežto gramnegatívne tvoria len približne 10–30 %6). U ľudí sú v mikroflóre najviac zastúpené kmene rodu Firmicutes (60–80 %) a Bacteroides (20–40 %), v malej miere taktiež proteobaktérie a actinobaktérie (asi 5 %). Z Firmicutes sú to hlavne Mycoplasma, Bacillus a Clostridia. Prehľad najviac zastúpených skupín baktérií v ľudskom črevnom mikrobióme je uvedený v tabuľke 16). Zloženie mikrobiómu je od neskorého detstva do neskorej dospelosti, kedy sa objavujú zmeny spôsobené starnutím, relatívne stabilné7, 8).
Tab. 1. Priemerné zloženie ľudského črevného mikrobiómu 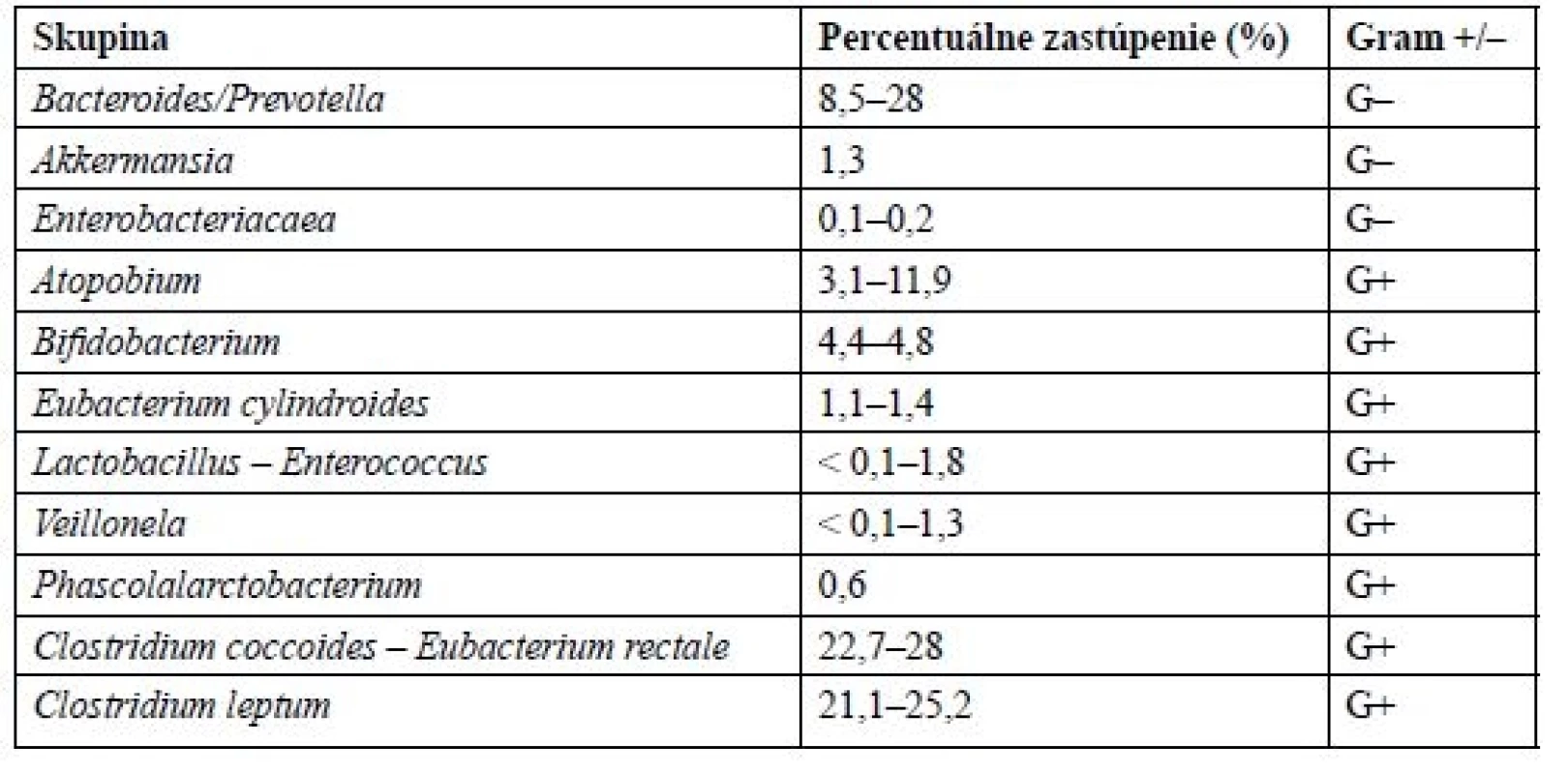
Za posledné desaťročie bolo preukázané, že väčšina pacientov trpiacich metabolickým syndrómom je charakteristická črevnou dysbiózou. Jedným z dôsledkov dysbiózy je tzv. „leaky gut“, ktorý označuje zvýšenú črevnú permeabilitu. U týchto pacientov môže byť znížené zastúpenie kmeňu Bacteroides až na polovicu a proporcionálne k tomu zvýšené zastúpenie kmeňu Firmicutes9). Preto sa považuje pomer Firmicutes/Bacteroides v zložení ľudského črevného mikrobiómu za signifikantný vo vzťahu k obezite10). Niektoré ľudské štúdie však naopak došli k záveru, že dochádza k zvýšenému zastúpeniu oboch týchto skupín, alebo dokonca k žiadnej zmene11, 12). Preto nie je vhodné používať tento pomer ako biomarker pri odlíšení obéznych od neobéznych. Pri detailnom preskúmaní črevnej mikroflóry jednotlivých pacientov s metabolickým syndrómom zisťujeme, že nie úplne všetci pacienti sú charakterizovaní podobnou dysbiózou, čo upozorňuje na niektoré rôzne závislé faktory a rozličnosť funkcií jednotlivých druhov baktérií13).
Mechanizmy interakcií mikrobiómu a hostiteľa
Medzi ľudským organizmom a jeho črevným mikrobiómom existuje určitá komunikácia. Mikrobióm dokáže s hostiteľom interagovať rôznymi spôsobmi. Jednou z ciest tejto interakcie je cez produkty metabolizmu mikrobiómu. Ako vieme situácia v čreve je tak ako zvyšok tela pod kontrolou nášho nervového systému. Nervový systém týmto spôsobom môže ovplyvňovať zloženie mikrobiómu v čreve zmenou peristaltiky, priepustnosti črevnej sliznice alebo zloženia sekrétov a uvoľňovania hormónov. Táto komunikácia však taktiež nie je len jednostranná14).
Mastné kyseliny s krátkym reťazcom
Najvýznamnejšiu úlohu majú mastné kyseliny s krátkym reťazcom („short-chain fatty acids“ – SCFAs) a rozvetvené SCFAs, ktoré vznikajú pri fermentácii nestráviteľných sacharidov, napr. laktát, butyrát či propionát. Tieto SCFAs sú ligandmi pre receptory spražené s G proteínmi (GPR) 43 a 41, ktoré v bunke fungujú buď znižovaním cAMP, alebo zvyšovaním intracelulárneho vápnika15). Stimuláciou GPR41 dochádza k zvýšenej produkcii leptínu (viď ďalej)16) a GPR43 sa podobá iným protizápalovm chemoatraktívnym receptorom17). Tieto receptory sa vyskytujú na rôznych tkanivách a bunkách, ako sú bunky imunitného systému, endokrinné bunky a adipocyty.
SCFAs rôznymi mechanizmami zefektívňujú metabolizmus. Najzaujímavejšie sú propionát a butyrát. Propionát prostredníctvom GPR43 receptorov, ktoré sa nachádzajú v periportálnych aferentných neurónoch, aktiváciou slučky črevo-mozog vplýva na príjem potravy indukciou intestinálnej glukoneogenézy18). Butyrát je okrem signálu sýtosti, znižovaniu príjmu potravy aj hlavným zdrojom energie pre kolonocyty19). Zdá sa, že zmenou črevného mikrobiómu podávaním rozličných prebiotík je možné modulovať príjem potravy a telesnú hmotnosť. Pri pokusoch na hlodavcoch napríklad podávanie fruktánov typu inulínu, ktoré sú hojne fermentované v proximálnej časti hrubého čreva, znížilo u pokusných zvierat podiel tuku, príjem potravy i celkovú telesnú hmotnosť. Taktiež boli v portálnej krvi namerané zvýšené koncentrácie anorexigénnych faktorov, konkrétne glucagon-like peptide-1 (GLP1), peptidu YY (PYY) a v ileu a hrubom čreve vyššie hladiny ich prekurzorov. Koncentrácia orexigénneho faktoru ghrelínu bola oproti kontrolnej skupine naopak výrazne nižšia20). Anorexigénne faktory sú produkované enteroendokrinnými L bunkami v čreve. Tieto bunky produkujú aj glucagon-like peptide 2 (GLP2), ktorý sa podieľa na posilňovaní črevnej bariéry21). Na ich povrchu sa nachádzajú receptory spražené s G proteínmi (GPR41 a GPR43). Ich ligandom sú SCFAs, ktoré pochádzajú práve z fermentácie spomínaných fruktánov22). Bolo preukázané, že črevný mikrobióm ovplyvňuje diferenciáciu kmeňových buniek do enteroendokrinných a tým pádom zvyšuje množstvo L buniek. Mechanizmus však zatiaľ ostáva neobjasnený23).
Významnú úlohu v regulácii metabolizmu a príjmu potravy má tiež adipokín leptín. Rezistencia na leptín je dá sa povedať typickým znakom obezity24). Pokusmi na myšiach, ktorým bola experimentálne navodená obezita a leptínová rezistencia podávaním stravy bohatej na tuky, bolo ukázané, že skupina, ktorá mala túto diétu doplnenú o prebiotiká, vykazovala vyššiu citlivosť na leptín. To sa prejavilo nižším príjmom potravy, hmotnosťou a zníženou lipogenézou v tukovom tkanive25). Uvažuje sa o tom, že prebiotiká redukujú tzv. systémový „low-grade inflammation“ a tým zvyšujú citlivosť k leptínu. „Low-grade inflammation“ je chronický zápal, ktorý je definovaný dvoj - až trojnásobne zvýšenými koncentráciami cytokínov a proteínov akútnej fázy v plazme. Je asociovaný s chronickými chorobami, ako je metabolický syndróm, ateroskleróza alebo diabetes26). Taktiež je preukázané, že sekrécia leptínu je závislá na SCFAs a GPR41/4316).
Fasting-induced adipose factor (FIAF)
Ďalším mechanizmom zahrnutým do kontroly telesnej hmotnosti mikrobiómom je regulácia exprese FIAF (fasting-induced adipose factor alebo angiopoitein-like protein 4). Je to proteín produkovaný enterocytmi, ktorý má inhibičný efekt na lipoproteínovú lipázu. Nevyvážený črevný mikrobióm môže tlmiť FIAF a tým zvyšovať aktivitu lipoproteínovej lipázy a triglyceridovú akumuláciu v tukovom tkanive27). To podporujú výsledky predklinickej štúdie, ktorá preukázala, že myši kŕmené stravou bohatou na tuky a súčasne suplementovanou Lactobacillus paracasei boli FIAF upregulované oproti skupine kŕmenou takou istou diétou bez suplementácie28).
Neuronálné regulácie
Mikrobióm môže taktiež interagovať s enterickým nervovým systémom, intrinzickými primárnymi aferentnými neurónmi (IPAN), senzorickými aferentnými vagovými neurónmi a centrálnym nervovým systémom a tým kontrolovať uvoľňovanie a produkciu neurotransmiterov29). Pravdepodobne sa to deje prostredníctvom lipopolysacharidov baktérii, ktoré sú súčasťou gramnegatívnych baktérii, a Toll-like receptorov (TLR), ktoré sú vystavené v submukóznom a myenterickom plexe, epiteliách hrubého čreva a sú vo vzťahu aj s enteroendokrinnými bunkami. Tieto receptory sú zároveň vystavené aj na gliových bunkách v enterickom nervovom systéme. Imunohistochemickými štúdiami bolo dokázané, že mikrobióm je nesmierne dôležitý pre homeostázu týchto gliových buniek30).
Špecifické proteíny produkované enterobaktériami, ako napríklad Escherichia coli, môžu zvýšiť sekréciu GLP1 a PYY. Intraperitoneálna aplikácia proteínu E. coli tiež znížila príjem potravy pôsobením v nucleus arcuatus a proteín, ktorý vystupuje ako mimetikum α-melanocyty stimulujúceho hormónu, stimuluje v nucleus arcuatus proopiomelanokortínové neuróny. Defekty proopiomelanokortínu vedú k obezite29). Taktiež už vyššie spomínaný lipopolysacharid tvoriaci stenu gramnegatívnych baktérii môže prekročiť črevnú bariéru a vyskytovať sa vo vyššej miere v plazme31).
Baktérie sú aj zdrojom neurotransmiterov. Najznámejšia je asi produkcia oxidu dusnatého, buď ich vlastnou syntetázou, alebo pomocou redukcie nitrátov. Oxid dusnatý je považovaný za jeden z hlavných neurotransmiterou v mozgu32, 33). Ďalšie baktérie, ako napríklad Clostridium sporogenes, dokážu dekarboxylovať tryptofán na tryptamín, ktorý indukuje uvoľňovanie serotonínu z enterochromafinných buniek na stimulovanie motility v gastrointestinálnom trakte účinkom na enterický nervový systém. Rody Lactobacillus a Bifidobacterium dokážu produkovať kyselinu γ-aminomaslovú (GABA), ktorá je zapojená do riadenia vyprázdňovania žalúdku a sekrécie žalúdočnej šťavy, črevnej motility a viscerálnej bolesti. Niektoré rody dokážu pravdepodobne produkovať aj látky ako adrenalín, noradrenalín34).
Metabolický syndróm
Metabolický syndróm je súbor príznakov, ktoré zvyšujú u jednotlivca riziko vzniku kardiovaskulárnych chorôb a diabetu typu 2. Prevalencia má celosvetovú stúpajúcu tendenciu. Pojem metabolický syndróm zahrňuje obezitu abdominálneho typu, dyslipidémiu, zvýšený krvný tlak, inzulínovú rezistenciu, glukózovú intoleranciu a stratu funkcie β-buniek35, 36).
Okrem vplyvu stravovacích návykov a nedostatočnej fyzickej aktivity sú tieto choroby spojené so zmenami štruktúry črevnej flóry a taktiež charakteristické progresívnym rozvojom „low-grade inflammation“ v metabolických tkanivách, ako sú tukové, pečeň, svaly a ostrovčeky pankreasu. Sú aktivované prevažne M1 makrofágy, ktoré produkujú veľké množstvá tumor nekrotizujúceho faktoru alfa (TNF-α), interleukínu (IL) -1β a 6, ktoré prispievajú k inzulínovej rezistencii fosforyláciou „c-Jun amino terminal kinase“ a inhibítoru podjednotky β nukleárneho faktoru kappa B, zodpovednú za fosforyláciu serínu „insulin receptor substrate-1“ (IRS-1). Serínová forforylácia inhibuje IRS, čo redukuje inzulínovú signalizáciu a vyvoláva inzulínovú rezistenciu37). Oproti tomu M2 makrofágy produkujú hlavné protizápalové cytokíny, napríklad IL-10, ktorý udržuje citlivosť na inzulín. Zodpovedné za udržovanie rovnováhy medzi M1 a M2 makrofágmi sú B a T lymfocyty prostredníctvom produkcie interferónu-γ a TNF-α, ktoré uprednostňujú diferenciáciu M1 makrofágov alebo produkciou IL-4, IL-5, IL-10 a IL-13, ktoré dohliadajú na vývin M2. U obéznych myší bolo pozorované, že akumulácii M1 makrofágov v tukovom tkanive predchádza infiltrovanie tohto tkaniva CD8 T lymfocytmi. U myší s genetickou depléciou týchto T lymfocytov bola nižšia infiltrácia makrofágov v tukovom tkanive, miernejší zápal a nižšia inzulínová rezistencia38).
Predpokladá sa, že fragmenty baktérii z črevného mikrobiómu sa translokujú do tkanív a iniciujú tak metabolický zápal. U pacientov je znížená expresia črevných „tight junctions“ proteínov a zvýšená permeabilita bariéry. Tento fenomén je označovaný ako metabolická endotoxémia. Najviac preskúmaná je rola lipopolysacharidu (LPS), ktorý tvorí stenu gramnegatívnych baktérii. K zvýšeniu jeho hladiny v krvi dochádza hlavne pri strave s vysokým obsahom tukov. Hladina LPS je v plazme najvyššia po jedle a v odpočinkovej fáze postupne klesá, čo zodpovedá proliferácii mikróbov v čreve nasledujúcej po príjme potravy39). Prvýkrát bola preukázaná kauzalita metabolickej endotoxémie po podávaní LPS myšiam, kde to indukovalo hepatickú inzulínovú rezistenciu, hyperglykémiu a zníženú glukózou indukovanú sekréciu inzulínu. Už do 90 minút po intravenóznom podaní bola zvýšená hladina laktátu v sére, glycerolu a intersticiálneho pyruvátu. Knock-out myšami, ktorým bol vyradený koreceptor pre LPS, čo je vlastne molekula CD14, nachádzajúca sa hlavne na povrchu monocytov, makrofágov a polmorfných mononukleárnych leukocytov, ale aj v solubilnej forme, bolo demonštrované, že tento faktor má významnú úlohu v inzulínovej rezistencii, zápale, príjme potravy a rozvoji tukového tkaniva. Spúšťacím mechanizmom je vznik komplexu LPS-CD1440). Po vzniku komplexu na membránach sú tieto imunitné bunky aktivované a produkujú prozápalové cytkíny ako TNF-α, IL-6, IL-1, IL-8 a interferón-γ. Kompex LPS so solubilným CD14 podporuje túto aktiváciu a taktiež sa môže viazať aj na bunky, ktoré CD14 na svojom povrchu nemajú a pôsobiť ďalej ako signálna molekula41). Prirodzene sú endotoxíny resorbované prostredníctvom chylomikrónov vznikajúcich v čreve42). LPS môže byť tiež transportované lipoproteínmi do tukových buniek, čím je tlmený ich prozápalový potenciál. Avšak LPS môžu lipoproteíny i poškodzovať, oxidovať, a indukovať produkciu superoxidového aniónu endotelovými bunkami. Tiež sa môžu z lipoproteínov uvoľniť v metabolických orgánoch a tým podnecovať zápal43, 44).
V čreve existuje obrana, ktorá bráni buď príliš veľkému prestupu častí baktérii alebo bráni prestupu baktériám z nehomeostatických rodín, ako je napríklad Proteobacteriaceae, ktoré sa zvýšene vyskytujú v mukóznej vrstve pri strave bohatej na tuky. Prvú líniu obrany tvoria antimikrobiálne peptidy, nazývané defenzíny. Sú produkované epitelovými Panethovými bunkami, ktoré rozpoznávajú „microbial associated molecular patterns“ pomocou pre nich špecifických receptorov, TLR a ďalších. Tieto bunky sekretujú konkrétne α-defenzín, β-defenzín 2 a 5 a lyzozým. Sekrécia týchto antimikrobiálnych peptidov je pri obezite redukovaná45). Ďalším obranným mechanizmom je produkcia imunoglobulínu A (IgA), ktorá tvorí takzvanú slizničnú imunitu. Bránia prestupu mikróbov a zároveň ich označuje k fagocytóze46).
Poslednou zložkou podieľajúcou sa na ochrane je vrodená a adaptívna imunita. Ak sa baktérie alebo ich zložky dostanú cez epitel do lamina propria, sú zachytené fagocytmi, ktoré ďalej komunikujú s „innate lymphoid cells“ – skupinou buniek z lymfoidnej línie, ktorá patrí k vrodenej imunite, pretože nereagujú antigén-špecificky, chýba im TCR/BCR (ILC) a T lymfocytmi. ILC3, ktoré sú hojne zastúpené v čreve, po aktivácii sekretujú IL-22 a IL-17, ktoré vplyvom na epitelové bunky zvyšujú sekréciu antimikrobiálnych peptidov. V neposlednej rade tieto bunky regulujú CD4 T lymfocyty47). Prostredníctvom „major histocompatibility complex“ glykoproteínov II. triedy im prezentujú antigény. Neindukujú však ich proliferáciu, ale obmedzujú patologickú odpoveď adaptívnej imunity na komenzálne baktérie. Chyba v interakcii týchto imunitných buniek je predpokladaná za príčinu vzniku metabolických chorôb. Túto hypotézu potvrdzujú štúdie, kde u hlodavcov kŕmených vysokotučnou diétou bol znížený IL-22 a ILCs48).
Ovplyvnenie metabolického syndrómu úpravou mikrobiómu
Ako je už vyššie spomínané, dysbióza mikrobiómu je asociovaná s metabolickým syndrómom. Preto sa mikrobóm stáva potenciálnym terapeutickým cieľom. Modulácia mikrobiómu sa zdá byť zaujímavým nástrojom v prevencii alebo liečbe tohto ochorenia. Pozitívnu zmenu črevného mikrobiómu je možné dosiahnuť administráciou prebiotík, probiotík alebo transplantáciou stolice. Oproti tomu je preukázané, že užívanie antibiotík rapídne zužuje taxonomickú rôznorodosť mikrobiómu49). Pozmenená diverzita a taktiež zastúpenie bakteriálnych génov a zmena metabolických dráh podporujú zložky mikrobiómu asociované s obezitou vo využívaní energie z potravy. Dlhodobejšie užívanie antibiotík je preto spojované so zvýšeným body mass indexom (BMI)50).
Úprava mikrobiómu podávaním probiotík
Orálne podanie živých baktérii umožňuje ich efektívnu integráciu do črevného ekosystému a tento spôsob ovplyvnenia mikrobiómu je dosiaľ najlepšie preskúmaný. Väčšina štúdii na hlodavcoch zaznamenala určité „antiobezitné“ účinky vyvolané podávaním baktérií rodu Lactobacillus.
Predklinické štúdie
Baktérie v štúdiách boli izolované z ľudského materského mlieka a podávané väčšinou per os. Skúmala sa aj veľkosť efektívnej dávky, kde sa najúčinnejšie prejavilo podávanie množstva baktérii o veľkosti 109 a viac „colony forming unit“ (CFU), jednotka používaná pri určovaní počtu životaschopných baktérii vo vzorke. Konkrétne L. gasseri je u hlodavčích modelov obezity vyvolaných diétou schopný znížiť veľkosť adipocytov, množstvo tukovej hmoty a zároveň obmedzovať ďalšie priberanie na váhe a ukladanie tuku51–53). L. gasseri BNR17 podávané myšiam vo vyšších dávkach sa preukázalo pozitívnym vplyvom na kontrolu hyperglykémie. Štúdia trvajúca 12 týždňov preukázala pokles glykovaného hemoglobínu a prevedením orálneho glukózového testu tiež zlepšenie glukózovej tolerancie51). Tiež bol preukázaný nižší stupeň zápalu v tukovom tkanive a znížená akumulácia tuku v pečeni54). Dáta získané v štúdii ukazujú, že podávanie L. rhamnosus a L. sakei znižujú expresiu lipogénnych génov v pečeni55). L. curvatus a L. plantarus dokážu znížiť hladiny cholesterolu v plazme a obsah lipidov v pečeni56). Ďalší štúdie sa zamerali na rod Bifidobacterium a pozorovali vplyv buď iba jedného druhu alebo ich kombinácie, ako napríklad B. longum a B. pseudocatenulatum. Taktiež bolo pozorované zníženie telesnej hmotnosti a úbytok tukového tkaniva u myší s obezitou vyvolanou vysokotučnou diétou. B. pseutocatenulatum CECT7765 zlepšuje tiež metabolické a imunologické zmeny asociované s obezitou57, 58). Štúdia zameraná na komerčnú kombináciu probiotík v prípravku VSL#3® obsahujúcom Lactobacillus spp., Bifidobacterium spp. a Steptococcus thermophilus demonštrovala pokles metabolického zápalu v pečeni vyvolaného u hlodavcov59). Všetky tieto preukázané antiobezitné efekty nastali bez toho, aby boli asociované s nejakou ďalšou zmenou, ako je napríklad úprava množstva a druhu konzumovanej potravy51, 54–59).
Mechanizmus, ako však tieto probiotiká uplatňujú svoj pozitívny efekt, nie je ešte objasnený. Podľa jednej štúdie administrácia L. paracasei indukuje zvýšenie množstva cirkulujúceho inhibítora lipoproteínovej lipázy, čo vedie k zmenšenému ukladaniu tukov60). U L. rhamnosus GG bola preukázaná zvýšená produkcia adipokínov podporujúcich inzulínovú senzitivitu, ako je napríklad adiponektín61). Administrácia všetkých zástupcov rodu Lactobacillus je charakterizovaná zníženou expresiou prozápalových génov v bielom tukovom tkanive. Okrem týchto jednotlivých účinkov mení administrácia probiotík zastúpenie a množstvo baktérii v čreve a jednotlivé druhy sa významne vzájomne ovplyvňujú. Napríklad podávanie L. acidophilus NCDC13 je spojené s nárastom Bifidobacterium62).
Klinické štúdie
Výsledky z publikovaných klinických štúdií sú zhrnuté v tabuľke 2. Autori štúdií sa obvykle sústredili na konkrétne bakteriálne kmene. Asi polovica štúdií preukázala pozitívny efekt na niektoré sledované parametre, druhá polovica štúdií však nepreukázala žiadne významné zmeny.
Tab. 2. Prehlaď výsledkov klinických štúdií 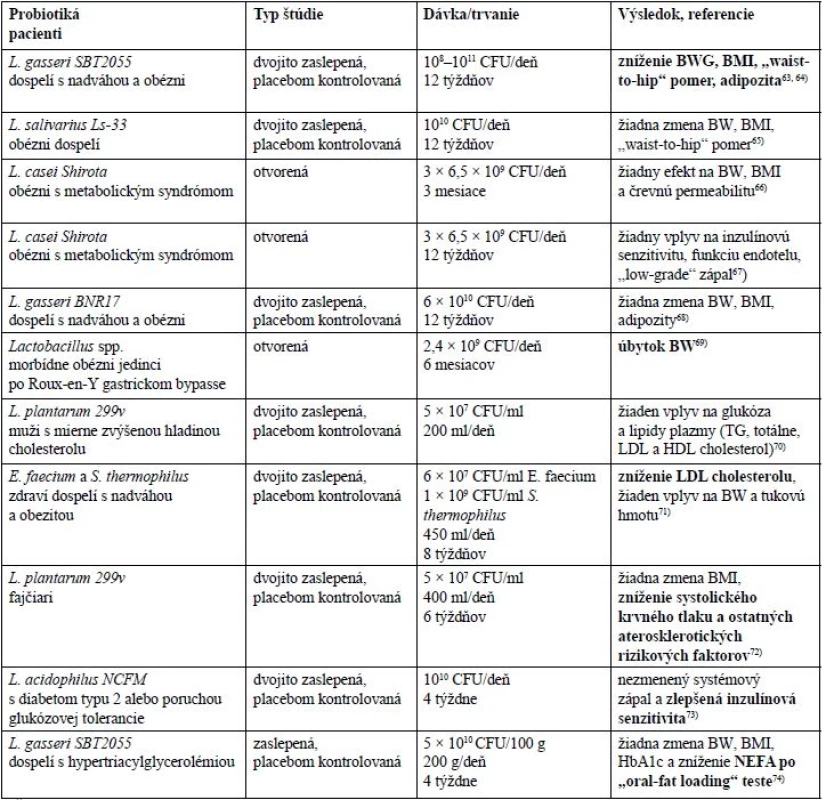
tučne = pozitívny efekt, normálne = žiadna zmena CFU – colony-forming unit, BW – telesná váha, BWG – príbytok telesnej váhy, NEFA – neesterifikované mastné kyseliny Úprava mikrobiómu podávaním prebiotík
Prebiotiká označujú nestráviteľné zložky potravy, ktoré sú fermentované baktériami, ktoré vo všeobecnosti rozpoznávame ako pre ľudské telo prospešné. Napríklad glukány, galaktány a fruktány podporujú rozvoj bifidobaktérii, ktorých znížené množstvo koreluje s rozvojom obezity a diabetu75). Pri sekvenčnej a „microarray“ analýze bolo preukázaných u skupiny po preliečení prebiotikmi viac ako 100 rozličných sekvencií, pričom zastúpenie niektorých baktérii bolo zvýšené, iných zas znížené76). U myší v modelu diétou indukovanej obezity viedla výživová suplementácia fruktánov typu inulínu alebo arabinoxylánov k zníženiu adipozity. Podávanie prebiotík zmenilo génovú expresiu v bielom tukovom tkanive prostredníctvom PPARs (peroxisome proliferator-activated receptors), ktorá viedla k zvýšenej lipolýze a zníženej adipogenéze. Okrem toho bola preukázaná aj zvýšená metabolická odpoveď k leptín77, 78). Suplementácia prebiotikmi viedla aj k zvýšeniu anorexigénnych peptidov (GLP-1 a PYY) a zníženiu orexigénneho faktoru ghrelínu79). Tento satietogénny efekt bol preukázaný i v klinických štúdiách, kde príjem oligofruktózy v strave zvyšoval pocit sýtosti a znižoval pocit hladu80). Zostáva ťažko objasniteľné, akým presným mechanizmom črevný mikrobióm ovplyvňuje endokrinné bunky čreva. Vyzerá to, že hlavnú funkciu zastáva produkcia SCFAs počas fermentácie prebiotík. SCFAs však nie sú jediným metabolitom, ale veľa metabolitov je pre nás v tejto chvíli ešte neznámych.
• Úprava mikrobiómu podávaním polyfenolov
Polyfenoly, sekundárne metabolity široko obsiahnuté v rastlinnej ríši, sú známe hlavne svojou antioxidačnou funkciou81). Vzhľadom však na ich nízku absorbovateľnosť v čreve bol objasnený aj ich efekt na črevný ekosystém a bariéru. Zvyšujú množstvo fekálneho mucínu a IgA, zlepšujú zmeny v črevnom mikrobióme, ktoré boli navodené vysokotučnou diétou82, 83). Tieto zistenia poukazujú na to, že polyfenoly by mohli predstavovať sľubný terapeutický prístup v prevencii metabolických chorôb bez toho, aby boli absorbované z tráviaceho traktu84). Ďalší text sa zaoberá dvoma najsľubnejšími zástupcami polyfenolov v potrave.
• Úprava mikrobiómu podávaním phlorizínu
Phlorizín je prírodný polyfenol a zložka nachádzajúca sa v množstve zeleniny a ovocia. Primárne bol objavený v jablku, nachádza sa však aj v jahodách, granátovom jablku či v niektorých rastlinách ako Lithocarpus polystachyus, Lippia graveolens, listy Malus toringoides a Pyrus betulaefolia85, 86). Tento polyfenol bol objavený ako prvý špecifický kompetitívny inhibítor symportu sodíku a glukózy (SGLT) lokalizovaného v mukóze krátkeho čreva (SGLT1) a proximálnom renálnom tubule (SGLT2)87, 88). V liečbe diabetu je už zavedená skupina liečiv, zvaná gliflozíny, ktoré tento kanál blokujú a ovplyvňujú tak glykémiu.
Avšak phlorizín samotný sa takto využiť nedá, pretože vykazuje malú orálnu biologickú dostupnosť. Po orálnom podaní je väčšina phlorizínu hydrolyzovaná β-glukozidázou a lactázophlorizín hydrolázou lokalizovanou v epitelových bunkách čreva na phloretín. V skutočnosti je v plazme detegované len necelé 1 % phlorizínu89). Táto nízka orálna biologická aktivita naznačuje, že na hypoglykemickom efekte phlorizínu sa podieľa aj iný mechanizmus ako blok SGLT. Cieľom predklinických štúdií bolo preukázať, že antidiabetický efekt phlorizínu spočíva v ovplyvnení štruktúry mikrobiómu, čo sa sledovalo orálnym glukózovým tolerančným testom, testom inzulínovej tolerancie, zmenami hladiny LPS v sére, zastúpení kmeňov baktérií a množstvom fekálnych SCFAs90). V pokuse boli tri skupiny – a to myši s diabetes mellitus, myši s diabetes mellitus dostávajúce phlorizín a kontrolná skupina. U skupiny s phlorizínom bola znížená hladina glukózy a taktiež inzulínu, čo sa stanovovalo z krvi po lačnení, aby sa vylúčil vplyv prijímanej potravy. Po 10 týždňoch terapie bola hladina glukózy preukázateľne zlepšená a efektívnejšie kontrolovaná inzulínom. U myší, ktorým bol podávaný phlorizín, bola hladina LPS znížená viac ako o polovicu oproti myšiam, ktoré phlorizín nedostávali, a dokonca bola hladina nižšia ako v kontrolnej skupine. Fekálne koncentrácie SCFAs (acetát, propionát, butyrát, isobutyrát), merané chromatograficky, boli signifikantne viac obsiahnuté v skupine s phlorizínom. Ďalej boli v štúdii preukázané aj štruktúrne zmeny črevnej flóry. Podobnosť mikrobiómu u myší s diabetom a kontrolnou skupinou vzrástla po suplementácii z 57 % na 85 %, naopak zhoda medzi vzorkou s phlorizínom a skupinou s diabetom klesla po liečbe zo 77 % na 64 %91).
Najzaujímavejšia z baktérii v súvislosti s metabolickými chorobami je asi Akkermansia muciniphila, mucín-degradujúca baktéria. Bolo preukázané, že podporuje rast pohárikových buniek v čreve, posilňuje integritu črevnej bariéry a eventuálne zväčšuje hlienovú vrstvu. Viaceré výskumy potvrdili znížené množstvo tohto druhu u obéznych a u pacientov s diabetom typu 276, 92). Štúdiami sa potvrdilo, že po podávaní phlorizínu dochádza k nárastu zastúpenia tejto baktérie v črevnom mikrobióme88, 93). Súčasne s nárastom SCFAs a butyrátu bolo pozorované u skupiny aj obohatenie mikrobiómu o kmeň Prevotella. Predpokladá sa, že kmene Prevotella ako SCFAs produkujúce baktérie podporujú ochrannú funkciu epitelových buniek hostiteľa a chráni ho pred infikovaním LPS do systémovej cirkulácie Množstvo patogénnych baktérii sa naopak znížilo91).
• Úprava mikrobiómu podávaním kakaových flavanolů
Flavanoly sú podtriedou flavonoidov, ktoré taktiež patria medzi polyfenoly. Kakao je špecifické v tom, že je to najvýznamnejší signifikantný zdroj takzvaného (-C) monoméru flavanolu v potrave. Kakao však obsahuje aj ostatné monoméry, oligoméry a polyméry v hojnom zastúpení. Flavanoly sú inak hojne zastúpené ešte napríklad v čajovníkoch, grepoch ale i orechoch či slivkách. Obsah polyfenolov v kakaovom prášku významne závisí od spôsobu spracovania. Len asi 5–10 % polyfenolov môže byť absorbovaných v tenkom čreve a zvyšok pokračuje do hrubého čreva, kde sú degradované mikróbmi. Hrubé črevo sa teda zdá byť hlavným pôsobiskom kakaových flavanolov94).
Prebiotický efekt kakaových flavanolov bol dokázaný in vitro, u hlodavcov a aj na humánnych štúdiách. Inkubácia vzoriek stolice s katechínom, oligomérnym flavanolom, ktorý kakao obsahuje, zvýšila rast skupín Clostridium coccoides, Eubacterium rectale, Escherichia coli a Bifidobacterium spp. Tieto skupiny sú schopné produkovať SCFAs pri sacharolytickom metabolizme a tým sú asociované s prospešnými účinkami na celulárnej a systémovej úrovni95). Kultivácia naopak inhibovala skupinu Clostridium histolyticum, prevažne proteolytickú skupinu baktérií. Proteolytická aktivita v hrubom čreve je považovaná za prospievajúci faktor v rozvoji karcinómu hrubého čreva a idiopatických črevných zápalov96, 97). V štúdii na hlodavcoch bol zaznamenaný tiež pokles Bacteroides a Staphylococcus98). U ľudí bolo po 4-týždňovej terapii preukázaný pokles v skupine Clostridium a nárast Bifidobacterium a Lactobacillus99). Kakaové flavanoly taktiež zlepšujú funkciu črevnej bariéry. Mechanizmus ešte nie je objasnený a vyžaduje ďalšie štúdie, ale pravdepodobne je to asociované s vplyvom na bakteriálne druhy, ako je Akkermansia100).
Ďalšou výhodou kakaových flavanolov, ktorá sa dá využiť v terapii a prevencii metabolického syndrómu, je, že okrem ovplyvnenia mikrobiómu dokážu priamo ovplyvňovať niektoré enzýmy. Jeho komplexná štruktúra s hojnými hydroxylovými skupinami mu umožňuje sa dobre nekovalentne viazať na tráviace enzýmy a antagonizovať ich. Znižuje aktivitu α-amylázy a glukozidázy. Zistilo sa, že látky obsahujúce viac komplexných polymérových zložiek sú účinnejšie vo väzbe na enzýmy. To bolo overené aj na štúdiách s rôznym kakaom. Vzorky primárne zložené z monomérov mali najmenší inhibičný efekt. Kakao obsahujúce prevažne komplexné polyméry bolo signifikantne účinné. Najvhodnejšie je teda najmenej spracované kakao – nazývané lavado. Zdá sa, že kakao dokáže potenciálne inhibovať aj iné pankreatické enzýmy101).
Úprava mikrobiómu transplantácií stolice
Fekálna transplantácia je metóda, ktorá je doposiaľ overená a zaužívaná hlavne v liečbe infekcií Clostridium difficile102). V poslednom čase sa začalo uvažovať o využití tejto metódy v liečbe metabolického syndrómu a obezity. Ako vieme, u pacientov trpiacich týmito ochoreniami nachádzame črevnú dysbiózu oproti normálnym jedincom. Baktérie týchto pacientov sú taktiež efektívnejšie v zberaní energie z potravy. Viacerými štúdiami na myšiach, ktoré sú koprofágy, bolo pozorované, že myši, ktoré konzumovali výkaly myší obéznych, pribrali signifikantne viac ako myši, ktoré konzumovali výkaly od myší neobéznych. To podporuje tvrdenie, že patologický mikrobióm má významnú rolu pri metabolickom syndróme103).
Výskum uskutočnený na ľuďoch europoidnej rasy, kde obézna skupina prijímala buď alogénny transplantát od štíhlej skupiny, alebo autológny transplantát, priniesol tiež zaujímavé výsledky. Objekty podstúpili transplantáciu po nočnom hladovaní ako darcov, tak i príjemcov. Pred transplantáciou a 6 týždňov po nej im bola odobraná na posúdenie biopsia tenkého čreva a zároveň sa u nich sledovala citlivosť tkanív na inzulín pomocou „hyperinsulinemic-euglycemic clamp“. Metódou, kedy je kontinuálnou infúziou inzulínu dosiahnutá hladina v plazme nad 100 µU/ml a zároveň je variabilnou infúziou udržovaná konštantná bazálna hladina glukózy. Pri dosiahnutí rovnovážneho stavu sa rýchlosť infúzie glukózy rovná spotrebe glukózy bunkami tkanív v tele a dá sa tým vyjadriť miera inzulínovej senzitivity. U obéznych bola nájdená nižšia diverzita mikrobiómu, aj keď celkové množstvo fekálnych baktérii nebolo znížené. Po 6 týždňoch vzrástla diverzita u skupiny s alogénnou vzorkou aspoň o 15 skupín, hlavne v zastúpení butyrát-produkujúcich baktérii. Zároveň s týmito zmenami mikrobiómu došlo k zvýšeniu inzulínovej citlivosti u tejto pozorovanej skupiny. Či je za mechanizmus zlepšujúci reakciu tkanív k inzulínu zodpovedný butyrát, ktorý zabraňuje prestupu endotoxických zložiek baktérii, nie je ešte úplne objasnené. Taktiež to, či by orálne podanie identifikovaných baktérii malo porovnateľný efekt na glukózový metabolizmus, je ešte otázkou výskumu104).
Otázkou ešte zostáva dlhodobý efekt tejto terapie. Podľa niektorých štúdii na myšiach, bol pri predĺženom podávaní stolice (až 28 týždňov) neobéznych myší myšiam obézny od 25. týždňa oproti očakávanému poklesu alebo udržaní váhy sledovaný prírastok. To môže naznačovať, že existuje nejaký kompenzatórny mechanizmus, ktorý dokáže obrátiť terapeutický efekt tejto metódy105).
Záver
Pacienti s metabolickým syndrómom vykazujú špecifické zmeny črevnej mikroflóry, takzvanú črevnú dysbiózu. Ovplyvnenie tohto mikrobiómu sa ukazuje ako sľubná možnosť terapie a zlepšovania jednotlivých symptómov ako aj v prevencii tohto komplexného ochorenia. Posunúť zloženie baktérii k zostave, ktorá sa nachádza u zdravej populácie, a podporiť v raste pre telo prospešné baktérie sa darí prostredníctvom probiotík, prebiotík alebo transplantácie stolice.
Rola probiotík v ovplyvnení mikrobiómu a následne v súvislosti s komorbiditami metabolického syndrómu bola preukázaná na dosť veľkom počte zvieracích štúdií. Počet štúdií na ľuďoch síce nie je tak veľký, ale i v mnohých týchto štúdiách malo podávanie probiotík prospešné účinky. Po terapii bolo sledované najmä zlepšenie BMI, hmotnosti, krvného lipidového profilu, ale aj inzulínovej senzitivity. Niektoré štúdie však tento metabolický vplyv nepreukázali a konkrétne mechanizmy, ktorými sa dané probiotiká podieľajú na ovplyvnení metabolického syndrómu, nám ešte doposiaľ nie sú presne známe.
Pozitívny efekt prebiotík pochádzajúcich hlavne z rastlinnej zložky našej potravy v prevencii metabolického syndrómu je podložený mnohými štúdiami. Prírodný polyfenol phlorizín vykazuje účinok nie len blokom SGLTs, ale i tým, že významne upravuje zloženie mikrobiómu smerom k SCFAs produkujúcim baktériám a taktiež zvyšuje množstvo baktérie Akkermansia muciniphila, ktorá zohráva významnú rolu v udržovaní a zlepšovaní integrity črevnej bariéry. Ďalšou látkou zo skupiny polyfenolov, ktorej benefičný efekt bol potvrdený mnohými štúdiami, sú kakaové flavanoly. Nie len, že optimalizujú pomer Firmicutes/Bacteroides, taktiež podporujú rast Akkermansie a mnohé svojou komplexnou štruktúrou antagonizujú enzýmy štiepiace sacharidy. Otázkou tu však ešte ostáva, aké je najefektívnejšie alebo teda najvhodnejšie zastúpenie týchto látok v potrave.
Ďalšou, v posledných rokoch hojne diskutovanou možnosťou, je transplantácia stolice. Zatiaľ sa však presadila ako štandardná liečba iba v terapii infekcií spôsobených Clostridium difficile, ku ktorým dochádza často po zničení črevného mikrobiómu antibiotikami. Aj keď v klinických štúdiách bola sledovaná zlepšená diverzita mikrobiómu a inzulínová senzitivita, dlhšie trvajúce štúdie na hlodavcoch nepreukázali pozitívny dlhodobý efekt tejto terapie. To môže naznačovať, že transplantát môže byť nejakými mechanizmami a interakciami s existujúcimi baktériami pozmenený, namiesto toho aby on dlhodobo ovplyvnil mikrobióm daného pacienta.
Aj keď tieto možnosti ešte nie sú štandardom v terapii metabolického syndrómu, tak pokračovanie štúdii v tomto smere sa zdá byť zmysluplné a ovplyvňovanie mikrobiómu má veľký terapeutický potenciál.
Publikácia vznikla na Masarykovej Univerzite v rámci projektu „Behaviorální psychofarmakologie a farmakokinetika v preklinickém výzkumu léčiv“ číslo MUNI/A/1132/2017 podporeného z prostriedkov účelovej podpory na špecifický vysokoškolský výskum, ktorú poskytlo MŠMT v roku 2018.
Stret záujmov: žiadny.
M. Tutková • doc. PharmDr. Jana Rudá-Kučerová, PhD. (∗)
Farmakologický ústav Lékařská fakulta Masarykovy Univerzity
Kamenice 5, 625 00 Brno
e-mail: jkucer@med.muni.cz
Zdroje
1. Monda V, et al. Exercise Modifies the Gut Microbiota with Positive Health Effects. Oxid. Med. Cell. Longev. 2017; 2017, 3831972.
2. Cani P. D, et al. Metabolic Endotoxemia Initiates Obesity and Insulin Resistance. Diabetes 2007; 56, 1761–1772.
3. Gibson G. R., Roberfroid M. B. Dietary modulation of the human colonic microbiota: introducing the concept of prebiotics. J. Nutr. 1995; 125, 1401–1412.
4. Backhed F, et al. The gut microbiota as an environmental factor that regulates fat storage. Proc. Natl. Acad. Sci. 2004; 101, 15718–15723.
5. Eckburg P. B, et al. Diversity of the Human Intestinal Microbial Flora. Science 2005; 308, 1635–1638.
6. Zoetendal E. G., Vaughan E. E., De Vos W. M. A microbial world within us. Mol. Microbiol. 2006; 59, 1639–1650.
7. Sun J., Chang E. B. Exploring gut microbes in human health and disease: Pushing the envelope. Genes Dis. 2014; 1, 132–139.
8. Petschow B, et al. Probiotics, prebiotics, and the host microbiome: the science of translation. Ann. N. Y. Acad. Sci. 2013; 1306, 1–17.
9. Ley R. E., Backhed F., Turnbaugh P., Lozupone C. A., Knight R. D., Gordon J. I. Obesity alters gut microbial ecology. Proc. Natl. Acad. Sci. 2005; 102, 11070–11075.
10. Ley R. E., Turnbaugh P. J., Klein S., Gordon J. I. Microbial ecology: Human gut microbes associated with obesity. Nature 2006; 444, 1022–1023.
11. Collado M. C., Isolauri E., Laitinen K., Salminen S. Distinct composition of gut microbiota during pregnancy in overweight and normal-weight women. Am. J. Clin. Nutr. 2008; 88, 894–899.
12. Jumpertz R, et al. Energy-balance studies reveal associations between gut microbes, caloric load, and nutrient absorption in humans. Am. J. Clin. Nutr. 2011; 94, 58–65.
13. Remely M., Hippe B., Zanner J., Aumueller E., Brath H., Haslberger A. G. Gut microbiota of obese, type 2 diabetic individuals is enriched in Faecalibacterium prausnitzii, Akkermansia muciniphila and Peptostreptococcus anaerobius after weight loss. Endocr. Metab. Immune Disord. Drug Targets 2016; 16, 99–106 .
14. Carabotti M., Scirocco A., Maselli M. A., Severi C. The gut-brain axis: interactions between enteric microbiota, central and enteric nervous systems. Ann. Gastroenterol. 2015; 28, 203–209.
15. Brown A. J, et al. The Orphan G protein-coupled receptors GPR41 and GPR43 are activated by propionate and other short chain carboxylic acids. J. Biol. Chem. 2003; 278, 11312–11319.
16. Xiong Y, et al. Short-chain fatty acids stimulate leptin production in adipocytes through the G protein-coupled receptor GPR41. Proc. Natl. Acad. Sci. USA 2004; 101, 1045–1050.
17. Maslowski K. M, et al. Regulation of inflammatory responses by gut microbiota and chemoattractant receptor GPR43. Nature 2009; 461, 1282–1286.
18. de Vadder F, et al. Microbiota-generated metabolites promote metabolic benefits via gut-brain neural circuits. Cell 2014; 156, 84–96.
19. Archer B. J., Johnson S. K., Devereux H. M., Baxter A. L. Effect of fat replacement by inulin or lupin-kernel fibre on sausage patty acceptability, post-meal perceptions of satiety and food intake in men. Br. J. Nutr. 2004; 91, 591.
20. Cani P. D., Dewever C., Delzenne N. M. Inulin-type fructans modulate gastrointestinal peptides involved in appetite regulation (glucagon-like peptide-1 and ghrelin) in rats. Br. J. Nutr. 2004; 92, 521–526.
21. Cani P. D, et al. Changes in gut microbiota control inflammation in obese mice through a mechanism involving GLP-2-driven improvement of gut permeability. Gut 2009; 58, 1091–1103.
22. Roberfroid M, et al. Prebiotic effects: metabolic and health benefits. Br. J. Nutr. 2010; 104, 1–63.
23. Cani P. D., Hoste S., Guiot Y., Delzenne N. M. Dietary non-digestible carbohydrates promote L-cell differentiation in the proximal colon of rats. Br. J. Nutr. 2007; 98, 32–37.
24. Fruhwürth S., Vogel H., Schürmann A., Williams K. J. Novel Insights into How Overnutrition Disrupts the Hypothalamic Actions of Leptin. Front. Endocrinol. (Lausanne). 2018; 9, 89.
25. Everard A, et al. Responses of gut microbiota and glucose and lipid metabolism to prebiotics in genetic obese and diet-induced leptin-resistant mice. Diabetes 2011; 60, 2775–2786.
26. Petersen A. M. W., Pedersen B. K. The anti-inflammatory effect of exercise. J. Appl. Physiol. 2005; 98, 1154–1162.
27. Bäckhed F., Manchester J. K., Semenkovich C. F., Gordon J. I. Mechanisms underlying the resistance to diet-induced obesity in germ-free mice. Proc. Natl. Acad. Sci. 2007; 104, 979–984.
28. Aronsson L, et al. Decreased fat storage by Lactobacillus paracasei is associated with increased levels of angiopoietin-like 4 protein (ANGPTL4). PLoS One 2010; 5, 13087.
29. Rhee S. H., Pothoulakis C., Mayer E. A. Principles and clinical implications of the brain-gut-enteric microbiota axis. Nat. Rev. Gastroenterol. Hepatol. 2009; 6, 306–314.
30. Kabouridis P. S, et al. Microbiota controls the homeostasis of glial cells in the gut lamina propria. Neuron 2015; 85, 289–295.
31. Tennoune N, et al. Bacterial ClpB heat-shock protein, an antigen-mimetic of the anorexigenic peptide α-MSH, at the origin of eating disorders. Transl. Psychiatry 2014; 4, 458.
32. Gusarov I, et al. Bacterial nitric-oxide synthases operate without a dedicated redox partner. J. Biol. Chem. 2008; 283, 13140–13147.
33. Ji X. B.,Hollocher T. C. Reduction of nitrite to nitric oxide by enteric bacteria. Biochem. Biophys. Res. Commun. 1988; 157, 106–108.
34. Williams B. B, et al. Discovery and characterization of gut microbiota decarboxylases that can produce the neurotransmitter tryptamine. Cell Host Microbe 2014; 16, 495–503.
35. Roberts C. K., Hevener A. L., Barnard R. J. Metabolic syndrome and insulin resistance: underlying causes and modification by exercise training. Comprehensive Physiology 2013; 3, 1–58.
36. Horská K., Kučerová J., Suchý P., Kotolová H. Metabolic syndrome – dysregulation of adipose tissue endocrine function. Ces. slov. Farm. 2014; 63, 152–159.
37. Bloch-Damti A, et al. Differential effects of IRS1 phosphorylated on Ser307 or Ser632 in the induction of insulin resistance by oxidative stress. Diabetologia 2006; 49, 2463–2473.
38. Nishimura S, et al. CD8+ effector T cells contribute to macrophage recruitment and adipose tissue inflammation in obesity. Nat. Med. 2009; 15, 914–920.
39. Boutagy N. E., McMillan R. P., Frisard M. I., Hulver M. W. Metabolic endotoxemia with obesity: Is it real and is it relevant? Biochimie 2016; 124, 11–20.
40. Luche E, et al. Metabolic endotoxemia directly increases the proliferation of adipocyte precursors at the onset of metabolic diseases through a CD14-dependent mechanism. Mol. Metab. 2013; 2, 281–291.
41. Thomas C. J, et al. Evidence of a trimolecular complex involving LPS, LPS binding protein and soluble CD14 as an effector of LPS response. FEBS Lett 2002; 531, 184–188.
42. Ghoshal S., Witta J., Zhong J., De Villiers W., Eckhardt E. Chylomicrons promote intestinal absorption of lipopoly-saccharides. J. Lipid Res. 2009; 50, 90–97.
43. Maziere C., Conte M. A., Dantin F., Maziere J. C. Lipopolysaccharide enhances oxidative modification of low density lipoprotein by copper ions, endothelial and smooth muscle cells. Atherosclerosis 1999; 143, 75–80.
44. Kitchens R. L., Thompson P. A., Viriyakosol S., O’Keefe G. E., Munford R. S. Plasma CD14 decreases monocyte responses to LPS by transferring cell-bound LPS to plasma lipoproteins. J. Clin. Invest. 2001; 108, 485–493.
45. Vora P, et al. Beta-defensin-2 expression is regulated by TLR signaling in intestinal epithelial cells. J. Immunol. 2004; 173, 5398–5405.
46. Mantis N. J., Rol N., Corthésy B. Secretory IgA’s complex roles in immunity and mucosal homeostasis in the gut. Mucosal Immunol. 2011; 4, 603–611.
47. Eberl G., Colonna M., Di Santo J. P., McKenzie A. N. J. Innate lymphoid cells: A new paradigm in immunology. Science 2015; 348, 6566.
48. Wang X, et al. Interleukin-22 alleviates metabolic disorders and restores mucosal immunity in diabetes. Nature 2014; 514, 237–241.
49. Dethlefsen L., Huse S., Sogin M. L., D. A. Relman D. A. The pervasive effects of an antibiotic on the human gut microbiota, as revealed by deep 16S rRNA sequencing. PLoS Biol. 2008; 6, 280.
50. Angelakis E., Armougom F., Million M., Raoult D. The relationship between gut microbiota and weight gain in humans. Future Microbiol. 2012; 7, 91–109.
51. Yun S. I., Park H. O., Kang J. H. Effect of Lactobacillus gasseri BNR17 on blood glucose levels and body weight in a mouse model of type 2 diabetes. J. Appl. Microbiol. 2009; 107, 1681–1686.
52. Kang J. H., Yun S. I., Park M. H., Park J. H., Jeong S. Y., Park H. O. Anti-obesity effect of Lactobacillus gasseri BNR17 in high-sucrose diet-induced obese mice. PLoS One 2013; 8, 54617.
53. Kang J. H., Yun S. I., Park H. O. Effects of Lactobacillus gasseri BNR17 on body weight and adipose tissue mass in diet-induced overweight rats. J. Microbiol. 2010; 48, 712–714.
54. Miyoshi M., Ogawa A., Higurashi S., Kadooka Y. Anti-obesity effect of Lactobacillus gasseri SBT2055 accompanied by inhibition of pro-inflammatory gene expression in the visceral adipose tissue in diet-induced obese mice. Eur. J. Nutr. 2014; 53, 599–606.
55. Ji Y. S, et al. Modulation of the murine microbiome with a concomitant anti-obesity effect by Lactobacillus rhamnosus GG and Lactobacillus sakei NR28. Benef. Microbes 2012; 3, 13–22.
56. Yoo S. R, et al. Probiotics L. plantarum and L. curvatus in combination alter hepatic lipid metabolism and suppress diet-induced obesity. Obesity (Silver Spring). 2013; 21, 2571–2578.
57. An H. M, et al. Antiobesity and lipid-lowering effects of Bifidobacterium spp. in high fat diet-induced obese rats. Lipids Health Dis. 2011; 10, 116.
58. Cano P. G., Santacruz A., Trejo F. M., Sanz Y. Bifidobacterium CECT 7765 improves metabolic and immunological alterations associated with obesity in high-fat diet-fed mice. Obesity (Silver Spring) 2013; 21, 2310–2321.
59. Esposito E, et al. Probiotics reduce the inflammatory response induced by a high-fat diet in the liver of young rats. J. Nutr. 2009; 139, 905–911.
60. Aronsson L, et al. Decreased fat storage by Lactobacillus paracasei is associated with increased levels of angiopoietin-like 4 protein (ANGPTL4). PLoS One 2010; 5, 13087.
61. Kim S. W., Park K. Y., Kim B., Kim E., Hyun C. K. Lactobacillus rhamnosus GG improves insulin sensitivity and reduces adiposity in high-fat diet-fed mice through enhancement of adiponectin production. Biochem. Biophys. Res. Commun. 2013; 431, 258–263.
62. Park D. Y, et al. Supplementation of Lactobacillus curvatus HY7601 and Lactobacillus plantarum KY1032 in diet-induced obese mice is associated with gut microbial changes and reduction in obesity. PLoS One 2013; 8, 59470.
63. Kadooka Y, et al. Effect of Lactobacillus gasseri SBT2055 in fermented milk on abdominal adiposity in adults in a randomised controlled trial. Br. J. Nutr. 2013; 110, 1696–1703.
64. Kadooka Y, et al. Regulation of abdominal adiposity by probiotics (Lactobacillus gasseri SBT2055) in adults with obese tendencies in a randomized controlled trial. Eur. J. Clin. Nutr. 2010; 64, 636–643.
65. Gøbel R. J., Larsen N., Jakobsen M., Mølgaard C., Michaelsen K. F. Probiotics to adolescents with obesity: effects on inflammation and metabolic syndrome. J. Pediatr. Gastroenterol. Nutr. 2012; 55, 673–678.
66. Leber B, et al. The influence of probiotic supplementation on gut permeability in patients with metabolic syndrome: an open label, randomized pilot study. Eur. J. Clin. Nutr. 2012; 6610, 1110–1115.
67. Tripolt N. J, et al. Short communication: Effect of supplementation with Lactobacillus casei Shirota on insulin sensitivity, β-cell function, and markers of endothelial function and inflammation in subjects with metabolic syndrome – a pilot study. J. Dairy Sci. 2013;96, 89–95.
68. Jung S. P, et al. Effect of Lactobacillus gasseri BNR17 on Overweight and Obese Adults: A Randomized, Double-Blind Clinical Trial. Korean J. Fam. Med. 2013; 34, 80–89.
69. Woodard G. A, et al. Probiotics improve outcomes after Roux-en-Y gastric bypass surgery: a prospective randomized trial. J. Gastrointest. Surg. 2009; 13, 1198–1204.
70. Bukowska H., Pieczul-Mróz J., Jastrzebska M., Chełstowski K., Naruszewicz M. Decrease in fibrinogen and LDL-cholesterol levels upon supplementation of diet with Lactobacillus plantarum in subjects with moderately elevated cholesterol. Atherosclerosis 1998; 137, 437–438.
71. Agerholm-Larsen L., Raben A., Haulrik N., Hansen A. S., Manders M., Astrup A. Effect of 8 week intake of probiotic milk products on risk factors for cardiovascular diseases. Eur. J. Clin. Nutr. 2000; 54, 288–297.
72. Naruszewicz M., Johansson M. L., Zapolska-Downar D., Bukowska H. Effect of Lactobacillus plantarum 299v on cardiovascular disease risk factors in smokers. Am. J. Clin. Nutr. 2002; 76, 1249–1255.
73. Andreasen A. S., et al. Effects of Lactobacillus acidophilus NCFM on insulin sensitivity and the systemic inflammatory response in human subjects. Br. J. Nutr. 2010; 104, 1831–1838.
74. Ogawa A., Kadooka Y., Kato K., Shirouchi B., Sato M. Lactobacillus gasseri SBT2055 reduces postprandial and fasting serum non-esterified fatty acid levels in Japanese hypertriacylglycerolemic subjects. Lipids Health Dis. 2014; 13, 36.
75. Cani P. D, et al. Selective increases of bifidobacteria in gut microflora improve high-fat-diet-induced diabetes in mice through a mechanism associated with endotoxaemia. Diabetologia 2007; 50, 2374–2383.
76. Everard A, et al. Responses of gut microbiota and glucose and lipid metabolism to prebiotics in genetic obese and diet-induced leptin-resistant mice. Diabetes 2011; 60, 2775–2786.
77. Delzenne N. M., Neyrinck A. M., Cani P. D. Gut microbiota and metabolic disorders: how prebiotic can work? Br. J. Nutr. 2013; 109, 81–85.
78. Dewulf E. M, et al. Inulin-type fructans with prebiotic properties counteract GPR43 overexpression and PPARγ-related adipogenesis in the white adipose tissue of high-fat diet-fed mice. J. Nutr. Biochem. 2011; 22, 712–722.
79. Cani P. D., Dewever C., Delzenne N. M. Inulin-type fructans modulate gastrointestinal peptides involved in appetite regulation (glucagon-like peptide-1 and ghrelin) in rats. Br. J. Nutr. 2004; 92, 521–526.
80. Cani P. D., Joly E., Horsmans Y., Delzenne N. M. Oligofructose promotes satiety in healthy human: a pilot study. Eur. J. Clin. Nutr. 2006; 60, 567–572.
81. Li A. N., Li S., Zhang Y. J., Xu X. R., Chen Y. M., Li H. B. Resources and biological activities of natural polyphenols. Nutrients 2014; 6, 6020–6047.
82. Roopchand D. E, et al. Dietary Polyphenols promote growth of the gut bacterium Akkermansia muciniphila and attenuate high-fat diet – induced metabolic syndrome. Diabetes 2015; 64, 2847–2858.
83. Taira T, et al. Dietary polyphenols increase fecal mucin and immunoglobulin A and ameliorate the disturbance in gut microbiota caused by a high fat diet. J. Clin. Biochem. Nutr. 2015; 57, 212–216.
84. Williamson G., Clifford M. N. Colonic metabolites of berry polyphenols: the missing link to biological activity? Br. J. Nutr. 2010; 104, 48–66.
85. Zhao Y., Li X., Zeng X., Huang S., Hou S., Lai X. Characterization of phenolic constituents in Lithocarpus polystachyus. Anal. Methods 2014; 6, 1359.
86. González-Gallego J., García-Mediavilla M. V., Sánchez-Campos S., Tuñón M. J. Fruit polyphenols, immunity and inflammation. Br. J. Nutr. 2010; 104, 15–27.
87. Kwon O, et al. Inhibition of the intestinal glucose transporter GLUT2 by flavonoids. FASEB J. 2007; 21, 366–377.
88. Hanhineva K, et al. Impact of Dietary Polyphenols on Carbohydrate Metabolism. Int. J. Mol. Sci. 2010; 11, 1365–1402.
89. Stevens J. F., Maier C. S. The chemistry of gut microbial metabolism of polyphenols. Phytochem. Rev. 2016; 15, 425–444.
90. Cardona F., Andrés-Lacueva C., Tulipani S., Tinahones F. J., Queipo-Ortuño M. I. Benefits of polyphenols on gut microbiota and implications in human health. J. Nutr. Biochem. 2013; 24, 1415–1422.
91. Mei X, et al. Insulin sensitivity-enhancing activity of phlorizin is associated with lipopolysaccharide decrease and gut microbiota changes in obese and type 2 diabetes (db/db) Mice. J. Agric. Food Chem. 2016; 64, 7502–7511.
92. Santacruz A, et al. Gut microbiota composition is associated with body weight, weight gain and biochemical parameters in pregnant women. Br. J. Nutr. 2010; 104, 83–92.
93. Masumoto S., Terao A., Yamamoto Y., Mukai T., Miura T., Shoji T. Non-absorbable apple procyanidins prevent obesity associated with gut microbial and metabolomic changes. Sci. Rep. 2016; 6, 31208.
94. Baba S, et al. Bioavailability of (–)-epicatechin upon intake of chocolate and cocoa in human volunteers. Free Radic. Res. 2000; 33, 635–641.
95. Gibson G. R. Dietary modulation of the human gut microflora using the prebiotics oligofructose and inulin. J. Nutr. 1999; 129, 1438–1441.
96. Tzounis X, et al. Flavanol monomer-induced changes to the human faecal microflora. Br. J. Nutr. 2008; 99, 782–792.
97. Hughes R., Magee E. A., Bingham S. Protein degradation in the large intestine: relevance to colorectal cancer. Curr. Issues Intest. Microbiol. 2000; 1, 51–58.
98. Massot-Cladera M., Pérez-Berezo T., Franch A., Castell M., Pérez-Cano F. J. Cocoa modulatory effect on rat faecal microbiota and colonic crosstalk. Arch. Biochem. Biophys. 2012; 527, 105–112.
99. Tzounis X., Rodriguez-Mateos A., Vulevic J., Gibson G. R., Kwik-Uribe C., Spencer J. P. E. Prebiotic evaluation of cocoa-derived flavanols in healthy humans by using a randomized, controlled, double-blind, crossover intervention study. Am. J. Clin. Nutr. 2011; 93, 62–72.
100. Everard A, et al. Cross-talk between Akkermansia muciniphila and intestinal epithelium controls diet-induced obesity. Proc. Natl. Acad. Sci. USA 2013; 110, 9066–9071.
101. Barrett A, et al. Inhibition of α-amylase and glucoamylase by tannins extracted from cocoa, pomegranates, cranberries, and grapes. J. Agric. Food Chem. 2013; 61, 1477–1486.
102. Brandt L. J. Intestinal microbiota and the role of fecal microbiota transplant (FMT) in treatment of C. difficile Infection. Am. J. Gastroenterol. 2013; 108, 177–185.
103. Konturek P. C, et al. Emerging role of fecal microbiota therapy in the treatment of gastrointestinal and extra-gastrointestinal diseases. J. Physiol. Pharmacol. 2015; 66, 483–491.
104. Vrieze A, et al. Transfer of intestinal microbiota from lean donors increases insulin sensitivity in individuals with metabolic syndrome. Gastroenterology 2012; 143, 913–917.
105. Kulecka M, et al. Prolonged transfer of feces from the lean mice modulates gut microbiota in obese mice. Nutr. Metab. (Lond) 2016; 13, 57.
Štítky
Farmácia Farmakológia
Článok vyšiel v časopiseČeská a slovenská farmacie

2018 Číslo 2-
Všetky články tohto čísla
- Melatonin jako základní stavební jednotka pro léčiva ve vztahu k neurodegenerativním poruchám
- Superrozvolňovadla ve farmaceutické technologii
- Selén v prevencii a podpornej liečbe nádorov mäkkých tkanív
- Mikrobióm v súvislosti s metabolickým syndrómom a možnosti terapeutického využitia jeho ovplyvnenia
- K obsahu národní části Českého lékopisu 2017
- Enchiridion medicinae Juraja Henischa (1549–1618)*
- Česká a slovenská farmacie
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- K obsahu národní části Českého lékopisu 2017
- Superrozvolňovadla ve farmaceutické technologii
- Mikrobióm v súvislosti s metabolickým syndrómom a možnosti terapeutického využitia jeho ovplyvnenia
- Melatonin jako základní stavební jednotka pro léčiva ve vztahu k neurodegenerativním poruchám
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



