-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Řízené uvolňování léčiv z lékových forem obalených vodnými celulosovými a akrylátovými polymerními disperzemi
Drug controlled release from dosage forms coated with aqueous cellulose and acrylic polymer dispersions
Current scientific papers concerning aqueous cellulose and acrylic polymer dispersions for controlled drug delivery are focused on stability studies and the search for suitable coated formulations for drug release at a specific time and site of the gastrointestinal tract. It can be achieved especially by preparing polymer blends or using other additives. The permeability of the ethylcellulose membranes can be increased by the addition of water-soluble polymers (drug release modifiers). If there is no independence of solubility of the drug on pH, a poly(vinyl alcohol)–poly(ethylene glycol) graft copolymer is frequently used, because it simultaneously hinders further polymer particle coalescence during long term storage. With respect to a low glass transition temperature and consequently high tackiness of polymer films, Eudragit NE should be blended with high glass transition temperature polymers which are miscible with the functional coating, for example Eudragit L or Eudragit RS. Eudragit L 30 D-55 coatings take over 2 hours to dissolve in vivo in the human small intestine. This fact can cause delayed drug release and bioavailability reduction of those drugs which are to be absorbed in proximal small intestine. Accelerated coating disintegration can be achieved by preparation of double-coating enteric systems or leaky enteric coatings.
Key words:
controlled release – ethylcellulose – Eudragit RS – Eudragit NE – Eudragit L-55
Autoři: D. Vetchý 1; H. Leštinová 2
Působiště autorů: Veterinární a farmaceutická univerzita Brno, Farmaceutická fakulta, Ústav technologie léků 1; Lékárna Na Předměstí, Třeboň 2
Vyšlo v časopise: Čes. slov. Farm., 2010; 59, 163-171
Souhrn
Současné vědecké práce týkající se celulosových a akrylátových vodných polymerních disperzí pro řízené uvolňování léčiva jsou zaměřené především na studie stability a hledání vhodných obalových formulací zajišťujících uvolňování léčiva v požadovaný čas a na požadovaném místě. Toho se dosahuje zejména vzájemnou kombinací polymerů, případně použitím dalších pomocných látek. Permeabilitu obalů z ethylcelulosy lze zvýšit přidáním pomocného polymeru, tzv. modifikátoru uvolňování. Pokud se léčivo rozpouští nezávisle na pH, využívá se často polyvinylalkohol-polyethylenglykol roubovaný kopolymer, protože zároveň zabraňuje další koalescenci polymerních částic během dlouhodobého uskladnění.
Eudragit NE bývá, vzhledem ke své příliš nízké teplotě sklovitého přechodu a z toho plynoucí vysoké lepivosti částic, kombinován s polymery, které tuto teplotu zvyšují. Používají se například Eudragit L nebo Eudragit RS. Eudragit L 30 D-55 je vzhledem ke své rozpustnosti při pH > 5,5 primárně určen pro zajištění transportu léčiv do tenkého střeva. Protože se však obaly z Eudragitu L 30 D-55 rozpadají v tenkém střevě až po 2 hodinách, není tak možné zajistit dostatečnou absorpci léčiv, která se vstřebávají v proximální části tenkého střeva. Urychlení rozpadu obalu lze dosáhnout přípravou dvojitých obalů nebo propustných enterosolventních obalů uvolňujících část léčiva již v žaludku.Klíčová slova:
řízené uvolňování – ethylcelulosa – Eudragit RS – Eudragit NE – Eudragit L-55Celulosové a akrylátové vodné polymerní disperze se pro přípravu obalených lékových forem s řízeným uvolňováním léčiv používají nejčastěji. Oproti organickým roztokům mají řadu výhod, proto se jim dává při výrobě farmakoterapeutických systémů přednost. Nejsou toxické, nemají negativní dopad na životní prostředí, při použití stejných koncentrací v porovnání s organickými roztoky mají menší viskozitu, což umožňuje použití vyšších koncentrací polymerů a zkrácení doby výroby, a v neposlední řadě se vyznačují nižšími výrobními náklady. Nicméně i vodné polymerní disperze mají nevýhodné vlastnosti. Vyznačují se zejména zhoršenou stabilitou, a tedy citlivostí k různým faktorům (teplota, pH, přítomnost elektrolytů a jiných polymerů) a po jejich aplikaci i zhoršenou dlouhodobou stabilitou léčivého přípravku z důvodu neúplné koalescence polymerních částic během výrobního procesu, která pokračuje během uskladnění.
Formování filmu z vodné disperze je poměrně složitý děj, který je vysvětlován řadou teorií. Polymer se v disperzi vyskytuje ve formě jednotlivých, vzájemně oddělených částic 1) zpravidla o průměru 200–300 nm 2). Již při nástřiku kapaliny na pevný povrch se voda rychle vypařuje, disperze se zahušťuje a částice polymeru se k sobě přibližují. Voda se vypařuje nejrychleji z povrchu, kde se posléze vytvoří tenká membrána. Membrána vytvoří překážku pro další evaporaci, čímž se celý proces zpomalí. Jakmile zůstane kapalina pouze v místě kontaktu jednotlivých částic polymeru, částice se začínají deformovat, hranice mezi nimi zanikají a dochází k jejich vzájemnému splývání (koalescenci) a tvorbě kontinuálního filmu 3).
Filmotvorné polymery jsou většinou amorfní povahy a při obyčejné teplotě se vyskytují v tzv. sklovitém stavu 1). Vyznačují se tvrdostí a křehkostí 4) a jejich použitím vznikají křehké lámavé filmy 5). Těmto nevýhodným vlastnostem lze předejít použitím tzv. změkčovadel (plastifikátorů), což jsou obvykle netěkavé, vysokovroucí kapaliny 6) o nízké molekulové hmotnosti 7), které přetvářejí tvrdé a křehké polymery na měkký, kaučukovitý materiál 4), zlepšují mechanické vlastnosti filmů 8), ovlivňují jejich permeabilitu a rozpustnost 9), snižují minimální filmotvornou teplotu (MFT) 10) a teplotu sklovitého přechodu (Tg) 1). Změny fyzikálních a mechanických vlastností jsou způsobeny zmenšením intermolekulárních kohezních sil mezi polymerními řetězci 6) a následným zvýšením jejich pohyblivosti.
Pro dosažení konstantních disolučních profilů je většinou nezbytné tepelné ošetření.
Cílem příspěvku je shrnout současné poznatky týkající se použití celulosových a akrylátových vodných polymerních disperzí pro přípravu obalených lékových forem s řízeným uvolňováním léčiva. Protože uvedené téma je příliš rozsáhlé, soustředí se příspěvek na ty vodné polymerní disperze, na které se současný výzkum nejčastěji zaměřuje.
Řízené uvolňování založené na celulose a jejích derivátech
Ve farmaceutické technologii se využívají zejména ethery a estery celulosy, jejichž vlastnosti závisejí především na povaze a rozsahu substituce hydroxylových skupin anhydroglukosových jednotek 11). Stupeň substituce (SS) je definován jako průměrný počet substituovaných hydroxylových skupin na jedné anhydroglukosové jednotce celulosy (obr. 1) a jeho maximální hodnota je rovna 3,0 12). Chemická povaha substituce hydroxylových skupin dává vznik derivátům specifických vlastností, rozsah substituce ovlivňuje zejména viskozitu a rozpustnost derivátů 11).
Obr. 1. Strukturní vzorec celulosy <sup>12)</sup> 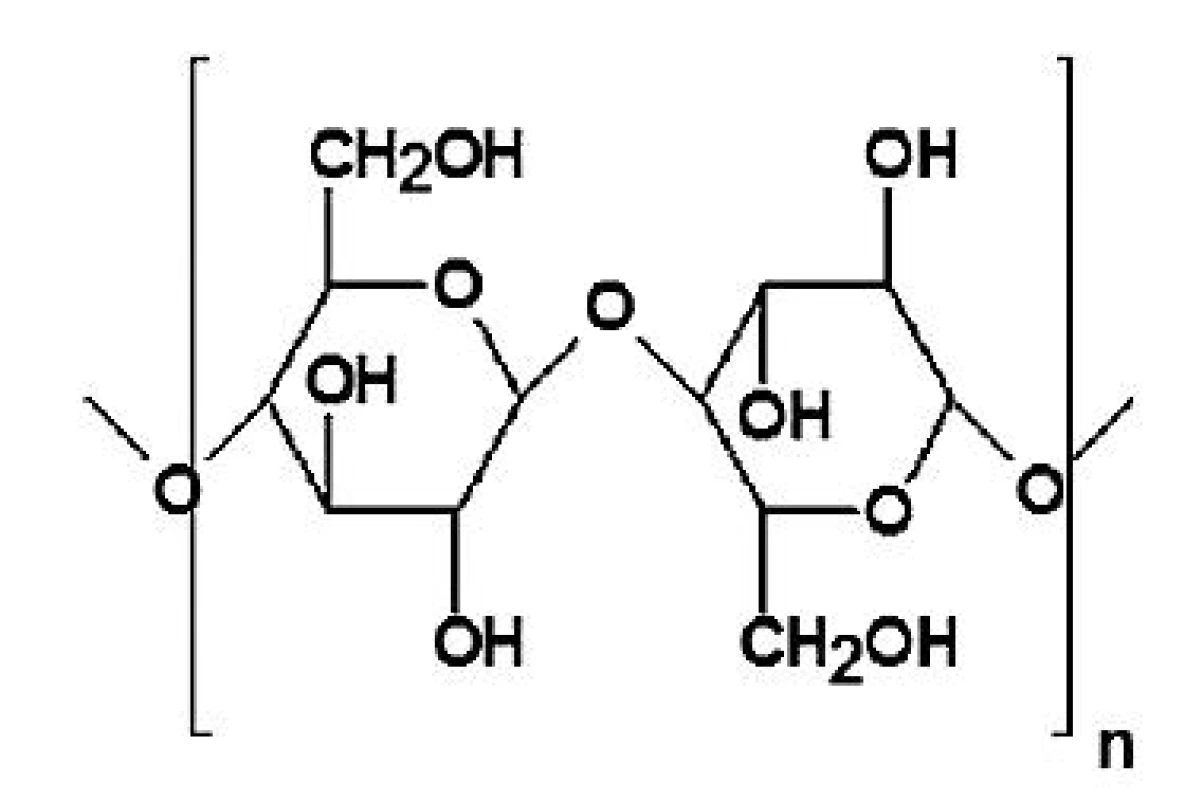
Estery celulosy se využívají především jako obaly enterosolventních lékových forem, což je podmíněno přítomností karboxylových skupin v molekule polymeru. Významným zástupcem této skupiny je celacefát, v němž je přibližně polovina hydroxylových skupin esterifikována acetylem a čtvrtina jednou, případně oběma karboxylovými skupinami kyseliny ftalové. Pokud je k esterifikaci použita pouze jedna karboxylová skupina kyseliny ftalové, druhá zůstává volná a stává se příčinou pH dependentní rozpustnosti celacefátu, které se využívá při přípravě enterosolventních lékových forem. Rozpustnost celacefátu ve vodě se pohybuje kolem pH 6 a bylo zjištěno, že ke kompletnímu rozpuštění celacefátu při pH tenkého střeva je potřeba asi 20% substituce kyselinou ftalovou 13).
Komerčně je celacefát dostupný například pod názvem Aquacoat CPD (dříve Aquateric) 13).
Také ostatní estery celulosy jsou rozpustné v závislosti na pH vodného média. Počátek rozpustnosti se v závislosti na stupni substituce pohybuje u acetát-sukcinátu hypromelosy v rozmezí 5,5–6,8, u ftalátu hypromelosy v rozmezí 5,0–5,5 13).
Ethylcelulosa
Většina ve vodě rozpustných etherů celulosy má hodnotu SS 0,4–2,0, kdežto ethylcelulosa (EC) jako nejčastěji používaný zástupce ve vodě nerozpustných etherů, má hodnotu SS 2,3–2,8 11).
Komerčně dostupný Aquacoat ECD a Surelease jsou dnes v řízeném uvolňování léčiv nejvíce využívané vodné disperze ethylcelulosy. Surelease je produkt firmy Colorcon a vyrábí se metodou inverze fází 14). Aquacoat ECD je produkt firmy FMC Corporation a vyrábí se metodou odpařování rozpouštědla 13). Laurylsulfát sodný a cetylalkohol slouží jako emulgátory a stabilizátory disperze 6). Aquacoat ECD neobsahuje plastifikátor, vhodné množství plastifikátoru se přidává až před vlastním obalováním.
Tepelně ošetřené filmové obaly z EC bez přídavku jakýchkoliv hydrofilních pomocných látek jsou špatně propustné pro většinu léčiv bez ohledu na typ disolučního média nebo tloušťku obalu 15). Permeabilitu obalů lze zvýšit přidáním pomocného polymeru, tzv. modifikátoru uvolňování 16). Jaký polymer se zvolí, závisí především na rozpustnosti léčiva v závislosti na pH.
Pokud se léčivo rozpouští nezávisle na pH, zvýší se jeho uvolňování přidáním ve vodě rozpustného polymeru, který po kontaktu s vodným médiem migruje ven z obalu, a vzniknou póry, přes které se léčivo uvolní. Mezi nejčastěji používané patří polyvinylalkohol-polyethylenglykol roubovaný kopolymer (PVA-PEG roubovaný kopolymer), hypromelosa (HPMC), polyethylenglykol (PEG) a povidon 15). HPMC ale způsobuje v komerčně dostupných disperzích EC (Surelease, Aquacoat ECD) flokulaci polymerních částic a následné snížení uvolňování léčiva po dlouhodobém uskladnění 15).
Rozpustnost některých léčiv je však silně závislá na pH disolučního média, a proto se EC kombinuje s polymery rozpustnými v tenkém střevě. Permeabilita směsi polymerů je při pH žaludku nízká, kdežto se zvyšujícím se pH roste. Tento postup kompenzuje uvolňování léčivých látek typu slabé báze, jejichž rychlosti uvolňování jsou při použití tradičních filmových obalů vysoké v žaludku a významně nižší ve střevě. Jako příklad lze uvést například kopolymery kyseliny methakrylové a methylmethakrylátu, acetát-sukcinát hypromelosy, celacefát, karagenan nebo propylenglykolalginát (PG alginát) 17, 18).
Rychlost uvolňování léčiva lze korigovat tloušťkou filmového obalu a množstvím použitého modifikátoru uvolňování. Kinetika uvolňování léčiva je závislá na typu přidaného plastifikátoru.
Po přidání hydrofilního plastifikátoru dochází společně s vodou k jeho částečné ztrátě během obalování, tepelného ošetření nebo uskladnění. Během disoluce pak přechází do disolučního média. Protože se Tg EC díky částečné ztrátě plastifikátoru a jeho přechodu do disolučního média zvyšuje na více než 37 oC, je EC ve sklovitém stavu a nemá tendenci se smršťovat. Volné prostory vzniklé přechodem plastifikátoru a pomocného polymeru (modifikátoru uvolňování) do disolučního média tedy zůstávají zachovány a léčivo jimi difunduje ven z lékové formy. Hydrofilní povaha plastifikátorů je podstatou uvolňování špatně rozpustného léčiva kinetikou nultého řádu. Uvolňování probíhá konstantní rychlostí, protože na vnitřní straně difuzní membrány se po celou dobu uvolňování udržuje nasycený roztok špatně rozpustného léčiva a na vnější straně jsou zajištěny dokonalé „sink“ podmínky. Výsledkem jsou konstantní koncentrační gradienty a uvolňování léčiva kinetikou nultého řádu. Zástupcem hydrofilních plastifikátorů je triethyl-citrát (TEC) a diethyl-ftalát (DEP) 15, 19–21).
Plastifikátory nerozpustné ve vodě, jejichž zástupci jsou dibutyl-ftalát (DBP) a dibutyl-sebakát (DBS), jsou v obalu přítomny i po přechodu pomocného polymeru do disolučního média, snižují Tg EC pod 37 oC. EC, která se tedy vyskytuje v kaučukovitém stavu, má tendenci se smršťovat a volné prostory vytvořené pomocným polymerem zanikají. Tato skutečnost je příčinou dvoufázového uvolňování léčiva 20, 21).
Yang et al. studovali vliv rozpustnosti plastifikátoru ve vodě na výsledné uvolňování diltiazem-hydrochloridu při různých podmínkách tepelného ošetření a tloušťkách obalu. Filmy z EC tepelně ošetřené 1 hodinu při 60 oC obsahující TEC absorbovaly vodu rychleji a ve větším množství než filmy obsahující ve vodě méně rozpustný DBS a Myvacet složený z acetylovaných monoglyceridů. Zároveň došlo rozpuštěním TEC a jeho přechodem do disolučního média ke snížení hmotnostního podílu obalu k jádru. Vyšší obsah vody a přechod hydrofilních pomocných látek do disolučního média byly tedy podstatou výsledného zvýšení permeability EC filmů. Pokud byly filmy tepelně ošetřeny po dobu 24 hodin teplotou 60 °C při relativní vlhkosti (RH) 75 %, rozdíly v uvolňování léčiva v závislosti na jednotlivých typech plastifikátorů nebyly významné a disoluční profily byly stabilní po dobu 6 měsíců i při uskladnění za podmínek 40 °C/75 % RH 22).
V případě směsi polymerů je však také velmi důležitá relativní afinita plastifikátoru k jednotlivým polymerům. Odlišné afinity mohou vyústit v nehomogenní redistribuci plastifikátoru mezi polymery, a ovlivňovat tak strukturu filmového obalu během uskladnění s následným ovlivněním uvolňování léčiva 15).
Polyvinylalkohol-polyethylenglykol roubovaný kopolymer jako modifikátor uvolňování léčiva z ethylcelulosových obalů
Jako modifikátor uvolňování léčiva z EC obalů je v poslední době intenzivně zkoumán zejména PVA-PEG roubovaný kopolymer, vyráběn pod obchodním názvem Kollicoat IR (obr. 2), protože zabraňuje další koalescenci polymerních částic během dlouhodobého uskladnění a minimalizuje tak jednu z hlavních negativních vlastností, které souvisejí s používáním vodných polymerních disperzí, dlouhodobou nestabilitu. Díky své hydrofilní povaze zlepšuje PVA-PEG roubovaný kopolymer formování filmu během obalování a tepelného ošetření zvýšením rychlosti absorpce vody a jejího absorbovaného množství. Voda je nutná pro vznik kapilárních sil a působí jako plastifikátor. PVA-PEG roubovaný kopolymer může také působit jako mechanická zábrana pokračujícího formování filmu mezi neúplně splynutými polymerními částicemi. Aby byla tepelným ošetřením po dobu 24 hodin při teplotě 60 oC a RH okolního prostředí zajištěna stabilita obalu během skladování jak při teplotě 25 °C a 60 % RH, tak při 40 °C/75 % RH, je nutné použít minimálně 10 % (w/w) PVA-PEG roubovaného kopolymeru v obalu 16, 19, 23, 24).
Obr. 2. Strukturní vzorec PVA-PEG roubovaného kopolymeru (Kollicoat IR) <sup>24)</sup> 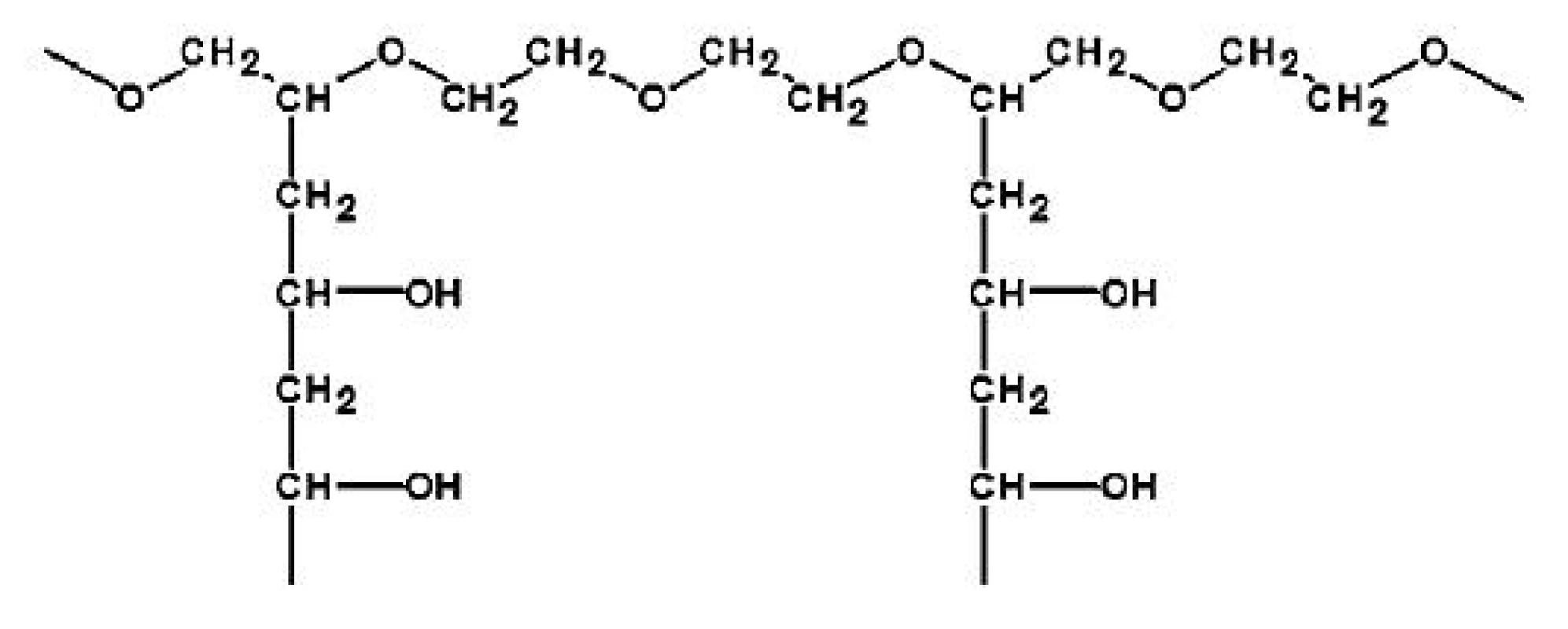
Osmoticky aktivní jádra a ve vodě dobře rozpustná léčiva mohou díky značnému influxu vody do systému bránit difuzi léčiva ven z obalené lékové formy, silný hydrostatický tlak vznikající v jádře může mechanicky namáhat obal, který při nedostatečné stabilitě praská, a výsledkem je rychlé uvolnění léčiva 25, 26). Léčiva ve vodě špatně rozpustná, jejichž klasickým zástupcem je theofylin, nemají vliv na absorpci vody do systému. Absorpce vody je v těchto případech určována pouze množstvím použitého PVA-PEG roubovaného kopolymeru.
Použití ve vodě nerozpustných plastifikátorů je spojeno s dvoufázovým profilem uvolňování léčiva. Během první fáze je uvolňování léčiva díky přechodu PVA-PEG roubovaného kopolymeru do disolučního média rychlé, ale během druhé fáze se kvůli zmenšujícím se volným prostorům mezi polymerními řetězci rychlost uvolňování léčiva výrazně snižuje 20).
Rychlost uvolňování lze korigovat množstvím přidaného PVA-PEG roubovaného kopolymeru a tloušťkou obalu. Z hlediska řízeného uvolňování se jako ideální pro ve vodě špatně rozpustná léčiva jeví 15 % (w/w) PVA--PEG roubovaného kopolymeru v obalu a tloušťka obalu 15 % (w/w). Dlouhodobá stabilita lékových forem obalených směsí EC a PVA-PEG roubovaného kopolymeru v poměru 85 : 15 je zajištěna již při tepelném ošetření 24 h/60 oC/RH okolního prostředí 23).
Ze studií, které se prováděly s diltiazem-hydrochloridem jako zástupcem ve vodě rozpustných léčiv, vyplynulo, že při použití stejného množství PVA-PEG roubovaného kopolymeru, stejné tloušťky obalu a přibližně stejné velikosti jádra, bylo uvolňování diltiazem-hydrochloridu ve srovnávání s theofylinem rychlejší. Protože se veškeré léčivo po absorpci vody rozpustí a molekuly léčiva, které opouštějí systém, nemají být jak nahrazovány, koncentrační gradienty mezi vnitřní a vnější stranou membrány se s časem zmenšují. Léčivo se uvolňuje kinetikou prvního řádu. Přítomnost pouze 5 % (w/w) PVA--PEG roubovaného kopolymeru v obalu není dostačující k zajištění dostatečné koalescence polymerních částic během obalování/tepelného ošetření a zabránění strukturních změn v obalu během uskladnění bez ohledu na množství léčiva a typ plastifikátoru. Z hlediska řízeného uvolňování a zachování dlouhodobé stability se jako ideální jeví složení filmového obalu EC:PVA-PEG roubovaný kopolymer 90 : 10 a tloušťka obalu 30 % (w/w). Během prvních 8 hodin se uvolní přibližně 80 % léčiva 23).
Další modifikátory uvolňování léčiva z ethylcelulosových obalů
Ve studii z roku 2009 Kranz et al. zjišťovali vliv přídavku enterosolventního polymeru Kollicoatu MAE 30 DP (kopolymer kyseliny methakrylové a methylmethakrylátu) k EC vodné disperzi na uvolňování slabě bazických léčiv, konkrétně vatalanib-sukcinátu. Rychlost uvolňování léčiva se v závislosti na pH měnila podle množství přidaného Kollicoatu MAE 30 DP. V prostředí žaludku byla rychlost uvolňování vyšší než ve střevě, pokud bylo množství přidaného Kollicoatu MAE 30 DP 15 a 25 % (w/w). Pokud bylo množství Kollicoatu MAE 30 DP v obalu 35 a 45 % (w/w), rychlost uvolňování byla vyšší ve střevě. Tato skutečnost byla vysvětlena slabě bazickou povahou léčiva (léčivo je lépe rozpustné při nižším pH) a přítomností karboxylových skupin v Kollicoatu MAE 30 DP (polymer je lépe rozpustný při vyšším pH). Snížená rozpustnost léčiva při vyšším pH je kompenzována zvýšením permeability obalu a tento jev je výraznější při vyšším množství Kollicoatu MAE 30 DP v obalu. Tepelné ošetření za podmínek 48 h/60 oC/75 % RH poskytlo stabilní disoluční profily po dobu dvou let pouze při uskladnění v podmínkách 25 oC/60 % RH 18).
V případě prodlouženého uvolňování slabě bazických léčiv může být EC kombinována také například s Eudragitem L. Minimální množství enterosolventního polymeru potřebné k vytvoření spojité fáze kolem EC je 40 % (w/w) 27). Pro dosažení stabilních profilů uvolňování je dostačující tepelné ošetření 24 h/60 oC bez ohledu na rozpustnost plastifikátoru. Plastifikátory nerozpustné ve vodě se však musí do disperze přidat již 24 hodin před filmovým obalováním, jinak nedojde k rovnoměrné distribuci plastifikátoru mezi polymery 28).
PG alginát je hydrofilní polymer, který významně zvyšuje rychlost absorpce vody a její absorbované množství 17), a díky volným karboxylovým skupinám je jeho rozpustnost vyšší v zásaditém pH. Siepmann et al. provedli testy disoluce s cílem zhodnotit vliv různého množství PG alginátu na rychlost uvolňování léčiva a jeho uvolněné množství. Z výsledků testů vyplynulo, že pro dosažení 8hodinového prodlouženého uvolňování theofylinu je optimální obalení pelet směsí EC : PG alginát 90 : 10 a tloušťka obalu 20 % (w/w). Při teplotě a RH okolního prostředí byly obalené pelety stabilní po dobu 6 měsíců bez ohledu na podmínky tepelného ošetření, tloušťku obalu a pH disolučního média. Nicméně k významnému snížení v rychlosti uvolňování theofylinu došlo během uskladnění pelet po dobu 6 měsíců při 40 oC/75 % RH, účinek byl výraznější v zásaditém pH 17, 19).
Řízené uvolňování založené na akrylátových polymerech
Akrylátové polymery používané ve farmaceutické technologii jsou známy převážně pod obchodním názvem Eudragit. Chemicky se jedná o kopolymery esterů kyseliny akrylové a methakrylové, jejichž fyzikálně-chemické vlastnosti jsou určovány funkčními skupinami 29, 30).
Níže příspěvek shrnuje výsledky vědeckých prací týkajících se tří v současnosti nejvíce zkoumaných typů: Eudragitu NE 30 D, RS 30 D a L 30 D-55 (obr. 3).
Obr. 3. Strukturní vzorce Eudragitu NE 30 D, RS 30 D a L 30 D-55 <sup>30)</sup> 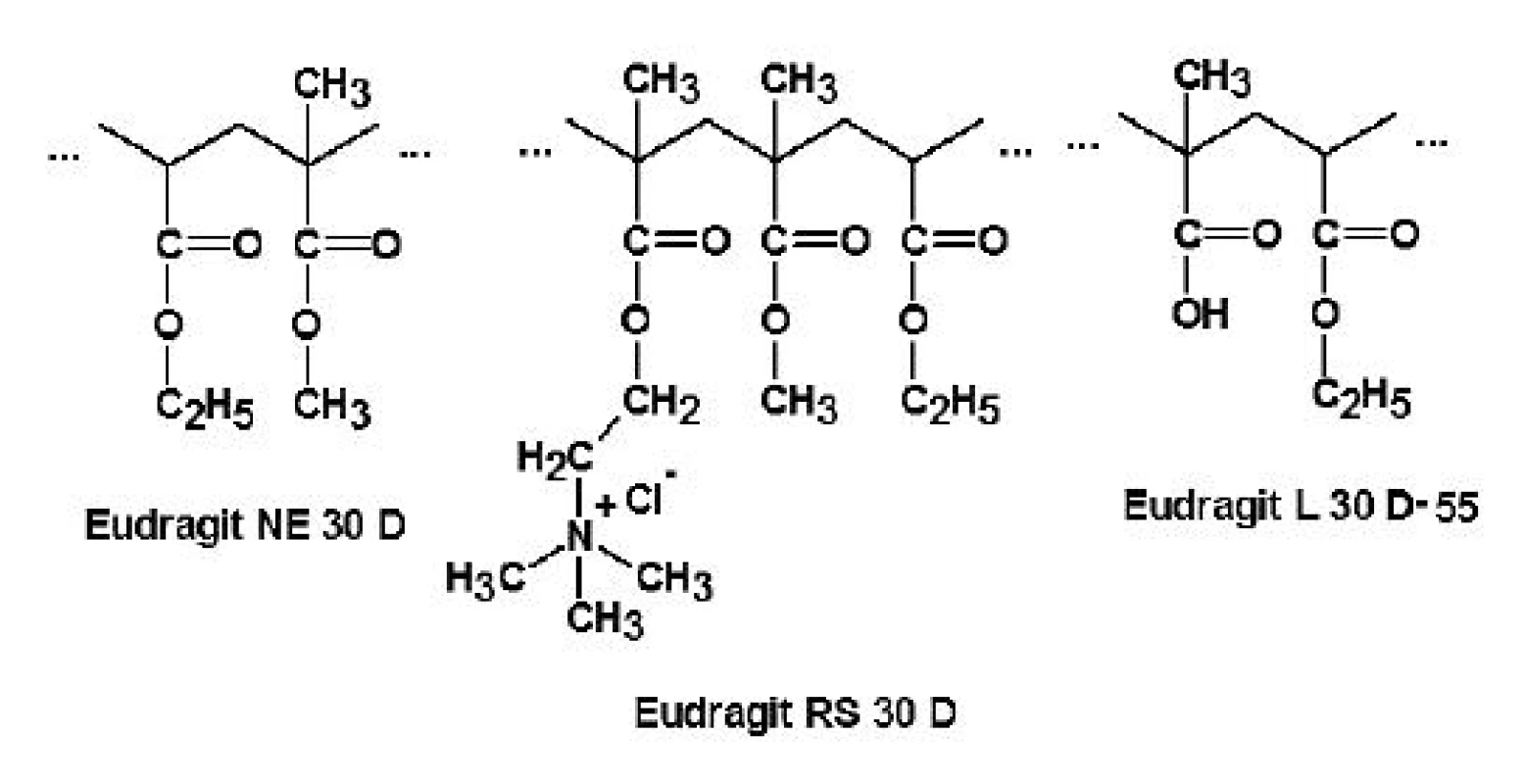
Eudragit NE 30 D
Filmy z Eudragitu NE 30 D mají díky velmi nízké teplotě sklovitého přechodu (Tg < 8 oC) 13) velmi dobré mechanické vlastnosti, a proto nevyžadují přítomnost plastifikátoru. Velkou nevýhodou Eudragitu NE je vysoká lepivost, která je příčinou aglomerace polymerních částic 31). Aglomeraci lze předejít přidáním antiadhezivních látek snižujících lepivost během obalování, tepelného ošetření a dlouhodobého uskladnění, např. mastku nebo glycerol-monostearátu (GMS) 14). Protože k významnějšímu snížení lepivosti je potřeba více než 100 % (w/w) mastku, jeví se jako výhodnější použít GMS, případně Span 20, 40, 60, 80 (5 % (w/w)). Mírná lepivost však přetrvává i v těchto formulacích při tepelném ošetření 24 h/40 oC, proto jsou obalená jádra před začátkem tepelného ošetření smíchávána s 5 % (w/w) mastku 31).
Vodná disperze Eudragit NE 30 D je stabilní v rozmezí pH 2–11 i po přídavku pigmentů TiO2, resp. Fe2O3. Na stabilitu nemá vliv ani přídavek NaCl v koncentraci 0,001–0,1 mol/l. Stabilní chování vodné disperze Eudragitu NE 30 D vůči změně pH nebo přidání pigmentu či elektrolytu je vysvětlováno stérickou stabilizací neiontovým surfaktantem Nonoxynolem 100 obsaženým v disperzi 32).
Změny fyzikálních parametrů ovlivňujících permeabilitu polymerních filmů, a tedy liberaci účinné látky, jsou u Eudragitu NE 30 D zvlášť významné, protože kromě pokračující koalescence polymerních částic může během uskladnění krystalizovat endogenní emulgátor Nonoxynol 100 (teplota tání 58–59 oC) a ovlivňovat tak disoluční profil účinné látky. Vykrystalizováním emulgátoru na povrchu polymerního obalu se mění struktura obalu (mění se tloušťka obalu, na povrchu obalu se tvoří trhliny) signalizující změnu permeability filmu a rozpouštění účinné látky. Podle studie, kterou zhotovili v roce 2003 Bajdik et al., ovlivňuje krystalizaci emulgátoru teplota (25 oC více než 40 oC), vlhkost (čím nižší, tím více) a doba uskladnění. Délka uskladnění zvyšovala krystalizaci za každých podmínek. Řešením je skladování lékových forem v dobře uzavřených obalech 33).
Problém fyzikálního stárnutí disperze Eudragitu NE 30 D vlivem nízké Tg lze řešit smísením s disperzí polymeru o vyšší Tg, která je s disperzí Eudragitu NE 30 D mísitelná, např. s Eudragitem RS 30 D, Eudragitem L 30 D nebo Eudragitem L 30 D-55 34).
Eudragit NE 30 D ve směsi s Eudragitem L 30 D
Uvolňování léčiva přes polymerní membránu ovlivňuje poměr polymerů ve směsi. Studie z roku 2005 zhotovená Lecomtem et al. se zabývala vlivem poměru polymerů ve směsi Eudragit NE : Eudragit L na absorpci vody přes vrstvu polymeru a na výsledné profily uvolňování modelového léčiva verapamil-hydrochloridu. Rychlost absorpce vody a její množství absorbované obalem se zvyšovalo se zvyšujícím se zastoupením Eudragitu L ve směsi (vyšší hydrofilita a bobtnavost Eudragitu L v porovnání s Eudragitem NE). Ve fosfátovém pufru (pH 7,4) byla rychlost absorpce vody a její absorbované množství mnohem vyšší než v 0,1 M HCl. Důvodem je rozpouštění Eudragitu L, který je nahrazován absorbovanou vodou a zároveň působení odpudivých sil mezi karboxylovými skupinami vede ke zvýšenému bobtnání zbylého polymeru. Výsledkem byla zvyšující se rychlost uvolňování léčiva a zvýšení jeho uvolněného množství 27).
Ve fosfátovém pufru (pH 7,4) se množství obalem absorbované vody lišilo v závislosti na vzájemném poměru obou polymerů v obalu. Ve směsi Eudragit NE : Eudragit L 25 : 75 docházelo během disoluce k počátečnímu zvětšení a následnému zmenšení povrchu, množství vody v obalu však zůstalo stejné. Pokud byl poměr polymerů ve směsi 50 : 50 nebo 75 : 25, docházelo nejprve k výrazné absorpci vody (51–66 % (w/w) vody) a následně k „odpuzení“ vody z obalu, takže její obsah se snížil na 35–40 % (w/w). Důvodem bylo rozpuštění hydrofilního polymeru Eudragitu L, čímž se film stal více hydrofobní, a vytlačil tak vodu ven z obalu. Podmínkou tohoto „odpuzení“ vody byla vysoká flexibilita zbylé polymerní struktury (Eudragitu NE). Protože z experimentálně zjištěných hodnot energií potřebných k porušení filmových obalů vyplynulo, že obaly byly dostatečně mechanicky pevné, léčivo se uvolňovalo i po rozpuštění Eudragitu L difuzí přes polymerní membránu 27).
Eudragit NE 30 D ve směsi s Eudragitem RS 30 D
Aby se dosáhlo Tg > 37 oC, je nutné k Eudragitu NE 30 D přidat minimálně stejné množství Eudragitu RS 30 D. Při poměru směsi 1 : 1 (w/w) je Tg rovna 38,09 oC. Rychlost uvolňování léčiva přes vrstvu tvořenou směsí polymerů je vyšší v porovnání s vrstvou tvořenou pouze Eudragitem NE, protože Eudragit RS obsahuje kvartérní amoniové funkční skupiny, které podporují bobtnání a zvyšují permeabilitu obalu 34). Tepelně ošetřené (18 h/60 oC) theofylinové pelety obalené směsí Eudragit NE:Eudragit RS 1 : 1 byly stabilní po dobu 3 měsíců v podmínkách 25 oC/60 % RH, v podmínkách uskladnění 40 oC/75 % RH se rychlost uvolňování theofylinu snížila 34).
Eudragit RS
Vodná disperze Eudragit RS 30 D je stabilní v rozmezí pH 2–11 i po přídavku pigmentů TiO2, resp. Fe2O3. Na stabilitu nemá vliv ani přídavek NaCl v koncentraci 0,001–0,1 mol/l 32).
Eudragit RS je polymer, jehož schopnost bobtnat a propouštět vodu je závislá na obsahu hydrofilních kvartérních amoniových skupin. Permeabilita polymeru pro léčivo je určována právě množstvím absorbované vody, a tedy zvýšením pohyblivosti polymerních řetězců, jejímž důsledkem je zvýšená pohyblivost léčiva uvnitř polymerní sítě. Požadované kinetiky uvolňování léčiva se v případě Eudragitu RS nejčastěji docílí jeho kombinací s Eudragitem RL, který je díky vyššímu obsahu kvarterních amoniových skupin hydrofilnější, a proto zvyšuje rychlost uvolňování léčiva. Například prostup fenylpropanolamin-hydrochloridu přes obal tvořený Eudragitem RL je 8× vyšší než přes obal z Eudragitu RS, zatímco u chlorfenamin-maleinátu je vyšší pouze 3×. Permeabilita obalů se tak může přizpůsobit požadavkům změnou poměru polymerů ve směsi 15).
Disperze Eudragitu RS vyžaduje přidání plastifikátoru. Množství TEC, které zajistí tvorbu kontinuálního filmu bez prasklin, je 10 % (w/w) 35). PEG 6000 je více rozpustný než TEC a přidání 10 nebo 15 % (w/w) PEG 6000 do disperze Eudragitu RS vedlo při disoluci k tvorbě prasklin a zrychlenému uvolňování léčiva v důsledku rozpouštění PEG 6000 35). Plastifikátory nerozpustné ve vodě se ze systému ani po kontaktu s vodou neztrácí a zůstávají v obalu. Stejně jako u plastifikátorů rozpustných ve vodě platí, že se zvyšujícím se množstvím ve vodě nerozpustných plastifikátorů se uvolňování léčiva snižuje v důsledku zlepšené koalescence polymerních částic a snížené možnosti tvorby prasklin. Zástupci využívaní pro Eudragit RS jsou například acetyltriethyl-citrát (ACET), tributyl-citrát (TBC) a dibutyl-sebakát (DBS). DBS má poměrně špatný plastifikační efekt, díky němuž se léčivo uvolňuje vyšší rychlostí 36). Přilnavost polymeru se výrazně zvýší, pokud je koncentrace plastifikátoru vyšší než 25 % (w/w). Molekulová hmotnost a rozpustnost plastifikátoru ve vodě hrají ve změně adhezivních vlastností polymerů důležitou roli. Plastifikátory rozpustné ve vodě zvyšují přilnavost polymerů výrazněji než polymery ve vodě nerozpustné 37). Vedle klasických plastifikátorů zmíněných v předchozích kapitolách mohou jako plastifikátory fungovat i některé další pomocné látky, např. surfaktanty nebo konzervanty a dokonce i samotná léčiva 38).
Jako antiadhezivní činidla lze v případě disperze Eudragitu RS použít mastek, GMS a surfaktanty Span 40 a Span 60. Span 20 a Span 80 používané jako antiadhezivní činidla v obalových formulacích Eudragitu NE nelze aplikovat v případě Eudragitu RS, protože jejich přídavek lepivost filmů z Eudragitu RS naopak zvyšuje 31).
Proces tepelného ošetření, jehož se využívá s cílem zajistit konstantní profily uvolňování léčiva, ve většině případů rychlost uvolňování snižuje, případně nemá na rychlost uvolňování žádný vliv. Nicméně během tepelného ošetření v horkovzdušných sušárnách filmů obsahujících hydrofilní plastifikátor může, zvláště při vyšších teplotách, docházet ke ztrátám plastifikátoru a vlhkosti, které vedou ke zvýšení Tg a tvorbě porézních a křehkých obalů projevující se rychlou disolucí léčiva. Tímto způsobem došlo ke zvýšené rychlosti uvolňování léčiva po tepelném ošetření obalů tvořených Eudragitem RS obsahujících plastifikátor TEC při teplotě vyšší než 70 oC a době delší než 4 hodiny 39, 40).
Vliv hydroxyethylcelulosy na dlouhodobou stabilitu filmů z Eudragitu RS
Hydroxyethylcelulosa (HEC) je díky své hydrofilní povaze nemísitelná s hydrofobním Eudragitem RS a během tepelného ošetření vytváří kolem částic Eudragitu RS spojitou fázi a mechanicky tak brání další koalescenci polymerních částic a proplétání řetězců. Vyrobené filmy jsou vlivem HEC poróznější a výsledkem je tedy zvýšená permeabilita pro vodu a vyšší rychlost disoluce. Rychlost uvolňování theofylinu z pelet obalených disperzí Eudragitu RS s 20 % (w/w) TEC a 10 % (w/w) HEC a tepelně ošetřených 24 h/40 oC byla stabilní po dobu 4 měsíců při 25 oC/60 % RH a bez počátečního zpoždění v uvolňování léčiva na rozdíl od formulací bez HEC 41).
Eudragit L 30 D-55
Vodná disperze Eudragit L 30 D-55 se využívá při filmovém obalování enterosolventních lékových forem, jejichž obsah má být cíleně uvolněn ve dvanáctníku (polymer se rozpouští při pH > 5,5) 30). Vodná disperze je při pH 2 nestabilní, dochází k agregaci částic. V rozmezí pH 3–5 je disperze stabilní i po přídavku pigmentů TiO2, resp. Fe2O3. Částice vodné disperze Eudragitu L 30 D-55 začínají agregovat již při koncentraci 0,06 mol/l NaCl 32).
Při disoluční zkoušce pelet obalených Eudragitem L 30 D-55 obsahujících ranitidin-hydrochlorid se zjistilo, že z pelet obalených 7,5 % (w/w) Eudragitu L 30 D-55 se v simulované žaludeční tekutině (SŽT) (pH 1,2) do dvou hodin uvolnilo 98 % léčiva, z pelet obalených 10 % (w/w) se uvolnilo 75 % léčiva a z pelet obalených 15 % (w/w) se uvolnila 4 % léčiva. Po převedení pelet do fosfátového pufru (pH 6,0) došlo ke kompletnímu uvolnění léčiva z pelet během 30 minut 42). Když se disperze Eudragitu L 30 D-55 použije ve směsi s disperzí Eudragitu NE 30 D, která obsahuje minimálně 80 % (w/w) Eudragitu NE 30 D, lze dosáhnout výrazného zpomalení uvolňování léčiva (7 hodin) 43). Minimálně 80% koncentrace Eudragitu NE 30 D je nutná, protože až od tohoto množství je směs polymerů plně mísitelná a homogenní a schopná vytvořit ideálně spojitý film 43).
In vivo se lékové formy obalené vodnou disperzí Eudragitu L 30 D-55 rozpadají po 2 hodinách v tenkém střevě a léčivo se tedy uvolňuje až v distální části tenkého střeva, což způsobuje opožděnou odpověď na medikaci a sníženou biologickou dostupnost léčiv absorbujících se v proximální části tenkého střeva. Možnými postupy jak dosáhnout rychlejšího uvolňování léčiva v proximální části tenkého střeva je tvorba tzv. dvojitých obalů („double-coating“), příp. kombinace Eudragitu L 30 D‑55 s látkami rozpustnými v kyselém prostředí (laktosa, PEG 8000) nebo neiontovými surfaktanty (Tween 80, Span 60) 47).
Dvojité obaly
Dvojité obaly jsou tvořeny z vnitřního a vnějšího obalu. Vnitřní obal je složen z Eudragitu L 30 D-55 a z 10 % (w/w) organické kyseliny (převážně se používá kyselina citronová nebo adipová) a tato vrstva se přídavkem 1 M NaOH neutralizuje na pH 5,6, čímž vzniká sodná sůl organické kyseliny vytvářející tlumivý systém. Uvolňování léčiva z formulací obsahujících kyselinu citronovou je rychlejší než z formulací obsahujících kyselinu adipovou z důvodu vyšší rozpustnosti kyseliny citronové ve vodě. Změna koncentrace z 10 na 20 % (w/w) v případě kyseliny citrónové má poměrně malý vliv na rychlost uvolňování léčiva. Naproti tomu změna koncentrace z 10 na 15 % (w/w) v případě kyseliny adipové výrazně zvyšuje rychlost uvolňování léčiva. Při zvýšení koncentrace kyseliny adipové na 20 % (w/w) a více dochází k její krystalizaci na povrchu obalů a k výraznému snížení v rychlosti uvolňování. Vnější obal tvoří vrstva Eudragitu L 30 D-55, která chrání vnitřní obal před kyselým prostředím. Bez její ochranné funkce by se sůl filmotvorného polymeru přeměnila v kyselém prostředí žaludku zpět na původní kyselou formu a uvolňování léčiva by se výrazně zpomalilo 44).
Mechanismus zrychlení uvolňování léčiva pomocí dvojitých obalů je založen na vlastnostech vnitřního obalu. Disoluční médium se po penetraci vnějším obalem dostává do kontaktu s vnitřním obalem a rozpouští ho (Eudragit L 30 D-55 ve vnitřním obalu je přídavkem 1 M NaOH částečně převeden na ve vodě rozpustný polymer). Rozpuštěný kyselý polymer a jeho sodná sůl společně s organickou kyselinou a její sodnou solí vytváří tlumivý systém a zvyšují iontovou sílu. Společně tak podporují rozpouštění vnějšího obalu. Rozpouštěním vnějšího obalu se snižuje pH uvnitř lékové formy, proto je nutná přítomnost tlumivého systému, který udržuje pH v takové oblasti, při kterém se vnější obal rozpouští 44, 45).
Z testů disoluce pelet obalených dvojitým obalem vyplynulo, že po 2 hodinách v 0,1 M HCl nedocházelo k žádnému uvolnění léčiva, membrána lékové formy zůstala v kyselém prostředí nezměněna. Při přenesení lékové formy do disolučního prostředí o pH 5,5 došlo k rychlému rozpouštění obalu. Po 35 minutách se objevily ve vnitřním obalu velké póry, vnější obal zůstal nezměněn. Po 45 minutách praskl i vnější obal a po 55 minutách se oba obaly úplně rozpustily 45).
Propustné enterosolventní obaly
Dalším možným postupem jak zajistit, aby biologická dostupnost léčiv, která se vstřebávají v proximální části tenkého střeva, byla co největší, je upravit enterosolventní obaly lékových forem tak, aby se určité množství léčiva začalo uvolňovat již v žaludku (propustné enterosolventní obaly). Uvolnění částečného množství léčiva již v žaludeční tekutině lze docílit kombinací Eudragitu L 30 D-55 (15 % (w/w)) s látkami rozpustnými v kyselém prostředí (laktosa, PEG 8000) nebo neiontovými surfaktanty (Tween 80, Span 60) 42). Množství léčiva uvolněného v SŽT po přidání jednotlivých látek je uvedeno v tabulce 1.
Tab. 1. Ovlivnění disoluce ranitidin-hydrochloridu z pelet obalených disperzí Eudragitu L 30 D-55 v závislosti na typu a množství aditiva v obalu <sup>43)</sup> 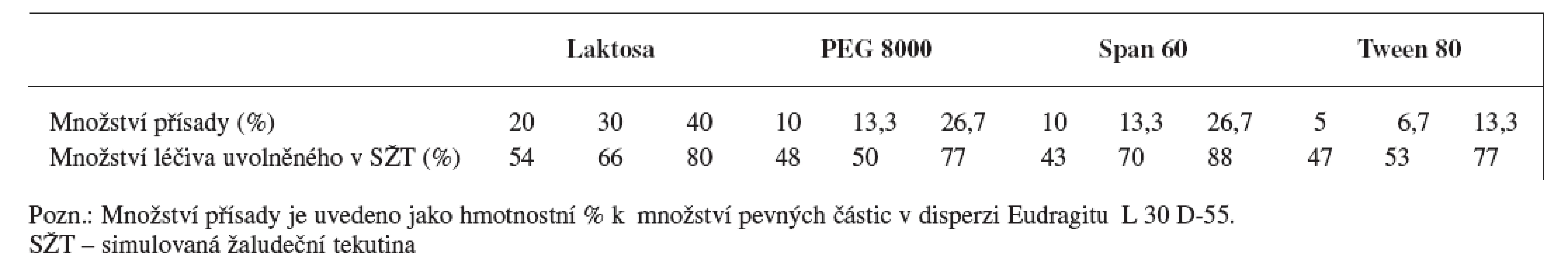
Závěr
Vodné polymerní disperze používané jako obalový materiál v řízeném uvolňování léčiv mají řadu výhodných vlastností, jež je v použití upřednostňují před organickými roztoky polymerů. Nicméně i vodné polymerní disperze mají svá negativa, která jsou spolu s požadavkem zajištění uvolnění léčiva v požadovaný čas a na požadovaném místě podnětem pro zdokonalování již existujících materiálů a metod příprav a zároveň pro hledání nových materiálů výhodnějších vlastností a nových obalových technik. I když jsou dosud nejčastěji používanými vodnými polymerními disperzemi deriváty celulosy a akrylátových polymerů, je dnes tendence využívat i biologicky degradovatelné přírodní polymery.
Seznam zkratek
- ACET – acetyltriethyl-citrát
- DBP – dibutyl-ftalát
- DBS – dibutyl-sebakát
- DEP – diethyl-ftalát
- EC – ethylcelulosa
- GMS – glycerol-monostearát
- HEC – hydroxyethylcelulosa
- HPMC – hypromelosa
- MFT – minimální filmotvorná teplota
- PEG – polyethylenglykol
- PG alginát – propylenglykolalginát
- PVA-PEG roubovaný kopolymer – polyvinylalkohol-polyethylenglykol roubovaný kopolymer
- RH – relativní vlhkost
- SS – stupeň substituce
- SŽT – simulovaná žaludeční tekutina
- TBC – tributyl-citrát
- TEC – triethyl-citrát
- Tg – teplota sklovitého přechodu
Adresa pro korespondenci:
doc. PharmDr. et Mgr. David Vetchý, Ph.D.
Ústav technologie léků FaF VFU
Palackého 1–3, 612 42 Brno
e-mail: vetchy@email.cz
Zdroje
1. Gryczová, E., Rabišková, M., Tomášek, V., Prokopová, A., Cepáková, L.: Vliv tepelného ošetření ethylcelulosového filmu na rychlost uvolňování sodné soli diklofenaku z pelet. Čes. slov. Farm., 2007; 56, 235–242.
2. Krejčová, K., Rabišková, M., Vetchý, D., Tomášek, V., Prokopová, A.: Vliv typu polymerové disperze na uvolňování diklofenaku sodné soli z obalených pelet. Čes. slov. Farm., 2007; 56, 190–199.
3. Meincken, M., Sanderson, R. D.: Determination of the inuence of the polymer structure and particle size on the lm formation process of polymers by atomic force microscopy. Polymer., 2002; 43, 4947–4955.
4. Sastry, S. V., Wilber, W., Reddy, I. K., Khan, M. A.: Aqueous-based polymeric dispersion: preparation and characterization of cellulose acetate pseudolatex. Int. J. Pharm., 1998; 165, 175–189.
5. Bauer, K., Lehman, K., Osterwald, H. P., Rothgang, G.: Coated Pharmaceutical Dosage Forms: Fundamentals, Manufacturing Techniques, Biopharmaceutical Aspects, Test Methods and Raw Materials. 1st ed. Boca Raton: CRC Press 1998; 280 p.
6. Wheatley, T. A., Steuernagel, C. R., Lehmann, K. O. R.: Aqueous Polymeric Coatings for Pharmaceutical Dosage Forms. In: McGinity, J. W. ed. Aqueous polymeric coatings for pharmaceutical dosage forms, 2nd ed. New York: Marcel Dekker, Inc. 1997.
7. Pongjanyakul, T., Puttipipatkhachorn, S.: Alginate-magnesium aluminum silicate lms: Effect of plasticizers on lm properties, drug permeation and drug release from coated tablets. Int. J. Pharm., 2007; 333, 34–44.
8. Mendoza-Romero, L., Pinon-Segundo, E., Nava-Arzaluz, M. G., Ganem-Quintanar, A., Cordero-Sánchez, S., Quintanar-Guerrero, D.: Comparison of pharmaceutical lms prepared from aqueous polymeric dispersions using the cast method and the spraying technique. Colloids and Surfaces A: Physicochem. Eng. Aspects., 2009; 337, 109–116.
9. Okarter, T. U., Sngla, K.: The effects of plasticizers on the release of metoprolol tartrate from granules coated with a polymethacrylate film. Drug Dev. Ind. Pharm., 2000; 26, 323–329.
10. Blackley, D. C.: Polymer latices: Science and technology. 2nd ed. London: Chapman & Hall 1997; 583p.
11. Jones, D.: Pharmaceutical applications of polymers for drug delivery. 1st ed. Shawbury: iSmithers Rapra Publishing 2004; 124p.
12. Ducháček, V.: Polymery – výroba, vlastnosti, zpracování, použití. Dostupné na: http://vydavatelstvi. vscht.cz/knihy/uid_isbn-80-7080-617-6/pages-img/obsah. html (10. 10. 2009).
13. Augsburger, L. L., Hoag, S. W.: Pharmaceutical dosage forms: Tablets: Volume 1: Unit operations and mechancial properties, 3rd ed. New York: Informa Healthcare 2008.
14. Wang, J., Ghebre-Sellassie, I.: Aqueous polymeric dispersions as film formers. In: Lieberman, H. A., Rieger, M. M., Banker,G. S. eds. Pharmaceutical Dosage Forms: Disperse Systems, 2nd ed. New York: Marcel Dekker, Inc. 1998.
15. Siepmann, F., Siepmann, J., Walther, M., MacRae, R. J., Bodmeier, R.: Polymer blends for controlled release coatings. J. Control. Release, 2008; 125, 1–15.
16. Siepmann, F., Hoffmann, A., Leclercq, B., Carlin, B., Siepmann, J.: How to adjust desired drug release patterns from ethylcellulose-coated dosage forms. J. Control. Release, 2007; 119, 182–189.
17. Siepmann, F., Wahle, C., Leclercq, B., Carlin, B., Siepmann, J.: pH-sensitive lm coatings: Towards a better understanding and facilitated optimization. Eur. J. Pharm. Biopharm., 2008; 68, 2–10.
18. Kranz, H., Gutsche, S.: Evaluation of the drug release patterns and long term stability of aqueous and organic coated pellets by using blends of enteric and gastrointestinal insoluble polymers. Int. J. Pharm., 2009; 380, 112–119.
19. Siepmann, F., Muschert, S., Leclercq, B., Carlin, B., Siepmann, J.: How to improve the storage stability of aqueous polymeric film coatings. J. Control. Release, 2008; 126, 26–33.
20. Frohoff-Hülsmann, M. A., Schmitz, A., Lippold, B. C.: Aqueous ethyl cellulose dispersions containing plasticizers of different water solubility and hydroxypropyl methylcellulose as coating material for diffusion pellets I. Drug release rates from coated pellets. Int. J. Pharm. 1999; 177, 69–82.
21. Frohoff-Hülsmann, M. A., Lippold, B. C., McGinity, J. W.: Aqueous ethyl cellulose dispersion containing plasticizers of different water solubility and hydroxypropyl methyl-cellulose as coating material for diffusion pellets II: properties of sprayed films. Eur. J. Pharm. Biopharm., 1999; 48, 67–75.
22. Yang, Q. W., Flament, M. P., Siepmann, F., Busignies, V., Leclercq, B. Herry, C., Tchoreloff, P., Siepmann, J.: Curing of aqueous polymeric film coatings: importance of the coating level and type of plasticizer. Eur. J. Pharm. Biopharm., 2010; 74, 362–370.
23. Muschert, S., Siepmann, F., Cuppok, Y., Leclercq, B., Carlin, B., Siepmann, J.: Improved long term stability of aqueous ethylcellulose lm coatings: Importance of the type of drug and starter core. Int. J. Pharm., 2008; 368, 138–145.
24. Technical information: Kollicoat IR. http://www.makeni. com.br/Portals/Makeni/prod/boletim/Kollicoat%20IR.pdf (12. 5. 2010).
25. Muschert, S., Siepmann, F., Leclercq, B., Carlin, B., Siepmann, J.: Drug release mechanisms from ethylcellulose: PVA-PEG graft copolymer-coated pellets. Eur. J. Pharm., Biopharm. 2009; 72, 130–137.
26. Muschert, S., Siepmann, F., Leclercq, B., Carlin, B., Siepmann, J.: Prediction of drug release from ethylcellulose coated pellets. J. Control. Release, 2009; 135, 71–79.
27. Lecomte, F., Siepmann, J., Walther, M., MacRae, R. J., Bodmeier, R.: pH-Sensitive Polymer Blends Used as Coating Materials to Control Drug Release from Spherical Beads: Elucidation of the Underlying Mass Transport Mechanisms. Pharm. Res., 2005; 22, 1129–1141.
28. Lecomte, F., Siepmann, J., Walther, M., MacRae, R. J., Bodmeier, R.: Polymer blends used for the aqueous coating of solid dosage forms: importance of the type of plasticizer. J. Control. Release, 2004; 99, 1–13.
29. Komárek, P., Rabišková, M.: Technologie léků, 3. vyd. Praha: Galén 2006, 399 s.
30. EUDRAGIT® – Targeted Drug Release and Tailored Service, http://eudragit.evonik.com/product/eudragit/en/ Pages/default.aspx (1. 12. 2009).
31. Nimkulrat, S., Suchiva, K., Phinyocheep, P., Puttipipatkhachorn, S.: Inuence of selected surfactants on the tackiness of acrylic polymer lms. Int. J. Pharm., 2004; 287, 27–37.
32. Ishikawa, Y., Katoh, Y., Oshima, H.: Colloidal stability of aqueous polymeric dispersions: Effect of pH and salt concentration. Colloids Surface B., 2005; 42, 53–58.
33. Bajdik, J., Pintye-Hódi, K., Regdon, G. Jr., Fazekas, P., Szabó-Révész, P., Erös, I.: The effect of storage on the behaviour of Eudragit NE free film. J. Therm. Anal. Calorim., 2003; 73, 607–613.
34. Kucera, S., Shah, N. H., Malick, A. W., Infeld, M. H., McGinity J. W.: Inuence of an acrylic polymer blend on the physical stability of film-coated theophylline pellets. AAPS PharmSciTech., 2009; 10, 864–871.
35. Kibria, G., Roni, M. A., Absar M. S., Jalil, R.: Effect of plasticizer on release kinetics of diclofenac sodium pellets coated with Eudragit RS 30 D. AAPS PharmSciTech., 2008; 9, 1240–1246.
36. Kim, T., Ji C.-W., Shim, S.-Y., Lee, B.-J.: Modified release of coated sugar spheres using drug-containing polymeric dispersions. Arch. Pharm. Res., 2007; 30, 124–130.
37. Dashewsky, A., Wagner, K., Kolter, K., Bodmeier, R.: Physicochemical and release properties of pellets coated with Kollicoat® SR 30 D, a new aqueous polyvinyl acetate dispersion for extended release. Int. J. Pharm., 2005; 290, 15–23.
38. Siepmann, F., Le Brun, V., Siepmann, J.: Drugs acting as plasticizers in polymeric systems: A quantitative treatment. J. Control. Release, 2006; 115, 298–306.
39. Bhattacharjya, S., Wurster, D. E.: Investigation of the drug release and surface morphological properties of film-coated pellets, and physical, thermal and mechanical properties of free films as a function of various curing conditions. AAPS PharmSciTech., 2008; 9, 449–457.
40. Wurster, D. E., Bhattacharjya, S., Flanagan, D. R.: Effect of curing on water diffusivities in acrylate free films as measured via a sorption technique. AAPS PharmSciTech., 2007; 8, E1–E6.
41. Zheng, W., Sauer, D., McGinity, J. W.: Inuence of hydroxyethylcellulose on the drug release properties of theophylline pellets coated with Eudragit® RS 30 D. Eur. J. Pharm. Biopharm., 2005; 59, 147–154.
42. Bendas, E. R., Ayres, J. W.: Leaky enteric coating on ranitidine hydrochloride beads: Dissolution and prediction of plasma data. Eur. J. Pharm. Biopharm., 2008; 69, 977–985.
43. El-Malah, Y., Nazzal, S.: Novel use of Eudragit® NE 30D/Eudragit® L 30D-55 blends as functional coating materials in time-delayed drug release applications. Int. J. Pharm., 2008; 357, 219–227.
44. Liu, F., Lizio, R., Meier, C., Petereit, H.-U., Blakey, P., Basit, A. W.: A novel concept in enteric coating: A double-coating system providing rapid drug release in the proximal small intestine. J. Control. Release, 2009; 133, 119–124.
45. Liu, F., Lizio, R., Schneider, U. J., Petereit, H.-U., Blakey, P., Basit, A. W.: SEM/EDX and confocal microscopy analysis of novel and conventional enteric-coated systems. Int. J. Pharm., 2009; 369, 72–78.
46. Catteau, D., Barthelemy, C., Deveaux, M., Robert, H., Trublin, F., Marchandise, X., Van Drunen, H.: Contribution of scintigraphy to verify the reliability of different preparation processes for enteric coated capsules. Eur. J. Drug. Metab. Pharmacokinet., 1994; 19, 91–98.
47. McConnell, E. L., Fadda, H. M., Basit, A. W.: Gut instincts: explorations in intestinal physiology and drug delivery. Int. J. Pharm., 2008; 364, 213–226.
Štítky
Farmácia Farmakológia
Článek NOVÉ KNIHY
Článok vyšiel v časopiseČeská a slovenská farmacie

2010 Číslo 4-
Všetky články tohto čísla
- Antimikróbne pôsobiace látky produkované baktériami mliečneho kvasenia
-
Standardní receptura pro přípravu léčivých přípravků v lékárnách IV
Čím může být užitečná sbírka Formularium hospitale
- Řízené uvolňování léčiv z lékových forem obalených vodnými celulosovými a akrylátovými polymerními disperzemi
- Development of a treatment of pregnant women suffering from epilepsy in the region of Ostrava between the years 1991 and 2006
- Technológia tabliet s riadeným uvoľňovaním s obsahom veľmi dobre rozpustných liečiv
-
Pracovní den Sekce přírodních léčiv České farmaceutické společnosti ČLS JEP
Hradecký den léčivých rostlin
Hradec Králové, 11. červen 2010
- Farmaceuti rokovali v Ružomberku
- NOVÉ KNIHY
- Doc. RNDr. Marián Bukovský, PhD. jubiluje
- Jaroslav Květina – osmdesátiletý
- Česká a slovenská farmacie
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle-
Standardní receptura pro přípravu léčivých přípravků v lékárnách IV
Čím může být užitečná sbírka Formularium hospitale
- Technológia tabliet s riadeným uvoľňovaním s obsahom veľmi dobre rozpustných liečiv
- Řízené uvolňování léčiv z lékových forem obalených vodnými celulosovými a akrylátovými polymerními disperzemi
- Antimikróbne pôsobiace látky produkované baktériami mliečneho kvasenia
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



