-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Imunochemické možnosti sledování degradace kolagenu typu II
Possibilities of immunochemical detection of cartilage type II collagen degradation
Degradation of articular cartilage is a major common hallmark of different types of arthritis. Collagen type II is possibly the ideal marker of cartilage destruction. Basic information on biochemistry, structure, and degradation of collagen type II is provided in the introduction. Immunochemical markers indicative of degradation of collagen type II fall into three groups according to the localization of the particular epitope within the collagen molecule: (a) denaturation (hidden) epitopes localized to the triple-helical domain, (b) cleavage neoepitopes localized to the collagenase cleavage site, (c) epitopes localized to telopeptides. Currently most promising marker designated as CTX-II belongs to the group (c).
Key words:
collagen II, marker, cartilage degradation, immunoassay, osteoarthritis, rheumatoid arthritis
Autoři: V. Vilím
Působiště autorů: Revmatologický ústav, Praha
Vyšlo v časopise: Čes. Revmatol., 15, 2007, No. 1, p. 3-12.
Kategorie: Přehledné referáty
Souhrn
Destrukce kloubní chrupavky je hlavním společným rysem artróz a artritid. Ideálním markerem degradace chrupavky je teoreticky kolagen typu II. V úvodu rešerše je podána stručná základní informace o biochemii, struktuře a degradaci kolagenu typu II. imunochemické markery degradace kolagenu typu II jsou pro snažší orientaci diskutovány po rozdělení do tří skupin podle lokalizace příslušných epitopů v molekule kolagenu II: (a) “denaturační” (skryté) epitopy lokalizované v helikální oblasti (b) neoepitopy lokalizované v místě štěpení kolagenázou a generované jejím účinkem (c) epitopy nacházející se v telopeptidech. Skupina (c) zahrnuje v současné době nejperspektivnější marker označovaný jako CTX-II.
Klíčová slova:
kolagen II, marker, degradace chrupavky, imunoesej, osteoartróza, revmatoidní artritidaÚvod
Destrukce kloubní chrupavky je hlavním společným rysem artróz a artritid. Osteoartróza (OA) je ivalidizující onemocnění, běžné ve vyšším věku (ve věkové skupině nad 75 let je incidence OA zhruba 85 %); degradace a postupná ztráta kloubní chrupavky je považována za klíčový rys jejího rozvoje. Revmatoidní artritida (RA) je chronické zánětlivé onemocnění kloubů, pro které je typická extenzivní erozivní destrukce kloubní chrupavky.
Nejrozšířenější metodou používanou k posouzení destrukce a ztráty kloubní chrupavky je měření šířky kloubní štěrbiny na rentgenových snímcích; takto prokazatelná destrukce je ale nutně už značně pokročilá a jako taková je považována za ireverzibilní. S cílem překonat tuto nevýhodu se řada laboratoří ve světě zabývá vývojem tzv. biochemických markerů destrukce chrupavky, tj. molekul přítomných v chrupavce a uvolňovaných do tělních tekutin při její degradaci. Celosvětově jsou do tohoto výzkumu vkládány značné intelektuální i finanční prostředky, v očekávání, že biomarkery pomohou při časné diagnóze OA (dříve než jsou změny viditelné na rentgenových snímcích), při identifikaci pacientů s vysokým rizikem progrese, při monitorování terapie a při výběru pacientů do klinických pokusů (1).
Ideálním markerem degradace chrupavky je teoreticky kolagen typu II. Je téměř absolutně specifický pro chrupavku, vedle níž se u dospělých jedinců vyskytuje už jenom ve sklivci oka a nukleu pulposu. V kloubní chrupavce představuje 15–25 % vlhké hmotnosti (50 % sušiny) a 90–95 % celkového obsahu kolagenu. Má mimořádně dlouhý biologický poločas (až desítky let) a tudíž extenzivní degradace vyzrálých zesíťovaných kolagenních vláken je vesměs považována za nevratnou. Průkaz zvýšené hladiny degradačních produktů kolagenu typu II v tělních tekutinách lze interpretovat jako indikátor ireverzibilního poškození chrupavky.
KOLAGEN
K dnešnímu datu bylo identifikováno více než 20 typů kolagenu, které podle struktury zařazujeme do několika tříd. Každá molekula kolagenu obsahuje jednu nebo více (podle typu) tzv. kolagenních (triple-helikálních) domén, tj. domén sestávajících ze tří polypeptidových řetězců svinutých do trojité šroubovice. Ve třídě I jsou zahrnuty kolageny tvořící fibrily, konkrétně typy I, II, III, V a XI. Molekuly těchto fibrilárních kolagenů sestávají z centrální helikální domény, na jejíchž obou koncích jsou krátké nehelikální úseky (telopeptidy). Tři dohromady svinuté řetězce mohou být identické, což je případ kolagenu typu II, který je homo-trimerem složeným ze tří řetězců označených jako α1(II) (v kolagenní nomenklatuře je typ kolagenu uveden římskou číslicí v závorce), nebo různé. Všechny tyto kolageny jsou syntetizovány jako prokolageny, tj. jako molekuly obsahující na obou koncích tzv. N - a C-terminální propeptidy, které jsou po sekreci prokolagenu z buňky odštěpeny.
Kolagen má naprosto unikátní strukturu. Každý jednotlivý α řetězec je v helikální části stočen v prostoru do levotočivé šroubovice. Tři levotočivé peptidové řetězce, posunuté navzájem o jeden aminokyselinový zbytek, jsou svinuty dohromady kolem centrální osy do kolagenní pravotočivé šroubovice, molekuly tropokolagenu (obr. 1). Na každou obrátku šroubovice připadají 3 aminokyseliny, přičemž každá třetí aminokyselina je glycin; trojitá šroubovice je totiž svinutá tak těsně, že pouze glycin (který nemá postranní řetězec) se vejde do centra šroubovice; postranní řetězce ostatních aminokyselin “trčí” z helixu ven. Sekvence helikální domény kolagenu je tedy složena z opakujícího se motivu Gly-X-Y, kde X a Y jsou libovolné aminokyseliny, nicméně v mnoha oblastech dále převažuje motiv Gly-Pro-X; pětičlenné heterocykly prolinových zbytků se nacházejí na vnější straně helixu a stabilizují šroubovicovou konformaci každého jednotlivého řetězce vzájemným odpuzováním. Po odstranění signálního peptidu podstupuje molekula prokolagenu řadu posttranslačních modifikací. Prolin je často hydroxylován na 4-hydroxyprolin (u fibrilárních kolagenů je v poloze 4 hydroxylováno zhruba 50 % všech prolinů) a triplet v sekvenci kolagenu má často podobu Gly-Pro-Hyp. Vysoký obsah 4-hydroxyprolinu v pozici Y kolagenního tripletu (nejméně 100 na každých 1000 aminokyselin helikální domény) je nezbytnou podmínkou vzniku stabilní trojšroubovice. Hyp je nezbytný pro vznik intramolekulárních vodíkových můstků a tím určuje termální stabilitu helikální domény; v jiných bílkovinách se vyskytuje jen výjimečně. Další modifikací, tentokrát specifickou pro kolagen, je hydroxylace lysinu na hydroxylysin; -OH skupina hydroxylysinu pak může být místem O-glykosidace (naprosto unikátní pro kolagen) a nést buď glukózu, nebo disacharid Gal-Glu (obr. 2).
Obr. 1. Skládání peptidových řetězců do kolagenní molekuly. a) peptidový řetězec (α řetězec), jehož primární struktura je daná pořadím aminokyselin (jeden bod znázorňuje jednu aminokyselinu), je stočen v prostoru kolem osy otáčení do levotočivé šroubovice; b) tři levotočivé peptidové řetězce jsou svinuty dohromady kolem centrální osy do kolagenní pravotočivé šroubovice; c) molekula tropokolagenu; na obou koncích molekuly se nacházejí nešroubovicové domény, tzv. telopeptidy. 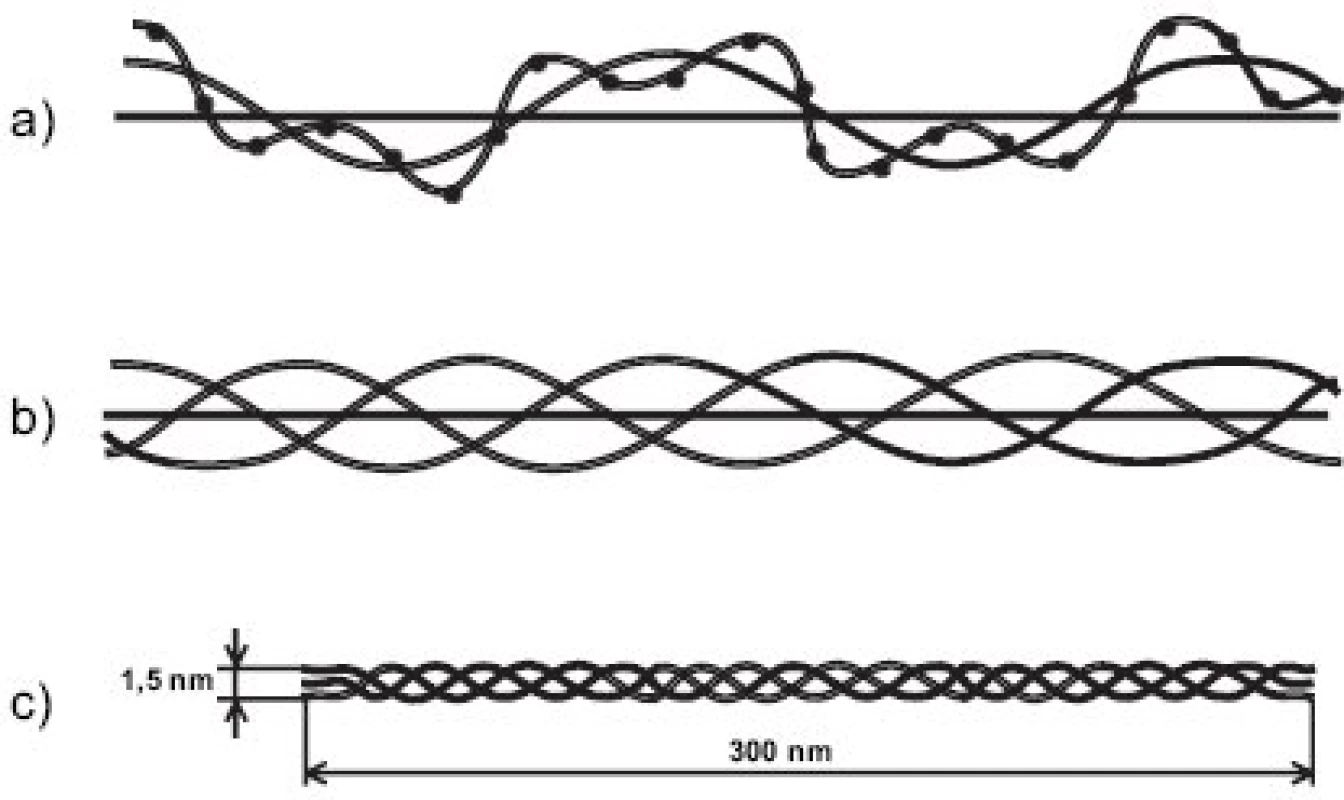
Molekuly kolagenů I, II a III (někdy označovaných jako “klasické” fibrilární kolageny) mají výsledný tvar víceméně rigidní tyčinky dlouhé asi 300 nm (tj. asi 1000 AA v každém ze tří svinutých řetězců) a o průměru jen asi 1.4 nm a skládají se do fibril tak, že mezi N - a C - koncem molekul následujících v řadě za sebou je vždy mezera a molekuly v sousední řadě jsou zhruba o jednu čtvrtinu (přesně o 67 nm) posunuty (obr. 3). Fibrily jsou dobře viditelné v elektronovém mikroskopu jako charakteristická příčně pruhovaná vlákna. Podle použitého způsobu barvení je důvod periodického příčného pruhování kolagenních fibril dvojího druhu. Příčné pruhování viditelné na fibrilách negativně barvených kyselinou fosfowolframovou (“banded fibrils”) je důsledkem střídavého uspořádání sousedních molekul ve fibrile, kdy na každý překryv 5 sousedních molekul (“overlap zone”) připadá jedna mezera (“gap zone”), ve které se překrývají jen 4 molekuly (obr. 3). Příčné pruhování viditelné na fibrilách pozitivně barvených (“cross-striation”) je důsledkem skutečnosti, že každá molekula tropokolagenu obsahuje opakující se oblasti s nahloučením polárních aminokyselin, vzdálené od sebe 67 nm, přičemž při pozitivním barvení pro elektronovou mikroskopii se tyto oblasti jeví jako proužky. Každá molekula obsahuje 4.4 periody opakování, označované jako D-perioda (D = 234 aminokyselin = 67 nm). V kolagenní fibrile jsou vždy sousední molekuly vůči sobě posunuty o násobek vzdálenosti D (1D, 2D, 3D, 4D); obrázek 3a je nutně zjednodušením, protože uspořádání molekul ve fibrile zobrazuje pouze ve dvojrozměrném řezu, zatímco fibrila je složena v trojrozměrném prostoru. Fibrily se dále skládají do superfibrilárních struktur podle funkčních požadavků kladených na kolagen v jednotlivých typech tkání; pro kolagen typu II v chrupavce jsou typické fibrily malého průměru (~20 nm).
Obr. 2. Skládání kolagenních molekul do vlákna: a - fibrila vzniká skládáním molekul tropokolagenu posunutých vůči sobě vždy zhruba o jednu čtvrtinu délky b - fibrila je stabilizována spojením molekul tropokolagenu kovalentními příčnými vazbami 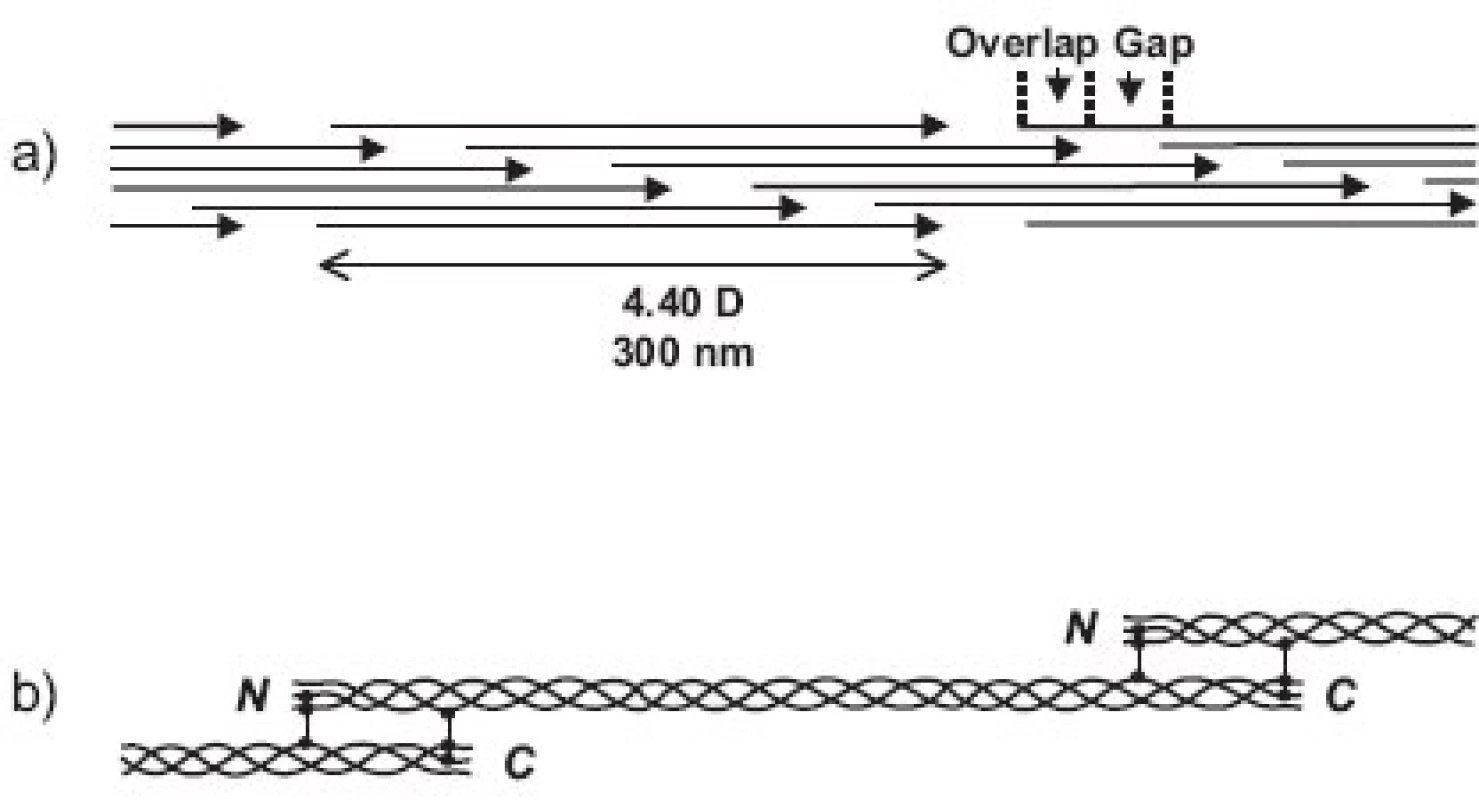
Fibrily jsou stabilizovány intermolekulárními příčnými vazbami, odvozenými od lysinu, popřípadě hydroxylysinu, a spojujícími dvě místa v překrývající se “hlavě a ocasu” sousedních molekul tropokolagenu ve fibrile, tj. dva C-telopeptidy (dosud není jisté, jestli ze dvou α řetězců jedné molekuly nebo ze dvou molekul sousedních) s N - terminální částí helixu sousední molekuly a analogicky C-terminální část helikální domény jedné molekuly se dvěma N-telopeptidy sousední(ch) molekul(y) (obr. 3b). Opět platí, že uspořádání příčných vazeb znázorněné v obrázku 3b je třeba brát jako zjednodušující schéma; přesnou lokalizaci příčné vazby v rámci jedné molekuly lze jednoznačně určit, ale určit přesně které molekuly v rámci fibrily jsou navzájem spojeny je momentálně metodicky neschůdné. Chemie vzniku příčných vazeb byla velmi detailně studována a z mnoha možných typů a variant di-, tri - a tetrafunkčních příčnovazebných elementů (různou měrou zastoupených v různých typech kolagenu) zde uvedeme jako příklad pouze trifunkční hydroxylysylpyridinolin (HP) a lysylpyridinolin (LP) (obr. 2). Trojvazný HP je typickou příčnou vazbou hojně zastoupenou v kolagenu typu II. Fibrily jsou dále stabilizovány tím, že se na jejich povrch kovalentně váží další komponenty, tj. vznikem heterofibril; v případě kolagenu typu II jsou to dva minoritní kolageny přítomné v chrupavce, kolagen typu IX a kolagen typu XI.
Obr. 3. Stavební elementy víceméně nebo výhradně specifické pro kolagen: hydroxyprolin (Hyp), hydroxylysin (Hyl), O-glykosylace na hydroxylysinu, příčné vazby hydroxylysylpyridinolin (HP) a lysylpyridinolin (LP). 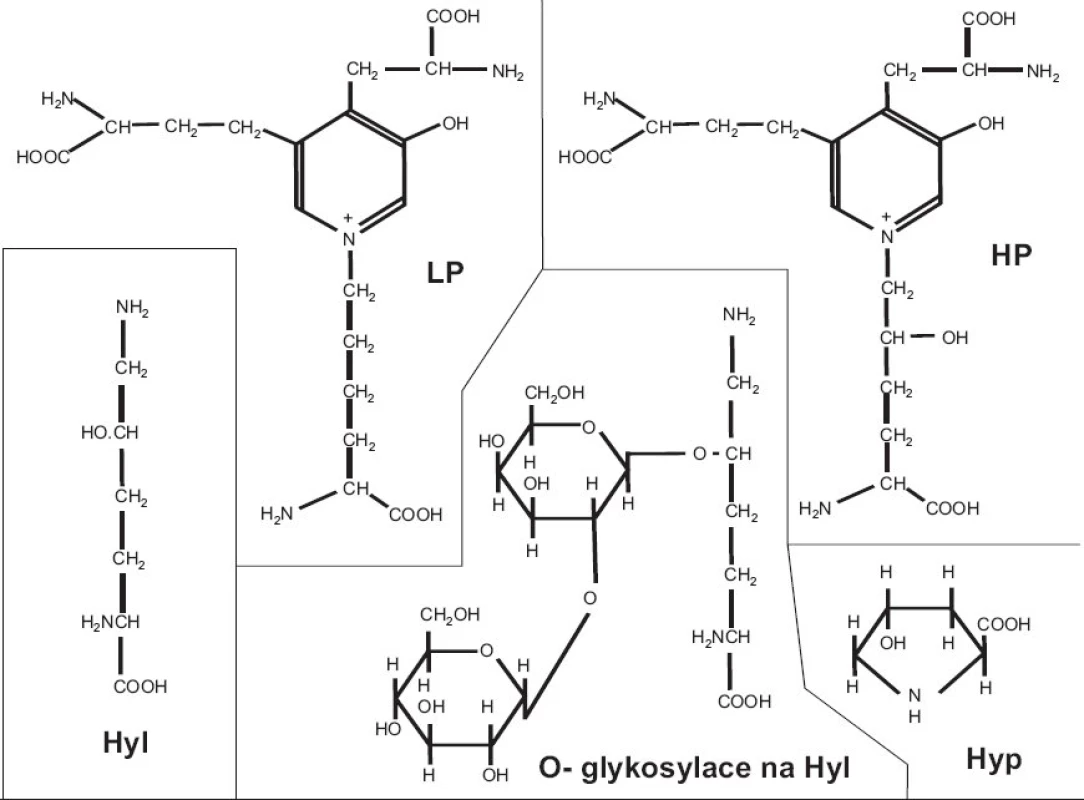
Stavební elementy víceméně nebo výhradně specifické pro kolagen jsou tedy následující: hydroxyprolin, hydroxylysin, O-glykosylace na hydroxylysinu, příčné vazby (obr. 2). Všechny tyto možnosti byly využity při sledování metabolismu kolagenu; problém je v tom, že žádná z nich není specifická pro kolagen určitého typu. Tak např. stanovení pyridinolinů v moči lze interpretovat jako index systémové degradace kolagenu, přičemž primárním zdrojem z něhož pocházejí tyto příčnovazebné elementy je kolagen typu I z kostí. Vyšší specifitu umožňují eseje, kterým se věnuje následující přehled, tj. eseje cílené na konkrétní peptidové sekvence, specifické pro kolagen zvoleného typu.
Protože struktura kolagenu je tak typická a je vynikající ilustrací vztahu struktura – funkce, lze základní informace najít prakticky v každé základní učebnici molekulární biologie, detailní pak v mnoha rešerších (např. 2, 3, 4); zde uvedený přehled je nutno brát jako velmi zjednodušenou a stručnou prezentaci základních informací potřebných k tomu, aby i laik porozuměl sdělení následujícího textu. Protože se zde nechceme zabývat molekulárními markery biosyntézy kolagenu typu II, nemusíme se biosyntéze v této rešerši věnovat a můžeme odkázat na jiné informační zdroje. Protože se ale chceme zabývat molekulárními markery degradace kolagenu typu II, je třeba ještě věnovat malou odbočku jeho degradaci. Ani zde neuvádíme pro jednoduchost odkazy na původní práce, které zájemce může vesměs najít v pracích citovaných v následující kapitole.
Extracelulární degradace fibrilárních typů kolagenu může být zahájena jak v nehelikálních oblastech (telopeptidy), tak v helikální oblasti. Řada enzymů (kolagenázy, MMP-1 a MMP-13; želatinázy, MMP-2 a MMP-9; stromelysin, MMP-3; matrilysin, MMP-7; katepsiny K, B a G; elastáza neutrofilů) může štěpit kolagen v nehelikálních doménách (oblastech telopeptidů), neexistuje ale žádný přímý důkaz, že tato aktivita hraje významnou roli při normálním metabolickém obratu kolagenu nebo za patologických podmínek. Za hlavní mediátory degradace kolagenu ve většině tkání jsou považovány kolagenázy, které představují jediné známé savčí enzymy schopné štěpit trojitou šroubovici kolagenu za neutrálního pH. Kolagenázy patří do rodiny zinek-dependentních endopeptidáz označovaných jako MMP (Matrix MetalloProteinases). Jsou známy 4 lidské kolagenázy: kolagenáza 1 (intersticiální kolagenáza), MMP-1; kolagenáza 2 (kolagenáza neutrofilů), MMP-8; kolagenáza 3, MMP-13; a kolagenáza 4, MMP-14 neboli membránová kolagenáza MT1-MMP. Kolagenázy štěpí fibrilární kolageny v triple-helikální oblasti, konkrétně kolagen typu II mezi aminokyselinami Gly906 a Leu907 (obr. 4); tímto štěpením vzniknou 2 charakteristické fragmenty představující 3/4 (fragment TCA) a 1/4 (fragment TCB) délky intaktního α-řetězce. Tyto štěpy mají velikost zhruba 75 a 25 kDa; všechny tři α řetězce jsou rozštěpeny současně. Za hlavní kolagenázy zodpovědné za štěpení kolagenu II in vivo jsou považovány MMP-1 a MMP-13. Rozštěpení trojité šroubovice vede za fyziologické teploty ke spontánní denaturaci molekuly (rozvinutí trojité šroubovice) na nehelikální želatin, následuje další štěpení účinkem výše uvedených kolagenáz, želatináz a/nebo stromelysinu před, během i po uvolnění štěpů z matrix chrupavky do synoviální tekutiny a dalšího transportu via lymfatický systém do krve. Díky proběhlému extenzivnímu štěpení želatinolytickými enzymy jsou fragmenty kolagenu II cirkulující v krvi dostatečně malé, aby mohly procházet ledvinovou filtrací a je tudíž možno je stanovovat i v moči.
Obr. 4. Pořadí aminokyselin v řetězci α1(II) lidského kolagenu typu II (COL2A1_HUMAN, P02458, UniProtKB/Swiss). Číslování pořadí aminokyselin v tomto obrázku (a v celé této rešerši) souhlasí s číslováním ve výše uvedeném zdroji a nemusí vždy souhlasit s číslováním uvedeným v jednotlivých citovaných publikacích. Zde uvedené číslování zahrnuje na N-konci signální peptid a N-propeptid, naopak nezahrnuje úsek 69 aminokyselin, které mohou, ale nemusí být součástí N-propeptidu díky alternativnímu setřihu. Číslice uvádí pořadí vždy poslední z desítky aminokyselin pod číslicí. Propeptidy (AA26-112 a AA1173-1418) nejsou v tomto obrázku vyznačeny, protože v nich lokalizované epitopy jsou markery syntézy, nikoli degradace. Protože hydroxylace prolinu na hydroxyprolin je posttranslační modifikací, je v této sekvenci prolin i hydroxyprolin značen pouze jako P; totéž platí i o dvojci lysin - hydroxylysin (K). Poloha příčných vazeb je vyznačena barevně (K 121, 239, 1061 a 1162) Barevné značení telopeptidů a epitopů diskutovaných v tomto článku: 113 - 131 N-terminální nehelikální oblast 1146 - 1172 C-terminální nehelikální oblast 132 - 1145 Triple-helikální oblast (oblast trojité šroubovice) a. “denaturační” epitopy lokalizované v helikální oblasti APGEDGRPGPPG (helikální oblast, AA511-522) - sekvenční epitop, na který se po rozvinutí trojité šroubovice váže mAb COL2-3/4m (7) GAPGPQGFQGNPGE PGEPGVSGPMGPRGPPGPPGKPGDDGEAGKPGKA (helikální oblast, AA147-194) - dva po sobě následující sekvenční epitopy, na který se po rozvinutí trojité šroubovice váží protilátky AH12 a AH8, použité v sandwich ELISA (10) HRGYPGLDG (helikální oblast, AA220-228) - sekvenční epitop, označený autory jako Coll 2-1, na který se po rozvinutí trojité šroubovice váže příslušné polyklonální antisérum (12) ERGETGPPGTS (helikální oblast, AA754-764) - sekvenční epitop, označený autory jako Helix-II, na který se po rozvinutí trojité šroubovice váže příslušné polyklonální antisérum (15) b. neoepitopy lokalizované v helikální oblasti v místě štěpení kolagenázou a generované jejím účinkem; místo štěpení kolagenázou (mezi Gly906 a Leu907) je vyznačeno šipkou: ↓ GPPGPQG (helikální oblast, AA899-906) - C-terminální neoepitop COL2-3/4C, generovaný štěpením kolagenu typu II v helikální oblasti kolagenázou - na tento neoepitop ve váže protilátka COL2-3/4Cshort (16) a mAb 9A4 (26) GEPGDDGPS (helikální oblast, AA888-896) - sekvenční epitop, na který se po rozvinutí trojité šroubovice váže mAb 5109 (27) c. epitopy nacházející se v telopeptidech REKGPDP (C-terminální telopeptid, AA1160-1166) - neoepitop, uvolňovaný z C-terminálního telopeptidu, obsahující příčnou vazbu a označovaný jako col2CTx (32) nebo jako CTX-II (CartiLaps ELISA) (38) 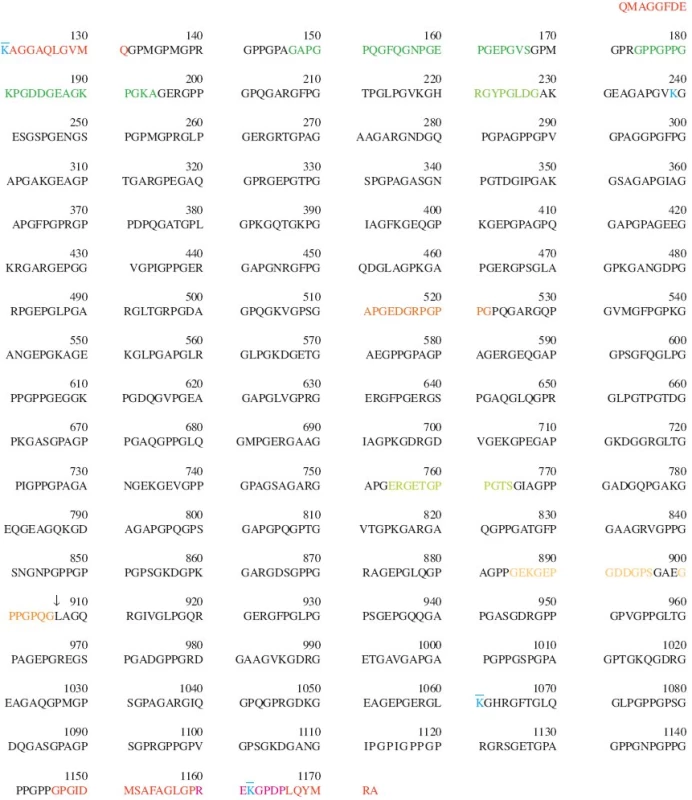
IMUNOCHEMICKÉ MARKERY DEGRADACE KOLAGENU TYPU II
Pro snazší orientaci si můžeme protilátky dosud použité ke specifické imunodetekci produktů degradace kolagenu II (fragmentů) v tělních tekutinách rozdělit do tří skupin podle lokalizace příslušných epitopů v molekule kolagenu II:
- a) “denaturační” (skryté) epitopy lokalizované v helikální oblasti
- b) neoepitopy lokalizované v místě štěpení kolagenázou a generované jejím účinkem
- c) epitopy nacházející se v telopeptidech
a. “denaturační” (skryté) epitopy lokalizované v helikální oblasti
Zatím 4 skupiny patentovaly využití sekvenčního “denaturačního” epitopu, nacházejícího se v helikální oblasti kolagenu II. Tyto skryté epitopy jsou vesměs tvořeny lineárními sekvencemi aminokyselin, které jsou v nativním kolagenu před protilátkou “skryty” a které jsou “zviditelněny” po uvolnění α1 řetězce z konformačního omezení v trojité šroubovici po jejím rozvinutí (denaturaci). Průkopnické práce pocházejí z laboratoře (Joint Diseases Laboratory, Shriners Hospital for Crippled Children, Montreal, Kanada), kterou vede Poole. Dodge a Poole (5) připravili monospecifické polyklonální antisérum (označené jako R181) proti denaturovanému kolagenu II (rozvinutým α-řetězcům), když jako imunogen použili bromkyanové štěpy hovězího tropokolagenu II (bromkyanové štěpy nerekombinují na helikální kolagen). Antisérum R181 rozeznávalo bromkyanové štěpy α1(II)CB11 a α1(II)CB8 a nereagovalo s nativním kolagenem II ani s kolageny jiných typů. Lokalizace uvedených bromkyanových peptidů je v první (N-terminální) polovině helikální oblasti a nezahrnuje místo štěpení kolagenázou. Tyto protilátky byly použity především k imunohistochemickým (IHC) studiím (5, 6). Peptid, odpovídající jedné z pěti hydrofilních domén lokalizovaných v bromkyanovém štěpu α1(II)CB11, byl následně syntetizován a použit jako imunogen při přípravě monoklonální protilátky (mAb) označené jako COL2-3/4m (7). Tato mAb rozeznává sekvenční epitop APGEDGRPGPPG (obr. 4) a nereaguje s nativním, ale pouze s denaturovaným kolagenem typu II. Označení 3/4 odpovídá skutečnosti, že po rozštěpení kolagenu typu II kolagenázou (které má za následek rozvinutí helixu a “zviditelnění” epitopu) je epitop součástí delšího štěpu. Identická sekvence je přítomna i v řetězci α3(XI) kolagenu typu XI, což je jediná bílkovina kromě kolagenu typu II, se kterou tato mAb reaguje. Rovněž tato protilátka byla využita především při imunohistochemických studiích demonstrujících poškození kolagenu typu II v lidské kloubní chrupavce při osteoartróze (7, 8).
Hollander a Croucher (9) připravili polyklonální antiséra (označená jako AH12 a AH9) proti peptidovým epitopům, nacházejícím se v N - a C-terminální prokřížené oblasti helikální části (tj. vždy mezi příčnou vazbou nacházející se v helikální oblasti a začátkem nebo koncem nejbližšího telopeptidu – obr. 3b). Výsledky získané pomocí IHC a při analýze kultivačních médií explantátů chrupavky pomocí těchto antisér pak naznačily, že N-terminální část helikální oblasti kolagenu II (obsahující epitop AH12) je po denaturaci mnohem odolnější k dalšímu štěpení a tedy stálejší než C-terminální část helikální domény (obsahující epitop AH9). Této informace využili autoři při návrhu sandwich ELISA, kombinující antisérum AH12 s další, tentokrát monoklonální, protilátkou AH8, jejíž epitop je od epitopu AH12 oddělen šesti aminokyselinovými zbytky (10) (obr. 4). Praktické využití této metody ELISA nebylo ovšem dosud v literatuře doloženo.
Další denaturační epitop, odpovídající peptidu lokalizovanému v helikální oblasti (HRGYPGLDG - obr. 4), stanovuje kompetitivní ELISA postavená na králičích antisérech, kterou vyvinuli Henroitin a spol. (11, 12). Epitop, označený autory jako Coll 2-1 je přítomen v krvi i v moči. Protože uvedená sekvence obsahuje tyrosin, autoři vyvinuli analogickou esej pro peptid, ve kterém je tento tyrosin nitrován na nitrotyrosin (Coll 2-1 NO2). Obě eseje byly dosud použity ve dvou klinických studiích, ve kterých byly oba epitopy stanovovány v séru OA a RA (13) a v moči OA (14) pacientů.
Poslední příspěvek v této oblasti přidali Charni a spol. (15), kteří použili pro zvolený epitop (ERGETGPPGTS – obr. 4) označení Helix II, vyvinuli kompetitivní ELISA s polyklonálním antisérem a prokázali, že hladinu uvedeného peptidu specifického pro kolagen II je možno měřit v moči OA i RA pacientů i zdravých jedinců.
b. neoepitopy lokalizované v místě štěpení kolagenázou a generované jejím účinkem
Skupina, kterou vede Poole, byla opět první, kde byly připraveny polyklonální protilátky rozeznávající neoepitopy generované štěpením kolagenu typu II kolagenázou (16). Antisérum anti-COL2-3/4C rozeznávalo karboxy-terminální neoepitop GPPGPQG (delší fragment TCA), antisérum anti-COL2-1/4N1 rozeznávalo amino-terminální neoepitop LAGQRG (kratší fragment TCB) a antisérum anti-COL2-1/4N2 rozeznávalo sekundární amino-terminální neoepitop vznikající zkrácením původního amino-terminálního neoepitopu o další 3 aminokyseliny (obr. 4). Vedle fragmentu kolagenu typu II reagovalo antisérum anti-COL2-3/4C i s analogickým fragmentem kolagenu typu I, pravděpodobně proto, že prvních 5 aminokyselin (počítáno od místa štěpení kolagenázou směrem k NH2 konci) je v případě těchto dvou typů kolagenu identických. Antisérum anti-COL2-3/4C jakož i výše uvedená mAb COL2-3/4m byly použity k přípravě inhibiční ELISA (7, 16); obě tyto eseje byly využity ke stanovení příslušných epitopů v extraktech chrupavky, přičemž relativní podíl obsahu epitopu COL2-3/4C je mírou podílu kolagenu rozštěpeného kolagenázou, zatímco relativní podíl obsahu epitopu COL2-3/4m je mírou podílu denaturovaného kolagenu. Oba ukazatele spolu v extraktech lidské OA chrupavky významně korelují (16) a tandem obou protilátek byl několikrát využit při imunohistochemii (např. 17, 18) i k analýze extraktů chrupavky (19).
Neoepitop, sestávající ze sedmi aminokyselinových zbytků (G-P-P(OH)-G-P-Q-G), nacházejících se na C-terminálním konci delšího kolagenázového štěpu TCA, je autory v literatuře označován jako neoepitop COL2-3/4Cshortnebo jako C1,2C, přičemž označení “krátký” odpovídá délce epitopu, nikoli fragmentu, na němž se tento epitop nachází, a označení C1,2C znamená, že epitop není specifický pro kolagen II, ale vzniká i při štěpení kolagenu typu I. Problém specifity pro kolagen II byl vyřešen prodloužením stanovované sekvence o tři aminokyseliny (G-G-E-G-P-P(OH)-G-P-Q-G, přičemž E pochází se sekvence kolagenu II a tandem G-G představuje “spacer”) na neoepitop COL2-3/4Clong, čili tzv. dlouhý epitop neboli C2C, protože tato delší sekvence už je specifická jen pro kolagen typu II (20). Přidaný glutamátový zbytek je důležitý pro specifitu připravené monoklonální protilátky; skutečnost, že pro její afinitu je důležitý i spacer sestávající ze dvou glycinů, naznačuje, že pro imunoreaktivitu je důležitá konformace, kterou daná sekvence zaujme po svém uvolnění z “konformačního omezení” v trojité šroubovici (20). Pro afinitu protilátky je rovněž důležitá hydroxylace prolinu na hydroxyprolin ve správné poloze. ELISA s touto protilátkou byla použita při studiích na zvířecích modelech k analýze krevní plazmy (21), synoviální tekutiny (SF) (22), SF a séra (19) a SF, séra a moči (23); u lidí pak k analýze SF (24), séra a moči (25). ELISA stanovující epitop C1,2C, jakož i ELISA stanovující epitop C2C, jsou komerčně dostupné (IBEX, Montreal, Quebec).
Se stejným neoepitopem (GPPGPQGna C-terminálním konci TCA) jako protilátka COL2-3/4Cshort reaguje i mAb 9A4, kterou připravili Otterness a spol. (26). Specifity pro kolagen II docílili tito autoři kombinací mAb 9A4 a další mAb 5109, která se váže na epitop GEPGDDGPS specifický pro kolagen II a lokalizovaný bezprostředně před epitopem pro mAb 9A4 (obr. 4), do sandwich ELISA (27). MAb 5109 nerozeznává danou sekvenci, jestliže se tato nachází v konformačně omezené podobě trojité šroubovice (jinými slovy nereaguje s nativním kolagenem, pouze s denaturovaným nebo rozštěpeným kolagenem II po rozvinutí trojité šroubovice). Tři aminokyselinové zbytky (GAE) oddělují oba epitopy dostatečně, takže nedochází ke stérické kompetici; mAb 5109 je použita jako první (“capture”) protilátka, mAb 9A4 jako druhá (detekční) protilátka. Pro stanovení neoepitopu vznikajícího při štěpení kolagenu typu II kolagenázou v moči je v současné době tato imunoesej komerčně dostupná pod názvem uTIINE (urinary type II collagen neoepitope). Použití této eseje je zatím v literatuře dokumentováno čtyřikrát (28–31).
c. epitopy nacházející se v telopeptidech
Fragmenty pocházející z telopeptidů a spojené příčnou vazbou (HP) jsou poslední skupinou pořadím v této rešerši, ale nikoli významem. Průkopnickou práci vykonal Eyre (University of Washington, Seattle, USA). Eyre byl prvním, kdo detailně popsal příčné vazby v telopeptidech fibrilárních kolagenů I, II a III (32). Základní struktura peptidu pocházejícího z C-terminálního telopeptidu kolagenu II a obsahující příčnou vazbu je následující:
přičemž příčná vazba označená jako Hyl-Hyl-Hyl je hydroxylysylpyridinolin (HP) (obr. 2). Z tělních tekutin je možno izolovat variace na tuto základní strukturu, ve které může být některý z peptidů spojených příčnou vazbou o 1-3 aminokyseliny delší nebo kratší (např. Glu-Hyl-Gly-Pro-Asp-Pro (EKGPDP) nebo Glu-Hyl-Gly-Pro-Asp-Pro-Leu (EKGPDPL), eventuálně Val-Hyl (VK), apod.). Veškeré tyto varianty jsou objevitelem souhrnně označovány jako col2CTx. V úvahu navíc připadají glykosylované varianty, u nichž je na hydroxylovou skupinu 3-hydroxypyridiniové příčné vazby navázán disacharid glukosyl-galaktóza. Předpokládá se, že peptid pocházející z helikální domény pochází z jiné molekuly kolagenu než telopeptidy (obr. 3); peptidy pocházející z telopeptidů mohou pocházet ze dvou α řetězců jedné molekuly, podání definitivního důkazu je ale momentálně metodicky neschůdné. Využití ELISA při stanovení všech variant této základní struktury je patentově chráněno; Eyre jako inventor je držitelem všech klíčových patentů v této oblasti, popisujících způsoby měření degradace kolagenu II, založené na imunostanovení fragmentů pocházejících z telopeptidů a spojených příčnou vazbou. Příčná vazba není nezbytnou součástí stanovovaného epitopu, kterým je pro kolagen typu II specifický peptid, je nicméně klíčová, protože díky ní je příslušný peptidový epitop relativně rezistentní vůči další proteolýze a “přežívá” v tělních tekutinách až do moči v měřitelném množství. V Eyrově skupině byly připraveny monoklonální protilátky proti výše popsaným peptidovým epitopům pocházejícím z C-terminálních telopeptidů kolagenu typu II (33) a následně použity v řadě prací základního výzkumu, ve kterých je i detailně popsána jejich specifita: mAb 10F2 např. (34), mAb 2B4 např. (35). ELISA s mAb 2B4 byla použita při analýze séra v případě OA (36) a synoviální tekutiny u OA a po úrazu a poranění kloubu (37). Amino-terminální telopeptidy z kolagenu II (col2NTx) nebyly v tělních tekutinách detekovány, zřejmě jsou in vivo degradovány až na volný HP.
Neoepitop EKGPDP (obr. 4), který je v současnosti nejslibnějším z potenciálních biomarkerů OA a který lze pod názvem CTX-II stanovovat v moči pomocí dvou komerčně nabízených kitů firmy Nordic Bioscience Diagnostics A/S (Herlev, Denmark) – vývoj příslušné mAb a kompetiční ELISA popisuje Christgau a spol. (38) – je totožný s epitopem popsaným výše (32). Esej Urine Pre-Clinical CartiLaps ELISA je kompetiční ELISA s jednou mAb, v případě eseje Serum Pre-Clinical CartiLaps ELISA určené pro stanovení v séru se jedná o sandwich ELISA, v níž je stejná mAb použita jako capture i jako detekční protilátka. První esej tedy detekuje přítomnost všech molekul, obsahujících lineární epitop CTX-II, druhá esej selektivně detekuje pouze epitop přítomný v duplikátu jako dimer spojený příčnou vazbou. Marker CTX-II má k dispozici nejrozsáhlejší soubor experimentálních dat, podporujících jeho využití jako biomarkeru artrózy. Klinických, populačních a modelových studií, ve kterých bylo stanovení CTX-II použito (vesměs s velmi slibnými výsledky), jsou už pravděpodobně desítky; jako příklady uvádíme studii asociace mezi koncentrací CTX-II v moči a prevalencí a rentgenovou progresí OA (39); klinický pokus ukazující na možnou prognostickou hodnotu koncentrace CTX-II v moči u RA (40); a extenzivní populační studii, uvádějící hodnoty koncentrace CTX-II v moči zdravých jedinců (41).
Všechny informace uvedené v této kapitole názorně shrnuje obrázek 4 a tabulka 1. Aminokyselinové sekvence peptidů uvedené v této kapitole pocházejí ze stejného zdroje jako obrázek 4a nejsou v nich tudíž rozlišovány dvojice Prolin/Hydroxyprolin a Lysin/Hydroxylysin (v obou případech je hydroxylace posttranslační modifikací); pro hydroxylovanou i nehydroxylovanou verzi je užita stejná jednopísmenná zkratka: P, respektive K.
Diskutovat předpokládaný nebo už prokázaný význam všech výše uvedených esejí pro všechny diagnózy, které připadají v úvahu v revmatologické praxi, je mimo zamýšlený rozsah tohoto souborného referátu; eventuální zájemce je možno odkázat na rešerši v anglickém jazyce, která problematiku kolagenních markerů pojednává z hlediska jejich klinického významu (42).
Tab. 1. V současné době dostupné imunoeseje pro degradační markery kolagenu II. 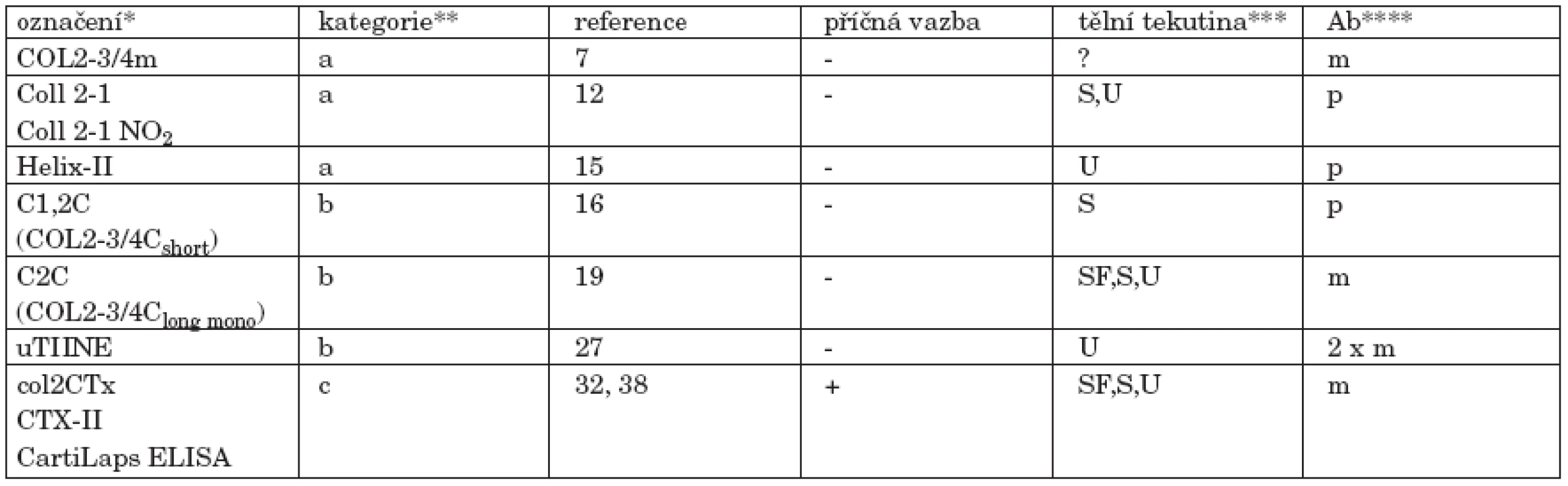
*uvedeno je označení běžně užívané v literatuře a není rozlišeno, zda se týká protilátky, epitopu, nebo eseje ** rozdělení podle lokalizace epitopu v molekule kolagenu II, tak jak je používáno v této rešerši: a. "denaturační" epitop lokalizovaný v helikální oblasti b. neoepitop lokalizovaný v místě štěpení trojité šroubovice kolagenázou c. epitop nacházející se v telopeptidu Pro přesnou lokalizaci jednotlivých epitopů v řetězci α1(II) viz obrázek 4 *** SF - synoviální tekutina, S - sérum, U - moč. Uvedena je lidská tělní tekutina, u níž je aplikace imunoeseje dokumentována v literatuře. V principu, esej použitelná k analýze séra musí fungovat i při analýze SF a epitop přítomný v moči musí být přítomen i v S a SF. **** m - monoklonální protilátka, p - polyklonální antisérum, 2 x m - sandwich dvou mAb Pozn.: Všechny eseje uvedené v této tabulce jsou chráněny patentem. ZÁVĚR
Na závěr je namístě jen malá poznámka. Všechny zde popsané markery byly vyvíjeny s cílem praktického využití a bez jediné výjimky se jedná výhradně o imunochemické metody. Pro svoji jednoduchost, rychlost, flexibilitu a příznivé cenové faktory jsou a budou metody imunochemické analýzy metodou volby při zavádění nových laboratorních přístupů do praxe a zde předkládaná rešerše je dobrou ilustrací tohoto konstatování.
PODĚKOVÁNÍ
Autor děkuje Dr. Š. Růžičkové a Mgr. J. Marešovi za pomoc při přípravě obrázků a pí. A. Swientekové za pomoc při zpracování literatury. V době zpracování této rešerše byl autor podporován Výzkumnými záměry MZ ČR 0002372801.
RNDr. V. Vilím
Revmatologický ústav
Na Slupi 4
128 50 Praha 2
Zdroje
1. Bauer DC, Hunter DJ, Abramson SB, Attur M, Corr M, Felson D, Heinegard D, Jordan JM, Kepler TB, Lane NE, Saxne T, Tyree B, Kraus VB. Classification of osteoarthritis biomarkers: a proposed approach. Osteoarthritis Cartilage 2006; 14 : 723–7.
2. Kühn K. The classical collagens: Types I, II, and III. In “Structure and Function of Collagen Types” (Mayne R, Burgeson RE, eds), pp.1–42, Academic Press, Orlando 1987.
3. Kielty CM, Grant ME. The collagen family: structure, assembly, and organization in the extracellular matrix. In “Connective Tissue and Its Heritable Disorders: Molecular, Genetic, and Medical Aspects, 2nd Edition” (Royce PM, Steinmann B, eds), p. 159–221, John Wiley and Sons, Canada, 2002.
4. Gelse K, Pöschl E, Aigner T. Collagens – structure, function, and biosynthesis. Adv Drug Delivery Rev 2003; 55 : 1531–46.
5. Dodge GR, Poole AR. Immunohistochemical detection and immunochemical analysis of type II collagen degradation in human normal, rheumatoid, and osteoarthritic articular cartilages and in explants of bovine articular cartilage cultured with interleukin-1. J Clin Invest 1989; 83 : 647–61.
6. Dodge GR, Pidoux I, Poole AR. The degradation of type II collagen in rheumatoid arthritis: an immunoelectron microscope study. Matrix 1991; 11 : 330–8.
7. Hollander AP, Heathfield TF, Webber C, Iwata Y, Bourne R, Rorabeck C, Poole AR. Increased damage to type II collagen in osteoarthritic articular cartilage detected by a new immunoassay. J Clin Invest 1994; 93 : 1722–32.
8. Hollander AP, Pidoux I, Reiner A, Rorabeck C, Bourne R, Poole AR. Damage to type II collagen in aging and osteoarthritis starts at the articular surface, originates around chondrocytes and extends into the cartilage with progressive degeneration. J Clin Incest 1995; 96 : 2859–69.
9. Croucher LJ, Hollander AP. Differential detection of type II collagen N–terminal and C-terminal denaturation epitopes in degrading cartilage. J Clin Pathol: Mol Pathol 1999; 52 : 323-31.
10. Hollander AP, Croucher LJ. Assay for collagen type II fragments. Patent no. WO9835235, 1998.
11. Deberg M, Christgau S, Henriksen D, Cloos P, Colette J, Reginster JY, Henroitin Y. Development of new immunoassay for the quantification of inflammatory related cartilage degradation [abstract]. Arthritis Rheum 2002; 46: S496.
12. Henroitin Y, Deberg M, Dubuc JE, Quettier E, Christgau S, Reginster JY. Type II collagen peptides for measuring cartilage degradation. Biorheology 2004; 41 : 543–7.
13. Deberg MA, Labasse AH, Christgau S, Cloos P, Henriksen D, Chapelle JP, Zegels B, Reginster J-Y, Henroitin Y. New serum biochemical markers (Coll 2-1 and Coll 2-1 NO2. for studying oxidative-related type II collagen network degradation in patients with osteoarthritis and rheumatoid arthritis. Osteoarthritis Cartilage 2005; 13 : 258–65.
14. Deberg MA, Labasse AH, Collette J, Seidel L, Reginster J-Y, Henroitin YE. One-year increase of Coll 2-1, a new marker of type II collagen degradation, in urine is highly predictive of radiological OA progression. Osteoarthritis Cartilage 2005; 13 : 1059–65.
15. Charni N, Juillet F, Garnero P. Urinary type II collagen helical peptide (HELIX-II) as a new biochemical marker of cartilage degradation in patients with osteoarthritis and rheumatoid arthritis. Arthritis Rheum 2005; 52 : 1081–90.
16. Billinghurst RC, Dahlberg L, Ionescu M, Reiner A, Bourne R, Rorabeck C, Mitchell P, Hambor J, Diekmann O, Tschesche H, Chen J, VanWart H, Poole AR. Enhanced cleavage of type II collagen by collagenases in osteoarthritic articular cartilage. J Clin Invest 1997; 99 : 1534–45.
17. Wu W, Billinghurst RC, Pidoux I, Antoniou J, Zukor D, Tanzer M, Poole AR. Sites of collagenase cleavage and denaturation of type II collagen in aging and osteoarthritic articular cartilage and their relationship to the distribution of matrix metalloproteinase 1 and matrix metalloproteinase 13. Arthritis Rheum 2002; 46 : 2087–94.
18. Aurich M, Squirez GR, Reiner A, Mollenhauer JA, Kuettner KE, Poole AR, Cole AA. Differential matrix degradation and turnover in early cartilage lesions of human knee and ankle joints. Arthritis Rheum 2005; 52 : 112–9.
19. Kojima T, Mwale F, Yasuda T, Girard C, Poole AR, Lavety S. Early degradation of type IX and type II collagen with the onset of experimental inflammatory arthritis. Arthritis Rheum 2001; 44 : 120–7.
20. Poole AR, Ionescu M, Fitzcharles MA, Billinghurst RC. The assesment of cartilage degradation in vivo: development of an immunoassay for the measurement in body fluids of type II collagen cleaved by collagenases. J Immunol Met 2004; 294 : 145–53.
21. Song X, Zeng L, Jin W, Thompson J, Mizel DE, Lei K, Billinghurst RC, Poole AR, Wahl SM. Secretory leukocyte protease inhibitor suppresses the inflammation and joint damage of bacterial cell wall-induced arthritis. J Exp Med 1999; 190 : 535-42.
22. Chu Q, Lopeez M, Hayashi K, Ionescu M, Billinghurst RC, Johnson KA, Poole AR, Markel M. Elevation of a collagenase generated type II collagen neoepitope and proteoglycan epitopes in synovial fluid following induction of joint instability in the dog. Osteoarthritis Cartilage 2002; 10 : 662–9.
23. Matyas JR, Atley L, Ionescu M, Eyre DR, Poole AR. Analysis of cartilage biomarkers in the early phases of canine experimental osteoarthritis. Arthritis Rheum 2004; 50 : 543–52.
24. Fraser A, Fearon U, Billinghurst RC, Ionescu M, Reece R, Barwick T, Emery P, Poole AR, Veale DJ. Turnover of type II collagen and aggrecan in cartilage matrix at the onset of inflammatory arthritis in humans – relationship to mediators of systemic and local inflammation. Arthritis Rheum 2003; 48 : 3085–95.
25. Cibere J, Thorne A, Kopec JA, Singer J, Canvin J, Robinson DB, Pope J, Hong P, Grant E, Lobanok T, Ionescu M, Poole AR, Esdalle JM. Glucosamine sulfate and cartilage type II collagen degradation in patients with knee osteoarthritis: randomized discontinuation trial results employing biomarkers. J Rheumatol 2005; 32 : 896–902.
26. Otterness IG, Downs JT, Lane C, Bliven ML, Stukenbrok H, Scampoli DN, Milici AJ, Mezes PS. Detection of collagenase-induced damage of collagen by 9A4, a monoclonal C-terminal neoepitope antibody. Matrix Biol 1999; 18 : 331–41.
27. Downs JT, Lane C, Nestor NB, McLellan TJ, Kelly MA, Karam GA, Mezes PS, Pelletier J-P, Otterness IG. Analysis of collagenase-cleavage of type II collagen using a neoepitope ELISA. J Immunol Met 2001; 247 : 25–34.
28. Woodworh TG, Otterness IG, Johnson K, Pickering E, Saltarelli MJ. Urinary type II collagen neoepitope (uTIINE) in osteoarthritis (OA) patients is associated with disease severity [abstract]. Arthritis Rheum 1999; 42:S258.
29. Saltarelli MJ, Johnson KS, Pickering E, Otterness IG, Vasquez-Abad MD, Woodworth TG. Measurement of urinary type II collagen neoepitope (uTIINE) levels in rheumatoid arthritis (RA) patients to assess joint status [abstract]. Arthritis Rheum 1999; 42:S249.
30. Pickering E, Vasquez-Abad MD, Saltarelli M, Lorello L, Moctezuma J, Burgos - Vargas R. Assesment of type II collagen neoepitope (TIINE) diurnal variation in urine of patients with rheumatoid arthritis following methotrexate (MTX) initiation [abstract]. Arthritis Rheum 2000; 43: S184.
31. Kraus VB, Stabler T, Le ET, Saltarelli M, Allen NB. Urinary type II collagen neoepitope as an outcome measure for relapsing polychondritis. Arthritis Rheum 2003; 48 : 2942–8.
32. Eyre DR. Methods of detecting collagen degradation in vivo. Patent no. WO9108478 1991.
33. Atley LM, Shao P, Shaffer K, Eyre D. Matrix metalloproteinase-mediated release of immunoreactive telopeptides from cartilage type II collagen [abstract]. Trans Orthop Res Soc 1998; 23 : 850.
34. Fernandes RJ, Schmid TM, Eyre DR. Assembly of collagen types II, IX and XI into nascent hetero-fibrils by a rat chondrocyte cell line. Eur J Biochem 2003; 270 : 3243–50.
35. Eyre DR, Pietka T, Weis MA, Wu JJ. Covalent cross-linking of the NC1 domain of collagen type IX to collagen type II in cartilage. J Biol Chem 2004; 279 : 2568–74.
36. Moskowitz RW, Holderbaum D, Atley LM, Eyre DR. Type II collagen C-telopeptide 2B4 epitope is a marker for cartilage degradation in familial osteoarthritis [abstract]. Arthritis Rheum 1998; 41:S352.
37. Lohmander LS, Atley LM, Pietka T, Eyre D. The release of crosslinked peptides from type II collagen into human synovial fluid is increased soon after joint injury and in osteoarthritis. Arthritis Rheum 2003; 48 : 3130–9.
38. Christgau S, Garnero P, Fledelius C, Moniz C, Ensig M, Gineyts E, Rosenquist C, Qvist P. Cartilage type II C-telopeptide fragments as an index of cartilage degradation. Bone 2001; 29 : 209–15.
39. Reijman N, Hazes JMW, Bierma-Zeinstra SMA, Koes BW, Christgau S, Christiansen C, Uitterlinden AG, Pols HAP. A new marker for osteoarthritis. Cross-sectional and longitudinal approach. Arthritis Rheum 2004; 50 : 2471–8.
40. Landewe L, Geusens P, Boers M, van der Heijde D, Lems W, Koppele JT, van der Linden S, Garnero P. Markers for type II collagen breakdown predict the effect of disease-modifying treatment on long-term radiographic progression in patients with rheumatoid arthritis. Arthritis Rheum 2004; 50 : 1390–9.
41. Mouritzen U, Christgau S, Lehmann HJ, Tanko LB, Chistiansen C. Cartilage turnover assessed with a newly developed assay measuring collagen type II degradation products: influence of age, sex, menopause, hormone replacement therapy, and body mass index. Ann Rheum Dis 2003; 62 : 332–6.
42. Birmingham JD, Vilim V, Kraus VB. Collagen biomarkers for arthritis applications. Biomarker Insights 2006; 1 : 61–76.
Štítky
Dermatológia Detská reumatológia Reumatológia
Článok vyšiel v časopiseČeská revmatologie
Najčítanejšie tento týždeň
2007 Číslo 1- První zkušenosti s léčbou psoriázy bimekizumabem v české reálné praxi – kazuistika z FNUSA
- Na český trh přichází biosimilar adalimumabu s prokázanou terapeutickou ekvivalencí
- Nehoňte nemocné s mMCC od čerta k ďáblu!
-
Všetky články tohto čísla
- Význam vybraných biomakerů v hodnocení a patogenezi osteoartrózy a revmatoidní artritidy. Souhrn doktorské dizertační práce
- Imunogenetické aspekty v etiopatogenezi revmatoidní artritidy: Role promotorového polymorfismu - 308 G/A genu pro tumor nekrotizující faktor α. Souhrn doktorské dizertační práce
- Imunochemické možnosti sledování degradace kolagenu typu II
- Mechanismy svalového zánětu a jejich klinické projevy u nemocných polymyozitidou a dermatomyozitidou. Souhrn doktorské dizertační práce
- Abstrakta přednášek z Třeboňských revmatologických dní, 3.–5. ledna 2007
- Abstrakta přednášek z Třeboňských revmatologických dní, 3.–5. ledna 2007 - pokračování
- Abstrakta přednášek z Třeboňských revmatologických dní, 3.–5. ledna 2007 - pokračování
- Česká revmatologie
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Mechanismy svalového zánětu a jejich klinické projevy u nemocných polymyozitidou a dermatomyozitidou. Souhrn doktorské dizertační práce
- Imunochemické možnosti sledování degradace kolagenu typu II
- Význam vybraných biomakerů v hodnocení a patogenezi osteoartrózy a revmatoidní artritidy. Souhrn doktorské dizertační práce
- Imunogenetické aspekty v etiopatogenezi revmatoidní artritidy: Role promotorového polymorfismu - 308 G/A genu pro tumor nekrotizující faktor α. Souhrn doktorské dizertační práce
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy




