-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Mastné kyseliny 1. Výskyt a biologický význam
Fatty acids – 1. Occurrence and biological significance
Fatty acids are monocarboxylic acids with chain-length 2–36 carbon atoms and 0–6 double bonds. Their physico-chemical properties are reflected also in the compounds, where fatty acids represent an important component (phospholipids, triglycerides), as well as in higher organized structures (plasma membranes, lipoproteins). Fatty acids are synthesized from two-carbon precursors; their degradation by ß-oxidation is accompanied by energy-release. Fatty acids are classified with respect to double bonds into saturated, monounsaturated and polyunsaturated. Simple lipids are esters of fatty acids and organic alcohols – cholesterol, glycerol and sphingosine and their derivatives. Endogenous acids can be desaturated up to ∆9 position; desaturation to other position is possible only from exogenous (essential) acids [(linoleic (n-6 series) and α-linolenic (n-3 series)]. Circulating lipids (in form of lipoproteins) consist of cholesterol esters and triglycerides in nonpolar core and phosphatidylcholin and sphingomyelin in the polar envelope of lipoproteins. Nonesterified fatty acids (product of lipolysis and source for lipid synthesis) are bound to plasma albumin. Membrane lipids, which ensure membrane fluidity and other functions, consist of phosphatidylcholine, phosphatidylethanolamine, sphingomyelin and some other (minor) phospholipids.
Key words:
fatty acids, lipids, lipoproteins, metabolism.
Autoři: E. Tvrzická; B. Staňková; M. Vecka; A. Žák
Působiště autorů: Univerzita Karlova v Praze, 1. lékařská fakulta, IV. interní klinika
Vyšlo v časopise: Čas. Lék. čes. 2009; 148: 16-24
Kategorie: Přehledový článek
Souhrn
Mastné kyseliny jsou monokarboxylové kyseliny s uhlíkovým řetězcem od 2 do 36 atomů a 0–6 dvojnými vazbami. Jejich fyzikálně-chemické vlastnosti se promítají do sloučenin, kde představují podstatnou složku (lipidy), stejně tak jako do vyšších organizovaných struktur (plazmatické membrány, lipoproteiny). Mastné kyseliny jsou syntetizovány z dvouuhlíkatých nebo tříuhlíkatých prekurzorů; jejich odbourávání ß-oxidací je doprovázeno uvolněním energie. Mastné kyseliny rozdělujeme podle počtu dvojných vazeb na nasycené, mononenasycené a vícenenasycené. Jednoduché lipidy jsou estery mastných kyselin a alkoholů – cholesterolu, glycerolu, sfingosinu a jejich derivátů. Endogenní kyseliny mohou být desaturovány až do ∆9 polohy, desaturace do vzdálenějších pozic je možná pouze u exogenních (esenciálních) kyselin (linolové (řada n-6) a α-linolenové (řada n-3)). Cirkulující lipidy ve formě lipoproteinů se skládají z esterů cholesterolu a triglyceridů v nepolárním jádru a z fosfatidylcholinu, sfingomyelinu a volného cholesterolu v polárním obalu. Neesterifikované mastné kyseliny (produkt lipolýzy a zdroj pro syntézu lipidů) jsou vázány na plazmatický albumin. Membránové lipidy, které zajišťují fluiditu i další funkce membrán, zahrnují fosfatidylcholin, fosfatidyletanolamin, sfingomyelin a další (minoritní) fosfolipidy.
Klíčová slova:
mastné kyseliny, lipidy, lipoproteiny, metabolismus.Úvod
Mastné kyseliny (FA) jsou strukturní součástí lipidů, které spolu s bílkovinami a sacharidy představují základní stavební kameny živé hmoty (1). Jsou to buď nasycené, nebo nenasycené karboxylové kyseliny s uhlíkovým řetězcem od 2 do 36 atomů. U vyšších živočichů a rostlin dominují FA se 16 a 18 uhlíkovými atomy, tj. kyseliny palmitová, stearová, olejová a linolová. Kyseliny s řetězcem kratším než 14 a delším než 22 uhlíkových atomů představují minoritní část. Většina FA má sudý počet atomů uhlíku, vzhledem k syntéze z dvouuhlíkatých jednotek. Přibližně polovina FA je nenasycených, s 1–6 dvojnými vazbami. Vícenenasycené FA (PUFA) jsou charakterizovány pentadienovým uspořádáním dvojných vazeb.
Mastné kyseliny jsou velmi často vyjadřovány schematickým vzorcem CN:p n-x, kde CN (uhlíkové číslo) představuje celkový počet atomů uhlíku, p – počet dvojných vazeb, x – polohu první dvojné vazby od metylové skupiny (n). Strukturní vzorce a značení vybraných FA jsou uvedeny na obrázku 1.
Obr. 1. Strukturní vzorce mastných kyselin. Při elongaci a desaturaci zůstává zachováno značení omega (n-), zatímco značení delta se mění; elongace i beta-oxidace probíhají na karboxylovém konci řetězce. 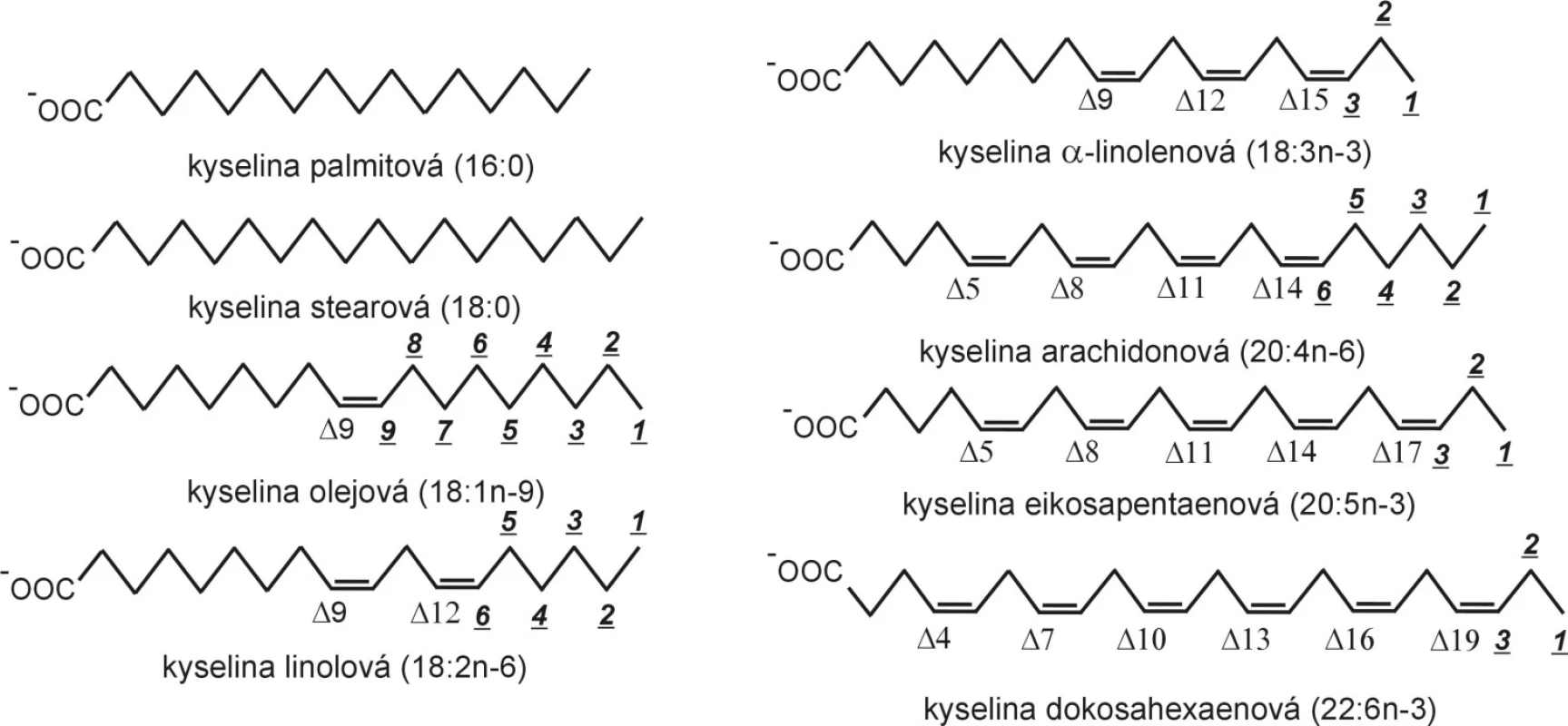
Fyzikálně-chemické vlastnosti
Bod tání mastných kyselin se zvyšuje s rostoucí délkou řetězce a klesá s rostoucím počtem dvojných vazeb. Tyto vlastnosti se promítají i do sloučenin, kde FA představují podstatnou složku (lipidy), stejně tak jako do vyšších organizovaných struktur (plazmatické membrány, lipoproteiny). Dvojné vazby mají za fyziologických podmínek převážně cis-konfiguraci, která způsobuje ohyb uhlíkového řetězce pod úhlem 60°. Tato vlastnost určuje sterické uspořádání řetězce, snižuje van der Waalsovy interakce, a tím i bod tání (2).
Stupeň nenasycenosti (počet dvojných vazeb v cis-konfiguraci) ovlivňuje významně mikroviskozitu buněčných membrán, jejich tloušťku a následně také funkce proteinů asociovaných s membránami (enzymy, buněčné receptory, membránové transportéry a iontové kanály).
Rozpustnost FA ve vodě s rostoucí délkou řetězce klesá. Ve zředěných roztocích jsou FA přítomny jako monomery, ve vyšších koncentracích (nad hodnotou tzv. kritické micelární koncentrace) pak tvoří micely. V micelách jsou karboxylové skupiny orientovány směrem do vodné fáze, zatímco hydrofobní alifatická část je orientována dovnitř micely (3). Amfifilní charakter fosfolipidů (PL) se uplatňuje i v lipozómech, které nacházejí stále širší využití v medicíně (4) i dalších oborech (kosmetika).
Biosyntéza mastných kyselin
Mastné kyseliny jsou syntetizovány v cytoplazmě z dvouuhlíkatých nebo tříuhlíkatých prekurzorů za účasti přenašeče acylových skupin, NADPH a acetyl-CoA-karboxylázy (1). V mikrozomálním systému se účastní elongace malonyl-CoA, v mitochondriálním systému acetyl-CoA. Odbourávání FA ß-oxidací v mitochondriích je doprovázeno uvolněním energie. V lidské krevní plazmě a tkáních bylo identifikováno asi 60 FA, z biologického hlediska jsou relevantní pouze některé z nich. Složení FA je charakteristické jak pro jednotlivé živočišné druhy, tak i pro jednotlivé tkáně.
Lidské (obecně savčí) tkáně jsou schopny syntetizovat nasycené FA (SFA) převážně se sudým počtem atomů uhlíku. Mononenasycené FA (MFA) vznikají zavedením dvojné vazby do polohy ∆9 od uhlíkového atomu karboxylové skupiny. Reakce je katalyzována enzymem ∆9 desaturázou (1). Výsledkem desaturace kyseliny stearové (18 : 0) je kyselina olejová (18 : 1 n-9), u kyseliny palmitové (16 : 0) je to kyselina palmitolejová (16 : 1 n-7). Mononenasycené FA řady n-9 s CN 20–24 jsou elongačními produkty kyseliny olejové, FA řady n-11 jsou desaturačními a elongačními produkty kyseliny arachové (20 : 0), jak schematicky ukazuje obrázek 2. Další desaturací (∆6, ∆5) a elongací kyseliny olejové vzniká Meadova kyselina (20 : 3 n-9), kterou lidský organismus produkuje pouze při nedostatku esenciálních FA (EFA) jako substrátu pro desaturaci, ve snaze zachovat fluiditu buněčných membrán (5).
Obr. 2. Elongace a desaturace endogenních mastných kyselin Postupnou desaturací a elongací kyseliny stearové vzniká endogenní vícenenasycená kyselina 20:3n-9 (Meadova); tuto kyselinu vytváří organismus při nedostatku esenciálních mastných kyselin ve snaze zachovat fluiditu membrán a získat substrát pro tvorbu eikosanoidů. 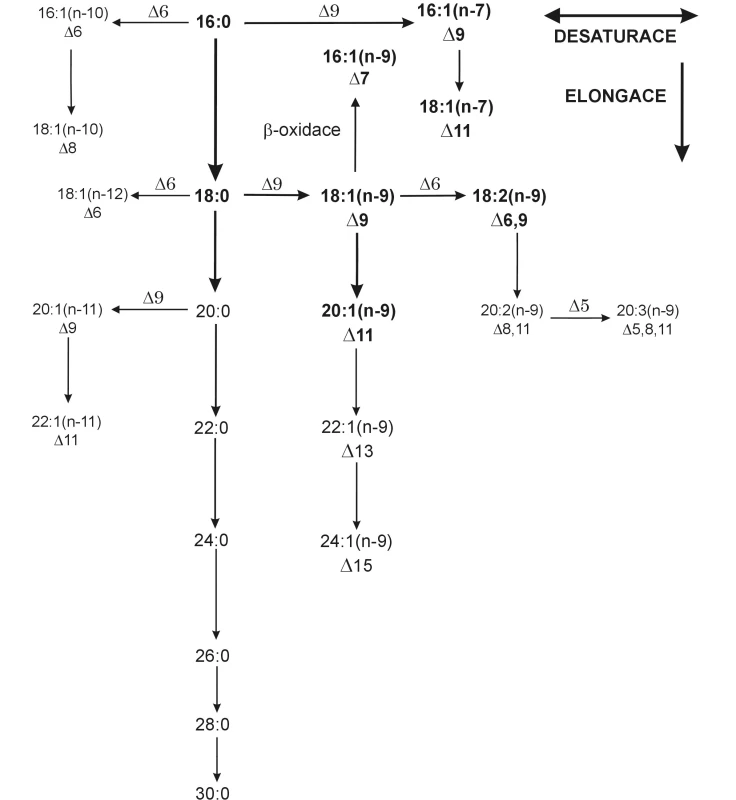
Vícenenasycené FA obsahují 2–6 dvojných vazeb v pentadienovém uspořádání. Za EFA jsou považovány PUFA s první dvojnou vazbou lokalizovanou na třetím (řada n-3) nebo šestém (řada n-6) uhlíkovém atomu od metylové skupiny. Tyto kyseliny není schopen organismus syntetizovat a je zcela závislý na jejich dietním přísunu. Základními prekurzory EFA jsou kyselina linolová (LA, 18 : 2 n-6) pro řadu n-6 a kyselina α-linolenová (ALA, 18 : 3 n-3) pro řadu n-3, zvané též mateřské FA. Obě kyseliny vznikají postupnou desaturací kyseliny olejové v endoplazmatickém retikulu a chloroplastu rostlin (1). Metabolickou přeměnu EFA ukazuje přehledně obrázek 3.
Obr. 3. Elongace a desaturace esenciálních mastných kyselin Kyseliny dokosapentaenová (22:5n-6) a dokosahexaenová (22:6n-3) nevznikají Δ4 desaturací svých teoretických prekurzorů; nejprve proběhne elongace na 24-uhlíkatý analog, poté jeho desaturace, a následnou ß-oxidací teprve vznikají zmíněné produkty. 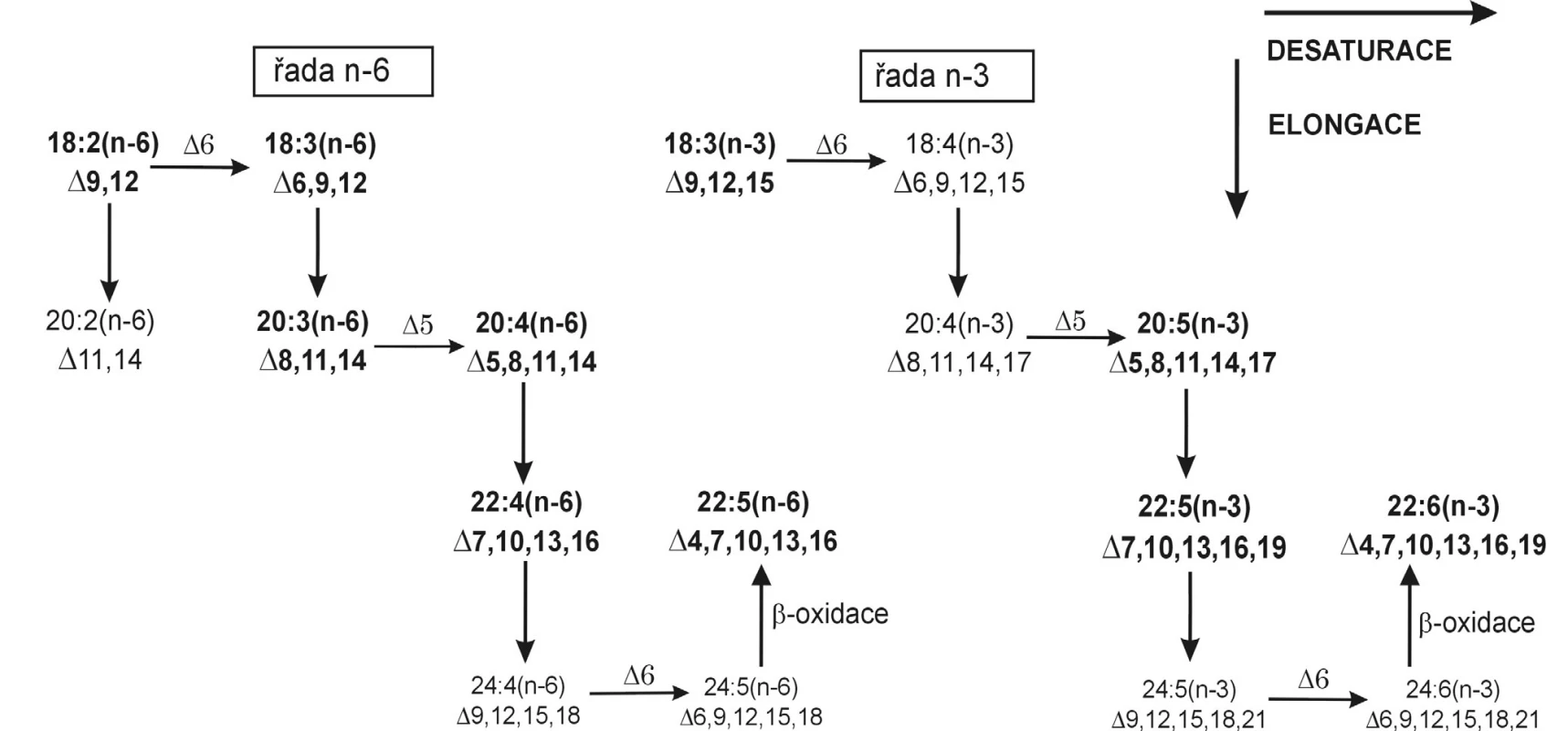
Mastné kyseliny v jednotlivých metabolických řadách mají odlišnou afinitu k enzymům i schopnost inhibovat desaturázy (v poměru FA n-3 : FA n-6 : FA n-9 ~ 10 : 3 : 1).
Klasifikace a biologické funkce
Mastné kyseliny rozdělujeme do několika skupin na základě jejich struktury, fyziologické úlohy a biologických účinků.
Nasycené mastné kyseliny
Nasycené mastné kyseliny dělíme do podskupin podle délky uhlíkového řetězce.
Mastné kyseliny s krátkým řetězcem (SCFA) zahrnují kyselinu octovou (2 : 0), propionovou (3 : 0) a máselnou (4 : 0); tyto kyseliny vznikají během fermentace vlákniny v proximální části tlustého střeva. Jsou rychle absorbovány, octová a částečně i propionová kyselina jsou resorbovány portální cirkulací, transportovány do jater a zde metabolizovány na glukózu (kyselina propionová) a mastné kyseliny (kyselina octová). Tento proces pokrývá 10–20 % klidového energetického výdeje organismu. Kyselina máselná a částečně i propionová jsou využívány v metabolismu kolonocytů (množení a obnova buněk).
Kyseliny s krátkým řetězcem stimulují ve střevě:
- a) absorpci sodíku, chloridů, bikarbonátů a vody,
- b) zvyšují krevní průtok tlustým střevem,
- c) stimulují proliferaci kolonocytů a produkci hlenu,
- d) stimulují autonomní nervový systém ve střevě a produkci gastrointestinálních hormonů (gastrin, enteroglukagon),
- e) snižují aciditu obsahu tlustého střeva, a tím omezují růst saprofytických bakterií i hnilobný rozklad (6).
Mastné kyseliny se středním řetězcem (MCFA) zahrnují kyselinu kapronovou (6 : 0), kaprylovou (8 : 0) a kaprinovou (10 : 0). Ty jsou přímo resorbovány a transportovány portální žílou, na rozdíl od ostatních FA, které jsou zabudovány do triglyceridů (TG) a PL chylomikronů (CM) a resorbují se via ductus thoracicus. K intramitochondriálnímu přenosu těchto kyselin není nutná přítomnost karnitinu ani karnitin-palmitoyl transferázy. Tukové emulze obsahující TG s MCFA (MCT) jsou využívány jako nutriční podpora, vzhledem k jejich kratšímu biologickému poločasu a vyšší stabilitě vůči lipoperoxidaci. Tyto emulze rovněž potlačují pokles klidového energetického výdeje během kalorické restrikce a používají se v redukčních dietních režimech při léčbě obezity (7).
Mastné kyseliny s dlouhým řetězcem (LCFA) zahrnují kyselinu laurovou (12 : 0), myristovou (14 : 0), palmitovou (16 : 0) a stearovou (18 : 0), které mají významný aterogenní a trombogenní potenciál. Tyto kyseliny představují 80–90 % celkových SFA přijímaných potravou. Jejich rostlinným zdrojem je především olej z kokosového ořechu (Cocos nucifera), olej z palmového jádra (Elaeis guineensis), kakaové máslo (Theobroma cao), bambucký tuk z ořechů Shea (Butyrospermum parkii) a illipové máslo z ořechů Illipe (Bassialatifola). Poslední tři produkty, které jsou významnou složkou čokolád, obsahují také asi 35 % kyseliny olejové. Potravním zdrojem LCFA z živočišné říše je máslo, vepřové sádlo a hovězí lůj (8).
Pravidelná konzumace LCFA zvyšuje hladinu cholesterolu, především cholesterolu v lipoproteinu o nízké hustotě (LDL-C), který má významný aterogenní potenciál a je dáván do souvislosti se zvýšenou úmrtností na ischemickou chorobu srdeční. Účinek jednotlivých FA na vzrůst koncentrací LDL-C klesá v řadě 12 : 0 > 14 : 0 > 16 : 0, účinek na pokles koncentrací cholesterolu v lipoproteinu o vysoké hustotě (HDL-C), v řadě 14 : 0 > 12 : 0 > 16 : 0. Kyselina stearová má neutrální účinek na koncentrace LDL-C a zvyšuje koncentrace HDL-C, jehož účinek je považován za antiaterogenní. Její trombogenní účinek je naopak považován za nejvyšší. Význam zvýšeného obsahu SFA v membránových raftech nebyl dosud zcela objasněn (9).
Aterogenní a trombogenní potenciál lze vyjádřit jako aterogenní index (AI) a trombogenní index (TI) (10):
AI = (12 : 0 + 4 × 14 : 0 + 16 : 0) × (PUFA n-6 + PUFA n-3 + MFA)-1
TI = (14 : 0 + 16 : 0 +18 : 0) × (0,5 × MFA + 0,5 × PUFA n-6 + 3 × PUFA n-3 + PUFA n-3/ PUFA n-6)-1
Mastné kyseliny s velmi dlouhým řetězcem (VLCFA) zahrnují kyselinu arachovou (20 : 0), behenovou (22 : 0), lignocerovou (24 : 0), cerotovou (26 : 0), montanovou (28 : 0) a melissovou (30 : 0), které jsou obsaženy v měřitelných koncentracích v krevním séru osob s vrozenými metabolickými poruchami, jako např. Zellwegerův syndrom, adrenoleukodystrofie vázaná na X-chromozóm, Refsumova choroba, Menkesova choroba (11). K léčbě těchto poruch mohou být využity PUFA n-3.
Mononenasycené mastné kyseliny
Mononenasycené mastné kyseliny rozlišujeme podle konfigurace dvojné vazby. Hlavními představiteli FA v cis configuraci jsou kyselina olejová (18 : 1 n-9), vakcenová (18 : 1 n-7) a palmitolejová (16 : 1 n-7). Endogenní původ mají dále kyseliny myristolejová (14 : 1 n-5), gondoová (20 : 1 n-9), eruková (22 : 1 n-9) a nervonová (24 : 1 n-9c), které jsou přítomny pouze v minoritním zastoupení. Exogenního původu jsou kyseliny gadolová (20 : 1 n-11), eruková a cetolová (22 : 1 n-11). Kyselina eruková, která je hojně zastoupena v oleji nekultivované řepky olejné (Brassica campestris), je považována za kardiotoxickou. Experimenty s laboratorními zvířaty ukázaly depozita tuku následované lézemi myokardu (12). Tyto nálezy daly podnět k vypěstování tzv. bezerukové řepky, kde je obsah kyseliny erukové minimální. Konzumace oleje s vyšším obsahem kyseliny erukové měla u pacientů s adrenoleukodystrofií pozitivní účinky na fluiditu membrán krevních destiček, ale negativní účinky na myokard je třeba mít rovněž na zřeteli (13).
Kyselina olejová v dietě má antiaterogenní i antitrombotické účinky (zvyšuje poměr HDL-C/LDL-C, snižuje agregabilitu destiček). Inkorporace kyseliny olejové do plazmatických lipidů (esterů cholesterolu (CE), TG a PL lipoproteinových částic) zvyšuje jejich odolnost vůči lipoperoxidaci. Náhrada SFA za kyselinu olejovou (v množství zhruba 7 energetických %) snižuje koncentrace TG, LDL-C a zvyšuje koncentrace HDL-C spolu s úpravou inzulínové rezistence. Podmínkou je příjem tuků, který nepřesahuje 30 energetických % (14). Kyselina olejová je majoritní kyselinou olivového oleje (Olea europaea), saflorového oleje ze semínek světlice barvířské (Carthamus tinctorius), kultivovaného řepkového oleje (Brassica campestris), kanolového oleje z geneticky modifikované řepky (Canola), oleje z burských ořechů (Arachis hypogaea), z lískových ořechů (Corylusamericana), sladkých mandlí (Prunusamygdalus dulcis)a avokáda (Persea gratissima). Nižší obsah kyseliny olejové (40–50 %) je v oleji z ovoce palmy olejné(Elaeis guineensis), v oleji z rýžových otrub (Oryza sativa), kukuřičném (Zea mays) a sezamovém oleji (Sesamum indicum). Řada olejnatých plodin je geneticky modifikována za účelem zvýšení obsahu kyseliny olejové, která nepodléhá snadno lipoperoxidaci a působí příznivě na obsah krevních lipidů (8).
Šlechtěním kanoly, která za normálních podmínek obsahuje asi 1% kyseliny stearové, lze získat produkt s vysokým obsahem (až 40 %) této kyseliny, což je výhodné pro výrobu margarínů. Kyselina stearová je známa tím, že nezvyšuje obsah cholesterolu v krvi (na rozdíl od kyselin palmitové a myristové).
Hlavními představiteli FA s trans konfigurací dvojné vazby jsou kyselina elaidová (18 : 1 n-9t) a trans-vakcenová (18 : 1 n-7t). Pro lidský organismus jsou trans-FA exogenními kyselinami, jejichž aterogenní účinek je vyšší než u SFA. Hlavním zdrojem kyseliny elaidové v potravě jsou margaríny a ztužené pokrmové tuky (rostlinné oleje hydrogenované za použití nekvalitního katalyzátoru), kyselina trans-vakcenová se nachází v másle a dalších mléčných výrobcích (vzniká působením bakterií v zažívacím traktu přežvýkavců). Hydrogenované tuky se používají při přípravě cukrářských výrobků a rychlého občerstvení (tzv. “fast food”). Sterická konfigurace trans-FA je podobná jako u SFA, což se projevuje v obdobném účinku na rigiditu, a tím i vlastnosti buněčných membrán. Trans MFA jsou asi dvakrát účinnější pro vzrůst LDL-C a snížení HDL-C než SFA a je diskutován jejich vliv na vzestup koncentrace Lp(a). Působení obou zmíněných kyselin na lidský organismus není identické a rozdíly jsou stále předmětem studia (15, 16).
Vícenenasycené mastné kyseliny
Vícenenasycené mastné kyseliny obsahují dvě a více dvojných vazeb v molekule. Endogenní PUFA jsou řady n-9 a organismus je syntetizuje při nedostatku esenciálních PUFA. Tyto PUFA, které jsou výhradně exogenního původu, rozdělujeme do dvou skupin: řady n-3 a řady n-6. Mají výrazný antiaterogenní i antitrombotický účinek, který je dán jejich komplexním působením na koncentrace lipoproteinů, fluiditu membrán, funkci membránových enzymů a receptorů, modulaci produkce eikosanoidů, regulaci krevního tlaku a metabolismus minerálů. Přítomnost většího počtu dvojných vazeb v molekule FA však zvyšuje možnost lipoperoxidace.
Vícenenasycené FA řady n-6: Mateřskou kyselinou je LA, jejími hlavními metabolickými produkty jsou kyselina γ-linolenová (18 : 3 n-6), dihomo-γ-linolenová (20 : 3 n-6) a arachidonová (20 : 4 n-6); minoritními složkami této řady jsou kyselina adrenová (22 : 4 n-6) a dokosapentaenová (22 : 5 n-6). Vysoký obsah PUFA n-6 (> 60 %) má olej sojový(Glycine soja), slunečnicový (Helianthus annuus), pupalkový (Oenothera biennis), saflorový olej z genetické variety světlice barvířské (Carthamus tinctorius), olej z hroznových jadérek (Vitis vinifera), z máku setého (Papaver somniferum), semínek brutnáku (Borago officinalis) a černého rybízu (Ribes nigrum). Nižší obsah (40–50 %) má olej z pšeničných klíčků (Triticum vulgare), kukuřice (Zea mays), vlašských ořechů (Juglansregia), semen bavlníku (Gossypium) a sezamu (Sesamum indicum) (8).
Vícenenasycené FA n-6 jsou aktivátory receptorů aktivovaných peroxizomovými proliferátory (PPAR γ > α). Jejich metabolický účinek zahrnuje zvýšenou syntézu cholesterolu, zvýšenou aktivitu LDL-receptorů (která je důsledkem jejich zvýšené mRNA), zvýšenou aktivitu cholesterol 7α-hydroxylázy (Cyp 7A1) a sníženou konverzi VLDL na LDL. Suplementace PUFA n-6 vede k poklesu celkového cholesterolu, LDL-C a HDL-C a ke zvýšené oxidaci a oxidabilitě částic LDL. Konečným efektem je „up-regulace” LDL-receptorů a aktivity Cyp 7A1. Jako ligandy PPAR-γ zvyšují PUFA n-6 inzulínovou senzitivitu, mění distribuci tuku a velikost adipocytů (17, 18). Kyselina arachidonová je hlavním prekurzorem eikosanoidů (prostaglandinů a tromboxanů 2. série a leukotrienů 4. série), účinných signálních molekul uvnitř i vně buňky (19).
Vícenenasycené FA řady n-3: Mateřskou kyselinou je ALA, hlavními metabolickými produkty jsou kyseliny timnodonová (eikosapentaenová, EPA, 20 : 5 n-3) a klupadonová (dokosahexaenová, DHA, 22 : 6 n-3), v menší míře pak kyselina dokosapentaenová (22 : 5 n-3). Zdrojem kyseliny α-linolenové jsou semena a listy některých rostlin: sojové boby (Glycine max), lněné semeno (Linum usitatissimum), semena černého rybízu (Ribes nigrum) a listy brutnáku (8). Konverze ALA na její metabolity s 20–22 CN je podstatně efektivnější u mořských živočichů než u člověka, a proto jsou EPA a DHA v lidském organismu také převážně exogenního původu (20). Tyto kyseliny, především pak DHA, jsou ve vysoké míře obsaženy v nervové tkáni a v retině, kde zajišťují správnou funkci těchto orgánů; dále hrají důležitou roli v signálové transdukci, pravděpodobně regulací signalizace G-proteinu (21).
Jako ligandy PPAR-α mají PUFA n-3 řadu pleiotropních metabolických účinků. Předpokládá se, že aktivace PPAR-α má za následek pokles lipogeneze a sekrece VLDL potlačením vazebné bílkoviny pro sterol regulující elementy (SREBP-1), dále vzrůst aktivity lipoproteinové lipázy, pokles koncentrace apolipoproteinu C-III a zvýšený reversní transport cholesterolu. Jako výživový doplněk indukují PUFA n-3 expresi odpřahujících proteinů a denzitu mitochondrií pomocí β-oxidace FA ve svalech (22).
Imunomodulační aktivita PUFA n-3 souvisí s jejich schopností potlačovat aktivaci T-lymfocytů. Tato aktivace vyžaduje acylované proteiny, které jsou lokalizovány převážně v membránových raftech, z nichž se uvolňují zvýšeným působením PUFA n-3 (23).
Konjugované mastné kyseliny: Nejhojnějšími FA s konjugovaným systémem dvojných vazeb jsou izomery LA (CLA). FA se vyskytují v červeném mase a mléčných produktech. Krávy volně se pasoucí v přírodě mají několikanásobně vyšší obsah CLA ve svalovině i mléce než krávy živené uměle. Nejčastěji se vyskytuje kyselina rumenová, izomer c9, t11 CLA (RA), v menším množství pak izomery t7, c9 > c11, t13 > c8, t10 > t10, c12 (24). Kyselina rumenová vzniká desaturací kyseliny trans-vakcenové (18 : 1 t11), která je produktem bakteriálního působení v zažívacím traktu přežvýkavců a je také dominující trans FA v mléčných produktech. Konjugované FA mají tedy obdobný původ jako trans FA, jejich biologické účinky jsou však většinou příznivé. V experimentálních studiích in vitro i in vivo bylo zjištěno jak antioxidační působení konjugovaných FA (pravděpodobně v důsledku tvorby FA s furanovou strukturou), tak i antikancerogenní účinky. Ty byly paradoxně zjištěny ve studii zabývající se účinky přepáleného tuku (25). Izomer 18 : 2 t10, c12 inhiboval akumulaci tuku in vivo, izomer 18 : 2 c9, t11 zlepšoval parametry lipidového metabolismu ovlivněním exprese SREBP-1c a LXRα v játrech (26). Optimismus daný výsledky experimentálních studií se bohužel nepotvrdil jednoznačně ve studiích humánních; jako hlavní důvod lze předpokládat výrazně nižší dávkování pro člověka než pro experimentální zvířata (27). Tyto rozdíly a také rozdíly v účincích jednotlivých izomerů budou zřejmě ještě delší dobu středem pozornosti pro základní výzkum.
Mastné kyseliny jako strukturální komponenty lipidů
Jednoduché lipidy jsou estery mastných kyselin a alkoholů – cholesterolu, glycerolu, sfingosinu a jejich derivátů. Podle typu báze rozlišujeme následující lipidové třídy (28):
- mastný alkohol – vosky
- cholesterol – cholesterol estery
- glycerol – triglyceridy, diglyceridy, monoglyceridy
- alkenylglycerol – eter-lipidy, plazmalogeny
- fosfoglycerol – glycerofosfolipidy
- glycerylhexosid – glyceroglycolipidy
- sfingosin – ceramidy
- fosfosfingosin – sfingofosfolipidy
- glykosfingosin – glykosfingolipidy
Strukturní vzorce jsou uvedeny na obrázku 4. Patofyziologické působení FA přímo souvisí s úlohou jednotlivých lipidů.
Obr. 4. Strukturní vzorce lipidových tříd 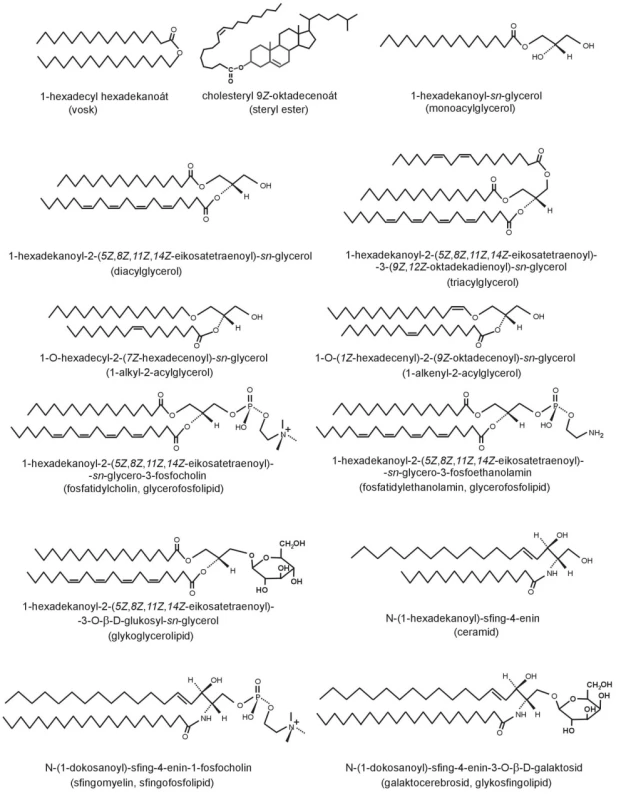
Cirkulující lipidy ve formě lipoproteinů se skládají z CE (60–70 % celkového cholesterolu) a TG v nepolárním jádru a z fosfatidylcholinu, sfingomyelinu a volného cholesterolu v polárním obalu. Neesterifikované FA (NEFA), produkty lipolýzy a zdroj pro syntézu lipidů, jsou v plazmě vázány na albumin (29).
Estery cholesterolu představují transportní a zásobní formu cholesterolu v organismu; při teplotě vnitřního prostředí tvoří tekuté krystaly. Majoritní kyselinou transportních CE je LA (cca 50 %), následovaná kyselinou olejovou (18 %), palmitovou (15 %) a arachidonovou (7 %) (30). Intracelulární CE obsahují převážně kyselinu olejovou a palmitolejovou. U savců jsou CE syntetizovány intravaskulárně v reakci katalyzované enzymem lecitin : cholesterol acyl transferázou (LCAT). Tento enzym přenáší FA z prostředního uhlíkového atomu lecitinu na 3-ß-OH skupinu cholesterolu za vzniku CE a lyzolecitinu. Estery cholesterolu tvoří podstatnou část jádra lipoproteinů LDL a HDL; jsou také hlavní komponentou lipidových inkluzí makrofágů a pěnových buněk v aterosklerotických lézích.
Triglyceridy jsou hlavní složkou jádra lipoproteinů o velmi nízké hustotě (VLDL), chylomikronů a lipidových inkluzí adipocytů. Nejhojnější FA v TG je kyselina olejová (40 %), dále pak kyseliny palmitová (22 %) a linolová (20 %) (31). Podobné zastoupení FA má také tuková tkáň: kyselina olejová 50 %, palmitová 22 % a linolová 12 %.
Fosfolipidy jsou spolu s neesterifikovaným cholesterolem hlavními lipidovými složkami polárního (hydrofilního) obalu lipoproteinů. Molekuly PL se volně zaměňují jak mezi jednotlivými lipoproteiny, tak mezi obaly lipoproteinů a plazmatickými membránami. Tento proces je realizován pomocí specifických bílkovinných přenašečů. Složení a obsah jednotlivých PL v obalu lipoproteinů je s výjimkou chylomikronů podobné u všech hlavních lipoproteinových tříd. Nejhojnějším PL je fosfatidylcholin (lecitin, PC), jehož obsah v plazmě dosahuje 60–70 %, následován sfingomyelinem (SM) (10–20 %), lyzofosfatidylcholinem (LPC) (3–5 %) a fosfatidylethanolaminem (PE) (2–6 %). Minoritními PL v plazmě jsou fosfatidylserin (PS) (1–2 %) a fosfatidylinozitol (PI) (1–2 %). V plazmatickém PC jsou nejhojnějšími FA kyseliny palmitová (30 %), linolová (25 %), stearová (14 %), olejová (11 %) a arachidonová (11 %) (30).
Některé parciální estery – monoglyceridy, diglyceridy, LPC a ceramidy – jsou intermediárními produkty syntézy či degradace dalších lipidů (jednoduchých i složených); jejich koncentrace v plazmě jsou velmi nízké, některé z nich ve funkci druhých poslů regulují řadu buněčných aktivit. Složení FA v těchto minoritních lipidech reflektuje složení FA v mateřských lipidových třídách.
Neesterifikované FA jsou v plazmě za fyziologických podmínek přítomny pouze ve velmi nízkých koncentracích (0,5–1,0 mmol/l), jejich profil je podobný jako u TG (32). Neesterifikované FA mohou být oxidovány, reesterifikovány nebo metabolizovány (elongovány či desaturovány). Při fyzické aktivitě jsou oxidovány ve svalech, v klidovém režimu v játrech a myokardu. Většina NEFA je reesterifikována v játrech na TG a PL. Limitujícím krokem pro mobilizaci NEFA z tukové tkáně je aktivita hormon-senzitivní lipázy. Zvýšené koncentrace NEFA působí toxicky na plazmatické membrány, což může mít za následek arytmie, protrombogenní účinky ap. V kombinaci se zvýšenou koncentrací glukózy urychlují vznik reaktivních kyslíkatých a dusíkatých sloučenin i iniciaci a rozvoj endoteliální dysfunkce.
Membránové lipidy, které zajišťují fluiditu i další funkce membrán, zahrnují jako hlavní PL třídy PC, PE, SM a jako minoritní PL třídy PS, PI, LPC a lyzofosfatidylethanolamin. Složení FA jednotlivých lipidových tříd výrazně ovlivňuje fluiditu membrán (33). Nejhojnějšími PL v buněčných membránách jsou PC a PE, s dominující kyselinou palmitovou a vysokým obsahem PUFA. Vyšší obsah PUFA má obvykle PE. Hlavní PL třídy výrazně ovlivňují biochemii membrán; organely mají obvykle mnohem více PE než buněčné membrány, které mají větší obsah SM. Zastoupení jednotlivých PL v membránách a složení jejich FA jsou charakteristické jak pro živočišné druhy, tak i pro jednotlivé tkáně; např. membrány jaterních buněk mají vysoký obsah PC, membrány mozkových buněk jsou bohaté na gangliosidy; buněčné membrány bakterií mají naopak nejvíce zastoupený PE.
Závěr
Struktura mastných kyselin a s ní související fyzikální a chemické vlastnosti předurčují tyto sloučeniny jako významné součásti živých organismů. V lipoproteinech se uplatňuje možnost atero - či antiaterogenního působení, v membránách jsou důležitým faktorem pro jejich fluiditu. V triglyceridech tukové tkáně slouží jako zdroj energie a izolátory, vícenenasycemé mastné kyseliny odštěpené z fosfolipidů jsou zdrojem pro tvorbu eikosanoidů, hrají roli v přenosu signálů, modulují transkripci genů a jsou důležitými ligandy receptorů. V neposlední řadě jsou využívány i v léčbě a prevenci některých onemocnění. O těchto vlastnostech bude pojednávat 2. díl této práce.
Zkratky
AI – aterogenní index
ALA – kyselina α-linolenová (α-linolenic acid)
CE – cholesterol ester
CLA – konjugovaná kyselina linolová (conjugated linoleic acid)
CN – uhlíkové číslo (carbon number)
CoA – koenzym A
Cyp 7A1 – cholesterol 7α-hydroxyláza
DHA – kyselina dokosahexaenová (docosahexaenoic acid)
DPA – kyselina dokosapentaenová (docosapentaenoic acid)
EFA – esenciální mastné kyseliny (essential fatty acids)
EPA – kyselina eikosapentaenová (eicosapentaenoic acid)FA – mastné kyseliny (fatty acids)
HDL-C – cholesterol v lipoproteinu o vysoké hustotě (high density lipoprotein cholesterol)
LA – kyselina linolová (linoleic acid)
LCAT – lecitin : cholesterol acyl transferáza
LCFA – mastné kyseliny s dlouhým řetězcem (long chain fatty acids)
LDL-C – cholesterol v lipoproteinu o nízké hustotě (low density lipoprotein cholesterol)
LPC – lyzofosfatidylcholin
LXR – jaterní receptor X (liver X receptor)
MCFA – mastné kyseliny se středním řetězcem (medium chain fatty acids)
MCT – triglyceridy se středním řetězcem (medium chain triglycerides)
MFA – mononenasycené mastné kyseliny (monounsaturated fatty acids)
mRNA – messenger ribonukleová kyselina
NADPH – nikotinamid adenosin fosfát – redukovaná forma
NEFA – neesterifikované mastné kyseliny (nonesterified fatty acids)
PC – fosfatidylcholin
PE – fosfatidyletanolamin
PI – fosfatidylinositol
PL – fosfolipidy
PPAR – receptory aktivované peroxizomovými proliferátory (peroxisome proliferator activated receptor)
PS – fosfatidylserin
PUFA – vícenenasycené mastné kyseliny (polyunsaturated fatty acids)
RA – kyselina rumenová (rumenic acid)
SCFA – mastné kyseliny s krátkým řetězcem (short chain fatty acids)
SFA – nasycené mastné kyseliny (saturated fatty acids)
SM – sfingomyelin
SREBP – vazebná bílkovina pro sterol regulující elementy (sterol regulatory element binding protein)
TG – triglycerid
TI – trombogenní index
VLCFA – mastné kyseliny s velmi dlouhým řetězcem (very long chain fatty acids)
VLDL – lipoprotein o velmi nízké hustotě (very low density lipoprotein)
Práce byla podporována výzkumným záměrem MSM 0021620820 a MSM 0021620807.
Adresa pro korespondenci:
RNDr. Eva Tvrzická, CSc.
IV. interní klinika 1. LF UK a VFN
U Nemocnice 2, 128 08 Praha 2
fax: +420 224 923 524, e-mail: eva.tvrzicka@vfn.cz
Zdroje
1. Nelson DL, Cox MM. Lipid Biosynthesis. In: Principles of Biochemistry. New York: W.H. Freeman and Comp. 2005; 787–815.
2. Gunstone FD. Fatty Acid Structure. In The Lipid Handbook. London: Chapman and Hall 1994; 1–19.
3. Larsson K, Quinn PJ. Physical Properties: Structural and Physical Characteristics. In The Lipid Handbook. London: Chapman and Hall 1994; 401–465.
4. De Jong WH, Borm PJ. Drug delivery and nanoparticles:applications and hazards. Int J Nanomedicine 2008; 3 : 133–149.
5. Mead JF. The metabolism of polyunsaturated fatty acids. In Holman RT. Progress in the Chemistry of Fats and Other Lipids. Oxford: Pergamon Press 1971; 161–189.
6. Compher C, Setto RW, Lew JI, et al. Dietary fiber and its Clinical Applications to Enteral Nutrition. In Rombeau JL, Rolandelli RH. Clinical Nutrition: Enteral and Tube Feeding. Philadelphia: W.B. Saunders Comp. 1997; 81–95.
7. Hainer V, Kunešová M, Štich V, et al. Úloha olejů s obsahem triglyceridů s mastnými kyselinami o středním řetězci v dietní léčbě otylosti. Vliv na klidový energetický výdej a sérové lipidy. Čas Lék čes 1994; 133 : 373–375.
8. Larsson K, Quinn PJ. Occurence and Characteristics of Oils and Fats. In The Lipid Handbook. London: Chapman and Hall 1994; 47–223.
9. Vemuri M, Kelley DS. The Effects of Dietary Fatty Acids on Lipid Metabolism. In Chow CK. Fatty Acids in Foods and Their Health Implications. Boca Raton: CRC Press 2007; 591–630.
10. Ulbright TLV, Southgate DAT. Coronary heart disease: seven dietary factors. Lancet 1991; 338 : 985–992.
11. Gotto AM. Contemporary diagnosis and management of lipid disorders. Newtown, Pa.: Handbooks in Health Care Co. 2004.
12. Beare-Rogers JL, Nera EA. Cardiac fatty acids and histopathology of rats, pigs, monkeys and gerbils fed rapeseed oil. Comp Biochem Physiol B 1972; 41 : 793–800.
13. Stöckler S, Opper C, Greinacher A, et al. Decreased platelet membrane anisotropy in patients with adrenoleukodystrophy treated with erucic acid (22 : 1)-rich triglycerides. J Inherit Metab Dis 1997; 20 : 54–58.
14. Richardi G, Giacco R, Rivellese AA. Dietary fat, insulin sensitivity and the metabolic syndrome. Clin Nutr 2004; 23 : 447–456.
15. Osso FS, Moreira AS, Teixeira MT, et al. Trans fatty acids in maternal milk lead to cardiac insulin resistance in adult offspring. Nutrition 2008; 24 : 727–732.
16. Booker CS, Mann JL. Trans fatty acids and cardiovascular health: translation of the evidence base. Nutr Metab Cardiovasc Dis 2008; 18 : 448–456.
17. Staels B. The PPAR System and Regulation of Lipoprotein Metabolism. In Betteridge DJ. Lipids and vascular disease. London: Martin Dunitz Publ 2000; 27–37.
18. Schoonjans K, Martin G, Staels B, et al. Peroxisome proliferator-activated receptors, orphans with ligands and functions. Curr Opin Lipidol 1997; 8 : 159–166.
19. Vergroesen AJ. Essential fatty Acids, Biomembranes and Eicosanoid Metabolism. In Vergroesen AJ, Crawford M. The role of fats in human nutrition. London: Academic Press 1989; 17–29.
20. Brenna TJ. Efficiency of conversion of [alpha]-linolenic acid to long chain n-3 fatty acids in man. Curr Opin Clin Nutr Metab Care 2002; 5 : 127–132.
21. Simopoulos AP. Omega-3 fatty acids in health and disease and in growth and development. Am J Clin Nutr 1991; 54 : 438–463.
22. Burdge G. Alpha-linolenic acid metabolism in men and women: nutritional and biological implication. Curr Opin Clin Nutr Metab Care 2004; 7 : 137–144.
23. Calder PC. N-3 polyunsaturated fatty acids and inflammation: from molecular biology to the clinic. Lipids 2003; 38 : 343–352.
24. Lawson RE, Moss AR, Ian Givens D. The role of dairy products in supplying conjugated linoleic acid to man’s diet: A review. Nutr Res Rev 2001; 14 : 153–172.
25. Pariza MW, Hargraves WA. A beef-derived mutagenesis modulator inhibits initiation of mouse epidermal tumors by 7,12 dimethylbenz[a]anthracene. Carcinogenesis 1985; 6 : 591–593.
26. Pineda Torra I, Gervois P, Staels B. Peroxisome proliferator-activated receptor alpha in metabolic disease, inflammation, atherosclerosis and aging. Curr Opin Lipidol 1999; 10 : 151–159.
27. Tvrzická E, Vecka M, Žák A. Konjugovaná kyselina linoleová – dietní suplement v prevenci kardiovaskulárních onemocnění? Čas Lék čes 2007; 146 : 459–465.
28. Harwood JL. Lipid Structure. In The Lipid Handbook. London: Chapman and Hall 1994; 21–46.
29. Havel RJ, Eder HA, Bragdon JH. The distribution and chemical composition of ultracentrifugally separated lipoproteins in human serum. J Clin Invest 1955; 34 : 1345–1353.
30. Zuijdgeest-van Leeuwen SD, van der Heijden MS, Veld TR, et al. Fatty acid composition of plasma lipids in patients with pancreatic, lung and oesophageal cancer in comparison with healthy subjects. Clin Nutr 2002; 21 : 225–230.
31. Tvrzická E, Vecka M, Staňková B, et al. Analysis of fatty acids in plasma lipoproteins by gas chromatography-flame ionization detection Quantitative aspects. Anal Chim Acta 2002; 465 : 337–350.
32. de Almeida IT, Cortez-Pinto H, Hidalgo G, et al. Plasma total and free fatty acids composition in human non-alcoholic steatohepatitis. Clin Nutr 2002; 21 : 219–223.
33. Nelson DL, Cox MM. Biological Membranes and Transport. In: Principles of Biochemistry. New York: W.H. Freeman and Comp. 2005; 369–420.
Štítky
Adiktológia Alergológia a imunológia Angiológia Audiológia a foniatria Biochémia Dermatológia Detská gastroenterológia Detská chirurgia Detská kardiológia Detská neurológia Detská otorinolaryngológia Detská psychiatria Detská reumatológia Diabetológia Farmácia Chirurgia cievna Algeziológia Dentální hygienistka
Článek Funkce dyneinu v buňceČlánek EditorialČlánek LAUREÁTI NOBELOVY CENYČlánek Hledání dlouhověkosti
Článok vyšiel v časopiseČasopis lékařů českých
Najčítanejšie tento týždeň
- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Kombinace metamizol/paracetamol v léčbě pooperační bolesti u zákroků v rámci jednodenní chirurgie
- Facilitovaná subkutánna imunoglobulínová terapia u seniorov s imunodeficienciami v reálnej praxi
- fSCIG v reálnej klinickej praxi u pacientov s hematologickými malignitami
-
Všetky články tohto čísla
- Klinická validita a užitečnost molekulárně genetických laboratorních zkoušek
- Stres v nukleárních proteinech
- Funkce dyneinu v buňce
- Mastné kyseliny 1. Výskyt a biologický význam
- Hledání dlouhověkosti
- Vznik savčích chlupů–folikulu
- Osteoporóza: koho, kdy a jak léčit?
- Editorial
- Oxid dusnatý u obezity a metabolického syndromu
- Káva, její legenda, historie a vliv na lidské zdraví
- Nespravedlnost, která zabíjí Zpráva o sociálních determinantách zdraví
- Historicko-medicínská výročí v roce 2009
- Začínáme diskuzi o postgraduálním vzdělávání Pište nám své názory!
- Profesor MUDr. Antonín Doležal DrSc., porodník a antropolog osmdesátiletý
- Poděkování vážené paní prof. MUDr. Jarmile Boguszakové, DrSc., za vedení časopisu Česká a slovenská oftalmologie
- MUDr. Ladislav Vyklický, Drsc. zemřel
- LAUREÁTI NOBELOVY CENY
- Časopis lékařů českých
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Mastné kyseliny 1. Výskyt a biologický význam
- Osteoporóza: koho, kdy a jak léčit?
- Profesor MUDr. Antonín Doležal DrSc., porodník a antropolog osmdesátiletý
- Káva, její legenda, historie a vliv na lidské zdraví
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



