-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Diferenciální diagnostika leukocytózy a leukopenie
Differential diagnosis of leukocytosis and leukopenia
The blood cell count is often examined in routine clinical praxis. Physiologic leucocyte count is in range 4–10 × 109 in liter of blood. Abnormal values of leukocytes and subtypes of leukocytes in differential count are often present. Changes in leukocytes counts are caused by variety of benignant or malignant conditions. It is important in clinical praxis to interpret changes in blood cell count correctly and choose adequate approach in investigation process. In general, leukocytosis and leukocytopenia may present in primary hematologic disorder or secondary/reactive states, caused by reaction of hematopoiesis to underlying condition. This article review common causes of leukocytosis or leucopenia and give basic advice how to investigate patients with changes in leukocytes count.
Keywords:
differential blood cell count – leukemia – leukocytosis – leukopenia
Autori: Tomáš Arpáš 1; Michael Doubek 1
Pôsobisko autorov: Interní hematologická a onkologická klinika, LF MU a FN Brno 1
Vyšlo v časopise: Vnitř Lék 2022; 68(E-7): 28-35
Kategória:
doi: https://doi.org/10.36290/vnl.2022.103Súhrn
Vyšetření krevního obrazu patří k nejčastěji vyšetřovaným laboratorním parametrům v klinické praxi lékaře. Fyziologické počty leukocytů jsou v rozmezí 4–10 × 109/l krve. U pacientů se často setkáváme se změnami absolutního počtu leukocytů a jednotlivých podtypů leukocytů v diferenciálním rozpočtu. Tyto změny můžou souviset s celou řadou závažných i benigních stavů a je potřeba je správně interpretovat a rozhodnout o dalším postupu. Příčiny leukocytózy a leukopenie lze jednoduše rozdělit na primárně hematologické onemocnění a příčiny sekundární (reaktivní), kdy změny hodnot leukocytů vznikají jako reakce hematopoézy a distribuce leukocytů v návaznosti na jiné onemocnění a stavy. Tento článek má za cíl stručně shrnout možné příčiny leukocytózy a leukopenie a též poskytnout stručné rady, jak při došetření těchto stavů postupovat.
Klíčová slova:
leukemie – leukopenie – diferenciální krevní obraz – leukocytóza
Úvod
Patologický počet leukocytů je v klinické praxi častým nálezem se širokým spektrem vyvolávajících příčin a často s potřebou komplexní diferenciální diagnostiky v rámci došetření. Důvody k vyšetření krevního obrazu jsou různé: preventivní prohlídky, vyšetření v akutním stavu nebo cílená kontrola krevního obrazu ze zjevného důvodu. Při zhodnocování patologických hodnot v krevním obraze je vždy potřeba myslet na klinický stav pacienta a důvod, proč byl odběr prováděn. Mimo laboratorní testy je vždy základem stanovení správného diagnostického postupu pečlivé klinické vyšetření pacienta a důkladná anamnéza. Přínosné často bývá zhodnocení laboratorní historie pacienta stran dynamiky změn krevního obrazu, v případě, že jsou starší výsledky dostupné.
Při patologických hodnotách leukocytů je potřeba provést jejich diferenciální rozpočet a zjistit, ve které linii leukocytů dochází k odchylce od normy. Vyšetření diferenciálního rozpočtu lze provést automatickým analyzátorem i v akutním režimu, limitací je neschopnost analyzátoru zhodnotit morfologické odchylky leukocytů a správně zařadit patologické buňky (např. blastické elementy může analyzátor řadit pod monocyty). V případě podezření na hematologické nebo hematoonkologické onemocnění (klinické symptomy, výrazné odchylky počtu krvinek) je indikováno morfologické vyšetření nátěru periferní krve mikroskopicky. Morfologické vyšetření je dále potřebné při hláškách automatického analyzátoru, zejména o přítomnosti blastů nebo atypických forem lymfocytů. Morfologické vyšetření může nalézt a blíže popsat případné patologické leukocyty (blasty, mladší formy, abnormální lymfocyty a jiné) v periferní krvi. Kromě počtu leukocytů vždy hodnotíme také ostatní parametry krevního obrazu: hemoglobin, hematokrit, objem erytrocytů, počet trombocytů, které nám poskytnou další informace o možné příčině leukocytózy nebo leukopenie a též vypovídají o akutnosti a závažnosti stavu pacienta (např. těžká anemie, trombocytopenie). Referenční meze parametrů krevního obrazu uvádí tabulka 1.
Tab. 1. Referenční meze krevního obrazu (20) 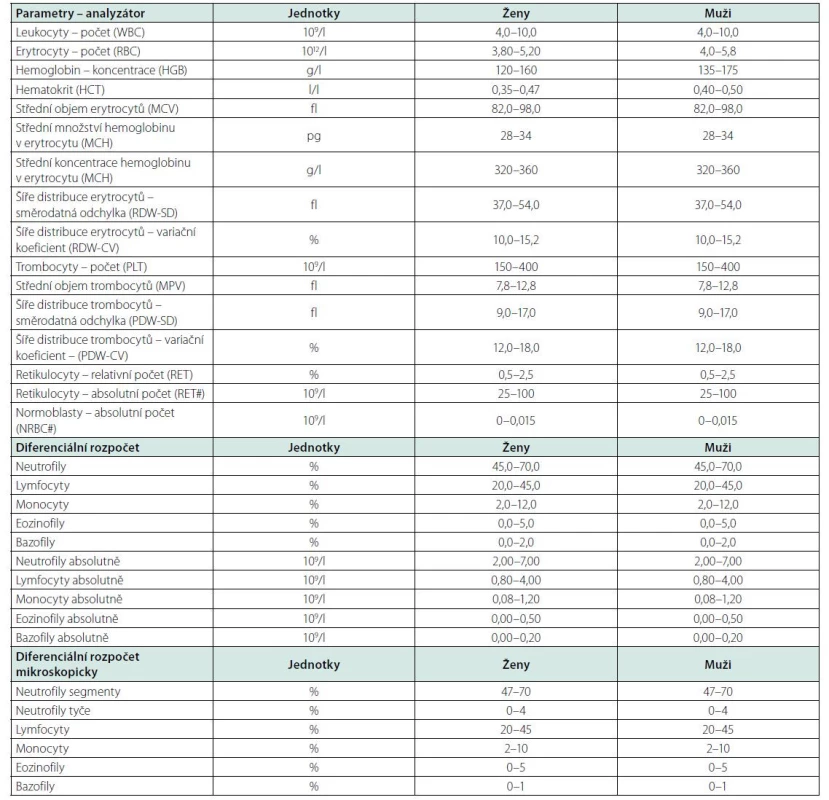
Pomocí vyšetření krevního obrazu s diferenciálním rozpočtem, důkladnou anamnézou a klinickým vyšetřením jsme většinou schopni snadno odlišit případné sekundární a reaktivní změny počtu leukocytů, nebo nabýt podezření na hematoonkologickou diagnózu.
Leukocytóza
Leukocytóza je častý laboratorní nález definovaný vzestupem počtu leukocytů nad referenční mez (10 × 109/l). Diferenciální diagnostika příčiny leukocytózy je široká a někdy i obtížná. Adekvátní zhodnocení anamnézy, klinického stavu pacienta a diferenciálního rozpočtu leukocytů je základem k správnému postupu. Pro došetření příčiny leukocytózy je důležité zjistit, který podtyp leukocytů je zmnožen a zdali jsou přítomny i patologické formy leukocytů jako blasty, nezralé formy, atypické lymfocyty. Typ zmnožených krvinek závisí na příčině leukocytózy (1, 2).
Přítomnost blastických elementů v periferní krvi vede k podezření na akutní leukemii. Typická bývá krátká anamnéza rozvoje potíží pacienta a rychlý vývoj změn v krevním obraze. Mimo průkaz různého počtu blastických elementů v krevním obraze typicky nalézáme cytopenie podmíněné náhradou zdravé krvetvorby. V diferenciálním rozpočtu bývá někdy zjevná absence mezistupňů vývoje granulocytů (promyelocytů, myelocytů a metamyelocytů) v kontrastu s přítomností blastů nazývána hiatus leukemicus. Potíže pacientů bývají často nespecifické, může být vyjádřen anemický syndrom, patologické krvácení, petechie a tvorba modřin při trombocytopenii, infekční komplikace při neutropenii nebo také známky orgánové infiltrace. V případě extrémní hyperleukocytózy obvykle nad 100 × 109/l podmíněné blastickými elementy bývá vyjádřen syndrom leukostázy s poruchou mikrocirkulace. Nová diagnóza akutní leukemie je závažným akutním stavem ohrožujícím pacienta na životě (krvácení, leukostáza, orgánové infiltrace a další). Pacienty s podezřením na akutní leukemii je nutno bez prodlevy referovat do hematoonkologického centra k dalšímu došetření a léčbě. Rozlišení podtypu akutní leukemie morfologickým, imunofenotypizačním a onkogenetickým vyšetřením se provádí v hematoonkologickém centru (3). Diagnóza akutní myeloidní leukemie (AML) je potvrzena při nálezu přes 20 % blastů myeloidního fenotypu v periferní krvi nebo kostní dřeni. Kritérium 20 % blastů nemusí být naplněno v případě cytogenetického průkazu translokace t(15;17), t(8;21), inv(16), t(16;16) nebo dalších cytogenetických a molekulárních změn definujících AML dle WHO klasifikace (13, 15). Klinicky specifickým podtypem akutní leukemie je promyelocytární leukemie (M3 dle francouzsko‑americko‑britské FAB klasifikace). Jedná se o nemoc s možnými urgentními komplikacemi. Vyzrálejší blastické elementy promyelocyty obsahují ve své cytoplazmě (patognomická) granula s prozánětlivými a prokoagulačními působky (tkáňový faktor, elastáza, proteolytické enzymy). V případě degranulace se rozvíjí akutní syndrom diseminované intravaskulární koagulopatie, pacienti jsou ohroženi trombózou i závažným krácením. V případě podezření na APL (nález susp. promyelocytů v krevním obraze nebo nález blastů s podezřelou koagulopatii) je potřeba pacienta urgentně referovat do hematologického centra na jednotku intenzivní péče. (3) Akutní lymfoblastová leukemie (ALL) mívá podobné příznaky jako AML. Častější bývají B symptomy a může být přítomna lymfadenopatie, orgánové infiltrace, např. splenomegalie, hepatomegalie, plicní infiltráty a zejména může být přítomna infiltrace CNS. Diagnóza se stanoví morfologickým a imunofenotypizačním vyšetřením blastů z periferní krve a kostní dřeni. V případě, že není dosaženo kritéria 25 % blastů ve dřeni, je nemoc nazývána lymfoblastový lymfom, nicméně jedná se o stejnou nozologickou jednotku.
Menší procento blastických elementů do 20 % v periferní krvi může být pozorováno v případě chronických myeloproliferativních nemocí (MPN), myelodysplastického syndromu (MDS) nebo překryvných diagnóz MDS/MPN. Z nemaligních příčin se blasty v periferní krvi objevit například u těžké infekce (leukemoidní reakce), reparaci kostní dřeně (např. po chemoterapii), nebo také iatrogenně po aplikaci granulocytárních růstových faktorů (G‑CSF) (1, 14).
Neutrofilie je v praxi nejčastější změnou počtu leukocytů, přičemž poznání příčiny nebývá většinou problémem. Za normálních okolností tvoří neutrofilní granulocyty 45–70 % leukocytů, za patologii je považován vzestup absolutního počtu nad hodnotu 7 × 109/l. Počet neutrofilů v periferní krvi je závislý na rovnováze tvorby v kostní dřeni, uložení v marginálním poolu a migraci do tkání. Funkcí neutrofilních granulocytů je zejména obrana organismu před infekcemi (zejména bakteriální a houbové) a reakce na poškození tkáně ve formě zánětů. Akcelerací tvorby granulocytů a jejich uvolněním z marginálních rezerv reaguje organismus na různé inzulty (infekce, poškození tkání, zánět, stres a jiné). V organismu je tvorba a migrace neutrofilů regulována cytokiny, růstovými faktory (G‑CSF a GM‑CSF) a adhezivními molekulami (2, 8).
Většina případů neutrofilie je reaktivní, v důsledku působení fyziologických mechanismů (prozánětlivé cytokiny, CSF) v návaznosti na vyvolávající situaci (např. infekce, trauma, zánět). Leukocytózu podmíněnou počtem neutrofilních granulocytů je potřeba hodnotit s ohledem na klinický stav pacienta a pátrat po sekundární příčině, pokud není zjevná. Nejčastější příčiny reaktivní neutrofilie jsou různé typy zánětu a stavy spojené s vyplavením prozánětlivých cytokinů, jako infekce, poškození tkání, nádory, nebo také autoimunitní procesy. Z dalších příčin je možná neutrofilie například po tkáňové ischemii, krvácení, při metabolických dekompenzacích (např. ketoacidóza), při kortikoterapii, po aplikaci G‑CSF u onkologicky léčených pacientů, po splenektomii a další (přehledně tabulka 2). Reaktivní elevace neutrofilních granulocytů jen zřídkakdy přesáhne hodnot přes 30 × 109/l a mívá přechodný ráz. Diferenciálně diagnostický přínos má i morfologické vyšetření leukocytů. U reaktivních příčin možno pozorovat v neutrofilech toxické azurofilné granulace a při vyšetření na alkalickou fosfatázu bývají reaktivní neutrofily silně pozitivní, na rozdíl od případů leukemie. Naopak u maligních příčin neutrofilie mohou být přítomny dysplastické změny granulocytů jako hypolobularizace jádra, abnormální shlukování chromatinu, hypogranulace cytoplazmy. Jako posun do leva označujeme zmnožení nezralých granulocytů (tyček, metamyelocytů, myelocytů), které bývá přítomno v případě intenzivního zánětu a infekce, ale typicky i u chronické myeloidní leukemie. Reaktivní leukocytóza extrémních hodnot s posunem doleva se nazývá také leukemoidní reakcí (1, 2, 8).
Tab. 2. Příčiny leukocytózy podmíněné neutrofilními granulocyty 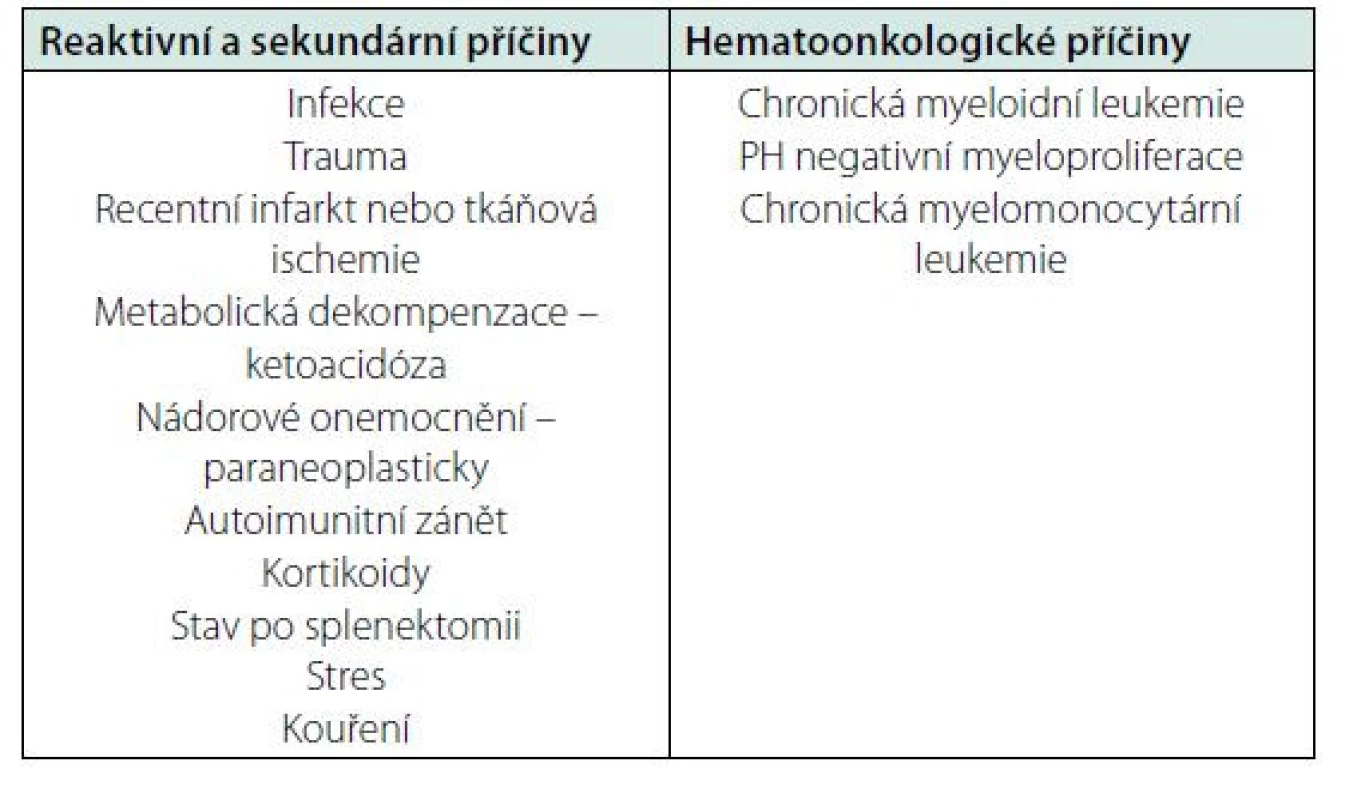
Na druhé straně, zvýšení počtu neutrofilních granulocytů může být také podmíněno myeloproliferativním onemocněním, kdy dochází k nezávislé a nadměrné proliferaci klonu myeloidní kmenové buňky. Tyto nemoci mají původ v alteraci genů (mutace nebo translokace) pro klíčové proteiny signálních drah spouštějících proliferaci klonu myeloidních buněk. V případě chronické myeloidní leukemie (CML) typicky nacházíme translokaci t(9;22) s utvořením Filadelfského chromozomu (PH) a vznikem fúzního genu BCR‑ABL. V případě ostatních myeloproliferativních nemocí zejména mutace Janusovy kinázy JAK2. Na myeloproliferativní onemocnění je třeba pomýšlet v případě extrémních hodnot granulocytů nad 30 × 109/l, chybění vysvětlující příčiny reaktivní elevace granulocytů nebo dlouhodobém přetrvávání patologických hodnot při kontrolách krevního obrazu. V krevním obrazu může být přítomno zmnožení bazofilních i eozinofilních granulocytů, typické pro CML. Polyglobulie anebo trombocytemie může nasměrovat diagnostiku směrem k PH negativním myeloproliferacím. Pozornost je potřeba věnovat příznakům typickým pro myeloproliferativní onemocnění, jako splenomegalie a hepatomegalie, konstituční symptomy (pocení, hubnutí, teploty nevyvolané infekcí) a trombotickým komplikacím doprovázejícím myeloproliferativní nemoci. Pacienti s klinicky atypickou trombózou (jak venózní, tak arteriální) a patologickou myeloidní leukocytózou, polyglobulií nebo trombocytemií, mají být hematologicky došetřeni pro podezření na myeloproliferativní onemocnění. Z myeloproliferativních nemocí (MPN) se neutrofilií může projevit typicky CML, ale i polycytemia vera, primární myelofibróza v prefibrotickém stadiu, chronická neutrofilní leukemie a chronická myelomonocytární leukemie (CMML). Diagnóza myeloproliferativní nemoci se potvrzuje vyšetřením kostní dřeně, cytogenetickým (např. t9;22) a molekulárně genetickým vyšetřením (BCR‑ABL, JAK2 a další). V případě extrémních hodnot leukocytů nad 100 × 109/l při CML hrozí i syndrom leukostázy v důsledku městnání leukocytů v mikrocirkulaci. Leukostáza se projeví nejčastěji měnlivou neurologickou symptomatologií, poruchami zraku a sluchu, respiračním a kardiálním selháváním, mohou se objevit ischemické komplikace s infarkty a u mužů také priapismus. Jedná se o hematologickou emergenci vyžadující terapeutický zásah ve formě leukaferézy a cytoredukční léčby (1, 2, 3, 8, 9, 11).
Hypereozinofilie je definována zvýšením počtu eozinofilních granulocytů nad 0,5 × 109/l, přičemž za klinicky významné se považují hodnoty nad 1,5 × 109/l. Těžká hypereozinofilie může vést k infiltraci a poškození tkání degranulací s uvolněním toxických substancí. Postižena bývá kůže, plíce, GIT, ale též srdce, specificky endokard s následnou fibrózou a možnou tvorbou kardiálních trombů. Je proto potřeba v diagnostice postupovat promptně. Příčina může být primární (klonální myeloproliferativní onemocnění), nebo častěji reaktivní/sekundární. V rámci hledání sekundární příčiny, známek myeloproliferace nebo lymfoproliferace a zhodnocení případného orgánového poškození je potřeba komplexní přístup zahrnující podrobnou anamnézu, klinické vyšetření, mikrobiologická, serologická, zobrazovací, hematologická a další vyšetření (2, 3, 5, 6).
V prvé řadě je potřeba pátrat po možné sekundární příčině. Nejčastější bývá sekundární eozinofilie při parazitárních infekcích, alergických reakcích, autoimunitních zánětech, plicních nemocech nebo také paraneoplasticky (např. u T lymfomů, Hodgkinova lymfomu, ale i solidních tumorů) (3, 5, 6).
Po vyloučení sekundárních příčin eozinofilie je potřeba se zaměřit na došetření možného klonálního hematologického onemocnění s eozinofilií. Je indikováno vyšetření kostní dřeně včetně onkogenetického vyšetření. WHO klasifikace specificky rozeznává kategorii myeloidních a lymfoidních malignit s eozinofilií a abnormalitami genů PDGFRA, PDGFRB a FGFR1. Chronická eozinofilní leukemie je definována eozinofilií a přítomností 2–20 % blastů v periferní krvi nebo 5–20 % v kostní dřeni, a/nebo eozinofilií s klonální cytogenetickou/molekulární abnormalitou nedefinující jiné onemocnění ve WHO klasifikaci. Dále může eozinofilie provázet myeloproliferativní nemoci, zejména CML, CMML a systémovou mastocytózu. Akutní myeloidní leukemie s fúzním genem CBFBMYH11 (cytogeneticky: inv(16)(p13.1q22) nebo t(16;16)(p13.1;q22)) může být také doprovázena hypereozinofilií (3, 5, 6).
V případě, že není prokázáno klonální hematologické onemocnění ani sekundární příčina hypereozinofilie a trvají počty eozinofilů přes 1,5 tis./μl po dobu víc než ½ roku, jedná se o idiopatickou hypereozinofilii. Jsou-li přítomny i známky orgánového poškození, nemoc je klasifikována jako hypereozinofilní syndrom (3, 5, 6) (Přehled příčin eozinofilie – tabulka 3).
Tab. 3. Příčiny hypereozinofilie 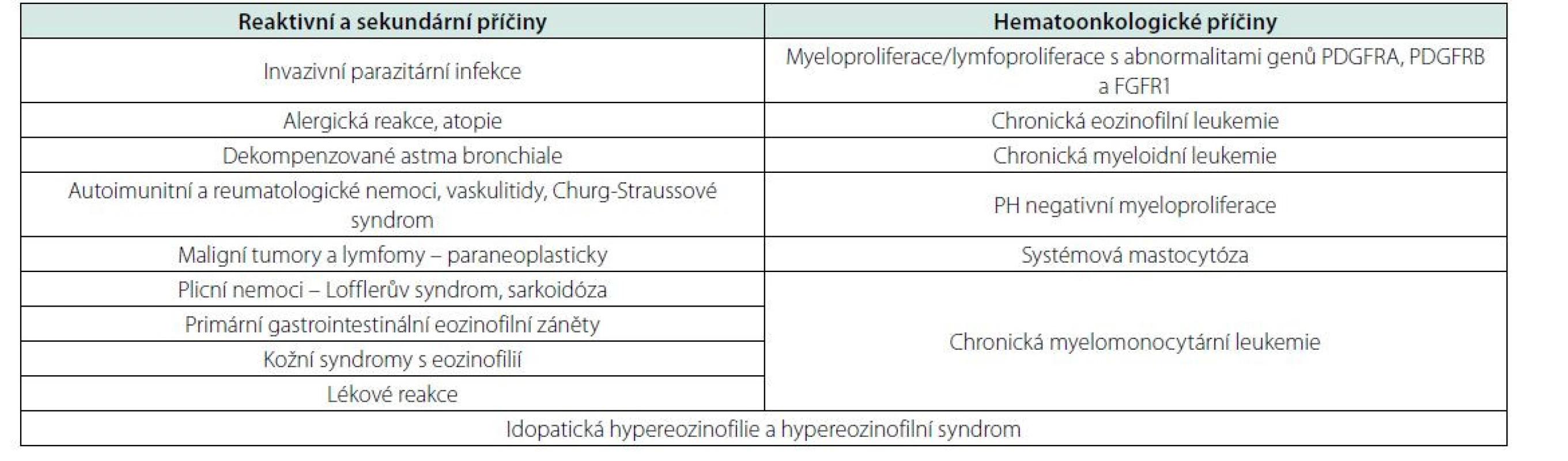
Bazofilie je v praxi raritní nález, zejména přítomna izolovaně. Reaktivní bazofilie je vzácná, příčinou může být například atopie, alergické reakce, některé chronické infekce. Reaktivní bazofilie bývá přechodná. V případě trvající bazofilie, extrémních hodnot nad 1 × 109/l a jiných známek myeloproliferace klinicky (hepatomegalie, splenomegalie, trombóza a jiné) nebo v krevním obraze (neutrofilie, posun doleva, polyglobulie, trombocytóza) je potřeba došetřit případné myeloproliferativní onemocnění, zejména CML (1, 4, 9, 11).
Monocytóza je definována počtem nad 1 × 109/l. Ve většině případů je reaktivního původu, bývá asociována s chronickými infekcemi, autoimunitními nemocemi, různými malignitami (karcinomy, lymfomy, myelom), po splenektomii, případně i v rámci lékových reakcí. Dále možno monocytózu pozorovat při obnově krvetvorby po chemoterapii nebo transplantaci krvetvorných buněk. V případě, že monocytóza je setrvalá a není zjevná vysvětlující příčina, v rámci došetření přichází v úvahu několik možných hematologických nemocí s monocytózou. Chronická myelomonocytární leukemie (CMML) je nemocí na pomezí myeloproliferace a myelodysplázie, typicky se vyskytující v starší populaci pacientů. V krevním obrazu je perzistentní monocytóza (nad 1 × 109/l, nad 10 %), přítomnost anemie a/nebo trombocytopenie, známky dysplazie v jedné nebo více řadách při vyšetření kostní dřeně a počet myeloidních blastů do 20 %. Pro diagnózu je potřeba vyloučit jiné myeloproliferativní nemoci, zejména CML (negativní vyšetření fúzního genu BCR‑ABL) (10). Z hematologických malignit může být dále přítomna monocytóza při některých podtypech akutní myeloidní leukemie, juvenilní myelomonocytární leukemii a někdy i v případě CML nebo PH negativních myeloproliferací. V praxi je potřeba monocytózu ověřovat mikroskopickým vyšetřením nátěrů krve. Při vyšetření automatickým přístrojem může docházet k zařazení blastických elementů pod monocyty, přičemž se může jednat o akutní leukemii (1, 7).
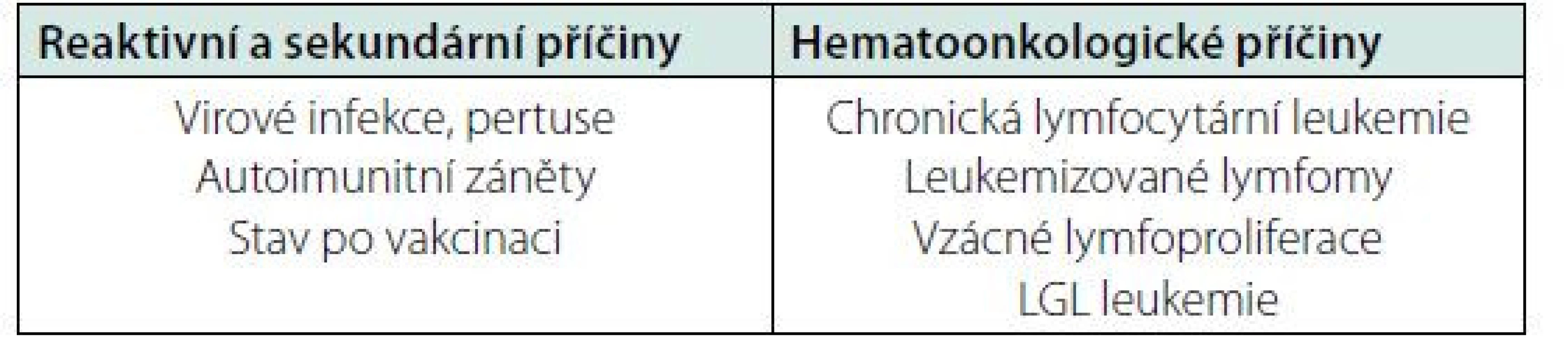
Lymfocytóza je definována počtem lymfocytů nad 4 × 109/l v dospělé populaci. V rámci došetření v anamnéze pátráme po možných příčinách reaktivní lymfocytózy, jako recentně prodělaná virová infekce, mononukleóza, pertuse, očkování, známé autoimunitní onemocnění a podobně. Reaktivní lymfocytóza jen málokdy přesáhne počtu 30 × 109/l a má přechodný charakter. Dále se soustředíme na případné známky lymfoproliferativního onemocnění jako B symptomy (horečka nezpůsobená infekcí, noční pocení, hubnutí), přítomnost lymfadenopatie, splenomegalie, v případě T ‑ lymfoproliferací kožní změny a infiltrace. Důležitou informaci pro diferenciální diagnostiku lymfocytózy nám poskytne morfologické vyšetření krevního obrazu. Lymfocytóza může mít monomorfní nebo polymorfní charakter. V případě monomorfní populace je podezření na lymfoproliferativní onemocnění, kdyžto reaktivní lymfocytóza má spíš polymorfní charakter. V případě monomorfní lymfocytózy dále v rámci morfologického vyšetření zkoumáme velikost a tvar lymfocytů, tvar jádra, přítomnost jadérka, granulace a zbarvení cytoplazmy. Klíčové v rámci diferenciální diagnostiky je vyšetření průtokovou flowcytometrií, která nám v případě maligní lymfoproliferace potvrdí klonální charakter populace lymfocytů a určí podtyp zmnožených lymfocytů. Pro chronickou lymfocytární leukemii a některé další lymfoproliferace je imunofenotypizace také diagnostická (1, 2).
Nejčastější leukémií dospělého věku je chronická lymfocytární leukemie (CLL). Typická je monomorfní lymfocytóza s malými lymfocyty s okrouhlým jádrem, ale mohou být přítomny i prolymfocyty (do 55 %). Počty lymfocytů pro stanovení diagnózy přesahují 5 × 109/l a často dosahují extrémních počtů přes 200 × 109/l. Buňky jsou však drobné a uzpůsobené cirkulaci (na rozdíl od blastů akutní leukemie), nebývají tedy známky leukostázy. Nemoc má chronický charakter a v počátečních stadiích většinou asymptomatický průběh, velká část pacientů je s CLL diagnostikována náhodným nálezem lymfocytózy při odběrech krevního obrazu z jiného důvodu. Mimo lymfocytózu mohou mít pacienti různě objemnou lymfadenopatii, splenomegalii a v pokročilých stadiích anemii a trombocytopenii. Přítomny někdy bývají i B symptomy a mohou se objevit i autoimunitní fenomény, zejména imunitní hemolytická anemie nebo imunitní trombocytopenie. Diagnóza se potvrdí flowcytometrickým vyšetřením s nálezem typického imunofenotypu s koexpresí znaků CD5, CD19, CD23. V případě, že dominuje lymfadenopatie bez lymfocytózy a diagnóza se prokáže histologickým vyšetřením, je nemoc označována jako lymfom z malých lymfocytů (SLL) (12).
Ostatní lymfoproliferace mívají většinou odlišný morfologický charakter lymfocytů a mají jiný imunofenotyp než CLL.
Z lymfomů se nejčastěji projevuje lymfocytózou mantle cell lymfom, buňky bývají větší než CLL a mívají členitější nebo naštípnuté jádro. Folikulární lymfom a jiné indolentní B lymfomy bývají leukemizované jen zřídka. Agresivní leukemizované lymfomy jako Burkittův lymfom nebo difuzní velkobuněčný B‑lymfom (DLBCL) mají charakter větších buněk až blastického vzhledu, klinické příznaky pacientů jsou závažné a rychle progredující (lymfadenopatie, B symptomy, orgánové infiltrace, CNS postižení) a pacienti vyžadují akutně došetření a léčbu. Patologickou lymfocytózu můžeme nacházet i u T‑lymfomů a Sézaryho syndromu. V případě nálezu buněk lymfomu v periferní krvi dle flowcytomatrie je v rámci došetření a stanovení přesné diagnózy lymfomu standardně potřeba pátrat po patologické lymfadenopatii, klinicky a pomocí zobrazovacích metod (ideálně vyšetření PET/CT), s následným histologickým vyšetřením lymfatické uzliny (je‑li přítomna patologická lymfadenopatie) a též provedením trepanobiopsie s histologickým vyšetřením kostní dřeně (3).
Ze vzácných lymfoproliferací se významnou lymfocytózou projevuje prolymfocytární leukemie (PLL), která může být B‑buněčná nebo T‑buněčná. B‑PLL je definována přítomností přes 55 % prolymfocytů v periferní krvi s odpovídajícím B‑buněčným imunofenotypem. Morfologicky jsou prolymfocyty asi 2× větší než lymfocyty, mají kulaté jádro se středně kondenzovaným chromatinem s přítomným jadérkem a neobjemnou cytoplazmou. U většiny případů nacházíme významné změny karyotypu s aberacemi zahrnujícími MYC onkogen a delece genu TP53. Nemoc má agresivní průběh a nepříznivou prognózu. T‑PLL je vzácná nemoc projevující se leukocytózou, postižením sleziny, uzlin a často kožní infiltrací. Diagnostika je založena na kombinaci klinických vyšetření, hodnocení krevních nátěrů, vyšetření imunofenotypu, cytogenetiky a molekulární biologie (3). V periferní krvi můžeme dále prokázat atypické lymfocyty s výběžky cytoplazmy u vlasatobuněčné leukemie nebo splenického lymfomu z B‑buněk marginální zóny (atypická/variantní vlasatobuněčná leukemie), většinou však nebývá absolutní zmnožení lymfocytů u těchto pacientů a typickými projevy jsou cytopenie, splenomegalie a infekční komplikace. Vlasatobuněčná leukemie je indolentní lymfoproliferací s příznivou prognózou, diagnostika je postavena na morfologickém vyšetření nátěru krve, typickém imunofenotypu a vyšetření mutace BRAF V600E. U variantní formy není přítomna mutace BRAF V600E, je mírně odlišný imunofenotyp a bývá častěji leukocytóza. Z dalších vzácných lymfoproliferací se mohou v periferní krvi nalézt například buňky leukemie z velkých granulárních lymfocytů (LGL) nebo buňky lymfoplazmocelulárního lymfomu (1, 3) (Přehled příčin lymfocytózy – tabulka 4).
Leukopenie
Leukopenie je definována poklesem celkového počtu leukocytů pod 4 × 109/l. V klinickém kontextu se pod leukopenií rozumí zejména neutropenie. Je tedy podstatné hodnocení absolutního počtu neutrofilních granulocytů v diferenciálním rozpočtu, jelikož normální nebo i zvýšený počet celkových leukocytů nevylučuje klinicky závažnou neutropenii. Za neutropenii označujeme hodnoty pod 2 × 109/l v kavkazské populaci (v africké populaci pod 1,5 × 109/l). Oportunními infekcemi jsou výrazně ohrožení pacienti při hodnotách pod 0,5 × 109/l. Lymfopenie je definována hodnotami pod 0,8 × 109/l a taktéž se jedná o stav klinicky významné imunokompromitace pro pacienta. Odchylky ostatních řad leukocytů většinou doprovázejí klinické stavy a nemoci s pancytopenií, izolovaný pokles absolutního počtu eozinofilů, bazofilů a monocytů nemá pro běžnou klinickou praxi podstatný význam.
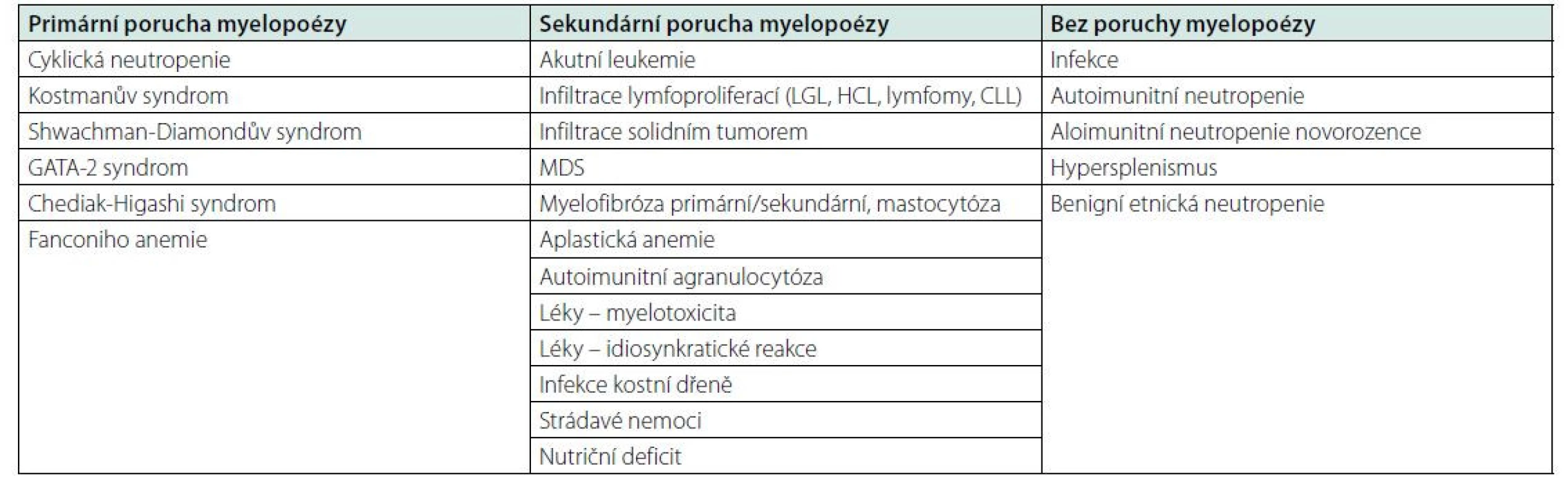
Neutropenie je v klinické praxi častým stavem, může se jednat o izolovanou patologii nebo přítomnou v kombinaci s dalšími cytopeniemi. Funkcí neutrofilních granulocytů je obrana organismu před infekcemi (zejména bakteriálními a houbovými) a reakce na poškození tkáně. Neutropeničtí pacienti jsou tedy ohroženi častějšími infekcemi se závažnějším průběhem a též oportunními infekcemi netypickými patogeny (např. systémové plísňové infekce, pneumonie vyvolané Pneumocytis Jirovecii a další). Počet neutrofilů v krvi je závislý na rovnováze tvorby, uložení v marginálním poolu a migraci do tkání. V cirkulující krvi je přítomno jen asi 5 % všech neutrofilních granulocytů, zbytek představují dozrávající granulocyty v kostní dřeni a marginální pool. V důsledku poruchy jednoho nebo kombinace těchto procesů dochází k neutropenii. Patofyziologicky lze příčiny neutropenie dělit na podmíněné sníženou kapacitu myelopoézy v kostní dřeni a příčiny s normální myelopoézou, přičemž snížená kapacita kostní dřeně může být způsobena primární (vrozenou) poruchou myelopoézy, nebo sekundárně, potlačením normální myelopoézy (např. infiltrace dřeně hematoonkologickou malignitou) (16).
Klinický obraz pacientů s neutropenií je závislý na příčině neutropenie a přítomnosti infekčních komplikací. Izolovaná neutropenie bez přítomnosti infekce je zpravidla asymptomatická. Ve vyšetření je důležitá anamnéza pacienta, zhodnocení aktuálních potíží, dotazy na četnost infekčních onemocnění, zhodnocení komorbidit, pečlivá léková anamnéza, dále přínosné bývá dohledání starších výsledků krevního obrazu k zhodnocení dynamiky. Z laboratorních vyšetření je klíčové samozřejmě vyšetření krevního obrazu s diferenciálním rozpočtem leukocytů a mikroskopické vyšetření nátěru krve. Hodnotíme závažnost neutropenie a přítomnost cytopenie v ostatních řadách. Přítomnost patologických buněk jako blastů či patologických lymfocytů může nasměrovat k diagnóze hematologické malignity, dysplastické rysy buněk k MDS, makrocytóza k deficitu vitaminu B12 nebo kyseliny listové. Flowcytometrická analýza periferní krve může odhalit patologický klon lymfocytů, nebo klon paroxyzmální noční hemoglobinurie. Přítomnost antileukocytárních protilátek podporuje autoimunitní původ neutropenie, nicméně je to poměrně nespecifické vyšetření, které nevylučuje jinou příčinu neutropenie. Pro došetření příčiny je téměř vždy potřeba vyšetření kostní dřeně. Základem je mikroskopické hodnocení nátěrů z aspirace kostní dřeně (myelogramu) s posouzením granulopoézy stran produkce, vyzrávání a přítomnosti dyplastických změn. Dále hodnotíme v myelogramu i změny v ostatních liniích a případné známky patologické infiltrace. Z aspirátu kostní dřeně se dále provádí flowcytometrické, cytogenetické a molekulárně genetické vyšetření dle indikace hematologa, v rámci došetření klonálních hematoonkologických nemocí. Často je v rámci diagnostiky zapotřebí také histologické vyšetření kostní dřeně provedením trepanobiopsie k posouzení struktury, celularity a poškození kostní dřeně u některých diagnóz, nebo například v případě nemožnosti aspirovat kostní dřeň (suchá punkce) (2, 8, 16).
Přehled příčin neutropenie
Neutropenie s primární (vrozenou) poruchou myelopoézy jsou skupinou vzácných vrozených nemocí, podmíněných mutací genů potřebných pro normální myelopoézu, které mimo neutropenii pacienta ohrožují vysokým rizikem vzniku hematologické malignity. Nemoci se projeví zpravidla v dětství nebo v časné dospělosti. Do této skupiny nemocí řadíme cyklickou neutropenii podmíněnou mutací genu ELANE kódujícího neutrofilní esterázu. Pacienti mívají v několika týdenních cyklech se opakující neutropenie vázané zejména na přítomnost infekce. Dále neutropenie s poruchou myelopoézy bývá součástí vrozených syndromů, například Kostmanův syndrom, Shwachman‑Diamondův syndrom, GATA-2 syndrom, Chediak‑Higashi syndrom, Fanconiho anemie. Diagnostika vrozené neutropenie je založena na rodinné anamnéze a rozsáhlém molekulárně genetickém vyšetření, používá se celoexomové sekvenování (WES) a masivní paralelní sekvenování (MPS) (16, 17).
Neutropenie se sekundární (získanou) poruchou myelopoézy. Ve většině případů je postižena hematopoéza ve vícerých vývojových liniích a pacienti se prezentují s pancytopenií. Z hematoonkologických příčin bývá neutropenie nebo pancytopenie přítomna při infiltraci dřeně akutní leukemií, lymfoproliferacemi (CLL, LGL, vlasatobuněčná leukemie, lymfomy, myelom), systémovou mastocytózou, nebo u myelofibrózy (3). Agresivní nehematologické malignity jako nediferencované karcinomy nebo melanom mohou někdy infiltrovat kostní dřeň s následnou pancytopenií. V diagnostice maligní infiltrace má klíčové postavení vyšetření nátěrů a histologie kostní dřeně. Myelodysplastický syndrom (MDS) je častou příčinou neutropenie hlavně u starších pacientů a pacientů s anamnézou předchozí onkologické léčby chemoterapií. Diagnóza MDS je stanovena na základě cytopenie v periferní krvi a přítomnosti dysplastických změn při vyšetření kostní dřeně, diagnózu podpoří nebo upřesní průkaz klonálních cytogenetických abnormalit nebo mutací. (3, 19) Získaná aplastická anemie je podmíněna imunitní destrukcí krvetvorby s těžkou pancytopenií, diagnóza se stanovuje per exclusionem vyloučením ostatních příčin pancytopenie, náročné je zejména odlišení od hypoplastické formy MDS (18).
V klinické praxi bývá častá zejména iatrogenní neutropenie, v důsledku myelotoxicity léků, zejména cytostatik, některých cílených onkologických léků a cytostaticky působících imunosupresiv (např. methotrexát, mykofenolát). Přímou myelotoxicitu pozorujeme i u jiných léků, například některých antivirotik (zidovudin, ganciclovir). Dávkově závislé idiosynkratické reakce projevující se neutropenií nebo aplázií ve vícerých krevních řadách byly pozorovány například po chloramfenikolu, solích zlata, thyreostatikách, nesteroidních antiflogistikách (indometacinu, acetaminofenu), tricyklických antidepresivech, phenothiazinech (2). Dalším možným mechanismem lékové toxicity způsobující neutropenii jsou imunoalergické, dávkově nezávislé reakce. Ty mohou být vyvolány teoreticky jakýmkoliv léčivem, popsané jsou například po sulfonamidech, betalaktamech, ticlopinech. Přerušení užívání léku vede k normalizaci počtu leukocytů (2). V rámci diagnostiky polékové neutropenie je potřeba prokázat jednoznačnou časovou souvislost s užíváním léku a vyloučit jinou příčinu neutropenie.
Z nemaligních příčin může být kostní dřeň postižena také u některých infekcí (parvovirus B19, leishmanióza a jiné) nebo i střádavých nemocí (Gaucherova nemoc). Nutriční deficit, zejména těžká megaloblastická anemie při deficitu vitaminu B12, se projeví pancytopenií včetně neutropenie, s typickým nálezem makrocytózy.
Neutropenie bez poruchy myelopoézy je podmíněna zvýšenou spotřebou neutrofilních granulocytů. Typickou příčinou jsou těžké infekce se septickým průběhem, kdy excesivní přesun neutrofilů do zanícených tkání nestíhá kompenzovat myelopoéza. Autoimunitní neutropenie bývá pozorována v případě systémových onemocnění pojiva (systémový lupus), vaskulitid nebo u reumatoidní artritidy (Feltyho syndom), bývají přítomny antileukocytární protilátky. Neutropenie s přítomností antileukocytárních protilátek se přechodně může objevit i v návaznosti na prodělanou virovou nebo bakteriální infekci. Neutropenie může být způsobena také splenomegalií s hypersplenismem (2, 8). Benigní etnická neutropenie je klinicky asymptomatické snížení počtu neutrofilů u příslušníků některých etnik v Africe, Arabů, Židů a dalších, bez potřeby léčebné intervence (17).
Lymfopenie
Lymfopenie je definována hodnotami pod 0,8 × 109/l, podmíněna může být jak primárním vrozeným imunodeficitem, tak získanými příčinami. Lymfopenie vede k poruchám adaptivní imunity v buněčné i humorální složce. Pacienti jsou ohroženi širokým spektrem oportunních infekcí (například herpetickými viry) a těžkým průběhem běžných infekcí. Získané příčiny lymfopenie jsou nejčastěji iatrogenní, typicky léčba imunosupresivy, kortikoidy, onkologická léčba zejména lymfoproliferací (chemoterapie, anti CD protilátky, inhibitory B buněčné signalizace a další). Lymfopenii možno pozorovat i v případě některých akutních infekcí, například při těžkém průběhu infekce způsobné koronavirem SARS‑CoV - 19. Další příčinou může být infekce virem HIV. V přístupu k pacientovi je potřeba prvně zhodnotit případnou zjevnou příčinu jako imunosupresiva, kortikoidy, chemoterapie nebo akutní infekce. V případě dlouhodobého trvání lymfopenie dopátrat anamnézu stran rizikového chování s ohledem na HIV infekci, provést testování na HIV. V případě podezření na primární (vrozený) imunodeficit doplnit flowcytometrii s imunofenotypizací lymfocytů a vyšetření imunologem (8).
Závěr
Diferenciální diagnostika leukocytózy a leukopenie je častým úkolem lékařů napříč všemi specializacemi. Adekvátní zhodnocení stavu a rozhodnutí o dalším postupu je klíčové, s ohledem na možná závažná onemocnění skrytá za laboratorní hodnotou počtu leukocytů.
KORESPONDENČNÍ ADRESA AUTORA:
MUDr. Tomáš Arpáš
Interní hematologická a onkologická klinika, LF MU a FN Brno
Jihlavská 340/20, 625 00 Brno
Cit. zkr: Vnitř Lék. 2022;68(7):E28-E35
Článek přijat redakcí: 27. 6. 2022
Článek přijat po recenzích: 30. 9. 2022
Zdroje
1. Chabot‑Richrds DS, George TI. Leukocytosis. Int J Lab Hem. 2014;36,279-288.
2. Hillman RS et al. Heamatolgy in clinical practice, 5. edition, McGraw‑Hill: 2010. ISBN 978-0-07-176653-1
3. Doubek M, Mayer J et al. Léčebné postupy v hematologii 2020. Doporučení ČHS ČLS JEP. ČLS JEP: 2020. ISBN 978-80-270-8240-7
4. Feriel J, Depasse F et al. How I investigate basophilia in daily practice. Int J Lab Hematol. 2020;42 : 237-245.
5. Larsen R.L., Savage N.M. How I investigate Eosinophilia. Int J Lab Hem. 2019;41 : 153-161.
6. Novotný J. Hypereozinofilie. Transfuze a hematologie dnes 2021; 27(4):278-282.
7. Lynch DT et al. How I investigate monocytosis. Int J Lab Hem. 2018;40 : 107-114.
8. Stiene‑Martin A. Nonmalignant Leukocyte Disorders. In: Rodak BF et al. Hematology: Clinical Principles and Aplications (4th edn.). St. Louise. Elsevier: 2012. 408-426. ISBN 978-1-4377-0692-5
9. Guglielmelli P, Vannucchi AM. Current management strategies for polycytemie vera and essential thrombocythemia, Blood Reviews 2020; (42) 100714. ISSN 0268-960X. https:// doi.org/10.1016/j.blre.2020.100714.
10. Patnaik, MM, Tefferi, A. Chronic Myelomonocytic leukemia: 2020 update on diagnosis, risk stratification and management. Am J Hematol. 2020;95 : 97-115.
11. Jabbour E, Kantarjian H. Chronic myeloid leukemia: 2020 update on diagnosis, therapy and monitoring. Am J Hematol. 2020; 95(6):691-709.
12. Smolej L,Špaček M, Pospíšilová Š et al. Doporučení pro diagnostiku a léčbu chronické lymfocytární leukemie 2021. Transfuze a kematologie dnes 2021;27(1):91-106.
13. Döhner H, Estey E et al. Diagnosis and management of AML in adults: 2017 ELN recommendations from an international expert panel. Blood 2017;129(4):424–447.
14. Terwilliger T, Abdul‑Hay M. Acute lymphoblastic leukemia: a comprehensive review and 2017 update. Blood Cancer Journal 2017; (7), e577; doi:10.1038/bcj.2017.53
15. Narayanan D., Weinberg O.K. How I investigate acute myeloid leukemia, Int J Lab Hematol. 2020;42 : 3-15.
16. Frater JL. How I investigate neutropenie, Int J Lab hematol. 2020;42(Suppl. 1):121-132.
17. Staňo Kozubík K,Vrzalová Z et al. Kongenitální neutropenie u dětí a dospělých, Transfuze a hematologie dnes 2021;27(4):297-303.
18. Bacigalupo A. How I treat acquired aplastic anemia. Blood. 2017;129(11):1428-1436.
19. Garcia‑Manero G, Chien KS, Montalban‑Bravo G. Myelodysplastic syndromes: 2021 update on diagnosis, risk stratification and management. Am J Hematol. 2020;95 : 1399-1420.
20. Doporučení ČHS ČLS JEP, Referenční meze krevního obrazu, retikulocytů, normoblastů a diferenciálního počtu leukocytů dospělých, verze: 2., revize: 2., platnost od: 18. 6. 2021
Štítky
Diabetológia Endokrinológia Interné lekárstvo
Článok vyšiel v časopiseVnitřní lékařství
Najčítanejšie tento týždeň
2022 Číslo E-7- Parazitičtí červi v terapii Crohnovy choroby a dalších zánětlivých autoimunitních onemocnění
- Rizikové období v léčbě růstovým hormonem: přechod mladých pacientů k lékařům pro dospělé
- Intermitentní hladovění v prevenci a léčbě chorob
- Statinová intolerance
- Monoklonální protilátky v léčbě hyperlipidemií
-
Všetky články tohto čísla
- Podiatrická péče z pohledu ambulantních specialistů – diabetologů
- Zápalové markery v klinickej praxi
- Pegvisomant v liečbe akromegálie
- Primární synoviální sarkom srdce klinicky napodobující SARS‑CoV- 2 asociovanou perikarditidu
- Diferenciální diagnostika leukocytózy a leukopenie
- Telemedicine, Innovative Technologies and Digital Health Working Group
- Vnitřní lékařství
- Archív čísel
- Aktuálne číslo
- Iba online
- Informácie o časopise
Najčítanejšie v tomto čísle- Diferenciální diagnostika leukocytózy a leukopenie
- Zápalové markery v klinickej praxi
- Pegvisomant v liečbe akromegálie
- Podiatrická péče z pohledu ambulantních specialistů – diabetologů
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy