-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Aortálna stenóza a dysfunkcia pravej komory
Aortic stenosis and right ventricular dysfunction
Cardiac damage in severe aortic stenosis (AS) is not limited to the aortic valve and left ventricle, but is a systemic disease characterized by a significant alteration in cardiac structure and function. Therefore, a new classification of AS based on the degree of myocardial damage was proposed. A significant number of patients with AS have right ventricular dysfunction likely due to ventricular interdependence. Relationship between right ventricular dysfunction and increased mortality in both symptomatic and asymptomatic patients with severe AS was demonstrated. These patients could benefit more from intervention. Therefore, a standardized echocardiographic examination of a patients with severe aortic stenosis should provide a detailed analysis of right ventricular function.
Keywords:
aortic stenosis – right ventricular dysfunction – TAVI
Autori: Pavol Fülöp 1,2; Marianna Dvorožňáková 3; Gabriel Valočik 2
Pôsobisko autorov: Interná klinika, Nemocnica AGEL Košice-Šaca a. s. 1; I. kardiologická klinika, VÚSCH, a. s., Košice 2; II. kardiologická klinika, VÚSCH, a. s., Košice 3
Vyšlo v časopise: Vnitř Lék 2021; 67(E-4): 13-16
Kategória:
Súhrn
Kardiálne poškodenie pri závažnej aortálnej stenóze (AS) nie je limitované na aortálnu chlopňu a ľavú komoru, ale ide o systémové ochorenie charakterizované významnou alteráciou štruktúry a funkcie srdca. Preto bola navrhnutá nová klasifikácia štádií AS na základe stupňa postihnutia myokardu. Významné množstvo pacientov s AS má dysfunkciu pravej komory, čo je pravdepodobne spôsobené komorovou interdependenciou. Preukázal sa vzťah medzi dysfunkciou pravej komory a zvýšenou mortalitou u symptomatických aj asymptomatických pacientov so závažnou AS. Títo pacienti by mohli viac profitovať z intervenčného výkonu. Štandardizované echokardiografické vyšetrenie pacientov so závažnou aortálnou stenózou by teda malo zahŕňať detailnú analýzu funkcie pravej komory.
Klíčová slova:
aortálna stenóza – dysfunkcia pravej komory – TAVI
Úvod
Aortálna stenóza (AS) je najčastejšia chlopňová chyba vo vyspelých krajinách, postihuje okolo 5 % starších ako 65 rokov a prevalencia narastá s vyšším vekom (1). Náhrada aortálnej chlopne (AVR), chirurgická (SAVR) alebo transkatétrová (TAVI), je jediná liečba zlepšujúca prežívanie. V súčasnosti je manažment pacientov s AS podľa odporúčaní kardiologických spoločností založený na posúdení 1) závažnosti AS (vrcholová rýchlosť (Vmax), stredný transvalvulárny gradient (PGmean), plocha ústia aortálnej chlopne (AVA), ejekčná frakcia ľavej komory (LVEF)) a 2) výskytu symptómov (angina pectoris, dýchavica a synkopa) (2).
Zabudnutá komora
Význam pravej komory (PK) bol desaťročia bagatelizovaný s prívlastkom zabudnutá komora. V roku 1943 Star et al. (3) po ťažkom poškodení voľnej steny pravej komory s rozpálenou spájkovačkou zaznamenali iba minimálny vzostup periférneho venózneho tlaku. Tento a podobné experimenty viedli k záveru, že funkčná, kontrahujúca sa stena pravej komory nie je nutná pre zachovanie normálnej cirkulácie. Zavŕšením bolo kompletné vylúčenie pravej komory z obehu (Fontanova cirkulácia) . Avšak vo svetle nových údajov sa potvrdzuje dôležitosť funkcie PK. Preukázal sa vzťah medzi dysfunkciou pravej komory a zvýšenou mortalitou a morbiditou, vrátane predĺženia hospitalizácií, pri mnohých chorobných stavoch (srdcové zlyhávanie, infarkt myokardu, pľúcna hypertenzia, vrodené srdcové chyby) či intervenčných výkonoch (4).
Pravá komora a aortálna stenóza
Kardiálne poškodenie pri aortálnej stenóze nie je limitované na aortálnu chlopňu a ľavú komoru (ĽK), ako to vnímajú súčasné odporúčania, ale ide o systémové ochorenie charakterizované závažnou alteráciou štruktúry a funkcie srdca (5). Générux et al. (5) navrhli novú klasifikáciu štádií AS na základe postihnutia myokardu mimo aortálnej chlopne. Táto klasifikácia vyčleňuje 4 štádiá: bez známok srdcového poškodenia mimo AS (0. štádium), poškodenie ľavej komory (1. štádium), postihnutie mitrálnej chlopňe a/alebo ľavej predsiene (2. štádium), postihnutie pľúcnej cirkulácie a/alebo stredne závažná až závažná trikuspidálna regurgitácia (3. štádium), dysfunkcia pravej komory (4. štádium). Každé zo štádií predstavuje postupný a signifikantný nárast krátkodobej mortality pred aj po náhrade aortálnej chlopne (Graf 1.). Systém navyše preukázal signifikantnú prídatnú hodnotu pri predikcii 1-ročného prežitia voči dobre známym prediktorom zlého výsledku AVR, vrátane STS (Society of thoracic surgeons) skóre.
Graf 1. Výsledky jednoročného sledovania pacientov po náhrade aortálnej chlopne zaradených podľa kardiálneho poškodenia do 4 štádií (upravené podľa (5)) 
Prognostická hodnota modelu bola preukázaná u symptomatických (6) aj asymptomatických pacientov (7). Recentné štúdie realizované Eleidom et al. (8) a Schewelom et al. (9) poskytujú ďalšie silné dôkazy podporujúce model klasifikácie nad rámec postihnutia ľavej komory u pacientov s AS.
Dysfunkcia pravej komory
Zdá sa, že prirodzený vývoj poškodenia myokardu pri AS nenapreduje systematicky (5). V skutočnosti medzi pacientmi v 3. a 4. štádiu častokrát nebolo pozorované kumulatívne poškodenie z predošlých fáz. A teda poškodenie myokardu pri tlakovom preťažení nemusí byť sekvenčné (ľavá komora —> ľavá predsieň —> pľúcna cirkulácia —> dysfunkcia pravej komory), ale závisí od pacientovej vulnerability a genetickej predispozície (10).
Chronicky zvýšený afterload pri AS spôsobuje hypertrofiu a fibrózu ĽK, čo vedie k deteriorácii longitudinálnej funkcie a následne poklesu LVEF (11). Pravá a ľavá komora sú úzko prepojené cez interventrikulárne septum, deliac si spoločné vlákna obkružujúce obe komory, ktoré sú obmedzené perikardiálnym priestorom, čo vysvetľuje funkčnú interdepedenciu medzi oboma komorami. Podľa Galli et al. (12) LVEF, globálny longitudinálny strain ĽK (LV-GLS) a PGmean dobre korelovali s TAPSE (Tricuspid annular plane systolic excursion) (≤ 17 mm), zatiaľ čo korelácia medzi TAPSE a systolickým tlakom v pľúcnej artérii (sPAP) bola slabá až žiadna. Tieto výsledky nasvedčujú tomu, že vzájomné vzťahy s Ľ K (komorová interdependencia) môžu mať hlavnú rolu v patofyziológii dysfunkcie PK u AS. Pozitívny efekt kontraktility ĽK na funkciu PK je zjavný aj z vyššej prevalencie dysfunkcie PK u pacientov s low-flow/ low-gradient AS (12).
Molekulárny mechanizmus účinku rastových signálov ako angiotenzín II a katecholamínov produkovaných hypertrofovanou ĽK môže parakrinným účinkom prispievať k remodelácii a funkčnej deteriorácii PK u AS (11). Túto hypotézu podporuje zistenie prepojenia medzi zvýšeným afterloadom ĽK u esenciálnej hypertenzie so zhrubnutím voľnej steny PK, koncentrickou remodeláciou pozorovanou srdcovou magnetickou rezonanciou a s poruchou longitudinálnej funkcie PK (13, 14).
AVR u pacientov s dysfunkciou pravej komory
Prognostická výhoda náhrady aortálnej chlopne oproti konzervatívnemu postupu u pacientov so závažnou pľúcnou hypertenziou je už dlho známa (15). Nezodpovedanou otázkou však ostáva, ktorá modalita výmeny chlopne je pre pacientov s pravostranným postihnutím prospešnejšia.
Pacienti s redukovanou LVEF bez kontraktilnej rezervy počas dobutamínovej echokardiograie sa po TAVI klinicky nezlepšili. Výskumné skupiny dospeli k záveru, že tento echokardiografický nález naznačuje ireverzibilnú remodeláciu ĽK, ktorá nezávisle predpovedá horšie výsledky po AVR (16). Galli et al. (12) popísali pri samotnej dysfunkcii pravej komory (TAPSE ≤ 17 mm) nárast kardiovaskulárnej (KVS) mortality, zatiaľ čo v kombinácii s redukovanou funkciou ĽK (LVEF ≤ 50 %) išlo o najsilnejší prediktor KVS mortality nezávisle od metódy náhrady chlopne (HR 4,08, 95 %, CI 1,36–12.22; P = 0,012). A teda porucha funkcie PK spolu s redukovanou funkciou ĽK môže viesť k limitovanému klinickému výsledku po AVR (17).
TAVI
Prognostické dôsledky funkcie PK a pľúcnej cirkulácie boli v minulosti často podceňované. Veľká časť pacientov podstupujúcich TAVI má pľúcnu hypertenziu a/alebo dysfunkciu pravej komory, čím sa stávajú rizikovejšími pre nepriaznivý výsledok (8, 9).
Úspešnosť TAVI je definovaná hlavne dosiahnutím špecifických implantačných cieľov, o ktorých sa zistilo, že sú spojené so zníženou mierou krátkodobej a strednodobej úmrtnosti (18). Faktory predpovedajúce zlepšenie funkčných schopností po TAVI sú však málo známe. Podľa Schuelera et al. (17) bola funkcia PK najspoľahlivejším prediktorom funkčného zlepšenia po TAVI. Non-responderi mali nižší vstupný GLS PK v porovnaní s respondermi (cut-off hodnota GLS PK: −9,11 %, AUC 0,74, senzitivita 62,2 %; špecificita 89,5 %). Preexistujúca dysfunkcia pravej komory definovná pomocou TAPSE resp. RIMP (TAPSE: HR = 0,95, CI 95 % 0,92–0,98, P = 0,004; RIMP (RV index of myocardial performance): HR = 10,84, CI 95 % 2,71–43,42, P = 0,0008) a konkomitantná stredná až závažná trikuspidálna regurgitácia (TR) (HR = 1,79, CI 95 % 1,52–2,11, P < 0,00001) boli prediktorom nepriaznivých výsledkov po TAVI v metaanalýze Fan et al. (19).
TAVI vs. SAVR
Analýza randomizovanej štúdie PARTNER IIA (Placement of AoRTic TraNscathetER Valves IIA) zistila štvornásobne častejšie zhoršenie funkcie pravej komory a dvojnásobný nárast mortality v SAVR ramene oproti TAVI (20). Faktory prispievajúce k zhoršeniu funkcie PK boli prítomnosť ≥ stredne závažnej TR a/ alebo dilatácie PK pred výkonom.
Kempny et al. (21) zdôraznili negatívny impakt kardiochirurgie na funkciu PK v 2 hlavných bodoch, po prvé – perikadiotómia vedie k narušeniu prívodu krvi k myokardu PK a negatívne ovplyvňuje end diastolický tlak. Po druhé systémová zápalová odpoveď vypustením pro-zápalových cytokínov v spojení s kardiopulmonálnym bypassom, ktorý produkuje nefyziologický tok krvi a teda vedie k zhoršeniu diastolickej funkcie PK, priamo poškodzuje PK. Avšak intraoperatívna štúdia odhalila zhoršenie funkcie PK takmer ihneď po perikardiotómii, a teda strata perikardiálnej podpory s následným vzostupom transmurálneho tlaku s vyšším napätím steny môže byť predominantný mechanizmus poškodenia PK (22).
TAVI naopak predstavuje menej invazívny prístup, pri ktorom by nemalo dôjsť k poškodeniu PK. Kempny et al. (21) sledovali 101 pacientov podstupujúcich TAVI a 22 SAVR, čím zistili deterioráciu funkcie PK iba u SAVR podskupiny. Eleid et al. (8) vo svojej štúdii zistili priamo úmerné zlepšenie funkcie PK po TAVI s nárastom AVA. Po výkone sa práca PK a systolické rýchlosti trikuspidálnej chlopne zvýšili, zatiaľ čo pľúcna vaskulárna rezistencia poklesla. Zlepšenie funkcie PK počas 6 mesačného follow-up bolo prezentované Roznbaumom et al. (23) u 147 pacientov s preexistujúcou závažnou TR iba po TAVI, nie po SAVR. Schueler et al. (17) rovnako publikoval zlepšenie funkcie PK po TAVI a nie po SAVR. Navyše opísal prepojenie medzi funkciou PK a klinickou odpoveďou na TAVI či SAVR. Pacienti s horšou funkciou PK pred výkonom a tí bez zlepšenia funkčných parametrov PK po výkone neprejavili klinické zlepšenie v rámci NYHA (New York Heart Association) triedy. Zhoršenie funkcie PK nebolo zistené ani pri transapikálnej implantácii chlopne. Limitovaná perikardiotómia potrebná pre transapikálny prístup počas TAVI nemá negatívny impakt na funkciu PK (21).
Časovanie
Nedávno publikované výsledky odhalili u asymptomatických pacientov v 3. resp. 4. štádiu 4,5 násobný nárast mortality na - priek optimálnemu sledovaniu v špecializovaných kardiocentrách a prísnej adherencii k odporúčaniam ohľadom výmeny aortálnej chlopne (8, 9). Tieto zistenia ponúkajú argumenty pre skoršiu intervenciu u asymptomatických pacientov so závažnou AS, a teda predchádzaniu rozsiahleho srdcového poškodenia. EARLY TAVR (24) (Evaluation of Transcatheter Aortic Valve Replacement Compared to SurveiLlance for Patients With AsYmptomatic Severe Aortic Stenosis) a EVoLVeD (25) (Early Valve Replacement Guided by Biomarkers of LV Decompensation in Asymptomatic Patients with Severe AS) štúdie skúmajú načasovanie intervencie u asymptomatických pacientov so závažnou AS. Avšak aj pri priaznivých výsledkoch týchto štúdií je pravdepodobné, že nie všetci pacienti budú profitovať zo skorej intervencie. Existuje preto potreba vyvinutia individuálnej stratégie, ktorá umožní kardiológom najlepšie načasovať AVR pre daného pacienta.
Významné množstvo pacientov (až do 20 % u asymptomatických závažných AS a do 50 % symptomatických závažných AS) má rozsiahle poškodenie myokardu (≥ 3. štádium) (26). Títo pacienti majú vyššiu mieru mortality po AVR. Preto u asymptomatických pacientov so závažnou AS by pravostranné postihnutie malo urýchliť zváženie včasnej AVR. Ideálne by mala intervencia nastať pred vznikom pľúcnej hypertenzie, signifikantnej TR, a alebo dilatácie/dysfunkcie pravej komory, a teda už pri dosiahnutí 2. štádia poškodenia myokardu, ako navrhol Tastet et al. (7).
Symptomatickí pacienti so závažnou AS a pravostranným postihnutím (≥ 3. štádium) by mohli viac profitovať z intervenčného výkonu (26). Pravostranné abnormality však nemusia byt zapríčinené iba AS, ale môžu byť dôsledkom pľúcnej hypertenzie či ischemickej choroby srdca. Napriek tomu pacienti v ≥ 3. štádiu sú náchylnejší k tlakovému preťaženiu zapríčinému AS a skoršia a/alebo menej invazívna metóda intervencie môže byť prínosná nezávisle od pôvodu pravostranného srdcového poškodenia (Obr. 1).
Obr. 1. Štádiá AS na základe postihnutia myokardu a možné implikácie pre terapeutický postup; zelená – súčasné odporúčania, modrá – navrhovaný postup v svetle nových výsledkov štúdií (upravedené podľa (26)) 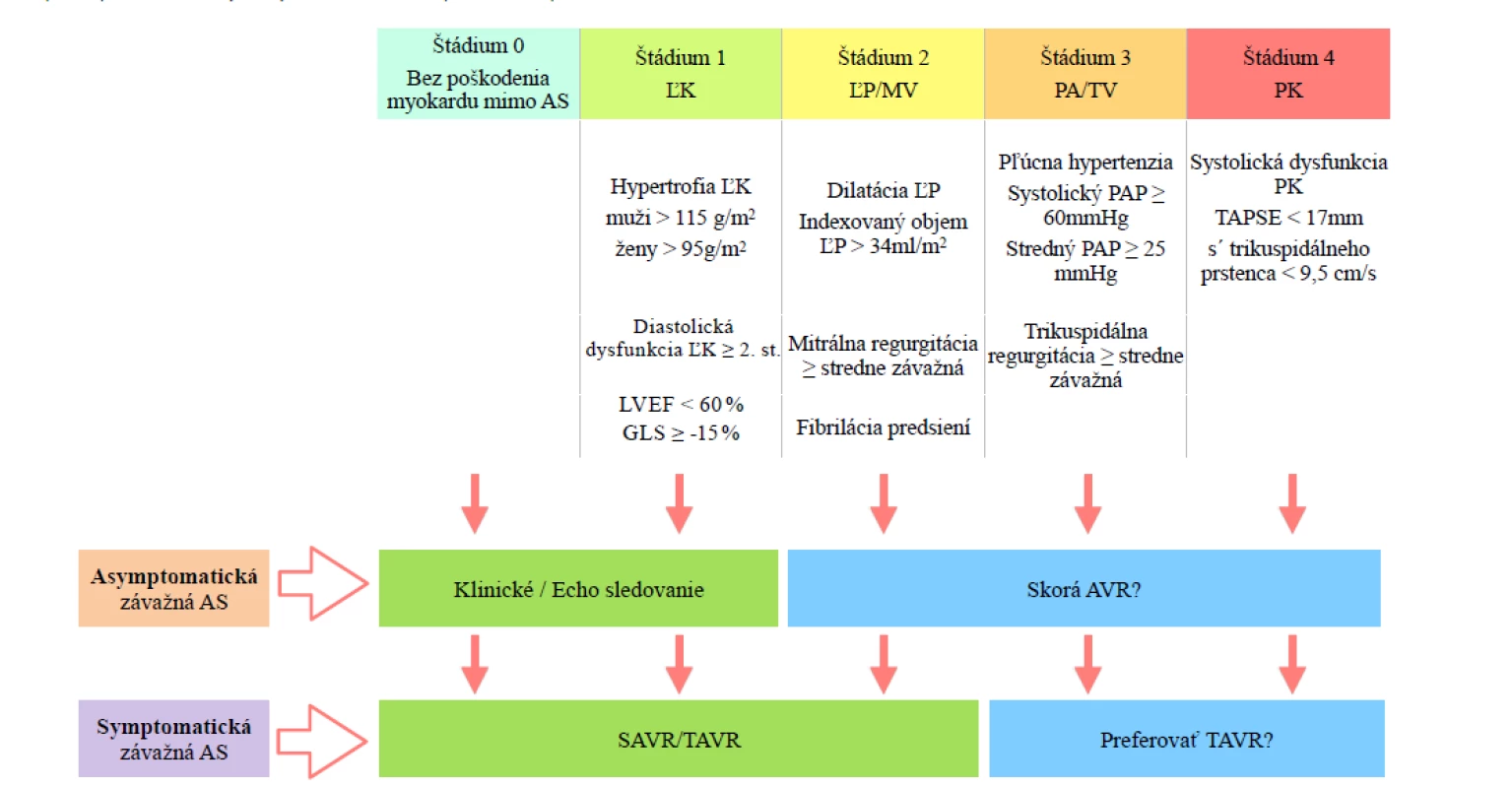
AS – aortálna stenóza; AVR – náhrada aortálnej chlopne; GLS – global; longitudinal strain; HF – srdcové zlyhávanie; ĽP = ľavá predsieň ; ĽK – ľavá komora; LVEF – ejekčná frakcia ľavej komory; MV – mitrálna chlopňa; PA – pľúcna artéria; PAP – tlak v pľúcnici; RV – pravá komora; SAVR – chirurgická náhrada aortálnej chlopne; SV – stroke volume; TAPSE – tricuspid annulus plane systolic excursion; TAVR – transkatétrová náhrada aortálnej chlopne; TV – trikuspidálna chlopňa Obrázok 1: Štádiá AS na základe postihnutia myokardu a možné implikácie pre terapeutický postup. Zelená - súčasné odporúčania, modrá - navrhovaný postup v svetle nových výsledkov štúdií. AS = aortálna stenóza; AVR = náhrada aortálnej chlopne ; GLS = global longitudinal strain; HF = srdcové zlyhávanie; ĽP = ľavá predsieň ; ĽK = ľavá komora; LVEF = ejekčná frakcia ľavej komory; MV = mitrálna chlopňa; PA = pľúcna artéria; PAP = tlak v pľúcnici; RV = pravá komora; SAVR = chirurgická náhrada aortálnej chlopne; SV = stroke volume; TAPSE = tricuspid Záver
Pri výbere pacientov na TAVI alebo SAVR sa rutinne neprihliada na funkciu PK. Narastajú dôkazy prepojenia medzi funkciou PK a klinickými výsledkami po chirurgických či intervenčných výmenách aortálnej chlopne. Najnovšie výsledky naznačujú, že u pacientov s už existujúcou dysfunkciou PK by SAVR mohla viesť k ďalšiemu zhoršeniu funkcie PK, zatiaľ čo pri TAVI sa zhoršenie neočakáva. U asymptomatických pacientov so závažnou AS by pravostranné postihnutie malo urýchliť zváženie včasnej AVR. Ideálne by mala intervencia nastať pred vznikom pľúcnej hypertenzie, signifikantnej TR, a alebo dilatácie/dysfunkcie pravej komory. Symptomatickí pacienti so závažnou AS a pravostranným postihnutím by mohli viac profitovať z intervenčného výkonu. Tento postup však vyžaduje overenie ďalšími štúdiami s väčšou vzorkou pacientov. Štandardizované echokardiografické vyšetrenie pacientov so závažnou aortálnou stenózou by na základe uvedeného malo zahŕňať detailnú analýzu funkcie PK.
KORESPONDENČNÍ ADRESA AUTORA:
MUDr. Pavol Fülöp
Interná klinika, Nemocnica AGEL Košice-Šaca a. s.
Lúčna 57, 040 15 Šaca
Článek přijat redakcí: 14. 12. 2020
Článek přijat po recenzích k publikaci: 29. 4. 2021
Zdroje
1. Coffey S, Cairns BJ, Iung B. The modern epidemiology of heart valve disease. Heart. 2016;102 : 75–85.
2. Baumgartner H, Falk V, Bax JJ et al. 2017 ESC/ EACTS guidelines for the management of valvular heart disease: the Task Force for the Management of Valvular Heart Disease of the European Society of Cardiology (ESC) and the European Association for Cardio-Thoracic Surgery (EACTS). Eur Heart J 2017; 38 : 2739–91.
3. Starr I, Jeffers WA, Meade RH. The absence of conspicuous increments of venous pressure after severe damage to the right ventricle of the dog, with a discussion of the relation between clinical congestive failure and heart disease. Am Heart J 1943; 26 : 291–301.
4. Konstam MA, Kiernan MS, Bernstein D et al. Evaluation and management of right-sided heart failure: a scientific statement from the American Heart Association. Circulation 2018; 137: e578–622.
5. Généreux P, Pibarot P, Redfors B et al. Staging classification of aortic stenosis based on the extent of cardiac damage. Eur Heart J 2017; 38 : 3351–8.
6. Vollema EM, Amanullah MR, Ng ACT et al. Staging cardiac damage in patients with symptomatic aortic valve stenosis. J Am Coll Cardiol 2019; 74 : 538–49.
7. Tastet L, Tribouilloy C, Maréchaux S et al. Staging cardiac damage in patients with asymptomatic aortic valve stenosis. J Am Coll Cardiol 2019; 74 : 550–63.
8. Eleid MF, Padang R, Pislaru SV et al. Effect of transcatheter aortic valve replacement on right ventricular-pulmonary artery coupling. J Am Coll Cardiol 2019; 12 : 2145–54.
9. Schewel J, Schmidt T, Kuck K-H et al. Impact of pulmonary hypertension hemodynamic on long-term outcome after trans-catheter aortic valve replacement. J Am Coll Cardiol 2019; 12 : 2155–68.
10. Thanassoulis G, Campbell CY, Owens DS et al. CHARGE Extracoronary Calcium Working Group. Genetic associations with valvular calcification and aortic stenosis. N Engl J Med 2013; 368 : 503–512.
11. Friedberg MK, Redington AN. Right versus left ventricular failure: differences, similarities, and interactions. Circulation 2014; 129 : 1033–44.
12. Galli E, Guirette Y, Feneon D et al. Prevalence and prognostic value of right ventricular dysfunction in severe aortic stenosis, Eur. Heart J. Cardiovasc. Imaging 2015; 16(5); 531–538
13. Todiere G, Neglia D, Ghione S, et al. Rightventricular remodelling in systemic hypertension: a cardiac MRI study. Heart 2011; 97 : 1257–61. 13.
14. Pedrinelli R, Canale ML, Giannini C et al. Right ventricular dysfunction in early systemic hypertension: a tissue Doppler imaging study in patients with high-normal and mildly increased arterial blood pressure. J Hypertension 2010; 28 : 615 – 21.
15. Malouf J, Enriquez-Sarano M, Pellikka P et al. Severe pulmonary hypertension in patients with severe aortic valve stenosis: clinical profile and prognostic implications. J Am Coll Cardiol 2002; 40 : 789–95.
16. Hayek S, Pibarot P, Harzand A, et al. Dobutamine stress echocardiography for risk stratification of patients with low-gradient severe aortic stenosis undergoing TAVI. JACC Cardiovasc Imaging. 2015; 8 : 380–382
17. Schueler R, Öztürk C, Laser JV et al. Right ventricular assessment in patients undergoing transcatheter or surgical aortic valve replacement. Catheter Cardiovasc Interv. 2020; 1–12.
18. Kapadia SR, Tuzcu EM, Makkar RR, et al. Long-term outcomes of inoperable patients with aortic stenosis randomly assigned to trans-catheter aortic valve replacement or standard therapy. Circulation. 2014;130 : 1483–1492.
19. Fan J, Liu X, Yu L et al. Impact of tricuspid regurgitation and right ventricular dysfunction on outcomes after transcatheter aortic valve replacement: A systematic review and meta-analysis. Clin Cardiol. 2019; 42(1): 206–212.
20. Cremer PC, Zhang Y, Alu M, et al. The incidence and prognostic implications of worsening right ventricular function after surgical or transcatheter aortic valve replacement: insights from PARTNER IIA. Eur Heart J 2018; 39 : 2659–67.
21. Kempny A, Diller GP, Kaleschke G, et al. Impact of transcatheter aortic valve implantation or surgical aortic valve replacement on right ventricular function. Heart. 2012; 98 : 1299–1304
22. Unsworth B, Casula RP, Kyriacou AA, et al. The right ventricular annular velocity reduction caused by coronary artery bypass graft surgery occurs at the moment of pericardial incision. Am Heart J 2010; 159 : 314–22.
23. Rozenbaum Z, Granot Y, Steinvil A et al. Aortic stenosis with severe tricuspid regurgitation: comparative study between conservative Transcatheter aortic valve replacement and surgical aortic valve replacement combined with tricuspid repair. J Am Soc Echocardiogr. 2018; 31(10): 1101–1108.
24. Evaluation of Transcatheter Aortic Valve Replacement Compared to SurveilLance for Patients With AsYmptomatic Severe Aortic Stenosis. Randomizovaná klinická štúdia, začiatok 12.07.2017. Dostupné z WWW: .
25. Early Valve Replacement Guided by Biomarkers of Left Ventricular Decompensation in Asymptomatic Patients With Severe Aortic Stenosis. Randomizovaná klinická štúdia, začiatok 21.07.2017. Dostupné z WWW: .
26. Pibarot P, Iung B, Cavalcante JL. Risk Stratification in Patients With Aortic Stenosis: Pay More Attention to the Right-Side Unit! JACC Cardiovasc Interv. 2019; 12(21): 2169-2172.
Štítky
Diabetológia Endokrinológia Interné lekárstvo
Článok vyšiel v časopiseVnitřní lékařství
Najčítanejšie tento týždeň
2021 Číslo E-4- Parazitičtí červi v terapii Crohnovy choroby a dalších zánětlivých autoimunitních onemocnění
- Rizikové období v léčbě růstovým hormonem: přechod mladých pacientů k lékařům pro dospělé
- Nech brouka žít… Ať žije astma!
- Intermitentní hladovění v prevenci a léčbě chorob
- Monoklonální protilátky v léčbě hyperlipidemií
-
Všetky články tohto čísla
- Hodnocení validity metody palcového tlaku u diabetiků – průběžné výsledky
- Lymfangiomatóza – vzácné generalizované onemocnění lymfatického systému
- Aortálna stenóza a dysfunkcia pravej komory
- Perkutánní intervence chronického uzávěru koronární tepny – komu, kdy a proč
- Pancytopenie jako hlavní projev nákazy lidským virem imunodeficience ve stadiu AIDS
- Vnitřní lékařství
- Archív čísel
- Aktuálne číslo
- Iba online
- Informácie o časopise
Najčítanejšie v tomto čísle- Perkutánní intervence chronického uzávěru koronární tepny – komu, kdy a proč
- Lymfangiomatóza – vzácné generalizované onemocnění lymfatického systému
- Aortálna stenóza a dysfunkcia pravej komory
- Pancytopenie jako hlavní projev nákazy lidským virem imunodeficience ve stadiu AIDS
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



