-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Reziduální riziko kardiovaskulárních komplikací a jeho snížení kombinací hypolipidemik
Residual risk of cardiovascular complications and its reduction with a combination of lipid lowering agents
Most patients treated with statins die due to cardiovascular events. The risk of cardiovascular event during statin treatment is called residual risk. The source of residual risk are some risk factors including dyslipidemia, characterized by low HDL-cholesterol, elevated triglycerides and apolipoprotein B, small dense LDL and sometimes also high lipoprotein(a). High residual risk is common in patients with metabolic syndrom, type 2 diabetes mellitus, insulinoresistance and abdominal obesity. Residual risk can be decreased by combination therapy statins with fibrates or statins with niacin; niacin can affect almost all lipids and lipoproteins that participate in residual risk. There are evidences from clinical trials that combinations statin with fibrates or statin with niacin are safe.
Key words:
cardiovascular diseases – rezidual risk – apolipoprotein B – HDL-cholesterol – triglycerides – statins – fibrates – niacin
Autoři: V. Soška 1,2
Působiště autorů: Oddělení klinické biochemie FN u sv. Anny v Brně, přednosta doc. MUDr. Vladimír Soška, CSc. 1; II. interní klinika Lékařské fakulty MU, Brno, přednosta prof. MUDr. Miroslav Souček, CSc. 2
Vyšlo v časopise: Vnitř Lék 2011; 57(3): 313-316
Kategorie: 60. narozeniny prof. MUDr. Jiřího Vítovce, CSc., FESC
Souhrn
I při léčbě statiny umírá většina nemocných na kardiovaskulární příhody. Riziko vzniku kardiovaskulární příhody při léčbě statiny se nazývá reziduální riziko. Podílí se na něm více faktorů, mezi kterými má významné postavení dyslipidemie, charakterizovaná snížením HDL-cholesterolu, zvýšením triglyceridů, apolipoproteinu B, eventuálně lipoproteinu(a) a malých částic LDL3. Reziduální riziko bývá vysoké především u osob s metabolickým syndromem, diabetes mellitus 2. typu, inzulinorezistencí a abdominálním nahromaděním tuku. Snížení reziduálního rizika je možné dosáhnout pomocí kombinace statinů s fibráty nebo s kyselinou nikotinovou, která má účinek na prakticky všechny lipidy a lipoproteiny, podílející se na reziduálním riziku. Z intervenčních studií existují doklady o tom, že kombinace statinů s fibráty nebo s kyselinou nikotinovou jsou kombinace bezpečné.
Klíčová slova:
kardiovaskulární onemocnění – reziduální riziko – apolipoprotein B – HDL-cholesterol – triglyceridy – statiny – fibráty – kyselina nikotinováÚvod
Termínem „reziduální riziko kardiovaskulárních onemocnění“ rozumíme riziko vzniku kardiovaskulární (KV) příhody u pacientů s dyslipidemií, kteří mají zavedenou léčbu statiny a kteří při této léčbě dosahují cílových hodnot LDL-cholesterolu (LDL-ch) pro svoji kategorii rizika. U velké části takto léčených osob dochází, i přes léčbu statiny, k rozvoji KV příhod a většina pacientů léčených statiny umírá i nadále na KV komplikace. Reziduální riziko KV onemocnění je dáno přítomností dalších doposud neovlivněných (nebo nedostatečně ovlivněných) rizikových faktorů. Patří k nim samozřejmě především kouření, hypertenze a diabetes mellitus, z krevních lipidů se pak na reziduálním riziku významně podílí především snížená koncentrace HDL--cholesterolu (HDL-ch), zvýšená koncentrace triglyceridů (Tg), zvýšená koncentrace apolipoproteinu B (apo B), zvýšený podíl malých „denzních“ částic LDL3 a někdy i zvýšená koncentrace lipoproteinu(a). Reziduální riziko je zodpovědné za většinu KV příhod proběhlých při statinové terapii. Statiny patří u osob s hypercholesterolemií ve vysokém riziku zcela určitě k základním lékům a jejich význam je nezpochybnitelný. Metaanalýza velkých statinových studií prokázala, že snížení cholesterolu o 1 mmol/ l vede k poklesu koronární mortality o 19 %, koronárních příhod o 25 % a celkové mortality o 12 % [1]. Dosažení cílových hodnot LDL-ch pomocí statinů proto vždy patří k základním cílům u osob, které mají vysoké KV riziko nebo které již prodělaly nějakou KV příhodu. Ukazuje se však, že terapie statiny nestačí, a pro další zlepšení prognózy nemocných je třeba pokusit se snížit i reziduální riziko. Dokonce i při agresivní léčbě statiny, kdy jsou dosahovány hodnoty LDL-ch pod 2 mmol/l, dochází ke KV příhodám, např. infarktu myokardu nebo cévní mozkové příhodě.
Lipidy a lipoproteiny, které se podílejí na reziduálním riziku
HDL-cholesterol
Snížená hladina HDL-ch je nezávislým rizikovým faktorem pro ischemickou chorobu srdeční (ICHS) [2] a metaanalýza epidemiologických studií prokázala inverzní závislost mezi HDL-Ch a rizikem ICHS [3]. Při analýze výsledků statinových studií bylo prokázáno, že hladina HDL-ch významně ovlivňuje i prognózu pacientů statiny již léčených. Např. ve studiích 4S bylo při terapii statiny riziko kardiálních příhod u pacientů s hladinou HDL-ch pod 0,9 mmol/ l obdobné jako u osob užívajících placebo, které měly hladinu HDL-ch nad 1,3 mmol/ l [4]. Obdobný vztah mezi rizikem při léčbě statiny a hladinou HDL-ch byl získán při analýze výsledků dalších statinových studií [5,6]. Je tedy zřejmé, že nízký HDL-ch se významným způsobem podílí na výši reziduálního rizika u nemocných léčených statiny, a je prokázáno, že zvýšení HDL-ch vede ke snížení KV rizika i bez snížení LDL-ch [7]. U osob léčených statiny, které mají nízkou hladinu HDL-ch, by proto bylo žádoucí dosáhnout jeho zvýšení nad hodnoty uvedené v tab. 1.
Tab. 1. Optimální hodnoty HDL-cholesterolu a triglyceridů [8]. ![Optimální hodnoty HDL-cholesterolu a triglyceridů [8].](https://www.prelekara.sk/media/cache/resolve/media_object_image_small/media/image/6d7dc6ff6b19db6987f6fec3de02b4ff.jpg)
Triglyceridy
Již v roce 1998 prokázala metaanalýza 22 klinických studií, že vzestup hladiny Tg o 1 mmol/ l přináší zvýšení rizika koronárních příhod o 15 % u mužů a o 37 % u žen [9]. Ke zvýšení Tg velmi často dochází současně se snížením HDL-ch, zvýšené Tg nicméně přinášejí zvýšené riziko KV příhod nezávisle na hladině HDL-ch, a to jak pro muže, tak pro ženy [10]. Některé novější práce pak ukázaly, že lepším ukazatelem budoucího KV rizika může být hladina Tg vyšetřená postprandiálně než hladina Tg stanovená nalačno [11,12]. Zvýšené postprandiální Tg byly sdruženy se zvýšeným rizikem infarktu myokardu, ischemické choroby srdeční, ischemické cévní mozkové příhody, a dokonce i celkové úmrtnosti.
Malé částice LDL
Existuje několik subpopulací lipoproteinů o nízké denzitě (LDL), které se liší svojí velikostí, obsahem cholesterolu a Tg. Obecně platí, že čím menší jsou částice LDL, tím větší mají schopnost akcelerovat aterosklerózu. Největší riziko přinášejí nejmenší LDL, označované jako LDL3. Podíl malých LDL3 se zvyšuje při hypertriglyceridemii a bývá vyšší také u osob s inzulinorezistencí. Je prokázána pozitivní korelace mezi velikostí LDL a rizikem infarktu myokardu [13]; zvýšení podílu subpopulace malých LDL3 významně zvyšuje riziko ICHS i infarktu myokardu [14] a stejně tak je prokázána závislost mezi koncentrací malých LDL3 v krvi a progresí aterosklerózy na koronárních arteriích [15].
Apolipoprotein B
Je to bílkovina navázaná na povrchu lipoproteinů VLDL, IDL a LDL. Na jedné lipoproteinové částici je vždy jediná molekula apo B, a jeho koncentrace proto zohledňuje počet všech aterogenních lipoproteinových částic v krvi. Zvýšená koncentrace apo B predikuje riziko KV komplikací lépe než koncentrace celkového nebo LDL-ch [16,17]. Apo B je dobrým ukazatelem reziduálního rizika především u osob s metabolickým syndromem a/nebo diabetes mellitus. Zvýšená koncentrace apo B může odkrýt zvýšené reziduální riziko i u osob, u kterých byla dosažena cílové hladina LDL-ch. Dosažení cílových hodnot apo B (tab. 2) proto může být pro zlepšení prognózy důležitější než dosažení cílové hladiny LDL-ch [18].
Tab. 2. Cílové hodnoty apolipoproteinu B a LDL-cholesterolu [19]. ![Cílové hodnoty apolipoproteinu B a LDL-cholesterolu [19].](https://www.prelekara.sk/media/cache/resolve/media_object_image_small/media/image/f90d0991cc872e81714b13cd1fa8da6e.jpg)
KVO – kardiovaskulární onemocnění, DM2 – diabetes mellitus 2. typu, DM1 – diabetes mellitus 1. typu, MAU – mikroalbuminurie *u pacientů s velmi vysokým rizikem (osoby s KVO a současně další rizikové faktory – diabetes mellitus, metabolický syndrom, časně po akutním koronárním syndromu, po aortokoronárním bypassu) jsou cílové hodnoty až 1,5 mmol/l Lipoprotein(a)
Jde o částici LDL, na které je navázána molekula glykoproteinu – tzv. apolipoprotein(a). Ten je strukturálně homologní s plazminogenem, se kterým soutěží o vazbu na plazmin, a zasahuje tak do procesu fibrinolýzy. Protože však lipoprotein(a) plazmin neaktivuje, je potlačena fibrinolýza a to vede k převaze trombogeneze nad trombolýzou [20]. Zvýšená koncentrace lipoproteinu(a) tak zvyšuje riziko uzávěru arterie trombem a je rizikovým faktorem vzniku koronárních příhod i předčasné ICHS [21,22]. Jeho hladina je z 90 % geneticky determinována a jeho aterogenita je potencována přítomností dalších rizikových faktorů [23]. Za rizikovou je obvykle považována jeho koncentrace nad 0,3 g/l. Jediným hypolipidemikem, které hladinu lipoproteinu(a) může snížit, je kyselina nikotinová.
Ovlivnění reziduálního rizika
Cílovou skupinou pro snižování reziduálního rizika jsou nemocní, kteří již užívají statin, dosahují cílových hodnot LDL-ch pro svoji kategorii rizika (tab. 2), ale mají při této léčbě v laboratorním nálezu některou z následujících abnormalit: snížený HDL-ch, zvýšené Tg, zvýšený apo B, eventuálně zvýšený lipoprotein(a). Zvýšený podíl frakce malých LDL3 zatím není možné běžně vyšetřovat, o jejich přítomnosti však může svědčit vyšší než cílová koncentrace apo B při cílové hodnotě LDL-ch pro danou kategorii rizika. Řada nemocných vykazuje více těchto odchylek současně, především pak osoby s metabolickým syndromem (kritéria metabolického syndromu jsou uvedena v tab. 3), nemocní s diabetes mellitus 2. typu nebo osoby s hyperinzulinemií a inzulinorezistencí. Prvním krokem ke snížení reziduálního rizika by měla vždy být snaha o změnu životního stylu – absence kouření, racionální strava, úprava tělesné hmotnosti a pravidelná fyzická aktivita. Většinou však bývá nutné přidat ke statinu další hypolipidemikum, které má schopnost ovlivnit výše uvedené odchylky v krevních lipidech a lipoproteinech. Takovými hypolipidemiky jsou fibráty a kyselina nikotinová.
Tab. 3. Kritéria pro diagnostiku metabolického syndromu: musí být přítomny alespoň 3 z uvedených 5 symptomů. 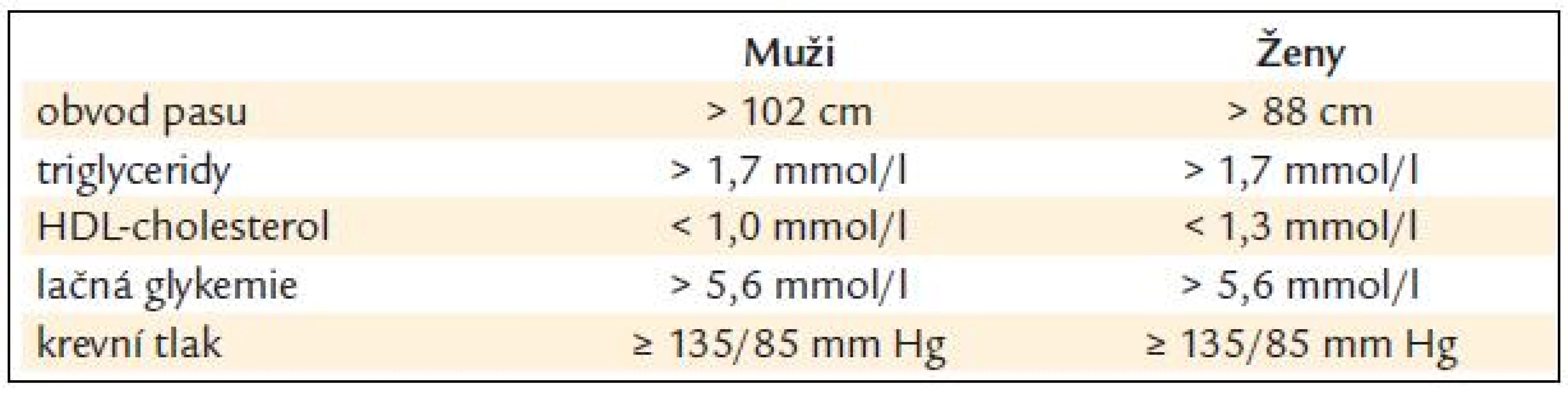
Fibráty
Jsou u nás nejdéle používanými léky. Snižují Tg o 20–50 %, zvyšují HDL-ch o 5–20 % a snižují frakci malých LDL3, nesnižují však hladinu lipoproteinu(a). Jejich účinek na Tg a HDL-ch není konstantní a závisí především na výchozím fenotypu krevních lipidů [24]. Význam kombinační léčby pomocí statinu s fenofibrátem u nemocných s diabetes mellitus 2. typu prokázala nedávno dokončená studie ACCORD. V této studii byli všichni pacienti léčeni simvastatinem a byli randomizováni k přidání fenofibrátu nebo placeba. U těch diabetiků, kteří měli zvýšené Tg a snížený HDL-ch, vedlo přidání fenofibrátu k simvastatinu k dalšímu, statisticky významnému snížení hlavních KV příhod o 31 % [25]. Ve skupině diabetiků, která zůstala na monoterapii simvastatinem, měly osoby se zvýšenými Tg a nízkým HDL-ch o 70 % vyšší relativní riziko KV příhod než diabetici bez tohoto typu dyslipidemie. Bezpečnost a účinnost kombinace statinu s fenofibrátem prokázaly i další studie, ze kterých je zřejmé, že přidání fenofibrátu ke statinu prakticky nezvyšuje riziko nežádoucích účinků ve srovnání s monoterapií statinem [26,27].
Kyselina nikotinová
Je nejúčinnějším lékem na zvýšení HDL-ch a má účinek na prakticky všechny frakce krevních lipidů. Snižuje LDL-ch asi o 20 %, Tg asi o 20–30 %, zvyšuje HDL-ch o 20–30 %. Je jediným hypolipidemikem, které může snížit hladinu lipoproteinu(a). Pro její klinické použití existují důkazy z řady intervenčních studií, ve kterých bylo prokázáno, že snižuje nejen KV příhody a KV mortalitu, ale i mortalitu celkovou [27,28]. Kyselina nikotinová byla použita v řadě klinických studií také v kombinaci s dalšími hypolipidemiky: statiny, fibráty a pryskyřicemi. Výsledky prakticky všech těchto studií byly velmi konzistentní – pokles mortality, morbidity, zpomalení progrese, či dokonce navození regrese aterosklerózy. Např. ve studii HATS vedla kombinace simvastatinu s niacinem k regresi aterosklerózy a k signifikantnímu (80%!) snížení KV mortality [29]. Ve studii Arbiter 2 vedlo přidání kyseliny nikotinové k terapii statiny jak ke zpomalení progrese aterosklerózy (měřena tloušťka intimy-medie na karotidách), tak i ke snížení KV příhod o 60 % [30]. Nejnovější studií, ve které byla použita kyselina nikotinová v kombinaci se statiny, je studie ARBITER 6 HALTS. V této studii byly sledovány změny tloušťky intimy-medie karotid u pacientů léčených statiny v závislosti na tom, zda byl k léčbě statiny přidán ezetimib, nebo kyselina nikotinová. Přidání kyseliny nikotinové ke statinu vedlo (ve srovnání s přidáním ezetimibu) k signifikantnímu vzestupu HDL-ch a snížení Tg, naopak ve větvi simvastatin + ezetimib se více snížil celkový a LDL-ch. Kombinace statin + ezetimib zastavila progresi aterosklerózy, kombinace statin + kyselina nikotinová však vedla k regresi aterosklerózy a ve srovnání s ezetimibem i k signifikantnímu poklesu KV příhod [31]. Tato studie je jasným důkazem toho, že snížení Tg a zvýšení HDL-ch může mít větší význam pro snížení reziduálního rizika než další aditivní pokles LDL-ch.
Kyselina nikotinová je ve světě používána již více než 50 let (především v USA), v České republice však nebyla jako hypolipidemikum nikdy registrována. Její terapeutická dávka je 2 g/den a hlavním limitujícím faktorem jejího použití byl specifický nežádoucí účinek – flush (zrudnutí a svědění až pálení obličeje, krku a někdy i celé horní části trupu). V současné době přichází na náš trh přípravek Tredaptive®, který obsahuje kromě 1 g kyseliny nikotinové také 20 mg laropiprantu v 1 tabletě. Laropiprant výrazně snižuje riziko rozvoje flushe, který se tak projevuje jen u velmi malého procenta pacientů a většinou po několika dnech ustupuje. Nemocného je však třeba na možnost výskytu flushe upozornit a vysvětlit mu, že nejde o nic nebezpečného, že po několika dnech obtíže zmizí, a především že mu tento lék může významně snížit riziko KV příhod a prodloužit život.
Závěr
Léčba nemocných s dyslipidemií, kteří jsou ve vysokém riziku KV komplikací, by měla být zaměřena nejen na snížení LDL-ch statiny, ale i na snížení eventuálního reziduálního rizika. Toho je možné dosáhnout pomocí kombinace hypolipidemik. Základem léčby nemocných s dyslipidemií je prakticky vždy statin se snahou dosáhnout cílovou hladinu LDL-ch pro příslušnou kategorii rizika. Pokud zůstává při léčbě statiny zvýšená hladina Tg, snížený HDL-ch, nebo zvýšený apo B, je dalším vhodným krokem přidání fenofibrátu nebo kyseliny nikotinové. Tato kombinace může dále snížit i LDL-ch a v případě kyseliny nikotinové i snížit lipoprotein(a), který je jinými hypolipidemiky neovlivnitelný. Kombinace statinu s fibrátem nebo s kyselinou nikotinovou snižuje také frakci malých, silně aterogenních částic LDL3. Účinnou kombinační léčbou lze dosáhnout významné redukce reziduálního rizika, a tím i zlepšení prognózy nemocných. Součástí snahy o snížení reziduálního rizika by však vždy měla být i režimová opatření, především absence kouření, racionální strava, fyzická aktivita a udržování optimální tělesné hmotnosti.
doc. MUDr. Vladimír Soška, CSc
www.fnusa.cz
e-mail: vladimir.soska@fnusa.czDoručeno do redakce: 8. 12. 2010
Zdroje
1. Baigent C, Keech A, Kearney PM et al. Cholesterol Treatment Trialist (CTT) Collaborators. Efficacy and safety of cholesterol lowering treatment: Prospective meta-anylysis of data from 90,056 participants in 14 randomized trials of statins. Lancet 2005; 366 : 1267–1278.
2. Gordon DJ, Probstfield JL, Garrison RJ et al. High-density lipoprotein cholesterol and cardiovascular disease. Four prospective American studies. Circulation 1989; 79 : 8–15.
3. Castelli WP, Garrison RJ, Wilson PWF et al. Incidence of coronary heart disease and lipoprotein cholesterol levels: The Framingham Study. JAMA 1986; 256 : 2835–2838.
4. Pedersen TR, Olsson AG, Faergeman O et al. Lipoprotein changes and reduction in the incidence of major coronary events in the Scandinavian Simvastatin Survival Study (4S). Circulation 1998; 97 : 1453–1460.
5. Sacks FM, Tonkin AM, Shepherd J et al. Effect of pravastatin on coronary disease events in subgroups defined by coronary risk factors: the Prospective Pravastatin Pooling Project. Circulation 2000; 102 : 1893–1900.
6. Ballantyne CM, Herd JA, Ferlic LL et al. Influence of low HDL on progression of coronary artery disease and response to fluvastatin therapy. Circulation 1999; 99 : 736–743.
7. Rubins HB, Robins SJ, Collins D et al. Gemfibrozil for the secondary prevention of coronary heart disease in men with low levels of high-density lipoprotein cholesterol. Veterans Affairs High-Density Lipoprotein Cholesterol Intervention Trial Study Group. N Engl J Med 1999; 341 : 410–418.
8. Cífková R, Býma S, Češka R et al. Prevence kardiovaskulárních onemocnění v dospělém věku. Společné doporučení českých odborných společností. Vnitř Lék 2005; 51 : 1021–1036.
9. Austin MA, Hokanson JE, Edwards KL. Hypertriglyceridemia as a cardiovascular risk factor. Am J Cardiol 1998; 81 : 7B–12B.
10. Hokanson JE, Austin MA. Plasma triglyceride level is a risk factor for cardiovascular disease independent of high-density lipoprotein cholesterol level: a meta-analysis of population-based prospective studies. J Cardiovasc Risk 1996; 3 : 213–219.
11. Freiberg JJ, Tybjaerg-Hansen A, Jensen JS et al. Nonfasting triglycerides and risk of ischemic stroke in the general population. JAMA 2008; 300 : 2142–2152.
12. Nordestgaard BG, Benn M, Schnohr P et al. Nonfasting Triglycerides and Risk of Myocardial Infarction, Ischemic Heart Disease, and Death in Men and Women. JAMA 2007; 298 : 299–308.
13. Stampfer MJ, Krauss RM, Ma J et al. A prospective study of triglyceride level, low-density lipoprotein particle diameter, and risk of myocardial infarction. JAMA 1996; 276 : 882–888.
14. Griffin BA, Freeman DJ, Tait GW et al. Role of plasma triglyceride in the regulation of plasma low density lipoprotein (LDL) subfractions: relative contribution of small, dense LDL to coronary heart disease risk. Atherosclerosis 1994; 106 : 241–253.
15. Watts GF, Mandalia S, Brunt JN et al. Independent associations between plasma lipoprotein subfraction levels and the course of coronary artery disease in the St. Thomas’ Atherosclerosis regression study (STARS). Metabolism 1993; 42 : 1461–1467.
16. Walldius G, Jungner I. The apoB//apoA-1 ratio: a strong, new risk factor for cardiovascular disease and a target for lipid-lowering therapy – a review of the evidence. J Intern Med 2006; 259 : 493–519.
17. Walldius G, Jungner I, Holme I et al. High apolipoprotein B, low apolipoprotein A-I, and improvement in the prediction of fatal myocardial infarction (AMORIS study): a prospective study. Lancet 2001; 358 : 2026–2033.
18. Barter PJ, Ballantyne CM, Carmena R et al. Apo B versus cholesterol in estimating cardiovascular risk and in quiding therapy: report of the thirty-person/ten country panel. J Intern Med 2006; 259 : 247–258.
19. Vaverková H, Soška V, Rosolová H et al. Doporučení pro diagnostiku a léčbu dyslipidémií v dospělosti, vypracované výborem České společnosti pro aterosklerózu. Vnitř Lék 2007; 53 : 181–197.
20. Loscalzo J, Weinfeld M, Fless GM et al. Lipoprotein(a), fibrin binding and plasminogen activation. Arteriosclerosis 1990; 10 : 240–245.
21. Assmann G, Schulte H, von Eckardstein A. Hypertriglyceridemia and elevated lipoprotein(a) are risk factors for major coronary events in middle-aged men. Am J Cardiol 1996; 77 : 1179–1184.
22. Dahlen GH, Guyton JR, Attar M et al. Association of levels of lipoprotein Lp(a), plasma lipids and other lipoproteins with coronary artery disease documented by angiography. Circulation 1986; 74 : 758–765.
23. Danesh J, Collins R, Peto R. Lipoprotein(a) and coronary heart disease. Meta-analysis of prospective studies. Circulation 2000; 102 : 1082–1085.
24. Filippatos T, Milionis HJ. Treatment of hyperlipidemia with fenofibrate and related fibrates. Expert Opin Invest Drugs 2008; 17 : 1599–1614.
25. Tonkin AM, Chen L Effects of combination lipid therapy in the management of patients with type 2 diabetes mellitus in the Action to Control Cardiovascular Risk in Diabetes (ACCORD) trial. Circulation 2010; 122 : 850–852.
26. Wierzbicki AS, Morrell J, McMahon Z et al. The effect of fibrate-statin combination therapy on cardiovascular events: a retrospective cohort analysis. Curr Med Res Opin 2010; 26 : 2141–2146.
27. Berge KG, Canner PL. Coronary drug project: experience with niacin. Eur J Pharmacol 1991; 40 (Suppl 1): S49–S51.
28. Canner PL, Berge KG, Wenger NK et al. Fifteen year mortality in coronary drug project patients: long term benefit with niacin. J Am Coll Cardiol 1986; 8 : 1245–1255.
29. Brown BG, Zhao XQ, Chait A et al. Simvastatin and niacin, antioxidant vitamins, or the combination for the prevention of coronary disease. N Engl J Med 2001; 345 : 1583–1592.
30. Taylor AJ, Sullenberger LE, Lee HJ et al. Arterial Biology for the Investigation of the Treatment Effects of Reducing Cholesterol (ARBITER) 2: a double-blind, placebo-controlled study of extended-release niacin on atherosclerosis progression in secondary prevention patients treated with statins. Circulation 2004; 110 : 3512–3517.
31. Villines TC, Stanek EJ, Devine PJ et al. The ARBITER 6-HALTS Trial (Arterial Biology for the Investigation of the Treatment Effects of Reducing Cholesterol 6-HDL and LDL Treatment Strategies in Atherosclerosis): final results and the impact of medication adherence, dose, and treatment duration. J Am Coll Cardiol 2010; 55 : 2721–2726.
Štítky
Diabetológia Endokrinológia Interné lekárstvo
Článok vyšiel v časopiseVnitřní lékařství
Najčítanejšie tento týždeň
2011 Číslo 3- Parazitičtí červi v terapii Crohnovy choroby a dalších zánětlivých autoimunitních onemocnění
- Intermitentní hladovění v prevenci a léčbě chorob
- Rizikové období v léčbě růstovým hormonem: přechod mladých pacientů k lékařům pro dospělé
- Statinová intolerance
- Monoklonální protilátky v léčbě hyperlipidemií
-
Všetky články tohto čísla
- Světový den ledvin (World Kidney Day – WKD)
- Jubilant prof. MUDr. Jiří Vítovec, CSc., FESC
- Interna a kardiologie, internisté a kardiologové
- Systolický wall stress ľavej komory srdca pri antihypertenzívnej liečbe
- Dyslipidemie a obezita 2011. Jak spolu souvisejí a v čem se liší
- Autoimunitní pankreatitida a IgG pozitivní sklerotizující cholangitida
- Výskyt aterogénnej dyslipidémie vo vzorke asymptomatických probandov vyšetrením pomocou metódy Lipoprint
- Zevní vlivy podmiňující vznik nádorů nebo ochraňující před jejich vznikem
- Vyskytují se v medicíně „módní“ choroby?
- Rostoucí problém – lidský papilomavirus a nádory hlavy/krku
- Mikroalbuminurie. Od diabetu ke kardiovaskulárnímu riziku
- Kotníko-pažní index u nemocných s diabetes mellitus 2. typu
- Trombohemoragický syndrom u nemocných s myeloproliferativním onemocněním s trombocytemií
- Reziduální riziko kardiovaskulárních komplikací a jeho snížení kombinací hypolipidemik
- Síť komplexních onkologických center České republiky
- Variabilita krevního tlaku a arteriální hypertenze
- Vnitřní lékařství
- Archív čísel
- Aktuálne číslo
- Iba online
- Informácie o časopise
Najčítanejšie v tomto čísle- Mikroalbuminurie. Od diabetu ke kardiovaskulárnímu riziku
- Zevní vlivy podmiňující vznik nádorů nebo ochraňující před jejich vznikem
- Interna a kardiologie, internisté a kardiologové
- Systolický wall stress ľavej komory srdca pri antihypertenzívnej liečbe
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



