-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
GUIDELINES EAU PRO TRANSPLANTACI LEDVINY (část 1)
Autoři: T. Kälble; M. Lucan; G. Nicita; R. Sells; F. J. Burgos Revilla; M. Wiesel
Vyšlo v časopise: Urol List 2009; 7(1): 63-84
Kategorie: Guidelines
OBSAH
- ÚVOD
- DÁRCOVSTVÍ LEDVINY
- 2.1 Technika explantace
- 2.1.1 Technika odběru orgánu od zemřelého dárce
- 2.1.2 Žijící dárce
- 2.1.2.1 Vyšetření
- 2.1.2.2 Předoperační opatření
- 2.1.2.3 Operační techniky nefrektomie u žijícího dárce
- 2.1.2.4 Pooperační péče
- 2.1.3 Literatura
- 2.2 Zachování orgánu
- 2.2.1 Roztoky pro uložení ledviny
- 2.2.2 Metody uchování ledviny
- 2.2.3 Vhodná doba uchování ledviny
- 2.2.4 Literatura
- 2.3 Opatření pro podporu získávání orgánů od
žijících dárců
- 2.3.1 Medicínské metody umožňující zvýšení počtu žijících dárců
- 2.3.1.1 Přijetí graftů s anatomickými anomáliemi
- 2.3.1.2 Laparoskopická nefrektomie u dárce (LLDN) – alternativní chirurgická metoda, která umožnila zvýšit počet žijících dárců
- 2.3.1.3 Plazmaferéza a intravenózní aplikace imunoglobulinu – záchranná terapie pro pozitivní „cross-match“ transplantáty ledvin od žijícího dárce
- 2.3.2 Etické ocenění dárců
- 2.3.2.1 Čestné vyznamenání dárce
- 2.3.3 Organizační metody pro podporu dárcovství orgánů
- 2.3.3.1 „Cross-over“ transplantace nebo párová (zkřížená) výměna orgánů
- 2.3.3.2 Nemocenská dovolená pro dárce orgánů
- 2.3.3.3 Zajištění přístupu k orgánům pro dárce
- 2.3.3.4 Pojištění dárců
- 2.3.4 Literatura
- 2.3.1 Medicínské metody umožňující zvýšení počtu žijících dárců
- 2.4 Problém etiky v otázce transplantace
- 2.4.1 Primární etické principy
- 2.4.1.1 Aspekt dobročinnosti: vykonání dobrého skutku
- 2.4.1.2 Zamezení riziku poškození
- 2.4.1.3 Respektování pacientova rozhodnutí
- 2.4.1.4 Aspekt spravedlnosti: spravedlivá alokace orgánů
- 2.4.2 Transplantace orgánů od zemřelých dárců
- 2.4.2.1 Zemřelý dárce
- 2.4.2.2 Alokace orgánů zemřelých dárců
- 2.4.3 Žijící dárci
- 2.4.3.1 Finanční ohodnocení dobročinných dárců
- 2.4.4 Literatura
- 2.4.1 Primární etické principy
- 2.5 Opatření podporující zvýšení počtu
transplantací orgánů
od zemřelých dárců
- 2.5.1 První přístup: Zvýšení počtu orgánů žijících dárců
- 2.5.1.1 Dárcovství orgánů od nepříbuzných žijících dárců
- 2.5.1.2 „Non-directed“ transplantace orgánu od žijícího dárce
- 2.5.1.3 Finanční ohodnocení žijících dárců centrální organizací
- 2.5.2 Druhý přístup: Zvýšení počtu transplantací orgánů od zemřelých dárců
- 2.5.2.1 Dárcovské karty
- 2.5.2.2 Zlepšení organizace a rozšíření zdrojů
- 2.5.2.3 Legislativa týkající se předpokládaného souhlasu („opting-out“)
- 2.5.2.4 Kritéria pro výběr dárců
- 2.5.2.5 Starší dárci
- 2.5.3 Literatura
- 2.5.1 První přístup: Zvýšení počtu orgánů žijících dárců
- 2.6 Kritéria pro výběr a odmítnutí dárce
ledviny
- 2.6.1 Diskuze
- 2.6.2 Infekce
- 2.6.3 Speciální výjimky týkající se infekce
- 2.6.4 Maligní tumory
- 2.6.5 Speciální výjimky týkající se zhoubných nádorů
- 2.6.6 Stav cévního řečiště a renální funkce
- 2.6.7 Druhořadí dárci
- 2.6.8 Jeden nebo dva grafty na jednoho příjemce
- 2.6.9 Literatura
- 2.1 Technika explantace
- PŘÍJEMCE LEDVINY
- 3.1 Předtransplantační terapie
- 3.1.1 Abnormální urogenitální cesty
- 3.1.2 Derivace moči
- 3.1.3 Indikace pro předtransplantační nefrektomii
- 3.1.3.1 Autosomálně dominantnípolycystické onemocnění ledvin (ADPKD)
- 3.1.3.2 Hypertenze refrakterní na medikamentózní léčbu
- 3.1.3.3 Chronická infekce ledvin nebo karcinom ledviny/urotelu
- 3.1.4 Literatura
- 3.2 Kritéria pro výběr nebo odmítnutí dárce
- 3.2.1 Komorbidity
- 3.2.2 Kardiovaskulární onemocnění
- 3.2.2.1 Onemocnění srdce
- 3.2.2.2 Onemocnění periferních arterií
- 3.2.2.3 Diabetes mellitus
- 3.2.3 Věk
- 3.2.4 Riziko recidivy (pův. onemocnění ledviny)
- 3.2.5 Riziko infekce
- 3.2.6 Literatura
- 3.3 Transplantace v těhotenství
- 3.3.1 Životnost graftu
- 3.3.2 Plánování rodičovství
- 3.3.3 Aplikace imunosupresiv
- 3.3.4 Kontrolní vyšetření
- 3.3.5 Sledování
- 3.3.6 Literatura
- 3.1 Předtransplantační terapie
1. ÚVOD
V evropských státech existují různé národní i lokální databáze obsahující údaje týkající se onemocnění ledvin v terminálním stadiu (ESRD) a transplantace ledvin. Jedinou celoevropskou organizací zabývající se touto problematikou je EDTA-ERA (The European Dialysis and Transplant Association-European Renal Association).
Nejnovější údaje nasvědčují tomu, že v průběhu několika posledních desítek let došlo ve všech evropských státech ke zvýšení počtu čekatelů na transplantaci ledviny, ačkoliv mezi jednotlivými státy existují mírné rozdíly. Užívání odlišných terapeutických modalit a kritérií pro výběr pacientů (zejména s ohledem na léčbu starších pacientů s výskytem komorbidit) v jednotlivých státech komplikuje srovnávání funkce transplantátu a míry přežití. Obvyklým trendem ve všech rozvinutých zemích je v současné době zvýšení počtu žijících dárců a indikace transplantace také u pacientů starších 65 let.
Nejčastější příčinou ESRD je diabetická nefropatie, těsně následovaná vaskulárními nefropatiemi, glomerulonefritidou, polycystickým onemocněním ledvin a intersticiální nefritidou – poslední tři uvedená onemocnění jsou méně častá a jejich incidence se v průběhu času významně nezměnila.
Za nejvhodnější léčbu pacientů s ESRD se v současné době považuje transplantace ledviny, která ve srovnání s dialýzou poskytuje benefit s ohledem na krátkodobé i dlouhodobé přežití. Nelze však opomíjet fakt, že doposud nemáme k dispozici dlouhodobé údaje týkající se sledování pacientů užívajících nové formy imunosupresiv, jako jsou například mykofenolát mofetil (MMF), tacrolimus (TAC) a sirolimus. Lze očekávat, že v oblasti vývoje non-nefrotoxických selektivních imunosupresiv indikovaných u pacientů po transplantaci dojde v následujících letech k významným pokrokům.
Vzhledem k odlišným postojům a metodám užívaným při transplantaci ledviny v jednotlivých evropských státech představují tato guidelines pouze obecného rádce, který nemůže zohledňovat legislativu jednotlivých států.
2. DÁRCOVSTVÍ LEDVINY
2.1 Technika explantace
2.1.1 Technika odběru orgánu od zemřelého dárce
Doporučení pro transplantaci ledviny od zemřelého dárce
- Při odběru většího počtu orgánů (tzv. multiorgánový odběr) se doporučuje vyjmout ledvinu až jako poslední. Nezbytným krokem je vhodné zavedení kanyly do aorty umožňující perfuzi studeným roztokem in-situ (úroveň důkazu: B).
- Po odběru jater a orgánů uložených v hrudníku se doporučuje (v případě, že máme svolení k odstranění pankreatu) en-bloc odběr ledviny a slinivky a jejich oddělení na „backtable“ (úroveň důkazu: B). En-bloc odběr všech intraabdominálních orgánů a en-bloc abdominální eviscerace umožňují předejít teplé ischemii a trakčnímu poranění cévního řečiště (úroveň důkazu: B).
- Odběr většího počtu orgánů (tzv. multiorgánový odběr) vyžaduje perfektní koordinaci a spolupráci všech operačních týmů (úroveň důkazu: B).
Dobu nezbytnou pro získání solidního orgánu je třeba minimalizovat tak, abychom zabránili zbytečnému ischemickému poškození. Odběr ledviny obvykle následuje po vyjmutí srdce, plic, jater a pankreatu. Dále je třeba zdůraznit následující body:
- Před zahájením odběru orgánu jsou infuzí aplikovány 3 l UW roztoku (University of Wisconsin).
- Otevření Gerotovy fascie umožní obnažení ledviny a ochlazení jejího povrchu. Během odběru srdce a perfuze chladného roztoku umístíme do dutiny břišní ledovou tříšť, s jejíž pomocí ochladíme povrch jater, ledvin a pankreatu.
- Po odběru srdce
(před odstraněním jater) je třeba zajistit následující:
- Aortální kanyla by neměla být zavedena dále než po ústí renálních arterií. V opačném případě není zajištěna adekvátní perfuze ledvin, což může zbytečně vést k teplé ischemii.
- V případě, že horní mesenterická arterie nebyla odstraněna spolu s arteria coeliaca zásobující játra, můžeme horní část zbývající aorty znovu zasvorkovat a tak umožnit kontinuální perfuzi a ochlazení ledvin během odběru jater. Odstranění horní mesenterické arterie může zabránit zavedení zahnutého disektoru tangenciálně ke zbývajícímu segmentu aorty. Ačkoliv tento postup umožní kontinuální perfuzi ledviny, existuje zde riziko okluze ústí renální arterie (zejména na pravé straně).
- Při přerušení vena cava mezi játry a ledvinami je třeba dbát na to, abychom nezpůsobili poranění pravé renální žíly. Pravá renální žíla totiž může často před ústím do vena cava probíhat superiorně, což může být příčinou jejího neúmyslného přerušení. Vzhledem k tomu, že při transplantaci jater je nezbytné resekovat také segment infrahepatické oblasti vena cava, je nezbytné upozornit tým provádějící odběr ledviny na ponechání dostatečného pahýlu vena cava a na potenciální riziko poranění pravé renální arterie.
- V případě, že jsme obdrželi svolení k odběru slinivky, učiníme tak před vyjmutím ledvin. Při preparaci slinivky opět hrozí riziko poranění levé renální žíly. Obvykle se provádí en-bloc odběr jater a slinivky (v některých případech také ledvin), orgány jsou následně odděleny na „backtable“.
Před transplantací, zejména v případě odběru většího počtu orgánů, není nutné provádět rozsáhlou mobilizaci ledvin. Při retroperitoneální preparaci může dojít k poranění aberantních renálních arterií, které má za následek neúplnou perfuzi a teplou ischemii ledvin.
Preparaci provádíme kraniálně a co nejvíce posteriorně. Linii preparace udržujeme na úrovni paraspinálních svalů. Gerotovu fascii ponecháme připojenu k ledvinám. Nadledviny nad horním pólem ledviny ponecháme intaktní, připojeny k ledvinám. Ledviny odstraníme en-bloc, bez předchozí identifikace struktur hilu.
Na „backtable“ je nutné identifikovat aberantní renální arterie, které mohou pocházet z iliackých arterií nebo distální či superiorní části aorty. Segment aorty ponecháme intaktní. Následně prozkoumáme délku, počet a velikost močovodů.
Před zabalením doporučujeme proplachovat ledvinu tak dlouho, dokud nejsou ve vytékajícím perfundovaném roztoku žádné známky krve.
V případě, že neprovádíme odběr jater, můžeme do aorty zavést perfuzní kanylu se dvěma balónky, která umožní selektivní renální perfuzi. Do dolního úseku vena cava zavedeme katétr, kterým během perfuze odtéká z ledviny žilní krev. Dále můžeme mobilizovat pravou část kolon, čímž odhalíme pravou ledvinu, vena cava inferior a spodní segment aorty. Následně identifikujeme a provedeme podvaz dolní mesenterické arterie a žíly, přerušíme splanchnické nervy, čímž umožníme mobilizaci levé části mezokolon a odhalíme levou ledvinu. Identifikujeme, podvážeme a přerušíme célický kmen.
Abychom minimalizovali proplach jater, můžeme zasvorkovat hepatoduodenální ligamentum.
V případě, že je dárce mladší než 3–4 roky, musí operatér zkontrolovat, zda aortická kanyla nezpůsobuje okluzi ústí renálních arterií.
Díky zdokonalení technik odběru orgánů od zemřelých dárců (NBHDs – dárci bez srdeční akce) je v současné době možné použít také orgány, které by dříve nebyly posouzeny jako vhodné k transplantaci. Zprávy o úspěšné funkci orgánů získaných tímto způsobem [5–6] vedly k rozvoji různých technik aortické infuze [7–9]. Tyto metody odběru umožnily získat orgány od NHBDs pacientů v zemích, jejichž legislativa nezahrnuje diagnózu mozkové smrti [10].
Zdokonalení technik odběru většího počtu orgánů [1–3] vyžaduje dobrou koordinaci a spolupráci jednotlivých operačních týmů [4]. Organizaci logistiky a plánování explantace orgánů by měl mít rutinně na starosti místní transplantační koordinátor.
2.1.2 Žijící dárce
Doporučení pro dárcovství ledviny od žijícího dárce
- Transplantace orgánu od žijícího dárce dosahuje vyšší míry úspěšnosti než transplantace orgánu ze zemřelého dárce. Dárcovství orgánů od žijících dárců umožňuje některým pacientům předejít dlouhým čekacím dobám, nebo dokonce dialýze (úroveň důkazu: B).
- Všichni potenciální dárci musí povinně podstoupit vyšetření renální funkce nezávislým nefrologem.
- Je vhodné, aby dárce podstoupil psychiatrické nebo nezávislé hodnocení motivace, způsobilosti a porozumění rizikům spojených s operací (úroveň důkazu: B).
- Zodpovědností operatéra je zajistit následující: dárce musí být fyzicky i psychicky způsobilý k operaci, orgán určený k transplantaci musí být v dobrém stavu a příjemce transplantátu by měl mít racionální očekávání týkající se výsledku operace.
- Odběr ledviny pomocí transperitoneálního přístupu je ve srovnání s jinými alternativami přístupu spojen s vyšší incidencí intestinálních komplikací a komplikací postihujících slezinu (2,3 %).
- Otevřená nefrektomie (u dárce) by se měla provádět pomocí extraperitoneálního přístupu – pomocí subkostální či dorsální lumbotomie.
- Laparoskopickou nefrektomii u dárce (trans nebo retro peritoneální) by měl provádět pouze zkušený operatér, který podstoupil adekvátní nácvik.
V současné době pochází 20–25 % ledvin užívaných při transplantaci od žijících dárců, ve většině případů existuje mezi dárcem a příjemcem orgánu genetická příbuznost. U malého (ale stále se zvyšujícího) počtu případů však dárce a příjemce nejsou v geneticky příbuzenském vztahu – obvykle se jedná o manželky, přátele a další jedince, kteří jsou k příjemci citově vázáni. Etická guidelines kladou následující dvě podmínky – dárce nesmí být k tomuto činu žádným způsobem přinucen a darování orgánu nesmí být motivováno finanční odměnou. Žijící dárce je považován za „dar z nebes“ [11], transplantace od žijícího dárce by měla být podporována vždy, když je vhodný dárce k dispozici (tab. 1).
Tab. 1. Výhody transplantace orgánu od žijícího dárce. 
2.1.2.1 Vyšetření
Vyšetření potenciálního dárce provádí nezávislý lékař. Toto vyšetření zahrnuje odebrání kompletní anamnézy, fyzikální vyšetření, běžné laboratorní testy, serologické vyšetření na přítomnost Epstein-Barr viru (EBV), viru herpes, cytomegaloviru (CMV), viru lidského imunodeficitu (HIV), viru hepatitidy typu B (HBV) a hepatitidy typu C (HCV). Součástí běžného vyšetření je rozbor a kultivace moči a 24hod. sběr moči za účelem zjištění clearance kreatininu a exkrece proteinů. V případě pochybností o přítomnosti hraniční hypertenze je vhodné měření krevního tlaku opakovat alespoň třikrát (optimálně desetkrát) při různých příležitostech.
Dále je nezbytné provedení renální arteriografie s vylučovací fází, která umožní vizualizaci celého vývodného systému.
Tento druh vyšetření lze provádět ambulantně. V některých centrech se namísto běžné angiografie užívá spirální CT. Také provádění angiografie pomocí magnetické rezonance (MR) začíná nabývat na významu.
Potenciální dárci mohou být klasifikováni jako nevhodní z celé řady důvodů (tab. 2). Potenciální dárci z řad sourozenců, kteří trpí diabetem, by měli podstoupit 5hod. test tolerance glukózy, ve vzorku 24hod. sběru moči navíc nesmí být žádné známky proteinurie. Nevysvětlitelná mikroskopická hematurie může být známkou onemocnění ledviny. Další kontraindikaci představuje anamnéza tromboembolie nebo tromboflebitidy, která u dárce zvyšuje riziko vzniku plicní embolie. Dárcovství je absolutně kontraindikováno také u pacientů se závažným onemocněním srdce a anamnézou maligní neoplazie. Relativní kontraindikaci představuje váha pacienta přesahující ideální hmotnost o více než 30 %.
Tab. 2. Vylučovací kritéria pro žijící dárce. 
Pacienti trpící psychiatrickými poruchami by měli podstoupit důkladné psychiatrické vyšetření, které prokáže, že dárce rozumí podmínkám navrhované procedury a souhlasí s nimi.
V případě, že vyšetření cévního zásobení a drenážního systému prokáže přítomnost jakékoliv abnormality, je třeba posoudit závažnost rizika, kterému budou dárce i příjemce vystaveni. U pacientů, kteří mají jednu ledvinu menší nebo u nichž je přítomna jakákoliv abnormalita, je vždy ponechána „lepší“ ledvina.
2.1.2.2 Předoperační opatření
Před zahájením zákroku vyšetří pacienta anesteziolog a tým zabývající se problematikou řešení bolesti. Ačkoliv se doporučuje kůži dezinfikovat již před operací, ochlupení oholíme až těsně před provedením incize.
2.1.2.3 Operační techniky nefrektomie u žijícího dárce
Existuje několik způsobů odběru ledviny od žijících dárců, volba závisí na zkušenosti operatéra a osobních preferencích [12–14]:
- klasický transperitoneální přístup – skrze incizi ve střední čáře, nebo vlevo či vpravo subkostálně
- sub/suprakostální extraperitoneální přístup (vlevo nebo vpravo)
- dorsální lumbální přístup, při němž se incize provádí pod dvanáctým žebrem prostřednictvím resekce dvanáctého žebra, nebo nad dvanáctým žebrem (extraperitoneálně, extrapleurálně)
- laparoskopický přístup, který může být transperitoneální nebo retroperitoneoskopický
Transperitoneální přístup se při odběru ledviny užívá nejčastěji v USA a Skandinávii. Operační fáze zhruba odpovídají stadiím transperitoneální nefrektomie prováděné při léčbě benigních i maligních onemocnění ledvin. Ve 2,3 % případů je z důvodu poranění sleziny, k němuž dochází během preparace kolon, nezbytné provedení splenektomie [15–17]. Transperitoneální přístup je spojen se signifikantně vyšší mírou intestinálních komplikací, jako je např. ileus (funkční, nebo dokonce obstrukční).
Vzhledem k větší délce levé renální žíly většina evropských transplantačních center doporučuje při transplantaci ledviny od žijícího dárce odebrat ledvinu z levé strany. Anesteziolog zvýší před provedením incize u dárce diurézu, která je obvykle řešena aplikací 25 g manitolu. Arteriální spasmus lze uvolnit zevní aplikací papaverinu.
Laparoskopický odběr ledviny představuje méně traumatickou techniku, která je spojena s menší bolestivostí a kratší dobou hospitalizace. Tento zákrok navíc zvyšuje počet potenciálních dárců, kteří si přejí pomoci svým drahým.
Během laparoskopického zákroku je nutné brát v úvahu následující opatření:
- Příprava pacienta. Odběr orgánu pomocí laparoskopické techniky (zejména preparace renálního pediklu) vyžaduje speciální podmínky – dostatečné množství tekutin a infuzi manitolu, které zajistí maximální renální funkci během zákroku i v pooperační fázi.
- Poloha pacienta na operačním stole. Pacient je umístěn na operačním stole s podloženou oblastí pravé nebo levé ledviny. Při laparoskopickém zákroku je vzhledem k delší levé renální žíle vhodnější odběr levé ledviny, na pravé straně může navíc preparaci komplikovat přítomnost jater.
- Transperitoneální laparoskopický přístup. Transperitoneální přístup nabízí operatérovi více pracovního prostoru. Přístup k ledvině získáme preparací levého kolon a peritonea v různém rozsahu. Přístup k renální arterii komplikuje její umístění za renální žílou. Po přerušení cevních spojek lze ledvinu snadněji vyjmout skrze dolní umbilikální incizi.
- Retroperitoneální přístup. Retroperitoneální přístup umožňuje snadnou a okamžitou identifikaci renální arterie a přímý přístup k větvím renální žíly. Hlavní nevýhoda této techniky spočívá v tom, že neumožňuje dostatečný prostor pro provedení extrakce a navíc zabraňuje užití speciálních sáčků („endobags“) k rychlému vyjmutí ledviny.
2.1.2.4 Pooperační péče
Klíčovou roli při prevenci výskytu pooperačních komplikací, jako jsou například atelektáza a pneumonie, hraje vhodná aplikace analgetik po zákroku [18–20]. Výskyt infekce je nutné minimalizovat pomocí vhodné profylaxe antibiotiky. V rámci prevence trombózy hlubokých žil dolních končetin doporučujeme podkožní aplikaci heparinu, užívání punčoch a speciálních kompresních zařízení. Většina pacientů je schopna orálně přijímat stravu již druhý nebo třetí den po operaci. Dárci jsou obvykle propuštěni po 2–6 dnech. Po operaci doporučujeme pravidelně kontrolovat renální funkci dárce. Dárci obvykle zaznamenají 25% zvýšení hladiny kreatininu v séru – hladina by se měla vrátit k normálu přibližně po třech měsících.
Neexistují žádné přesvědčivé důkazy, které by prokazovaly, že dárci jsou po vyjmutí ledviny vystaveni jakémukoliv dlouhodobému riziku spojenému s dárcovstvím. Přesto doporučujeme provádět u těchto pacientů pravidelné kontroly (toto vyšetření může provádět i praktický lékař).
2.1.3 Literatura
1. Starzl TE, Hakala TR, Shaw BW Jr, Hardesty RL, Rosenthal TJ, Griffith BP, Iwatsuki S, Bahnson HT. A flexible procedure for multiple cadaveric organ procurement. Surg Gynecol Obstet 1984;158(3):223 – 230.
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&list_uids=6367113& dopt= Abstract&itool=iconabstr
2. Starzl TE, Miller C, Broznick B, Makowka L. An improved technique for multiple organ harvesting. Surg Gynecol Obstet 1987;165(4):343–348.
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&list_uids=3310285& dopt= Abstract&itool=iconabstr
3. Starzl TE, Iwatsuki S, Shaw BW, Gordon RD. Orthotopic liver transplantation in 1984. Transplant Proc 1985;17 : 250.
4. Lucan M. Textbook of Surgical Urologic Techniques (Romanian), (ed.) Bucuresti: Infomedica, 2001, pp. 528–536.
5. Ruers TJ, Vroemen JP, Kootstra G. Non-heart beating donors: a successful contribution to organ procurement. Transplant Proc 1986;18 : 408.
6. Casavilla A, Ramirez C, Shapiro R, et al. Orthotopic liver transplantation in 1984. Transplantation 1995; 59 : 197–203.
7. Yland M, Anaise D, Ishimaru M, Rapaport FT. New pulsatile perfusion method for non-heart-beating cadaveric donor organs: a preliminary report. Trans-plant Proc 1993;25(6):3087–3090.
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&list_uids=8266463& dopt= Abstract&itool=iconnoabstr
8. Matsuno N, Kozaki M, Sakurai E, Uchiyama M, Iwahori T, Kozaki K, Kono K, Tanaka M, Tamaki T, Tamaki I. Effect of combination in situ cooling and machine perfusion preservation on non-heartbeating donor kidney procurement. Transplant Proc 1993; 25(1 Pt 2);1516–1517.
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&list_uids=8442171& dopt= Abstract&itool=iconnoabstr
9. Anaise D, Smith R, Ishmaru M, Waltzer WC, Shabtai M, Hurley S, Rapaport FT. An approach to organ salvage from non-heart-beating cadaver donors under existing legal and ethical requirements for transplantation. Transplantation 1990;49(4):290–294.
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&list_uids=2305458& dopt= Abstract&itool=iconabstr
10. Ericzon BG, Lundgren G, Wilczek H, Groth CG. Experience with human liver grafts obtained after donor cardiac standstill. Transplant Proc 1987;19(5): 3862–3863.
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&list_uids=3313948& dopt= Abstract&itool=iconnoabstr
11. Kuss R, Bourget P. In: An illustrated History of Organ Transplantation: The Great Adventure of the Century. Rueil-Malmaison, France: Sandoz, 1992.
12. Lucan M, Rotariu P, Iacob G, Ghervan L, Lapusan Carmen, Sarb D. Renal grafts with anatomic anomalies – a solution to extend the pool of living donors. Abdominal Organ Transplantation From Living Donors: State of the Art, 21–23 June, 2002, Gubbio, Italy. Abstracts volume, p. P85.
13. Lucan M. Actualities in renal transplantation. In: Dragomirescu C, Popescu I. Actualities in Surgery (Romanian). Celsius, Bucuresti: Celsius, 1998, pp. 243–250.
14. Lucan M. Experience with living donor renal transplantation in Romania. (German) In: Fahlenkamp D, Schonberger B, Tufveson GA, Loening SA (eds). Podium Urologie, Band 3, Living Donor-Renal transplantation. Berlin: Blackwell Wissenschafts–Verlag, 1997, pp. 151–158.
15. Waltzer WC, Engen DE, Stanson AW, Sterioff S, Zincke H. Use of radiographically abnormal kidneys in living-related donor renal transplantation. Nephron 1985;39(4):302–305.
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&list_uids=3885061& dopt= Abstract&itool=iconabstr
16. Ruiz R, Novick AC, Braun WE, Montague DK, Stewart BH. Transperitoneal live donor nephrectomy. J Urol 1980;123(6):819–821.
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&list_uids=7381994& dopt= Abstract&itool=iconabstr
17. Novick AC. Surgery of Renal Transplantation and Complications. Vascular Problems in Urologic Surgery. Philadelphia: WB Saunders, 1983.
18. Lucan M. (ed.) [Textbook of Surgical Urologic Techniques], Bucuresti: Infomedica, 2001, pp. 1111–1114 [Romanian].
19. Yanaga K, Podeta LG, Broznick B, Shapiro R, Stieber A, Makowka L. Multiple organ recovery for transplantation. In: Starzl TE, Shapiro R, Simmons RL. (eds.) Atlas of Organ Transplantation. New York: Gower 1992, pp. 1–49.
20. Eklund B, Eklund P, Lindfors O, Lindstrom BL. Living donor nephrectomy: surgical aspects. Scand J Urol Nephrol 1981;64 : 157–161.
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&list_uids=6755675& dopt= Abstract&itool=iconabstr
2.2. Zachování orgánu
Doporučení pro zachování orgánu
- Roztok Euro-Collins (EC) se užívá pouze při odběru orgánů od žijících dárců a v případě, že je u zemřelého dárce k odběru určena pouze ledvina (úroveň důkazu: B).
- Při odběru většího počtu orgánů doporučujeme užívat roztok UW. Tento roztok představuje nejvhodnější způsob zachování jater, užívání UW roztoku je navíc spojeno se signifikantně vyšší incidencí okamžité funkce ledviny (77 % při užívání UW vs. 67 % při užívání EC) (úroveň důkazu: A).
2.2.1 Roztoky pro uložení ledviny
Hlavní složku moderních roztoků určených k uložení ledviny [1–6] představují rozpustné látky nepronikající skrze semipermeabilní membránu, jako jsou například fosfáty, laktobionáty, glukóza, sacharóza nebo rafinóza, které zabraňují vzniku otoku vyvolaného hypotermií. Doposud však nebylo dosaženo konsenzu s ohledem na další, méně významné složky roztoku, jako jsou například pufry zabraňující vzniku acidózy, redukční agens minimalizující poškození vzniklé oxidačními procesy při reperfuzi, prekurzory nukleotidu adeninu umožňující regeneraci vysokoenergetických fosfátů po revaskularizaci a konečně draslík a hořčík zabraňující úbytku buněčných kationtů.
Mezi nejznámější roztoky z této skupiny patří Sacksův roztok [7], Rossův a Marchallův roztok [8] a fosfáto-pufrová sacharóza [9]. Při proplachování orgánů se v současné době doporučuje užívat UW roztok – ten představuje nejlepší prostředek pro zachování jater a led-vin odebraných při multiorgánovém odběru.
2.2.2 Metody uchování ledviny
V současné době existují dvě metody pro zachování ledviny:
- neustálá hypotermická perfuze (tento postup není v současné době nezbytný, pokud se nejedná o NHBD dárce)
- propláchnutí orgánu po jeho vyjmutí a uložení do ledové tříště
2.2.3 Vhodná doba uchování ledviny
Doba studené ischemie by měla být co nejkratší. Zachování orgánů závisí zejména na hypotermických technikách, které byly vyvinuty s cílem snížit rychlost metabolismu, uchovat zásobu adenosin trifosfátu a předejít vzniku volných kyslíkových radikálů během reperfuzní fáze. Maximální doba studené ischemie bude kratší u méně vhodných dárců a dárců ve vyšším věku.
2.2.4 Literatura
1. Beltzer FO, Ashby BS, Dunphy JE. 24-hour and 72-hour preservation of canine kidneys. Lancet 1967; 2(7515):536-538.
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&list_uids=4166894& dopt= Abstract&itool=iconnoabstr
2. Collins GM, Bravo-Shugarman M, Terasaki Pl. Kidney preservation for transportation. Initial perfusion and 30 hours’ ice storage. Lancet 1969;2(7632): 1219-1222.
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&list_uids=4187813& dopt= Abstract&itool=iconnoabstr
3. Cofer JB, Klintmalm GB, Morris CV, Solomon H, Watemberg IA, Husberg BS, Jennings LW. A prospective randomized trial between Euro-Collins and University of Wisconsin solutions as the initial flush in hepatic allograft procurement. Transplantation 1992;53(5):995-998.
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&list_uids=1585493& dopt= Abstract&itool=iconabstr
4. Opelz G, Terasaki PI. Advantage of cold storage over machine perfusion for preservation of cadaver kidneys. Transplantation 1982;33(1):64-68.
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&list_uids=7039024& dopt= Abstract&itool=iconabstr
5. Buhl MR, Jorgensen S. Breakdown of 5’-adenine nucleotides in ischaemic renal cortex estimated by oxypurine excretion during perfusion. Scand J Clin Lab Invest 1975;35(3):211-217.
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&list_uids=1153918& dopt= Abstract&itool=iconabstr
6. Kerr WK, Kyle VN, Keresteci AG, Smythe CA. Renal hypothermia. J Urol 1960;81 : 236-242.
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&list_uids=14408638& dopt= Abstract&itool=iconnoabstr
7. Sacks SA, Petritsch PH, Leong CH, Kaufmann JJ. Experiments in renal preservation: 48 and 72-hour canine kidney preservation by initial perfusion and hypothermic storage. J Urol 1974;111(4):434-438.
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&list_uids=4819364& dopt= Abstract&itool=iconnoabstr
8. Jablonski P, Howden B, Marshall V, Scott D. Evaluation of citrate flushing solution using the isolated perfused rat kidney. Transplantation 1980;30(4):239-243.
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&list_uids=7003841& dopt= Abstract&itool=iconabstr
9. Lam FT, Mavor AI, Potts DJ, Giles GR. Improved 72-hour renal preservation with phosphate-buffered sucrose. Transplantation 1989;47(5):767-771.
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&list_uids=2655211& dopt= Abstract&itool=iconabstr
2.3 Opatření pro podporu získávání orgánů od žijících dárců
Doporučení pro podporu získávání orgánů od žijících dárců
- Propast mezi počtem dárců a poptávkou čekatelů na transplantaci ledviny se neustále zvětšuje. Nabídka orgánů od zemřelých dárců nestačí pokrýt poptávku. Přesto se však počet žijících dárců (tj. pacientů, kteří jsou ochotni darovat orgán za svého života) zvyšuje. Ve Spojených státech dokonce počet ledvin transplantovaných ze žijících dárců přesáhl počet ledvin získaných od dárců zemřelých. Dárcovství orgánů žijícími dárci je třeba podporovat i v evropských státech (úroveň důkazu: C).
- Dárcovství orgánů představuje neocenitelný skutek, který je třeba vnímat jako dobročinný dar. Společnost by měla dárcům vyjádřit vděk (např. čestné vyznamenání, náhrada nákladů spojených s transplantací, nemocenská dovolená, prioritní přístup k orgánům při transplantaci, pojištění dárců), stejně jako je tomu u ostatních charitativních počinů, aniž by ohrozila dobrovolnou podstatu tohoto jednání (úroveň důkazu: C).
- Laparoskopická nefrektomie je spojena s nižší morbiditou, umožňuje rychlejší rekonvalescenci a lepší kosmetický výsledek. Tento přístup umožňuje zvýšit počet jedinců, kteří jsou ochotni darovat vlastní orgán, bez ohrožení dárcovy bezpečnosti či funkce alograftu (úroveň důkazu: C). Tuto metodu by měl provádět pouze zkušený a školený operatér.
- V případě, že legislativa povoluje párovou (zkříženou) výměnu orgánů, doporučujeme tuto metodu podporovat (pakliže máme k dispozici vhodné páry dárce/příjemce (úroveň důkazu: C).
Počet transplantací orgánů od žijících dárců lze zvýšit pomocí následujících tří způsobů:
- Medicínský způsob: laparoskopický odběr orgánů, párová (zkřížená) výměna orgánů, transplantace graftu s anatomickými abnormalitami (anomálie fúze močových cest), překonání pozitivní křížové zkoušky pomocí plazmaferézy a intravenózní aplikace imunoglobulinu
- Etický způsob: vyjádření respektu a ocenění dárců
- Organizační způsob: poskytnutí nemocenské dovolené pro dárce a refundace všech nákladů a ušlých zisků
2.3.1 Medicínské metody umožňující zvýšení počtu žijících dárců
2.3.1.1 Přijetí graftů s anatomickými anomáliemi
Vzhledem k nedostatku žijících dárců považuje většina expertních transplantačních center užívání graftu s anomáliemi, jako jsou například renální cysty, obstrukce uretero-pelvické junkce, solitární konkrementy > 1 cm, duplexní ureterální systém, mnohačetné arterie a žíly, za pouze relativní kontraindikaci pro transplantaci.
V případě, že dárce, který je v příbuzenském vztahu s příjemcem, má odpovídající imunologický profil korespondující s příjemcem a abnormální ledvinu, která představuje jediný dostupný orgán pro transplantaci, a potenciální příjemce nemůže dále fungovat na hemodialýze, doporučuje se transplantovat abnormální ledvinu a dárci ponechat ledvinu zdravou.
2.3.1.2 Laparoskopická nefrektomie u dárce (LLDN) – alternativní chirurgická metoda, která umožnila zvýšit počet žijících dárců
Laparoskopický přístup nabízí díky zvětšení, které umožňuje optický systém, a videokameře přesnější preparaci renálního pediklu (v případě, že zákrok provádí zkušený operatér). Pokud je navíc laparoskopická operace prováděna retroperitoneálním přístupem, je také rychlejší a přímočařejší (tab. 3) [7].
Tab. 3. Výhody a nevýhody laparoskopické nefrektomie při odběru ledviny od žijícího dárce. 
Menší rozměr incize určené k extrakci ledviny a její umístění v dolní části břicha má ve srovnání s klasickou otevřenou operací za následek významné zmírnění pooperační bolesti a minimalizaci traumatu břišní stěny, což vede k rychlejšímu a lepšímu hojení, rychlejší mobilizaci pacienta a jeho začlenění do běžného života. Pacienti jsou obvykle schopni již první den po operaci přijímat stravu perorálně, druhý den jsou schopni normálního stravování. LLDN je navíc spojena s o 30 % nižší aplikací analgetik. Rovněž potřeba perorální analgetické medikace je výrazně snížena.
Žádná retrospektivní studie srovnávající transplantaci ledviny (s ledvinou získanou laparoskopickým přístupem) se standardní otevřenou nefrektomiií neprokázala žádný statistický rozdíl mezi oběma přístupy. Populace byly s ohledem na shodu HLA, počet dárců v příbuzenském vztahu s příjemcem, výskyt diabetu, anamnézu předchozí transplantace, pohlaví a rasu srovnatelné.
Celkový výskyt komplikací u dárce při laparoskopickém přístupu je srovnatelný s otevřenou operací. 1,5–2% míra výskytu závažných komplikací se ještě snižuje s narůstající zkušeností operačního týmu. Americké i evropské studie uvádějí, že náklady na laparoskopickou nefrektomii převyšují cenu otevřené operace o 200–400 $. Pacienti podstupující laparoskopický zákrok jsou však schopni návratu do zaměstnání o 17 dní dříve než pacienti po otevřené operaci. Zaměstnavatel tak ušetří více než 4000 $ na jednom zaměstnanci.
Díky zavedení laparoskopického přístupu zaznamenala řada transplantačních center více než 100% zvýšení počtu dárcovství ledviny od žijícího dárce. Laparoskopická nefrektomie umožňuje ve srovnání s běžnou otevřenou operací rychlejší rekonvalescenci, lepší kosmetický výsledek a je spojena s menší bolestivostí po zákroku. Pokud operaci provádí zkušený operatér, nedochází ke zvyšování rizik pro dárce ani funkci graftu.
2.3.1.3 Plazmaferéza a intravenózní aplikace imunoglobulinu – záchranná terapie pro pozitivní „cross-match“ transplantáty ledvin od žijícího dárce
Pozitivní křížová zkouška může představovat nepřekonatelnou bariéru pro transplantaci ledviny. Existuje velká populace vysoce senzitivních pacientů, kteří mají pouze minimální naději na přijetí transplantátu. Někteří pacienti z této populace mají dokonce potenciálního žijícího dárce, který splňuje standardní transplantační kritéria, ale mezi pacientem a dárcem existuje pozitivní AHG (antihuman globulin) křížová zkouška.
Kombinace plazmaferézy a intravenózní aplikace imunoglobulinu ve cloně standardní dávky cyklosporinu, mykofenolátu mofetilu a steroidů vede k odstranění anti-HLA protilátek specifických pro dárce. Bylo prokázáno, že suprese B-buněk prostřednictvím aplikace MMF nebo sirolimu zajišťuje dobrou funkci graftu [8].
Je však třeba mít na paměti, že tato technika je stále ve fázi klinického hodnocení, neměla by tedy být u potenciálních příjemců ledvin od živých dárců obecně akceptována, dokud nebudeme mít k dispozici další důkazy.
2.3.2 Etické ocenění dárců
2.3.2.1 Čestné vyznamenání dárce
Zajímavým způsobem vyznamenání dárců orgánů by se mohl stát slavnostní obřad uspořádaný organizací zajišťující přísun orgánů pro transplantaci. Čestné vyznamenání, které by dárce obdržel z rukou vysoce postavené autority, a to jménem celé společnosti, by mohlo představovat vhodný způsob, jak vyjádřit vděk a uznání všem žijícím dárcům a rodinám dárců zesnulých [1,2].
2.3.3 Organizační metody pro podporu dárcovství orgánů
2.3.3.1 „Cross-over“ transplantace nebo párová (zkřížená) výměna orgánů
„Cross-over“ transplantace ledviny nebo párová (zkřížená) výměna je definována jako výměna orgánu mezi dvěma nebo třemi páry dárce – příjemce, kteří nemohou transplantaci uskutečnit přímo mezi sebou z důvodu nekompatibilní krevní skupiny nebo pozitivní křížové zkoušky. Mezi těmito jedinci se nakombinují nové páry dárce – příjemce tak, aby výsledná dvojice dárce – příjemce měla kompatibilní krevní skupinu a negativní křížovou zkoušku.
Dárce i příjemce zařazení do programu párové (zkřížené) výměny orgánu se odděleně zúčastní pohovoru, který umožní vyloučit případný nátlak ze strany čekatele na orgán [9]. Dále jsou informováni o benefitech a rizicích spojených s dárcovstvím; dárce podepíše informovaný souhlas. Všichni dárci podstoupí fyzikální a psychologické vyšetření bez ohledu na to, zda mezi dárcem a čekatelem existuje pokrevní příbuznost, nebo nikoliv. Upřednostnit je třeba výměnu mezi jedinci podobného věku s ledvinou podobné velikosti.
Od roku 1986, kdy Rapaport jako první představil koncept párové (zkřížené) výměny ledviny s cílem zvýšit počet transplantací od žijících dárců, byla tato technika aplikována v několika dalších státech – např. USA, Mexiku, Jižní Koreji a Japonsku. V Evropě se tato metoda využívá pouze výjimečně (např. ve Švýcarsku, Rumunsku, Rakousku).
Nekompatibilní krevní skupina a další imunologické překážky (např. pozitivní křížová zkouška) znemožnily transplantaci u řady jedinců, kteří chtěli poskytnout orgán svému partnerovi/ce nebo jinému členu rodiny.
Řešením tohoto problému je právě program pro párovou (zkříženou) výměnu orgánů, který umožňuje výměnu orgánů od dvou žijících dárců [3] nebo případně výměnu orgánů od jednoho žijícího a jednoho zemřelého dárce. V druhém případě, představeném v nedávné době v Nové Anglii, USA, daruje žijící dárce nekompatibilní se svým plánovaným příjemcem svůj orgán kompatibilnímu pacientovi, který je na čekací listině pro transplantaci ledviny ze zemřelého dárce, výměnou za což dostává původní plánovaný příjemce prioritu na čekací listině pro transplantaci ledviny ze zemřelého dárce. V tomto případě se uskuteční dvě transplantace za okolností, které by bez existence výměnného programu neumožňovaly ani jednu.
Při párové (zkřížené) výměně orgánů využívá čekatel na transplantaci benefit odběru orgánu ze žijícího dárce. Párová (zkřížená) výměna ledviny snižuje délku trvání dialýzy před zákrokem a umožňuje zvýšení počtu žijících dárců. Ve státech, kde představují žijící dárci hlavní zdroj orgánů pro transplantaci, je vhodné podporovat „cross-over“ transplantaci s cílem zvýšit počet transplantací. Program párové (zkřížené) výměny orgánů nabízí řešení v situacích, kdy pacient nemá k dispozici žádného vhodného dárce.
2.3.3.2 Nemocenská dovolená pro dárce orgánů
Při absenci ze zaměstnání, kterou vyžaduje hospitalizace a rekonvalescence po zákroku, dnes dárce orgánu riskuje újmu na zisku, a dokonce ztrátu zaměstnání [4]. V řadě států je pro všechny dárce orgánu uzákoněna třicetidenní placená nemocenská dovolená [5]. Dárce by v žádném případě neměl následkem svého činu utrpět žádnou osobní újmu.
2.3.3.3 Zajištění přístupu k orgánům pro dárce
Zdravotní stav dárce by měl být monitorován ve sledovacím protokolu, který umožní detekovat případný výskyt zdravotních komplikací spojených s dárcovstvím orgánu, k nimž by došlo v následujících letech [6]. Dárci by navíc měli disponovat nejvyšší prioritou na čekací listině v případě, že sami budou v budoucích letech vyžadovat transplantát.
2.3.3.4 Pojištění dárců
Legislativa by měla zahrnovat program poskytující životní a invalidní pojištění všem žijícím dárcům, který bude obsahovat mechanismus ochraňující dárce před případnými katastrofickými lékařskými výdaji vzniklými následkem vyjmutí orgánu.
2.3.4 Literatura
1. H.R. 708, Gift of life Congressional Medal Act of 2001 (U.S. Rep. P. Srak, Calif.).
http://search.hrsa.gov/search?q=Gift+of+life+Congressional+Medal+Act+of+2001&ie=&site=organ_donor&output=xml_no_dtd&client=my_frontend&lr=&proxystylesheet=my_frontend&oe=
2. S. 235, Gift of life Congressional Medal Act of 2001 (U.S. Sen. W. Frist, Tenn.).
http://search.hrsa.gov/search?q=Gift+of+life+Congressional+Medal+Act+of+2001&ie=&site=organ_donor&output=xml_no_dtd&client=my_frontend&lr=&proxystylesheet=my_frontend&oe=
3. Ross LF, Rubin DT, Siegler M, Josephson MA, Thistlethwaite JR Jr, Woodle ES. Ethics of a pairedkidney-exchange-program. N Engl J Med 1997;336(24): 1752-1755.
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&list_uids=9180096& dopt= Abstract&itool=iconnoabstr
4. Smith C. She saves mom, gets fired for it. Seattle Post-Intelligencer, November 22, 2001.
http://seattlepi.nwsource.com/local/47757_kidney22.shtml?searchpagefrom=1&searchdiff=762
5. Organ Donor Leave Act, H.R. 457, Pub. L. No. 106-56.
http://www.ncsl.org/programs/employ/Leave-medicaldonors.htm
6. Abecassis M, Adams M, Adams P, Arnold RM, Atkins CR, Barr ML, Bennett WM, Bia M, Briscoe DM, Burdick J, Corry RJ, Davis J, Delmonico FL, Gaston RS, Harmon W, Jacobs CL, Kahn J, Leichtman A, Miller C, Moss D, Newmann JM, Rosen LS, Siminoff L, Spital A, Starnes VA, Thomas C, Tyler LS, Williams L, Wright FH, Youngner S; The Live Organ Donor Consensus Group. Consensus statement on the live organ donor. JAMA 2000;284(22):2919-2926.
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&list_uids=11187711& dopt= Abstract&itool=iconabstr
7. Lucan M. (ed.) [Textbook of Surgical Urologic Techniques], Bucuresti: Infomedica, 2001, pp. 1111-1114. [Romanian]
8. Overview of the High PRA Rescue Protocol, University of Maryland Medicine web site, © 2001 University of Maryland medical system, Baltimore, USA.
http://www.umm.edu/transplant/kidney/highpra.html
9. Rapaport FT. The case for a living emotionally related international kidney donor exchange registry. Transplant Proc 1986;18(3 Suppl 2):5-9.
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&list_uids=3521001& dopt= Abstract&itool=iconnoabstr
2.4 Problém etiky v otázce transplantace
Doporučení týkající se etických otázek
- Každý jedinec má právo darovat i přijmout orgán (úroveň důkazu: B).
- Transplantace ledviny za úplatu je naprosto nepřijatelná, je v rozporu se zákonem a není podporována International Society of Transplation (úroveň důkazu: B).
- Vzhledem ke zvyšující se úspěšnosti transplantace orgánů od žijících dárců (soudě podle přežití pacientů a uchycení graftu) a nedostatku orgánů od zemřelých dárců je vhodné dárcovství orgánů od žijících dárců podporovat. Tato výzva je zčásti motivována přetrvávajícím nedostatkem orgánů od zemřelých dárců (úroveň důkazu: B).
- Žijící dárce musí podepsat informovaný souhlas, který lze získat pouze v případě, že dárce řádně porozumí všem rizikům – např. bolestivost, hernie (5 %), infekce (2 %), pneumothorax (5 %) a úmrtí (1 : 3000) (úroveň důkazu: B).
- S pacientem je třeba jednat jako s „klíčovou osobou“, a nikoliv jako s pouhým „prostředkem“. Respektování důstojnosti patří mezi základní lidská práva (úroveň důkazu: B).
- Vhodnost transplantace orgánu od žijícího dárce, který není s čekatelem spřízněn pokrevním poutem, musí nejprve schválit místní etická komise nebo, jak vyžaduje legislativa v některých státech, soud (úroveň důkazu: C).
- Co je a co není etické, je třeba posoudit na základě rovnováhy mezi klinickou poptávkou (záchrana života ekonomicky efektivním způsobem) a respektováním práva jedince darovat/nedarovat orgán v průběhu života/po smrti (úroveň důkazu: C).
2.4.1 Primární etické principy
Lékařská etika se řídí několika elementárními principy [1–4]. Ve snaze vyhovět všem principům současně často dochází v individuálních případech k různým konfliktům.
2.4.1.1 Aspekt dobročinnosti: vykonání dobrého skutku
Základním principem lékařské etiky je povinnost usilovat za každou cenu o pacientovo blaho. Ačkoliv dárce nezíská svým činem žádný fyzický prospěch, obecně se předpokládá, že psychosociální benefit žijícího dárce ospravedlňuje rizika související s dárcovstvím orgánu.
2.4.1.2 Zamezení riziku
Je nezbytné přesvědčit se o tom, že benefit a poškození, které může být spojeno se zákrokem, jsou v adekvátní rovnováze. Kvalifikované posouzení dárce a minimalizace rizika před uskutečněním dárcovství orgánu od živého dárce má tedy nesmírný význam.
2.4.1.3 Respektování pacientova rozhodnutí
Pacienti schopní porozumět příslušným informacím, posoudit jejich dosah a učinit rozumné rozhodnutí jsou považováni za svéprávné a jejich rozhodnutí darovat orgán k transplantaci je třeba respektovat.
2.4.1.4 Aspekt spravedlnosti: spravedlivá alokace orgánů
Aspekt spravedlnosti je významný zejména v případě, kdy poptávka daleko převyšuje nabídku. Alokace orgánů by měla probíhat na základě systému, v němž jsou pacientům přidělovány priority (metoda přidělování priorit pacientům by měla být morálně ospravedlnitelná). Vzácné zdroje je třeba obvykle alokovat pacientům z velké populace zájemců.
2.4.2 Transplantace orgánů od zemřelých dárců
V uplynulých letech došlo ke zvýšení počtu orgánů od žijících dárců. Velká většina dostupných orgánů však stále pochází od zemřelých dárců, dárců po mozkové smrti a dárců NHBD programu, který se v současné době užívá v řadě transplantačních center. Tato studnice však pomalu vysychá, což v kombinaci s neustále se zvyšujícím počtem čekatelů vyvíjí obrovský tlak na transplantační programy.
2.4.2.1 Zemřelý dárce
Ve většině států představuje zásadní překážku pro proces dárcovství opatření souhlasu. Proces získání formálního souhlasu k transplantaci od členů rodiny, případně od samotného pacienta v průběhu života, lze definovat jako „zařazení se“ do dárcovského programu. Pokud nebyl souhlas explicitně poskytnut, předpokládá se, že byl odepřen. V řadě evropských států však legislativa uvádí přesně opačný případ. V případě, že pacient před smrtí explicitně neuvede nesouhlas poskytnout po smrti orgány k transplantaci, předpokládá se, že byl souhlas získán.
Tato legislativa má pozitivní dopad na rozvoj dárcovství, na druhou stranu se může zdát, že narušuje práva jedince.
Čím zkušenější je osoba pověřená získáním souhlasu rodinných příslušníků (ať již se jedná o lékaře intenzivní péče, neurochirurga, transplantačního koordinátora nebo sociálního pracovníka), tím větší má šanci na jeho opatření. Intenzivista, který s rodinnými příslušníky pacienta probírá okolnosti mozkové smrti a jejích následků, by měl být schopen zodpovědět případné otázky týkající se dárcovství orgánu. Řadě klinických lékařů činí potíže hovořit s rodinnými příslušníky o otázce mozkové smrti, a jakákoliv rozpačitost na straně lékaře může mít negativní dopad na pacientovy příbuzné. K překonání tohoto problému mohou pomoci výukové programy, jako je například European Donor Hospital Education Programme – EDHEP, které lékařům poradí, jak zdokonalit taktiku potřebnou k získávání povolení k dárcovství orgánu od truchlících rodinných příslušníků. V některých státech se vedení nemocnice snaží obejít tuto neochotu zaváděním tzv. „povinné žádosti“ nebo „běžného dotazování“.
2.4.2.2 Alokace orgánů zemřelých dárců
Kdo je vlastně „majitelem“ orgánu zemřelého dárce a kdo rozhoduje o jeho přidělení – obě dvě otázky vyžadují jasnou definici [5]. Obecně se však předpokládá, že o přidělení nebo likvidaci orgánu by měl rozhodovat stát, který tento úkol svěřuje příslušnému transplantačnímu týmu [6].
Alokace orgánů ze zemřelých dárců na základě osobních charakteristik, jako jsou například rasa, vyznání nebo majetek příjemce, je v současné době naprosto nepřijatelná. Evropské systémy zaměřující se na dosažení maximálního užitku a prospěchu přidělují orgány na základě shody v HLA testování. Tyto systémy (např. Euro-transplant, UK Transplant) přidělují zájemcům prioritní body na základě délky čekací doby, shody a senzitizace. Všechny podobné systémy zabývající se alokací ledvin vhodným zájemcům by měly být dokonale transparentní a měly by podléhat pravidelné revizi.
2.4.3 Žijící dárci
Etický přístup k dárcovství orgánů je podmíněn pravidly, která se snaží být charitativní při současném zachování autonomie.
Vzhledem ke zvyšující se úspěšnosti transplantace orgánů od žijících dárců (soudě podle přežití pacienta a graftu) a nedostatku orgánů od zemřelých dárců byly transplantace orgánů od žijících dárců až donedávna považovány za politováníhodnou nezbytnost [8]. Kvůli chronickému nedostatku orgánů ze zemřelých dárců se však transplantace orgánů od žijících dárců staly přijatelnější. Výsledek transplantace orgánu od žijícího dárce je lepší než při transplantaci graftu od zemřelého dárce, zároveň je respektována nezávislost dárce. Dárcovství navíc představuje emocionálně naplňující skutek jak pro dárce, tak pro příjemce.
2.4.3.1 Finanční ohodnocení dobročinných dárců
Podstata transplantačních programů obvykle spočívá v dobrovolném dárcovství ledviny žijícími členy rodiny. Společnosti podporující rozvoj transplantace obvykle odmítají přisuzovat orgánu nebo tkáni jakoukoliv finanční hodnotu: dar orgánu k transplantaci je tedy penězi nezaplatitelný a evropská legislativa zakazuje jeho darování za úplatu.
Světová zdravotnická organizace uvádí, že lidské tělo a jeho části nemohou být předmětem peněžní transakce, uskutečňování a přijímání plateb by tedy mělo být zakázáno.
2.4.4 Literatura
1. Gillon R. Philosophical medical ethics. Chichester: Wiley, 1985.
2. Bierce A. The enlarged devil’s dictionary. London: Penguin, 1990.
3. Boyd KM, Higgs R, Pinching AJ. (eds.) The new dictionary of medical ethics. London: BMJ Publishing, 1997.
4. General Medical Council. Good medical practice. 2nd edn. London: GMC, 1998.
5. Andrews LB. My Body, My Property. Hastings Centre Rep 1986;16 : 28-38.
6. Dossetor JB. Ethics in transplantation. In: Morris P Jr (ed.) Kidney transplantation. 4th edn. Philadelphia: WB Saunders, 1994, pp. 524-531.
7. Sells RA, Johnson R, Hutchinson I. Recommendations on the use of living kidney donors in the United Kingdom. Br Med J 1986;293 : 257-258.
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&list_uids=3089478& dopt= Abstract&itool=iconabstr
2.5 Opatření podporující zvýšení počtu transplantací orgánů od zemřelých dárců
Propast mezi „poptávkou“ a „nabídkou“ ledvin pro transplantaci se ve všech evropských státech postupně zvětšuje. Zajímavou výjimku představují následující tři státy: Španělsko, Rakousko a Belgie. V těchto zemích přesahuje počet darovaných ledvin určených k transplantaci 40/milion obyvatel. Podle nejnovějších údajů získaných z registrů v těchto státech postačuje tento objem orgánů určených k transplantaci na pokrytí poptávky čekatelů na čekacích seznamech, ve Španělsku nabídka dokonce převyšuje poptávku [1].
Ve zbytku Evropy je míra transplantace orgánů ze zemřelých dárců prakticky stabilní nebo od roku 1989 klesá.
Tab. 4 uvádí počty transplantací ledvin v roce 2001 v různých evropských státech.
Tab. 4. Počty transplantací ledvin v roce 2001. 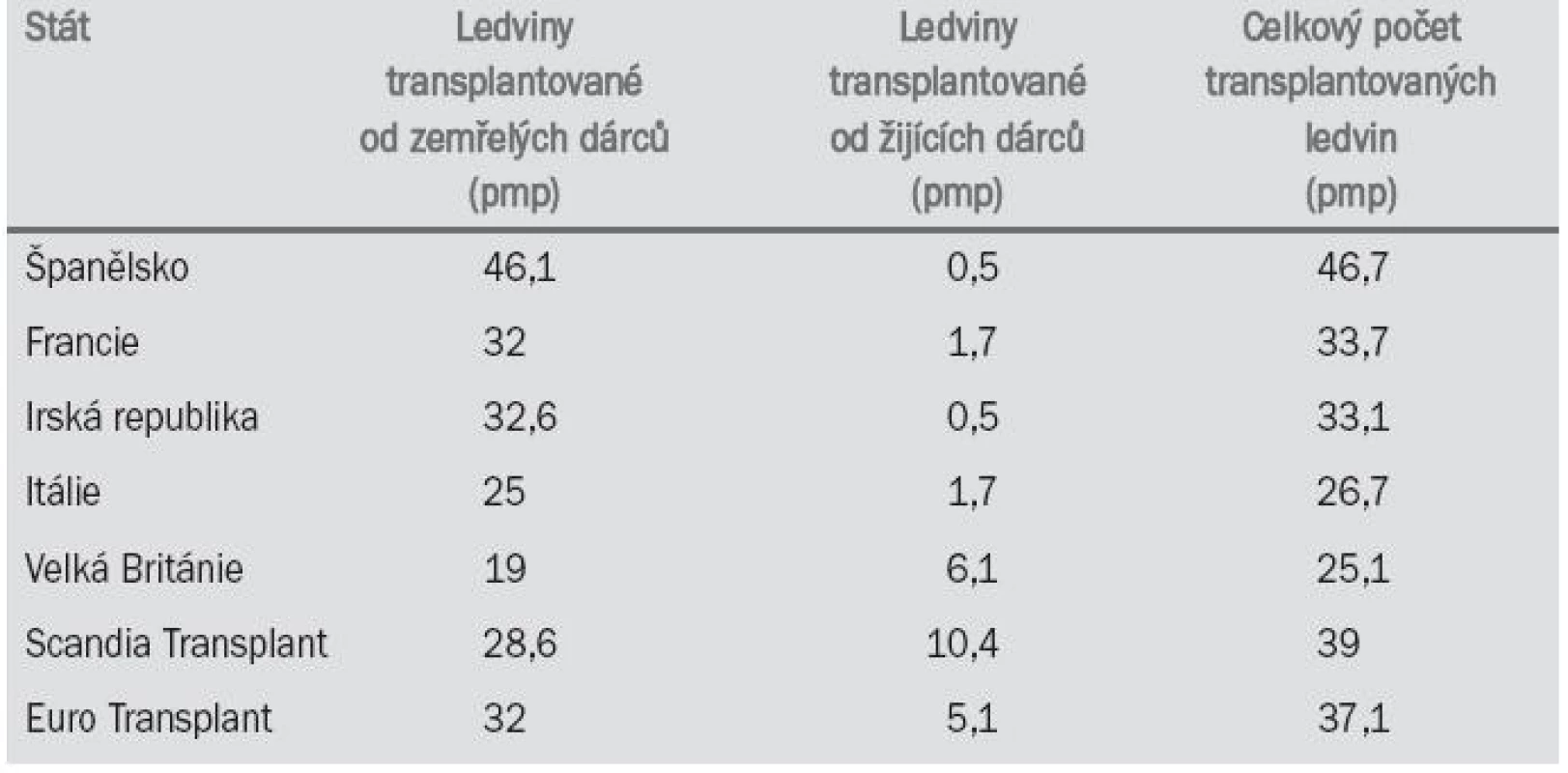
V devadesátých letech uplynulého století se objevila celá řada studií zaměřených většinou na jednotlivé státy a registry, které se pokoušely vyvinout metody, jak zvýšit počet dárců ledvin ze 6–10/milion obyvatel (pmp) až na 20–25 pmp. Tyto studie nasvědčují tomu, že těchto výsledků lze účinně dosáhnout, a ve většině případů je i překonat. Většina těchto studií byla zaměřena na jednotlivé iniciativy, jako je například změna legislativy týkající se transplantace, spíše než na vývoj integrovaných dárcovských programů. Dárcovství orgánu představuje komplexní fenomén závislý na řadě faktorů a interakcí, z nichž pouze některé lze univerzálně aplikovat ve všech evropských státech. V současné době naléhavě potřebujeme dobře designované studie. Dárcovství orgánu sestává z celého řetězce kroků a jeho výsledek závisí na nejslabším článku.
I v případě, že posílíme každý článek procesu dárcovství, musí být celý systém i jeho jednotlivé elementy v souladu s národními morálními a kulturními hodnotami.
V dokumentu zabývajícím se tématem transplantace ledviny, jako jsou tato guidelines, je poměrně snadné vymezit minimální standard, kterého by měly jed-notlivé státy dosáhnout. Obtížnějším úkolem se však jeví stanovit doporučení pro specifické aktivity zacílené na podporu dárcovství orgánů žijících dárců, o něž by se měly jednotlivé státy a profesionální organizace opírat. Přesto navrhujeme v další části guidelines následující možnosti.
2.5.1 První přístup: Zvýšení počtu orgánů žijících dárců
Transplantační centra ve Spojených státech a Norsku významně zvýšila dodávku transplantátů o více než 50 % orgánů získaných od pokrevních i nepokrevních dárců – tj. žijících dárců, které nepojí s příjemcem žádný příbuzenský vztah. Je pravděpodobné, že v USA k tomuto nárůstu žijících dárců přispěla možnost odběru orgánu pomocí laparoskopické nefrektomie, která je spojená s kratší dobou hospitalizace a kratší absencí v zaměstnání.
Ačkoliv se počet transplantací od žijících dárců postupně zvyšuje také v evropských státech, tuto míru lze dále zvýšit pomocí následujících přístupů:
- Nefrologové jak v transplantačních centrech, tak i v ostatních zdravotnických zařízeních by se měli snažit otázku dárcovství orgánu od žijícího dárce otevřeně projednat s rodinnými příslušníky pacienta s renálním onemocněním v konečném stadiu, optimálně před zahájením dialýzy. Tento postup umožňuje transplantovat orgán předtím, než je nutné přistoupit k dialýze, zvýšení míry transplantace a efektivnější využívání dialyzačních jednotek.
- Poradenská centra vedená kvalifikovanými sestrami nebo „koordinátory pro transplantaci orgánů od žijících dárců“ by měla případným zájemcům o transplantaci poskytovat informace týkající se screeningových testů a zařídit refundaci nezbytných výloh dárců v souladu se zákonem.
- Všechna transplantační centra by měla dodržovat dohodnutý screeningový protokol (predikované riziko mortality při dárcovství orgánů od žijících dárců nesmí přesáhnout 1/3000) [6].
- Pokud je tento postup v souladu se zákonem, je vhodné podporovat také transplantace orgánů od nepokrevních žijících dárců.
Doporučení
- Veřejní činitelé a zdravotnický personál by měli usilovat o zvýšení veřejného povědomí o možnosti darovat orgán rodinnému příslušníku a benefitech s dárcovstvím spojených.
- Každý nefrolog, který pečuje o ESRD pacienta, by měl v počátečním stadiu onemocnění informovat jeho rodinné příslušníky o možnosti dárcovství orgánu.
- Ke každé transplantační jednotce by měl být přidělen „koordinátor pro transplantaci orgánů od žijících dárců“ dozírající na náročný proces výběru dárce a lékařských vyšetření rodinných příslušníků.
2.5.1.1 Dárcovství orgánů od nepříbuzných žijících dárců
V mnoha evropských státech je dobrovolné „nepokrevní“ dárcovství ledviny povoleno zákonem v případě, že je prokázána dobrovolná povaha dárcovství a vyloučena jakákoliv finanční motivace [2]. Výjimku představuje Velká Británie, kde tento typ dárcovství podléhá kontrole „Unrelated Living Donor Regularory Authority“, která schvaluje všechny nabídky „nepokrevních“ dárců.
Doporučení
Dárcovství orgánů žijícími dárci (pokrevními i nepokrevními), pakliže je v souladu se zákonem, by mělo být podporováno.
2.5.1.2 „Non-directed“ transplantace orgánu od žijícího dárce
Různá americká centra podporují tzv. „non-directed“ transplantace orgánu od žijícího dárce, kdy dobrovolný dárce daruje orgán neznámému příjemci [3]. Ačkoliv je tento postup poněkud kontroverzní, není v rozporu s žádnými morálními ani společenskými principy. Zařazení tohoto typu dárcovství na seznam doporučení však komplikují různé etické a právní aspekty.
2.5.1.3 Finanční ohodnocení žijících dárců centrální organizací
Měli by dárci ledviny obdržet finanční ohodnocení od centrální organizace, která by měla na starost výběr vhodného příjemce?
Doporučení
Legislativa ve všech evropských státech v současné době zakazuje dárcovství orgánu za úplatu.
2.5.2 Druhý přístup: Zvýšení počtu transplantací orgánů od zemřelých dárců
2.5.2.1 Dárcovské karty
V řadě států jsou občané motivováni různými propagačními programy k pořízení dárcovských karet nebo k registraci v počítačovém registru dárců. Ve Velké Británii je v současné době v podobném registru zapsáno osm milionů obyvatel, zatímco 5–10 % populace upřednostňuje vlastnictví dárcovských karet. Přesto však z podobných iniciativ vzejde ročně pouze přibližně padesát dárců. Úspěšnost těchto programů, zvýšení počtu potenciálních dárců a zvýšení počtu transplantačních center závisí především na publicitě. Intenzivisté a transplantační koordinátoři by měli na základě těchto registrů akceptovat přání potenciálních dárců po jejich smrti.
Doporučení (úroveň důkazu: C)
Ve všech zemích, kde legislativa nepovoluje koncept „předpokládaného souhlasu“, je třeba dárce získat prostřednictvím dárcovských registrů nebo dárcovských karet.
2.5.2.2 Zlepšení organizace a rozšíření zdrojů
Zvýšení počtu transplantací orgánů od zemřelých dárců vyžaduje lepší organizaci příslušných služeb a podporu zdrojů. V řadě států (např. Velká Británie, Česká republika) mají v současné době jednotky intenzivní péče příliš malou lůžkovou kapacitu, takže počet dárců z řad pacientů JIP nepřevyšuje 20 pmp (případů na milion obyvatel). Ve státech s vyšším počtem dárců orgánů, jejichž JIP disponují větší kapacitou (např. Španělsko, Belgie), došlo k rozšíření personálu zodpovědného za dohled nad dárcovskými programy (tzv. transplantačních koordinátorů) a uvolnění potřebných finančních prostředků. Řada úspěšných vzdělávacích programů, jako je například EDHEP, nebo kontrolních programů (Donor Action), pomohla zvýšit povědomí lékařů JIP o významu dárcovství orgánů od zemřelých dárců a vyrovnat se s emocionálním napětím, které s sebou přináší řešení otázky dárcovství s rodinnými příslušníky pacienta. Transplantační koordinátoři nesou taktéž zodpovědnost za styk s veřejností, jejich úkolem je zabránit nepříznivé mediální publicitě. Koordinátoři jsou také ve styku s koronery.
Doporučení (úroveň důkazu: C)
Odborné organizace v jednotlivých státech by měly v případě nutnosti vyvíjet tlak na ministerstvo zdravotnictví s cílem udržet potřebný počet lůžek JIP, vytvořit skupinu transplantačních koordinátorů, získat finanční podporu pro vzdělávací programy pro lékaře JIP, jako je například EDHEP, a podporovat programy typu Donor Action.
2.5.2.3 Legislativa týkající se předpokládaného souhlasu („opting-out“)
Zavedení konceptu předpokládaného souhlasu, alespoň soudě podle dostupných údajů, vedlo ke zvýšení počtu transplantací orgánů od zemřelých dárců. Všechny evropské státy, kde počet dárců ledviny převyšuje 20 pmp/rok (Španělsko, Rakousko, Belgie a Česká republika), přijaly koncept předpokládaného souhlasu. Negativní publicita měla za následek omezení tohoto přístupu s následným snížením míry dárcovství. Ostatní evropské státy uplatňují „mírnější verzi“ předpokládaného souhlasu, která zohledňuje stanoviska rodinných příslušníků. Většina států uplatňujících koncept informovaného souhlasu nedosahuje tak dobrých výsledků – jedinou výjimku představují USA, kde míra dárcovství v současnosti přesahuje 25 dárců pmp.
Doporučení
Není v rámci možností těchto guidelines vytvořit doporučení týkající se tak zásadní změny, jakou je úprava zákonů týkajících se dárcovství orgánů od zemřelých dárců.
2.5.2.4 Kritéria pro výběr dárců
NHBDs (dárci bez srdeční akce): Před zavedením definice mozkové smrti v roce 1976 představovali NHBDs zdroj primárně nefunkčních orgánů a byli vyloučeni jako zdroj pro odběr ledviny pro transplantaci. Ve Velké Británii a Holandsku byla v poslední době u zemřelých pacientů vyvinuta metoda in-situ perfuze, která dosahuje povzbudivých výsledků. Ledviny lze napojit na přístroj zajišťující kontinuální perfuzi, kdy jejich použitelnost můžeme hodnotit pomocí průtokových parametrů a exkrece močových enzymů [4]. Legislativa schvalující princip předpokládaného souhlasu by pomohla zajistit daleko větší počet NHBDs vzhledem k tomu, že rychlou intra-arteriální studenou perfuzi by bylo možné zahájit již před příjezdem rodinných příslušníků do zdravotnického zařízení. Ve státech, kde legislativa podporuje informovaný souhlas, však zahájení perfuze bez svolení rodinných příslušníků představuje nežádoucí zásah. Na základě schválení koronera by bylo možné zahájit perfuzi i bez souhlasu rodinných příslušníků – tento postup by umožnil významné zvýšení počtu NHBDs.
Doporučení (úroveň důkazu: B)
Transplantaci orgánů od NHBDs je vhodné aktivně podporovat. Transplantační koordinátoři by měli zprostředko-vat možnost využít jako NHBDs také pacienty, kteří zemřou ihned po převozu na úrazové oddělení. V otázce právních důsledků je nutná konzultace s místním koronerem.
2.5.2.5 Starší dárci
Ačkoliv dlouhodobá míra přežití ledvin transplantovaných od starších dárců(> 60 let) je o 10–15 % nižší než u orgánů mladších dárců, můžeme zkrácením doby studené ischemie a pečlivější volbou dárců docílit lepších výsledků [5].
Doporučení
Při pečlivém výběru pacientů lze populaci dárců starších 60 let podporovat a považovat za vhodný zdroj pro transplantaci kadaverózních orgánů.
2.5.3 Literatura
1. Miranda B, Gonzalez Alvarez I, Cuenden N, Naya MT, De Felipe C. Update on organ retrieval in Spain. Nephrol Dial Transplant 1999;14(4):842-845.
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&list_uids=10328455&dopt= Abstract&itool=iconfft
2. Levinsky NG. Organ donation by unrelated donors. New Engl J Med 2000;343(6):430-432.
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&list_uids=10933744&dopt =Abstract&itool=iconnoabstr
3. Matas AJ, Garvey CA, Jacobs CL, Kahn JP. Nondirected donation of kidneys from living donors. New Engl J Med 2000;343(6):433-436.
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&list_uids=10933745&dopt =Abstract&itool=iconnoabstr
4. Balupuri S, Buckley P, Snowden C, Mustafa M, Sen B, Griffiths P, Hannon M, Manas D, Kirby J, Talbot D. The trouble with kidneys derived from the non heart-beating donor: a single centre 10-year experience. Transplantation 2000;69(5):842-846.
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&list_uids=10755537&dopt =Abstract&itool=iconabstr
5. Gridielli B, Remuzzi G. Strategies for making more organs available for transplantation. New Engl J Med 2000;343(6):404-410.
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&list_uids=10933740&dopt =Abstract&itool=iconnoabstr
6. The United Kingdom Guidelines for Living Donor Kidney Transplantation British Transplantation Society and the Renal Association. 2000.
http://www.cambridge-transplant.org.uk/program/ renal/lrdgui.pdf
2.6 Kritéria pro výběr a odmítnutí dárce ledviny
Doporučení pro výběr a odmítnutí ledviny od dárců se zachovanou srdeční akcí:
- Jakýkoliv subjekt (bez ohledu na věk) v kómatu po mozkové smrti je vhodné považovat za potenciálního dárce orgánů (úroveň důkazu: C).
- Souhlas rodinných příslušníků nebo partnerů k odběru orgánu musí být získán v souladu s národní legislativou a pravidly pro získávání souhlasu. Jedince, kteří v průběhu svého života odmítli darovat svůj orgán k transplantaci, je nutné ze seznamu potenciálních dárců vyloučit (úroveň důkazu: C).
- K transplantaci nelze využít žádný orgán, který je postižen potenciálně přenosnou patologií. Následující onemocnění lze považovat za kritéria pro zamítnutí dárce: infekční onemocnění, jako jsou HIV, nekontrolovaná sepse, tuberkulóza, akutní hepatitida, virová infekce neznámého původu a různé typy maligních neoplasmat. Mezi vylučovací kritéria patří také užívaní drog a v některých případech též podezření, že potenciální dárce provozoval v uplynulých dvou měsících nechráněný sex (úroveň důkazu: B).
- Pro příjemce je nutné zajistit transplantaci kvalitního orgánu. Každé transplantační centrum by mělo mít svá vlastní kritéria pro posouzení vhodnosti orgánu k transplantaci. V případě, že transplantační centrum užívá k transplantaci (s cílem rozšíření fondu dárců) také méně kvalitní orgány od starších dárců, je nutné u těchto potenciálních dárců posoudit jejich věk, stav vaskulárního řečiště, renální funkci a výskyt komorbidit. Za spodní hranici pro transplantaci ledviny se v současné době považuje clearance kreatininu > 60 ml/ min. V případě, že se clearance kreatininu u dárce pohybuje v rozmezí 60–50 ml/min, bývá potenciální dárce označován jako „marginální“. V případě clearance kreatininu < 50 ml/min nelze orgán užít pro „single“ transplantaci. Orgány nevhodné pro „single“ transplantaci je však možné použít při transplantaci dvou ledvin současně (tzv. duální transplantace). V tomto případě je nutné informovat pacienty na čekací listině, kteří musí uvést souhlas s přijetím ne zcela optimálního orgánu nebo případně dvojitého graftu (úroveň důkazu: B).
2.6.1 Diskuze
V případě, kdy zvažujeme subjekt v kómatu za potenciálního kadaverózního dárce, je nutná diagnóza mozkové smrti. U každého takového subjektu je nezbytné vyloučit přítomnost jakékoliv patologie, která by mohla být přenesena na příjemce orgánu. Dále je třeba se ujistit o tom, zda všechny orgány určené k transplantaci mají dostatečnou kvalitu.
V současné době není dárcovství orgánu omezeno žádnou věkovou hranicí. Dříve byly subjekty starší 55 let považovány za nevhodné pro dárcovství, celosvětový nedostatek orgánů pro transplantaci však vedl k tomu, že se v současné době užívají k transplantaci orgány také od starších kadaverózních dárců. Nejvýznamnější změnou, k níž došlo v uplynulých deseti letech s ohledem na věkové rozmezí dárců, je zvýšení horní věkové hranice dárců.
Krátkodobé výsledky transplantací ledvin od dárců starších 65 let jsou téměř srovnatelné s výsledky transplantací orgánů od mladších subjektů, dlouhodobá míra přežití graftu je však při tomto druhu transplantace horší [1]. Hlavní riziko pro „starší“ ledviny spočívá v delší době studené ischemie [2,3]. Moderní definice vhodného dárce má méně přísné požadavky na věkovou hranici, a naopak klade větší důraz na fyzický stav dárce, zejména na stav orgánu určeného k transplantaci, ve snaze snížit možnost vyřazení použitelného orgánu.
V současné době tedy věk potenciálních dárců není omezen žádnou absolutní hranicí. Vzhledem k častějšímu výskytu komorbidit u starších dárců je v této populaci nezbytné provedení pečlivého výběru a zajištění krátké doby ischemie. Tento trend zvyšování horní věkové hranice dárců nad 55 let se uplatňuje i u žijících dárců [4].
Doporučení
Doporučujeme získat svolení k explantaci orgánu od rodinných příslušníků i v případě, kdy transplantační zákon povoluje koncept předpokládaného souhlasu. Kontakt mezi rodinnými příslušníky potenciálního dárce a ohleduplným, školeným profesionálem se významně podílí na utváření pozitivního veřejného mínění v otázce dárcovství orgánů.
2.6.2 Infekce
U potenciálního dárce je třeba vyloučit přítomnost následujících onemocnění: HIV-1 a HIV-2, HCV a povrchový antigen viru hepatitidy B (HBsAg), hepatitidu D (HDV) – pozitivní sérologické vyšetření, akutní hepatitidu, cytomegalovirus (CMV), Epstein-Barr virus (EBV) (pouze pokud je příjemcem dětský pacient), virové infekce, sepsi, tuberkulózu, infekce neznámé etiologie, rodinnou anamnézu (nebo klinické symptomy, které mohou svědčit o následujícím) Creutzfeldt-Jakobovy nemoci a aktivní syfilis.
U pacientů, u nichž máme podezření na intravenózní aplikaci drog, existuje vysoké riziko přenosu HIV na orgány příjemce. Sérologické testy mohou být navíc v průběhu inkubační doby (2 měsíce u HIV, až 6 měsíců u hepatitidy) negativní. Aplikace velkého množství tekutin během resuscitace s cílem získání kontroly nad masivním krvácením může také ovlivnit sérologický profil potenciálního dárce [5]. Nevhodný dárce tak může mít následkem rozředění krve normální výsledek sérologického vyšetření, testování je tedy nutné opakovat.
2.6.3 Speciální výjimky týkající se infekce
Dárce s pozitivním testem HCV: U HCV pozitivního příjemce je transplantace poté, co příjemce podepíše informovaný souhlas, povolena. U HCV negativního příjemce je transplantace orgánu od HCV pozitivního dárce riskantní. V naléhavých případech je však možné (poté, co příjemce podepíše informovaný souhlas) k transplantaci přistoupit.
Dárce s pozitivním testem HBsAg: U HBsAg pozitivního příjemce (v případě negativního HDV antigenu) je transplantace poté, co příjemce podepíše informovaný souhlas, povolena. U HBsAg negativního příjemce s anti-HBsAg titrem ≥ 10 mlU/ml je transplantace poté, co příjemce podepíše informovaný souhlas, povolena. U HBsAg negativního příjemce s nedetekovatelnou hladinou protilátek anti-HBsAg je transplantace možná pouze v případě, kdy transplantace orgánu zachrání příjemci život (v případě negativního HDV antigenu a poté, co příjemce podepíše informovaný souhlas).
Dárce s pozitivními HBc protilátkami: Při transplantaci jater je riziko přenosu hepatitidy B z HBsAg pozitivního dárce na příjemce vysoké (50 %). V tomto případě je transplantace povolena poté, co příjemce podepíše informovaný souhlas. Transplantace srdce a plic je spojena s nízkým, ačkoliv ne nulovým rizikem přenosu hepatitidy B, transplantace je tedy u HBsAg pozitivního příjemce nebo HBsAg negativního příjemce s anti-HBsAg titrem ≥ 10 mlU/ml povolena poté, co příjemce podepíše informovaný souhlas. U HBsAg negativního příjemce s nedetekovatelnou hladinou protilátek anti-HBsAg je transplantace možná pouze v případě, kdy transplantace orgánu zachrání příjemci život.
2.6.4 Maligní tumory
Dárcovství je absolutně kontraindikováno u pacientů s aktivním karcinomem, anamnézou karcinomu prsu, melanomu, leukémie nebo lymfomu. U potenciálních dárců, u nichž došlo ke krvácení do mozku neznámé etiologie, je nutné vyloučit jako možnou příčinu intrakraniálního krvácení přítomnost metastáz. Na základě měření hladiny hCG v séru je například nutné u případných dárců vyloučit přítomnost choriokarcinomu.
V případě ostatních typů karcinomů (pokud od ukončení léčby uplynulo méně než 10 let) se dárcovství doporučuje pouze v případech, kdy transplantace umožní záchranu života. Úspěšné výsledky byly zaznamenány i při transplantaci ledviny s malými karcinomy nízkého grade, které byly kompletně odstraněny. Pacienti, kterým je transplantován podobný orgán, však vyžadují velmi pečlivé sledování [6].
2.6.5 Speciální výjimky týkající se zhoubných nádorů
Následující tumory nepředstavují kontraindikaci pro dárcovství orgánu:
- karcinom z bazálních buněk
- nemetastazující spinocelulární karcinom kůže
- cervikální karcinom in-situ
- karcinom hlasivek in-situ
Doposud nebylo dosaženo konsenzu v otázce dárcovství ledviny od pacientů s karcinomem močového měchýře z přechodných buněk ve stadiu TaG1 (TNM). Protokol screeningu karcinomu prostaty se v jednotlivých státech liší, toto vyšetření je navíc indikováno pouze v případě, kdy jsou pro jeho provedení důvodné příčiny.
Za vhodné dárce ledviny lze považovat i pacienty trpící následujícími tumory mozku o nízkém grade (grade 1 a 2) [7]:
- astrocytom nízkého grade
- hypofyzární adenom
- epidermoidní cysta
- koloidní cysta třetí mozkové komory
- pilocytické astrocytomy, ependymomy
- oligodenrogliomy nízkého grade (Schmidt A a B)
- papilomy chloroidního plexu
- tumory z ganglionních buněk (gangliomy, gangliocytomy)
- benigní meningeomy
- kraniofaryngeomy
- hemangioblastomy (nesouvisející s Von Hippel Lindau syndromem)
- akustické schwannomy
- pienocytomy
- dobře diferenciované teratomy
Potenciální příjemci postižení následujícími tumory vysokého grade (grade 3 a 4) mohou transplantaci podstoupit pouze v klinicky urgentních případech:
- anaplastický astrocytom
- anaplastický oligodendrogliom (Schmidt C a D)
- maligní ependymomy
- mozková gliomatóza
- glioblastom multiforme
- pineoblastomy
- meduloblastom
- tumory ze zárodečných buněk (s výjimkou dobře diferenciovaných teratomů)
- anaplastické a maligní meningeomy
- intrakraniální sarkomy
- chordomy
- primární cerebrální lymfomy
Pacienti s mozkovým tumorem jakéhokoliv grade, kteří podstoupili vytvoření ventrikulo-peritoneálního zkratu, se vzhledem k vysokému riziku systémové diseminace buněk tumoru zkratem nemohou stát dárci.
2.6.6 Stav cévního řečiště a renální funkce
Mezi vážná rizika spojená se selháním graftu patří dlouhodobá anamnéza diabetu mellitus nebo závažná hypertenze s vaskulárním poškozením sítnice. Anamnéza infarktu myokardu, koronární bypass a angina, závažné systémové vaskulární onemocnění, příhody dlouhotrvající hypotenze, oligurie nebo dlouhodobá hospitalizace na jednotce intenzivní péče představují parametry, které pacientovi zabraňují stát se dárcem orgánu, případně umožňují dárcovství pouze jednoho orgánu. Na základě výše uvedených obecných kritérií pro potenciální dárce je nutné provedení důkladného vyšetření renální funkce.
Na základě obecného konsenzu se renální funkce dárce hodnotí pomocí clearance kreatininu, spočítané pomocí Cockcroft-Gaultova vzorce, který umožňuje korelaci hladiny kreatininu v séru s věkem, tělesnou hmotností a pohlavím pacienta [8]. Stav močových cest lze hodnotit také na základě 24hod. proteinuie a ultrazvukového vyšetření ledvin. Tyto parametry lze využít také při screeningu u starších dárců. V mnoha transplantačních centrech je hladina kreatininu 260 ml/min na spodní hranici normy pro ledviny, které lze transplantovat dvěma příjemcům, nezávisle na histologii orgánu. Jiná centra naopak doporučují provedení biopsie pro zhodnocení zúžení a sklerotizace arteriol podle Karpinského kritérií [9] v případě, kdy hladina clearance kreatinu < 100 ml/min (tab. 5).
Tab. 5. Semi-kvantitativní stupnice pro určování skóre renální biopsie (Karpinski et al, 1999). 
2.6.7 Marginální dárci
Spolu se zvyšujícím se počtem čekatelů na transplantaci ledviny, k němuž dochází ve všech státech, se zvyšuje také průměrných věk těchto zájemců. Vzhledem ke snížení počtu úmrtí následkem úrazu se také zvyšuje průměrný věk kadaverózních dárců. V letech 1992 až 1997 představovali ve Španělsku dárci starší 60 let 27 % všech dárců [11], zatímco v roce 1997 bylo v USA 44 % dárců starších 50 let [12]. V minulosti by tito starší pacienti nebyli vzhledem k riziku selhání graftu nebo opožděné funkci považováni za vhodné kandidáty pro dárcovství ledviny [13]. V současné době, kdy se transplantační centra potýkají s nedostatkem ledvin pro transplantaci, se definice vhodného dárce poněkud rozšiřuje [14,15].
Kritéria definující takzvané marginální dárce nebyla doposud standardizována. Je tedy nezbytné přehodnotit parametry pro odběr orgánů, které by jinak nebyly k transplantaci použity. Tyto parametry si volí jednotlivá transplantační centra na základě výsledků, kterých se snaží docílit [16], a obvykle mezi ně patří:
- věk
- diabetes mellitus
- hypertenze
- závažné vaskulární onemocnění
- hladina kreatininu v séru
- proteinurie
- hmotnost ledviny
- výsledek histologického vyšetření na základě biopsie
Jak již bylo uvedeno, dlouhé trvání studené ischemie může u těchto méně kvalitních graftů vést k opoždění nástupu funkce po transplantaci ledviny.
Rejekce orgánu je vzácnější při transplantaci graftu od starších pacientů ve srovnání s mladšími. Vzhledem k tomu, že transplantace orgánů od marginálních dárců umožňuje ve srovnání s dialyzační léčbou benefit v době přežití [17] a vzhledem k horším dlouhodobým výsledkům ve srovnání s krátkodobými výsledky, se jeví jako logické transplantovat orgány od starších dárců starším pacientům [18]. Tento postup je indikován zejména v lokálních transplantačních programech, kde lze délku studené ischemie snížit na minimum. Zájemci zařazení na čekací listinu, zejména starší pacienti, by měli být informováni o rizicích a benefitech spojených s transplantací orgánů od marginálních dárců. Pacientům starším 60 let by měla být nabídnuta možnost transplantace graftu od marginálního dárce, tito pacienti musejí uvést souhlas s přijetím ne zcela optimálního orgánu nebo případně s duální transplantací.
U marginálního orgánu je třeba posoudit následující parametry [19]:
- Věk > 70 let, bez dalších rizikových faktorů.
- Věk 60–70 let, s anamnézou diabetu mellitus, hypertenzí, klinickou proteinurií do 1 g/24 hod nebo vaskulární změny sítnice.
- Clearance kreatininu 50 ml/min, v tomto případě lze orgány použít pro „single“ transplantaci (transplantace pouze jedné ledviny).
- Clearance kreatininu < 50 ml/min, v tomto případě by měly být orgány použity pro duální transplantaci (transplantace dvou ledvin jednomu příjemci). V případě abnormálního histologického vyšetření nelze orgány užít.
- Přibližně 5–20% glomeruloskleróza prokázaná při biopsii s alespoň 25 glomeruly z každé ledviny, v tomto případě lze orgány použít pro „single“ transplantaci nebo duální transplantaci.
- Více než 20% glomeruloskleróza, v tomto případě nelze orgány použít.
Skutečný klinický význam výše uvedených kritérií nebyl doposud vyjasněn, protože pečlivá statistická validace pomocí multivarietní analýzy nebyla doposud provedena. Například názory týkající se významu provedení předoperační renální biopsie se různí [20,21].
2.6.8 Jeden nebo dva grafty na jednoho příjemce
Důvody pro podporu, nebo naopak zamítnutí programu duální transplantace dvou marginálních ledvin vycházejí ze dvou protichůdných konceptů. Na jednu stranu u ledviny s malým objemem nefronů dochází k hyperfiltraci a glomelurální hypertenzi, které způsobují progresivní glomerulosklerózu [22]. Jedna marginální ledvina má snížený objem funkční tkáně parenchymu a suboptimální počet nefronů, jejichž počet se dále sníží během studené ischemie, poranění během transplantace a následkem nefrotoxicity vyvolané imunosupresí. Řešením této situace může být simultánní transplantace obou ledvin jednomu příjemci, která umožní zvýšit objem nefronů a předejít výše zmíněnému poškození ledvin. Na druhou stranu však marginální ledviny mají pravděpodobně jistou funkční rezervu, kterou však lze ověřit až po provedení transplantace. Po transplantaci ledviny tak často dojde ke zvýšení rychlosti glomerulární filtrace [23–25], proto někteří považují duální transplantaci za zbytečnou.
Pokud posuzujeme tyto dvě protichůdné hypotézy v kontextu nejnovějších poznatků, měly by být obě ledviny považované na základě funkčních a histologických aspektů za nevhodné k transplantaci transplantovány jednomu příjemci, nebo by neměly být užity k transplantaci vůbec [26].
Operační technika duální transplantace nebyla doposud standardizována [27].
Předběžné údaje prokazují, že u pacientů s dvojitým graftem (stejné věkové skupiny) dochází k rejekci graftu méně často než u mladších pacientů, kterým byla transplantována pouze jedna ledvina [28]. Remuzzi et al [29] ve své prospektivní multicentrické studii dospěli k závěru, že duální transplantace je bezpečná, dobře snášená a není spojena s větším počtem operačních komplikací než transplantace jednoho graftu.
Důkazy týkající se duálních transplantací však jasně nasvědčují tomu, že je nutné provedení dalších prospektivních studií s delší dobou sledování, které nám umožní stanovit, které ledviny jsou vhodné pro duální transplantaci. Doposud bylo dosaženo konsenzu pouze v otázce, které ledviny lze obecně považovat za nevhodné k transplantaci. Hlavní rozpor se týká indikátorů, které spolehlivě identifikují ledviny vhodné pro duální transplantaci.
2.6.9 Literatura
1. Alexander JW, Bennett LE, Breen TJ. Effect of donor age on outcome of kidney transplantation. A twoyear analysis of transplants reported to the United Network for Organ Sharing Registry. Transplantation 1994; 57(6):871-876.
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&list_uids=8154034&dopt= Abstract&itool=iconabstr
2. Wyner LM, McElroy JB, Hodge EE, Peidmonte M, Novick AC. Use of kidneys from older cadaver donors for renal transplantation. Urology 1993;41(2):107-110.
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&list_uids=8497979&dopt= Abstract&itool=iconabstr
3. Cicciarelli J, Iwaki Y, Mendez R. The influence of donor age on kidney graft survival in the 1990s. Clin Transpl 1999 : 335-340.
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&list_uids=11038652&dopt =Abstract&itool=iconabstr
4. Kerr SR, Gillingham KJ, Johnson EM, Matas AJ. Living donors > 55 years: to use or not to use? Transplantation 1999;67(7):999-1004.
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&list_uids=10221484&dopt =Abstract&itool=iconabstr
5. Scheinkestel CD, Tuxen DV, Cooper DJ, Butt W. Medical management of the (potential) organ donor. Anaesth Intensive Care 1995;23(1):51-59.
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&list_uids=7778748&dopt= Abstract&itool=iconnoabstr
6. Penn I. Precautions to be taken to prevent transmission of neoplastic diseases in the grafting process. In: Organ and tissue transplantation in the European Union. London: Graham and Trotman, 1994 : 33-41.
7. Council of Europe International Consensus. Committee of experts on the organisational aspects of cooperation in organ transplantation. Standardisation of organ donor screening to prevent transmission of neoplastic diseases, 1997. Council of Europe Publishing-Strasbourg Cedex.
8. Cockcroft DW, Gault MH. Prediction of creatinine clearance from serum creatinine. Nephron 1976; 16(1):31-41.
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&list_uids=1244564&dopt= Abstract&itool=iconabstr
9. Karpinski J, Lajoie G, Cattran D, Fenton S, Zaltzman J, Cardella C, Cole E. Outcome of kidney transplantation from high-risk donors is determined by both structure and function. Transplantation 1999;67(8):1162-1167.
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&list_uids=10232568&dopt =Abstract&itool=iconabstr
10. Official Report on Transplant Activities of Council of Europe. Transplant 1994;7 : 17-27.
11. Riera L, Seron D, Franco E, Suarez JF, Fulladosa X, Ramos R, Gil-Vernet S, Condom E, Gonzalez C, Grinyo JM, Serrallach N. Double kidney transplant. Transplant Proc 1999;31(6):2287-2289.
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&list_uids=10500581&dopt =Abstract&itool=iconnoabstr
12. Lee CM, Carter JT, Weinstein RJ, Pease HM, Scandling JD, Pavalakis M, Dafoe DC, Alfrey EJ. Dual kidney transplantation: older donors for older recipients. J Am Coll Surg 1999;189(1):82-91; discussion 91-92.
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&list_uids=10401744&dopt =Abstract&itool=iconabstr
13. Hariharan S, McBride MA, Bennett LE, Cohen EP. Risk factors for renal allograft survival from older cadaver donors. Transplantation 1997;64(12):1748-1754.
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&list_uids=9422415&dopt= Abstract&itool=iconabstr
14. Alexander JW, Vaughn WK. The use of ‘marginal’ donors for organ transplantation. The influence of donor age on outcome. Transplantation 1991;51(1): 135-141.
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&list_uids=1987682&dopt= Abstract&itool=iconabstr
15. Johnson LB, Kno PC, Dafoe DC, Schweitzer EJ, Alfrey EJ, Klassen DK, Hoehn-Saric EW, Weir MR, Bartlett ST. Double adult renal allografts: a technique for expansion of the cadaveric kidney donor pool. Surgery 1996;120(4):580-583; discussion 583-584.
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?db=pubmed&cmd=Retrieve&dopt=AbstractPlus&list_ uids =8862363&query_hl=186&itool=pubmed_DocSum
16. Persson NH, Omnell Persson M, Ekberg H, Kallen R, Waldner. A renal transplantation from marginal donors: results and allocation strategies. Transplant Proc 2001;33(7-8):3759-3761.
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&list_uids=11750601&dopt =Abstract&itool=iconnoabstr
17. Ojo AO, Hanson JA, Meier-Kriesche H, Okechukwu CN, Wolfe RA, Leichtman AB, Agodoa LY, Kaplan B, Port FK. Survival in recipients of marginal cadaveric donor kidneys compared with other recipients and wait-listed transplant candidates. J Am Soc Nephrol 2001;12(3):589-597.
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&list_uids=11181808&dopt =Abstract&itool=iconabstr
18. Basar H, Soran A, Shapiro R, Vivas C, Scantlebury VP, Jordan ML, Gritsch HA, McCauley J, Randhawa P, Irish W, Hakala TR, Fung JJ. Renal transplantation in recipient over the age of 60: the impact of donor age. Transplantation 1999;67(8):1191-1193.
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&list_uids=10232574&dopt =Abstract&itool=iconabstr
19. European best practice guidelines for renal transplantation (part 1). Transplantation Section II: Evaluation and selection of donors. Nephrol Dial Transplant 2000;15(Suppl 7):39-51.
http://www.ndt-educational.org/images/Renal%20 Transplantation%201%20Section%20II.pdf
20. Andres A, Herrero JC, Morales E, Praga M, Vazquez S, Vereda M, Cebrian P, Rodicio JL, Morales JM, Aguirre F, Diaz R, Polo G, Leiva 0. The double or single renal graft depending on the percentage of glomerulosclerosis in the preimplant biopsy reduces the number of discarded kidneys from donors older than 60 years. Transplant Proc 1999;31(6):2285-2286.
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&list_uids=10500580&dopt =Abstract&itool=iconnoabstr
21. Pokorna E, Vitko S, Chadimova M, Schuck O, Ekberg H. Proportion of glomerulosclerosis in procurement wedge renal biopsy cannot alone discriminate for acceptance of marginal donors. Transplantation 2000;69(1):36-43.
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&list_uids=10653377&dopt =Abstract&itool=iconabstr
22. Brenner BM, Cohen RA, Milford EL. In renal transplantation, one size may not fit all. J Am Soc Nephrol 1992;3(2):162-169.
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&list_uids=1391717&dopt= Abstract&itool=iconnoabstr
23. Halloran PF, Melk A, Barth C. Rethinking chronic allograft nephropathy: the concept of accelerated senescence. J Am Soc Nephrol 1999;10(1):167-181.
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&list_uids=9890324&dopt= Abstract&itool=iconnoabstr
24. Berardinelli L, Beretta C, Raiteri M, Pasciucco A, Carini M. Long-term results of 211 single necrokidney transplantations from extreme-age donors: why dual allograft? Transplant Proc 2001;33(7-8):3774-3776.
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&list_uids=11750606&dopt =Abstract&itool=iconnoabstr
25. Beckurts UT, Stippel D, Pollok M, Arns W, Weber M, Holscher AH. Single-centre experience with the ‘old for old’ program for renal transplantation. Transplant Proc 2001;33(7-8):3779-3780.
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&list_uids=11750608&dopt =Abstract&itool=iconnoabstr
26. Alfrey EJ, Lee CM, Scandling JD, Witter MM, Carter JT, Markezich AJ, Salvatierra 0, Dafoe DC. Expanded criteria for donor kidneys: an update on outcome in single versus dual kidney transplants. Transplant Proc 1997;29(8):3671-3673.
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&list_uids=9414884&dopt= Abstract&itool=iconnoabstr
27. Dietl KH, Wolters H, Marschall B, Senninger N, Heidenreich S. Cadaveric ‘two-in-one’ kidney transplantation from marginal donors: experience of 26 cases after 3 years. Transplantation 2000;70(5):790-794.
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&list_uids=11003359&dopt= Abstract&itool=iconabstr
28. Lu AD, Carter JT, Weinstein RJ, Prapong W, Salvatierra O, Dafoe DC, Alfrey EJ. Excellent outcome in recipients of dual kidney transplants: a report of the first 50 dual kidney transplants at Stanford University. Arch Surg 1999;134(9):97l-975; discussion 975-976.
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&list_uids=10487592&dopt= Abstract&itool=iconabstr
29. Remuzzi G, Grinyo J, Ruggenenti P, Beatini M, Cole EH, Milford EL, Brenner BM. Early experience with dual kidney transplantation in adults using expanded donor criteria. Double Kidney Transplant Group (DKG). J Am Soc Nephrol 1999;10(12):2591-2598.
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&list_uids=10589699&dopt= Abstract&itool=iconabstr
3. PŘÍJEMCE LEDVINY
3.1 Předtransplantační terapie
3.1.1 Abnormální urogenitální cesty
Doporučení (úroveň důkazu: B/C)
- U pacientů, u nichž je onemocnění ledviny v terminálním stadiu způsobeno kongenitální malformací (tj. posteriorní uretrální chlopeň, spina bifida, „prune belly“, vezikoureterální reflux, extrofie močového měchýře, Vaterův syndrom: vertebrální/vaskulární anomálie, anální atrézie, tracheo-esofageální píštěl, atrézie jícnu, renální anomálie/radikální dysplazie) nebo získanou malformací (tj. tuberkulóza, neurogenní, opakovaná korekce vezikoureterálního refluxu) nebo funkční poruchou dolních cest močových, je nezbytné provést před transplantací korekci této abnormality – klíčovou roli zde má provedení předtransplantačního urodynamického vyšetření [1,2].
- U pacientů s močovým měchýřem s nízkou kompliancí s vysokým intravezikálním tlakem a/nebo reziduální močí je nezbytné zahájit farmakoterapii (např. parasympatikolýzu) a/nebo intermitentní katetrizaci. V případě selhání těchto metod nebo v případě, že nelze provést katetrizaci, je nutné provedení supravezikální derivace moči [2,3–6]. Z důvodu vysokého rizika ztráty transplantátu je třeba se vyhnout provedení ureterální implantace u pacientů se zesílenou fibrotickou stěnou močového měchýře (např. po uretrálních chlopních) [1].
3.1.2 Derivace moči
U pacientů, kterým byl odstraněn močový měchýř (např. cystektomie), a pacientů se sfinkterovou nedostatečností (např. neurogenní, iatrogenní) je nezbytné provedení derivace moči prostřednictvím konduitu nebo kontinentního katetrizovatelného pouche s umbilikálním stomatem. U pacientů s močovým měchýřem s nízkou kompliancí s intaktními sfinktery představují vhodné řešení augmentace močového měchýře a vytvoření kontinentního pouche s umbilikálním stomatem [2,4–6]. Intermitentní katetrizace se pohodlněji provádí prostřednictvím umbilikálního stomatu než skrze močovou trubici.
Většina autorů doporučuje provedení supravezikální močové derivace minimálně 10–12 týdnů před transplantací [2,5, 6]. V tomto termínu je také možné odstranit ledviny a močový měchýř zasažené chronickou infekcí. Augmentaci močového měchýře však lze stejně dobře provádět po transplantaci [3,5]. Komplikace obvykle provázejí spíše derivaci moči, např. stenóza ureterální anastomózy nebo stenóza či insuficience stomatu [3,5,6]. Pacienti s konduitem, s augmentovaným či abnormálním močovým měchýřem mají vyšší riziko močové infekce, která může vést až ke ztrátě transplantátu [1,2,4,5]. Během prvních šesti měsíců po transplantaci proto doporučujeme profylaxi antibiotiky [2].
3.1.3 Indikace pro předtransplantační nefrektomii
3.1.3.1 Autosomálně dominantní polycystické onemocnění ledvin (ADPKD)
U pacientů s ADPKD je vzhledem k nedostatku prostoru pro transplantaci ledviny nebo z důvodu výskytu komplikací, jako jsou například infekce cysty, ruptura cysty s/bez hematurie, bolest nebo abnormální obvod pasu, nezbytné provedení uni nebo bilaterální nefrektomie. Ledvinu lze odstranit buď pomocí jednodobé nefrektomie, kdy současně s odběrem ledviny transplantujeme nový graft, nebo pomocí dvoudobého zákroku. Obě procedury jsou spojeny se srovnatelnou mírou výskytu komplikací a dosahují srovnatelných výsledků [7].
3.1.3.2 Hypertenze refrakterní na medikamentózní léčbu
U pacientů trpících hypertenzí refrakterní na medikamentózní léčbu vede bilaterální nefrektomie u většiny pacientů ke snížení počtu užívaných antihypertenzivních preparátů. Dorsální lumbotomie je spojena s nižší morbiditou než incize ve střední čáře [8].
3.1.3.3 Chronická infekce ledvin nebo karcinom ledviny/urotelu
Další indikace pro provedení předtransplantační nefrektomie zahrnují chronické infekční onemocnění ledvin nebo podezření na karcinom ledviny nebo urotelu.
3.1.4 Literatura
1. Adams J, Gudemann C, Mohring K, Mehls O, Wiesel M. Renal transplantation in children with malformations of the urinary tract. Transplant Proc 2002; 34(2):726-727.
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&list_uids=12009680&dopt= Abstract&itool=iconnoabstr
2. Crowe A, Cairns HS, Wood S, Rudge CJ, Woodhouse CR, Neild GH. Renal transplantation following renal failure due to urological disorders. Nephrol Dial Transplant 1998;13(8):2065-2069.
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&list_uids=9719166&dopt= Abstract&itool=iconfft
3. Ebert A, Boswald M, Schott G, Rosch WH. Transplantation in children with congenital anomalies of the lower urinary tract. Akt Urol 2001;32 : 266-272.
4. Hatch DA, Koyle MA, Baskin LS, Zaontz MR, Burns MW, Tarry WF, Barry JM, Belitsky P, Taylor RJ. Kidney transplantation in children with urinary diversion or bladder augmentation. J Urol 2001; 165(6 Pt 2): 2265-2268.
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&list_uids=11371960&dopt= Abstract&itool=iconabstr
5. Koo HP, Bunchman TE, Flynn JT, Punch JD, Schwartz AC, Bloom DA. Renal transplantation in children with severe lower urinary tract dysfunction. J Urol 1999; 161(1):240-245.
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&list_uids=10037414&dopt= Abstract&itool=iconabstr
6. Power RE, Calleary JG, Hickey DP. Pre-transplant bilateral native nephrectomy for medically refractory hypertension. Ir Med J 2001;94(7):214-216.
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&list_uids=11693214&dopt= Abstract&itool=iconabstr
7. Glassman DT, Nipkow L, Bartlett ST, Jacobs SC. Bilateral nephrectomy with concomitant renal graft transplantation for autosomal dominant polycystic kidney disease. J Urol 2000;164(3 Pt 1):661-664.
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&list_uids=10953121&dopt= Abstract&itool=iconabstr
8. Riedmiller H, Gerharz EW, Kohl U, Weingartner K. Continent urinary diversion in preparation for renal transplantation: a staged approach. Transplantation 2000;70(12):1713-1717.
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&list_uids=11152102&dopt= Abstract&itool=iconabstr
3.2 Kritéria pro výběr nebo odmítnutí dárce
Doporučení (úroveň důkazu: B)
U všech kandidátů na transplantaci je nezbytné provedení speciálního kardiovaskulárního vyšetření, které umožní zlepšit dobu přežití pacienta i graftu.
U všech pacientů s renálním onemocněním v terminálním stadiu důsledkem diabetu mellitus je vhodné zvážit transplantaci ledviny jako možnost první volby.
3.2.1 Komorbidity
Komorbidity, jako například diabetes mellitus nebo kardiovaskulární onemocnění, významným způsobem ovlivňují u pacientů po transplantaci ledviny morbiditu i mortalitu [2,11]. K úmrtí dochází u více než 42 % pacientů s funkčním graftem [9], nejzávažnější příčinu představuje srdeční selhání. Je tedy zřejmé, jak významnou roli hraje pečlivé vyšetření potenciálního příjemce transplantátu. Zvláště důležité je kardiovaskulární vyšetření, které umožňuje minimalizovat časné selhání graftu z důvodu technických problémů a zlepšit pacientovo přežití po transplantaci [6].
Transplantace ledviny však ve srovnání s dialyzační léčbou nabízí uremickým pacientům s kardiovaskulárním onemocněním benefit v době přežití.
3.2.2 Kardiovaskulární onemocnění
3.2.2.1 Onemocnění srdce
Vzhledem k tomu, že dialyzovaní pacienti mají významné riziko vzniku kardiovaskulárních onemocnění, je nezbytné u všech kandidátů na transplantaci ledviny provést pečlivé vyšetření [8], které bude zahrnovat:
- echokardiografii umožňující detekci onemocnění chlopní, kardiomyopatii, systolickou/diastolickou dysfunkci levé komory srdeční
- zátěžový elektrokardiogram a/nebo zátěžovou scintigrafii thaliem nebo stresovou echokardiografii u pacientů s nízkou fyzickou kapacitou
- koronární angiografii u všech podezřelých případů, zejména u starších dialyzovaných pacientů s diabetem
V případě, že je to možné, je vhodné u kandidátů na transplantaci provést revaskularizaci (operační nebo koronární angioplastiku) [3].
3.2.2.2 Onemocnění periferních arterií
Onemocnění periferních arterií se u uremických pacientů vyskytuje velmi často. U potenciálních příjemců transplantátu může být závažné onemocnění pánevních cév signifikantní příčinou selhání graftu z technických důvodů, případně může vést ke zvýšení rizika amputace [6].
Před transplantací by měly být rutinně indikovány duplexní sonografie periferních arterií a radiografické vyšetření pánve. V případě jakýchkoliv pochybností (zejména u pacientů s diabetem) doporučujeme provedení angiografie nebo non-invazivního zobrazovacího vyšetření pánevních a periferních tepen pomocí počítačové tomografie (CT) nebo magnetické rezonanční tomografie (MRT).
Dále je nutné vyloučit možnost závažného vaskulárního okluzního onemocnění karotid s cílem zabránit vzniku intra nebo pooperační cévní mozkové příhody [1].
3.2.2.3 Diabetes mellitus
Pacienti trpící diabetem mají po transplantaci ledviny ve srovnání s nediabetickými pacienty vyšší mortalitu a horší dlouhodobé výsledky. Řada studií však prokázala, že diabetes mellitus per se nepředstavuje kontraindikaci pro transplantaci ledviny [5]. Transplantace ledviny nebo kombinovaná transplantace ledviny–slinivky snižuje u uremických pacientů s diabetem ve srovnání s dialýzou dlouhodobou morbiditu i mortalitu.
Transplantaci ledviny je tedy vhodné zvážit u všech uremických pacientů s diabetem, u nichž se nevyskytují jiné závažné kontraindikace, zejména kardiovaskulární onemocnění. Vzhledem ke zvláště vysoké incidenci kardiovaskulárních onemocnění u pacientů s diabetem je nezbytné provedení angiografie koronárních a periferních tepen nebo neinvazivní zobrazovací vyšetření (např. MRT-angiografie), které nám pomohou vyloučit pacienty s vysokým vaskulárním rizikem [10]. Další častou komplikací vyskytující se u diabetických pacientů je neuropatie močového měchýře. V tomto případě doporučujeme provedení urologického vyšetření, které bude zahrnovat uroflometrii s měřením reziduální moči. U pacientů se závažnou diabetickou uropatií je vhodné dodatečné provedení urodynamické studie.
3.2.3 Věk
Ačkoliv není pochyb o tom, že transplantace ledviny umožňuje u mladších pacientů s renálním selháním v konečném stadiu zlepšení doby přežití a kvality života, transplantace ledviny u starších pacientů zůstává nadále předmětem diskuse. U pacientů starších 65 let, kteří podstoupili transplantaci, bylo ve srovnání s pacienty vedenými na čekací listině prokázáno snížení mortality [7]. Dlouhé čekací doby v této populaci pacientů významně snižují klinické výsledky a socio-ekonomické výhody časné transplantace. V této populaci pacientů je nutné využít všechny prostředky k tomu, abychom zkrátili čekací dobu. Doporučujeme tedy starší pacienty zařadit do seniorského programu EUROTRANSPLANT a zažádat o dárcovství orgánu od žijícího dárce.
U starších pacientů na dialýze, kteří jsou kandidáty na transplantaci ledviny, je třeba věnovat speciální pozornost výskytu konkomitantního kardiovaskulárního onemocnění a preexistujícího karcinomu. V případě, že pečlivé vyšetření vyloučí přítomnost závažného kardiovaskulárního onemocnění nebo zhoubného nádoru, domníváme se, že při transplantaci ledviny u pacientů starších 65 let lze dosáhnout dobrých výsledků.
U starších pacientů po transplantaci ledviny byl prokázán zvýšený výskyt infekce. Toto riziko je tedy třeba zvážit při výběru vhodných kandidátů pro transplantaci.
3.2.4 Riziko recidivy (původní onemocnění ledviny)
U transplantované ledviny často dochází k histologické recidivě původního onemocnění. Míra recidivy se různí v závislosti na povaze původního onemocnění. Pacientovi je třeba zdůraznit, že transplantace (dokonce u pacientů s recidivujícím onemocněním) nabízí ve srovnání s dialyzační léčbou celkově lepší dobu exspektace a lepší kvalitu života. Navzdory těmto faktům je nutné s pacientem podrobně prodiskutovat míru recidivy. U onemocnění s časnou a velmi vysokou mírou časné recidivy se doporučuje kriticky zvážit možnost dárcovství orgánu od žijícího dárce. Pouze u několika vzácně se vyskytujících onemocnění představuje vysoká míra recidivy spojená se špatnou prognózou kontraindikaci pro transplantaci ledviny (LCDD). Tab. 6 uvádí míru recidivy u nejdůležitějších onemocnění.
Tab. 6. Míra recidivy a přežití graftu u pacientů s recidivujícím onemocněním. (Uveřejněno s laskavým svolením dr. O. Hergesella, Department of Nephrology, University of Heidelberg.) 
3.2.5 Riziko infekce
Infekce může představovat u pacientů s transplantovaným graftem významnou příčinu morbidity i mortality. Abychom předešli život ohrožujícímu riziku, je nezbytné před transplantací identifikovat potenciální ložiska infekce.
Všichni kandidáti na transplantaci by měli podstoupit otorinolaryngologické, dermatologické, urologické a gynekologické vyšetření a zubní prohlídku s cílem vyloučit přítomnost potenciálního ložiska infekce. Před transplantací je dále nutné provést screening na HBV, HCV, tuberkulózu, cytomegalovirus a Treponema pallidum.
Zvláště důležité je sérologické vyšetření HBV a HCV, protože virová hepatitida představuje po transplantaci ledviny hlavní příčinu onemocnění jater a přispívá k potransplantační morbiditě a mortalitě. Incidence HBV u dialyzovaných pacientů v uplynulých deseti letech významně poklesla. Není tedy žádným překvapením, že počet HBV pozitivních pacientů na čekacích listinách je v současné době velmi nízký.
HCV pozitivní pacienti, kteří podstoupí transplantaci ledviny, jsou ve srovnání s HCV negativními pacienty vystaveni vyššímu riziku úmrtí. Celková mortalita je však nižší u HCV pozitivních pacientů, kteří podstoupili transplantaci, než u HCV pozitivních pacientů na čekacím listu. U HCV pozitivních pacientů je před transplantací vhodné provedení biopsie jater, která umožní zvolit adekvátní antivirovou tera-pii.
3.2.6 Literatura
1. Barbagallo CM, Pinto A, Gallo S, Parrinello G, Caputo F, Sparacino V, Cefalu AB, Novo S, Licata G, Notarbartolo A, Averna MR. Carotid atherosclerosis in renal transplant recipients: relationships with cardiovascular risk factors and plasma lipoproteins. Transplantation 1999;67(3):366-371.
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&list_uids=10030280&dopt= Abstract&itool=iconabstr
2. Braun WE, Marwick TH. Coronary artery disease in renal transplant recipients. Cleve Clin J Med 1994; 61(5):370-385.
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&list_uids=7955310&dopt= Abstract&itool=iconabstr
3. de Lemos JA, Hills LD. Diagnosis and management of coronary artery disease in patients with endstage renal disease on hemodialysis. J Am Soc Nephrol 1996;7(10):2044-2054.
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&list_uids=8915964&dopt= Abstract&itool=iconabstr
4. Hirschl MM. Type II diabetes mellitus and chronic renal insufficiency: renal transplantation or haemodialysis treatment? Nephrol Dial Transplant 1996; 11(Suppl 9):98-99.
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&list_uids=9050043&dopt= Abstract&itool=iconabstr
5. Holley JL, Monaghan J, Byer B, Bronsther O. An examination of the renal transplant evalutation process focusing on cost and the reason for patient exclusion. Am J Kidney Dis 1998;32(4):567-574.
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&list_uids=9774116&dopt= Abstract&itool=iconabstr
6. Jassal SV, Krahn MD, Naglie G, Zaltzman JS, Roscoe JM, Cole EH, Redelmeier DA. Kidney transplantation in the elderly: a decision analysis. J Am Soc Nephrol 2003;14(1):187-196.
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&list_uids=12506151&dopt= Abstract&itool=iconabstr
7. Kasiske BL, Ramos EL, Gaston RS, Bia MJ, Danovitch GM, Bowen PA, Lundin PA, Murphy KJ. The evaluation of renal transplant candidates: clinical practice guidelines. Patient Care and Education. Committee of the American Society of Transplant Physicians. J Am Soc Nephrol 1995;6(1):1-34.
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&list_uids=7579061&dopt= Abstract&itool=iconnoabstr
8. Lindholm A, Albrechtsen D, Frödin L, Tufveson G, Persson NH, Lundgren G. Ischemic heart disease - major cause of death and graft loss after renal transplantation in Scandinavia. Transplantation 1995; 60(5):451-457.
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&list_uids=7676492&dopt= Abstract&itool=iconabstr
9. Weinrauch L, D´Elia JA, Healy RW, Gleason RE, Christleib AR, Leland OS Jr. Asymptomatic coronary artery disease: angiographic assessment of diabetics evaluated for renal transplantation. Circulation 1978; 58(6):1184-1190.
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&list_uids=361277&dopt=Abstract&itool=iconabstr
10. Wolfe RA, Asby VB, Milford EL, Ojo AO, Ettenger RE, Agodoa LY, Held PJ, Port FK. Comparison of mortality in all patients on dialysis, patients on dialysis awaiting transplantation, and recipients of a first cadaveric transplant. N Engl J Med 1999;341(23):1725-1730.
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&list_uids=10580071&dopt= Abstract&itool=iconabstr
3.3 Transplantace v těhotenství
3.3.1 Životnost graftu
Chronické renální selhání jde často ruku v ruce se sexuální dysfunkcí a infertilitou. Po úspěšné transplantaci ledviny dochází ke zlepšení sexuálního života i plodnosti, s pacienty obou pohlaví je tedy nezbytné prodiskutovat otázku početí. U přibližně 10–15 % pacientek dochází v průběhu těhotenství ke zhoršení funkce transplantátu, které však nemusí být nezbytně zapříčiněno graviditou [1]. Čtyři z pěti autorů prokázali ve studii srovnávající dlouhodobou prognózu graftu u gravidních pacientek a normální populace pacientů po transplantaci, že gravidita nemá žádný dopad na přežití transplantátu [2–6].
Incidence abortu (spontánní 14 % a terapeutické 20 %) u žen s transplantátem je srovnatelná s incidencí u normální populace. Pacientky s transplantovanou ledvinou však mají ve srovnání s normální populací vyšší pravděpodobnost, že u nich dojde k předčasnému porodu (50 %) a že novorozenec bude mít menší hmotnost (20 %) [7].
Gravidita probíhá často u pacientek s transplantovanou ledvinou bez jakýchkoliv komplikací, přesto je vhodné tuto populaci pacientek považovat za vysoce rizikovou. Péče o gravidní pacientky s transplantovanou ledvinou vyžaduje spolupráci porodníka, nefrologa i urologa.
Doporučení
Většina pacientek s normálně funkčním transplantátem ledviny bez hypertenze (případně dobře kontrolovanou hypertenzí) je schopna otěhotnět a graviditu dobře snáší. Populaci gravidních pacientek po transplantaci ledviny je však přesto vhodné považovat za vysoce rizikovou. Péče o gravidní pacientky s transplantovanou ledvinou vyžaduje spolupráci porodníka, nefrologa i urologa (úroveň důkazu: B).
3.3.2 Plánování rodičovství
V ideálním případě by měla pacientka otěhotnět ve chvíli, kdy je ona i pacientčin graft v celkově dobrém zdravotním stavu. Ideální doba pro plánování gravidity je obvykle nejdříve, ale ani později než 1–2 roky po transplantaci. Těhotenství v dřívějším intervalu se nedoporučuje vzhledem k tomu, že trvá několik měsíců, než kompliance pacientky na graft dosáhne rovnováhy [8]. Stejně tak není vhodné početí několik let po transplantaci, kdy může dojít k chronické rejekci graftu a/nebo zhoršení renální funkce. Přesto bylo zaznamenáno několik ojedinělých úspěšných těhotenství i mimo tento doporučovaný interval.
Vědecké údaje prokazují, že v případě, že jsou funkce graftu i imunosuprese stabilizovány, u pacientky nejsou přítomny žádné známky odmítnutí, hypertenze, proteinurie, hydronefrózy ani chronické infekce, nejsou mezi graviditou v časném doporučovaném nebo pozdějším termínu pozorovány žádné signifikantní rozdíly. V případě, že jsou všechny výše uvedené podmínky splněny, může pacientka otěhotnět prakticky kdykoliv.
Je třeba zdůraznit, že přítomnost hydronefrózy během těhotenství zvyšuje riziko infekce a litiázy a může komplikovat poslední trimestr těhotenství.
Gravidita by měla být identifikována co možná nejdříve, aby bylo možné začít monitorování a úpravu imunosuprese.
Doporučení
Početí je vhodné naplánovat tehdy, když jsou pacientka i graft v celkově dobrém stavu, renální funkce i imunosuprese jsou stabilizovány a pacientka je bez známek rejekce graftu, hypertenze, proteinurie, hydronefrózy i chronické infekce (úroveň důkazu: B).
3.3.3 Aplikace imunosupresiv
U gravidních pacientek zahrnuje imunosuprese obvykle aplikaci cyklosporinu, s nebo bez azathioprinu a prednisonu [9]. Tyto preparáty pronikají skrze placentu, ale pravděpodobně nezvyšují riziko teratogenity. Během těhotenství, obvykle v třetím trimestru, může dojít ke změně (obvykle k poklesu) hladiny cyklosporinu v krvi, což je způsobeno zvýšením distribučního objemu a farmakokinetikou. Dávkování cyklosporinu je obvykle v tomto období nutné zvýšit [9]. Několik nejnovějších studií uvádí, že nový preparát tacrolimus [10–12], užívaný po transplantaci ledviny, srdce a jater, lze bezpečně aplikovat i gravidním pacientkám. Pouze několik studií se zabývá účinností MMF, který je v těhotenství kontraindikován (stejně jako sirolimus).
Doporučení
Cyklosporin a takrolimus pravděpodobně nezvyšují riziko teratogenity. Tyto preparáty jsou v současné době aplikovány v kombinaci se (nebo bez) steroidy a azathioprinem. Aplikace mykofenolátu mofetilu nebo sirolimu se u gravidních pacientek nedoporučuje (úroveň důkazu: C).
3.3.4 Kontrolní vyšetření
Kontrolní vyšetření gravidních pacientek po transplantaci ledviny by se mělo zaměřovat na hodnocení následujících parametrů:
- hypertenze
- proteinurie
- renální funkce
- rejekce
- infekce
Hypertenze se vyskytuje u velkého počtu pacientek po transplantaci ledviny. Pokud k ní dojde před 28. týdnem těhotenství, zvyšuje se riziko, že pacientka porodí mrtvé novorozeně, dítě o nízké hmotnosti, nebo dokonce hrozí úmrtí plodu [13]. U téměř 30 % pacientek s transplantátem dochází k preeklampsii – v případě, že pacientka trpí také hypertenzí, může dojít k předčasnému porodu.
Abnormální proteinurie se vyskytuje u 30–40 % pacientek ve třetím trimestru. Výskyt proteinurie během prvních měsíců gravidity (případně v kombinaci s hypertenzí, chronickou rejekcí nebo glomerulonefritidou) představuje negativní prognostický faktor pro plod.
Nelze nijak prokázat, že by gravidita jakkoliv ohrožovala funkci kvalitního transplantátu. Někteří autoři však uvádějí, že narušení renální funkce před početím může vést k progresivnímu zhoršení až do stavu, kdy pacientka vyžaduje dialyzační léčbu [14]. Mírné narušení renální funkce během těhotenství může zastřít progresivní chronickou subklinickou rejekci. K narušení funkce graftu může dojít také následkem hyperfiltrace, k jejíž exacerbaci dochází během gravidity [7]. Doposud však nebylo prokázáno, že by zvýšená míra glomerulární filtrace způsobovala glomerulosklerózu.
Frekvence rejekce není vyšší než očekávaná rejekce u negravidních pacientek. V případě, že je graft stabilizován, je rejekce neobvyklá. Diagnostikování rejekce může být obtížné a může vyžadovat provedení biopsie ledviny.
Výskytu bakteriální infekce močových cest lze předejít častým prováděním kultivace moči. Virová infekce se může přenést na plod, v případě CMV infekce může dojít k mentální retardaci. Kultivace amniotické tekutiny umožní odhalit přítomnost jakékoliv infekce [15].
Doporučení
Kontrolní vyšetření gravidních pacientek po transplantaci ledviny by se mělo zaměřovat na hodnocení hypertenze (k preeklampsii dochází u 30 % pacientek), proteinurie, renální funkce, rejekce a infekce (úroveň důkazu: B).
3.3.5 Sledování
Míra interrupce je u pacientek s transplantátem vysoká. Pacientky podstupují interrupci jak ze zdravotních, tak z osobních důvodů. Ačkoliv transplantace graftu do dutiny břišní nevede k mechanickému narušení porodu vaginální cestou, u vysokého procenta pacientek s transplantátem (50 %) je prováděn císařský řez. Kojení se vzhledem k potenciálnímu riziku působení imunosupresiv na dítě nedoporučuje. Během prvních tří měsíců po porodu je vhodné matku pečlivě monitorovat a každý týden testovat stav renální funkce. V odborné literatuře existuje pouze minimum publikací zaměřených na dlouhodobý zdravotní stav a růst potomků (včetně dospělosti) pacientek s transplantátem. Jak již bylo výše uvedeno, u pacientek s transplantovanou ledvinou dochází často k předčasnému porodu a jejich potomci mají nižší porodní hmotnost. U těchto novorozenců navíc existuje 3–5% riziko výskytu strukturních malformací náhodné typologie. Studie zaměřující se na dlouhodobé následky expozice plodu imunosupresivní terapii jsou teprve ve svých počátcích. Jiné údaje nemáme k dispozici.
Potomci otců s transplantovanou ledvinou podstupujících imunosupresivní terapii se nijak neliší od dětí v běžné populaci. U těchto plodů je míra interrupce nižší než u matek s transplantátem. U potomků otců s dědičným onemocněním je však vyšší riziko přenosu této choroby (z otce na dítě).
Doporučení
Ačkoliv pacientky po transplantaci ledviny mohou porodit normální, tj. vaginální cestou, u vysokého procenta pacientek (50 %) je prováděn císařský řez. Kojení se vzhledem k potenciálnímu riziku působení imunosupresiv na dítě nedoporučuje (úroveň důkazu: C).
3.3.6 Literatura
1. Hou S. Pregnancy in chronic renal insufficiency and end-stage renal disease. Am J Kidney Dis 1999; 33(2):235-252.
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&list_uids=10023634&dopt=Abstract&itool=iconabstr
2. Ventura A, Martins L, Dias L, Henriques AC, Sarmento AM, Braga J, Pereira MC, Guimaraes S. Pregnancy in renal transplant recipients. Transplantation Proc 2000;32(8):2611-2612.
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&list_uids=11134726&dopt =Abstract&itool=iconnoabstr
3. Rizzoni G, Ehrich JH, Broyer M, Brunner FP, Brynger H, Fassbinder W, Geerlings W, Selwood NH, Tufveson G, Wing AJ. Successful pregnancies in women on renal replacement therapy: report from the EDTA Registry. Nephrol Dial Transplant 1992;7(4):279-287.
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&list_uids=1317516&dopt= Abstract&itool=iconabstr
4. Sturgiss SN, Davison JM. Effect of pregnancy on the long-term function of renal allografts: an update. Am J Kidney Dis 1995;26(1):54-56.
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&list_uids=7611268&dopt= Abstract&itool=iconabstr
5. First MR, Combs CA, Weiskittel P, Miodovnik M. Lack of effect of pregnancy on renal allograft sur-vival or function. Transplantation 1995;59(4):472-476.
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&list_uids=7878748&dopt= Abstract&itool=iconabstr
6. Salmela KT, Kyllonen LE, Holmberg C, Gronhagen-Riska C. Impaired renal function after pregnancy in renal transplant recipients. Transplantation 1993; 56(6):1372-1375.
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&list_uids=8279005&dopt= Abstract&itool=iconabstr
7. Davison JM, Milne JE. Pregnancy and renal transplantation. Br J Urol 1997;80(Suppl 1):29-32.
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&list_uids=9240221&dopt= Abstract&itool=iconnoabstr
8. Bar J, Ben-Rafael Z, Padoa A, Orvieto R, Boner G, Hod M. Prediction of pregnancy outcome in subgroups of women with renal disease. Clin Nephrol 2000;53(6):437-444.
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&list_uids=10879663&dopt= Abstract&itool=iconabstr
9. Armenti VT, Moritz MJ, Davison JM. Drug safety issues in pregnancy following transplantation and immunosuppression: effects and outcomes. Drug Safety 1998;19(3):;219-232.
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&list_uids=9747668&dopt= Abstract&itool=iconabstr
10. Kainz A, Harabacz I, Cowlrick IS, Gadgil SD, Hagiwara D. Review of the course and outcome of 100 pregnancies in 84 women treated with tacrolimus. Transplantation 2000;70(12):1718-1721.
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&list_uids=11152103&dopt= Abstract&itool=iconabstr
11. EBPG Expert Group on Renal Transplantation. European best practice guidelines for renal transplantation. Section IV: Long term management of the transplant recipient. IV.10. Pregnancy in renal transplant recipients. Nephrol Dial Transplant 2002; 17(Suppl 4):50-55.
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&list_uids=12091650&dopt =Abstract&itool=iconabstr
12. Jain A, Venkataramanan R, Fung JJ, Gartner JC, Lever J, Balan V, Warty V, Starzl TE. Pregnancy after liver transplantation under tacrolimus. Transplantation 1997;64(4):559-565.
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&list_uids=9293865&dopt= Abstract&itool=iconabstr
13. Sturgiss SN, Davison JM. Perinatal outcome in renal allograft recipients: prognostic significance of hypertension and renal function before and during pregnancy. Obstet Gynecol 1991;78(4):573-577.
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&list_uids=1923157&dopt= Abstract&itool=iconabstr
14. Armenti VT, Ahlswede KM, Ahlswede BA, Cater JR, Jarrell BE, Mortiz MJ, Burke JF Jr. Variables affecting birthweight and graft survival in 197 pregnancies in cyclosporine-treated female kidney transplant recipients. Transplantation 1995;59(4):476-479.
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&list_uids=7878749&dopt= Abstract&itool=iconabstr
15. Hagay ZJ, Biran G, Ornoy A, Reece EA. Congenital cytomegalovirus infection: a long-standing problem still seeking a solution. Am J Obstet Gynecol 1996; 174(1 Pt 1):241-245.
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&list_uids=8572014&dopt= Abstract&itool=iconabstr
Štítky
Detská urológia Urológia
Článek Úvodní slovo
Článok vyšiel v časopiseUrologické listy
Najčítanejšie tento týždeň
2009 Číslo 1- Vyšetření T2:EGR a PCA3 v moči při záchytu agresivního karcinomu prostaty
- Lék v boji proti benigní hyperplazii prostaty nyní pod novým názvem Adafin
-
Všetky články tohto čísla
- Tři zdroje ledvin k transplantaci
- Transplantace ledvin od žijících dárců
- Urologická příprava a sledování pacienta před transplantací ledviny
- Principy transplantačního zákona
- Úvodní slovo
- Chirurgické techniky transplantace ledviny
- Urologické komplikácie po transplantácii obličky
- Urologické malignity u nemocných po transplantaci ledviny
- Co na publikované články říká profesor Patrik C. Walsh?
- Urologická onemocnění vedoucí k ledvinné nedostatečnosti a možné cesty prevence konečného stadia selhání ledvin
- GUIDELINES EAU PRO TRANSPLANTACI LEDVINY (část 1)
- Urologické listy
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Urologické komplikácie po transplantácii obličky
- Urologická onemocnění vedoucí k ledvinné nedostatečnosti a možné cesty prevence konečného stadia selhání ledvin
- Chirurgické techniky transplantace ledviny
- Tři zdroje ledvin k transplantaci
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



