-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Dlouhodobé následky léčby testikulárního karcinomu
Autori: Jayakrishnan Jayachandran M. D.stephen J. Freedland M. D. 1,2 1,2,3; Judd W. Moul M. D. 1
Pôsobisko autorov: Division of Urologic Surgery, Department of Surgery and the Duke Prostate Center 1; Urology Section, Veterans Affairs Medical Center 2; Department of Pathology, Duke University School of Medicine, Durham, NC, USA 3
Vyšlo v časopise: Urol List 2008; 6(4): 59-64
Ačkoliv testikulární karcinom tvoří pouze 1 % všech karcinomů u mužské populace, u mužů ve věkové skupině 15–35 let představuje nejčastěji se vyskytující solidní nádor [1]. Incidence testikulárního karcinomu se pravděpodobně zvyšuje – každý rok je identifikováno > 8 000 nových případů [1,2]. 95 % maligních tumorů varlete tvoří tumory ze zárodečných buněk, ve většině případů se jedná o seminomy. Ostatní typy tumorů (na základě histologického vyšetření) jsou vzhledem ke shodnému protokolu léčby označovány společným termínem non-seminomatózní tumory ze zárodečných buněk. Díky účinným multidisciplinárním terapeutickým přístupům představuje testikulární tumor jedno z mála potenciálně vyléčitelných zhoubných nádorových onemocnění.
Prvním krokem standardního postupu při léčbě pacientů s testikulárním karcinomem je provedení radikální unilaterální inquinální orchiektomie, která umožňuje lokální kontrolu tumoru a poskytuje diagnostické informace. Vzhledem k tomu, že testikulární tumory mají obvykle tendenci vytvářet metastázy do lymfatických uzlin, poměrně často je po orchiektomii indikována retroperitoneální lymfadenektomie (RPLND). U pacientů s metastázami o nízkém objemu umožňuje tento zákrok vyléčení onemocnění, u ostatních pacientů poskytuje informace týkající se stadia tumoru nezbytné pro volbu dalšího postupu. Modifikace a zdokonalení operační techniky (zejména metody umožňující zachování nervů) omezily výskyt komplikací spojených s operační léčbou karcinomu varlete na úroveň srovnatelnou s komplikacemi provázejícími léčbu benigních onemocnění. Jednou z hlavních příčin prodloužení délky života pacientů s testikulárním karcinomem je fakt, že testikulární tumory jsou – na rozdíl od ostatních solidních tumorů – senzitivní na chemoterapii.
Prodloužení délky života pacienta, které je důsledkem účinnější léčby, však odhaluje i nežádoucí dlouhodobé následky různých forem léčby. Je však třeba podotknout, že benefit chemoterapie a radioterapie s ohledem na kontrolu karcinomu a dobu přežití specifickou pro karcinom více než vyváží výskyt komplikací. Časná detekce a okamžitá léčba těchto komplikací by měly představovat nedílnou součást sledovacího protokolu. Tento článek uvádí přehled nejvýznamnějších dlouhodobých vedlejších účinků spojených s léčbou testikulárního karcinomu (tab. 1).
Tab. 1. Významné dlouhodobé následky spojené s různými typy léčby karcinomu varlete. 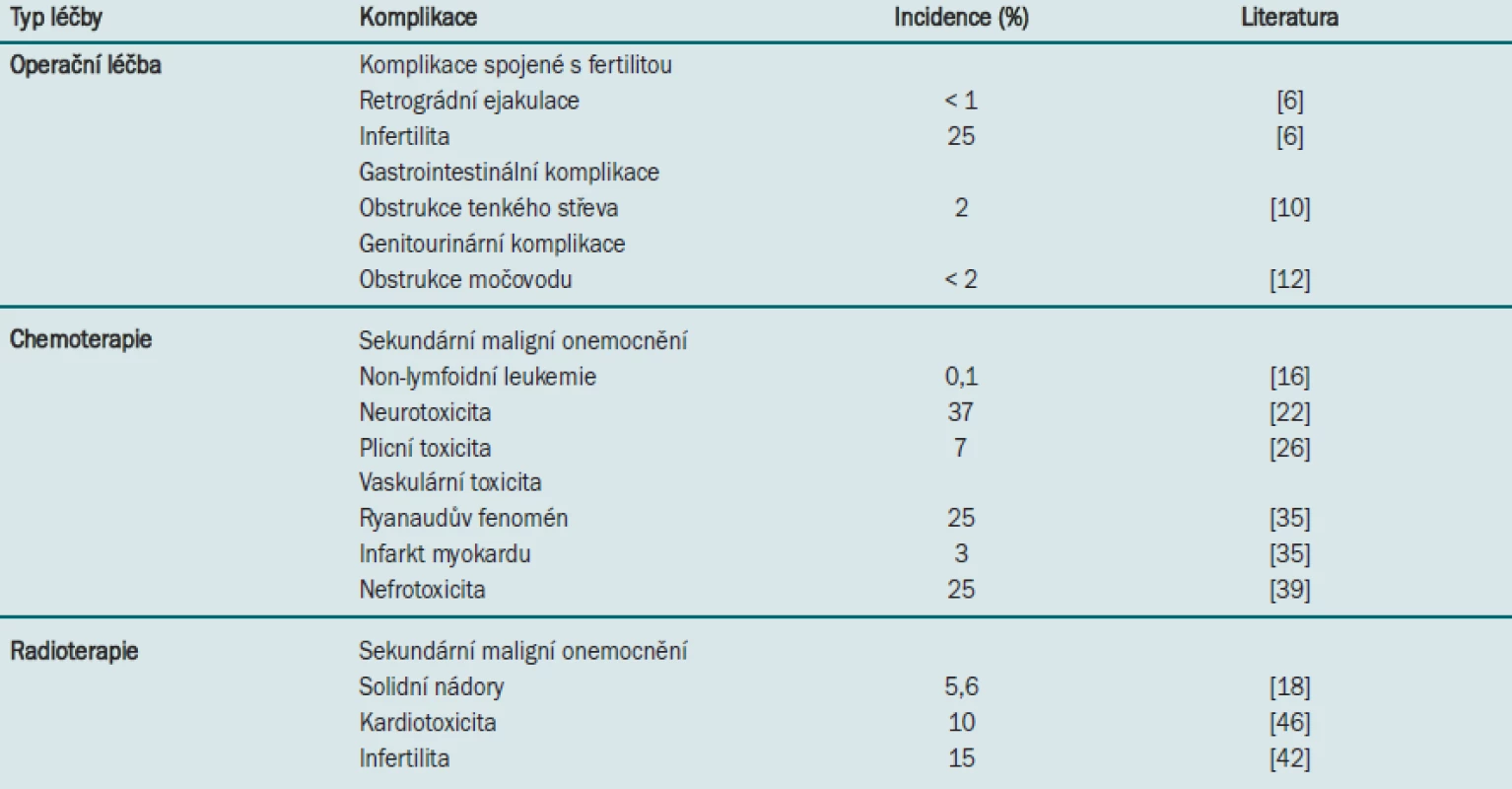
OPERAČNÍ KOMPLIKACE
Již po mnoho desítek let je RPLND považována za vhodný způsob kontroly karcinomu. Na počátku zahrnovala RPLND bilaterální suprahilární disekci s cílem dosáhnout maximálního odstranění karcinomu, tohoto výsledku však bylo dosaženo za cenu většího výskytu komplikací [3]. Lepší porozumění způsobu šíření metastáz do lymfatických uzlin mělo za následek zavedení současného standardu – disekce je omezena pouze na infrahilární oblasti a pomocí nervy šetřících technik je možné dále minimalizovat morbiditu spojenou se zákrokem [4]. U většiny pacientů podstupujících RPLND nevede vlastní operace ke vzniku dlouhodobých komplikací. Neustálé zdokonalování nervy šetřících technik vedlo k definování vzorových oblastí disekce, což má za následek téměř nulovou mortalitu a morbiditu srovnatelnou s morbiditou dosaženou při otevřené laparotomické operaci benigních onemocnění [5]. RPLND může být indikována také při resekci post-primární reziduální rezistence – tento zákrok je však vzhledem k vyšším technickým nárokům (tkáň zjizvena při chemoterapii) spojen s vyšším výskytem komplikací [5].
Fertilita
Retroperitoneální přístup užívaný při léčbě testikulárního karcinomu je spojen se zvýšením rizika poranění nervů zodpovědných za ejakulaci. Narušení postganglionárních sympatických vláken v hypogastrickém plexu při operačním zákroku může mít za následek vznik anejakulace nebo retrográdní ejakulace. Abychom předešli této iatrogenní komplikaci, je třeba dbát zvýšené opatrnosti při disekci v blízkosti bifurkace aorty – tyto nervy mají klíčový význam pro ejakulační funkci [6]. V tomto případě doporučujeme provádět jednu ze dvou následujících operačních technik – modifikovaný rozsah disekce a nervy šetřící techniku. První metoda umožňuje ohraničit disekci pouze na infrahilární unilaterální oblast. Druhá metoda představuje v současné době standardní přístup a umožňuje téměř 100% zachování ejakulační funkce (zejména v případě, že techniku provádí zkušený operatér) [7]. Tuto metodu lze využít dokonce při bilaterální disekci.
Pravděpodobnost nervového poranění je vyšší při provádění disekce na levé straně ve srovnání s operací prováděnou na opačné straně. Použití neurostimulátorů během operace usnadňuje identifikaci a zachování nervů zodpovědných za ejakulaci [8]. Vzhledem k nízkému věku těchto pacientů a nepříznivému dopadu chemo a radioterapie na fertilitu je vhodné doporučit pacientům vyžadujícím adjuvantní léčbu kryoprezervaci spermií.
Gastrointestinální komplikace
Obstrukce tenkého střeva po RPLND představuje jak akutní, tak dlouhodobou komplikaci – v některých případech dochází k manifestaci symptomů až dva roky po operaci. Výskyt obstrukce tenkého střeva je častější u pacientů, kteří podstoupili před RPLND chemoterapii, a u případů vyžadujících provedení bilaterální preparace. Jedná se však o poměrně vzácnou komplikaci, která se vyskytuje pouze u přibližně 2 % pacientů [10]. Ve většině případů lze gastrointestinální komplikace léčit konzervativně. Operační léčba je nutná pouze u pacientů, kteří nereagují na konzervativní léčbu a pacientů, u nichž dochází k toxicitě, jako jsou například pyrexie, ztráta objemu tekutiny, závažná metabolická acidóza a poruchy rovnováhy elektrolytů. Za nejvhodnější strategii lze považovat prevenci vzniku adhezí, čehož docílíme opatrnou disekcí s pozorností věnovanou hemostáze, precizním přiblížením serózních okrajů. Dále je nutné omezit expozici serózy a tak předejít jejímu vysoušení [5].
Genitourinární komplikace
Preparace močovodu může být technicky obtížně proveditelná zejména u pacientů, kteří podstoupili chemoterapii, a může mít za následek akutní poranění nebo narušení cévního zásobení dlouhých segmentů ureteru, k němuž může dojít až dlouho po vzniku obstrukce, a progresivní zhoršení renální funkce [11]. Další vzácně se vyskytující pozdní komplikací je uretrální striktura, která může v některých případech vyžadovat provedení uretroplastiky [12]. Nebylo doposud prokázáno, zda je tato komplikace způsobena drenáží Foleyho katétrem, který se rutinně zavádí po operačním zákroku, nebo jiným mechanismem. Vzhledem k tomu, že ke vzniku těchto komplikací dochází dlouhou dobu po operaci, je třeba je zohlednit v rámci sledovacího protokolu. Incidence těchto komplikací je však naštěstí velmi nízká (< 2 % případů) [11].
Cévní poranění
Preparace hilu ledviny je často spojena s renovaskulárním poraněním, které má za následek vznik dlouhodobé renovaskulární hypertenze. Při resekci dolní duté žíly může dojít ke vzniku otoku dolních končetin, které může přetrvávat po dobu > 6 měsíců. Ve většině případů tyto komplikace po vytvoření nového kolaterálního zásobení vymizí [13]. Opět se jedná o velmi vzácně se vyskytující komplikaci.
Komplikace spojené s hojením rány
Nejčastější akutní komplikací spojenou s RPLND je vznik infekce v ráně. Infekce může mít za následek vznik dlouhodobých komplikací ventrální hernie u přibližně 1 % středních laparotomií prováděných u RPLND [1].
KOMPLIKACE SPOJENÉ S CHEMOTERAPIÍ
Zavedení sloučenin obsahujících platinu v rámci léčby diseminovaného testikulárního karcinomu na počátku sedmdesátých let minulého století představuje významný milník v dějinách moderní onkologie. Možnosti chemoterapie se dále vyvíjí s ohledem na zlepšení doby přežití pacienta a v poslední době také s ohledem na omezení toxicity související s léčbou. V současné době se za standard považuje kombinace BEP (bleomycin, etoposid a cisplatina), případně různé kombinace těchto sloučenin, které při léčbě pacientů s onemocněním s nízkým rizikem umožňují dosáhnout až ³ 90% míry vyléčení [14]. Všechny chemoterapeutické protokoly jsou spojeny s výskytem toxicity, většinu akutních komplikací však lze poměrně snadno řešit. Prodloužení doby přežití u mladších pacientů však s sebou nese riziko vzniku dlouhodobých komplikací vyvolaných chemoterapií. Tato problematika představuje velmi podrobně zkoumanou oblast onkologie. V další části dokumentu uvádíme podrobný popis nejčastějších vedlejších účinků.
Sekundární maligní onemocnění
Jedním z nejvíce zdrcujících důsledků kurativní terapie testikulárního karcinomu je vznik sekundárního maligního onemocnění. Kombinovaná chemoterapie užívaná při léčbě karcinomů varlete je spojena se zvýšením rizika vzniku na terapii rezistentního typu leukemie. Ve většině případů dochází ke vzniku leukemie pět let po ukončení chemoterapie z myeloidních prekurzorů [15]. Vzhledem k tomu, že před zavedením moderních chemoterapeutických protokolů byla incidence leukemie v této populaci pacientů poměrně nízká, nabízí se připisovat zvýšení tohoto rizika užívání etoposidu a cisplatiny. Vznik leukemie obvykle souvisí s aplikací etoposidu a závisí na velikosti aplikované dávky (riziko se zvyšuje při kumulativním dávkování > 2 g/m2) [16]. Také aplikace cisplatiny je spojena s vyšším rizikem vzniku leukemie, ačkoliv riziko při aplikaci samotné cisplatiny je nižší než při aplikaci samotného etoposidu. Stupeň rizika je přímo úměrný dávkování a délce trvání aplikace cisplatiny [16]. Je třeba zdůraznit, že synergický účinek cisplatiny a etoposidu je spojen s vyšším rizikem než samotná aplikace každého z preparátů. Je třeba také uvážit poměrně nízkou incidenci iatrogenní leukemie (0,5 %). Kollmansberger et al uvádějí, že na jeden případ sekundární leukemie připadá 20 vyléčených testikulárních karcinomů [17]. Ačkoliv nebyla zjištěna etiologická souvislost mezi aplikací chemoterapeutik a vznikem solidních tumorů, Travis et al prokázali ve studii zahrnující 14 registrů nádorových onemocnění v Evropě i USA u pacientů podstupujících chemoterapeutickou léčbu testikulárního karcinomu signifikantně vyšší riziko incidence solidních karcinomů vyvolaných radioterapií [18]. Tento závěr potvrzují i výsledky dalších studií [19].
Neurotoxicita
Ze všech agens běžně užívaných při kombinované terapii představuje cisplatina nejvýznamnější neurotoxickou sloučeninu [20]. Jiné důkazy prokazují, že neurotoxicitu může způsobovat také užívání vinblastinu. Ačkoliv přesný mechanismus vzniku neurotoxicity není znám, neurotoxicita vyvolaná aplikací cisplatiny se projevuje axonální degenerací senzorických ganglií a následnou distální senzorickou neuropatií [21]. Míra toxicity závisí na velikosti aplikované dávky, kumulativní dávkování > 400 mg/m2 má za následek horší manifestaci onemocnění. Akutní příznaky jsou převážně senzorické [22] a většina z nich je po ukončení chemoterapie reverzibilní. Největší riziko vzniku neurologických komplikací mají pacienti trpící Raynaudovým syndromem a hypomagnesemií, kteří jsou léčeni pomocí kombinace cisplatiny a vinblastinu [23]. Během sledování je nezbytné monitorování rychlosti nervového vedení, které umožňuje časnou detekci neurotoxicity [21]. Až u 40 % pacientů léčených cisplatinou pravděpodobně dojde ke vzniku přetrvávající neurotoxicity [21,22]. Na rozdíl od účinné léčby akutních komplikací však nemáme k dispozici žádnou účinnou léčbu dlouhodobé neurotoxicity. Aktivní monitorování pacientů s vyšším rizikem vzniku neurotoxicity proto představuje nedílnou součást sledovacích protokolů.
Bylo prokázáno, že cisplatina má také ototoxický účinek – postihuje vláskovité buňky vnitřního ucha a vede ke vzniku ztráty sluchu a tinitu [24]. Tento vedlejší účinek závisí na velikosti dávky a rychlosti infuze a vyskytuje se u > 50 % pacientů (u ³ 20 % pacientů je tato komplikace trvalého charakteru) [25]. Kromě kumulativní dávky cisplatiny se na zvýšení rizika ototoxicity cisplatiny podílejí také expozice intenzivnímu hlučnému prostředí a současná aplikace vinblastinu [25]. U většiny pacientů nedochází k prezentaci závažných symptomů, s výjimkou pacientů s narušenou renální funkcí a starších pacientů.
Plicní toxicita
Ačkoliv užívání bleomycinu významně přispívá k dosažení vysoké míry přežití bez karcinomu, jeho aplikace způsobuje u 7 % pacientů plicní komplikace, které mohou být u přibližně 1 % fatální [26]. Riziko vzniku plicních komplikací je vyšší u kuřáků, pacientů podstupujících ozařování hrudníku nebo kyslíkovou terapii a u pacientů s renální dysfunkcí [27]. K nástupu pneumotitidy dochází během několika měsíců po terapii, tato komplikace závisí na velikosti dávky. Plicní komplikace představují závažný problém, protože řada pacientů s testikulárním karcinomem jsou kandidáty pro záchrannou terapii vyžadující zachování optimální plicní funkce.
U pacienta s anamnézou předchozí aplikace bleomycinu je v rámci prevence potenciálních komplikací nutné monitorování okysličení a rovnováha tekutin [28–30]. Plicní toxicita vyvolaná aplikací bleomycinu se obvykle projevuje dechovou nedostatečností a oboustranným bazálním šelestem. V případě potvrzení toxicity pomocí radiografického vyšetření a vyšetření plicní funkce (plicní objemy, kapacita difuze kyslíku) se doporučuje vysazení bleomycinu [31]. Vzhledem k tomu, že u pacientů podstupujících chemoterapii dochází často ke vzniku infekce následkem potlačení imunosuprese pod vlivem léčby, je nezbytné vyloučit její přítomnost. Diagnózu je vhodné potvrdit pomocí mikroskopického vyšetření sputa nebo bronchoalveolárního výplachu. Poté, co definitivně vyloučíme přítomnost infekce, je vhodné zahájit aplikaci vysoké dávky steroidů (ačkoliv nemáme k dispozici přesvědčivé údaje podporující jejich účinnost v této indikaci) [32].
Cévní toxicita
Více než třetina pacientů podstupujících chemoterapeutickou léčbu testikulárního karcinomu trpí Raynaudovým fenoménem [33]. Tato choroba se obvykle projevuje záchvatovitým spasmem postihujícím krevní cévy prstů. Tato komplikace je nejčastěji spojena s aplikací bleomycinu, může se však vyskytovat také při užívání cisplatiny a vinblastinu [33,34]. Úlevy od symptomů lze docílit aplikací blokátorů kalciového kanálu, zejména u přibližně 25 % pacientů s přetrvávajícími symptomy [35].
Bylo prokázáno, že pacienti přežívající po léčbě testikulárního karcinomu mají vyšší riziko vzniku ischemie myokardu v mladším věku – přibližně u 3 % pacientů dojde k infarktu myokardu (MI) [35]. Na patogenezi MI se nejčastěji podílí cisplatina [36], což je pravděpodobně zapříčiněno přímým účinkem cisplatiny na endotel nebo vasospasmem, který vzniká v důsledku hypomagnesemie. Zvýšená hladina cholesterolu v séru a incidence metabolického syndromu u pacientů podstupujících chemoterapeutickou léčbu karcinomu varlete jsou dalšími faktory, které mohou přispívat k patogenezi MI.
Sporadický výskyt cerebrovaskulárních příhod u pacientů přežívajících léčbu karcinomu varlete je připisován podobnému cévnímu mechanismu vyvolanému chemoterapií.
V nedávné době provedená holandská studie uvádí, že léčba testikulárního karcinomu zvyšuje riziko vzniku kardiovaskulárních onemocnění na úroveň srovnatelnou s rizikem zaznamenaným u kuřáků [19]. Zda je příčinou hyperkoagulační stav spojený s nádorem nebo chemoterapie, zůstává předmětem debaty.
Nefrotoxicita
Nefrotoxicita je dobře popsaný vedlejší účinek terapie cisplatinou. Rozsah poškození ledviny je přímo úměrný kumulativní dávce a maximální hladině cisplatiny [38]. Klinické projevy mohou být akutní povahy a mohou vést ke vzniku hyperurikemie, hypokalemie a hypomagnesemie nebo až k chronickému selhání ledvin [23]. Přetrvávající komplikace se vyskytují u 25 % pacientů [38,39]. Hypomagnesemie, která může být zapříčiněna přímo toxickým účinkem cisplatiny nebo cisplatinou vyvolaným renálním selháním, může mít za následek parestezii, třes a křeče a zřejmě stejně tak se podílí na patogenezi senzorické neuropatie [40]. Přibližně u jedné třetiny pacientů přetrvá snížená glomerulární funkce vyvolaná aplikací cisplatiny, což podnítilo snahy vědců objevit preparát dosahující stejné účinnosti, ovšem bez současného toxického efektu. Americký Úřad pro kontrolu potravin a léčiv schválil užívání organického thiofosfátu – amifostinu v kombinaci s cisplatinou s cílem snížit rozsah výskytu vedlejších účinků spojených s její aplikací [23]. Prevence nefrotoxicity spočívá v dodržování standardních doporučení – zaručení dostatečné hydratace a uvážlivé aplikaci dalších nefrotoxických agens, zejména aminoglykosidů, protože pacienti užívající tyto preparáty jsou důsledkem chemoterapií indukované imonosuprese náchylní ke vzniku infekce.
Fertilita
Účinek chemoterapie není specifický pro konkrétní orgán, ale působí na všechny rychle se dělící buňky. Téměř u všech pacientů podstupujících chemoterapii tedy dojde ke vzniku azoospermie. Ačkoliv u většiny pacientů se jedná o reverzibilní komplikaci, v některých případech může azoospermie přetrvat až dva roky po ukončení chemoterapie [41]. Rizikové faktory pro vznik komplikací souvisejících s fertilitou zahrnují abnormality FSH (folikuly stimulujícího hormonu), abnormální morfologii spermií a toxicitu závisející na velikosti dávky (zejména v případě chemoterapie založené na platině) [23,42,43]. Dalším potenciálním mechanismem může být poškození Leydigových buněk (indukované chemoterapií) [43], k němuž však dochází pouze u 10–20 % případů [44]. U pacientů s testikulárním karcinomem může být infertilita vyvolána jak samotným onemocněním, tak souviset s jeho léčbou. Pacientům, kteří v budoucnosti plánují početí potomků, se tedy před zahájením léčby doporučuje kryoprezervace spermií a asistovaná reprodukce.
KOMPLIKACE SOUVISEJÍCÍ S RADIOTERAPIÍ
Radioterapie představuje jednu z nejoblíbenějších metod adjuvantní léčby seminomů s nízkým rizikem s téměř 100% mírou vyléčení [45]. V další části uvádíme přehled dlouhodobých komplikací souvisejících s tímto druhem léčby.
Sekundární maligní onemocnění
Radioterapie je spojena se zvýšením rizika vzniku solidních karcinomů vyvolaných léčbou [19]. Travis et al ve své studii vycházející z registru zahrnujícího > 40 000 pacientů s testikulárním karcinomem prokázali, že u pacientů léčených pomocí radioterapie dochází 10 let po diagnostikování onemocnění ke dvojnásobnému zvýšení rizika vzniku solidního karcinomu ve srovnání s rizikem 1–4 roky po operaci [18]. Většina těchto tumorů je lokalizována na okraji radiačního pole. Infradiafragmatická radiace souvisí se zvýšením incidence gastrointestinálních karcinomů, genitourinárních a retroperitoneálních sarkomů, zatímco supradiafragmatická radiace (užívaná v minulosti pro kontrolu šíření nádoru do mediastina) je spojena s vyšší incidencí karcinomu plic, pleury, jícnu a štítné žlázy [15,18]. Při kombinaci radioterapie s chemoterapií se riziko ještě podstatně zvyšuje a přetrvává až 30 let po ukončení léčby. Při sledování je tedy nutné vzít v úvahu potenciální vznik sekundárních maligních onemocnění.
Kardiotoxicita
Incidence srdečních příhod dosahuje u pacientů s testikulárním karcinomem, kteří podstupují radioterapii, téměř 10 % [46]. Radioterapie je zejména u pacientů podstupujících ozáření mediastina spojena se zvýšením rizika MI [36,46]. Ačkoliv ozáření mediastina se běžně při léčbě karcinomu varlete neprovádí, v současné době užívaná subdiafragmatická pole však mohou zahrnovat i bázi srdce – u pacientů přežívajících po terapii karcinomu varlete se tedy doporučuje předpokládat určité riziko srdeční příhody.
Infertilita
Během ozařování testikulárního karcinomu nelze zabránit alespoň minimálnímu vystavení kontralaterálního varlete radiaci. Ačkoliv vliv radioterapie na spermatogenezi a funkci Leydigových buněk je méně škodlivý než účinek chemoterapie, u pacientů podstupujících kombinovanou léčbu vyžaduje obnova spermatogeneze delší časový interval [42]. Další rizikové faktory zahrnují velikost dávky a typ radiačního pole [47]. 85 % pacientů podstupujících radioterapii je schopno početí potomka [42].
Pozdní recidiva testikulárního karcinomu
Ačkoliv pozdní recidiva může být projevem agresivní povahy primárního onemocnění, významně přispívá k morbiditě pacienta. Pozdní recidiva je definována jako recidiva, k níž dojde po uplynutí 24 měsíců bez známek výskytu onemocnění. Recidiva může být diagnostikována na základě zvýšené hladiny markerů v séru nebo detekce rezistentní nebo progredující masy nádoru. K recidivě však dochází pouze v relativně vzácných případech (2–4 % pacientů) [48].
Za jednu z možných příčin recidivy je považována dediferenciace teratomatózních buněk primárního tumoru – v tomto případě je nejvhodnějším způsobem léčby operační resekce. U pacientů, kteří nemohou podstoupit operační zákrok, a pacientů, kteří před léčbou nepodstoupili chemoterapii, může být indikována chemoterapeutická léčba. U pacientů, u nichž dojde k pozdní recidivě, je pravděpodobně přítomen tumor agresivní povahy a tito pacienti mají vysoké riziko vzniku opakované recidivy. Za léčbu první volby se v tomto případě považuje chirurgická resekce, která může být indikována v kombinaci se záchrannou chemoterapií. Výsledky léčby této populace pacientů jsou obvykle velmi špatné, míra přežití bez recidivy se pohybuje v rozmezí 26–64 % [49].
SLEDOVÁNÍ PACIENTŮ S CÍLEM MONITOROVÁNÍ DLOUHODOBÉHO EFEKTU
Na základě výše uvedených informací je zřejmé, že sledovací protokoly by měly spočívat nejenom v monitorování potenciální recidivy a sekundárních maligních onemocnění, ale také v monitorování následků léčby. Sledování by mělo kromě onkologického sledování zahrnovat každoroční důkladné fyzikální vyšetření pacienta (včetně vyšetření kardiovaskulární a neurobiologické funkce). Jednou za rok je vhodné povést hodnocení renální funkce (včetně stanovení hladiny magnézia), dva roky po ukončení chemoterapie se doporučuje stanovení lipidového profilu. Pacientům, kteří podstoupili úspěšnou léčbu karcinomu varlete, je vhodné doporučit strategie vedoucí ke snížení rizika vzniku kardiovaskulárních onemocnění, jako je například zdravá strava, dostatek pohybu a omezení kouření, a specifická preventivní opatření, jako například vyhýbání se hlučnému prostředí a aplikaci neuropatických a ototoxických preparátů. Vaughn et al doporučují dodržování výše uvedených preventivních opatření, ovšem s upozorněním, že neexistují žádné přesvědčivé důkazy prokazující jejich účinnost [50]. Dopad podobných opatření na celkový zdravotní stav pacienta je však dostatečně přesvědčivým argumentem pro jejich implementaci do sledovacího protokolu i před tím, než bude benefit této strategie prokázán v prospektivních studiích.
ZÁVĚR
Za benefit účinnějších terapeutických modalit a zlepšení doby přežití bohužel platíme cenu v podobě výskytu dlouhodobých vedlejších účinků. Zavedení nervy šetřící RPLND pomohlo odstranit vedlejší komplikace operačního zákroku v podobě narušení ejakulační funkce. Zcela evidentní poměr rizika ku benefitu chemoterapeutické léčby/radioterapie činí z těchto strategií spolu s operačním řešením i navzdory výskytu dlouhodobých vedlejších komplikací standardní modality řešení testikulárního karcinomu. Tyto pokroky v rámci léčby testikulárního karcinomu učinily z dříve téměř fatálního karcinomu potenciálně vyléčitelné onemocnění. Vzhledem k velmi nízké incidenci většiny dlouhodobých komplikací a absenci důkazů prokázaných v klinických studiích, které by vedly k modifikaci současných protokolů, je nutné benefit v době přežití podpořit pečlivými sledovacími programy, které budou zaměřeny na monitorování dlouhodobých účinků spojených s onemocněním i jeho léčbou.
1,2Jayakrishnan Jayachandran, M.D.
1,2,3Stephen J. Freedland, M.D.
1Judd W. Moul, M.D.
1Division of Urologic Surgery, Department of Surgery and the Duke Prostate Center
2Urology Section, Veterans Affairs Medical Center
3Department of Pathology, Duke University School of Medicine, Durham, NC, USA
Zdroje
1. Jemal A, Siegel R, Ward E et al. Cancer statistics 2007. CA Cancer J Clin 2007; 57 : 43–66.
2. Shah MN, Devesa SS, Zhu K et al. Trends in testicular germ cell tumours by ethnic group in the United States. Int J Androl 2007; 30 : 206–213.
3. Moul JW, Robertson JE, George SL et al. Complications of therapy for testicular Cancer. J Urol 1989; 142 : 1491–1496.
4. Jewett MA, Groll RJ. Nerve-sparing retroperitoneal lymphadenectomy. Urol Clin N Am 2007; 34 : 149–158; Abstr. viii.
5. Beck SD, Foster RS. Long-term outcome of retroperitoneal lymph node dissection in the management of testis cancer. World J Urol 2006; 24 : 267–272.
6. Sheinfeld J, Bosl GJ. Surgery of testicular tumors. In: Wein AJ, Kavoussi LR, Novick AC et al., editors. Campbell-Walsh Urology.9th Ed: Philadelphia, PA: Saunders 2006.
7. Leisinger HJ, Donohue JP. The role of retroperitoneal surgery in testis cancer. Crit Rev Oncol Hematol 2002; 44 : 71–80.
8. Kaiho Y, Nakagawa H, Ito A et al. Ipsilateral seminal emission generated by electrostimulation of the lumbar sympathetic nerve during nerve sparing laparoscopic retroperitoneal lymph node dissection for testicular cancer. J Urol 2004; 172 : 928–931.
9. The NCCN testicular cancer clinical practice guidelines in oncology (Version 1.2008) http://www. nccn.org/professionals/physician_gls/PDF/testicular.pd f accessed 25 October 2007.
10. Baniel J, Sella A. Complications of retroperitoneal lymph node dissection in testicular cancer: primary and postchemotherapy. Semin Surg Oncol 1999; 17 : 263–267.
11. Heidenreich A, Albers P, Hartmann M et al. Complications of primary nerve sparing retroperitoneal lymph node dissection for clinical stage I non-seminomatous germ cell tumors of the testis: experience of the German Testicular Cancer Study Group. J Urol 2003; 169 : 1710–1714.
12. Jewett MA, Wesley-James T. Early and late complications of retroperitoneal lymphadenectomy in testis cancer. Can J Surg 1991; 34 : 368–373.
13. Spitz A, Wilson TG, Kawachi MH et al. Vena caval resection for bulky metastatic germ cell tumors: an 18-year experience. J Urol 1997; 158 : 1813 – 1818.
14. Van Dijk MR, Steyerberg EW, Habbema JD. Survival of non-seminomatous germ cell cancer patients according to the IGCC classification: an update based on meta-analysis. Eur J Cancer 2006; 42 : 820–826.
15. Richiardi L, Scélo G, Boffetta P et al. Second malignancies among survivors of germ-cell testicular cancer: a pooled analysis between 13 cancer registries. Int J Cancer 2007; 120 : 623–631.
16. Kollmannsberger C, Beyer J, Droz JP et al. Secondary leukemia following high cumulative doses of etoposide in patients treated for advanced germ cell tumors. J Clin Oncol 1998; 16 : 3386–3391.
17. Kollmannsberger C, Kuzcyk M, Mayer F et al. Late toxicity following curative treatment of testicular cancer. Sem Surg Oncol 1999; 17 : 275–281.
18. Travis LB, Fossĺ SD, Schonfeld SJ et al. Second cancers among 40 576 testicular cancer patients: focus on long-term survivors. J Natl Cancer Inst 2005; 97 : 1354–1365.
19. Van den Belt-Dusebout AW, de Wit R, Gietema JA et al. Treatment-specific risks of second malignancies and cardiovascular disease in 5-year survivors of testicular cancer. J Clin Oncol 2007; 25 : 4370–4378.
20. Siegal T, Haim N. Cisplatin-induced peripheral neuropathy. Frequent off-therapy deterioration, demyelinating syndromes, and muscle cramps. Cancer 1990; 66 : 1117–1123.
21. Krarup-Hansen A, Helweg-Larsen S, Schmalbruch H et al. Neuronal involvement in cisplatin neuropathy: prospective clinical and neurophysiological studies. Brain 2007; 130 : 1076–1088.
22. Hansen SW, Helweg-Larsen S, Trojaborg W. Long-term neurotoxicity in patients treated with cisplatin, vinblastine, and bleomycin for metastatic germ cell cancer. J Clin Oncol 1989; 7 : 1457–1461.
23. Hartmann JT, Kollmannsberger C, Kanz L et al. Platinum organ toxicity and possible prevention in patients with testicular cancer. Int J Cancer 1999; 83 : 866–869.
24. Knight KR, Kraemer DF, Winter C et al. Early changes in auditory function as a result of platinum chemotherapy: use of extended high-frequency audiometry and evoked distortion product otoacoustic emissions. J Clin Oncol 2007; 25 : 1190–1195.
25. Bokemeyer C, Berger CC, Hartmann JT et al. Analysis of risk factors for cisplatin-induced ototoxicity in patients with testicular cancer. Br J Cancer 1998; 77 : 1355–1362.
26. O'Sullivan JM, Huddart RA, Norman AR et al. Predicting the risk of bleomycin lung toxicity in patients with germ-cell tumours. Ann Oncol 2003; 14 : 91–96.
27. Sleijfer S. Bleomycin-induced pneumonitis. Chest 2001; 120 : 617–624.
28. Donat SM, Levy DA. Bleomycin associated pulmonary toxicity: is perioperative oxygen restriction necessary? J Urol 1998; 160 : 1347–1352.
29. Waid-Jones MI, Coursin DB. Perioperative considerations for patients treated with bleomycin. Chest 1991; 99 : 993–999.
30. De Wit R, Sleijfer S, Kaye SB et al. Bleomycin and scuba diving: where is the harm? Lancet Oncol 2007; 8 : 954–955.
31. Carver JR, Shapiro CL, Ng A et al. American Society of Clinical Oncology clinical evidence review on the ongoing care of adult cancer survivors: cardiac and pulmonary late effects. J Clin Oncol 2007; 25 : 3991–4008.
32. Jensen JL, Goel R, Venner PM. The effect of corticosteroid administration on bleomycin lung toxicity. Cancer 1990; 15(65): 1291–1297.
33. Bokemeyer C, Berger CC, Kuczyk MA et al. Evaluation of longterm toxicity after chemotherapy for testicular cancer. J Clin Oncol 1996; 14 : 2923–2932.
34. Berger CC, Bokemeyer C, Schneider M et al. Secondary Raynaud's phenomenon and other late vascular complications following chemotherapy for testicular cancer. Eur J Cancer 1995; 31A: 2229–2238.
35. Meinardi MT, Gietema JA, van der Graaf WT et al. Cardiovascular morbidity in long-term survivors of metastatic testicular cancer. J Clin Oncol 2000; 18 : 1725–1732.
36. Van den Belt-Dusebout AW, Nuver J, De Wit R et al. Long-term risk of cardiovascular disease in 5-year survivors of testicular cancer. J Clin Oncol 2006; 24 : 467–475.
37. Stefenelli T, Kuzmits R, Ulrich W et al. Acute vascular toxicity after combination chemotherapy with cisplatin, vinblastine, and bleomycin for testicular cancer. Eur Heart J 1988; 9 : 552–556.
38. Osanto S, Bukman A, Van Hoek F et al. Long-term effects of chemotherapy in patients with testicular cancer. J Clin Oncol 1992; 10 : 574–579.
39. Chaudhary UB, Haldas JR. Long-term complications of chemotherapy for germ cell tumours. Drugs 2003; 63 : 1565–1577.
40. Lajer H, Daugaard G. Cisplatin and hypomagnesemia. Cancer Treat Rev 1999; 25 : 47–58.
41. Petersen PM, Hansen SW, Giwercman A et al. Dose-dependent impairment of testicular function in patients treated with cisplatin-based chemotherapy for germ cell cancer. Ann Oncol 1994; 5 : 355–358.
42. Huddart RA, Norman A, Moynihan C et al. Fertility, gonadal and sexual function in survivors of testicular cancer. Br J Cancer 2005; 93 : 200–207.
43. Brennemann W, Stoffel-Wagner B, Helmers A et al.
Gonadal function of patients treated with cisplatin based chemotherapy for germ cell cancer. J Urol 1997; 158 : 844–850.
44. Gerl A, Muhlbayer D, Hansmann G et al. The impact of chemotherapy on leydig cell function in long term survivors of germ cell tumors. Cancer 2001; 91 : 1297–1303.
45. Neill M, Warde P, Fleshner N. Management of low-stage testicular seminoma. Urol Clin North Am 2007; 34 : 127–136;
Abstr.vii–viii.
46. Huddart RA, Norman A, Shahidi M et al. Cardiovascular disease as a long-term complication of treatment for testicular cancer. J Clin Oncol 2003; 21 : 1513–1523.
47. Gandini L, Sgrň P, Lombardo F et al. Effect of chemo - or radiotherapy on sperm parameters of testicular cancer patients. Hum Reprod 2006; 21 : 2882–2889.
48. Shahidi M, Norman AR, Dearnaley DP et al. Late recurrence in 1263 men with testicular germ cell tumors. Cancer 2002; 95 : 520–530.
49. Carver BS, Motzer RJ, Kondagunta GV et al. Late Relapse of testicular germ cell tumors. Urol Oncol 2005; 23 : 441–445.
50. Vaughn DJ, Gignac GA, Meadows AT. Long-term medical care of testicular cancer survivors. Ann Intern Med 2002; 136 : 463–470.
Štítky
Detská urológia Urológia
Článok vyšiel v časopiseUrologické listy
Najčítanejšie tento týždeň
2008 Číslo 4- Vyšetření T2:EGR a PCA3 v moči při záchytu agresivního karcinomu prostaty
- Lék v boji proti benigní hyperplazii prostaty nyní pod novým názvem Adafin
-
Všetky články tohto čísla
- Syndrom pánevní bolesti u mužů a sexuální dysfunkce
- Priapismus
- Sexuální dysfunkce: nejdůležitější zprávy z AUA 2008
- Systém hodnocení erektilní dysfunkce pomocí stupnice EHS
- Úvodník
- Osteopenie a osteoporóza u infertilních mladých mužů trpících sexuální dysfunkcí – klinická zkušenost
- Peyronieho choroba
- Aktuality v andrologické endokrinologii
- Dlouhodobé následky léčby testikulárního karcinomu
- Role retroperitoneální lymfadenektomie u pacientů s nonseminomovými germinálními tumory varlat a poruchy ejakulace
- Klinická praxe založená na důkazech: Úvod do problematiky pro urology
- Klinická aplikace projektu Early Prostate Cancer Program
- Urologické listy
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Syndrom pánevní bolesti u mužů a sexuální dysfunkce
- Peyronieho choroba
- Priapismus
- Osteopenie a osteoporóza u infertilních mladých mužů trpících sexuální dysfunkcí – klinická zkušenost
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



