-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
GUIDELINES EAU PRO DIAGNOSTIKU A LÉČBU INFEKCÍ MOČOVÝCH CEST, VČETNĚ POHLAVNÍCH CEST U MUŽŮ
1. ČÁST
Autoři: K. G. Naber; B. Bergman; M. C. Bishop; T. E. Bjerklund Johansen; H. Botto; B. Lobel; F. Jimenez Cruz; F. P. Selvaggi
Vyšlo v časopise: Urol List 2005; 3(2): 71-95
(PRO VELKÝ ROZSAH BUDE 2. ČÁST UVEŘEJNĚNA V JEDNOM Z PŘÍŠTÍCH ČÍSEL)
OBSAH
- Úvod 73
- 1.1 Klasifikace 73
- 1.2 Literatura 73
- NEKOMPLIKOVANÉ INFEKCE MOČOVÝCH CEST U DOSPĚLÝCH 74
- 2.1 Souhrn 74
- 2.2 Úvod 7
- 2.3 Definice 75
- 2.4 Spektrum etiologie 75
- 2.5 Akutní nekomplikovaná cystitida u negravidních žen před menopauzou 75
- 2.5.1 Diagnóza 75
- 2.5.2 Léčba 76
- 2.5.3 Sledování po léčbě 77
- 2.6 Akutní nekomplikovaná pyelonefritida u negravidních žen před menopauzou 77
- 2.6.1 Diagnóza 77
- 2.6.2 Léčba 77
- 2.6.3 Sledování po léčbě 78
- 2.7 Recidivující (nekomplikované) infekce močových cest u žen 78
- 2.7.1 Úvod 78
- 2.7.2 Profylaktické antimikrobiální režimy 78
- 2.7.3 Alternativní profylaktické metody 78
- 2.8 Infekce močových cest v těhotenství 79
- 2.8.1 Epidemiologie 79
- 2.8.2 Asymptomatická bakteriurie 79
- 2.8.3 Akutní cystitida během těhotenství 79
- 2.8.4 Akutní pyelonefritida během těhotenství 79
- 2.9 Infekce močových cest u žen po menopauze 80
- 2.10 Akutní nekomplikované infekce močových cest u mladých mužů 80
- 2.10.1 Patogeneze a rizikové faktory 80
- 2.10.2 Diagnóza 80
- 2.10.3 Léčba 80
- 2.11 Literatura 80
- INFEKCE MOČOVÝCH CEST U DĚTÍ 82
- 3.1 Souhrn 82
- 3.2 Úvod 82
- 3.3 Etiologie 82
- 3.4 Patogeneze 82
- 3.5 Projevy a symptomy 82
- 3.5.1 Novorozenci 82
- 3.5.2 Děti mladší 6 měsíců 82
- 3.5.3 Děti v předškolním věku (2–6 let) 83
- 3.5.4 Děti školního věku a adolescenti 83
- 3.5.5 Závažnost infekce močových cest 83
- 3.5.6 Závažné infekce močových cest 83
- 3.5.7 Nekomplikované infekce močových cest 83
- 3.5.8 Epididymoorchitida 83
- 3.6 Diagnóza 83
- 3.6.1 Fyzikální vyšetření 83
- 3.6.2 Laboratorní testy 83
- 3.6.3 Zobrazovací vyšetření močových cest 84
- 3.7 Plán vyšetřování 84
- 3.8 Léčba 84
- 3.8.1 Závažné infekce močových cest 85
- 3.8.2 Nekomplikované infekce močových cest 85
- 3.9 Literatura 85
- INFEKCE MOČOVÝCH CEST U RENÁLNÍ NEDOSTATEČNOSTI, PO TRANSPLANTACI, DIABETES MELLITUS A IMUNOSUPRESI 87
- 4.1 Souhrn 87
- 4.2 Úvod 88
- 4.3 Jaké jsou akutní účinky infekce močových cest na ledvinu a stávají se léze chronickými? 88
- 4.3.1 Diabetes mellitus 89
- 4.3.2 Tuberkulóza 89
- 4.4 Progreduje chronické onemocnění ledvin kvůli infekci rychleji a predisponuje renální onemocnění k infekci močových cest? 89
- 4.4.1 Chronické onemocnění ledvin a infekce močových cest 89
- 4.4.2 Infekce močových cest při transplantaci ledviny 90
- 4.5 K jakým problémům dochází při aplikaci antibiotik u pacientů s renální nedostatečností a u pacientů po transplantaci ledviny? 90
- 4.5.1 Aplikace antibiotik při renálním selhání/transplantaci 90
- 4.5.2 Léčba infekce močových cest u příjemců transplantované ledviny 90
- 4.5.3 Mykotická infekce 90
- 4.6 Jsou imunosuprimovaní pacienti náchylní k infekci močových cest, zejména v souvislosti s transplantací ledviny? 90
- 4.6.1 Imunosuprese 90
- 4.7 Literatura 91
- KOMPLIKOVANÁ INFEKCE MOČOVÝCH CEST ZPŮSOBENÁ UROLOGICKÝMI PORUCHAMI 92
- 5.1 Souhrn 92
- 5.2 Definice a klasifikace 92
- 5.2.1 Klinické projevy 93
- 5.2.2 Kultivace moči 93
- 5.3 Mikrobiologie 93
- 5.3.1 Spektrum a rezistence na antibiotika 93
- 5.3.2 Komplikovaná infekce močových cest spojená s močovými konkrementy 93
- 5.3.3 Komplikovaná infekce močových cest spojená se zavedením katétru 93
- 5.4 Léčba 93
- 5.4.1 Obecná pravidla 93
- 5.4.2 Výběr antibiotik 93
- 5.4.3 Délka trvání aplikace antibiotik 94
- 5.4.4 Komplikované infekce močových cest spojené s močovými konkrementy 94
- 5.4.5 Komplikované infekce močových cest spojené se zavedeným katétrem 94
- 5.4.6 Komplikované infekce močových cest u pacientů s poraněním míchy 94
- 5.4.7 Sledování po léčbě 94
- 5.5 Závěr 95
- 5.6 Literatura 95
1. ÚVOD
Mikroorganizmy pronikají do močových cest ascendentní, hematogenní nebo lymfatickou cestou. Existují klinické i experimentální důkazy, že ascenze mikroorganizmů uretrou je nejčastější cestou vedoucí k infekci močových cest (urinary tract infection - UTI), zejména u organizmů enterického původu (tj. Escherichia coli a další enterobakterie). To je logickým vysvětlením častějšího výskytu infekce močových cest u žen než u mužů i zvýšeného rizika výskytu infekce po katetrizaci močového měchýře nebo instrumentaci. Jediné zavedení katétru do močového měchýře u ambulantních pacientů způsobí infekci močových cest v 1–2 % případů. Zavedený katétr s otevřeným drenážním systémem vede k infekci močových cest do 3 až 4 dnů téměř ve 100 % případů. Užití uzavřeného systému drenáže zpomalí nástup infekce. Tento nález poskytuje důkaz, že pacienti, u nichž byla provedena katetrizace, jsou infikovaní vzestupnou cestou. Domníváme se, že bakterie se pohybuje v mukopurulentním prostoru mezi močovou trubicí a katétrem, což vede ke vzniku bakteriurie během 4 týdnů. Dochází k tomu navzdory skutečnosti, že moč v sáčku může být sterilní (následkem přidání antibakteriálních látek) a že lze zabránit retrográdnímu toku moči z jímacího sáčku do katétru.
Hematogenní infekce močových cest je omezena na několik poměrně vzácných mikrobů, jako je například Staphylococus aureus, Candida spp., Salmonella spp. a Mycobacterium tuberculosis, jež způsobují primární infekci jinde v organizmu. Candida albicans způsobuje snadno klinicky zjevnou infekci močových cest hematogenní cestou, je však zároveň málo častou příčinou průniku ascendentní infekce při zavedeném katétru nebo po aplikaci antibiotik.
Koncept bakteriální virulence nebo patogenity v močových cestách ukazuje, že ne všechny druhy bakterií jsou schopné vyvolat infekci. Čím je přirozený obranný mechanizmus více narušen (obstrukce, katetrizace močového měchýře), tím menší virulenci potřebuje kterýkoli bakteriální kmen k vyvolání infekce. To je podloženo dobře dokumentovaným pozorováním in vitro, že bakterie izolovaná z pacienta s komplikovanou infekcí močových cest často neprojevuje virulentní faktory. Koncept virulence také ukazuje, že jisté kmeny bakterií jednoho druhu jsou jedinečně vybaveny specializovanými virulentními faktory, které umožňují průnik bakterie z fekální flóry, z introitus vaginae nebo z periuretrální oblasti močovou trubicí do močového měchýře nebo méně často umožňují organizmům kolonizovat ledvinu a vyvolat systémový zánět. Různé druhy řasinek E. coli představují právě takové virulentní faktory.
Přesto zůstávají některé otázky nezodpovězeny. Například jaké množství bakterií je považováno za relevantní pro určení diagnózy infekce močových cest? Dle Rubina a Stamma et al [1,2] je za relevantní považována následující bakteriurie (viz dodatek 1):
- ≥ 103 kolonie vytvářejících jednotek (colony forming units - cfu) uropatogenu/ml vzorku středního proudu moči (mid stream sample - MSU) u akutní nekomplikované cystitidy u žen
- ≥ 104 cfu uropatogenu/ml MSU u akutní nekomplikované pyelonefritidy u žen
- ≥ 105 cfu uropatogenu/ml MSU u žen nebo ≥ 104 cfu uropatogenu/ml MSU u mužů nebo u moči z katétru u žen s komplikovanou infekcí močových cest
U vzorku moči získané suprapubickou punkcí močového měchýře je jakýkoliv počet bakterií relevantní. Přesto je třeba zvážit problém počítání malého počtu. Pokud je užito inoculum 0,1 ml moči a pro statistické důvody je potřeba 10 identických kolonií, je za těchto okolností nejnižší počet, jenž lze počítat, 102 cfu uropatogenu/ml. Asymptomatická bakteriurie je diagnostikována v případě, že 2 kultury stejného kmene bakterií (ve většině případů je k dispozici pouze druh) odebrané během intervalu ≥ 24 hodin vykazují bakteriurii ≥ 105 cfu uropatogenu/ml.
Je zřejmé, že metody odběru moči a kultivace a kvalita laboratorního vyšetření se mohou lišit. Proto musí být pro vyšetření pacientů užity 2 úrovně standardu. Základní standardní úroveň je nezbytná pro rutinní hodnocení, vyšší standardní úroveň je vyžadována pro vědecké hodnocení. Při výzkumu musí být stanoven požadavek precizní definice metod odběru, doby, po kterou je moč v močovém měchýři atd, a tyto parametry musí být pečlivě zaznamenány.
Při rutinním klinickém vyšetření je před určením diagnózy nutné zjistit několik základních kritérií: klinické symptomy, výsledky vybraných laboratorních testů (krev, moč nebo prostatický exprimát - expressed prostatic secretion - EPS) a důkazy přítomnosti mikrobů pomocí kultivace nebo dalších specifických testů. Většinu těchto vyšetření lze dnes provádět v kterékoli laboratoři.
Příležitostně ukazuje histologické vyšetření na přítomnost zánětu (tj. biopsie prostaty nebo resekované řízky prostaty). V některých případech mohou takovéto nálezy (např. prostatitida u pacientů, kteří mají zvýšené hodnoty specifického prostatického antigenu - PSA) pomoci určit vhodnou léčbu. Přesto většinou přispívají histologické nálezy k výběru léčby jen velmi málo.
1.1 Klasifikace
Infekce lze klasifikovat podle jejich umístění v urogenitálním systému, jako například pyelonefritidu, uretritidu (hlavně histologická nebo rentgenologická diagnóza), cystitidu, prostatitidu, prostatovezikulitidu, uretritidu, funikulitidu, epididymitidu anebo orchitidu. Avšak různé části močových cest spolu navzájem do určité míry komunikují. Proto bakterie v jedné oblasti mohou být přítomny i jinde. Z praktických klinických důvodů však jsou infekce močových cest a infekce pohlavních cest u mužů klasifikovány dle predominantních klinických symptomů:
- nekomplikovaná infekce dolních cest močových (cystitida)
- nekomplikovaná pyelonefritida
- komplikovaná infekce močových cest s nebo bez pyelonefritidy
- urosepse
- uretritida
- speciální formy: prostatitida, epididymitida a orchitida.
Klinické projevy a řešení různých kategorií infekcí močových cest se mohou během života měnit a mohou záviset na stavu pacienta. Proto je třeba brát v úvahu speciální skupiny pacientů (starší osoby, pacienty s dalšími onemocněními a imunokompromitované pacienty).
Kritéria pro diagnózu infekce močových cest, upravená podle guidelines Infectious Diseases Society of America (IDSA) [1] a European Society of Clinical Microbiology and Infectious Diseases (ESCMID) [2] jsou shrnuta v Dodatku 1.
Schéma 1. Klinické řešení akutní pyelonefritidy (upraveno dle [26]). ![Schéma 1. Klinické řešení akutní pyelonefritidy (upraveno dle [26]).](https://pl-master.mdcdn.cz/media/image/9c76ed7a390a6653b854cf809a788c29.jpg?version=1537795528)
1.2 Literatura
Doporučená četba:
Naber KG. Experience with the new guidelines on evaluation of new anti-infective drugs for the treatment of urinary tract infections. Int J Antimicrob Agents 1999; 11 : 189-196.
1. Rubin RH, Shapiro ED, Andriol VT, Davies RJ, Stamm WE. Evaluation of new anti-infective drugs for the treatment of UTI. Clin Infect Dis 1992; 15(Suppl 1): S216-S227.
2. Rubin RH, Shapiro ED, Andriol VT, Davies RJ, Stamm WE, with modifications by a European Working Party (Norrby SR). General guidelines for the evaluation of new anti-infective drugs for the treatment of UTI. Taufkirchen, Germany: The European Society of Clinical Microbiology and Infectious Diseases 1993 : 294-310.
2. NEKOMPLIKOVANÉ INFEKCE MOČOVÝCH CEST U DOSPĚLÝCH
2.1 Souhrn
Definice
Akutní nekomplikované infekce močových cest u dospělých zahrnují příhody akutní cystitidy a akutní pyelonefritidy u jinak zdravých jedinců (většinou žen bez rizikových faktorů, tj. žádné strukturální nebo funkční abnormality močových cest nebo další onemocnění, které by zvyšovalo riziko infekce nebo selhání terapie).
Spektrum etiologie
Spektrum etiologických agens ovlivňujících příčinu vzniku je podobné u nekomplikovaných infekcí horních a dolních cest močových. Patogenem je asi v 70–95 % případů E. coli a ve více než 5 % případů Staphylococcus saprophyticus.
Příležitostně jsou izolovány i další enterobakterie jako například Proteus mirabilis a Klebsiella spp. nebo enterokoky.
Akutní nekomplikovaná cystitida u negravidních žen před menapauzou
Kromě fyzikálního vyšetření se pro rutinní stanovení diagnózy doporučuje provést rozbor moči (pomocí testovacího proužku) zahrnující stanovení bílých a červených krvinek a nitritů. Počet kolonií ≥ 103 cfu uropatogenu/ml je považován za relevantní bakteriurii.
Krátká aplikace antimikrobiálních preparátů je vysoce efektivní a užitečná vzhledem k tomu, že zlepšuje komplianci, je levnější a vykazuje nižší frekvenci nepříznivých účinků. Terapie jedinou dávkou je obecně méně efektivní než stejné antibiotikum aplikované po delší dobu. Avšak nejvhodnější antimikrobiální preparáty aplikované po 3 dny jsou stejně efektivní jako stejná antibiotika aplikovaná po delší dobu. Delší léčba obvykle vykazuje vyšší míru negativních účinků.
Trimethoprim (TMP) nebo TMP-sulfametoxazol (TMP-SMX) lze doporučit jako preparát 1. volby při empirické terapii v komunitách s uropatogenní rezistencí na TMP < 10–20 %. Jinak se pro empirickou terapii doporučují jako preparáty 1. volby fluorochinolony. Fosfomycin trometamol, pivmecilinam a nitrofurantoin jsou alternativními perorálními preparáty, zejména v situacích, v nichž nejsou fluorochinolony indikovány.
Rozbor moči, zahrnující test pomocí testovacího proužku, je při rutinním sledování dostatečný. U asymptomatických pacientů nemusí být po léčbě indikována kultivace moči. U žen, u nichž se symptomy nezlepšují, nebo zlepší a poté během 2 týdnů recidivují, by měla být provedena kultivace moči a testování na citlivost antimikrobiálního agens.
Akutní nekomplikovaná pyelonefritida u negravidních žen před menopauzou
Akutní pyelonefritidu lze rozpoznat dle bolesti v boku, nevolnosti a zvracení, horečky (> 38 °C) nebo citlivosti v kostovertebrálním úhlu. Může se objevit bez přítomnosti symptomů cystitidy, tj. dysurie a častého močení. Kromě fyzikálního vyšetření se pro rutinní stanovení diagnózy doporučuje provést rozbor moči (pomocí testovacího proužku) zahrnující stanovení bílých a červených krvinek a nitritů. Počet kolonií ≥ 104 cfu uropatogenu/ml je považován za relevantní bakteriurii.
Pro vyloučení obstrukce průtoku moči nebo přítomnosti renálních konkrementů by mělo být provedeno vyšetření horních cest močových pomocí ultrazvuku a prostého RTG. Pokud zůstává pacient po 72 hodinách léčby febrilní, je třeba zvážit i další vyšetření, jako je například vylučovací urogram, počítačová tomografie (CT) nebo scan s kyselinou dimerkaptosukciniovou (DMSA), abychom vyloučili další komplikující faktory, jako jsou renální nebo perinefrické abscesy.
U lehčích případů se jako terapie 1. volby doporučuje aplikace perorálního fluorochinolonu po dobu 7 dní. V případě, že je při počátečním barvení dle Grama přítomen grampozitivní organizmus, doporučuje se aplikace aminopenicilinu s inhibitorem beta-laktamázy (beta-lactamase inhibitor - BLI). Pacientky se závažnějšími případy akutní nekomplikované pyelonefritidy by měly být hospitalizovány a léčeny parenterálně. Při zlepšení lze přejít na perorální aplikaci fluorochinolonu nebo TMP-SMX (pokud je účinný proti infikujícímu organizmu) po dobu 1 nebo 2 týdnů. V oblastech zvýšené rezistence E. coli na fluorochinolony a v případech, v nichž jsou fluorochinolony kontraindikovány (tj. těhotenství, kojící ženy, adolescence), se doporučuje perorální aplikace cefalosporinu 2. nebo 3. generace.
Rutinní provedení kultivace po léčbě u asymptomatických pacientů nemusí být indikována, rozbor moči pomocí testovacího proužku je dostatečným rutinním vyšetřením. U žen, u nichž dojde k vymizení symptomů pyelonefritidy během 2 týdnů, by měla být pro vyloučení abnormalit močových cest provedena opakovaná kultivace moči, testování citlivosti a vhodné vyšetření.
Recidivující (nekomplikovaná) infekce močových cest u žen
Recidivující infekce močových cest se často vyskytuje u mladých, zdravých žen, přestože mají jinak anatomicky a fyziologicky normální močové cesty. Doporučují se následující profylaktická řešení:
- dlouhodobé užívání nízké dávky antimikrobiálních preparátů aplikovaných před spaním
- profylaxe po pohlavním styku u žen, u nichž je epizoda infekce spojena s pohlavním stykem.
Alternativní metody profylaxe nejsou v současné době ještě tak efektivní jako antimikrobální profylaxe.
Infekce močových cest v těhotenství
Infekce močových cest se během těhotenství vyskytuje často. Většina žen má bakteriurii před těhotenstvím, zatímco u 20–40 % žen s asymptomatickou bakteriurií se vyvine pyelonefritida během těhotenství. Léčba asymptomatické bakteriurie toto riziko snižuje.
Většina symptomatických infekcí močových cest u gravidních žen se projevuje jako akutní cystitida. Krátkodobá terapie není u gravidních žen zavedena tak jako u negravidních. U recidivující infekce močových cest se jako profylaxe proti opětovné infekci doporučuje nízká dávka cefalexinu (125–250 mg) nebo nitrafurantoinu (50 mg) na noc. Alternativním přístupem může být profylaxe po pohlavním styku.
Při akutní pyelonefritidě mohou být doporučovanými antibiotiky cefalosporiny 2. nebo 3. generace, aminoglykosid nebo aminopenicilin v kombinaci s BLI. Chinolony, tetracykliny a TMP by neměly být v těhotenství aplikovány v 1. trimestru a sulfonamidy v posledním trimestru. V případech opožděného poklesu teploty a dilatace horních cest močových může být zaveden ureterální stent a indikována profylaxe až do porodu.
Infekce močových cest u žen po menopauze
V případě akutní infekce močových cest je antimikrobiální léčba u žen po menopauze podobná jako u žen před menopauzou, avšak krátkodobá terapie u žen po menopauze není tak dobře zdokumentována jako u mladších žen. V případě recidivující infekce močových cest by mělo být provedeno gynekologické vyšetření pro vyloučení přítomnosti tumoru, obstrukčních problémů nebo genitální infekce.
U žen s recidivující infekcí močových cest po menopauze může terapie intravaginálním estriolem signifikantně snížit procento recidivy. U zbylých pacientek by mělo být k hormonální léčbě navíc doporučeno antimikrobiální profylaktické řešení.
Akutní nekomplikovaná infekce močových cest u mladých mužů
Pouze malý počet mužů ve věku 15 až 50 let trpí akutní nekomplikovanou infekcí močových cest. U těchto mužů by měla být aplikována antibiotika po dobu minimálně 7 dnů. U adolescentů, mužů s pyelonefritidou, recidivujících infekcí nebo v případě podezření na komplikující faktor by mělo být rutinně provedeno urologické vyšetření.
2.2 Úvod
Akutní, nekomplikovaná infekce močových cest u dospělých zahrnuje příhody akutní cystitidy a akutní pyelonefritidy objevující se u jinak zdravých jedinců. Tyto infekce močových cest se vyskytují zejména u žen bez rizikových faktorů, o nichž je známo, že zvyšují riziko komplikací nebo selhání léčby. Nekomplikovaná infekce močových cest je infekcí vyskytující se velmi často.
Přibližně 25–30 % žen ve věku 20 až 40 let popisuje příhodu, kterou jejich lékař považoval za nekomplikovanou infekci močových cest [1].
2.3 Definice
Rozlišení nekomplikované a komplikované infekce močových cest je důležité vzhledem k implikacím týkající se vyšetření před a po léčbě, druhu a trvání antimikrobiální léčby a rozsahu vyšetření močových cest. Komplikovaná infekce močových cest je spojena se stavem, jenž zvyšuje rizika získání infekce nebo selhání léčby. V době projevů akutního nástupu symptomů cest močových není obvykle možné definitivně klasifikovat, zda mají pacienti komplikovanou, nebo nekomplikovanou infekci močových cest. Některé faktory však byly identifikovány jako markery potencionální komplikované infekce močových cest (tab. 1).
Tyto faktory slouží pouze jako guidelines pro lékaře, kteří musí v závislosti na omezené klinické informaci rozhodnout, zda pokračovat v rozsáhlejším vyšetřování a léčbě. Obecně můžeme bezpečně předpokládat, že negravidní žena před menopauzou s akutním nástupem dysurie, častou mikcí, která nepodstoupila v poslední době instrumentaci, nebyla léčena antimikrobiálními preparáty a nemá anamnézu abnormalit močovopohlavních cest, bude mít nekomplikovanou infekci dolních (cystitida) nebo horních (pyelonefritida) cest močových. Recidivující infekce močových cest se často vyskytuje u mladých zdravých žen, přestože mají jinak anatomicky i fyziologicky normální močové cesty.
Stále zůstává otázkou diskuse, zda klasifikovat infekci močových cest v těhotenství jako nekomplikovanou nebo komplikovanou infekci. Přestože jsou údaje týkající se infekce močových cest u zdravých žen po menopauze bez genitourinálních abnormalit omezené, je velmi pravděpodobné, že infekce močových cest u takových žen budou také nekomplikované. Údaje týkající se infekce močových cest u zdravých dospělých mužů jsou vzácné a víme daleko méně o optimální diagnóze a terapeutických přístupech.
2.4 Etiologické spektrum
Spektrum organizmů vyvolávajích příčinu vzniku je podobné u nekomplikované infekce horních i dolních cest močových, přitom je E. coli hlavním patogenem v asi 70–95 % případů a S. saprophyticus u více než 5 % případů. Příležitostně mohou být u takových pacientů izolovány další enterobakterie, jako například P. mirabilis a Klebsialla spp. nebo Enterococci. Asi u 10–15 % symptomatických pacientů nemůže být bakteriurie detekována pomocí rutinních metod.
2.5 Akutní nekomplikovaná cystitida u negravidních žen před menopauzou
Akutní cystitida je spojena s významnou morbiditou. Průměrně je každá epizoda tohoto druhu infekce močových cest u mladých žen spojena se symptomy trvajícími 6,1 dnů, 2,4 dny omezené aktivity, 1,2 dny, během nichž nebyly schopny navštěvovat školu nebo zaměstnání a 0,4 dny strávenými na lůžku [3].
2.5.1 Diagnóza
Negravidní žena před menopauzou s akutní dysurií má obvykle 1 ze 3 druhů infekce:
- akutní cystitida
- akutní uretritida způsobená Chlamydia trachomatis, Neisseria gonorrhoeae nebo virem Herpes simplex
- vaginitida způsobená Candida spp. nebo Trichomonas vaginalis.
Dle anamnézy a fyzikálního vyšetření lze obvykle s poměrně vysokou přesností rozlišit tato 3 onemocnění.
Akutní cystitida je pravděpodobnější v případě, že si žena stěžuje na urgenci a bolest suprapubické oblasti, má citlivou suprapubickou oblast, užívá pesar, má symptomy, které jsou podobné již dříve potvrzené cystitidě nebo v nedávné době podstoupila uretrální instrumentaci. Přestože přibližně 40 % žen s cystitidou má hematurii, není to predikátor komplikované infekce. Uretritida způsobená N. gonorrhoeae nebo C. trachomatis je pravděpodobnější, pokud měla žena pohlavní styk s novým sexuálním partnerem během několika posledních týdnů nebo pokud má její sexuální partner uretrální symptomy, v případě anamnézy pohlavně přenosného onemocnění (sexually transmitted disease - STD), v případě postupného nástupu symptomů během posledních několika týdnů a v případě vaginálních symptomů, jako je vaginální výtok nebo zápach. Vaginitidu lze rozpoznat dle přítomnosti vaginálního výtoku nebo zápachu, pruritu, dyspareunie, zevní dysurie, bez zvýšené frekvence nebo urgence mikce.
V případě podezření na infekci močových cest je indikován rozbor moči (tj. pomocí testovacího proužku) pro vyšetření pyurie, hematurie a přítomnosti nitritů. Pyurie se vyskytuje téměř u všech žen s akutní, symtomatickou infekcí močových cest a u většiny žen s uretritidou způsobenou N. gonorrhoeae nebo C. trachomatis; její absence ukazuje na alternativní diagnózu. Definitivní diagnóza infekce močových cest je stanovena při přítomnosti signifikantní bakteriurie, definice, která zůstává stále poněkud kontroverzní. Tradiční standard signifikantní bakteriurie je ≥ 105 cfu uropatogenu/ml ve středním proudu moči založený na vyšetření žen s akutní pyelonefritidou a asymptomatickou bakteriurií, které byly provedeny před 40 lety [4]. Některé další recentní studie prokazují, že je tento standard necitlivý v případě, že je aplikován na ženy s akutní symptomatickou infekcí a že přibližně u jedné třetiny až poloviny všech případů akutní cystitidy je přítomna bakteriurie < 105 cfu/ml [5,6].
Z praktických důvodů by měl být počet kolonií ≥ 103 užit pro určení diagnózy akutní nekomplikované cystitidy [7,8].
Určení počtu kolonií z kultivace moči není obecně nezbytné u žen s nekomplikovanou cystitidou, nebo organizmy a jejich antimikrobiální profil jsou předvídatelné. Výsledky kultivace jsou k dispozici až poté, co symptomy ustoupily nebo se výrazně zlepšily. V případě, že symptomy nepřipomínají infekci močových cest, měla by být provedena kultivace MSU nebo cévkované moči (zkušeným urologickým pracovníkem). V případě potřeby detekce takovéto infekce musí být laboratoř instruována k hledání bakteriurie o „nízkém počtu“ kolonií.
V případě, že je přítomen jakýkoliv z výše uvedených faktorů ukazující na uretritidu nebo vaginitidu, nebo v případě pochybností v určení diagnózy je indikováno vyšetření pánve. Pánevní vyšetření by mělo zahrnovat pečlivé zhodnocení důkazů pro přítomnost vaginitidy, uretrálního výtoku nebo herpetických vředů, cervikální vyšetření pro zjištění cervicitidy a cervikálních a uretrálních kultur N. gonorrhoeae a C. trachomatis (nebo další senzitivní a specifické testy prvního proudu ranní moči jako například testy polymerázové řetězové reakce nebo „ligase chain reaction“testy).
2.5.2 Léčba
Zdá se, že s ohledem na funkci ledvin a zvýšenou mortalitu spojenou s akutní nekomplikovanou cystitidou se nevyskytují žádné dlouhodobé nepříznivé účinky ani u žen, u nichž došlo k opakované recidivě, ani u negravidní populace. Neléčená cystitida zřídka progreduje v symptomatickou infekci horních cest močových. Zdá se tedy, že význam infekce dolních cest močových u negravidních žen je omezen na morbiditu symptomů způsobených infekcí, která může vést k následnému narušení života postižených jedinců. Ve skutečnosti většina infekcí dolních cest (50–70 %) v případě, že jsou neléčeny, vymizí spontánně, přestože symptomy mohou přetrvat několik měsíců.
Znalost antimikrobiálního profilu citlivosti uropatogenů způsobujících nekomplikovanou infekci močových cest může pomoci při určování terapie, přestože trend rutinního provádění kultivace u pacientů s nekomplikovanou cystitidou může bohužel vést k nedostatku takovýchto údajů. Charakter rezistence E. coli způsobující nekomplikovanou infekci močových cest se může v různých zemích značně lišit, proto nejsou v Evropě žádná vhodná doporučení.
Krátká aplikace antimikrobiálních preparátů je vysoce efektivní při léčbě akutní nekomplikované cystitidy u žen před menopauzou [9]. Krátkodobá aplikace je vhodná vzhledem ke zlepšené komplianci, kterou poskytuje, nižší ceně a nižší frekvenci nežádoucích účinků. Avšak při posuzování potencionální finanční výhody krátkodobé aplikace je třeba zvážit potencionální dodatečné náklady spojené se selháním léčby nebo recidivy způsobené krátkodobou léčbou. Je také třeba zvážit potenciální psychologické aspekty terapie 1 dávkou, vzhledem k tomu, že symptomy nemusí vymizet spontánně do 2 nebo 3 dnů, během nichž může mít pacientka pocit nedostatečné léčby. Takovýto scénář může vést k zbytečným návštěvám nebo telefonátům lékaři.
Pro léčbu těchto často se vyskytujících bakteriálních infekcí je užívána celá škála antimikrobiálních režimů, zahrnujících různé medikamenty, dávkování, časování a délku léčby. Pouze několik těchto řešení bylo přímo srovnáváno v adekvátně designovaných studiích. Pro vytvoření na důkazech založených guidelines pro antimikrobiální léčbu nekomplikované bakteriální cystitidy a pyelonefritidy u žen výbor IDSA hodnotil systematicky anglickou medicínskou literaturu do roku 1999. Následně byla vytvořena guidelines pro antimikrobiální léčbu akutní bakteriální cystitidy a pyelonefritidy u žen. Doporučení byla klasifikována podle významu a kvality důkazů. Tyto guidelines byly hodnoceny několika specialisty na infekční onemocnění a urology z celého světa a byly podpořeny American Urological Association (AUA) a ESCMID. Od té doby, co byly guidelines korigovány dle údajů medicíny založené na důzkazech (EBM), užívá jejich údaje Health Care Office (HCO) UTI Working Group EAU [10].
Pouze 75 studií z několika tisíc publikovaných titulů a abstrakt splňuje zahrnující a vylučující kritéria, 32 studií bylo dvojitě zaslepených. U těchto studií byly brány v úvahu následující antimikrobiální medikamenty: TMP, TMP-SMX, TMP-sulfadiazin, chinolony (ciprofloxacin, fleroxacin, lomefloxacin, norfloxacin, ofloxacin, pefloxacin, kyselina pipemidiciová, rufloxacin), nitrofurantoin, beta laktamy (amoxicilin, sloučeniny podobné ampicilinu, cefadroxil, pivmecilinam, ritipenem axetil) a fosfomycin trometamol.
Lze vyvodit následující závěry:
- U jinak zdravých dospělých negravidních žen s akutní nekomplikovanou cystitidou je léčba 1 dávkou obecně méně efektivní, než stejné antibiotikum aplikované po delší dobu. Avšak nejvhodnější (viz níže) antimikrobiálními preparáty aplikované po dobu 3 dnů jsou stejně efektivní jako stejné antimikrobiální medikamenty aplikované po delší dobu. Delší léčba obvykle vykazuje vyšší procento výskytu negativních účinků.
- TMP-SMX byl nejstudovanějším preparátem (30 studií). 3denní režim TMP-SMX proto může být považován za léčebný standard. TMP samotný byl ekvivalentní TMP-SMX vzhledem k eradikaci u výskytu nežádoucích účinků. Při zvážení možných vzácných ale závažných vedlejších účinků způsobených sulfonamidy lze považovat samotný TMP za preferovanější preparát než TMP-SMX. TMP nebo TMP-SMX lze doporučit jako medikamenty terapie 1. volby, při empirické terapii pouze v komunitách s procentem rezistence uropatogenu na TMP < 10–20 %, nebo je zde blízký vztah mezi citlivostí a eradikací E. coli na jedné straně a rezistencí a přetrváváním uropatogenu na straně druhé [11]. Při užití TMP jako terapie 1. volby bylo také riziko vzniku rezistentních uropatogenů v případě recidivy mnohem vyšší, než při užití pivmecilinamu a ciprofloxacinu [12], které mají nejnižší riziko.
- Fluorochinolony (ciprofloxacin, fleroxacin, norfloxacin a ofloxacin) jsou ekvivalentní k TMP-SMX v případě, že jsou aplikovány po dobu 3 dnů. Pefloxacin a rufloxacin [13-16], oba dva aplikované jako 1denní terapie, jsou zajímavou volbou a mohou být při eradikaci bakteriurie a její recidivy ekvivalentní k TMP-SMX. Stále zůstává otázkou vyšší incidence vedlejších účinků těchto preparátů než u jiných doporučovaných terapií. Fluorochinolony jsou nákladnější než TMP a TMP-SMX, a nejsou tedy doporučovány jako preparáty 1. volby při empirické terapii s výjimkou komunit s procentem rezistence uropatogenu na TMP > 10–20 %. Avšak v některých zemích se rezistence E. Coli na fluorochinolony zvýšila až na > 10 %. V této situaci lze pro empirickou terapii zvážit aplikaci alternativních perorálních preparátů (viz sekce). U těchto preparátů lze očekávat > 90 % eradikaci bakteriurie.
- Skupina beta laktamů je méně účinná než výše uvedené preparáty. Zatím nejsou k dispozici pro analýzu žádné velké komparativní studie mezi jedním z výše doporučovaných řešení (3denní aplikace TMP, TMP-SMX. nebo některého z fluorochinolonů) a perorálních cefalosporinů 2. a 3. generace nebo aminopenicilinu v kombinaci s BLI. Pouze 1 studie adekvátní velikosti srovnávala beta laktam (pivmecilinam) aplikovaný po dobu 3 dnů [17]: 3denní terapie byla ekvivalentní k 7denní s ohledem na eradikaci počáteční bakteriurie, přestože kratší léčba byla spojena se zvýšenou incidencí recidivy. Souhrnné bakteriologické výsledky prokázaly, že 7denní aplikace pivmecilinamu 200 mg 2krát denně a 3denní aplikace norfloxacinu 400 mg 2krát denně mají podobné výsledky [18].
Fosfomycin trometamol aplikovaný v 1 dávce může být zajímavou alternativou. Avšak pro demonstraci jeho srovnatelnosti se standardními preparáty, tj. TMP, TMP-SMX nebo jedním z fluorochinolonů aplikovaných po dobu 3 dnů je nezbytné provedení velkých studií.
Nitrofurantoin vyžaduje další zkoumání a nemůže být ještě považován za preparát vhodný pro krátkodobou terapii u akutní nekomplikované cystitidy. Pokud je aplikován v této indikaci, doporučuje se 7denní aplikace.
Přestože ještě nebyly provedeny kontrolované studie, může cystitida způsobená S. saprophyticus lépe odpovídat na delší léčbu, tj. 7 dnů.
Urologická analgetika, jako například fenazopyridin, 200 mg 3krát denně, mohou být aplikována u pacientů, kteří mají 1–2 dny silné dysurické příznaky. Ženy s cystitidou, včetně těch s těžkou dysurií a urgencí, obvykle vykazují vymizení, nebo zlepšení symptomů během 2–3 dnů po zahájení léčby, což je třeba pacientce vysvětlit. Potřeba a trvání analgetické terapie u žen s infekcí močových cest musí být tedy individuální.
Přestože se obecně doporučuje, aby pacienti s infekcí močových cest zvýšili příjem tekutin pro podpoření mikce, a tím eliminaci uropatogenů, není jasné, zda je to u pacientů s infekcí močových cest vhodné, nebo nikoliv.
2.5.3 Sledování po léčbě
Rozbor moči zahrnující test moči pomocí testovacího proužku je při rutinním sledování dostatečný. Rutinní kultivace po léčbě nemusí být indikována u asymptomatických pacientů, nebo benefit detekce a léčby asymptomatické bakteriurie byl u zdravých žen prokázán pouze v těhotenství a před urologickou instrumentací nebo operací. U žen, u nichž symptomy nezmizí do ukončení léčby, a u žen, u nichž symptomy sice vymizí, ale recidivují během 2 týdnů, by měla být provedena kultivace moči a testování antimikrobiální citlivosti. V takové terapeutické situaci je třeba předpokládat, že infikující organizmus není citlivý na původně aplikovaný preparát, a je třeba zvážit opakovanou léčbu trvající 7 dnů s použitím jiného preparátu.
2.6 Akutní nekomplikovaná pyelonefritida u negravidních žen před menopauzou
2.6.1 Diagnóza
Akutní pyelonefritida se projevuje bolestí v boku, nevolností a zvracením, horečkou (> 38 °C), nebo citlivostí v kostovertebrálním úhlu a může se vyskytovat s nebo bez symptomů cystitidy. Projevy akutní nekomplikované pyelonefritidy se obvykle mění od mírného do středně těžkého onemocnění. Život ohrožující stav s dysfunkcí více orgánů, zahrnující septický syndrom s nebo bez šoku a renálním selháním musíme považovat za komplikovaný případ.
Pro zjištění pyurie a hematurie je indikován rozbor moči. Na rozdíl od cystitidy, je 80095 % příhod pyelonefritidy spojeno s > 105 cfu uropatogenu/ml [19]. Při rutinním určování diagnózy se doporučuje hranice 104 cfu/ml [7,8]. Pro vyloučení obstrukce močových cest nebo přítomnosti renálních konkrementů by mělo být provedeno vyšetření horních cest močových pomocí ultrazvuku [20] a prostého rentgenového snímku. Další vyšetření jako vylučovací urografie, CT nebo DMSA scan by měla být zvážena v případě, že pacient zůstává po 72 hodinách léčby febrilní, aby se vyloučily další komplikující faktory, např. renální nebo perinefrické abscesy. Rutinní provádění vylučovací urografie u pacientů s akutní nekomplikovanou pyelonefritidou není potřebné, nebo až 75 % pacientů s nekomplikovanou akutní pyelonefritidou má normální močové cesty.
Tab. 1. Faktory, které ukazují na potencionální komplikovanou infekci močových cest (upraveno dle [2]). ![Faktory, které ukazují na potencionální komplikovanou infekci močových cest (upraveno dle [2]).](https://www.prelekara.sk/media/cache/resolve/media_object_image_small/media/image/9b43d1383d5733bc96142563ca93a21c.png)
2.6.2 Léčba
Z několika set článků hodnocených skupinou IDSA [10] bylo pouze 5 prospektivních, randomizovaných, kontrolovaných studií [5,21-24]. Na základě jejich analýzy a analýzy 1 studie [25] publikované později byly vytvořeny následující závěry.
- TMP-SMX je upřednostňován před ampicilinem (žádná kontrolovaná studie neužívala samotný TMP).
- U většiny žen se zdá být 2týdenní terapie TMP-SMX při akutní nekomplikované pyelonefritidě dostatečná. V některých studiích (ale žádná neměla dostatečnou výpovědní hodnotu) s různými antibiotiky, např. aminoglykosidy byla doporučena dokonce ještě kratší doba terapie, 5–7 dnů.
- V komunitách, v nichž je procento rezistence E. coli na TMP > 10 %, by měl být při empirické terapii doporučen fluorochinolon. Bylo prokázáno, že 7denní aplikace ciprofloxacinu, 500 mg 2krát denně, prokázala signifikantně vyšší procento eradikace bakterií a nižší procento vedlejších účinků, v porovnání s 14denní terapií užívající TMP-SMX, 960 mg 2krát denně [25]. Vyšší efektivnost prokázaná u ciprofloxacinu byla způsobena hlavně TMP-rezistentními kmeny E. coli.
- Pro aminopenicilin v kombinaci s BLI a perorální cefalosporiny 2. nebo 3. generace chybí dostatečně významné komparativní studie srovnávající je s fluorochinolonem nebo TMP SMX.
- V oblastech s procentem rezistence E. coli na fluorochinolony > 10 % a v situacích, v nichž jsou fluorochinolony kontraindikovány (tj. těhotenství, kojící ženy, adolescence), se doporučuje aminopenicilin v kombinaci s BLI nebo perorální cefalosporin 2. nebo 3. generace, a to buï pro počáteční aplikaci, nebo v případě, že pacient musí změnit aplikaci na perorální.
Dle této analýzy doporučuje HCO UTI Working Group perorální fluorochinolon aplikovaný 7 dnů jako terapii 1. volby kromě situací, v nichž není fluorochinolon indikován (viz výše). Pokud je při počátečním barvení dle Grama zjištěn grampozitivní mikroorganizmus, doporučuje se aplikace aminopenicilinu v kombinaci s BLI. Závažnější případy akutní nekomplikované pyelonefritidy by měly být hospitalizovány a v případě, že pacient nemůže užívat perorální preparáty, měl by být léčen parenterálně fluorochinolonem, aminopenicilinem v kombinaci s BLI a skupinou 2 nebo 3 cefalosporinů nebo aminoglykosidem. Při zlepšení může pacient přejít na perperorální léčbu s aplikací jednoho ze zmiňovaných antibakteriálních preparátů (pokud je aktivní proti infekčnímu organizmu), aby dokončil 1 - až 2týdenní terapii.
Přestože asi 12 % pacientů hospitalizovaných pro akutní nekomplikovanou pyelonefritidou má bakteriemii, je běžnou praxí provádět kultivaci z krve pouze v případě, že je pacient ve stavu vyžadujícím hospitalizaci. Neexistují žádné důkazy, že by bakteriemie předpovídala horší prognózu nebo vyžadovala delší terapii u jinak zdravého jedince s pyelonefritidou.
2.6.3 Sledování po léčbě
Rutinní provedení kultivace po léčbě u asymptomatického pacienta nemusí být indikováno, rozbor moči pomocí testovacího proužku je dostatečným rutinním vyšetřením. U žen, u nichž nedojde ke zlepšení symptomů pyelonefritidy během 3 dnů, nebo pokud vymizí a znovu recidivují během 2 týdnů, by měla být provedena opakovaná kultivace moči, testování antimikrobiální citlivosti a vhodné vyšetření, jako například ultrazvukové vyšetření nebo CT ledvin. U pacienta bez urologické abnormality můžeme předpokládat, že infekční organizmus není citlivý na původně užitý preparát a je třeba vzít v úvahu opakovanou léčbu trvající 2 týdny s aplikací jiného preparátu. U pacientů, u nichž dojde k recidivě se stejným patogenem, jako byl původní infekční kmen, je obvykle dostačující 6týdenní léčba.
2.7 Recidivující (nekomplikovaná) infekce močových cest u žen
2.7.1 Úvod
10 % až 20 % žen zaznamená recidivující nekomplikovanou infekci močových cest [27]. Rizikové faktory pro recidivují infekci jsou genetické i behaviorální. Ženy, které nevylučují substance krevních skupin, mají zvýšený výskyt recidivující infekce močových cest [28]. Ženy s recidivující infekcí mají zvýšenou frekvenci infekce močových cest u příbuzných ženského pohlaví v 1. linii [29]. Navíc E. coli, nejčastěji se vyskytující uropatogen, lépe adheruje k buňkám epitelu u žen s již dřívější recidivující infekcí [30,31]. Behaviorální faktory spojené s recidivující infekcí močových cest zahrnují sexuální aktivitu, s vysokým rizikem zejména u žen užívajících jako antikoncepci spermicidní látky [2,3,32,33].
2.7.2 Profylaktické antimikrobiální režimy
Jedním z efektivních přístupů k řešení recidivující nekomplikované infekce močových cest je prevence infekce aplikací dlouhodobých antimikrobiálních preparátů aplikovaných před spaním [34]. Souhrn různých dávkování je uveden v tab. 2.
Tab. 2. Antimikrobiální režimy zaznamenané profylaktické úspěšnosti při prevenci akutní nekomplikované infekce močových cest u žen. 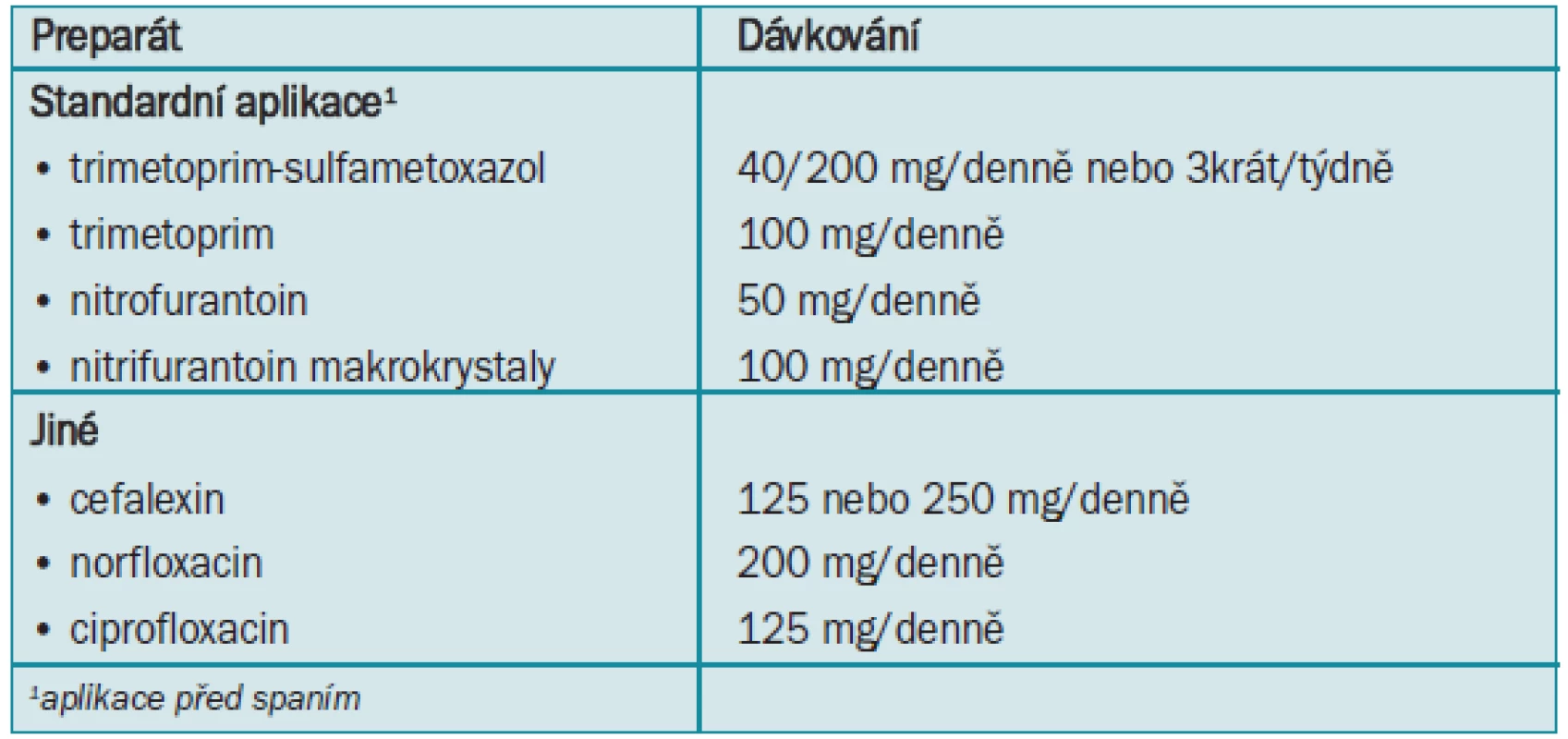
Obecně se výskyt infekce díky profylaxi sníží o 95 %. Počáteční délka profylaktické terapie je obvykle 6 měsíců nebo 1 rok. Avšak při aplikaci ko-trimoxazolu (TMP-SMX) zůstává efektivní kontinuální profylaxe trvající 2 [35] nebo 5 let [36]. Nezdá se, že by profylaxe ovlivňovala přirozenou historii recidivující infekce močových cest. V případě, že nepokračuje, dokonce po několika delších periodách je přibližně 60 % žen znovu infikováno během 3 až 4 měsíců.
Alternativní profylaktickým přístupem je profylaxe po pohlavním styku u žen, u nichž je infekce spojena se sexuálním stykem [37-39].
2.7.3 Alternativní profylaktické metody
Alternativní metody, jako je acidifikace moči, brusinkový džus [40], extrakt z Medvědice lékařské (uvae ursi) a vaginální aplikace laktobacilu [41,42] prokazují různé výsledky. Záznamy týkající se imunostimulujících výtažků E. coli prokázaly sníženou frekvenci recidivujících infekcí [43] a pokles stupně bakteriurie u paraplegických pacientů [44].
U některých žen s nekomplikovanou infekcí močových cest může být efektivní vodní diuréza, ale často opožïuje efektivnější řešení s aplikací antimikrobiálních preparátů, dokud se stav pacienta nezhorší. Důkazy pro to, abychom mohli doporučit ženám změnit jejich tělesné návyky a menstruační praktiky nebo močení po pohlavním styku [45], jsou také velmi slabé.
2.8 Infekce močových cest v těhotenství
Infekce močových cest se v těhotenství vyskytuje velmi často. Je diskutabilní, zda tyto infekce klasifikovat jako nekomplikované dokonce u případů bez dalších rizikových faktorů kromě těhotenství. Bereme-li v úvahu tento fakt, budeme v této sekci diskutovat asymptomatickou bakteriurii, akutní cystitidu a akutní pyelonefritidu pouze s ohledem na těhotenství, a nikoli na další rizikové faktory.
Zdá se, že faktory, které predisponují výskyt infekce močových cest v těhotenství, souvisí s anatomickými a fyziologickými změnami v ledvině a močových cestách, ke kterým dochází v těhotenství. Uretery jsou dilatované nad vstupem do pánve a močový měchýř je posunut anteriorně a superiorně zvětšující se dělohou. Průtok krve ledvinou a procento glomerulární filtrace se v těhotenství zvýší o 30–40 % a ledviny jsou mírně zvětšené a hyperemické. Průtok moči může být pomalejší a močový měchýř se nemusí úplně vyprázdnit.
2.8.1 Epidemiologie
Prevalence asymptomatické bakteriurie se v amerických, evropských a australských studiích pohybuje mezi 4–7 % [46]. Incidence souvisí se sexuální aktivitou a stoupá se zvyšujícím se věkem a graviditou. Je také vyšší mezi pacienty z nižších socio-ekonomických skupin. Symptomatická infekce se vyskytuje u přibližně 1–2 % gravidních žen.
Většina žen získá bakteriurii před těhotenstvím. Při prvním vyšetření je procento bakteriurie u gravidních žen podobné jako u negravidních žen s obdobnými rizikovými faktory. Asi u 37–57 % žen, u nichž došlo ve školním věku k bakteriurii, se v těhotenství vyvine infekce močových cest. Další 1 % infekce se objeví při těhotenství [47]. Ve studii provedené ve Švédsku se riziko získání bakteriurie zvyšovalo s délkou trvání těhotenství, dosahující maxima mezi 9. a 17. týdnem těhotenství [48]. Bakteriurie v těhotenství je spojená se signifikantním zvýšením počtu novorozenců s nízkou porodní váhou (< 2 500 g), nízkým věkem (< 37 týdnů) a neonatální mortalitou. Ženy s přetrvávající infekcí navzdory léčbě nebo důkazu, že infekce invaduje tkáň, mají vyšší riziko porození nedonošeného novorozence. Přesto je třeba zmínit, že bakteriální vaginóza je také důležitý nezávislý faktor týkající se předčasného porodu, a doporučuje se tedy léčba.
2.8.2 Asymptomatická bakteriurie
Dřívější studie provedené Kassem [47] a ostatními demonstrovaly, že u 20–40 % žen s asymptomatickou bakteriurií se objeví v těhotenství pyelonefritida. Léčba bakteriurie snižuje toto riziko [49]. Je stále diskutabilní, zda je screening (tj. po první 3měsíční periodě) asymptomatické bakteriurie u gravidních žen opodstatněný. Wadland a Planten [50] zjistili, že provedení screeningu se vyplatí, v případě, že je prevalence bakteriurie > 2 %. U sociálně stabilní populace s nízkou prevalencí asymptomatické bakteriurie nemusí být screening nezbytný [46].
Na druhou stranu lze dosáhnout výrazného snížení roční incidence pyelonefritidy zavedením programu vyšetřujícího a léčícího asyptomatickou bakteriurii u gravidních žen [49]. Abychom předešli zbytečné léčbě, je asymptomatická bakteriurie definována jako 2 po sobě jdoucí pozitivní kultivace stejného druhu. Nesprávně může být pozitivní procento jednoduchého MSU až 40 %. Proto by ženy s pozitivní kultivací moči měly být požádány o opakovanou návštěvu během 1 až 2 týdnů, během níž je po zdůraznění důkladného očistění vulvy před mikcí získán druhý vzorek moči pomocí MSU nebo cévkováním.
Léčba by měla být založená na testování citlivosti antibiotik a obvykle zahrnuje 7denní aplikaci antibiotik; avšak někteří autoři doporučují krátkodobou terapii jako u akutní cystitidy [51]. 1–4 týdny po léčbě a alespoň jednou před porodem by měly být provedeny kontrolní kultivace.
2.8.3 Akutní cystitida v těhotenství
Většina symptomatických infekcí močových cest se u gravidních žen projevuje jako akutní cystitida stejně jako u jejich negravidních protějšků. Avšak krátkodobá terapie není u gravidních žen tak zavedená, jako u žen negravidních. Perorální cefalosporiny 2. a 3. generace, pivmecilinam nebo fosfomycin trometamol, mohou být považovány za kandidáty pro úspěšnou krátkodobou terapii. Některé menší studie a názory odborníků podporují tento přístup [51]. Jinak je doporučována konvenční terapie amoxicilinem, cefalexinem nebo nitrofurantoinem. Pro demonstraci vymýcení bakteriurie by měly být po terapii provedeny kontrolní kultivace moči. Užitím dlouhodobé profylaxe nezískáme žádný benefit s výjimkou recidivujících infekcí jako u negravidních žen. Cefalexin o nízké dávce (125–250 mg) nebo nitrofurantoin (50 mg) aplikované na noc se doporučují pro profylaxi v případě opakované infekce zahrnující puerperium. Alternativním přístupem může být profylaxe po pohlavním styku [52,53].
2.8.4 Akutní pyelonefritida v těhotenství
Akutní pyelonefritida má tendenci se objevovat v pozdějším stadiu těhotenství, obvykle v posledním trimestru. Gilstrap et al [54] zjistili akutní pyelonefritidu u 2 % z 24 000 hodnocených gravidních pacientek. Incidence se zvyšuje v puerperiu. U pacientek se obvykle vyskytuje vysoká horečka, leukocytóza a bolest v kostovertebrálním úhlu. Bakteriemie se vyskytuje často, ale v případě, že je pacient léčen efektivní terapií, není mortalita ani komplikace závažné. Hlavním problémem je přítomnost urologických abnormalit a rizik u matky, jako je například toxemie, hypertenze, předčasný porod a perinatální mortalita.
V současnosti užívaná antimikrobiální terapie je tak efektivní, že dokonce i u bakteremie téměř všechny pacientky s nekomplikovanou pyelonefritidou prodělávají terapii v dobrém stavu a během několika dnů jsou afebrilní. Mezi doporučovaná antibiotika lze zahrnout cefalosporiny 2. nebo 3. generace, aminopenicilin v kombinaci s BLI nebo aminoglykosid. Chinolony, tetracykliny a TMP by neměly být aplikovány v 1. trimestru a sulfonamidy pak v posledním trimestru v těhotenství. V případech opožděného poklesu teploty a dilatace horních cest močových může být indikováno zavedení ureterálního stentu a antimikrobiální profylaxe až do doby porodu; vhodné je zvážit možnost pokračovat v profylaxi ještě po dobu šestinedělí.
2.9 Infekce močových cest u žen po menopauze
Vagina obvykle obsahuje vzhledem k působení lokální mikrobiální flóry pouze malý počet gramnegativních enterických bakterií. Laktobacily působí nízké pH vaginy. U žen po menopauze a po antimikrobiální terapii jsou méně abundantní. Předpokládá se, že estrogeny mají ochranný vliv proti recidivující infekci močových cest u žen po menopauze, nebo podporují růst laktobacilů a snižují vaginální pH. Gramnegativní enterické bakterie obvykle vaginu u postmenopauzálních žen nekolonizují, pokud ovšem tyto ženy nejsou náchylné k recidivující infekci močových cest [56]. U postmenopauzálních žen signifikantně snížila terapie perorálním [57,58] nebo intravaginálním podáním estriolu [55] procento recidivy. U ostatních pacientek lze navíc k hormonální léčbě doporučit antimikrobiální profylaktickou léčbu (viz výše).
V případe akutní infekce močových cest je antimikrobiální léčba podobná jako u žen premenopauzálních. Avšak krátkodobá terapie u postmenopauzálních žen není tak dobře dokumentována jako u žen mladších. Raz et al [59] publikovali studii postmenopauzálních žen (průměrný věk 65 let) s nekomplikovanou infekcí močových cest, z jejíž závěru vyplynulo, že byl ofloxacin v dávce 200 mg 1krát denně podávaný po dobu 3 dnů, signifikantně efektivnější při krátkodobém i dlouhodobém sledování než 7denní léčba cefalexinem v dávce 500 mg 4krát denně, přestože byly všechny uropatogeny citlivé na oba tyto preparáty. V případě recidivující infekce močových cest by mělo být provedeno urologické nebo gynekologické vyšetření, aby se vyloučila přítomnost tumoru, obstrukčních problémů nebo genitální infekce.
2.10 Akutní nekomplikovaná infekce močových cest u mladých mužů
2.10.1 Patogeneze a rizikové faktory
Je zvykem považovat všechny infekce močových cest u mužů za komplikované, protože většina z těch, které se vyskytnou u novorozenců, kojenců nebo starších osob, je spojena s urologickými abnormalitami, obstrukcí výtoku z močového měchýře nebo instrumentací. Močové infekce u jinak zdravého dospělého muže mezi 15 a 50 lety jsou velmi vzácné. V Norsku bylo zaznamenáno 6–8 případů infekce močových cest za rok na 10 000 mužů ve věku 21–60 let.
Předpokládá se, že velký rozdíl v prevalenci infekcí močových cest u žen a mužů je způsoben více faktory, mezi něž patří větší vzdálenost mezi obvyklým zdrojem uropatogenů (anus a uretrální meatus), sušší prostředí obklopující mužskou uretru, větší délku mužské uretry a antibakteriální aktivitu prostatické tekutiny. Malý počet 15–50letých mužů přesto trpí akutními nekomplikovanými infekcemi močových cest. Přesné důvody těchto infekcí nejsou známy, mezi rizikové faktory však patří pohlavní styk s infikovaným partnerem, anální styk a absence obřízky [61], avšak tyto faktory nejsou vždy přítomny.
2.10.2 Diagnóza
Symptomy nekomplikované infekce u mužů jsou podobné jako u žen. Uretritida musí být vyloučena u pohlavně aktivních mužů pomocí barvení dle Grama nebo mikroskopickým vyšetřením 1. vzorku ranní moči pro zjištění uretrální leukocytotózy. Uretrální barvení dle Grama vykazující přítomnost leukocytů a predominantně gramnegativních tyčinek ukazuje na uretritidu způsobenou E. coli, která může předcházet, nebo doprovázet infekci močových cest. Dysurie se často vyskytuje u infekcí močových cest i uretritidy.
Etiologická agens, která způsobují nekomplikovanou infekci močových cest u mužů, jsou také podobné jako u žen. Krieger et al [62] zaznamenali, že ze 40 případů nekomplikované infekce močových cest u mužů bylo 93 % způsobeno E. coli.
2.10.3 Léčba
Vzhledem k nízké frekvenci, s níž se infekce močových cest vyskytuje u této skupiny mužů, nejsou k dispozici údaje z kontrolovaných studií. Doporučuje se empirická aplikace preparátů dříve diskutovaných u nekomplikované cystitidy nebo pyelonefritidy u žen. Nitrofurantoin by neměl být aplikován u mužů s infekcí močových cest vzhledem k tomu, že nedosahuje spolehlivé koncentrace v tkáni. U akutní nekomplikované pyelonefritidy se doporučuje aplikace fluorochinolonu jako počáteční empirická perorální léčba v oblastech, v nichž je procento rezistence E. coli na fluorochinolony nízké (< 10 %). Jinak je třeba zvážit aplikaci alternativních preparátů (viz sekce).
Přestože je možné, že krátkodobá léčba je u mužů s nekomplikovanou cystitidou efektivní, neexistují žádné studie podporující tuto praxi. Proto se u těchto mužů doporučuje terapie trvající alespoň 7 dnů s ohledem na poměrně vysokou pravděpodobnost skrytého komplikujícího faktoru, která je vyšší než u žen. Déle trvající terapie může také snížit pravděpodobnost perzistující prostatické infekce.
Význam urologického vyšetření mužů s jednoduchou nekomplikovanou infekcí močových cest nebyl stanoven. Urologické vyšetření by mělo být prováděno rutinně u adolescentů a u mužů s pyelonefritidou a recidivujícími infekcemi nebo kdykoliv je přítomen komplikující faktor.
2.11 Literatura
Doporučená četba:
Hooton TM. Diagnosis and treatment of uncomplicated UTI. Infect Dis Clin North Am 1997; 11 : 551-581.
1. Kunin CM. The concept of significant bacteriuria. In: Detection, Prevention and Management of UTIs. 4th ed. Philadelphia: Lea & Febiger 1994.
2. Johnson JR, Stamm WE. Diagnosis and treatment of acute UTIs. Infect Dis Clin North Am 1987; 1 : 773.
3. Foxman B, Frerichs RR. Epidemiology of UTI: I. Diaphragm use and sexual intercourse. Am J Public Health 1985; 75 : 1308-1313.
4. Kass EH. Asymptomatic infections of the urinary tract. Trans Assoc Am Physicians 1956; 69 : 56.
5. Johnson JR, Lyons MF II, Pearce W, Gorman P, Roberts PL, White N, Brust P, Olsen R, Gnann JW, Stamm WE. Therapy for women hospitalized with acute pyelonephritis: a randomized trial of ampicillin versus trimethoprim-sulfamethoxazole for 14 days. J Infect Dis 1991; 163 : 325-330.
6. Kunin CM. Guidelines for the evaluation of new anti-infective drugs for the treatment of UTI: additional consideration. Clin Inf Dis 1992; 15 : 1041-1044.
7. Rubin RH, Shapiro ED, Andriole UT, Davis RJ, Stamm WE. Evaluation of new anti-infective drugs for the treatment of UTI. Clin Infect Dis 1992; 15(Suppl 1): 216-227.
8. Rubin RH, Shapiro ED, Andriole VT, Davis RJ, Stamm WE, with modifications by a European Working Party.General guidelines for the evaluation of new anti-infective drugs for the treatment of UTI. Taufkirchen, Germany: The Eúropean Society of Clinical Microbiology and Infectious Diseases 1993 : 240-310.
9. Naber KG. Short-term therapy of acute uncomplicated cystitis. Curr Opin Urol 1999; 9 : 57-64.
10. Warren JW, Abrutyn E, Hebel JR, Johnson JR, Schaeffer AJ, Stamm WE. Guidelines for antimicrobial treatment of uncomplicated acute bacterial cystitis and acute pyelonephritis in women. Clin Infect Dis 1999; 29 : 745-758.
11. Minassian MA, Lewis DA, Chattopadhyay D, Bovill B, Duckworth GJ, Williams JD. A comparison between single-dose fosfomycin trometamol (Monuril®) and a 5-day course of trimethoprim in the treatment of uncomplicated lower UTI in women. Int J Antimicrob Agents 1998; 10 : 39-47.
12. Henning C, Bengtsson L. Behandling av akuta Urinvägsbesvär. Enkla test och fragor underlättar diagnos och terapival. Läkartidingen 1997; 94 : 2387-2390.
13. Petersen EE, Wingen F, Fairschild KL, Halfide A, Hendrischk A, Links M, Schad M, Scholz HR, Schurmann N, Siegmann S et al. Single dose pefloxacin compared with multiple dose co-trimoxazole in cystitis. J Antimicrob Chemother 1990; 26(Suppl B): 147-152.
14. Dubois J, St-Pierre C, Auger P, Phillips R, Perrier A. Single-dose pefloxacin vs. seven days of trimethoprim-sulfamethoxazole in uncomplicated infection of the lower urinary tract in women. Rev Infect Dis 1989; 11(Suppl 5): S1343-S1344.
15. Jardin A, Cesana M. French Multicenter Urinary Tract Infection-Rufloxacin Group. Randomized, double-blind comparison of single-dose regimens of rufloxacin and pefloxacin for acute uncomplicated cystitis in women. Antimicrob Agents Chemother 1995; 39 : 215-220.
16. Del Rio G, Dalet F, Aguilar L, Caffaratti J, Dal-Re R. Single-dose rufloxacin versus three day norfloxacin treatment of uncomplicated cystitis: clinical evaluation and pharmacodynamic considerations. Antimicrob Agents Chemother 1990; 6 : 153-160.
17. Pitkajarvi T, Pyykonen ML, Kannisto K, Püppo T, Vüta P. Pivmecillinam treatment in acute cystitis. Three versus seven days study. Árzneimittelforschung 1990; 40 : 1156-1158.
18. Nicolle LE. Pivmecillinam in the treatment of urinary tract infections. J Antimicrob Chemother 2000; 46 (Suppl S1): 35-39.
19. Roberts FJ. Quantitative urine culture in patients with UTI and bacteriuria. Am J Clin Pathol 1986; 85 : 616.
20. Weidner W, Ludwig M, Weimar B, Rau W. Rational diagnostic steps in acute pyelonephritis with special reference to ultrasonography and computed tomography. Int J Antimicrob Agents 1999; 11 : 257-259.
21. Gleckman R, Bradley P, Roth R, Hibert D, Pelletier C. Therapy of symptomatic pyelonephritis in women. J Urol 1985; 133 : 176-178.
22. Jernelius H, Zbornik J, Bauer CA. One or three weeks' treatment of acute pyelonephritis? A double-blind comparison, using a fixed combination of pivampicillin plus Pivmecillinam. Acta Med Scand 1988; 223 : 469-477.
23. Ode B, Bröms M, Walder M, Cronberg S. Failure of excessive doses of ampicillin to prevent bacterial relapse in the treatment of acute pyelonephritis. Acta Med Scand 1980; 207 : 305-307.
24. Stamm WE, McKevitt M, Counts GW. Acute renal infection in women: treatment with trimethoprim-sulfamethoxazole or ampicillin for two or six weeks. Ann Intern Med 1987; 106 : 341-345.
25. Talan DA, Stamm WE, Reuring-Scherer J, Churet D, and the Pyelonephritis Investigators Group, USA. Ciprofloxacin (CIP) 7-day vs. TMP/SMZ 14-day ceftriaxone (CRO) for acute uncomplicated pyelonephritis: a randomized, double-blind trial. International Congress of Infectious Diseases. Boston, MA, USA, 1998.
26. Engel JD, Schaeffer AJ. Evaluation of and antimicrobial therapy for recurrent UTIs in women. Urol Clin North Am 1998; 25 : 685-701.
27. Sanford JP. Urinary tract symptoms and infection. Ann Rev Med 1975; 26 : 485.
28. Kinane DF, Blackwell CC, Brettle RP, Weir DM, Winstanley FP, Eltor RA. ABO blood group, secretor state and susceptibility to recurrent UTI in women. BMJ 1982; 285 : 7.
29. Fenell RS, Wilson SG, Garin EH, Pryor ND, Sorgen CD, Walker RD, Richard GA.
Bacteriuria in families of girls with recurrent bacteriuria. Clin Pediatr 1977; 16 : 1132.
30. Schaeffer AJ, Jones J, Dunn JK. Association of in vitro Escherichia coli adherence to vaginal and buccal epithelial cells with susceptibility of women to recurrent UTIs. N Engl J Med 1981; 304 : 1062-1066.
31. Kozody NL, Harding GKM, Nicolle LD, Kelly K, Ronad AR. Adherence of Escherichia colito epithelial cells in the pathogenesis of UTI. Clin Invest Med 1985; 8 : 121-125.
32. Nicolle LE, Harding GKM, Preiksaitis J, Ronald AR. The association of urinary tract infection with sexual intercourse. J Infect Dis 1982; 146 : 579-583.
33. Fihn SD, Latham RH, Roberts P, Running K, Stamm WE. Association between diaphragm use and UTI. JAMA 1985; 254 : 240-245.
34. Nicolle LE, Ronald AR. Recurrent UTI in adult women: diagnosis and treatment. Inf Dis Clin North Am 1987; 1 : 793-806.
35. Harding GKM, Ronald AR, Nicolle LE, Thomson MJ, Gray GJ. Long-term antimicrobial prophylaxis for recurrent UTI in women. Rev Infect Dis 1982; 4 : 438-443.
36. Nicolle LE, Harding GKM, Thomson M, Kennedy J, Urias B, Ronald AR. Efficacy of five years of continuous low dose cotrimoxazole prophylaxis for prevention of UTI. J Infect Dis 1988; 157 : 1239-1242.
37. Vosti KL. Recurrent UTIs: prevention by prophylactic antibiotics after sexual intercourse. JAMA 1990; 264 : 703-706.
38. Stapleton A, Latham RH, Johnson C, Stamm WE. Post-coital antimicrobial prophylaxis for recurrent urinary infection. JAMA 1990; 264 : 703-706.
39. Melekos MD, Asbach HW, Gerharz E, Naber KG. Post-intercourse versus daily ciprofloxacin prophylaxis for recurrent UTIs in premenopausal women. J Urol 1997; 157 : 935.
40. Jepson RG, Miha jevic L, Craig S. Cranberries for the prevention of UTIs (Cochrane Review). The Cochrane Library. 4th ed Oxford: Update software 1998.
41. Reid G, Bruce AW, Taylor M. Influence of three-day antimicrobial therapy and lactobacillus vaginal suppositories on recurrence of UTIs. Clin Ther 1992; 14 : 11-16.
42. Baerheim A, Larsen E, Digranes A. Vaginal application of lactobacilli in the prophylaxis of recurrent lower UTI in women. Scand J Prim Health Care 1994; 12 : 239-243.
43. Schulman CC, Corbusier A, Michiels H, Taenzer HJ. Oral immunotherapy of recurrent UTIs: a double-blind placebo-controlled multicenter study. J Urol 1993; 150 : 917-921.
44. Hachen HJ. Oral immunotherapy in paraplegic patients with chronic UTIs: a double-blind placebo-controlled trial. J Urol 1990; 143 : 759-763.
45. Kunin CM. UTIs. Detection, prevention, and management. 5th ed. Baltimore: Williams & Wilkins 1997.
46. MacLean AB. UTI in pregnancy. Br J Urol 1997; 80(Suppl 1): 10-14.
47. Kass EH. Bacteriuria and pyelonephritis of pregnancy. Arch Intern Med 1960; 105 : 194-198.
48. Stenqvist K, Dahlen-Nilsson I, Lidin-Janson G, Lincoln K, Oden A, Rignell S, Svanborg-Eden C. Bacteriuria of pregnancy. Frequency and risk acquisition. Am J Epidemiol 1989; 129 : 372-379.
49. Gratacos E, Torres PJ, Vila J, Alonso PL, Cararach V. Screening and treatment of asymptomatic bacteriuria in pregnancy prevent pyelonephritis. J Inf Dis 1994; 169 : 1390-1392.
50. Wadland WC, Planten DA. Screening for asymptomatic bacteriuria in pregnancy. A decision and cost analysis. J Fam Pract 1989; 29 : 372-376.
51. Bailey RR. Single-dose/short-term therapy in children and in pregnant women. Infection 1994; 22(Suppl 1): S47-S48.
52. Pfau A, Sacks TG. Effective prophylaxis for recurrent UTIs during pregnancy. Clin Infect Dis 1992; 14 : 810-814.
53. Pfau A. Recurrent UTI in pregnancy. Infection 1994; 22(Suppl 1): S49.
54. Gilstrap LC, Cunningham FG, Whalley PJ. Acute pyelonephritis in pregnancy: a retrospective study. Obstet Gynecol 1981; 57 : 409-413.
55. Raz R, Stamm WE. A controlled-trial of intravaginal estriol in postmenopausal women with recurrent UTIs. N Engl J Med 1993; 329 : 753-756.
56. Pfau A, Sacks T. The bacterial flora of the vaginal vestibule, urethra and vagina in the normal premenopausal woman. J Urol 1977; 118 : 292-295.
57. Privette M, Cade R, Peterson J, Mars D. Prevention of recurrent urinary tract infections in postmenopausal women with urogenital infections. Nephron 1988; 50 : 24-27.
58. Kirkengen AL, Andersen P, Gjersoe E, Johannessen GR, Johnsen N, Bodd E. Oestriol in the prophylactic treatment of recurrent UTIs in postmenopausal women. Scand J Prim Health Care 1992; 10 : 139-142.
59. Raz R, Rottensterich E, Leshem Y, Tabenkin H. Double-blind study comparing 3-day regimens of cefixime and ofloxacin in treatment of uncomplicated UTIs in women. Antimicrob Agents Chemother 1994; 38 : 1176.
60. Vorland LH, Carlson K, Aalen ODD. An epidemiological survey of UTIs among outpatients in Northern Norway. Scand J Infect Dis 1985; 17 : 272.
61. Stamm WE. UTIs in young men. In: Bergan T (ed). UTIs: Infectiology. Basel: Karger 1997; 46-47.
62. Krieger JN, Ross SO, Simonson JM. UTIs in healthy university men. J Urol 1993; 149 : 1046.
3. INFEKCE MOČOVÝCH CEST U DĚTÍ
3.1 Souhrn
Klinické projevy infekce močových cest u kojenců a malých dětí mohou být velmi atypické. Vyšetření by mělo být provedeno po 2 příhodách infekce u dívek a 1 u chlapců. Cílem je vyloučení neobvyklého výskytu obstrukce, vezikoureterálního refluxu (VUR) a neuropatického míšního onemocnění. Fimóza, labiální adheze a zácpa mohou být také relevantní.
Ultrasonografie horních močových cest doplněná mikční cystouretrografií (VCU) je zobrazovací vyšetření 1. volby u kojenců a velmi malých dětí. Později v dětství je VCU nahrazena nepřímou radionuklidovou cystografií.
Chronické pyelonefritické jizvení ledviny se vytvoří již v raných stadiích života. Je způsobeno kombinací infekce močových cest, intrarenálním refluxem a VUR. Někdy se jako důsledek dysplazie objeví již in utero. Po 2. roce života se nové jizvy vytvoří jen vzácně. Je nepravděpodobné, že by i velmi časné odhalení a léčba refluxu mohla signifikantně změnit incidenci refluxní nefropatie, a proto má screening asymptomatické bakteriurie u kojenců malý benefit.
VUR je léčen dlouhodobou profylaxí antibiotiky, operační reimplantace se provádí pouze u malého počtu dětí s významnou infekcí.
Pravidla léčby infekce močových cest u dětí jsou poněkud odlišnější, než je tomu u dospělých.
Krátkodobé podávání není obecně přijímáno, a proto léčba trvá 7 až 10 dní. Pokud dítě zvrací a je dehydratované, vyžaduje se hospitalizace a aplikace parenterálních antibiotik alespoň po první 2 dny. Tetracykliny a fluorochinolony by se neměly vzhledem k jejich nežádoucímu vedlejšímu účinku na zuby a chrupavku aplikovat.
3.2 Úvod
Infekce močových cest představuje nejčastěji se vyskytující bakteriální infekci u dětí mladších 2 let [1]. Důsledek infekce je obvykle benigní, ale u kojenců může progredovat k tvorbě renálních jizev, zejména ve spojitosti s kongenitálními anomáliemi močových cest. Opožděné následky spojené s renálním jizvením vedou nakonec k hypertenzi, proteinurii, renálnímu poškození a v konečném stadiu až u 24 % dětí k onemocnění ledvin, vyžadujícímu léčbu chronickou dialýzou. Přispívají také ke chronickému renálnímu selhání u významného počtu dospělých [2].
Bylo zjištěno, že 5 % dívek školního věku a 0,5 % chlapců školního věku prodělá alespoň 1 příhodu infekce močových cest během školního věku. Riziko infekce močových cest v 1. dekádě života je 1 % u chlapců a 3 % u dívek. Incidence je odlišná u dětí mladších 3 měsíců, v tomto období je častější mezi chlapci. Kolem 6 měsíců věku je odhadovaný poměr mezi dívkami a chlapci 10 : 1. Incidence asymptomatické bakteriurie je 0,7–3,4 % u novorozenců, 0,7–1,3 % u kojenců mladších 3 let a mezi 0,2 a 0,8 % u chlapců a dívek předškolního věku. Incidence symptomatické bakteriurie je 0,14 % u novorozenců s dalším zvýšením na 0,7 % u chlapců a 2,8 % u dívek mladších než 6 měsíců. Celkové procento recidivy v novorozeneckém věku se uvádí ve výši 25 % [3,4].
3.3 Etiologie
Nejčastěji se vyskytujícími patogeny jsou gramnegativní, hlavně enterické organizmy, z nichž E. coli je zodpovědná za 90 % všech příhod infekcí močových cest [5]. Grampozitivní mikroorganizmy (zejména Enterococcus a Staphylococcus spp) jsou pak patogeny u 5–7 % případů. Infekce získáné při hospitalizaci představují širokou škálu agresivních organizmů (např. Klebsiella, Serratia a Pseudomonas spp). Streptococcus skupiny A a B se vyskytuje poměrně často u novorozenců. Lze pozorovat trend stále častější izolace S. saprophyticus
3.4 Patogeneze
Infekce močových cest může být vyvolána obstrukcí zapříčiněnou celou řadou kongenitálních abnormalit močových cest, kupř. uretrálními chlopněmi, obstrukcí pyelouretrální junkce nebo neobstrukční stázou (tj. „prune belly“ syndrom - VUR). Běžnější, ale signifikantnější příčiny infekce močových cest zahrnují labiální adhezi a chronickou zácpu [7]. Také fimóza může predisponovat ke vzniku infekce močových cest, do jaké míry je však zatím stále sporné [8-10]. Mechanizmus je však zřejmý: enterobakterie pocházející z intestinální flóry kolonizují předkožkový vak, povrch glans penis a distální uretru. Mezi těmito organizmy jsou kmeny E. coli s P fimbriemi, jež přilnou k vnitřní vrstvě předkožky a k uroepiteliálním buňkám [11] a mají tendenci se šířit vzestupně až do renálního parenchymu. Většina dalších patogenů močových cest prochází vzhůru luminem nebo perivezikálními a ureterickými lymfatickými cestami.
U novorozenců může infekce výjimečně dosáhnout renálního parenchymu hematogenním šířením. Dysfunkční mikce u jinak normálního dítěte může vést k méně častému vyprazdňování močového měchýře, které je podporováno oddalujícími manévry, např. křížení nohou, sezení na patách ap [12]. Tato dysfunkce může také být projevem zneužívání dítěte. Pelvická nefropatie je obvykle spojena se spina bifida a může způsobit infekci zejména v těch případech, v nichž je obstrukce způsobená sfinkterovou dyssynergií vyvolanou VUR. Reziduální moč se může také hromadit jako následek lézí dolního motoneuronu [3].
Spojitost mezi renálním poškozením a infekcí močových cest je sporný. Mechanizmus obstrukční nefropatie je zřejmý, ale pokud se objeví VUR, vyskytují se drobné změny. Nezbytné komponenty téměř jistě zahrnují VUR, intrarenální reflux a infekci močových cest. Všechny musí působit současně v časném dětství, kdy je rostoucí ledvina náchylná k parenchymatózní infekci. V pozdějším věku se zdá přítomnost bakteriurie irele-vantní vzhledem k progresi existujících jizev, nebo velmi neobvyklé tvorbě nových jizev. Dalším přidruženým faktorem je, že mnoho takzvaných jizev je ve skutečnosti in utero vytvořená dysplastická renální tkáň.
3.5 Znaky a symptomy
Symptomy jsou nespecifické, přestože existuje přímý vztah s věkem dítěte.
3.5.1 Novorozenci
Obvyklý obraz je charakterizován známkami špatné výživy, narušením normálního vývoje, podrážděností, asymptomatickou bakteriurií (1 %) nebo septickým šokem.
3.5.2 Děti mladší než 6 měsíců
Zde je mírná predominance gastrointestinálních symptomů, jako je zvracení, průjem, známky špatné výživy, nezdravý vzhled nebo abdominální distenze. U 5 až 10 % případů skrytého průběhu febrilního syndromu neznámého původu je infekce močových cest. Také žloutenka je poměrně častým symptomem způsobeným jaterní toxicitou nebo hemolytickým efektem některých kmenů E. coli. Další symptomy spojené s močovými cestami, jako je intermitentní dysfukční mikce nebo slabý proud moči, mohou být neurčité.
3.5.3 Děti předškolního věku (2 až 6 let)
Syptomy jsou více specifické a souvisí s močovými cestami. Obvyklými nálezy jsou horečka, častá mikce, dysurie, bolest v suprapubické a abdominální oblasti nebo inkontinence
3.5.4 Děti školního věku a adolescenti
Je možné rozlišit mezi infekcí dolních cest močových (cystitida) a horních cest močových (pyelonefritida), protože pacienti jsou schopni popsat své symptomy a vztáhnout je k určité anatomické lokalizaci.
3.5.5 Závažnost infekce močových cest
Z praktických důvodů by měly být rozlišeny závažné a jednoduché formy infekce močových cest vzhledem k tomu, že závažnost symptomů do jisté míry určuje stupeň urgence, s níž je prováděno vyšetřování a léčba (Schéma 2).
Schéma 2. Klinická klasifikace infekce močových cest u dětí. 
3.5.6 Závažné infekce močových cest
Infekci močových cest považujeme za závažnou, pokud má dítě horečku > 39°C, nemocný vzhled, přetrvávající zvracení a mírnou nebo těžkou dehydrataci. Pokud je očekáván nízký stupeň kompliance, mělo by být s dítětem nakládáno jako při závažné infekci močových cest.
3.5.7 Jednoduchá infekce močových cest
Dítě s nekomplikovanou infekcí močových cest může mít pouze mírnou pyrexii, ale je schopno přijímat tekutiny a perorální preparáty. Takové dítě je dehydratované pouze mírně, nebo vůbec a má dobrý očekávaný stupeň kompliance.
3.5.8 Epididymoorchitida
Epididymoorchitida je velmi neobvyklá, bolest v šourku a zánět je u chlapců před pubertou obvykle způsoben torzí.
3.6 Diagnóza
3.6.1 Fyzikální vyšetření
Je nezbytné vyloučit přítomnost fimózy, labiální adheze nebo symptomy pyelonefritidy nebo epididymoorchitidy. Absence horečky nevylučuje přítomnost zánětlivého procesu.
3.6.2 Laboratorní testy
Rozbor moči: někdy je obtížné získat vzorky a jsou užívány různé metody. U dětí mladších 2 let mohou být vzorky moči odebrány přiložením plastikového jímače na genitálie, katetrizací močového měchýře nebo suprapubickou aspirací. U starších dětí může být vhodným vzorkem střední proud moči. Pokud je vzorek moči získán přímo ze sběrného váčku, je za validní výsledek považována pouze negativní kultivace moči. Nejspolehlivější vzorek je odebrán suprapubickou aspirací, protože všechny nalezené organizmy jsou považovány za signifikantní bakteriurii (s výjimkou £ 300 cfu/ml koaguláza-negativní Staphyloccocus spp). Laboratoř musí být instruována, aby hledala bakteriurie s nízkým počtem kolonií. V případě katetrizace je nebytný počet ≥ 1 000–50 000 cfu/ml, abychom mohli považovat bakteriurii za signifikantní. Jinak se vyžaduje pro posouzení bakteriurie jako signifikantní počet ≥ 10 000 cfu/ml u mikce středního proudu u symptomatických dětí nebo ≥ 100 000 cfu/ml 2 různé dny u asymptomatických dětí.
Avšak stále sílí názor, že výskyt 5 000–10 000 cfu patogenu/ml ve 2 různých vzorcích u symptomatického dítěte by měl být považován za signifikantní bakteriurii [5] (Schéma 3).
Schéma 3. Mikrobiologická kritéria infekce močových cest u dětí. 
Je také nezbytné mít na mysli, že konečná koncentrace bakterií v moči je přímo závislá na metodě odběru vzorků, diuréze a metodě uskladňování a transportu vzorku po odběru [13].
Rozbor moči: Mikroskopické vyšetření močového sedimentu poskytuje užitečnou informaci o přítomnosti leukocytů a uropatogenů. Prospěšná je pak kombinace nitrátového testu s testem na leukocytární esterázu na jednom testovacím proužku.
Bakteriurie bez pyurie může být zjištěna v případech bakteriální kontaminace, když odebíráme vzorek před nástupem zánětlivé reakce nebo bakteriální kolonizace - je to klinický syndrom známý jako asymptomatická bakteriurie. V takových případech se doporučuje pro objasnění situace opakovat rozbor moči po 24 hodinách. U febrilních dětí s pozitivní kultivací moči by měla absence pyurie zpochybnit diagnózu infekce močových cest. Spíše je v takovém případě vhodné uvažovat o asymptomatické bakteriurii s konkomitantním septickým ložiskem zodpovědým za febrilní syndrom.
Bakteriurie bez pyurie je zjištěna v 0,5 % vzorků, prevalence, jež koresponduje s odhadovaným procentem asymptomatické bakteriurie [14,15]. Absence nebo přítomnost pyurie sama o sobě tedy nemusí být považována za spolehlivý parametr, pomocí nějž lze diagnostikovat, nebo naopak vyloučit infekci močových cest. I další faktory mohou ovlivnit výsledky testu, jsou to např. stupeň hydratace, metoda odběru vzorku, způsob centrifugace, objem, v němž je sediment znovu rozpuštěn a subjektivní interpretace výsledků [16]. Ze všech těchto důvodů má screening infekce močových cest u novorozenců a dětí mladších 6 měsíců, zahrnující mikroskopické vyšetření bílých krvinek (white blood cells - WBC) nebo bakterií nebo nitrátový test, minimální předpovědní hodnotu [17-19]. Naopak pozitivní prediktivní hodnota signifikantního barvení dle Grama u pyurie je 85% [14].
Kombinací obou diagnostických procedur jsou u febrilních dětí nálezy ≥ 10 WBC/mm3 a ≥ 50 000 cfu/ml u vzorků odebraných při katetrizaci signifikantní pro infekci močových cest a rozlišují infekci od kontaminace [14,17]. Dle Landaua et al [20] ukazuje pyurie u dětí s febrilní atakou na akutní pyelonefritidu.
N-acetyl-beta-glukosaminidáza, marker tubulárního poškození, se zvyšuje u febrilních infekcí močových cest a může se stát spolehlivým diagnostickým testem pro infekci močových cest [21], přestože je zvýšena také u VUR. Klinické užití koncentrace interleukinu (IL)-6 u infekce močových cest [22] je stále ve fázi výzkumu.
C-reaktivní protein (CRP): Ačkoliv je nespecifický u febrilních dětí s bakteriurií, zdá se být CRP užitečný při rozlišování mezi akutní pyelonefritidou a asymptomatickou bakteriurií společně s neurologickým problémem. Je považován za signifikantní při koncentraci > 20 µg/ml.
3.6.3 Zobrazovací vyšetření močových cest
Zobrazovací technika považovaná za „zlatý standard“ by byla cenově výhodná, bezbolestná, bezpečná, s minimální nebo žádnou radiací a schopností detekovat jakoukoliv signifikantní strukturální anomálii. Současné techniky ještě nesplňují tyto požadavky. Nejdůležitější zobrazovací procedury jsou uvedeny níže.
Ultrasonografie
Je při vyšetřování dětí velmi populární vzhledem k bezpečnosti, rychlosti, absenci ionizující radiace a vysoké přesnosti při identifikaci anatomie a velikosti renálního parenchymu a vývodného systému. Je subjektivní, závisí tedy na vyšetřujícím, a nepodává žádnou informaci o renální funkci. Avšak lze identifikovat jizvy, přestože ne tak dobře jako na DMSA scanu [23-25]. Bylo prokázáno, že je při detekci signifikantních renálních abnormalit stejně citlivá jako vylučovací urografie [26].
Radionuklidová vyšetření
Technetium (Tc)-99m DMSA je radioizotop, ktery se váže k bazální membráně proximálních tubulárních renálních buněk, polovina dávky zůstává v renální kůře po 6 hodinách. Tato technika je užitečná při posuzování funkčního renálního parenchymu a zabezpečuje přesnou diagnózu jizvení kůry ledviny, protože ukazuje oblasti s nízkou aktivitou nebo nedostatečnou funkcí. Infekce močových cest interferuje s příjmem tohoto raditoizotopu buňkami proximálního renálního tubulu, což umožňuje adekvátní zobrazení oblastí s fokálním defektem v renálním parenchymu. Proto radionuklidový scan, prokazující snížení příjmu radioizotopu s defektem ve tvaru hvězdy v renálním parenchymu, ukazuje na akutní příhodu pyelonefritidy, stejné snížení ovšem s nedostatečnou fokální vizualizací renální kůry, by ukazovalo na přítomnost chronické léze [27-29].
Scan Tc-99m DMSA je užitečný pro identifikaci refluxní nefropatie projevující se buï jako fokální jizvení, nebo jako hladká uniformní ztráta renální tkáně [30,31]. Rushton et al [32] konstatovali, že pouze děti s prokázaným snížením příjmu radioizotopu jsou ve vážném riziku vzniku signifikantní renální jizvy bez ohledu na existenci VUR. Z tohoto důvodu by bylo rozumné začít v těchto případech antimikrobiální profylaxi. Ransley a Risdon [33] zaznamenali, že Tc-99m DMSA prokazuje 100% specifitu a 80% senzitivitu. Další studie odhalily, že minimální defekt parenchymu, pokud je charakterizován mírnou oblastí hypoaktivity, může být zhojen pomocí antimikrobiální terapie ve 100 % případů [34,35]. Dlouhotrvající defekty jsou nevyhnutelně spojeny se vznikem renálních jizev. Ve skutečnosti bude 40 % těchto renálních jizev objevujících se jako následek pyelonefritidy nezvratných [36].
Radionuklidové scany také poskytují metodu časné diagnózy: v 1. týdnu akutní epizody pyelonefritidy vykazuje 50–85 % dětí pozitivní nálezy. Navíc jsou takové scany považovány při detekci renálních jizev za citlivější než vylučovací urografie a ultrasonografie [37-40]. Je proto navrhováno, že radionuklidové skeny mohou nahradit echografii jako přístup 1. volby u dětí s infekcí močových cest [41].
Cystouretrografie
Existují 2 druhy cystouretrografie.
Konvenční VCU je nejčastěji užívaným radiologickým vyšetřením při vyšetřování dolních cest močových a zejména VUR. Je považována za nezbytnou při vyšetřování infekce močových cest u dětí mladších než 1 rok. Hlavními nevýhodami jsou riziko infekce, potřeba retrográdního plnění močového měchýře a možný efekt radiace na dítě [42]. V posledních letech byla pro vyšetření VUR u dívek užívána fluoroskopická VCU s nízkou dávkou z důvodu minimalizace vystavení radiaci [43].
Radionuklidová cystografie (nepřímá) se provádí prodloužením doby scanování po injikování Tc-99m DTPA/MAG-3 jako část dynamické renografie. Představuje atraktivní alternativu ke konvenční cystografii zejména při sledování pacientů s refluxem vzhledem k její nízké dávce radiace. Nevýhodami jsou slabá zobrazovací rozlišovací schopnost a obtíže při detekování abnormalit močových cest [44].
Vylučovací urografie zůstává cenným nástrojem při vyšetřování močových cest u dětí, ale její užití při infekci močových cest je diskutabilní, dokud předběžné explorace jako VCU nebo radionuklidové scany neodhalí existenci VUR. Hlavní nevýhodou u kojenců jsou vedlejší účinky kontrastní látky a vystavení radiaci [45].
CT–scan má navzdory své zavedené roli při diagnostikování lézí horních cest močových značně omezené užití při sledování infekce močových cest u dětí ze stejných důvodů jako vylučovací uroGramy [46].
3.7 Plán vyšetření
Plán vyšetření infekce močových cest u dítěte je zobrazen ve Schématu 4.
Schéma 4. Plán vyšetření infekce močových cest u dítěte. 
Není pravděpodobné, že screening vyhledávající asymptomatickou bakteriurii u kojenců může předejít tvorbě pyelonefritických jizev vzhledem k tomu, že se obvykle tvoří již v ranném stadiu vývoje. Pouze malý počet dětí s infekcí močových cest má další urologické onemocnění, ale pokud je takové onemocnění přítomno, může způsobovat značnou morbiditu. Proto je třeba po 2 epizodách infekce močových cest u dívek a 1 epizodě u chlapců podstoupit vyšetření, ovšem nikoli v případě asymptomatické bakteriurie [47-50]. U kojenců by mělo být provedeno ultrazvukové vyšetření a přímá VCU. Později (> 5 let) je VCU nahrazeno nepřímou radionuklidovou cystografií. DMSA – –scan by měl být proveden po průkazu VUR. Potřeba provedení DTPA/MAG-3 scanu je podmíněna nálezy ultrazvukového vyšetření, zejména v případě podezření na obstrukční lézi.
3.8 Léčba
Léčba má 4 hlavní cíle:
- Eliminace symptomů a eradikaci bakteriurie u akutní příhody.
- Prevence renálního jizvení.
- Prevence recidivující infekce močových cest.
- Korekce sdružených urologických lézí.
Přehled léčby febrilní infekce močových cest u dětí je znázorněn ve schématu 5.
Schéma 5. Léčba febrilní infekce močových cest u dětí. 
3.8.1 Závažná infekce močových cest
Závažná infekce močových cest vyžaduje adekvátní parentální doplnění tekutiny a vhodnou antimikrobiální léčbu, nejlépe cefalosporiny. Pokud je podezření na grampozitivní infekci močových cest, je vhodné aplikovat aminoglykosidy, ampicilin nebo amoxicilin/klavulanát [51]. V případě alergie na cefasporiny může být užit aztreonam nebo gentamycin. Pokud je aplikace aminoglykosidů nezbytná, je třeba monitorovat jejich hodnoty v séru. Pokud jsou v kultivaci moči nalezeny koky, představuje léčbu volby ampicilin nebo amoxicilin/klavulanát.
U novorozenců je pozorování koncentrací antimikrobiálních preparátů v séru a následné upravení dávkování pro kompenzaci deficitu renální funkce povinné. Měli bychom se vyhnout aplikaci chloramfenikolu, sulfonamidů, tetracyklinů, rifampicinu, amfotericinu B a chinolonů. Užití ceftraxionu je třeba se vyvarovat vzhledem k jeho vedlejšímu účinku - vzniku žloutenky.
U starších dětí je možno užit celou škálu antimikrobiálních preparátů, s výjimkou tetracyklinů (vzhledem k tomu, že způsobují tvorbu skvrn na zubech) a fluorochinolonů (vzhledem k toxixitě vůči chrupavce) [52]. Po dobu 24–36 hodin by měla být aplikována parenterální terapie. Pokud je dítě v dobrém stavu, afebrilní a je schopno přijímat tekutiny, je možno aplikovat perorální preparát po dobu 10-14 dnů. Preferovanými antimikrobiálními preparáty jsou: amoxicilin, cefalexin, cefixim nebo TMP. Ambulantní léčba má některé výhody, jako například menší psychická zátěž pro dítě a větší komfort pro celou rodinu. Je levnější, dobře snášená a předchází oportunní infekci [14]. U dětí mladších než 3 roky, které mají potíže s polykáním perorálních medikamentů, se doporučuje parenterální léčba po dobu 7–10 dnů.
Přestože je to diskutabilní téma, zdá se rozumným řešením denní aplikace antimikrobiální profylaxe po akutní epizodě alespoň 6 měsíců. Nejúčinnějšími antimikrobiálními preparáty jsou nitrofurantoin, TMP, cefalexin a cefaclor [53].
3.8.2 Prostá infekce močových cest
Je považována u dětí za infekci s nízkým rizikem, a proto je adekvátní parenterální aplikace cefalosporinu 1 dávkou, například ceftriaxonu nebo v případě alergie aztreonamu. Poté následuje aplikace TMP, cefalexinu nebo amoxicilinu po 10–14 dní. Jakmile je léčba ukončena, měla by být započata antimikrobiální profylaxe trvající alespoň 6 měsíců. V případě nedostatečné odpovědi, komplikací nebo pozitivní kultivace krve je třeba dítě hospitalizovat a započít parenterální léčbu [54].
Dávkování antimikrobiálních přípravků je uvedeno v tab. 3.
Tab. 3. Dávkování antimikrobiálních přípravků u dětí (Převzato z [55]). ![Dávkování antimikrobiálních přípravků u dětí (Převzato z [55]).](https://www.prelekara.sk/media/cache/resolve/media_object_image_small/media/image/cb018dd592b1dbf1fcca94eddff1d9d8.png)
3.9 Literatura
1. Jodal U. The natural history of bacteriuria in childhood. Infect Dis Clin North Am 1987; 1 : 713-729.
2. Jacobson SH, Eklof O, Eriksson CG, Lins LE, Tidgren B, Winberg J. Development of uraemia and hypertension after pyelonephritis in childhood. A 27-year follow up. BMJ 1989; 299 : 703-706.
3. Lettgen B. Harnwegsinfektionen in Kindesalter. Altes and Neues. Klin Padiatr 1993; 205 : 325-331.
4. Feld LG, Greenfield SP, Ogra PL. UTI in infants and children. Pediatr Rev 1990; 11 : 71-77.
5. Shapiro ED. Infections of the urinary tract. Pediatr Infect Dis J 1991; 11 : 165-168.
6. Abrahamsson K, Hansson S, Jodal U, Lincoln K. Staphylococcus saprophyticus UTIs in children. Eur J Pediatr 1993; 152 : 69-71.
7. Watson AR. UTI in early childhood. J Antímicrob Chemother 1994; 34 : 53-60.
8. Craig JC, Knight JF, Sureshkuman P, Mantz E, Roy LP. Effect of circumcision on incidence of UTI in preschool boys. J Pediatr 1996; 128 : 23-27.
9. Wiswell TE, Smith FR, Bass JW. Decreased incidence of urinary tract infections in circumcised male infants. Pediatrics 1985; 75 : 901-903.
10. Wiswell TE, Hachey WE. UTIs and the uncircumcised state: an update. Clin Pediatr 1993; 32 : 130-134.
11. Fusell EN, Roberts JA. Adherence of bacteria to human foreskins. J Urol 1988; 140 : 997-1001.
12. Wan J, Kaplinsky R, Greenfield S. Toílet habits of children evaluated for UTI. J Urol 1995; 154 : 797-799.
13. Stork JE. UTI in children. Adv Pediatr Infect Dis 1987; 2 : 115-134.
14. Hoberman A, Wald ER. UTIs in young febrile children. Pediatr Infect Dis J 1997; 16 : 11-17.
15. Wettergren B, Jodal U, Noren L, Bjure J. Spontaneous clearance of asymptomatic bacteriuria during the first year of life. Acta Paediatr Scand 1985; 74 : 925-926.
16. Stamm WE. Measurement of pyuria and its relationship to bacteriuria. Am J Med 1983; 75 : 53-58.
17. Hoberman A, Chao HP, Keller DM, Hickey R, Davis HW, Ellis D. Prevalence of UTI in febrile infants. J Pediatr 1993; 123 : 17-23.
18. Hoberman A, Wald ER, Reynolds EA, Penchansky L, Charron M. Pyuria and bacteriuria in urine specimens obtained by catheter from young children with fever. J Pediatr 1994; 124 : 513-519.
19. Piercey KR, Khoury AE, McLorie GA, Churchill BM. Diagnosis and management of UTIs. Curr Opin Urol 1993; 3 : 25-29.
20. Landau D, Turner ME, Brennan J, Majd M. The value of urinalysis in differentiating acute pyelonephritis from lower UTI in febrile infants. Pediatr Infect Dis J 1994; 13 : 777-781.
21. Jantausch PA, Rifai N, Getson P, Akrem S, Majd M, Wiedermann BL. Urinary N-acetyl-beta-glucosaminidase and beta-2-microglobulin in the diagnosis of UTI in febrile infants. Pediatr Infect Dis J 1994; 13 : 294-299.
22. Benson M, Jodal U, Andreasson A, Karlsson A, Rydberg J, Svanborg C. Interleukin 6 response to UTI in childhood. Pediatr Infect Dis J 1994; 13 : 612-616.
23. Kass EJ, Fink-Bennett D, Cacciarelli AA, Balon H, Pavlock S. The sensitivity of renal scintigraphy and sonography in detecting nonobstructive acute pyelonephritis. J Urol 1992; 148 : 606-608.
24. Tasker AD, Lindsell DRM, Moncrieff M. Can ultrasound reliably detect renal scarring in children with UTI, Clin Radiol 1993; 47 : 177-179,
25. Pickworth FE, Carlin JB, Ditchfield MR, de Campo MP, Cook DJ, Nolan T, Powell HR, Sloane R, Grimwood K. Sonographic measurement of renal enlargement in children with acute pyelonephritis and time needed for resolution: implications for renal growth assessment. Am J Roentgenol 1995; 155 : 405-408.
26. Kangarloo H, Gold RH, Fine RN, Diament RJ, Boechat MI. UTI in infants and children evaluated by ultrasound. Radiology 1985; 154 : 367-373.
27. Kass EJ. Imaging in acute pyelonephritis. Curr Opin Urol 1994; 4 : 39-44.
28. Stutley JE, Gordon I. Vesico-ureteric reflux in the damaged non-scarred kidney. Pediatr Nephrol 1992; 6 : 25-29.
29. Britton KE. Renal radionuclide studies. In: Whitfield HN, Hendry WF, Kirby RS, Duckett JW {eds). Textbook of Genitourinary Surgery. Oxford: Blackwell Science 1998; 76-103.
30. Rosenberg AR, Rossleigh MA, Brydon MP, Bass SJ, Leighton DM, Farnsworth RH. Evaluation of acute UTI in children by dimercaptosuccihic acid scintigraphy: a prospective study. J Urol 1992; 148 : 1746-1749.
31. Jakobsson B, Soderlundh S, Berg U. Diagnostic significance of 99m Tc-dimercaptosuccinic acid (DMSA) scintigraphy in UTI. Arch Child Dis 1992; 67 : 1338-1342.
32. Rushton HG, Majd M, Jantausch B, Wiedermann L, Belman AB. Renal scarring following reflux and non-reflux pyelonephritis in children: evaluation with 99m Technetium-dimercaptosuccinic acid scintigraphy. J Urol 1992; 147 : 1327-1332.
33. Ransley PG, Risdon RA. Renal papillary morphology in infants and young children. Urol Res 1975; 3 : 111-113.
34. Risdon RA. The small scarred kidney of childhood; a congenital or an acquired lesion? Pediatr Nephrol 1987; 1 : 632-637.
35. Risdon RA, Godley ML, Parkhouse HF, Gordon I, Ransley PG. Renal pathology and the 99m Tc-DMSA image during the evolution of the early pyelonephritic scar: an experimental study. J Urol 1994; 151 : 767-773.
36. Jacobson B, Berg U, Svensson L. Renal scarring after acute pyelonephritis. Arch Dís Child 1994; 70 : 111-115.
37. Rushton HG, Majd M, Chandra R, Yim D. Evaluation of 99m Tc dimercapto-succinic acid renal scans in experimental acute pyelonephritis in piglets. J Urol 1988; 140 : 1169-1174.
38. Bircan ZE, Buyan N, Hasanoglu E, Ozturk E, Bayhan H, Isik S. Radiologic evaluation of UTI. Int Urol Nephrol 1995; 27 : 27-32.
39. Elison BS, Taylor D, Van der Wall H, Pereira FK, Cahill S, Rosenberg AR, Farnworth RH, Murray IP. Comparison of DMSA scintigraphy with intravenous urography for the detection of renal scarring end its correlation with vesicoureteric reflux. Br J Urol 1992; 69 : 294-302.
40. MacKenzie JR, Fowler K, Hollman AS, Tappin D, Murphy AV, Beattie TJ, Army AE. The value of ultrasound in the child with an acute UTI. Br J Urol 1994; 74 : 240-244.
41. Mucci B, Maguire B. Does routine ultrasound have a role in the investigation of children with UTI? Clin Radiol 1994; 49 : 324-325.
42. Haycock GB. A practical approach to evaluating UTI in children. Pediatr Nephrol 1991; 5 : 401-402.
43. Kleinman PK, Diamond BA, Karellas A, Spevak MR, Nimkin K, Belenguer P.
Tailored low-dose fluoroscopic voiding cystourethrography for the reevaluation of vesicoureteral reflux in girls. Am J Roentgerol 1994; 162 : 1151-1156.
44. Sadeleer CD, Boe VD, Keuppens F, Desprechins B, Verboven M, Piepsz A. How good is technetium-99m mercaptoacetyltriglycine indirect cystography? Eur J Nucl Med 1994; 21 : 223-227.
45. Vela Navarrete R. Infección urinaria en el niňo. In: Tomo I. Jiménez Cruz JF, Rioja LA (eds). Tratado de Urologa. Barcelona: Ed Prous 1993 : 499-507.
46. Huang JJ, Sung JM, Chen KW, Ruaan MK, Shu GHF, Chuang YC. Acute bacterial nephritis: a clinicoradiologic correlation based on computer tomography. Am J Med 1992; 93 : 289-298.
47. Majd M, Rushton HG, Jantausch B, Wiedermann L. Relationship of vesicoureteral reflux, p-fimbriated E. coli and acute pyelonephritis in children with febrile UTI. J Pediatr 1991; 119 : 578-585.
48. Melis K, Vandevivere J, Hockens C, Vervaet A, Sand A, van Acker KJ. Involvement of the renal parenchyma in acute UTI: the contribution of 99m Tc dimercaptosuccinic acid scan. Eur J Pediatr 1992; 151 : 536-539.
49. Smellie JM, Rigden SPA. Pitfalls in the investigation of children with UTI. Arch Dis Child 1995; 72 : 251-255.
50. Smellie JM, Rigden SPA, Prescod NP. UTI: a comparison of four methods of investigation. Arch Dis Child 1995; 72 : 247-250.
51. Rushton HG. UTIs in children: evaluation and treatment. Curr Opin Urol 1995; 5 : 280-289.
52. Broseta E, Jiménez-Cruz JF. Infección urinaria en el niňo. In: Broseta E, Jiménez-Cruz JF (eds). Infección Urinaria. Madrid: Ed Aula Médica 1999 : 185-194.
53. Smellie JM, Gruneberg RN, Bantock HM, Prescod N. Prophylactic co-trimoxazole and trimethoprim in the management of UTI in children. Pediatr Nephrol 1988; 2 : 12-17.
54. Hellerstein S. UTIs. Old and new concepts. Pediatr Clin North Am 1995; 42 : 1433-1457.
55. Deutsche Gesellschaft für pädiatrische Infektiologie e.V. (DGPI) (ed.). Handbuch Infektionen bei Kindern and Jugendlichen. 3rd ed. Munich: Futuramed 2000 : 125-132.
4. INFEKCE MOČOVÝCH CEST PŘI RENÁLNÍ NEDOSTATEČNOSTI, U PŘÍJEMCŮ TRANSPLANTÁTU, DIABETES MELLITUS A IMUNOSUPRESI
4.1 Souhrn
Jaké jsou akutní účinky infekce močových cest na ledvinu a mohou se stát léze chronickými?
U akutní pyelonefritidy se mohou objevit velmi dramatické změny ve fokálním snížení perfuze při zobrazovacím vyšetření a korespondující dysfunkce renálních tubulárních buněk. Avšak v případě normální ledviny u dospělého jedince je chronické poškození ledviny nepravděpodobné. U diabetes mellitus může příležitostně rozšířená infekce predisponovat k pyogenní infekci s tvorbou intrarenálního perinefrického abscesu a vzácně specifickému druhu infekční intersticiální nefritidy. Papilární nekróza je častým následkem pyelonefritidy u diabetiků.
Diabetici jsou náchylní k rychlé progresi infekce parenchymu, proto je nutné nejprve vyléčit asymptomatickou bakteriurii, a poté zabránit dlouhodobou aplikací antibiotik opakování infekce.
Progreduje chronické renální onemocnění jako následek infekce rychleji, a predisponují partikulární renální onemocnění ke vzniku infekce močových cest?
Existuje několik potenciálně významných faktorů predisponujících k infekci při uremii, zahrnující ztrátu několika obranných mechanizmů močových cest a stupeň imunosuprese. Polycystické onemocnění ledvin u dospělých (adult polycystic kindey disease - APCKD), významný VUR a obstrukční uropatie v konečné fázi může vést ke vzniku fokusů infekce, nebo jejímu ascendentnímu šíření. Závažná infekce močových cest s doprovázející bakteriemií může urychlit progresi renálního selhání, existuje však jen málo důkazů, že intenzivní neodkladná léčba infekce, nebo profylaxe zpomalí narušení renální funkce, jakmile k němu již jednou došlo.
VUR a infekce močových cest v konečné fázi chronického renálního selhání
Bilaterální nefroureterektomie by měla být provedena pouze jako poslední možnost.
Obstrukce a infekce močových cest
Stejně jako ve všech ostatních situacích kombinace infekce a obstrukce je nebezpečná a měla by být léčena důkladně a rázně. Obstrukce může být skrytá a vyžadovat speciální diagnostické testy, např. videourodynamiku, tlakově průtokové studie horních cest močových ap.
Polycystické onemocnění ledvin u dospělých
Akutní pyelonefritida, infekční cysty (prezentující se jako recidivující bakteriemie nebo „lokální sepse“) by měly být léčeny vysokými dávkami fluorochinolonů podaných efektivně. Měly by být aplikovány po delší dobu a následovány profylaxí. Jako poslední možnost se provádí bilaterální nefrektomie.
Močové konkrementy a infekce močových cest
U pacientů bez renálního poškození (tj. odstranění konkrementů) je třeba, pokud je to možné, minimalizovat léčbu antibiotiky, pokud nelze konkrement odstranit. Nefrektomie je poslední možností, ale i reziduální renální funkce může být životně důležitá.
Potřeba korekce uropatie a odstranění potenciálního ohniska infekce v ledvině v poslední fázi onemocnění je naléhavější, pokud pacient čeká na transplantaci ledviny. Dokonce i v tomto případě mohou být výsledky nefrektomie zjizvené nebo hydronefrózní ledviny v naději vyléčení infekce neuspokojivé.
Při dialýze je snaha eliminovat určitá antibiotika.
Jsou imunosuprimovaní pacienti náchylní k infekci močových cest? Je infekce močových cest signifikantní příčinou selhání štěpu?
Imunosuprese má sekundární význam, přestože v extrémním případě vyvolá alespoň perzistentní bakteriurii, která se může stát symptomatickou. V kontextu s transplantací ledviny jsou infekce močových cest velmi časté, ale imunosuprese je pouze jeden z mnoha faktorů, které jsou klasifikovány jako „operační“.
4.2 Úvod
Kdykoliv je u pacienta s renální nedostatečností přítomna infekce močových cest, vzniknou problémy při léčbě infekce i řešení renálního onemocnění. Je třeba také konfrontovat důležitá hlediska s ohledem na příčinu, speciální citlivost, účinky a komplikace infekce renálního parenchymu, zejména u imunosuprimovaných pacienta.
Tuto sekci lze rozdělit na 4 otázky:
- Jaké jsou akutní účinky infekce močových cest na ledvinu a stanou se léze chronickými?
- Progreduje renální onemocnění rychleji důsledkem infekce a predisponují určitá renální onemocnění vzniku infekce močových cest?
- Jaké problémy se objeví při aplikaci antibiotik u pacientů s renální nedostatečností a po transplantaci ledviny?
- Jsou imunosuprimovaní pacienti náchylní k infekci močových cest v souvislosti s transplantací ledviny? Je infekce močových cest signifikantní příčinou selhání štěpu?
4.3 Jaké jsou akutní vlivy infekce močových cest na ledvinu a mohou léze nabýt chronickou podobu? Lze předejít jejich vzniku?
Někteří autoři považují akutní pyelonefritidu za „komplikovanou“, protože může způsobit renální jizvení u doposud normální ledviny [1,2]. Patologicky se může podobný proces objevit v takových odlišných situacích jako obstrukční a refluxní nefropatie, přestože distribuce a rozsah lézí může být různý [3-5].
Účinky VUR a intrarenálního refluxu na renální parenchym a podílu ascendentní infekce nejsou stále vyřešeny. Renální jizvení se může vytvořit v důsledku těchto 3 elementů, přestože téměř ve všech případech již v rané části života. V tomto úzkém životním období musí být při patogenezi chronické pyelonefritidy zvážena renální dysplazie. Přestože v rané fázi tohoto onemocnění je akutní infekce významná, stav recidivující akutní infekce močových cest nebo asymptomatické bakteriurie je zejména při progresi tvorby jizev nevýznamný. Profylaxe antibiotiky proto nabízí při zachování renální tkáně při refluxní nefropatii u starších dětí a dospělých pouze malý benefit i tehdy, pokud ještě nebyl reflux úspěšně léčen [6]. Avšak další diskuse týkající se refluxní nefropatie přesahují rozsah této sekce.
Obstrukce objevující se při močových dysfunkcích nebo supravezikálně způsobuje hlavně procesem apoptózy dysfunkci renálních tubulárních buněk a nakonec poškození ledviny. Infekce potencuje proces úbytku parenchymu a v extrémních případech dojde ke vzniku pyonefrózy, perinefrického abscesu a rozšířené systémové sepse. V případě, že je přítomna obstrukce, je prakticky nemožné dlouhodobě eradikovat infekci [7]. Vzhledem k tomu, že na detailní diskuse týkající se obstrukční nefropatie není v této kapitole prostor, je dostačující říci, že ledvina, jež je permanentně poškozena jakoukoliv příčinou, má menší rezervy snášet účinky refluxu, obstrukce a infekce. Za jakýchkoliv podmínek vyžaduje kombinace obstrukce a infekce urgentní chirurgické řešení a obojí musí být neodkladně léčeno.
Závažná infekce může vést k narušení renální funkce, a to sepsí, endotoxemií, hypotenzí a nízkou renální perfuzí jakožto součásti procesu multiorgánového selhávání. Přítomnost močových konkrementů a diabetes mellitus dále sníží obranyschopnost hostitele [8].
Vlivy infekce močových cest na normální ledvinu jsou komplexní. Stojí za hodnocení a mohou poskytnout vodítko při určování vzniku chronických změn. E. coli je nejčastěji izolovaným gramnegativním organizmem u většiny pacientů s akutní pyelonefritidou. Proporce je nižší u dospělých než u dětí (69 % vs 80 %) [9]. Virulentní organizmy způsobí přímé poškození buněk obvykle po kolonizaci renální pánvičky. K poškození může dojít také nepřímo vlivem mediátorů zánětu. Metastatická infekce zřídkakdy způsobí renální infekci manifestující se jako kortikální abscesy obvykle u náchylných jedinců (např. pacientů s diabetes mellitus a pacientů imunosuprimovaných) [10].
Bakteriální infekce močových cest může vyvolat horečku, zvýšit reaktanty akutní fáze (např. CRP a rychlost sedimentace erytrocytů) a vyvolat odpověï imunoglobulinu (Ig) A a reakci cytokinu [11]. Zejména hodnoty IL-2 a IL-6 v séru jsou zvýšeny [12,13]. Důsledkem poškození tkáně je sekrece tubulárních proteinů a enzymů, tj. alfa - a beta-, mikro - a makroglobulinu a N-acetyl glukosaminidázy. Funkčním důsledkem může být ztráta koncentrující schopnosti, která může přetrvat dlouhodobě [14,15]. Nálezy sérologické imunitní reakce a bakterie pokryté protilátkami na různé antigenní části organizmu jsou považovány za důkaz imunitní odpovědi, a tedy za důkaz vystavení se organizmům, které potencionálně poškozují renální parenchym [16].
Existuje mnoho identifikovatelných faktorů souvisejících s virulencí bakteriální buňky a její schopnosti přilnout na sliznici před invazí. Například řasinky typu 1 nebo fimbrie se kombinují s receptory manózy na uromukoidu ochranné mukopolysacharidové vrstvy na uroepiteliálních buňkách vystýlajících močové cesty. Typ 2 neboli fimbrie P se váží na glycidy substancí krevní skupiny, které jsou vylučovány urotelem hostitele. V praxi to znamená, že Enterobacteriaceae, které jsou patogenní pro ledvinu, vedou k expresi fimbrie P nebo typu 2 alespoň u dětí: 90 % dětí s akutní pyelonefritidou vykazuje expresi těchto organizmů ve srovnání s mnohem menším počtem dětí, které měly cystitidu nebo asymptomatickou bakteriurii [17]. Bakteriální adheze může mít pro organizmus různý benefit, pro obranné mechanizmy hostitele je toto připojení totiž jednodušší lokalizovat a zničit.
Paradoxně může snížená adherence usnadnit tichou penetraci do renálního parenchymu. Ve studii, která byla provedena v Nizozemí se skupinou 160 pacientů, kteří v nedávné době prodělali akutní infekci močových cest a u nichž došlo ke snížení koncentrační schopnosti, neměl signifikantní počet z nich (40 %) febrilie. U většiny pacientů měly infiltrující bakterie snížené adhezivní charakteristiky, a tím možná usnadnily jejich penetraci do renálního parenchymu a způsobily trvalejší strukturální a funkční poškození.
Možnost vzniku jizvení v důsledku infekce močových cest při absenci refluxu, obstrukce nebo močových konkrementů je sporné. Bylo zjištěno, že akutně může dojít k dramatické redukci renální perfuze a exkrece, a tzv. lobární nefronii lze demonstrovat pomocí nových metod zobrazovacích vyšetření jako například CT nebo DMSA–scanu, ovšem nikoliv pomocí standardní intravenózní urografie. V jedné takovéto studii bylo prokázáno, že u 55 % pacientů bez dříve existujících lézí došlo během epizody akutní pyelonefritidy ke vzniku akutních lézí parenchymu [2]. Tyto přetrvaly u 77 % pacientů 3–6 měsíců [9]. Alwall [18] popsal 29 žen sledovaných po dobu 20–30 let s nálezem narůstajícího renálního poškození a chronickou pyelonefritidou zjištěnou pomocí biopsie. Tato dříve provedená studie užívala hrubé diagnostické techniky, které neumožňovaly identifikovat dříve existující onemocnění. Proto mohly mít tyto pacientky renální poškození již na počátku, a po tak dlouhé době nebylo možné vyloučit jiné příčiny renálního poškození a intersticiální neuropatii (např. abúzus analgetik). Toto důležité téma bylo objasněno v nedávno provedené studii používající DMSA–scany během akutní fáze akutní pyelonefritidy. 37 z 81 pacientek mělo 1 nebo více perfuzních defektů, z nichž většina vymizela během 3 měsíců. Pokud přetrvaly, byla provedena intravenózní urografie, která prokázala přítomnost refluxu nebo obstrukční nefropatie, jež musely předcházet epizodu akutní infekce [19].
Souhrnem lze říci, že malé parenchymatózní jizvy prokázané pomocí moderních zobrazovacích vyšetření se mohou vytvořit jako důsledek akutní neobstrukční pyelonefritidy. Avšak u pacientů s těmito jizvami nedochází k chronickému selhání ledvin a jejich jizva je velmi odlišná od léze, kterou můžeme vidět u refluxní nefropatie. To souhlasí s klinickou zkušeností. U akutní pyelonefritidy může být provedení intravenózní urografie nebo DMSA – –scanu při akutní infekci močových cest velmi alarmující a dramatické, ale v praxi změny většinou vymizí. Závažnost symptomů u epizody akutní pyelonefritidy a velmi malé riziko permanentního poškození by nemělo ovlivnit lékaře od poskytnutí intenzivní aplikace antibiotik.
Existuje několik specifických stavů, při nichž může akutní infekce močových cest způsobit renální poškození:
- diabetes mellitus
- tuberkulóza
4.3.1 Diabetes mellitus
Diabetes zvyšuje riziko akutní pyelonefritidy vyvolané infekcí způsobenou Enterobacteriaceae v dolních cestách močových, přestože Klebsiella spp. je častá (25 % v porovnání s 12 % u nediabetiků). Asymptomatická bakteriurie se často vyskytuje u diabetiků ženského pohlaví (u mužů však ne) a v případě, že je neléčena, může vést k narušení renální funkce [20]. Mechanizmus není ještě zcela prozkoumán a u nekomplikované akutní pyelonefritidy je nejistý. Mohou být přítomny další faktory: diabetická nefropatie [21] a autonomní nefropatie, způsobující mikční dysfunkci. Narušená rezistence hostitele predisponuje k přetrvání nefropatogenních organizmů a vzniku renálních komplikací, přestože specifické důkazy chybějí.
Glykosurie inhibuje fagocytózu a snad i buněčnou imunitu a podporuje bakteriální adherenci, avšak špatná kontrola glykemie nezvyšuje riziko bakteriurie [22].
Diabetici jsou také náchylní k málo uváděné a neobvyklé formě infekční intersticiální nefritidy [23] charakterizované histologicky akutním pyogenním infiltrátem s mikroabscesy a vznikem akutního renálního selhání. Původ organizmů může být hematogenní. Dokonce při absenci obstrukce může akutní infekce parenchymu nepozorovaně progredovat k tvorbě intrarenálních abscesů, jejichž ruptura vede ke kolekci hnisu perirenálně a vzniku psoatického abscesu. Tato nekrotizující infekce, někdy způsobená organizmy tvořícími plyn, má vysoké procento mortality, i když projev může být příležitostně poměrně indolentní.
Papilární nekróza se u diabetiků vyskytuje často, zejména ve spojení s akutní pyelonefritidou. Je nepochybně spojena s permanentním jizvením renálního parenchymu, ačkoliv je obtížné vyloučit obstrukci způsobenou odloučenými papilami jako příčinu nefropatie. Převládá názor, že diabetici představují skupinu jedinců, kteří jsou zvláště náchylní k rychlé progresi infekce renálního parenchymu, a proto je třeba pokusit se o eradikaci asymptomatické bakteriurie. Profylaxe antibiotiky je obvykle požadována zejména v případě papilární nekrózy, ale zatím jsou podobná doporučení založena spíše na bázi zdravého úsudku než důkazů prospektivních randomizovaných studií.
4.3.2. Tuberkulóza
Tuberkulóza může způsobovat akutní i chronické poškození ledvin jejich bilaterální infiltrací. Vzácně může vést až k renálnímu selhání. Avšak mohou se objevit i mírnější formy intersticiálního granulomatózního onemocnění, které mohou způsobit renální selhání při absenci fibrózy, kalcifikaci nebo obstrukci [24,25].
Tuberkulóza a lepra mohou způsobovat renální poškození vznikem amyloidní glomerulonefritidy a tvorbou proliferativní glomerulonefritidy [26,27]. Přestože moderní trend při léčbě urogenitální tuberkulózy usiluje o zkrácení délky trvání léčby, v případě přítomnosti onemocnění renálního parenchymu se vyžaduje prodloužená léčba.
4.4 Progreduje chronické renální onemocnění rychleji důsledkem infekce a predisponují některá onemocnění ke vzniku infekce močových cest?
4.4.1 Chronická renální onemocnění a infekce močových cest
Existují dobré důvody, proč by měli být všichni pacienti s uremií náchylní k infekci močových cest a proč by měla infekce močových cest zvyšovat procento deteriorizace funkce. Antibakteriální vlastnosti normální moči mohou být díky obsahu urey nebo nízkému pH a vysoké osmolaritě ztraceny [28]. Uremičtí pacienti jsou také mírně imunosuprimováni a může být inhibována tvorba protektivního uroepiteliálního hlenu [29-31]. Ale stále až na několik výjimek existuje málo důkazů prokazujících vztah mezi již dříve existujícím chronickým renálním onemocněním a přetrvávající infekcí močových cest [7]. Výsledky odstranění zjizvené nebo hydronefrotické ledviny ve snaze o vyléčení infekce jsou často zklamáním.
Přesto existuje několik výjimek. Infekce močových cest je prominentní komplikace APCKD, při níž je symptomatická infekce močových cest projevem u 23–42 % pacientů (obvykle žen) [32]. Standardními laboratorními médii může být obtížné získat pozitivní kultivaci, ale pyurie je častá především v pozdějších fázích progrese onemocnění. Akutní pyelonefritida se vyskytuje často a může být způsobena pyogenní infekcí začínající v cystách [33]. Efektivita léčby antibiotiky může záviset na tom, zda jsou cysty derivovány z proximálních (aktivní sekrece) nebo distálních tubulů (pasivní difuze), a na rozpustnosti užitého přípravku v tucích. Cefalosporiny gentamycin a ampicilin, které jsou standardní léčbou při akutní pyelonefritidě a vyžadují aktivní transport, jsou často neefektivní [34]. Fluorchinolony jsou obecně nejúčinnější, ale někdy je jediným řešením (zejména po transplantaci) bilaterální nefrektomie. Nelze zaměňovat polycystické onemocnění se získaným renálním cystickým onemocněním v konečném stadiu ledviny, jež nemá žádnou predispozici k infekci močových cest.
Otázka, zda urologické komplikace zahrnující infekci močových cest, ovlivňují progresi renálního selhání u polycystického onemocnění nebo u jakékoliv jiné renální patologie, je sporná. Závažná symptomatická infekce močových cest může ukázat na negativní prognózu zejména u mužů s APCKD. Nefrolitiáza, způsobená zejména infekčními struvitovými konkrementy, obstrukční uropatie a významný reflux zcela zřetelně podporují infekci, přestože ne nevyhnutelně. Zda důkladná léčba asymptomatické bakteriurie, nebo dokonce mírné klinické infekce močových cest způsobí nějaký rozdíl v progresi renálního onemocnění, je nejasné [35].
4.4.2 Infekce močových cest u transplantovaných ledvin
Infekce močových cest je častá po transplantaci ledviny. Bakteriurie je přítomna u 35–80 % pacientů, přestože riziko je sníženo pokrokem v dárcovské chirurgii, snížením dávky imunosupresiv a užitím profylaxe antibiotik [36]. Časné faktory predisponující k infekci močových cest zahrnují infekci v ledvině dárce. Poté, co je ledvina vyjmuta z ochranného obalu, měla by být provedena kultivace, jak výtoku z renální žíly, tak okolní tekutiny zachycené ve sterilních plastových sáčcích obsahujících excidovanou ledvinu, mikroorganizmy totiž mohou být přeneseny při procesu transplantace. Katétry zavedené do močového měchýře a ureterální stenty způsobují úbytek glykosaminoglykanové vrstvy z urotelu, stejně jako poskytují zdroj organizmů v biofilmu pokrývajícím cizí tělesa. Infekce ve vlastních ledvinách se může díky imunosupresi značně zhoršit. Tento problém je nejzávažnější u papilární nekrózy, zejména u diabetes mellitus [37], masivním infekčním VUR, polycystickém onemocnění a u infekčních konkrementů. Také je třeba si povšimnout zvyšujícího se počtu dětí s kongenitálními uropatiemi, často ve spojení s neuropatickou dysfunkcí močového měchýře a kombinací intravezikální obstrukce, nízkou kompliancí močového měchýře, reziduální moči a VUR. Včas před transplantací ledviny musí být provedeno kompletní urodynamické vyšetření, vedoucí k indikaci rutinní intermitentní samokatetrizace a jakékoliv nezbytné operaci močového měchýře. U pacientů na dialýze a po transplantaci byla také úspěšně provedena derivace moči, augmentace a substituce močového měchýře, přestože bakteriurie se vyskytuje často a může vyžadovat aplikaci antibiotik.
V prvních 3 měsících je infekce močových cest spíše symptomatická s vysokým procentem recidivy. Později je výskyt pyelonefritidy a bakteriemie nižší a také lepší odpověï na antibiotika, pokud nedojde k urologickým komplikacím (např. píštěl, obstrukce). Infarkt celé ledviny nebo její části způsobený arteriálním poškozením může vyvolat infekci bakteriální kolonizací nekrotické tkáně, což se často objevuje u běžných komunitních nebo náročných organizmů. Dokud není ledvina nebo alespoň její nekrotická část odstraněna, není možné infekci eradikovat.
Existuje několik potenciálních mechanizmů, které mohou způsobit selhání štěpu. Dříve se předpokládalo, že reflux štěpu může způsobit pyelonefritidu a jizvení parenchymu. Tato zjištění nebyla potvrzena a většina operatérů neprovádí antirefluxní anastomózu. Infekce může teoreticky vyvolat selhání štěpu jinými mechanizmy, jako například přímým účinkem cytokinů, růstovými faktory (tumour necrosis factor) a volnými radikály jako části kaskády zánětlivé reakce.
Infekce močových cest může snadno znovu vyvolat cytomegalovirovou infekci, která může vést k akutní rejekci transplantátu. Někdy může být obtížné rozlišit rejekci od infekce [38].
4.5 Jaké problémy se objevují při terapii antibiotiky u pacientů s renální nedostatečností a po transplantaci ledviny?
4.5.1 Aplikace antibiotik u selhání/transplantace ledviny
Mnoho detailních informací týkajících se aplikace a dávkování antibiotik je uvedeno v tab. 4–8. Je důležité si uvědomit, že peritoneální dialýza a hemodialýza vedou k eliminaci některých antibiotik, čemuž je třeba se vyhnout nebo je aplikovat v mnohem vyšší dávce. Mezi imunosupresivy a antibiotiky také dochází k významným interakcím.
Tab. 4. Aplikace antibiotik při infekci močových cest při renálním poškození. 
Tab. 6. Léčba tuberkulózy při renálním selhání. 
Tab. 7. Doporučení pro prevenci a léčbu infekce močových cest při transplantaci ledviny. 
Tab. 8. Infekce močových cest při transplantaci ledviny. 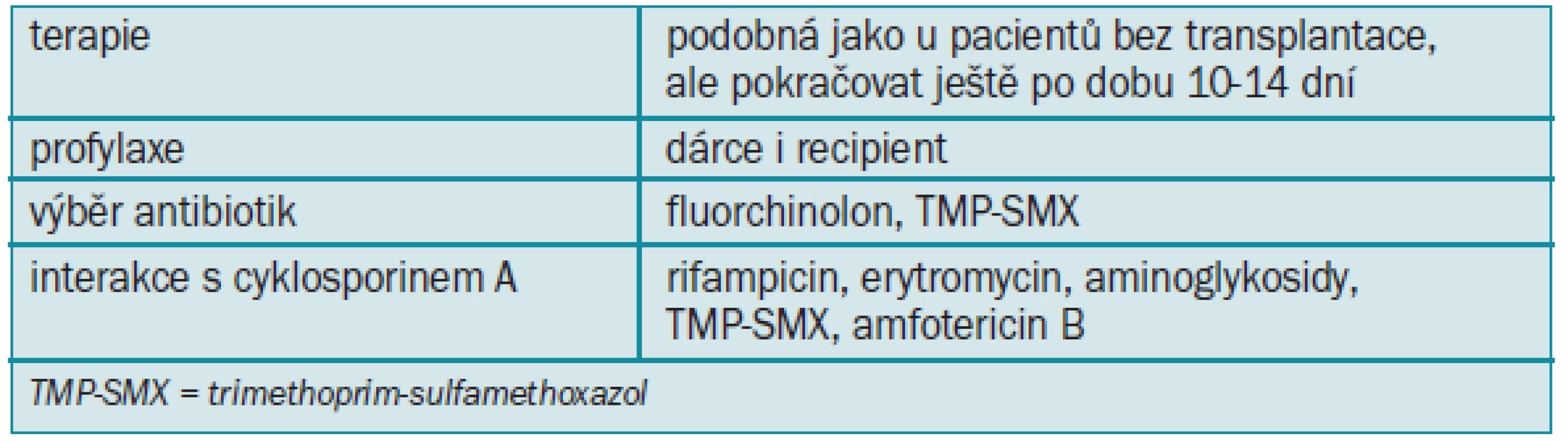
4.5.2 Léčba infekce močových cest u příjemců transplantátu ledviny
Léčba symptomatické infekce močových cest u pacientů po transplantaci je podobná jako u pacientů bez transplantace. Benefit krátkodobé léčby je třeba ještě prokázat, a tak se ve většině případů aplikuje léčba po dobu 10–14 dnů. Výběr antibiotik záleží na speciální potřebě penetrace renálního parenchymu; zejména aplikace fluorchinolonů se jeví efektivní.
U většiny jednotek je při prevenci infekce močových cest efektivní kombinace TMP a SMX [39]. Také předchází pneumonii způsobené Pneumocystis carinii a infekcím vyvolaným dalšími vzácnými organizmy. Profylaxe antibiotikem o nízké dávce s kotrimaxozolem se doporučuje 6 měsíců po transplantaci. To pokryje rizikové období, v němž je infekce pravděpodobněji symptomatická a spojená s akutním poškozením štěpu. Při nízkém dávkování nedochází k negativním interakcím s cyklosporinem A, přestože při vyšší dávce doporučované některými autory je při aplikaci TMP možný výskyt synergické nefrotoxicity. Je třeba zvážit interakce dalších medikamentů (např. gentamycin, TMP-SMX a amfotericin B zvyšují toxicitu cyklosporinu A; rifampicin způsobuje syntézu cytochromu p450 syntetázy a erytromycin inhibuje jaterní metabolizmus cyklosporinu A).
4.5.3 Mykotická infekce
Kandida se může vyskytnout u jakéhokoli pacienta s imunosupresí, ale vyskytuje se daleko častěji u diabetiků, těch s chronickým výskytem reziduální moči a v případě zavedení katétru nebo stentu. Doporučuje se léčit pomocí antimykotických preparátů (flukonazol, amfotericin B plus flucytosin) i asymptomatické pacienty. Obvykle je nezbytné odstranění katétru nebo stentu.
U jakéhokoli pacienta s recidivující infekcí je třeba brát v úvahu a okamžitě léčit anatomickou příčinu, jako například urologickou komplikaci transplantované ledviny nebo dysfunkci močového měchýře příjemce.
Význam asymptomatické bakteriurie po transplantaci ledviny není stále vyřešen. Doporučuje se vyšetřovat u těchto pacientů strukturální abnormality a v případě jejich přetrvání je léčit.
4.6 Jsou imunosuprimovaní pacienti náchylní k infekci močových cest v souvislosti s renální transplantací? Je infekce močových cest signifikantní příčinou selhání štěpu?
4.6.1 Imunosuprese
Význam imunosuprese samotné při vzniku infekce močových cest není stále objasněn [40]. Pacienti s renálním selháním v posledním stadiu nejsou obecně náchylní k obvyklým gramnegativním močovým patogenům, přestože u nich může dojít k neobvyklé a granulomatózní infekci. U těchto pacientů je prokázána snížená buněčná a humorální imunita.
Avšak situace je o něco jasnější u HIV–pozitivních pacientů a pacientů s AIDS mužského pohlaví, u nichž existuje úzké spojení mezi počtem CD4 a rizikem bakteriurie především u pacientů, u nichž je počet < 200 buněk/ml. Asi 40 % pacientů s bakteriurií bude asymptomatických. U těchto pacientů nemusí profylaxe pneumonie způsobené Pneumocystis carinii snížit procento výskytu bakteriurie jako profylaxe stejného typu u pacientů po transplantaci, což je zřejmě způsobeno dřívějším vznikem rezistentních organizmů. Také u těchto pacientů jsou poměrně časté virové a mykotické infekce.
4.7 Literatura
1. Kincaid-Smith P, Fairley KF. Complicated UTI in adults. In: Cattell WR (ed). Infections of the Kidney and Urinary Tract. Oxford: Oxford University Press 1996; 186-205.
2. Meyrier A. Frequency of development of early corticol scarring in acute primary pyelonephritis. Kidney Int 1989; 35 : 696-793.
3. Hudson CJ, Craven JD, Lewis DG, Matz LR, Clarke RJ, Ross EJ. Experimental obstructive nephropathy in the pig. Br J Urol 1969; 41 : 4-51.
4. Hudson CJ, Maling TMJ, McManamon PJ, Lewis MG. The pathogenesis of reflux nephropathy (chronic atrophic pyelonephritis). Br J Radiol 1975; Suppl 13 : 1-26.
5. Bishop MC. Obstructive uropathy. In: Mundy AR (ed). Scientific Basis of Urology. Edinburgh: Churchill Livingston 1987 : 115-151.
6. Bailey RR. Vesico-ureteric Reflux and reflux nephropathy. In: Cameron S et al. (eds). Oxford Text Book of Clinical Nephrology. Oxford: Oxford University Press 1992 : 1983-2002.
7. Bishop MC. Urosurgical management of UTI. J Antimicrob Ther 1994; 33:Suppl A: 74-91.
8. Roberts JA. Management of pyelonephritis and upper UTIs. Urol Clin N Am 1999; 26 : 753-763.
9. Fraser IR, Birch D, Fairley KF, Lichtenstein JS, Tress B, Kincaid-Smith P. A prospective study of cortical scarring in acute febrile pyelonephritis in adults: clinical and bacteriological characteristics. Clin Nephrol 1995; 43 : 159-164.
10. George NJ R. UTI. In: Mundy AR, George NJR, Fitzpatrick JM, Neill DE (eds). Scientific Basis of Urology. 2nd ed. Oxford: ISIS Medical Media 1998 : 143-173.
11. Svanborg C, de Man P, Sandberg T. Renal involvement in UTI. Kidney Int 1991; 39 : 541-549.
12. Hedges S, Stenquist K, Lidin-Janson G, Martinell J, Sandberg T, Svanborg C. Comparison of urine and serum concentration of interleukin 6 in women with acute pyelonephritis in asymptomatic bacteriuria. J Infect Dis 1992; 166 : 653-656.
13. Jacobson SH, Hylander B, Wretling B, Brauner A. Interleukin 6 and interleukin in serum and urine in patients with acute pyelonephritis in relation to bacterial virulence-associated traits and renal function. Nephron 1994; 67 : 172-179.
14. Ronald AR, Cutler RE, Turck M. Effect of bacteriuria on renal concentrating mechanisms. Ann Intern Med 1969; 70 : 723-733.
15. de Man P, Claeson I, Johnson IM, Jodal U, Svanborg C. Bacterial attachment as a predictor of renal abnormalities in boys with UTI. J Paediatr 1989; 115 : 915-922.
16. Percival A, Brumfitt W, De Louvois J. Serum antibody levels as an indication of clinically unapparent pyelonephritis. Lancet 1964; 2 : 1027-1033.
17. Kallenius G, Svenson SB, Hultberg H et al. Recurrence of P-fimbriated Escherichia coli in UTI. Lancet 1981; 2 : 139-172.
18. Alwall N. On controversial and open questions about the course and complications of non-obstructive urinary tract infection in young women. Acta Med Scand 1978; 203 : 369-377.
19. Bailey RR, Lynn KL, Robson RA, Smith AH, Maling TMJ, Turner JG. Renal scars in adults with acute pyelonephritis. Clin Nephrol 1996; 46 : 99-104.
20. Ooi BS, Chen BTM, Yu M. Prevalence and site of bacteriuria in diabetes mellitus. Postgrad Med J 1974; 50 : 497-499.
21. Korzeniowski OM. Urinary tract infection in the impaired host. Med Clin N Am 1991; 75 : 391-404.
22. Mackie ADR, Drury PL. UTI in diabetes mellitus. In: Cattell WR (ed). Infections of the Kidney and Urinary Tract. Oxford: Oxford University Press, Medical Publications 1996 : 218-233.
23. Cattell WR. UTI and acute renal failure. In: Raine AEG (ed). Advanced Renal Medicine. Oxford: Oxford University Press 1992 : 302-313.
24. Mallinson WJW, Fuller RW, Levison DA, Baker LR, Cattell WR. Diffuse interstitial renal tuberculosis - an unusual cause of renal failure. Quart J Med 1981; 50 : 137-148.
25. Morgan SH, Eastwood JB, Baker LR. Tuberculous interstitial nephritis - the tip of an iceberg. Tubercle 1990; 71 : 5-6.
26. McAdam KPWJ, Anders RF, Smith SR, Russell DA, Price MA. Association of amyloidosis with erythema nodosum leprosum reactions and recurrent neutrophil leucocytosis in leprosy. Lancet 1975; 3 : 572-576.
27. Ng WL, Scotland DM, Hua A. Glomerulonephritis in leprosy. Am J Clin Nephrol 1981; 76 : 321-329.
28. Neal DE. Host defence mechanisms in UTIs. Urol Clin N Am 1999; 26 : 677-686.
29. Khan IH, Catto GR. Long term complications of dialysis: infection. Kidney Int 1993; 43 : 143-148.
30. Kessler M, Hoen B, Mayeux D, Hestin D, Fontenalle C. Bacteraemia in patients on chronic haemodialysis. A multicentre prospective survey. Nephron 1993; 64 : 95-100.
31. Saitoh H, Nakamura K, Hida M, Saitoh T. UTIs in oliguric patients with chronic renal failure. J Urol 1985; 133 : 990-993.
32. Elzinga LW, Bennett WM. Miscellaneous renal and systemic complications of autosomal dominant polycystic kidney disease including infection. In: Watson ML, Torres VE (eds). Polycystic Kidney Disease. Oxford Clinical Nephrology Series. Oxford: Oxford University Press 1996 : 483-499.
33. Sklar AH, Caruana RJ, Lanners JE, Strauser GD. Renal infections in autosomal dominant polycystic kidney disease. Am J Kidney Dis 1987; 10 : 81-88.
34. Schwab SJ, Bauder SJ, Klahr S. Renal infection in autosomal dominant polycystic disease. Am J Med 1987; 82 : 714-722.
35. Gower PE. A prospective study of patients with radiological pyelonephritis, papillary necrosis and obstructive atrophy. Quart J Med 1976; 45 : 315-349.
36. Tolkoff-Rubin NE, Rubin RH. UTI in the renal transplant recipient. In: Bergan T (ed). UTIs. Basel: Karger 1997 : 27-33.
37. Tolkoff-Rubin NE, Rubin RH. The infectious disease problems of the diabetic renal transplant recipient. Infect Dis Clin North Am 1995; 9 : 117-130.
38. Steinhoff J, Einechke G, Niederstadt C et al. Renal graft rejection or UTI? The value of myeloperoxidas, C-reactive protein and alpha 2 macroglobulin in urine. Transplantation 1997; 64 : 443-447.
39. Fox BC, Sollinger HW, Belzer FO, Maki DG. A prospective randomised double blind study of trimethoprim-sulphamethoxazole for prophylaxis of infection in renal transplantation: clinical efficacy, absorption of TMP-SMX, effects on the mircroflora
and the cost benefit of prophylaxis. Am J Med 1990; 89 : 255-274.
40. Tolkoff-Rubin NE, Rubin RH. UTI in the immunocompromised host. Lesson from kidney transplantation and the AIDS epidemic. Infect Dis Clin N Am 1997; 11 : 707-717.
41. Van Dooyeweert DA, Schneider MME, Borleffs JCC, Hoepelman AIM. Bacteriuria in male patients infected with human immunodeficiency virus type 1. In: Bergan T (ed). UTIs. Basel: Karger 1997 : 37-45.
5. KOMPLIKOVANÁ INFEKCE MOČOVÝCH CEST ZPŮSOBENÁ UROLOGICKÝMI ONEMOCNĚNÍMI
5.1 Souhrn
Komplikovaná infekce močových cest je infekce spojená se strukturálními nebo funkčními abnormalitami močopohlavních cest nebo přítomností onemocnění, které zasahuje do obranného mechanizmu hostitele, což zvyšuje riziko získání infekce nebo selhání terapie.
Komplikovanou infekci močových cest může způsobit celá řada bakterií. Spektrum je mnohem větší než u nekomplikované infekce močových cest a bakterie jsou s větší pravděpodobností rezistentní k antimikrobiálním preparátům, zejména u komplikované infekce močových cest spojené s léčbou.
Predominantní jsou enterobakterie a nejčastěji se vyskytujícím patogenem je E. coli, ovšem nefermentující mikrobi (např. Pseudomonas aeruginosa) a grampozitivní koky (např. stafylokoky a enterokoky mohou v závislosti na dalších podmínkách hrát také důležitou roli.
Strategie léčby závisí na závažnosti onemocnění. Léčba zahrnuje 3 cíle: řešení urologické abnormality, antimikrobiální terapii a v případě potřeby podpůrnou péči. Často nezbytná hospitalizace pacienta. Abychom zabránili vzniku rezistentních kmenů, měla by být terapie vedena kultivací moči, kdykoliv je to možné.
V případě, že je nezbytná empirická terapie, mělo by spektrum antibiotik zahrnovat nejrelevantnější patogeny. Doporučovanými alternativami jsou fluorchinolon, který se vylučuje především ledvinami, aminopenicilin v kombinaci s BLI, cefalosporin skupiny 2 nebo 3a, nebo v případě parenterální terapie aplikace aminoglykosidu.
V případě selhání počáteční terapie nebo v případě klinicky závažné infekce by mělo být vybráno antibiotikum s širším spektrem, které působí i proti Pseudomonas, např. fluorchinolon (pokud nebyl užit při počáteční terapii), acylaminopenicilin (piperacilin) v kombinaci s BLI, cefalosporiny skupiny 3b nebo karbapenem s/bez kombinace s aminoglykosidem.
Délka terapie je obvykle 7–14 dnů, ale někdy je nutné ji prodloužit až na 21 dnů.
Dokud nejsou úplně odstraněny predisponující faktory, vyléčení bez recidivující infekce není obvykle možné. Proto 5–9 dnů po skončení terapie by měla být provedena kultivace moči a další po 4–6 týdnech.
5.2 Definice a klasifikace
Komplikovaná infekce močových cest je infekce spojená se strukturálními nebo funkčními abnormalitami močopohlavních cest nebo přítomností onemocnění, což zvyšuje riziko získání infekce nebo selhání terapie [1-3]. Dvě kritéria jsou při definování komplikované infekce močových cest povinná: pozitivní kultivace moči a jeden nebo více z faktorů uvedených v tab. 9.
Tab. 9. Faktory ukazující na potencionální výskyt komplikované infekce močových cest. 
Komplikovaná infekce močových cest se může objevit u heterogenní skupiny pacientů. Ale ani věk pacienta ani pohlaví samotné nehrají roli při definici komplikované infekce močových cest. S ohledem na prognózu a klinické studie se doporučuje rozdělit komplikovanou infekci močových cest způsobenou urologickými onemocněními alespoň do 2 skupin [4].
- Pacienti, u nichž mohou být komplikující faktory eliminovány pomocí terapie, např. extrakce močových konkrementů, odstranění zavedeného katétru.
- Pacienti, u nichž komplikující faktor nemůže být, nebo není dostatečně odstraněn během terapie, např. permanentně zavedený katétr, reziduální močové konkrementy po léčbě nebo neurogenní močový měchýř.
5.2.1 Klinické projevy
Komplikovaná infekce močových cest může, nebo nemusí souviset s klinickými symptomy (dysurie, urgence, frekvence, bolest v boku, citlivost kostovertebrálního úhlu, bolest v suprapubické oblasti a horečka). Klinické projevy se mohou lišit od závažné obstrukční akutní pyelonefritidy s hrozící urosepsí až k pooperační infekci způsobené katétrem, která může spontánně vymizet, jakmile je katétr odstraněn. Je třeba si uvědomit, že symptomy zejména dolních cest močových (LUTS) nejsou způsobeny pouze infekcí močových cest, ale také dalšími urologickými onemocněními jako benigní hyperplazie prostaty (BPH), transuretrální resekce prostaty (TURP) atd.
Kromě urologických abnormalit jsou často při komplikované infekci močových cest přítomny další stavy - diabetes mellitus (10 %) a renální selhání, které mohou souviset s urologickými abnormalitami [5]. Podrobněji jsou popsány v kapitole 4.
5.2.2 Kultivace moči
Signifikantní bakteriurie u komplikované infekce močových cest je definována počtem ≥ 105 cfu/ml a ≥ 104 cfu/ml ze středního proudu moči u žen a mužů [1,2]. Pokud je odebrán vzorek moči cévkováním, lze považovat počet ≥ 104 cfu/ml za relevantní. U asymptomatického pacienta se vyžaduje provedení dvou po sobě jdoucích kultivací moči (rozdíl alespoň 24 hodin) s nálezem ≥ 105 cfu/ml stejného mikroorganizmu. Požadavek na pyurii je 10 leukocytů per high-power field (x400) resuspendovaného sedimentu alikvotní části moči nebo na mm3 z necentrifugované moči. Pro rutinní hodnocení lze použít test pomocí proužku, zahrnující test leukocytesterázy, hemoglobin a nitritovou reakci.
5.3 Mikrobiologie
5.3.1 Spektrum a rezistence na antibiotika
Pacienti s komplikovanou infekcí močových cest, a už získanou při hospitalizaci, nebo s běžnou komunitní uroinfekcí, vykazují přítomnost rozličných druhů mikroorganizmů s vyšší prevalencí rezistence proti antimikrobiálním preparátům a vyšším procentem selhání léčby, pokud nelze přítomnou abnormalitu odstranit. Přítomnost rezistentního kmene sama o sobě však nestačí pro definování komplikované infekce močových cest; je také nezbytná přítomnost abnormality močových cest (anatomická nebo funkční) nebo přítomnost dalšího onemocnění predisponujícího k infekci močových cest.
Komplikovanou infekci močových cest může způsobit celá řada bakterií. Spektrum je mnohem širší než u nekomplikované infekce močových cest a bakterie jsou častěji rezistentní k antibiotikům (zejména při komplikované infekci spojené s léčbou) než bakterie izolované u nekomplikované infekce močových cest. Obvyklými kmeny zjištěnými při kultivaci jsou E. coli, Proteus, Klebsiella, Pseudomonas, Serratia spp., Enterococci. Převládají enterobakterie (60–70 %) [6-8], a zejména při první infekci je nejčastějším patogenem E. coli. Jinak se spektrum bakterií liší dle zdravotnického zařízení a doby výskytu.
5.3.2 Komplikované infekce močových cest spojené s močovými konkrementy
V podskupině komplikovaných infekcí močových cest souvisejících s močovými konkrementy se zdá být výskyt E. coli a Enterococci méně významný. Naopak jsou ve větší míře zjištěny Proteus spp a Pseudomonas [9]. Z organizmů produkujících ureázu převládají Proteus, Providencia, Morganella spp. a Corynebacterium urealyticum. Ovšem Klebsiella, Pseudomonas, Serratia a Staphilococcus spp. jsou také do jisté míry producenty ureázy. Mezi pacienty s litiázou mělo 88 % infekci močových cest v době diagnózy a 82 % pacientů bylo infikováno organizmy produkujícími ureázu [10]. Enzym ureáza štěpí moč na oxid uhličitý a amoniak. Toto zvýšení amoniaku v moči poškozuje vrstvu glykosaminoglykanu, což zvyšuje adherenci bakterií [11] a zvyšuje tvorbu struvitových krystalů. Z nich vznikají močové konkrementy a inkrustace na močových katétrech [12].
Patogenní potenciál koagulázo-negativních stafylokoků a streptokoků, které nepatří do skupiny D, je sporný [13,14]. Za jistých okolností, jako je například přítomnost konkrementu nebo cizích látek, mohou být stafylokoky relevantními patogeny. Jinak se stafylokoky, dle publikovaných studií, nevyskytují u komplikované infekce močových cest tak často (0–11 %) [6,15].
5.3.3 Komplikovaná infekce močových cest spojená se zavedeným katétrem
U infekce související se zavedeným katétrem je distribuce mikroorganizmů podobná [16]; je třeba brát v úvahu přítomnost biofilmu.
Antimikrobiální terapie může být úspěšná pouze v počátečním stadiu této infekce [15].
5.4 Léčba
5.4.1 Obecná pravidla
Strategie léčby závisí na závažnosti onemocnění. Vhodná antimikrobiální terapie a řešení urologické abnormality je nezbytné. V případě potřeby se podává podpůrná péče. Často je nezbytná hospitalizace v závislosti na závažnosti onemocnění.
5.4.2 Výběr antibiotik
Empirická léčba symptomatické komplikované infekce močových cest vyžaduje znalost spektra možných patogenů a rezistence na antibiotika a vyšetření závažnosti dalších urologických abnormalit (zahrnující vyšetření renální funkce).
Bakteriemie je obvykle zjištěna příliš pozdě na to, aby mohla ovlivnit výběr antibiotik. Avšak podezření na přítomnost bakteriemie musí ovlivnit empirickou léčbu. Nejdůležitějším faktorem pro prognózu je stále závažnost sdruženého onemocnění současného urologického stavu.
Bylo publikováno mnoho terapeutických studií zabývajících se specifickými antimikrobiálními terapiemi u komplikované infekce močových cest. Bohužel většina studií má při praktickém řešení v běžné situaci omezené použití z důvodu následujících limitací:
- špatná charakterizace populace pacientů
- nejasné hodnocení závažnosti onemocnění
- nejsou správně rozlišeny nozokomiální a komunitní infekce
- málokdy je zohledňován urologický výsledek.
Intenzivní aplikace jakéhokoli antimikrobiálního preparátu, zejména pokud je užíván na empirické bázi ve skupině pacientů s vysokou pravděpodobností recidivující infekce, vede ke vzniku mikroorganizmů rezistentních při dalších infekcích. Kdykoli je to možné, měla by být empirická terapie nahrazena terapií přizpůsobenou specifickým infekčním organizmům zjištěným při kultivaci moči. Proto musí být před započetím terapie získán vzorek moči pro kultivaci a výběr antimikrobiálního přípravku by měl být znovu zhodnocen poté, co jsou k dispozici výsledky kultivace [7]. Prozatím nebylo prokázáno, že by jakýkoli přípravek nebo skupina přípravků byla účinnější v případě, že je infekční organizmus citlivý na aplikovaný preparát.
U pacientů s renálním selháním, a již souvisí s urologickou abnormalitou, nebo ne, je třeba vhodně upravit dávkování.
V případě, že je nezbytná empirická léčba, doporučuje se aplikace fluorchinolonů s renální exkrecí, protože mají široké spektrum antimikrobiální účinnosti, která pokrývá většinu očekávaných patogenů, a dosahují vysoké koncentrace v moči i v urogenitálních tkáních. Fluorchinolony mohou být aplikovány perorálně i parenterálně. Dalšími alternativami jsou aminopenicilin v kombinaci s BLI, cefalosporin skupiny 2 nebo 3a, nebo v případě parenterální terapie aminoglykosid.
Ve většině států vykazuje E. coli vysoké procento rezistence proti TMP-SMX (18 % při posledním hodnocení v USA) [16], proto bychom se měli vyhnout jeho aplikaci jako léku první volby. Fosfomycin trometamol je užíván při nekomplikované cystitidě v 1 dávce. Aminopeniciliny, ampiciliny nebo amoxycilin nejsou v současné době proti E. coli účinné. V případě selhání počáteční terapie, nebo pokud nejsou ještě k dispozici mikrobiologické výsledky nebo při počáteční terapii v případě klinicky závažné infekce bychom měli přejít na aplikaci antibiotika se širším spektrem, které je účinné také proti Pseudomonas, např. fluorchinolon (pokud nebyl užit při počáteční terapii), acylaminopenicilin (piperacilin) v kombinaci s BLI, cefalosporin skupiny 3b nebo karbapenem, případně v kombinaci s aminoglykosidem.
Pacienti mohou být léčeni ambulantně. U závažnějších případů (tj. u hospitalizovaných pacientů) musí být antibiotika aplikována parenterálně a pro empirickou terapii se užívá kombinace aminoglykosidů s beta-laktamy nebo fluorchinolonem. Po několika dnech parenterální terapie lze přejít na perorální léčbu, pokud dojde ke klinickému zlepšení. Terapii je třeba znovu přehodnotit v případě, že jsou zjištěny infekční kmeny nebo pokud je známa jejich citlivost.
Úspěšná léčba komplikované infekce močových cest vždy kombinuje úspěšnou antimikrobiální terapii, optimální řešení přítomných urologických abnormalit nebo dalších onemocnění a dostatečná život podporující opatření.
Možnosti antibakteriální léčby jsou shrnuty v dodatku 2.
5.4.3 Délka antibiotické terapie
Obecně se doporučuje léčba trvající 7–14 dnů, ale délka by měla souviset s léčbou přítomné abnormality [1]. Někdy je nezbytné prodloužení léčby až na 21 dnů v závislosti na klinické situaci [2].
5.4.4 Komplikovaná infekce močových cest spojená s močovými konkrementy
Pokud zůstane ložisko infekce nebo konkrementu, dojde k růstu močového kamene. Je tedy nezbytné úplné odstranění konkrementů a adekvátní antimikrobiální terapie. Eradikace infekce zřejmě eliminuje růst struvitových konkrementů [18]. Pokud nebylo dosaženo úplného odstranění močového kamene, měla by být zvážena dlouhodobá antimikrobiální terapie [19].
5.4.5 Komplikovaná infekce močových cest spojená se zavedenými katétry
Současné údaje nepodporují léčbu asymptomatické bakteriurie, a to ani při krátkodobé katetrizaci (méně než 30 dní), ani při dlouhodobé katetrizaci, protože podporuje výskyt rezistentních kmenů [20,21]. Při krátkodobé katetrizaci mohou antibiotika oddálit nástup bakteriurie, ale nesnižují výskyt komplikací [22].
Symptomatická komplikovaná infekce močových cest spojená se zavedeným katétrem je léčena přípravkem s co nejužším spektrem v závislosti na výsledcích kultivace a senzitivity. Optimální doba trvání ještě není přesně stanovena.
Léčba, která je buï příliš krátká, nebo je příliš dlouhá, může způsobit výskyt rezistentních kmenů. Rozumným kompromisem může být 7denní léčba.
5.4.6 Komplikovaná infekce močových cest u pacientů s poraněním míchy
Všeobecně se uznává, že by asymptomatická bakteriurie u těchto pacientů neměla být léčena [23] dokonce ani v případě intermitentní katetrizace. U symptomatických příhod infekce u pacientů s poraněním míchy zkoumalo vhodný přípravek a vhodnou délku terapie pouze několik studií. V současné době se nejčastěji užívá terapie trvající 7–10 dní. U této specifické skupiny pacientů není žádný preparát či skupina antimikrobiálních preparátů účinnější než jiná.
Možnosti antimikrobiální léčby jsou uvedeny v tab. 10.
Tab. 10. Možnosti antimikrobiální léčby při empirické terapii. 
5.4.7 Sledování po léčbě
Dalším znakem těchto infekčních onemocnění je vyšší pravděpodobnost rezistence mikroorganizmů přítomných při komplikované infekci močových cest. Tento fakt a priori nesouvisí s přítomností abnormality močových cest, ale spíše s tím, že pacienti s komplikovanou infekcí močových cest mívají recidivující infekci [7]. Z tohoto důvodu musí být před a po ukončení antimikrobiální léčby provedena kultivace moči kvůli identifikaci mikroorganizmů a hodnocení testu citlivosti.
5.5 Závěr
Dokud nejsou predisponující faktory úplně odstraněny, není skutečná léčba (tj. bez recidivující infekce) obvykle možná. Součástí nezbytné části léčby je provedení korekce těchto abnormalit, pokud je možné. Pokud nelze urologickou abnormalitu odstranit, je pravidlem recidiva infekce, a to buï relaps (tj. stejný mikroorganizmus) nebo opakovaná infekce (tj. nový mikroorganizmus). Z tohoto důvodu musí být 5–10 dní po dokončení terapie provedena kultivace moči a další o 4–6 týdnů později.
5.6 Literatura
1. Rubin RH, Shapiro ED, Andriole VT, Davis RJ, Stamm WE. Evaluation of new anti-infective drugs for the treatmént of UTI. Clin Infect Dis 1992; 15(Suppl 1): 216-227.
2. Rubin RH, Shapiro ED, Andriole VT, Davis RJ, Stamm WE, with modifications by a European Working Party. General guidelines for the evaluation of new anti-infective drugs for the treatment of UTI. Taufkirchen, Germany: The European Society of Clinical Microbiology and Infectious Diseases 1993 : 240-310.
3. Kumazawa J, Matsumoto T. Complicated UTIs. In: Bergan T (ed). UTIs. Infectiology. Basel: Karger 1997; 1. vol: 19-26.
4. Naber KG. Experience with the new guidelines on evaluation of new anti-infective drugs for the treatment of UTIs. Int J Antimicrob Agents 1999; 11 : 189-196.
5. Sharifi R, Geckler R, Childs S. Treatment of UTIs: selecting an appropriate broad-spectrum antibiotic for nosocomial infections. Am J Med 1996; 100(Suppl 6A): 76-82.
6. Frankenschmidt A, Naber KG, Bischoff W, Kullmann K. Once-daily fleroxacin versus twice-daily ciprofloxacin in the treatment of complicated UTIs. J Urol 1997; 158 : 1494-1499.
7. Nicolle LE. A practical guide to the management of complicated UTI. Drugs 1997; 53 : 583-592.
8. Cox CE, Holloway WJ, Geckler RW. A multicenter comparative study of meropenem and imipenem/cilastatin in the treatment of complicated UTIs in hospitalized patients. Clin Infect Dis 1995; 21 : 86-92.
9. Dobardzic AM, Dobardzic R. Epidemiological features of complicated UTI in a district hospital of Kuwait. Eur J Epidemiol 1997; 13 : 465-47G.
10. Emori TG, Gaynes RP. An overview of nosocomial infections, including the role of the microbiology laboratory. Clin Microbiol Rev 1993; 6 : 428-442.
11. Parsons CL, Stauffer C, Mulholland SF, Griffith DP. Effect of ammonium on bacterial adherence in bladder transitional epithelium. J Urol 1984; 132 : 365-366.
12. Dumanski AJ, Hedelin H, Edin-Li jergen A, Beauchemin D, McLean RJ. Unique ability of the Proteus mirabilis capsule to enhance mineral growth in infectious urinary calculi. Infect Immun 1994; 62 : 2998.
13. Stamm WE, Hooton TM. Management of UTIs in adults. N Engl J Med 1993; 329 : 1328-1334.
14. US Department of Health and Human Services, Food and Drug Administration. Center for Drug Evaluation and Research (CDER). Guidance for Industry, Complicated UTIs and Pyelonephritis-Developing Antimicrobial Drugs for Treatment. Clin-Anti. Rockville, MD: Drug Information Branch. Division of Communications Management, July 1998.
15. Reid G. Biofilms in infectious disease and on medical devices. Int J Antimicrob Agents 1999; 11 : 223-226.
16. Sahm DF, Vaughan D, Thornsberry C. Antimicrobial resistance profiles among Escherichia colt (EC) urinary tract isolates in the United States: a current view. 39th Interscience Conference on Antimicrobial Agents and Chemotherapy (ICAAC), San Francisco, CA, USA, 1999: Abstract 611.
17. Lerner SA, Price S, Kulkarni S. Microbiological studies of fosfomycin trometamol against urinary isolates in vitro. In: Williams N (ed). New Trends in UTIs. Basel: Karger 1988 : 121-129.
18. Griffith DP, Osborne CA. Infection (urease) stones. Miner Electrolyte Metab 1987; 13 : 278.
19. Beck EM, Riehle RA Jr. The fate of residual fragments after extracorporeal shock wave lithotripsy monotherapy of infection stones. J Urol 1991; 145 : 6.
20. Alling B, Brandberg A, Seeberg S, Svanborg A. Effect of consecutive antibacterial therapy on bacteriuria in hospitalized geriatric patients. Scand J Infect Dis 1975; 7 : 201-207.
21. Warren JW, Anthony WC, Hoopes JM, Muncie HL. Cephalexin for susceptible bacteriuria in afebrile, long term catheterized patients. JAMA 1982; 248 : 454-458.
22. Yoshikawa TT, Nicolle LE, Norman DC. Management of complicated UTI in older patiens. JAGS 1996; 44 : 1235-1241.
23. National Institute on Disability and Rehabilitation Research. The prevention and management of urinary tract infections among people with spinal cord injuries. Consensus Statement. J Am Paraplegia Soc 1992; 15 : 194-204.
Štítky
Detská urológia Urológia
Článek MYKOTICKÉ INFEKCEČlánek CHRONICKÉ PÁNEVNÍ BOLESTIČlánek EditorialČlánek SEPTICKÝ ŠOK U UROINFEKCÍČlánek KVÍZ
Článok vyšiel v časopiseUrologické listy
Najčítanejšie tento týždeň
2005 Číslo 2- Vyšetření T2:EGR a PCA3 v moči při záchytu agresivního karcinomu prostaty
- Lék v boji proti benigní hyperplazii prostaty nyní pod novým názvem Adafin
-
Všetky články tohto čísla
- NEKOMPLIKOVANÉ UROINFEKCE: CO JE NOVÉHO A CO SE ZMĚNILO
- KOMPLIKOVANÉ UROINFEKCE: CO JE NOVÉHO A CO SE ZMĚNILO
- INFEKCIE MOČOVÝCH CIEST U DETÍ A V TEHOTENSTVE
- MYKOTICKÉ INFEKCE
- Editorial
- UROGENITÁLNÍ TUBERKULÓZA NA POČÁTKU 3. TISÍCILETÍ
- CHRONICKÉ PÁNEVNÍ BOLESTI
- PRINCIPY ANTIMIKROBIÁLNÍ LÉČBY U UROINFEKCÍ
- SEXUÁLNĚ PŘENOSNÁ ONEMOCNĚNÍ Z POHLEDU UROLOGA
- SEPTICKÝ ŠOK U UROINFEKCÍ
-
GUIDELINES EAU PRO DIAGNOSTIKU A LÉČBU INFEKCÍ MOČOVÝCH CEST, VČETNĚ POHLAVNÍCH CEST U MUŽŮ
1. ČÁST - KVÍZ
- Urologické listy
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- MYKOTICKÉ INFEKCE
- INFEKCIE MOČOVÝCH CIEST U DETÍ A V TEHOTENSTVE
- SEPTICKÝ ŠOK U UROINFEKCÍ
-
GUIDELINES EAU PRO DIAGNOSTIKU A LÉČBU INFEKCÍ MOČOVÝCH CEST, VČETNĚ POHLAVNÍCH CEST U MUŽŮ
1. ČÁST
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy