-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Souhrn doporučení 2014
Vyšlo v časopise: Transfuze Hematol. dnes,20, 2014, No. Supplementum, p. 7-22.
Kategorie: Diagnostika a léčba Waldenströmovy makroglobulinemie
Waldenströmova makroglobulinemie (WM) patří do skupiny B-lymfoproliferativních onemocnění. Jedná se o krevní nádorové onemocnění, pro něž je typická lymfoplazmocytární infiltrace kostní dřeně nebo lymfatické tkáně a přítomnost monoklonálního imunoglobulinu (MIG) typu IgM v séru. Jedná se zatím o nevyléčitelné onemocnění. Rozhodnutí o léčebném přístupu je komplexní. Nemocné je nutné stratifikovat dle rizika a tomu uzpůsobit zvolený léčebný postup.
Pacienti s doutnající nebo asymptomatickou WM a stabilními parametry krevního obrazu jsou obvykle pouze sledováni. Léčebné možnosti WM dříve zahrnovaly především použití alkylačních látek a purinových analog, často v monoterapii. V současné době se léčebné přístupy mění vlivem zavedení kombinací s monoklonální protilátkou rituximabem a některými novými léky včetně bortezomibu a bendamustinu. U vhodných pacientů s WM zůstává užitečnou léčebnou možností provedení transplantace krvetvorných buněk. Symptomatičtí pacienti s WM s mírnou cytopenií, průvodní neuropatií spojenou s ukládáním MIG nebo hemolytickou anémií nereagující na kortikoidy, jsou obvykle léčeni rituximabem v monoterapii. Pacienti s klinicky významnou symptomatologií, například těžkou cytopenií, symptomatickou lymfadenopatií nebo hyperviskozitou, mohou být léčeni rituximabem v kombinaci s kortikoidem a alkylační látkou. U pacientů se symptomatickým relapsem WM po předchozí léčebné odpovědi trvající více než 2 roky je doporučováno opakování iniciální terapie. Pro nemocné s nedostatečnou odpovědí na iniciální terapii nebo léčebnou odpovědí kratší než 2 roky je nutné zvolit alternativní léčebnou strategii.
Předložené doporučení bylo vypracováno na základech medicíny založené na důkazech s cílem popsat všechny důležité oblasti diagnostiky a léčby Waldenströmovy makroglobulinemie platné v roce 2014.
1 Metodické postupy tvorby doporučení
Předložené doporučení bylo vypracováno na základech medicíny založené na důkazech s cílem popsat všechny důležité oblasti diagnostiky a léčby Waldenströmovy makroglobulinemie. Úrovně důkazů a stupně doporučení standardně používané v guidelines jsou uvedeny v tabulce 1.
Tab. 1. Úrovně důkazu a stupně doporučení používané ve směrnicích (guidelines) a principech medicíny založené na důkazech (evidence based medicine). 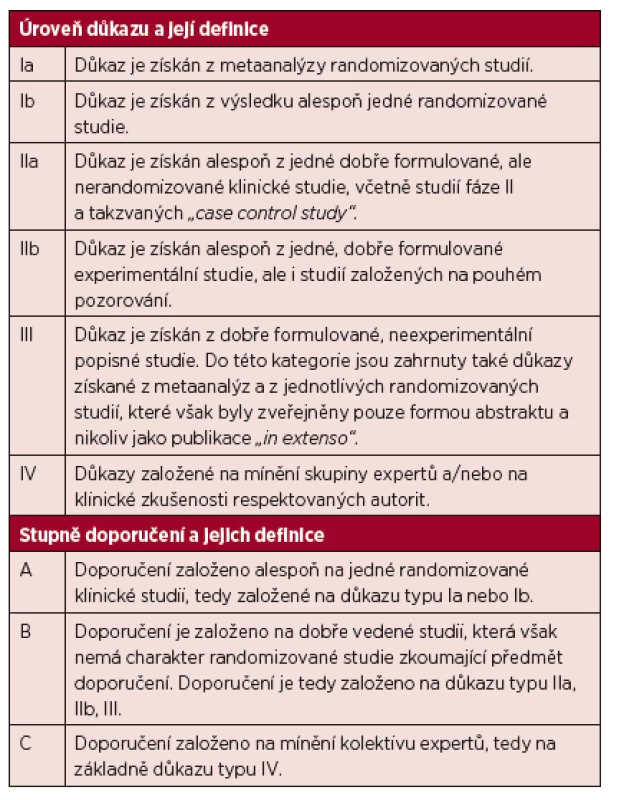
2 Diagnostická část
Diagnóza Waldenströmovy makroglobulinemie (WM) vyžaduje jak histologický průkaz lymfoplazmocytárního lymfomu v kostní dřeni, případně i v lymfatické tkáni, tak průkaz monoklonálního imunoglobulinu typu IgM. Vzácnější je průkaz lymfoplazmocytárního lymfomu bez přítomnosti monoklonálního imunoglobulinu. V tom případě se onemocnění označuje jako lymfoplazmocytární lymfom.
Lymfoplazmocytární lymfom je B-lymfoproli-ferativní onemocnění, charakteristické lymfoplazmocytární klonální expanzí. Toto onemocnění je vzácné, představuje asi 1,5 % ze všech nehodgkinských lymfomů. V typických případech postihuje kostní dřeň, lymfatické uzliny a slezinu. Morfologie ukazuje malé lymfocyty s variabilním stupněm cytoplazmatické maturace.
Pro onemocnění je v rámci B lymfocytů typický imunofenotyp CD19loCD20+CD22loCD5-CD10-CD11c-CD23-CD25+CD27+cIgLC+sIgM++ (Paiva, 2014) a charakteristický histopatologický nález při vyšetření postižené kostní dřeně nebo lymfatické uzliny. Dle WHO klasifikace z roku 2008 je toto onemocnění řazeno mezi zralé B-celulární neoplázie a je definováno jako neoplázie z malých B lymfocytů, plazmocytoidních lymfocytů a plazmocytů (Ansell, MA 2010; Swerdlow, 2008).
Molekulární podstata onemocnění není zcela objasněná, v řadě případů MW lze najít deleci 6q, trizomii chromozomů 4 a 8, deleci 13q a další cytogenetické aberace (Ševčíková, 2012). Nejčastější chromozomovou aberací je delece 6q, právě v této oblasti leží nádorový supresor BLIMP-1, který hraje důležitou roli při přechodu zralého B lymfocytu do plazmatické buňky. O dalších důležitých genech hrajících roli v patogenezi MW je pojednáno podrobně v práci Ševčíkové a spol. (Ševčíková, 2012). Průkaz bodové mutace v genu MYD88 pomocí alelově specifické PCR může být nápomocný v situacích, kdy histologické a imunofenotypizační vyšetření nedokážou s jistotou odlišit klinicky podobnou lymfoproliferaci, jako je například lymfom marginální zóny (Varrettoni, 2013; Ševčíková, 2012).
Onemocnění se často vyvíjí z monoklonální gamapatie nejistého významu typu IgM a klinické příznaky nastupují velmi pozvolna. Jsou způsobeny buď infiltrací kostní dřeně s potlačením fyziologické krvetvorby (anémie, trombocytopenie, neutropenie), nebo jsou způsobeny monoklonálním imunoglobulinem (nejčastěji neuropatie vazbou na nervová vlákna, hyperviskozita, kryoglobulinemie či další projevy podrobně popsané jinde) (Adam, 2007).
Pacienti s doutnající nebo asymptomatickou formou WM a stabilními parametry krevního obrazu mohou být dlouhodobě sledováni bez terapie, protože léčba je indikována až choroba začne být symptomatická.
Je velmi důležité odlišit symptomatickou a asymptomatickou formu WM a dále monoklonální gamapatii IgM (Owen, 2003), diagnostická kritéria jsou uvedena v tabulce 2.
Tab. 2. Diagnostická kritéria pro IgM MGUS, symptomatický a asymptomatický WM <i>(Owen, 2003)</i>. 
Rozhodnutí o léčbě stejně jako volba léčebného přístupu proto musí být komplexní. Je nutné nemocné stratifikovat dle rizika a tomu uzpůsobit terapii (Ansell MA, 2010). Léčebné možnosti WM zahrnovaly dříve zejména použití alkylačních látek a purinových analog, často v monoterapii. V současné době se terapeutické přístupy mění vlivem zavedení kombinací s monoklonální protilátkou rituximabem a některými novými léky včetně bortezomibu a bendamustinu (Owen, 2014). U vhodných pacientů s WM zůstává užitečnou terapeutickou možností provedení transplantace krvetvorných buněk (Owen, 2014). V současné době jsou symptomatičtí pacienti s WM s mírnou cytopenií, průvodní neuropatií spojenou s ukládáním MIG nebo hemolytickou anémií nereagující na kortikoidy obvykle léčeni rituximabem v monoterapii. Pacienti s klinicky významnou symptomatologií, například těžkou cytopenií, symptomatickou lymfadenopatií nebo hyperviskozitou, mohou být léčeni rituximabem v kombinaci s kortikoidem a alkylační látkou, například kombinací DRC (dexametazon, rituximab, cyklofosfamid).
U pacientů se symptomatickým relapsem WM po předchozí léčebné odpovědi trvající více než 1–2 roky je doporučováno opakování iniciální terapie. Pro pacienty s nedostatečnou odpovědí na iniciální terapii nebo léčebnou odpovědí kratší než 2 roky je nutné zvolit alternativní léčebnou strategii.
2.1 Epidemiologické údaje
Waldenströmova makroglobulinemie je vzácně se vyskytující monoklonální gamapatie. Wang uvádí incidenci WM 3,8/1 milion obyvatel, dvakrát častější je u mužů než u žen (Wang, 2012). Vos uvádí incidenci kolem 3 případů na 1 milion (Vos, 2013). V ČR by tedy mělo být ročně diagnostikováno 30–38 nových případů.
2.2 Příznaky nemoci
Příznaky nemoci lze obecně rozdělit na:
- projevy insuficience kostní dřeně,
- projevy toxicity MIG a hyperviskozitu,
- projevy extramedulární proliferace lymfoplazmocytárního lymfomu (lymfadenopatie, organomegalie včetně splenomegalie).
K nespecifickým příznakům patří patologická únava související s normochromní normocytovou anémií anebo s hyperviskozitou. Samotná anémie může mít více příčin (např. infiltraci kostní dřeně s útla-kem fyziologické krvetvorby, hemodiluci při vysoké koncentraci MIG, nebo krevní ztráty). Anémie může být také důsledkem utlumení erytropoézy prozánětlivými cytokiny jako je tomu u „anémie chronických chorob“.
K nespecifickým příznakům patří úbytek hmotnosti a febrilie či subfebrilie. Pacienti s WM mají vyšší riziko krvácení či trombózy díky nízkým hladinám von Willebrandova faktoru (Hivert, 2012). Příznaky WM přehledně shrnuje tabulka 3 (Adam, 2007).
Tab. 3. Příznaky Waldenströmovy makroglobulinemie. 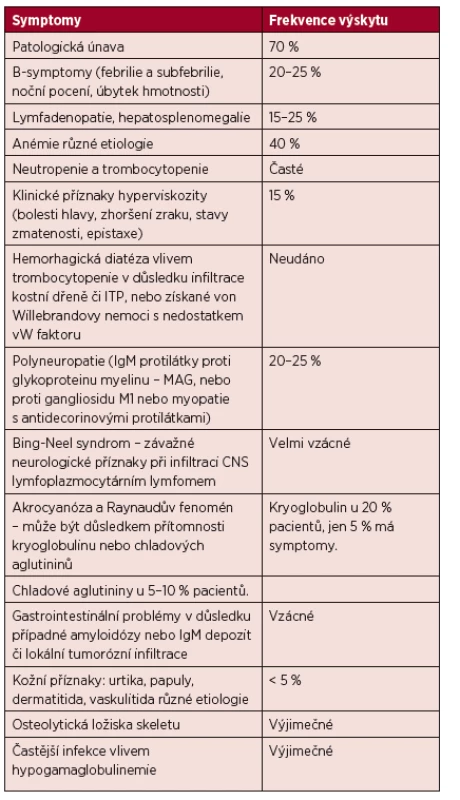
U všech IgM gamapatií, tedy jak u Waldenströmovy makroglobulinemie, tak i u MGUS typu IgM je častá polyneuropatie.
Poměrně častým nálezem u WM je kryoglobulinemie. Kryoglobulinemie I. typu je způsobena MIG typu IgM, který v chladu gelifikuje a tak způsobuje poruchu prokrvení prochlazené končetiny. V literatuře se dále popisuje i možná asociace Waldenströmovy makroglobulinemie s hepatitidou C. U těchto nemocných je často přítomna kryoglobulinemie II. typu, kdy je kryoglobulin tvořen komplexem polyklonálního imunoglobulinu typu IgG s monoklonálním imunoglobulinem typu IgM. Tento komplex má aktivitu revmatoidního faktoru. Kryoglobulinemie provázející pacienty s Waldenströmovou makroglobulinemií a hepatitidou C má proto pestřejší příznaky – způsobuje kožní purpuru, artralgie, Raynaudův fenomén a vaskulitidu postihující kůži, játra, ledviny i periferní nervy (Ševčíková, 2012; Adam, 2008).
Prvním příznakem WM může být i hyperviskozita, jejíž reologické důsledky lze vidět na očním pozadí. Hyperviskozita způsobuje zvýšení krvácení ze sliznic zažívacího traktu, může způsobit poruchy zraku, trombózu retinálních cév, krvácení do retiny, exsudáty a edém papily. To může vést k bolestem hlavy, závratím, poruchám sluchu, diplopii a výjimečně vyústit v kóma či krvácení do CNS.
2.3 Základní vyšetření
Základním vyšetřením u WM je průkaz zvýšené koncentrace monoklonálního, ale i celkového imunoglobulinu typu IgM, histologické a imunohistochemické vyšetření kostní dřeně, kterou toto onemocnění typicky postihuje. Ve většině případů je přítomna pouze infiltrace kostní dřeně, v menšině případů jsou přítomna rovněž extramedulární ložiska. Vyšetření kostní dřeně s adekvátní flowcytometrickou analýzou je vyžadováno pro stanovení definitivní diagnózy WM. Zvýšené zastoupení B lymfocytů, identifikovaných pomocí morfologického hodnocení (> 20 %) i průtokové cytometrie (> 5 %), odpovídá spíše WM nežli IgM-MGUS (Ocio, 2011). Při imunofenotypizačním vyšetření B lymfocytů je pak pro WM typická přítomnost následujících znaků: CD19lo, CD20, CD22lo, CD27 a CD25, zatímco znaky CD5, CD23 a CD103 vesměs exprimovány nejsou (Paiva, 2014; Owen, 2014). Velmi často jsou v kostní dřeni nalézány plazmocyty (PC) a plazmablasty, které sice vykazují normální „nemyelomový“ fenotyp (CD19-CD45-CD56+), avšak ve většině případů se jedná o klonální buňky vzniklé diferenciací z patologických B lymfocytů (Paiva, 2014). V rámci diferenciální diagnostiky může docházet k fenotypovému překryvu s lymfomem marginální zóny (MZL), tento ovšem mívá slaběji exprimován povrchový IgM, heterogenně CD25 a silně CD22 (Paiva, 2014; Owen, 2014). Další B lymfoproliferativní onemocnění s produkcí IgM pak lze vyloučit na základě fenotypu, např. CD10+ folikulární lymfom (FL) či CD5++ chronické B lymfocytární leukemie (B-CLL). Přestože v nízkém počtu případů byla u WM zaznamenána vysoká exprese CD5, nepřítomnost buněk CD20dimsIglo či FMC7- B-CLL vyloučila (Paiva, 2014).
Cytogenetické vyšetření je možné provést a může být užitečné v diagnostice onemocnění, ale jeho výsledky nejsou pro stanovení diagnózy zásadní a neovlivňují terapii. Delece chromozomu 6q je nejčastější cytogenetickou abnormalitou u WM, je přítomna u 50 % pacientů, její vliv na celkové přežití je však prozatím nejasný (Owen, 2014).
Pokud je stanovena diagnóza WM, pak je nutné provést komplexní vyšetření, jehož cílem je doku-mentovat rozsah nemoci a detekovat případné komplikace. Rozsah doporučených vyšetření je uveden v tabulce 4.
Tab. 4. Vyšetření prováděná u Waldenströmovy makroglobulinemie. 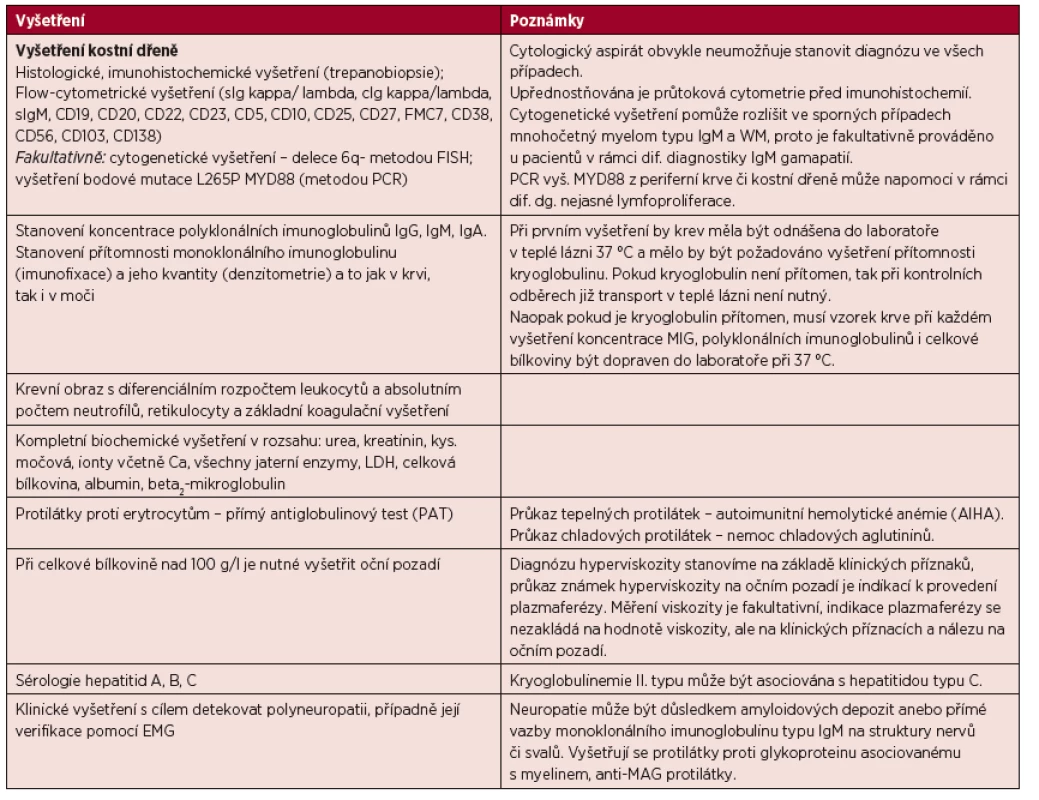
Monitorování koncentrace MIG IgM by mělo být prováděno vždy ve stejné laboratoři a za použití stejné metodologie. U části pacientů s WM může dojít k transformaci do difuzního velkobuněčného B lymfomu (DLBCL), v těchto případech je doporučována biopsie tkáně (nejčastěji lymfatické uzliny) a histologická verifikace. Monoklonální imunoglobulin typu IgM se může vyskytovat i u dalších lymfoproliferací (Adam, 2007).
V případě, že nelze provádět monitorování koncentrace MIG pomocí standardních parametrů, lze využít vyšetření volných lehkých či těžkých řetězců (FLC nebo HLC).
Rentgenové vyšetření skeletu ve stejném rozsahu jako u mnohočetného myelomu se provádí jen v případě klinického podezření na postižení skeletu.
PET-CT vyšetření přináší informace jak o postižení kostí, tak o mimokostních projevech, tj. přítomné lymfadenopatii anebo splenomegalii či hepatomegalii (Banwait, 2011).
Vyhodnocování léčebné odpovědi se obvykle provádí na základě vývoje koncentrace monoklonálního imunoglobulinu IgM.
V případě klinického obrazu polyneuropatie, typicky převážně periferního typu, je vhodné odebrat protilátky proti nervovým strukturám (anti-MAG protilátky, anti-GM protilátky), dále provést neurologické vyšetření a EMG vyšetření a vyloučit jiné příčiny neuropatie, včetně AL amyloidózy.
2.4 Prognóza a vzorový zápis diagnózy WM
Waldenströmova makroglobulinemie je nemoc s poměrně příznivou prognózou. Udávaný medián celkového přežití je 6,4 roku (Adam, 2007; Owen, 2014).
Osud nemocných je však velmi různorodý a více informací o prognóze u konkrétního pacienta nám mohou poskytnout prognostické indexy. Nejvýznamnějším z nich je Mezinárodní prognostický skórovací systém pro WM (ISSWM), který je založen na hodnocení 5 klíčových parametrů, kterými jsou – věk, hodnota hemoglobinu, počet trombocytů, sérové koncentrace beta2-mikroglobulinu a MIG (Morel, 2009), podrobnosti jsou uvedeny v tabulce 5.
Tab. 5. Mezinárodní prognostický skórovací systém pro nemocné s Waldenströmovou makroglobulinemií – ISSWM (Morel, 2009). 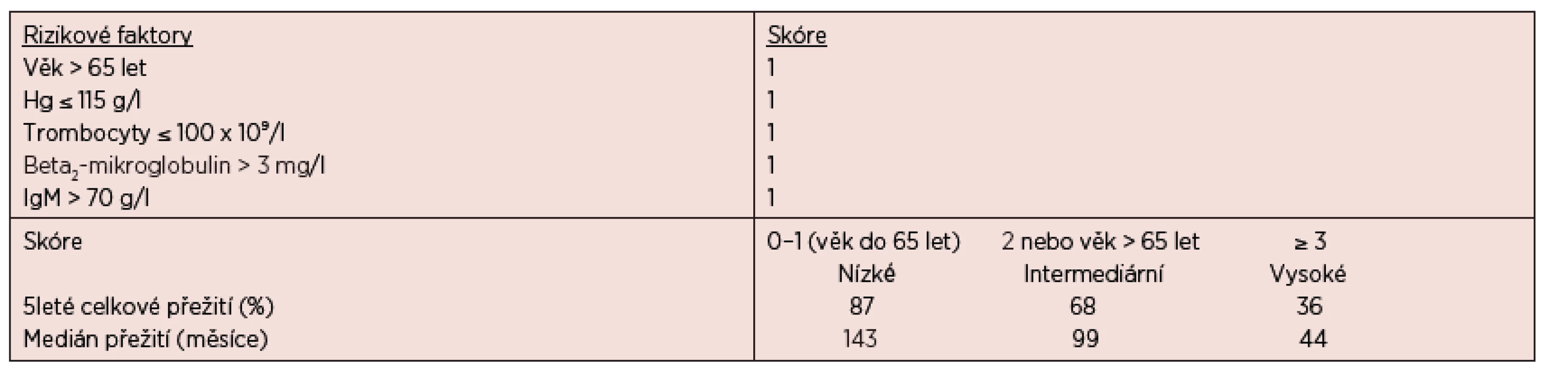
Doporučený zápis diagnózy WM by měl být v následujícím formátu: C88.0 Morbus Waldenström/Waldenströmova makroglobulinemie – asymptomatický/symptomatický; datum diagnózy, riziko dle ISSWM nízké/intermediární/vysoké; rozsah postižení (CT trupu/USG periferních uzlin v době stanovení diagnózy/relapsu); indikace k léčbě (hyperviskozita, nemoc chladových aglutininů, symptomatická kryoglobulinemie, IgM mediovaná neuropatie, lymfadenopatie, organomegalie, anémie s hemoglobinem < 100 g/l, trombocytopenie < 100 x 109/l).
2.5 Závěrečná doporučení k diagnostické části
- a) Monitorování koncentrace MIG IgM by mělo být prováděno v jedné laboratoři a za použití vždy stejné metodologie (stupeň doporučení A, úroveň důkazu Ib).
- b) Vyšetření kostní dřeně, nejlépe trepanobiopsie s adekvátní imunofenotypizační analýzou, je nezbytné pro stanovení diagnózy WM (stupeň doporučení A, úroveň důkazu Ib).
- c) Biopsie tkáně je doporučována u všech pacientů se suspektní histologickou transformací (u části nemocných s WM může dojít k transformaci do DLBCL) (stupeň doporučení A, úroveň důkazu Ib).
- d) U pacientů se symptomatickou periferní neuropatií je doporučováno vyšetření anti-MAG protilátek (stupeň doporučení A, úroveň důkazu Ib).
- e) Provedení CT vyšetření (hrudníku, břicha, pánve) je doporučováno u všech symptomatických pacientů před zahájením chemoterapie (stupeň doporučení B, úroveň důkazu IIa).
- f) Cytogenetická analýza a další genomická vyšetření jsou v rámci rutinní diagnostiky MW prozatím spíše fakultativní (stupeň doporučení B, úroveň důkazu IIa). PCR vyšetření mutace MYD88 genu může napomoci v rámci diferenciální diagnostiky WM. Další hodnocení prognostického význa-mu genomických změn a chromozomálních aberací je vhodné, optimálně v rámci prospektivních klinických studií (stupeň doporučení B, úroveň důkazu IIa).
3 Obecné informace o léčbě
3.1 Indikace k léčbě
Současné léčebné možnosti (chemoterapie i cílená léčba) mají potenciál dosáhnout léčebné odpovědi (remise nemoci) u velkého počtu nemocných. U většiny nemocných však není možná úplná elimi-nace maligního klonu a tedy dosažení úplného uzdravení. Nemoc obvykle po remisi, trvající řá-dově měsíce či roky, opět recidivuje a vyžaduje další léčbu. Proto se u Waldenströmovy makroglobulinemie v současné době doporučuje asymptomatické nemocné pouze sledovat a se zahájením léčby vyčkávat až do prvních klinických projevů (Johnson, 2006; Owen, 2014).
Indikací k zahájení léčby Waldenströmovy makroglobulinemie jsou:
- klinické příznaky a projevy hyperviskozity (neurologické nebo oční projevy),
- symptomatická periferní neuropatie,
- symptomatická kryoglobulinemie,
- cytopenie (koncentrace hemoglobinu pod 100 g/l a/nebo počet trombocytů pod 100 x 109/1,
- velká („bulky“) lymfadenopatie nebo organomegalie nebo známky transformace ve velkobuněčný B-lymfom,
- nebo jiné projevy onemocnění, které jsou natolik závažné, že vyžadují zahájení léčby (febrilie, noční pocení, úbytek hmotnosti, patologická únava, neuropatie či jiné poškození organismu monoklonálním imunoglobulinem).
Koncentrace monoklonálního imunoglobulinu IgM není sama o sobě indikací k zahájení léčby, nicméně pokud by koncentrace dosáhla 50 g/l, doporučuje se pátrat po možných projevech hyperviskozity (krvácení z nosu a z dásní, zhoršení vizu, bolesti hlavy, závratě, ataxie a změny psychiky). Vždy je nutné provést vyšetření očního pozadí. Pokud jsou přítomny klinické příznaky hyperviskozity, je akutně indikována plazmaferéza.
3.2 Volba optimální léčby
Při volbě léčby je nutno zodpovědět následující otázky:
Umožňuje věk a stav pacienta případnou vysokodávkovanou chemoterapii při neúspěchu klasické chemoterapie? Pokud ano, pak je nutné omezit dávky alkylačních cytostatik a v rámci léčby první linie by neměla být podávána purinová analoga.
Má pacient závažnou cytopenii (neutropenii anebo trombocytopenii)? Pokud ano, pak zvolit takovou léčbu, která cytopenii neprohloubí a nezpůsobí tak závažné komplikace.
Potřebuje pacient rychlý nástup léčebné odpovědi? Pokud ano, pak zvolit léky, po nichž dochází k rychlému poklesu koncentrace monoklonálního imunoglobulinu.
Je přítomna klinicky symptomatická hyperviskozita či jiné komplikace způsobené monoklonálním imunoglobulinem? Pokud ano, je nutno léčbu začít terapeutickou plazmaferézou (Johnson, 2006).
Skutečnost, že Waldenströmova makroglobulinemie je velmi vzácným onemocněním s relativně dlouhým přežitím nemocných, limituje organizování velkých klinických studií. Proto informace o účinnosti léčby máme z menších studií, které obvykle hodnotí pouze počet léčebných odpovědí a délku remise, zatímco studie fáze III, které by srovnávaly vliv léčebných postupů na délku celkového přežití, jsou ojedinělé.
Léčebný algoritmus pro primoléčbu WM je uveden ve schématu 1, léčebný algoritmus pro léčbu relapsu či refrakterní WM je uveden ve schématu 2.
Schéma 1. Primoléčba Waldenströmovy makroglobulinemie. 
Schéma 2. Léčba relapsu/refrakterní Waldenströmovy makroglobulinemie. 
3.3 Hodnocení léčebných odpovědí
Hodnocení účinku léčby u WM vychází z posuzování vývoje koncentrace MIG, ale i dalších klinických parametrů – lymfadenopatie či organomegalie. Kritéria dosažení léčebných odpovědí u WM jsou přehledně uvedena v tabulce 6.
Tab. 6. Definice léčebných odpovědí u Waldenströmovy makroglobulinemie <i>(Owen, 2013)</i>. 
4 Přehled léčebných možností
4.1 Glukokortikoidy
Podání běžných dávek prednizonu (do 1 mg/kg) nezvyšuje počet léčebných odpovědí ani neprodlužuje délku přežití. Běžné dávky prednizonu jsou však účinné u pacientů s autoimunitní hemolytickou anémií, případně kryoglobulinemií II. typu, ale již ne u nemoci chladových aglutininů (Dimopoulos, 2005a; Björkholm, 2004).
Vysoké dávky glukokortikoidů, konkrétně dexametazonu, však potlačily chorobu a navodily léčebnou odpověď u pacientů, u nichž pro cytopenii nepřipadala v úvahu léčba alkylačními cytostatiky (O´Reilly, 1967; Jane, 1988).
4.2 Klasická cytostatika
Dříve standardním léčebným postupem u Wal-denströmovy makroglobulinemie bylo podávání chlorambucilu. Léčebná odpověď při léčbě chlorambucilem nastupuje u nemocných s WM pomalu, interval do dosažení maximální léčebné odpovědi se pohybuje v rozmezí 9–18 měsíců. Počet celkových léčebných odpovědí po chlorambucilu kolísá kolem 50–60 %, kompletní remise je touto léčbou dosažena výjimečně. Nebyl prokázán rozdíl mezi léčebnými efekty kontinuál-ní (0,1 mg/kg/den dlouhodobě) a intermitentní (0,3 mg/kg/den 7 dní v 6týdenních intervalech) aplikace chlorambucilu. Medián celkového přežití byl v obou skupinách 5,4 roku, medián intervalu od randomizace do dosažení objektivní léčebné odpovědi byl 18 měsíců a medián trvání remise 26 měsíců (Kyle, 2000).
Optimální délka podávání chlorambucilu není známa. V některých studiích byl podáván do dosažení maximálního efektu, v jiných studiích byl podáván fixně po dobu 1 až 2 let. Nebylo prokázáno, že by podávání chlorambucilu v rámci udržovací léčby mělo jakýkoliv přínos (Dimopoulos, 2005a). Monoterapie chlorambucilem je v současné době již překonaným standardem minulého století.
4.3 Purinová analoga
Do skupiny purinových analog patří fludarabin, 2-chlorodeoxyadenosin a pentostatin. V klinických studiích byl dominantně používán fludarabin.
4.3.1 Fludarabin
4.3.1.1 Fludarabin v monoterapii
Klinická studie testující fludarabin v monoterapii jak u relabujících, tak u dříve neléčených nemocných s WM, je studie zahrnující 182 nemocných. Celkový počet léčebných odpovědí dosáhl 38–40 % u nově diagnostikovaných (118 pacientů) a 33 % u pacientů dříve léčených (64 nemocných). Kompletní remise byly dosaženy výjimečně, pouze ve 3 % případů. Medián bezpříznakového a celkového přežití byl 43 resp. 84 měsíců (Dhodapkar, 2003). V literatuře lze najít dvě prospektivní randomizované studie, v nichž byly porovnány výsledky léčby fludarabinem v monoterapii se staršími léčebnými postupy. Randomizované srovnání léčby prvního relapsu fludarabinem a režimu CAP (cyklofosfamid, adriamycin a prednizon) u 92 nemocných prokázalo lepší léčebnou odpověď po fludarabinu 30 % versus 11 % po režimu CAP (p = 0,019). Medián trvání léčebné odpovědi byl 19 versus 3 měsíce (p < 0,01). Mezi mediány celkového přežití nebyl signifikantní rozdíl, 41 versus 45 měsíců. Nepřítomnost rozdílu v délce přežití souviselo s tím, že pacienti nereagující na léčbu CAP byli následně rovněž léčeni fludarabinem (Leblond, 2001).
V roce 2013 byla publikována randomizovaná studie srovnávající perorální terapii chlorambucilem a fludarabinem u pacientů s dosud neléčenou WM, do této klinické studie bylo zařazeno 339 pacientů s WM. Tato studie prokázala efektivitu obou léků (celková léčebná odpověď 48 % pro fludarabin a 39 % pro chlorambucil), pacienti léčení fludarabinem měli však signifikantně lepší dobu do progrese a delší celkové přežití. Sekundární malignity byly frekventovanější ve skupině léčené chlorambucilem (Leblond, 2013).
Z výsledků obou srovnávacích studií se odvíjí doporučení pro volbu fludarabinového režimu při léčbě prvního či dalšího relapsu. V iniciální léčbě je nutné současné použití léku s rychle nastupující léčebnou odpovědí. Výsledky léčby fludarabinem v menších skupinách pacientů byly uvedeny v přehledu publikovaném již dříve (Adam, 2008). Dle výsledků těchto klinických studií má monoterapie fludarabinem vyšší počet léčebných odpovědí než klasická léčba chlorambucilem nebo kombinací alkylačního cytostatika, antracyklinu a prednizonu.
Důležité je poznání, že léčba fludarabinem v monoterapii či v kombinaci může mít za následek jen velmi pozvolna se rozvíjející léčebnou odpověď, maximální léčebná odpověď se může dostavit až několik měsíců po posledním cyklu léčby (Leblond, 1998).
4.3.1.2 Fludarabin v kombinaci s alkylačním cytostatikem
Kombinace fludarabinu s cyklofosfamidem přináší vyšší počet léčebných odpovědí než fludarabin v monoterapii. Studie z posledních let popisují u dříve neléčených osob dosažení léčebné odpovědi až v 85 % případů, u relabujících nemocných a nemocných refrakterních na alkylační cytostatika je počet dosahovaných léčebných odpovědí o něco nižší, v rozmezí 55–89 % (Leblond, 1998; Dimopoulos, 2003; Tamburini, 2005; Tam, 2005; Tam, 2006a; Weber, 2003; Tedeschi, 2012).
Podobně i další větší studie testující fludarabin + cyklofosfamid, navíc ještě s rituximabem, prokázaly sice vysoký počet léčebných odpovědí, ale nepřehlédnutelnou toxicitu. Ve studii zveřejněné roku 2012 autoři léčili touto kombinací 43 pacientů a dosáhli 79 % léčebných odpovědí, z toho 11,6 % kompletních a 20,9 %velmi dobrých parciálních remisí. Nicméně závažná neutropenie 3. a 4. stupně dle WHO klasifikace se objevila u 45 % nemocných v průběhu léčby, po jejím ukončení mělo 19 nemocných (44 %) dlouhotrvající neutropenii a u 3 nemocných se v průběhu dalšího sledování rozvinul MDS (Tedeschi, 2012).
4.3.2 Zhodnocení přínosu purinových analog
Purinová analoga dosahují zvláště v kombinaci s dalšími léky vyšší počet léčebných odpovědí, než dosahovala monoterapie cyklofosfamidem či chlorambucilem. Maximální léčebné odpovědi je obvykle dosaženo po 3–6 měsících, ale v 17 % případů byla maximální odpověď popsána opožděně, po 6 a v 5 % až po 12 měsících. Celkové pětileté přežití a bezpříznakové přežití dosahuje při této léčbě 62 % resp. 49 % nemocných. Hlavním nežádoucím účinkem této léčby je myelosuprese. Léčba purinovými analogy zmenšuje naděje na úspěšný sběr kmenových buněk krvetvorby pro následnou vysokodávkovanou chemoterapii. Purinová analoga dále způsobují i dlouhodobý pokles T-lymfocytů (jak CD4+, tak i CD8+), vedou tak ke snížení efektivity buněčné imunity a zvýšení rizika vzniku oportunních infekcí.
Purinová analoga, zvláště pokud jsou podávána s alkylačními cytostatiky, poškozují DNA a zároveň inhibují její opravy. V literatuře lze najít sporadické zprávy o vyšší incidenci transformace WM do „high grade“ nehodgkinského lymfomu, o vzniku sekundárního myelodysplastického syndromu a akutní myeloidní leukemie. Incidence transformace do nehodgkinského lymfomu se v několika retrospektivních studiích pohybovala mezi 4,7 až 8,0 % a incidence transformace do MDS/AML mezi 1,4 až 8,9 %, což je frekvence vyšší než při jakékoliv jiné léčbě (Tedeschi, 2012; Tam, 2006b; Leleu, 2007; Souchet-Compain, 2013a). Proto je vždy nutné pečlivě zvažovat přínos a rizika této léčby pro nemocného (Souchet-Compain, 2013b).
4.4 Rituximab
4.4.1 Rituximab v monoterapii
Rituximab v monoterapii (podání 1x týdně po dobu 4 týdnů) dosahuje 30–60 % léčebných odpovědí. Léčebná odpověď nastupuje relativně pomalu, časový interval do maximální odpovědi od zahájení léčby obvykle přesahuje 3 měsíce. Kompletní remise jsou při monoterapii vzácné a mediány délky léčebné odpovědi se pohybují mezi 7–9 měsíci u osob již dříve léčených resp. dosahují až mediánu 27 měsíců u osob dříve neléčených. Ale i pacienti, kteří nesplňují kritéria parciální remise, mají často z této léčby prospěch, neboť vlivem léčby dojde ke zlepšení parametrů krevního obrazu.
V největší publikované studii využívající léčebného efektu 4 aplikací rituximabu v týdenních intervalech (69 osob) bylo dosaženo léčebné odpovědi (nejméně PR) u 52 %, přičemž podskupiny dříve neléčených a léčených pacientů se počtem léčebných odpovědí nelišily. Medián délky léčebné odpovědi u neléčených osob dosáhl 27 měsíců (Gertz, 2004).
V další podobné studii u 26 již dříve léčených pacientů bylo zaznamenáno 48 % parciálních remisí a 17 % menších léčebných odpovědí po aplikaci 8 infuzí rituximabu. Medián intervalu do dosažení 50% léčebné dopovědi byl 7 měsíců, do dosažení maximální léčebné opovědi pak 17 měsíců. Při mediánu sledování 29 měsíců došlo k progresi pouze u dvou pacientů (Treon, 2005b).
Překvapivým jevem při monoterapii rituximabem byl dočasný vzestup koncentrace monoklonálního IgM a zvýšení viskozity po léčbě („IgM flare“). Pod výchozí hodnotu se monoklonální IgM dostal ve většině případů do 4 měsíců. Předpokládá se, že apoptóza patologických buněk navozená léčbou má za následek uvolnění monoklonálního IgM do oběhu. Léčebné odpovědi byly méně časté ve skupině s tímto vzestupem (28 %) než ve skupině nemocných bez vzestupu (80 %). Tento jev nebyl pozorován při aplikaci rituximabu spolu s chemoterapií (Ghobrial, 2004). Rituximab v monoterapii tedy nemá vyšší počet léčebných odpovědí než klasická chemoterapie. Proto se používá dominantně v kombinaci s chemoterapií, v monoterapii se podává pouze při léčbě autoimunitních komplikací (hemolytická anémie, nemoc chladových aglutininů), případně u monoklonálním IgM vyvolané neuropatie.
4.4.2 Rituximab v kombinaci s alkylačními cytostatiky a antracykliny
Vzhledem k tomu, že rituximab je u WM aktivní a přitom nemyelosupresivní lék, je vhodné jej kombinovat s chemoterapií. Podobně jako u jiných maligních lymfomů, i zde se projevil aditivní efekt rituximabu, který vede k výraznému zvýšení počtu léčebných odpovědí. Kombinovanou léčbou je možné dosáhnout podstatně vyššího počtu léčebných odpovědí s nezanedbatelným počtem kompletních remisí.
Kombinace CHOP (cyklofosfamid, adriamycin, vincristin a prednizon) je dlouhodobě používán pro léčbu vysoce i nízce agresivních lymfomů. Protože WM/lymfoplazmocytární lymfom patří do skupiny nízce agresivních lymfomů, je pochopitelné, že pacienti s touto chorobou byli léčeni touto kombinací, případně režimem R-CHOP. V největší takové studii bylo ran-domizováno celkem 69 pacientů, z toho hodnotitelných bylo 64 nemocných. Pacienti léčení režimem R-CHOP měli signifikantně vyšší počet léčebných odpovědí a podstatně delší remise než ve skupině bez rituximabu. Přitom mezi oběma skupinami nebyl signifikantní rozdíl ve výskytu nežádoucích účinků (Buske, 2009).
Přínos přidání rituximabu k chemoterapii založené na alkylačním cytostatiku, případně dalších cytostaticích, u WM potvrdily i další studie (Dimopoulos, 2007; Treon, 2005a). Trojkombinací cyklofosfamidu, dexametazonu a rituximabu (režim DRC) bylo dosaženo léčebné odpovědi u 74 % léčených a dvouleté přežití bez progrese bylo 67 %, přitom pouze u 9 % pacientů byla pozorována neutropenie stupně 3 (Dimopoulos, 2007).
4.4.3 Rituximab v kombinaci s purinovými analogy
Také účinek purinových analog lze dále prohloubit a prodloužit přidáním rituximabu (Weber, 2003; Treon, 2002; Tedeschi, 2007). Kombinace rituximabu, purinového analoga a alkylačního cytostatika dosahují vysokého počtu léčebných odpovědí v rozpětí 50–94 %. Nicméně tato léčba je spojena s vyšším výskytem MDS. Proto jsou purinová analoga u WM obvykle doporučována až pro léčbu relapsu nemoci.
Treon s kolegy (Treon, 2009a) popsali po kombinaci fludarabin+rituximab dosažení celkové léčebné odpovědi (více než PR) u 86 % pacientů s WM, s mediánem doby do progrese 51 měsíců.
5 Další léčebné alternativy
5.1 Bortezomib
5.1.1 Bortezomib v monoterapii relabující či rezistentní choroby
Celkem tři klinické studie testovaly účinek monoterapie bortezomibem u pacientů s recidivující či rezistentní formou WM. V této indikace navodil 60–85 % celkových léčebných odpovědí (včetně MR) a 41–60 % parciální remisí. Pokles koncentrace monoklonálního imunoglobulinu byl velmi rychlý, po prvních dvou cyklech poklesl o více než 25 % výchozí hodnoty (Dimopoulos, 2005b; Treon, 2007; Chen, 2007; Chen, 2009).
5.1.2 Bortezomib v kombinované léčbě relabující či rezistentní choroby
Poté, co byla prokázána účinnost bortezomibu v monoterapii, byly zahájeny klinické studie ověřující jeho účinek u pacientů s rezistentní či refrakterní nemocí v rámci kombinované léčby. V klinické studii s 37 pacienty byl bortezomib podáván 1x týdně v dávce 1,6 mg/m2 a rituximab 1x měsíčně. Počet celkových léčebných odpovědí včetně MR dosahoval 81 %, přitom 46 % bylo parciálních a 5 % kompletních remisí. Medián intervalu do progrese činil 16,4 měsíce (Ghobrial, 2010a).
5.1.3 Bortezomib v iniciální léčbě
Po prokázání účinnosti bortezomibu v rámci druhé léčebné linie byly zahájeny klinické studie, v rámci nichž byl bortezomib použit pro primoterapii WM. V kanadské studii bylo celkem 12 pacientů léčeno bortezomibem v monoterapii. Z nich se celkem 25 % dostalo nejméně do parciální remise (Chen, 2007; Chen, 2009).
Pro další zvýšení účinnosti léčby použil Treon u 23 pacientů kombinovanou léčbu bortezomibem, rituximabem a dexametazonem. Celkový počet léčebných odpovědí včetně MR byl 96 %, parciální remisi či lepší léčebnou odpověď dosáhlo 83 %, kompletní remise či téměř kompletní remise (near CR) pak 22 % nemocných. Po dvou letech zůstávalo 18 z 23 pacientů stále v remisi (Treon, 2009b).
Vzhledem k tomu, že dle klinických zkušeností je podávání bortezomibu pouze 1x týdně spojeno s menší neurotoxicitou, ale se stejnou účinností, tak skupina European Myeloma Network zorganizovala klinickou studii testující bortezomib, rituximab a dexametazon (BRD) u dříve neléčených nemocných (60 pacientů). Na léčbu pozitivně reagovalo celkem 85 % (3 % CR, 7 % VGPR, 58 % PR, 17 % MR). Medián intervalu do progrese (PFS) byl 42 měsíců, 3leté trvání léčebné odpovědi dosáhlo 70 % a 3letého celkového přežití 81 % léčených. Léčba kombinací bortezomibu, rituximabu a dexametazonu se vyznačuje velmi rychlým nástupem léčebné odpovědi, dobrou tolerancí léčby, která není myelotoxická a dosahuje vysokého počtu dlouhodobých léčebných odpovědí. Bortezomib je velmi účinný i u nemocných s hyperviskozitou, protože rychle redukuje koncentraci monoklonálního imunoglobulinu (Dimopoulos, 2010a; Ghobrial, 2010b).
Informace o nižší neurotoxicitě při stejné účinnosti při podávání bortezomibu 1x týdně byla základem i další studie, která prověřovala účinnost bortezomibu v dávce 1,6 mg/m2 podávanou 1x týdně (den 1, 8 a 15) v 28denních cyklech při celkovém počtu 6 cyklů. V prvním a ve čtvrtém cyklu (měsíci) léčby byl aplikován rituximab 375 mg/m2 i. v. 1x týdně. Celkově bylo u 26 dříve neléčených pacientů dosaženo 88 % léčebných odpovědí včetně MR, 58 % bylo PR a 8 % nCR nebo CR. Celkem 79 % léčených bylo déle než 1 rok od ukončení léčby bez známky recidivy nemoci (Marchand, 2011).
Na základě výsledků uvedených klinických studií fáze II uvádějí některá mezinárodní doporučení bortezomib jako lék vhodný pro léčbu Waldenströmovy makroglobulinemie (Dimopoulos, 2009; Dimopoulos, 2010b). Jeho nevýhodou jsou jeho neurotoxické účinky (Dimopoulos, 2013). Jiní autoři doporučují bortezomib používat u WM prozatím pouze v rámci klinických studií (Owen, 2014).
5.2 Bendamustin
Vzhledem k tomu, že fludarabin má svá rizika, je žádoucí najít další lék do kombinace k rituximabu, který by měl dobrý efekt a menší toxicitu než fludarabin. V posledních letech se u nízce agresivních lymfoproliferací a u mnohočetného myelomu osvědčil dříve málo používaný bendamustin, který přináší lepší výsledky než klasická alkylační cytostatika a jeho akutní i pozdní toxicita je akceptovatelná (Vidal, 2012).
K dispozici je popis výsledků jeho využití u souboru 30 nemocných s refrakterní či relabující formou WM, kteří byli léčeni bendamustinem v kombinaci s rituximabem (90 mg/m2 i. v. den 1, 2) a rituximab (375 mg/m2 i. v. den 1 nebo 2) cyklu. Celkový počet léčebných odpovědí byl 83,3 %, z toho 5 pacientů dosáhlo VGPR a 20 PR (Treon, 2011).
Kombinace bendamustinu a rituximabu se jeví jako nadějná pro použití u nově diagnostikované WM. Rummel a kol. (Rummel, 2013) publikovali vysokou léčebnou odpověď 86 % v souboru 116 pacientů.
V roce 2013 byly k dispozici výsledky jen jedné studie srovnávající léčbu R-CHOP versus R-bendamustin. Celkem 22 pacientů bylo léčeno bendamustinem a rituximabem a 19 chemoterapií R-CHOP. Obě skupiny měly stejný počet léčebných odpovědí, 95 %. Medián bezpříznakového přežití byl však signifikantně delší ve skupině léčené bendamustinem. Ve skupině léčené R-CHOP byl 36 měsíců, zatímco v bendamustinové skupině nebyl ještě v době hodnocení dosažen (p < 0,0001). V době analýzy došlo k relapsu u 4 (18 %) pacientů v bendamustinové skupině a u 11 (58 %) ve skupině léčené R-CHOP, přičemž v bendamustinové skupině bylo méně nežádoucích účinků (Rummel, 2013). Z uvedeného vyplývá, že kombinace bendamustinu s rituximabem dosahuje vysokého počtu léčebných odpovědí jak u nově zjištěné WM, tak i u relabující či refrakterní WM.
6 Transplantace krvetvorných buněk
Výsledky některých klinických studií, především u pacientů s relapsem WM, prokázaly, že autologní transplantace krvetvorných buněk (SCT) je i u WM užitečná a bezpečná terapie (udávaná mortalita bez souvislosti s relapsem v 1 roce je 5 %), která vede k prodloužení bezpříznakového období, ale nevede k vyléčení (Gertz, 2012; Owen, 2014; Bachanova, 2012; Kyriakou, 2010a). Informace o vysokodávkové chemoterapii lze čerpat z četných malých studií a pak z několika větších analýz. Použity přitom byly jak přípravné režimy používané pro folikulární lymfomy, tak pro mnohočetný myelom (Adam, 2014).
Chemosenzitivní onemocnění je důležitým prediktorem léčebné odpovědi a SCT by neměla být prováděna u refrakterního onemocnění. Pouze menší skupina s relapsem WM je vhodná k provedení autologní SCT, zde je nutno zohlednit věk, přítomnost komorbidit a indolentní průběh u většiny pacientů s tímto onemocněním. U autologní SCT je udáván medián bezpříznakového období (PFS) 4 roky a celkové přežití v 5 letech 60 % (Kyriakou, 2010a; Gertz, 2012).
U pacientů, kteří jsou potenciálními kandidáty pro autologní SCT, by neměla být podávána purinová analoga, jelikož tyto léky mohou negativně ovlivnit úspěšnost následného sběru periferních krvetvorných buněk (Owen, 2014).
Provedení autologní SCT je tak dnes doporučováno u mladších pacientů v dobrém klinickém stavu, kteří mají chemosenzitivní relaps onemocnění a krátkou dobu trvání první remise (méně než 2 roky) (Owen, 2014).
V literatuře lze nalézt jen limitované množství dat o provedení alogenní SCT u WM. Alogenní transplantace přináší navíc případný benefit „graft versus lymfoma“ efektu, u některých pacientů lze dosáhnout dlouhodobé kontroly nemoci. Mortalita související s léčbou dosahuje u alogenní SCT 23 % pro režimy s redukovanou intenzitou a 33 % pro myeloablativní režimy, u 45–50 % pacientů je udáván 5letý interval PFS resp. 50–60 % celkové přežití (Kyriakou, 2010b). Provedení alogenní SCT lze zvážit u mladého pacienta s WM bez komorbidit, s agresívním, ale chemosenzitivním průběhem nemoci (Owen, 2014).
7 Podpůrná terapie a léčba komplikací
7.1 Léčba hyperviskozity a další indikace plazmaferézy
Plazmaferéza je indikovaná u pacientů s klinicky závažnými příznaky hyperviskozity, samotná fyzikální hodnota naměřené viskozity, přitom není indikací pro plazmaferézu.
Výměna 1–1,5 plazmatického objemu sníží viskozitu asi o 60–75 %. U pacientů s klinicky závažnými projevy hyperviskozity se proto doporučuje provést 1–2 plazmaferézy (Einstein, 2006; Clark, 1999; Stone, 2012).
Opakované plazmaferézy s cílem udržení viskozity v přijatelných mezích jsou doporučovány jednak pro nemocné, jejichž nemoc je rezistentní na medikamentózní léčbu a také pro nemocné, kteří nejsou schopni podstoupit účinnou medikamentózní léčbu. Efekt plazmaferézy nastupuje rychle a trvá 4–6 týdnů (Ansell, 2010; Menke, 2009; Drew, 2002).
Tab. 7. Přehled doporučených léčebných režimů u WM (obsahuje jen vybrané režimy). 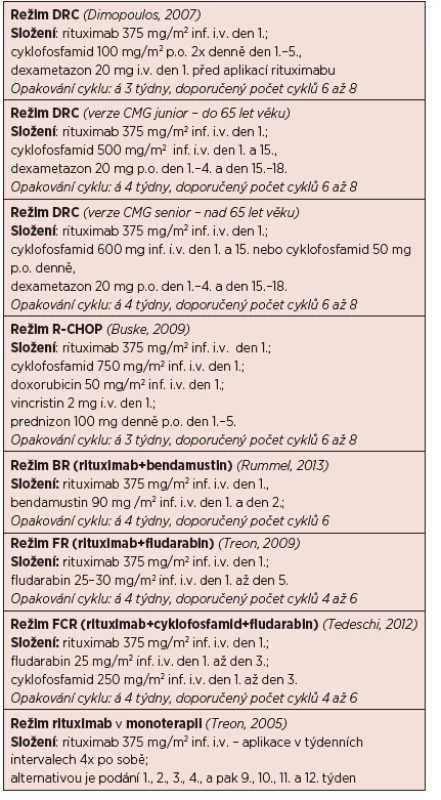
Dle omezených zkušeností je plazmaferéza léčebnou alternativou u nemocí způsobených monoklonálním imunoglobulinem (IgM related disorders), jako jsou závažná neuropatie nebo symptomatická kryoglobulinemie. Může být využita i jako iniciální krok před podáním cytoredukční léčby, která utlumí aktivitu nemoci.
Při plánování léčby si lékař musí být vědom možnosti dočasného zvýšení koncentrace monoklonálního IgM vlivem rituximabu, a jeho podání naplánovat tak, aby nedošlo k tomuto jevu (flare efekt).
7.2 Léčba anémie a profylaxe trombotických komplikací
Doporučení pro léčbu anémie:
U každého pacienta s anémií je třeba standardně provést diferenciální diagnostiku příčinu anémie.
Pokud není nalezena jiná příčina anémie a anémie odpovídá anémii chronických chorob při WM/LPL, je v případě klinických příznaků (obvykle při hodnotách hemoglobinu nižších než 100 g/l) možné zvážit léčbu humánním rekombinačním erytropoetinem.
Léčebný test s preparátem stimulujícím erytropoézu je na zvážení u všech nemocných s WM/LPL a symptomatickou anémií. Indikace musí korespondovat s obecnou indikací pro léčbu erytropoetinem vydanou Českou hematologickou společností.
Erytropoetin je indikovaný k léčbě anémie u pacientů s WM a chronickým renálním selháním.
Doporučení pro profylaxi trombotických komplikací
Je nutno stanovit souhrnné riziko trombózy na základě rizikovosti léčebného režimu, přítomnosti rizikových faktorů zvyšujících riziko a anamnézy prodělané tromboembolické příhody.
Po stanovení stupně souhrnného rizika trombózy je pak doporučen následující postup:
- Vysoký stupeň rizika
Základní opatření: LMWH 100 IU/kg 1x denně nebo vyšší profylaktická dávka LMWH podle SPC (Clexane 40 mg, Zibor 3500 j, Fragmin 5000 j, Fraxiparine u osob s hmotností do 50 kg 0,3 ml, u osob s hmotnostní 50–69 kg – 0,4 ml, u osob s hmotností nad 70 kg – 0,6 ml vše 1x denně). U pacientů s umělou chlopní: ponechat warfarin, kontroly INR á 7–14 dní, při nemožnosti dosáhnout stabilní INR převést na LMWH 100 IU/kg 2x denně. - Střední stupeň rizika
Základní opatření: LMWH ve vyšší profylaktické dávce podle SPC (viz výše). Za adekvátní postup je možno považovat ASA 100 mg denně nebo warfarin v terapeutické dávce, zejména pokud pacient tyto léky užívá z jiné indikace). U pacientů s umělou chlopní: ponechat warfarin, kontroly INR á 7–14 dní, při nemožnosti dosáhnout stabilní INR převést na LMWH 100 IU/kg 2x denně. - Nízký stupeň rizika
Základní opatření: jen fyzikální opatření (mobilizace, řádná hydratace, elastické punčochy). U pacientů se současnou indikací ASA nebo warfarinu tyto léky ponechat. U pacientů s umělou chlopní: ponechat warfarin s kontrolami INR po 7–14 dnech, při nemožnosti dosažení stabilního INR převést na LMWH 100 IU/kg 2x denně.
Poznámka: Uvedené dávkování LMWH platí pro nadroparin, enoxaparin a dalteparin.
7.3 Léčba periferní neuropatie způsobené monoklonálním imunoglobulinem IgM
Při pomalu progredující neuropatii není léčba vždy nevyhnutná. U pacientů s progredující neuropatií je doporučená léčba. Při agresivním průběhu se středně těžkou a těžkou neuropatií je vhodná vstupně léčebná plazmaferéza (obvykle týdenní plazmaferézy po dobu 2–3 měsíců) následovaná konsolidací imunochemoterapií (R-CP, R-CD). Při pomalejším průběhu a mírné neuropatii lze zvážit monoterapii rituximabem.
Při výrazných projevech senzorické neuropatie je v průběhu chemoterapie doporučená i symptomatická léčba s použitím gabapentinu, pre-gabalinu a duloxetinu, tyto léky indikuje a předepisuje neurolog.
8 Sledování po léčbě
Součástí pravidelných kontrol sledování nemocného je anamnéza, fyzikální vyšetření, kontrolní panel odběrů včetně kvantifikace IgM každé 3 měsíce po dobu 2 let, každých 4–6 měsíců po dobu dalších 3 let, a následně v ročních intervalech se speciálním zaměřením na transformaci nemoci, sekundární malignity. Minimální adekvátní radiologické anebo ultrasonografické vyšetření každých 6 měsíců po dobu 2 let, kontroly zobrazovacími vyšetřeními v ročních intervalech v případě vstupní lymfadenopatie a/nebo organomegalie.
9 Závěrečná doporučení pro terapii WM*
9.1 Léčba první linie
- a) Pacienti se symptomatickou WM by měli být léčeni režimem obsahujícím rituximab (stupeň doporučení A, úroveň důkazu Ib).
- b) Vhodnými kombinovanými režimy pro iniciální léčbu WM jsou například tyto: dexametazon+rituximab+cyklofosfamid (DRC), rituximab+alkylační látka+kortikoid (režimy R-COP, R-CP, R-CHOP), dále bendamustin+rituximab (BR).
- b) Purinová analoga lze použít také v rámci první linie, nicméně pro jejich nežádoucí účinky, obzvláště v kombinaci s alkylačními cytostatiky se doporučuje použít spíše v rámci druhé linie léčby (kombinace fludarabin+rituximab = FR nebo fludarabin+cyklofosfamid+rituximab = FCR).
- b) Volba režimu u konkrétního pacienta vyžaduje komplexní zhodnocení zahrnující performance status, klinický stav včetně renálních funkcí, přítomnost komorbidit a zvážení, zda pacient není vhodným kandidátem pro pozdější transplantační léčbu (stupeň doporučení B, úroveň důkazu IIa).
- c) Chlorambucil zůstává možnou léčebnou možností u starších fragilních pacientů s WM (stupeň důkazu B, úroveň I). Perorální fludarabin je upřednostněn, je-li k dispozici, před perorálním chlorambucilem. Oba léky jsou účinnou léčebnou variantou u této skupiny nemocných (stupeň doporučení A, úroveň důkazu Ib).
9.2 Léčba druhé a další linie
- a) Pacienty s klinicky asymtomatickým relapsem projevujícím se pouze postupným vzestupem MIG je vhodné pouze sledovat a léčbu zahájit až v případě klinicky významné progrese WM (stupeň doporučení A, úroveň důkazu Ib).
- b) Pacienti se symptomatickým relapsem by měli znovu dostat režim obsahující rituximab, pokud je exprimován znak CD20. Používány jsou režimy obdobné jako v léčbě první linie, ale také režimy obsahující bortezomib nebo purinová analoga (např. FR, FCR, BR – bortezomib+rituximab), DRC. Volba režimu vyžaduje komplexní zhodnocení klinického stavu u konkrétního pacienta a také zvážení potenciální možnosti provedení SCT (stupeň doporučení B, úroveň důkazu IIa).
- c) Opakování léčby z první linie je možné, pokud dojde k relapsu nemoci po delší době (obvykle > 1–2 roky (stupeň doporučení B, úroveň důkazu IIa).
- d) Režim obsahující bortezomib je potenciální alternativou léčby symptomatického relapsu WM, preferovány jsou režimy s týdenním podáváním bortezomibu s cílem předejít neurologické toxicitě, doporučována je profylaxe proti HZV reaktivaci (stupeň doporučení B, úroveň důkazu IIa).
- e) Mladší pacienti (do 65 let věku) s chemosenzitivním relapsem WM jsou kandidáty pro provedení transplantace a měli by být diskutováni s transplantačním centrem (stupeň doporučení B, úroveň důkazu IIa).
*(V ČR v roce 2014 je použití rituximabu, bortezomibu a bendamustinu při léčbě WM možné pouze po schválení revizním lékařem příslušné zdravotní pojišťovny. Standardně jsou v ČR pro léčbu Waldenströmovy makroglobulinemie hrazena zatím pouze klasická cytostatika, kortikoidy a fludarabin).
Zdroje
1. Adam Z, Krejčí M, Pour L, Ševčíková E. Léčba Waldenströmovy makroglobulinémie v roce 2014. Vnitř Lék 2014; 60 : 139-157.
2. Adam Z, Ščudla V, Krejčí M, Kořístek Z. Léčba Waldenströmovy makroglobulinémie a léčba nemocí způsobených monoklonálním gamaglobulinem. Vnitřní Lék 2008; 54 : 68-83.
3. Adam Z, Šmardová J, Ščudla, V. Waldenströmova makroglobulinémie – klinické projevy, diferenciální diagnostika a prognóza nemoci. Vnitřní Lék 2007; 53 : 1325-1337.
4. Ansell SM, Kyle RA, Reeder CB, et al. Diagnosis and management of Waldenström macroglobulinemia: Mayo stratification of macroglobulinemia and risk-adapted therapy (mSMART) guidelines. Mayo Clin Proc 2010; 85 : 824-833.
5. Bachanova V, Burns LJ. Hematopoietic cell transplantation for Waldenström macroglobulinemia. Bone Marrow Transplant 2012; 47 : 330-336.
6. Banwait R, O‘Regan K, Campigotto F, et al. The role of 18F-FDG PET/CT imaging in Waldenstrom macroglobulinemia. Am J Hematol 2011; 86 : 567-572.
7. Björkholm M. Treatment options in Waldenström´s macroglobulinemia. Clin Lymphoma 2004; 5 : 155-162.
8. Buske C, Hoster E, Dreyling M, et al. The addition of rituximab to front-line therapy with CHOP (R-CHOP) results in a higher response rate and longer time to treatment failure in patients with lymphoplasmacytic lymphoma: results of a randomizedtrial of the German Low-Grade Lymphoma Study Group (GLSG). Leukemia 2009; 23 : 153-1561.
9. Clark WF, Rock GA, Buskard N, et al. Therapeutic plasma exchange: an update from the Canadian Apheresis Group. Ann Intern Med 1999; 131 : 453-462.
10. Dhodapkar MV, Jacobson JL, Gertz MA, et al. Prognostic factors and response to fludarabine therapy in Waldenström´s macroglobulinemia: an update of a US Intergroup trial. Semin Oncol 2003; 30 : 220-225.
11. Dimopoulos MA, Anagnastopoulos A, Kyrtsonis MC, et al. Primary treatment of Waldenström´s macroglobulinemia with dexamethasone, rituximab and cyclophosphamide. J Clin Oncol 2007; 25 : 3344-3349.
12. Dimopoulos MA, Anagnostopoulos A, Kyrtsonis MC, et al. (2005b). Treatment of relapsed or refractory Waldenström‘s macroglobulinemia with bortezomib. Haematologica 2005; 90 (12): 1655-1658.
13. Dimopoulos MA, Garcia Sanz R, Gavriatopoulou M, et al. (2010a). Primary therapy of Waldenström´s macroglobulinemia with weakly bortezomib, low dose dexamethasone and rituximab: a phase II study od the European Myeloma Network. ASH Annual Meetings Abstracts 2010; 116: abstract 1971.
14. Dimopoulos MA, Gertz MA, Gastritis E, et al. Update on treatment recommendation from the fourth International Workshop on Waldenström´s macroglobulinemia. J Clin Oncol 2009; 27 : 120-126.
15. Dimopoulos MA, Hamilos G, Efstathiou E, et al. Treatment of Waldenström´s macroglobulinaemia with combination of fludarabine and cyclophosphamide. Leukemia Lymphoma 2003; 44: 993-996.
16. Dimopoulos MA, Chen C, Kastritis E, et al. (2010b). Bortezomib as a treatment option in patients with Waldenström macroglobulinemia. Clin Lymphoma Myeloma Leuk 2010; 10 : 110-117.
17. Dimopoulos MA, Kyle RA, Anagnastopoulos A, et al. (2005a). Diagnosis and management of Wadenström´s macroglobulinemia. J Clin Oncol 2005; 23 : 1564-1577.
18. Dimopoulos MA, Termos E, Gastritis E. Proteasome inhibitor therapy for Waldenström´s macroglobulinemia. Clin Lymphoma Myeloma and Leukemia 2013; 13 : 235-237.
19. Drew MJ. Plasmapheresis in the dysproteinemias. Ther Apher 2002; 6 : 45-52.
20. Einstein R. Therapeutic plasma exchange performed in tandem with hemodialysis for patients with M-protein disorders. J Clin Apheresis 2006; 21 : 100-104.
21. Gertz MA, Reeder CB, Kyle RA. Stem cell transplant for Waldenström macroglobulinemia: an underutilized technique. Bone Marrow Transplant 2012; 47 : 1147-1153.
22. Gertz MA, Rue M, Blood E, et al. Multicenter phase II trial of rituximab in Waldenström´s macroglobulinaemia. An Eastern Cooperative Oncology Group Study. Leuk Lymphoma 2004; 45 : 2047-2055.
23. Ghobrial IM, Hong F, Padmanabhan S, et al. (2010a). Phase II trial of weekly bortezomib in combination with rituximab in relapsed or relapsed and refractory Waldenstrom macroglobulinemia. J Clin Oncol 2010; 28 : 1422-1428.
24. Ghobrial IM, Xie W, Padmanabhan S, et al. (2010b). Phase II trial of weekly bortezomib in combinatin with rituximab in untreated patientes with Waldenström´s macroglobulinemia. Am J Hematol 2010; 85 : 670-674.
25. Ghobrial IR, Fonseca R, Greipp PR, et al. Initial imunoglobulin M flare after rituximab therapy in patients diagnosed with Waldenström´s macroglobulinaemia. Cancer 2004; 101 : 2593-2598.
26. Hivert B, Caron C, Petit S, et al. Clinical and prognostic implications of low level of von Willebrand factor in patients with Waldenström macroglobulinemia. Blood 2012; 120 : 3214-3221.
27. Chen C, Kouroukis CT, White D, et al. Bortezomib in relapsed or refraktory Waldenström‘s macroglobulinemia. Clin Lymphoma Myeloma 2009; 9 : 74-76.
28. Chen CI, Kouroukis CT, White D, et al. National Cancer Institute of Canada Clinical Trials Group. Bortezomib is active in patients with untreated or relapsem Waldenstrom‘s macroglobulinemia: a phase II study of the National Cancer Institute of Canada Clinical Trials Group. J Clin Oncol 2007; 25 : 1570-157.
29. Jane SM, Salem HH. Treatment of resistant Waldenström´s macroglobulinaemia with high dose glucocorticosteroids. Aust NZJ Med 1988; 18 : 77-78.
30. Johnson SA, Birchall J, Luckie C, et al. Guidelines on management of Waldenström´s macroglobulinemia. Brit J Haematol 2006; 132 : 687-697.
31. Kyle RA, Greipp PR, Gertz MA, et al. Waldenström´s macroglobulinemia. A prospective study comparing daily with intermittent oral chlorambucil. Brit J Haematol 2000; 108: 737-742.
32. Kyriakou C, Canals C, Cornelissen JJ (2010b). Allogeneic stem-cell transplantation in patients with Waldenström macroglobulinemia: report from the Lymphoma Working Party of the European Group for Blood and Marrow Transplantation. J Clin Oncol 2010; 28 : 4926-4934.
33. Kyriakou C, Canals C, Sibon D, et al. (2010a). High-dose therapy and autologous stem-cell transplantation in Waldenstrom macroglobulinemia: the Lymphoma Working Party of the European Group for Blood and Marrow Transplantation. J Clin Oncol 2010; 28 : 2227-2232.
34. Leblond V, Ben-Othman T, Deconinck E, et al. Activity of fludarabine in previously treated Waldenström´s macroglobulinaemia. J Clin Oncol 1998; 16 : 2060-2064.
35. Leblond V, Johnson S, Chevret S, et al. Results of a randomised trial comparing chlorambucil versus fludarabine for patients with untreated Waldenström´s macroglobulinemia, marginal zone lymphoma or lymphoplasmocytic lymphoma. J Clin Oncol 2013; 31 : 301-307.
36. Leblond V, Levy V, Maloisel F, et al. Multicenter randomized comparative trial of fludarabine and the combination of cyclophosphamide doxorubicin prednisone in 92 patients with Waldenström´s macroglobulinaemia in first relapse or with primary refraktory disease. Blood 2001; 98 : 2640-2644.
37. Leleu Y, Manning R, Soumerai J, et al. Increased incidence of disease transformation and development of MDS/AML in Waldenström´s macroglobulinemia patients treated with nucleoside analogs. Haematologica 2007; s2 : 95/A WM3.10.
38. Marchand T, Tas P, Houot R, et al. Cutaneous macroglobulinosis treated with bortezomib and rituximab. Eur J Haematol 2011; 87 : 98.
39. Menke MN, Feke GT, McMeel JW, et al. Ophthalmologic techniques to assess the severity of hyperviscosity syndrome and the effect of plasmapheresis in patients with Waldenström‘s macroglobulinemia. Clin Lymphoma Myeloma. 2009; 9 : 100-103.
40. Morel P, Duhamel A, Gobbi P, et al. International prognostic scoring system for Waldenström macroglobulinemia. Blood 2009; 113 : 4163-4170.
41. O´Reilly RA, MacKanzie MR. Primary macroglobulinaemia: remission with adrenal corticosteroid therapy Arch Intern Med 1967; 44: 889-890.
42. Ocio EM, del Carpio D, Caballero Á, et al. Differential diagnosis of IgM MGUS and WM according to B-lymphoid infiltration by morphology and flow cytometry. Clin Lymphoma Myeloma Leuk 2011; 11 : 93-95.
43. Owen RG, Kyle RA, Stone MJ, et al. VIth International Workshop on Waldenström macroglobulinemia. Response asssessment in Waldenström macroglobulinemia: update from the VIth international Worshop. Br J Haematol 2013; 160 : 171-176.
44. Owen RG, Pratt G, Rebecca L, et al. Guidelines on the diagnosis and management of Waldenström´s macroglobulinaemia. Brit J Hematol 2014; 165 : 316-333.
45. Owen RG. Developing diagnostic criteria in Waldentrom´s macroglobulinemia. Semin Oncol 2003; 30 : 196-200.
46. Paiva B, Montes MC, García-Sanz R, et al. Multiparameter flow cytometry for the identification of the Waldenström‘s clone in IgM-MGUS and Waldenström‘s Macroglobulinemia: new criteria for differential diagnosis and risk stratification. Leukemia 2014; 28 : 166-173.
47. Rummel MJ, Niederle N, Maschmeyer G, et al. Bendamustin plus rituximab versus CHOP plus rituximab as first line treatment for patients with indolent and mandle-cell lymphoma. An open label multicentre randomised phase 3 non inferiority trial. Lancet 2013; 381 : 1203-1210.
48. Souchet-Compain L, Nguyen S, Choquet S, Leblond V (2013a). Fludarabine in Waldenstrom‘s macroglobulinemia. Expert Rev Hematol 2013; 6(3): 229-237.
49. Souchet-Compain L, Nguyen S, Choquet S, Leblond V (2013b). Primary therapy of Waldenström macroglobulinemia with nucleoside analogue-based therapy. Clin Lymphoma Myeloma Leuk 2013; 13 : 227-230.
50. Stone MJ, Bogen SA. Evidence-based focused review of management of hyperviscosity syndrome. Blood 2012; 119 : 2205-2208.
51. Swerdlow SH, Campo E, Harris NL, et al. WHO classification of tumours of hematopoietic and lymphoid tissues. Lyon 2008, 439s.
52. Ševčíková S, Novák L, Kubiczková L, et al. Molekulární základy Waldenströmovy macroglobulinemie. Klin Onkol 2012; 25 : 413-420.
53. Tam CS, Wolf M, Prince HM, et al. (2006a). Fludarabine, cyclophosphamide and rituximab for the treatment of patients with chronic lymphocytic leukemia or indolent lymphoma. Cancer 2006; 106 : 2412-2420.
54. Tam CS, Wolf MM, Westerman D, et al. Fludarabine combination therapy is highly effective in fist line and salvage treatment of patients with Waldenström´s macroglobulinemia. Clin Lymphoma Myeloma 2005; 6: 136-139.
55. Tam, CS. Seymour JF, Prince JM (2006b). Treatment releated myelodysplasia following fludarabine combinations chemotherapy. Haematologica 2006; 91 : 1546-1550.
56. Tamburini JL, Chaleteix V, Cermane JP, et al. Fludarabine plus cyclophoshamide in Waldenström´s macroglobulinemia. Results in 49 patients. Leukemie 2005; 19 : 1831-1834.
57. Tedeschi A, Benevolo G, Varettoni M, et al. Fludarabine plus cyclophosphamide and rituximab in Waldenström´s macroglobulinemia. An effective but myelosupresive regiment to be offered to patients with advanced disease. Cancer 2012; 118 : 434-443.
58. Tedeschi A, Miqueleiz AS, Ricci F, et al. Fludarabine cyclophosphamide and rituximab an effective regimen characterized by high incidence of delayed responses in Waldenström´s macroglobulinaemia. Haematologica 2007; s2: 227/A1225.
59. Treon SP Hunter ZR, Barnagan AR (2005a). CHOP plus rituximab in Waldenström´s macroglobulinemia. Clin Lymphoma 2005; 5 : 273-277.
60. Treon SP, Branagan AR, Ioakimidis L, et al (2009a). Long-term outcomes to fludarabine and rituximab in Waldenstrom macroglobulinemia. Blood 2009; 113, 3673–3678.
61. Treon SP, Emmanoulides C, Kimby E, et al (2005b). Extended rituximab therapy in Waldenström´s macroglobulinaemia. Ann Oncol 2005; 16 : 132-138.
62. Treon SP, Hanzis C, Tripsas C, et al. Bendamustine therapy in patients with relapsed or refractory Waldenström‘s macroglobulinemia. Clin Lymphoma Myeloma Leuk 2011; 11 : 133-135.
63. Treon SP, Hunter ZR, Matous J, et al. Multicenter clinical trial of bortezomib in relapsed/refractory Waldenstrom‘s macroglobulinemia: results of WMCTG Trial 03-248. Clin Cancer Res 2007; 13 : 3320-3325.
64. Treon SP, Ioakimidis L, Soumerai JD, et al (2009b). Primary therapy of Waldenström macroglobulinemia with bortezomib, dexamethasone, and rituximab: WMCTG clinical trial 05-180. J Clin Oncol 2009; 27 : 3830-3835.
65. Treon SP, Wasi P, Emmanoulides CA. Combination therapy with rituximab and fludarabine is highly active in Waldenström´s macroglobulinemia. Blood 2002; 100: s1/A211.
66. Varettoni M, Arcaini L, Zibellini S, et al. Prevalence and clinical significance of the M YD88(L265P) somatic mutation in Waldenstrom‘s macroglobulinemia and realted lymphoid neoplasms. Blood 2013; 121 : 2522-2528.
67. Vidal L, Gafter-Gvili A, Gurion R, et al. Bendamustine for patients with indolent B cell lymphoid malignancies including chronic lymphocytic leukaemia. Cochrane Database Syst Rev. 2012; 9: CD009045. doi: 0.1002/14651858 .CD009045.pub2.
68. Vos JMI, Minnema MC, Wijermans PW, et al. Guidelines for diagnosis, treatment of Waldenström´s macroglobulinemia. Netherlands J Med 2013; 71 : 54-62.
69. Wang H, CHen Y, Li F, et al. Temporal and geografic variations of Waldenström macroglobulinemia incidence. A large population based study. Cancer 2012; 118 : 3793-3800.
70. Weber DM, Dimopoulos MA, Dalasalle K, et al. 2-chlorodeoxyadenosine alone and in combination for previously untreated Waldenström´s macroglobulinemia. Semin Oncol 2003; 30 : 243-247.
71. Weber DM, Thomas S, Wang M, et al. Rituximab alone or in combination in the frontline treatment of Waldenström´s macroglobulinemia. Haematologica 2003; s2: A87.
Štítky
Hematológia Interné lekárstvo Onkológia
Článok vyšiel v časopiseTransfuze a hematologie dnes
Najčítanejšie tento týždeň
2014 Číslo Supplementum- Nejasný stín na plicích – kazuistika
- Těžké menstruační krvácení může značit poruchu krevní srážlivosti. Jaký management vyšetření a léčby je v takovém případě vhodný?
- I „pouhé“ doporučení znamená velkou pomoc. Nasměrujte své pacienty pod křídla Dobrých andělů
- Parazitičtí červi v terapii Crohnovy choroby a dalších zánětlivých autoimunitních onemocnění
-
Všetky články tohto čísla
- Nabídka klinické studie pro pacienty s Waldenströmovou makroglobulinémií
- Úvodník
- Diagnostika a léčba mnohočetného myelomu - Autoři
- Změny od roku 2012
- Pomalidomid
- Úvodník
- Carfilzomib
- Klub pacientů mnohočetný myelom
- Česká myelomová skupina, nadační fond (CMG NF)
- 11. Hematologie a transfuzní lékařství
- Diagnostika a léčba Waldenströmovy makroglobulinemie - Autoři
- Diagnostika a léčba Waldenströmovy makroglobulinemie - Obsah guidelines
- Souhrn doporučení 2014
- Transfuze a hematologie dnes
- Archív čísel
- Aktuálne číslo
- Iba online
- Informácie o časopise
Najčítanejšie v tomto čísle- Souhrn doporučení 2014
- Carfilzomib
- Diagnostika a léčba mnohočetného myelomu - Autoři
- 11. Hematologie a transfuzní lékařství
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



