-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Pomalidomid
Vyšlo v časopise: Transfuze Hematol. dnes,20, 2014, No. Supplementum, p. 29-32.
Kategorie: Diagnostika a léčba mnohočetného myelomu
Pomalidomid (CC-4047, 4-amino-2-(2,6-dioxopiperidin-3-yl) isoindolin-1,3-dion) je lék z třídy imunomodulačních přípravků (IMiDs; Immunomodulatory drugs). Má přímý tumoricidní účinek na myelomy, imunomodulační účinky a inhibuje podporu stromálních buněk pro růst nádorových buněk mnohočetného myelomu. Konkrétně pomalidomid inhibuje proliferaci a indukuje apoptózu hematopoetických nádorových buněk. Rovněž inhibuje proliferaci buněčných linií mnohočetného myelomu rezistentních vůči lenalidomidu a v kombinaci s dexametazonem působí jak na buněčné linie odpovídající na lenalidomid, tak i na ty, které jsou vůči lenalidomidu rezistentní, a indukuje apoptózu nádorových buněk. Pomalidomid zvyšuje imunitu zprostředkovanou T buňkami a přirozenými zabíječi – NK buňkami (Natural Killer) a inhibuje tvorbu prozánětlivých cytokinů (např. TNF-α a IL-6) monocyty. Také inhibuje angiogenezi blokováním migrace a adheze endotelových buněk. Pomalidomid je silný inhibitor in vitro proliferace buněčných linií MM a prokázalo se, že je aktivní u subjektů s relabujícím či refrakterním MM (Mark, 2014).
Pomalidomid má díky své modifikované chemické struktuře několik výhod oproti ostatním imunomodulačním lékům. Nemá zkříženou rezistenci k thalidomidu a lenalidomidu, je velmi dobře tolerován a není nutná redukce dávky u renálního selhání (Siegel, 2012; Mark, 2014).
Na základě výsledků studie MM-002 byl pomalidomid (Pomalyst v USA, Imnovid v EU) registrován zrychlenou procedurou už v roce 2013 v USA i EU pro léčbu pacientů s mnohočetným myelomem, kteří obdrželi nejméně dvě předchozí linie léčby, včetně lenalidomidu a bortezomibu, a jsou rezistentní na léčbu nebo dochází k progresi do 60 dnů od ukončení poslední terapie.
Klinické studie u mnohočetného myelomu
1 Pomalidomid u pacientů s relabujícím nebo refrakterním MM (RRMM)
MONOTERAPIE
Pomalidomid měl v monoterapii RRMM významný protinádorový účinek. Studie fáze I/II testovala účinnost a bezpečnost pomalidomidu v dávce 1–10 mg u 44 pacientů s RRMM, kteří absolvovali jednu předchozí linii. Pacienti byli léčeni denně nebo ob den s dávkami 1, 2, 5 a 10 mg. Celkové léčebné odpovědi (ORR) dosáhlo 52 % pacientů, medián PFS 13,8 měsíce, medián OS 28 měsíců (Streetly, 2008; Streetly, 2009). Klinická studie MM-002 fáze I/II hodnotila účinnost a bezpečnost pomalidomidu v monoterapii nebo v kombinaci s nízkodávkovaným pomalidomidem u pacientů s RRMM předléčených lenalidomidem a bortezomibem. V souboru 221 významně předléčených nemocných (průměrně 5 léčebných linií) byl podáván POM +LoDex (kohorta 1; n = 113) nebo POM v monoterapii (kohorta 2; n = 108). V kohortě 1 dosáhlo celkové léčebné odpovědi (ORR) 33 % pacientů, medián PFS 4,2 měsíce, medián OS 16,5 měsíce. V kohortě 2 dosáhlo ORR 18 % pacientů, medián PFS 2,7 měsíce, medián OS 13,6 měsíců (Richardson, 2014).
Maximální tolerovaná dávka byla stanovena na 4 mg a v dalších studiích se pomalidomid testoval v dávce 2–4 mg (Richardson, 2013).
KOMBINOVANÉ REŽIMY
K dispozici jsou výsledky několika klinických studií fáze I/II u RRMM hodnotící pomalidomid v kombinovaných režimech s jinými léky, nejčastěji dexametazonem. Ve studiích vykazoval pomalidomid (2–4 mg denně s podáním 21 nebo 28 dnů) v kombinaci s týdenní léčbou dexametazonem (20–40 mg) významnou aktivitu u nemocných s RRMM, a to včetně nemocných refrakterních na lenalidomid nebo bortezomib (Leleu, 2013; Richardson, 2014). Výsledky jsou v tabulce 1. Celková léčebná odpověď byla pozorovaná zpravidla u 25–65 % nemocných. Dosažené mediány PFS a OS byly od 3 do 13 měsíců, respektive od 13,5 do 33 měsíců (Mark, 2014).
Zásadní jsou výstupy z první randomizované studie fáze III MM-003 u nemocných po selhání léčby jak bortezomibem, tak lenalidomidem, která srovnávala režim POM/DEX (pomalidomid 4 mg/den/den 1–21 v 28denním cyklu; nízká dávka dexametazonu 40/20 mg týdně pro nemocné s ≤ 75/> 75 roků) proti vysoké dávce dexametazonu (20/40 mg, dny 1–4, 9–12, a 17–20). Režim POM/DEX měl signifikantní přínos na prodloužení PFS intervalu (medián 4,0 vs. 1,9 měsíce; hazard ratio [HR] = 0,48; p < 0,0001) a rovněž prodloužení mediánu celkového přežití (12,7 vs. 8,1 měsíce; HR = 0,74; p = 0,028) (San Miguel, 2013).
Jiná závažná pozorování
Výraznou předností pomalidomidu je, že nezpůsobuje závažnou polyneuropatii ani nezhoršuje polyneuropatii související s předchozí neurotoxickou léčbou. Pomalidomid je možné podávat nemocným s preexistující polyneuropatií (San Miguel, 2013).
Účinnost pomalidomidu byla potvrzena i u významně předléčených pacientů s RRMM, jejichž předchozí léčba zahrnovala bortezomib a imunomodulační látku (thalidomid nebo lenalidomid) (Leleu, 2013; Richardson, 2014).
Pomalidomid lze bezpečně podávat u pacientů s renálním selháním bez nutnosti redukovat dávku léku, vzhledem k jeho minimální nefrotoxicitě (Siegel, 2012).
Vedlejší účinky a tolerance pomalidomidu
Pomalidomid má příznivý profil bezpečnosti bez vyskytující se kumulativní toxicity a neurotoxicity (Richardson, 2013; Richardson, 2014; Leleu, 2013; San Miguel, 2013). Nejčastějším nežádoucím účinkem je hematologická toxicita, infekční komplikace, únava a předpokládá se sklon k tromboembolické nemoci u nemocných bez profylaxe. V randomizované studii fáze III MM-003 (POM/DEX vs. DEX) byly s použitím pomalidomidu spojeny tyto specifické vedlejší účinky st. 3–4: neutropenie (49 % vs. 19 %), febrilní neutropenie (9 % vs. 0 %) a infekce (33 % vs. 25 %). K infekční komplikaci však nedocházelo zpravidla v průběhu neutropenie, která byla většinou krátkodobá. Výskyt významné periferní neuropatie a tromboembolické příhody (stupeň ≥ 3) byl 1 % (San Miguel, 2013). Většina nežádoucích účinků pomalidomidu je zvládnutelná pomocí vhodných profylaktických opatření, přerušením podávání, případně úpravou dávky léku. Podobně jako pro ostatní imunomodulační léky jsou nastavena přísná bezpečnostní opatření pro teratogenitu léku. U pacientů je doporučena profylaxe tromboembolické nemoci. Srovnání vedlejších účinků imunomodulačních látek je uvedeno v tabulce 2.
Dle SPC léku se pomalidomid podává perorálně v úvodní dávce 4 mg jednou denně ve dnech 1–21 v 28denním cyklu do progrese onemocnění. Lék se podává na lačno – nejméně 2 hodiny před jídlem a 2 hodiny po jídle. Redukční kroky v případě výskytu toxicity jsou 3 mg, 2 mg a 1 mg denně. (Pomalyst® SPC, 2013; Imnovid SPC 2014).
Doporučení pro léčbu pomalidomidem
- Imnovid je v kombinaci s dexametazonem indikován k léčbě dospělých pacientů s relabovaným a refrakterním mnohočetným myelomem, kteří absolvovali alespoň dvě předchozí léčebná schémata, zahrnující jak lenalidomid, tak i bortezomib, a při poslední terapii vykazovali progresi onemocnění (stupeň doporučení A, úroveň důkazu Ib).
- Pomalidomid se podává perorálně ve startovací dávce 4 mg jednou denně ve dnech 1–21 v 28denním cyklu. Léčba pokračuje do progrese onemocnění dle SPC léku (stupeň doporučení A, úroveň důkazu Ia).
- Pomalidomid lze bezpečně podávat u pacientů s renálním selháním bez nutnosti redukovat dávku (stupeň doporučení B, úroveň důkazu IIb).
- Mezi klíčová profylaktická opatření patří profylaxe žilní trombózy po celou dobu léčby a použití růstových faktorů v případě myelosuprese. Profylaxe kyselinou acetylsalicylovou (100 mg/den) je vhodná u pacientů se standardním rizikem venózního tromboembolismu (VTE). Je doporučeno použít LMWH v profylaktických dávkách pro pacienty s vyšším rizikem (stupeň doporučení B, úroveň důkazu IIa).
- Použití pomalidomidu nezpůsobuje ani nezhoršuje polyneuropatii související s předchozí neurotoxickou léčbou. Pomalidomid je možné podávat nemocným s preexistující polyneuropatií (stupeň doporučení A, úroveň důkazu Ia).
- Pomalidomid je teratogenní lék a při jeho použití je nezbytné dodržovat přesně stanovený bezpečnostní program (stupeň doporučení C, úroveň důkazu IV).
Tab. 1. Studie fáze II s pomalidomidem a dexametazonem v nízkých dávkách u relabujícího/refrakterního MM. 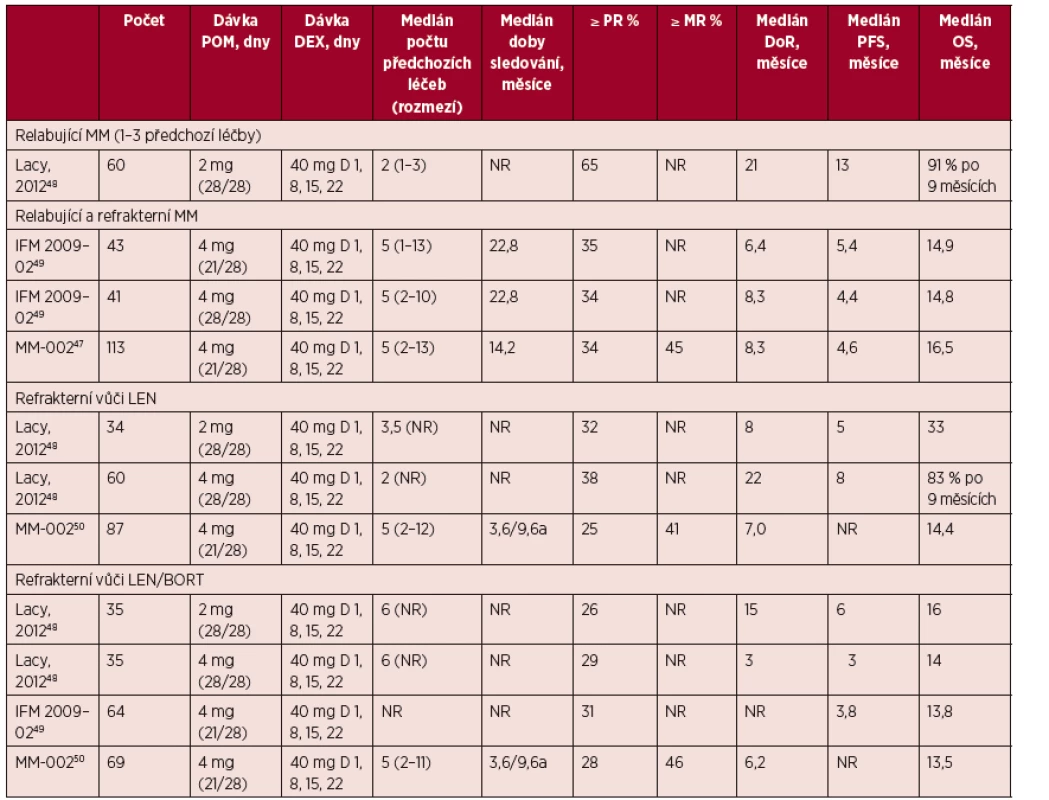
Zkratky: BORT – bortezomib; D – den; DEX – dexametazon; DoR – doba trvání léčebné odpovědi (duration of response); LEN – lenalidomid; MM – mnohočetný myelom; MR – minimální léčebná odpověď (minimal response); NR – není uvedeno (not reported); OS – celková doba přežívání (overall survival); PFS – přežívání bez progrese (progression free survival); POM – pomalidomid; PR – částečná léčebná odpověď (partial response). aMedián sledování byl 3,6 měsíce u PFS a 9,6 měsíce u OS. Tab. 2. Profily toxicity pomalidomidu, lenalidomidu a thalidomidu u relabujícího/refrakterního MM (upraveno podle Mark, 2014). 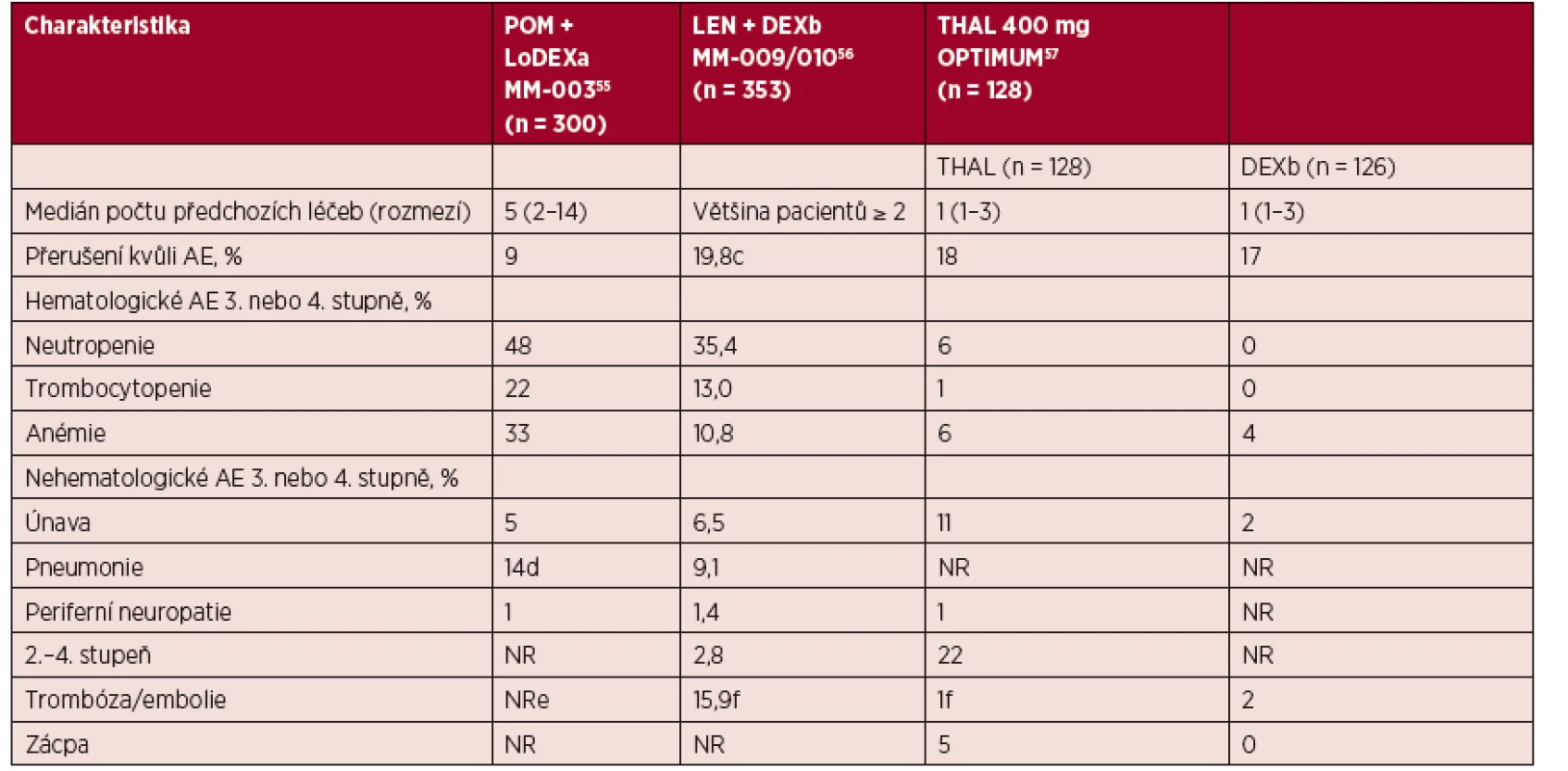
Zkratky: AE – nežádoucí účinky (adverse events); DEX – dexametazon; LEN – lenalidomid; LoDEX – dexametazon v nízkých dávkách (low-dose dexamethasone); MM – mnohočetný myelom; NR – není uvedeno (not reported); POM – pomalidomid; THAL – thalidomid. aDexametazon 40 mg/týden (20 mg/týden u pacientů ve věku > 75 let). bDexametazon podávaný 1.–4., 9.–12. a 17.–20. den 28denního cyklu po dobu prvních 4 cyklů a poté pouze 1.–4. den. cNení uvedeno ve studii MM-00966 dČtyři pacienti měli pneumonii 5. stupně. eTromboprofylaxe byla vyžadována. fTromboprofylaxe nebyla vyžadována.
Zdroje
1. Leleu X, Attal M, Arnulf B, et al. Pomalidomide plus low dose dexamethasone is active and well tolerated in bortezomiband lenalidomide-refractory multiple myeloma: Intergroupe Francophone du Myelome 2009-02. Blood 2013; 121 : 1968–75.
2. Mark TM, Coleman M, Niesvizky R. Preclinical and clinical results with pomalidomide in the treatment of relapsed/refractory multiple myeloma. Leukemia Research 2014; 38(5): 517–524.
3. Richardson PG, Siegel DS, Vij R, et al. Pomalidomide alone or in combination with low-dose dexamethasone in relapsed and refractory multiple myeloma: a randomized phase 2 study. Blood 2014 Mar 20; 123(12): 1826-32.
4. Richardson PG, Siegel D, Baz R, et al. Phase 1 study of pomalidomide MTD, safety and efficacy in patients with refractory multiple myeloma who have received lenalidomide and bortezomib. Blood 2013; 121 : 1961–7.
5. San Miguel J, Weisel K, Moreau P, et al. Pomalidomide plus low-dose dexamethasone versus high-dose dexamethasone alone for patients with relapsed and refractory multiple myeloma (MM-003): a randomised, open-label, phase 3 trial. Lancet Oncol 2013; (September) Epub ahead of print.
6. Siegel DS, Richardson PG, Baz R, et al. Pomalidomide (POM) with low-dose dexamethasone (LoDEX) in patients with relapsed and refractory multiple myeloma (RRMM): impact of renal function on patientoutcomes. Blood (ASH Annual Meeting Abstracts) 2012; 120: abstract 4072.
7. Streetly M, Stewart O, Gyertson K, et al. Pomalidomide monotherapy for relapsed myeloma is associated with excellent responses and prolonged progression free and overall survival [poster] Poster presented at: Annual Meeting and Exposition of the American Society of Hematology 2009; December 5-8; New Orleans, LA.
8. Streetly MJ, Gyertson K, Daniel Y, et al. Alternate day pomalidomide retains anti-myeloma effect with reduced adverse events and evidence of in vivo modulation. British Journal of Haematology 2008; 141(1): 41-51.
Štítky
Hematológia Interné lekárstvo Onkológia
Článek ÚvodníkČlánek Změny od roku 2012Článek ÚvodníkČlánek CarfilzomibČlánek Souhrn doporučení 2014
Článok vyšiel v časopiseTransfuze a hematologie dnes
Najčítanejšie tento týždeň
2014 Číslo Supplementum- fSCIG v reálnej klinickej praxi u pacientov s hematologickými malignitami
- Nejasný stín na plicích – kazuistika
- Když se ve střevech děje něco nepatřičného...
- Těžké menstruační krvácení může značit poruchu krevní srážlivosti. Jaký management vyšetření a léčby je v takovém případě vhodný?
- Jak naučit dítě s hemofilií aplikovat injekci? V Motole pomáhají sestrám i umělé ruce
-
Všetky články tohto čísla
- Nabídka klinické studie pro pacienty s Waldenströmovou makroglobulinémií
- Úvodník
- Diagnostika a léčba mnohočetného myelomu - Autoři
- Změny od roku 2012
- Pomalidomid
- Úvodník
- Carfilzomib
- Klub pacientů mnohočetný myelom
- Česká myelomová skupina, nadační fond (CMG NF)
- 11. Hematologie a transfuzní lékařství
- Diagnostika a léčba Waldenströmovy makroglobulinemie - Autoři
- Diagnostika a léčba Waldenströmovy makroglobulinemie - Obsah guidelines
- Souhrn doporučení 2014
- Transfuze a hematologie dnes
- Archív čísel
- Aktuálne číslo
- Iba online
- Informácie o časopise
Najčítanejšie v tomto čísle- Souhrn doporučení 2014
- Carfilzomib
- 11. Hematologie a transfuzní lékařství
- Diagnostika a léčba mnohočetného myelomu - Autoři
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



