-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Metalothionein a jeho role v detoxikaci těžkých kovů a predispozici k chorobám
Metallothionein and its role in detoxification of heavy metals and predisposition to diseases
Heavy metals, including both essential and toxic heavy metals, are a major category of globally distributed environmental pollutants that negatively affect human health. Heavy metals have an ability to accumulate in the various tissues and become a part of the food chain. The most serious impact of toxic heavy metals is based on their interactions with many different enzymes and subsequently with many cellular processes. The significant variability between individual animal species and the considerable intra-species variability in heavy metal toxicity is well known. Different expression and function (sometimes caused by single nucleotide polymorphisms) of metal binding proteins such as metallothioneins or glutathione, which are useful at detoxification, may represent one of the reasons for inter - and intra-species variability. If the organism is not able to deal with the negative effects of heavy metals, a higher incidence of many diseases can occur. According to the various studies, the level of metallothionein (MT) expression and some single nucleotide polymorphisms (SNP) in the MT sequence were related to the risk of the genesis of different diseases and to the levels of heavy metals in various tissues. Recently, a significant relationship between SNP in the MT gene, diabetes type 2, cardiovascular diseases, and atherosclerosis has been identified. Some SNPs were responsible for higher levels of cadmium and lead in blood and kidneys, whereas zinc and copper levels were significantly decreased. The over-expression of MT can lead to the protection of cells, which should undergo apoptosis. The over-expression of MT has been observed in breast cancer, intestine and stomach cancer, bladder cancer, prostate cancer, as well as in head and neck cancer cells.
Key words:
heavy metals, metallothionein, polymorphisms, detoxification, metabolism, cancer, SNP.
Autoři: M. Raudenská 1; K. Šmerková 3; V. Tanhäuserová 1; J. Gumulec 1; M. Hlavna 1; M. Sztalmachová 1; L. Pácal 1; P. Babula 2; V. Adam 3; T. Eckschlager 4; R. Kizek 3; M. Masařík 1
Působiště autorů: Masarykova univerzita Brno, Lékařská fakulta, Ústav patologické fyziologie, Přednostka: prof. MUDr. Anna Vašků, CSc. 1; Veterinární a farmaceutická univerzita v Brně, Ústav přírodních léčiv, Přednosta: doc. RNDr. Milan Žemlička, CSc. 2; Mendelova univerzita v Brně, Agronomická fakulta, Děkan: prof. Ing. Ladislav Zeman, CSc. 3; Univerzita Karlova v Praze, 2. Lékařská fakulta a Fakultní nemocnice Motol, Klinika dětské hematologie a onkologie, Přednosta: prof. MUDr. Jan Starý, DrSc. 4
Vyšlo v časopise: Prakt. Lék. 2012; 92(6): 322-326
Kategorie: Přehledy
Souhrn
Těžké kovy vyskytující se v životním prostředí mají nezanedbatelný vliv na lidské zdraví. Díky jejich schopnosti kumulace v rostlinných a následně živočišných tkáních se stávají součástí potravního řetězce. Nejzávažnějším účinkem těžkých kovů v toxické koncentraci je to, že fungují jako enzymatické jedy a zasahují najednou do mnoha buněčných a metabolických procesů. Je známo, že mezi jednotlivými živočišnými druhy i jedinci téhož druhu existuje značná variabilita v účinku těžkých kovů. Jednou z příčin vnitrodruhové variability může být rozdílná míra exprese a funkčnosti kov-vázajících peptidů (metalothioneinů, glutathionu), které pomáhají při detoxikaci organizmu. V některých případech je změna exprese či funkce způsobená přítomností jednonukleotidových polymorfizmů (SNP). Pakliže se organizmus nedokáže patřičně vyrovnat s negativními účinky těžkých kovů, může docházet k zvýšené incidenci různých chorob. Hladina exprese metalothioneinů (MT) a polymorfizmy v MT sekvenci byly v mnoha studiích dány do souvislosti s rizikem vzniku různých onemocnění a množstvím těžkých kovů ve tkáních. S polymorfizmy v genech pro metalothionein již bylo asociováno riziko vzniku diabetu 2. typu, kardiovaskulárních nemocí a aterosklerózy. Některé polymorfizmy též souvisely s vyšší hladinou kadmia a olova v krvi a ledvinách a nedostatkem zinku a mědi v organizmu. Nadměrná exprese MT může však vést k ochraně buněk, které by za správných okolností měly podlehnout apoptóze. Zvýšená exprese metalothioneinu byla pozorována u buněk rakoviny prsu, střev a žaludku, močového měchýře, prostaty, hlavy a krku.
Klíčová slova:
těžké kovy, metalothionein, polymorfizmy, detoxikace, metabolizmus, nádorová onemocnění, SNP.Úvod
Koncentrace těžkých kovů v životním prostředí se v posledních 100 letech radikálně zvyšuje. Ačkoli jejich negativní účinky na lidské zdraví jsou známy již mnoho let, stále jsou masově využívány v průmyslu a zemědělství (insekticidy, fosfátová hnojiva, fungicidy) (1). Těké kovy, zejména olovo a kadmium, mají schopnost akumulovat se v různých orgánech a zásadně ovlivňovat zdraví jedince, a to již ve velmi nízkých koncentracích. Jejich akutní, chronická nebo sub-chronická toxicita může vést k neurotoxickým, karcinogenním, mutagenním či teratogenním efektům (19).
Důležitou roli v udržování přiměřených hladin esenciálních těžkých kovů a detoxikaci organizmu při expozici neesenciálním těžkým kovům hrají metalothioneiny. Řada vědeckých studií prokázala, že v mnoha různých tkáních existuje vztah mezi hladinami těžkých kovů a expresí metalothioneinů (25, 41).
Těžké kovy
Za těžké kovy jsou považovány kovy, jejichž hustota je větší než 4500 kg/m3 (4,5 g/cm3). Nejdůležitější těžké kovy můžeme dle vlivu na metabolizmus rozdělit na:
- esenciální: Fe, Cu, Zn, Mn, Co, Mo.
Tyto kovy jsou v malých dávkách nepostradatelné pro správnou funkci organizmu (jsou součástí molekuly enzymu, nebo fungují jako aktivátory enzymů).
- toxické: Hg, Cd, Pb, As, Cr.
Toxické kovy se vážou na -SH, -COOH a -NH2 skupiny biomolekul, mění jejich strukturu i funkci, a působí tak jako enzymatické jedy. Někdy dochází též ke kompetici s esenciálními látkami (olovo nahrazuje vápník v kostech, kde se posléze kumuluje (17), kadmium nahrazuje zinek v některých enzymech).
Nejvýznamnější negativní efekty těžkých kovů na buněčné procesy jsou shrnuty na obrázku 1.
Obr. 1. Vliv těžkých kovů na buněčné procesy. Toxické těžké kovy se projevují zejména jako takzvané enzymatické jedy. Nahrazují v metaloenzymech původní kofaktor a nabourávají tak správnou strukturu a funkci enzymů. Tímto mechanizmem mohou zasahovat do mnoha buněčných dějů a v konečné fázi mohou působit vznik nádorového onemocnění. 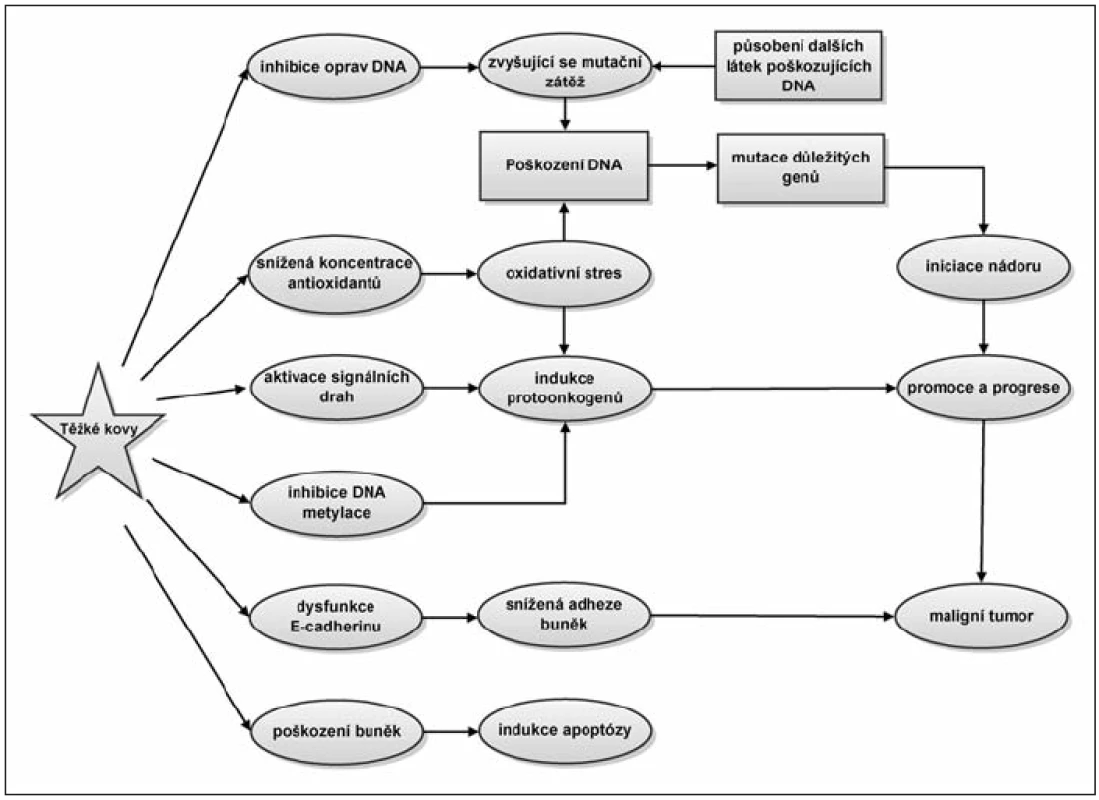
Metalothioneiny
Metalothioneiny (MT) patří do rodiny nízkomolekulárních, intracelulárních proteinů s molekulovou hmotností mezi 6–10 kDa. Obsahují vysoký podíl aminokyseliny cysteinu (až třetina hmotnosti), zatímco aromatické aminokyseliny zcela chybí. Právě vysoký podíl cysteinu způsobuje jeho vysokou afinitu ke kovům, zejména ke kadmiu, zinku, olovu, rtuti a mědi (29, 38).
MT jsou rozděleny dle své primární struktury a dle organizmu, ze kterého pocházejí do dvou tříd MT-I a MT-II. Savčí MT jsou zastoupeny třídou MT-I a jsou tvořeny 61 až 68 aminokyselinami. MT-I jsou rozděleny do čtyř izoforem ( MT-1, MT-2, MT-3 a MT-4) (42). Nejvíce exprimovanou formou MT v lidském organizmu je MT-2. Rozdíly v expresi mezi MT-2 a ostatními izoformami metalothioneinů jsou dány sekvenčními rozdíly v oblasti promotoru, které umožňují vazbu aktivátorů neboli enhancerů transkripce právě u MT-2 izoformy (33). Mezi enhancery transkripce MT-2 genu lze zahrnout kovy (12, 23), interleukiny (4), některé interferony (34), TNF-α (6) a glukokortikoidy (33).
Po navázání transkripčního faktoru MTF-1 (metalregulatory transcription factor-1) na regulační úsek DNA zvaný MRE (metal responsive element), ležící na promotoru genu pro MT, je zahájena transkripce. Za normálních okolností se MTF-1 v buňce nachází v inaktivním stavu s navázaným MTI (metallothionein transcription inhibitor), což je inhibitor bránící navázání MTF-1 na MRE. Po vstupu iontu kovu do buňky se tento iont naváže na MTI a uvolní se tím MTF-1, který může zahájit transkripci MT. Vzrůstající koncentrace těžkých kovů tak může indukovat syntézu MT (14, 12).
MT se účastní mnoha buněčných funkcí především transportu, skladování a detoxikace kovů, metabolizmu esenciálních kovů a vychytávání volných radikálů. Tvorba komplexů MT-kov chrání organizmus hlavně před akutními toxickými účinky kovů. Nejvyšší afinitu vykazuje MT k Cd(II), Pb(II), Ag (I), Hg (II), a Pt(II a IV) (39).
Exprese MT a její asociace s chorobami
Zvýšená exprese metalothioneinu byla pozorována u buněk rakoviny prsu (11), střev a žaludku (7), močového měchýře (36), prostaty (13, 27), hlavy a krku (16). Nadměrná exprese MT2 též zvyšuje tvorbu matrixové metaloproteinázy 9, a tím zvyšuje invazivitu rakovinných buněk (22, 43).
Pravděpodobná je také významná role metalothioneinu v lékové rezistenci (8, 24). Bylo zjištěno, že zvýšená hladina proteinu MT2A koreluje například s rezistencí k adriamycinem (ADR) vyvolané apoptóze a s inhibicí nádorového supresoru p53 (30). Rovn~ cisplatina-rezistentní buňky rakoviny močového mchýře vykazovaly zvýšenou hladinu MT2A proteinu (35).
Zvýšená exprese MT1A i MT2A byla zjištěna také u Gravesovy-Basedowovy choroby (32) a v buňkách obklopujících amyloidní plaky vznikající při Alzheimerově chorobě (15).
Těžké kovy a metabolizmus
Hlavními způsoby vstřebávání těžkých kovů do těla jsou ingesce, inhalace a absorpce kůží. Pokud není vdechnutá látka rozpustná v mukózních hlenech přechází do alveol a difúzí, či aktivním transportem se dostává do krve (např. po vdechnutí par elementární rtuti se Hg vstřebává asi z 80 %). Při ingesci závisí toxicita na formě kovu, pH, rychlosti průchodu potravy trávicím ústrojím, biotransformaci střevními organizmy a množstvím komplexotvorných organických látek a proteinů jako jsou metalothioneiny. Při vstřebávání se opět uplatňuje pasivní transport (difúze) a také aktivní transport (vazba na specifické bílkoviny). Transport probíhá krví za účasti krevních bílkovin. Hlavními centry detoxikace jsou játra a ledviny, ke kumulaci kovů dochází však i v mozku a kostech. Bylo prokázáno, že kadmium a olovo vázané na MT jsou pro organizmus daleko méně toxické, než tyto kovy ve volném stavu (18, 31, 39). Neabsorbované a vyloučené toxiny jsou odstraňovány močí a stolicí. Schéma základního metabolizmu těkých kovů je uvedeno na obrázku 2 (obr. 2).
Obr. 2. Základní metabolizmus těžkých kovů. Těžké kovy se do těla dostávají nejčastěji ingescí, inhalací a absorpcí skrze kůži. Transport probíhá krví za účasti krevních bílkovin. Hlavními centry detoxikace jsou játra a ledviny, kde jsou těžké kovy navázány na metalothioneiny a glutathion. Ve formě vázané na proteiny (peptidy) se těžké kovy vylučují z organizmu. Těžké kovy, které se nepodaří z organizmu vyloučit, se kumulují ve tkáních. 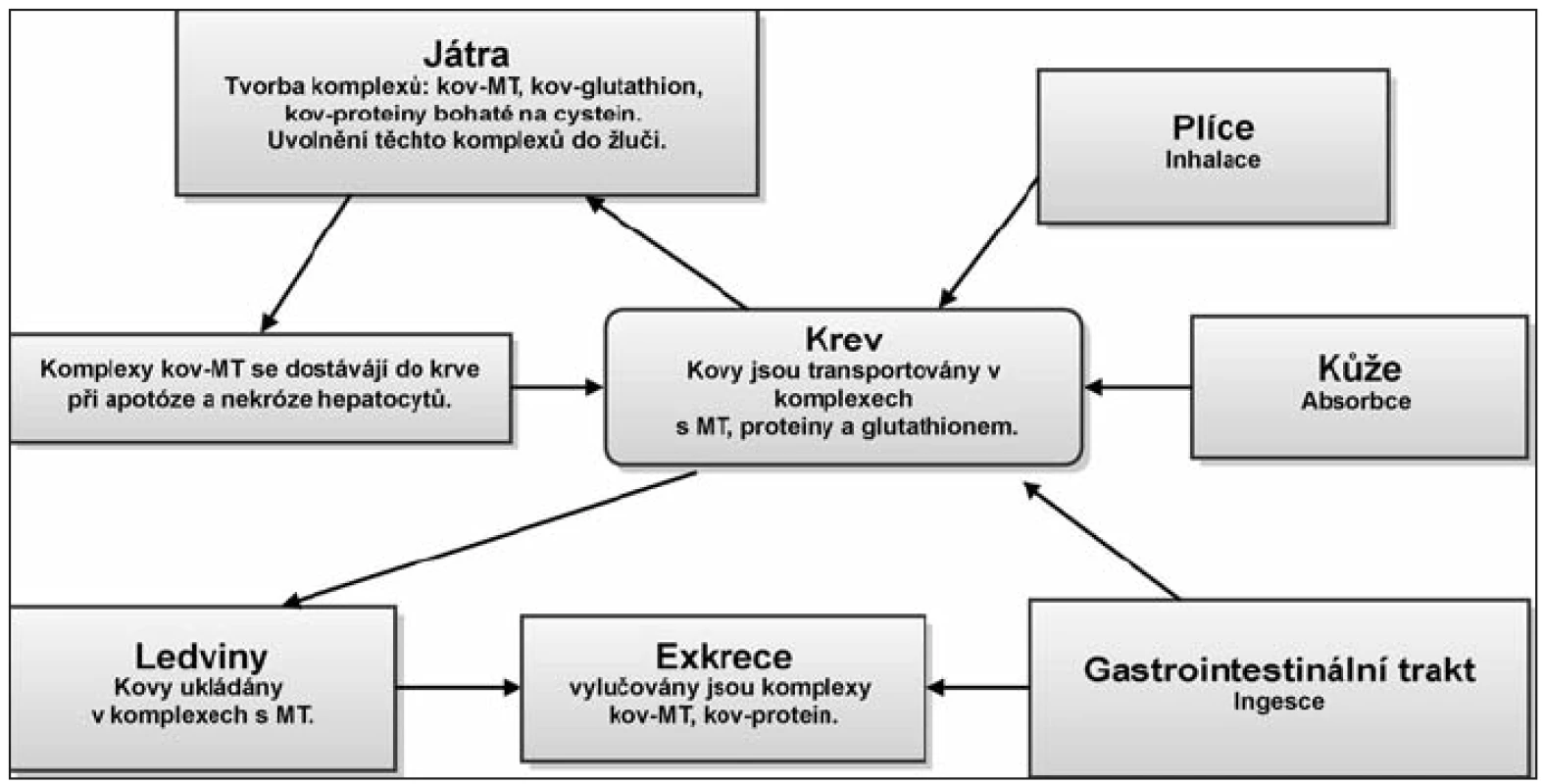
MT polymorfizmy a jejich vztah k závažným onemocněním
Jak již bylo řečeno, metalothioneiny jsou důležitými proteiny při obraně organizmu proti toxickým efektům těžkých kovů. Indukce exprese metalothioneinů byla prokázána při oxidativním stresu a zvýšených koncentracích těžkých kovů v těle (5). Rychlá indukce exprese MT v přítomnosti kovů tak činí z MT užitečný biomarker intoxikace organizmu těžkými kovy (2, 26). Hladina exprese metalothioneinu a polymorfizmy v MT sekvenci byly v mnoha studiích dány do souvislosti s rizikem vzniku různých onemocnění a množstvím těžkých kovů ve tkáních. Podrobněji popíšeme nejdůležitější z nich.
Jednonukleotidový polymorfizmus (SNP) c.152A/G v genu MT1A
SNP c. 152A/G označuje polymorfní místo, které zahrnuje bázi nacházející se na 152. pozici od začátku kódující sekvence genu MT1A. Na tomto místě se může vyskytovat nukleotid A, nebo G viz obrázek 3. Frekvence alely G tohoto SNP byla signifikantně asociována s incidencí diabetu typu 2 (40).
Jednonukleotidový polymorfizmus (SNP) c.80A/C v genu MT1A
Polymorfizmus c.80A/C někde uváděný též jako +647 (počítáno od počátku transkripce), se nachází v kódující oblasti genu MT1A na 80. pozici od začátku kódující sekvence (obr. 3). Tento polymorfizmus byl asociován s dlouhověkostí v italské populaci, zvýhodněni byli nositelé alely A (20). Nositelé alely C byli naopak predisponováni k rozvoji kardiovaskulárních nemocí a diabetu typu 2 (3).
Obr. 3. Umístění polymorfizmů v genu MT1A. SNP c. 152A/G označuje polymorfní místo, které zahrnuje bázi nacházející se na 152. pozici od začátku kódující sekvence genu MT1A. Na tomto místě se může vyskytovat nukleotid A, nebo G. SNP c. 80A/C označuje polymorfní místo, které zahrnuje bázi nacházející se na 80. pozici od začátku kódující sekvence genu MT1A. Na tomto místě se může vyskytovat nukleotid A, nebo C. 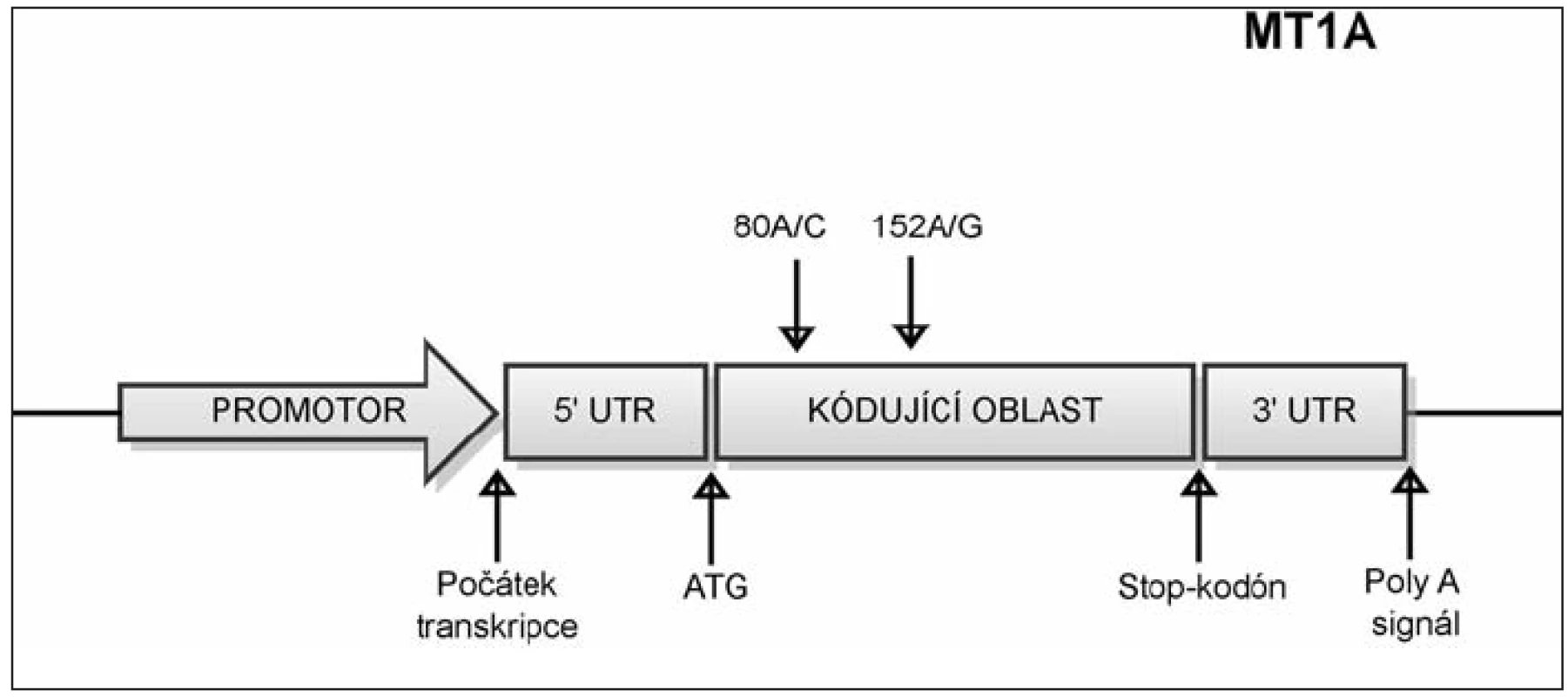
Jednonukleotidový polymorfizmus (SNP)-5A/G v MT2A
Polymorfizmus -5A/G leží v promotorové oblasti genu MT2A 5 nukleotidů před počátkem transkripce (obr. 4). Nachází se v regulačním úseku DNA zvaném MRE (metal responsive element), na který se za normálních okolností váže transkripční faktor MTF-1. Pokud se však v sekvenci vyskytuje G místo A, MTF-1 se nemůže navázat a míra transkripce MT2A se snižuje.
Obr. 4. Umístění polymorfizmů v genu MT2A. SNP -5A/G označuje polymorfní místo v promotorové oblasti genu MT2A, které zahrnuje bázi nacházející se 5 nukleotidů před počátkem transkripce. SNP -209A/G označuje polymorfní místo v promotorové oblasti genu MT2A, které zahrnuje bázi nacházející se 209 nukleotidů před počátkem transkripce. SNP +838 C/G označuje polymorfní místo v 3‘ nepřekládané oblasti, které se nachází v místě vzdáleném 838 nukleotidů od začátku transkripce. 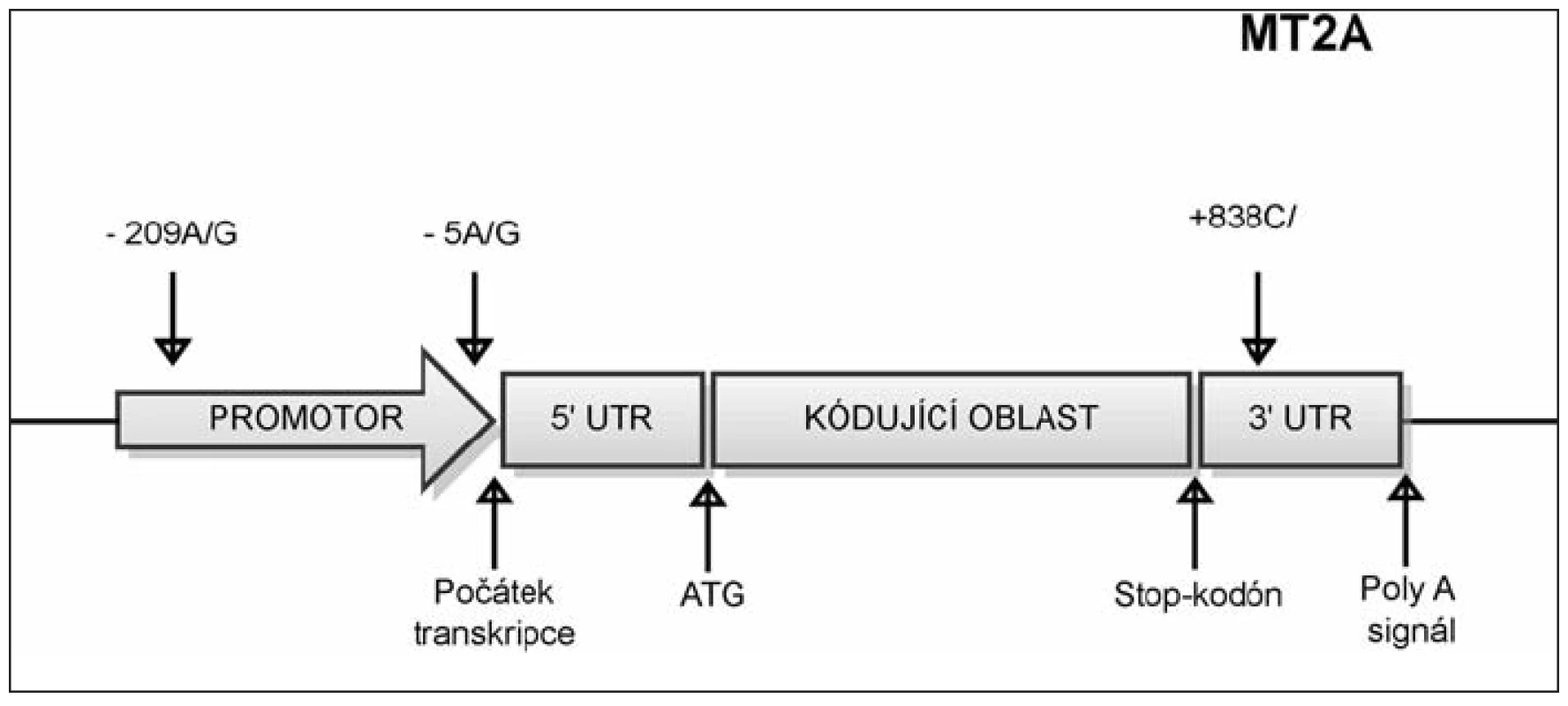
Kita a kol. zjistili, že promotorový polymorfizmus -5A/G v MT2A snižuje indukci exprese MT2A vyvolanou kadmiem, z čehož lze usuzovat na vyšší citlivost jedinců s rizikovou alelou G k toxickým účinkům kadmia (23). Toto bylo potvrzeno studií Kyaaltiho a kol. v roce 2010, kdy byla nalezen vyšší obsah kadmia v ledvinách nositelů alely G tohoto polymorfizmu (průměrné hodnoty byly 87 μg/g tkáně u nositelů genotypu AA, 151 μg/g u genotypu AG a 153 μg/g u genotypu GG) (20). Kritická hladina kadmia je 200 μg na gram tkáně, překročení této hranice může vyvolat dysfunkci ledvin (28).
U nositelů alely G byly též nalezeny vyšší hladiny kadmia (průměrné hodnoty pro genotyp AA-1,6 ppb (parts of cadmium per billion) genotyp AG a GG-2,2 ppb) a olova (průměrné hodnoty pro genotyp AA-30,1 ppb, genotyp AG a GG-33,7 ppb) a nižší hladiny zinku (průměrné hodnoty pro genotyp AA-1,0 ppb, genotyp AG a GG-0,8 ppb) v krvi studovaných subjektů (21). Naopak při analýze těžkých kovů v placentě rodiček, obsahovaly více kadmia placenty nositelek genotypu AA (37). SNP -5A/G v MT2A by se mohl v budoucnu stát slibným ukazatelem rizika vzniku chorob spojených s expozicí kadmia.
Recentní studie též uvádějí souvislost mezi polymorfizmem -5A/G v promotoru MT2A a dlouhověkostí v turecké populaci (3).
Jednonukleotidový polymorfizmus (SNP) +838 C/G v MT2A
Polymorfizmus +838 C/G v 3’nepřekládané oblasti genu MT2A (viz obr. 4) byl asociován s výskytem aterosklerózy, nedostatkem zinku a mědi a vyšší hladinou prozánětlivých cytokinů. Ve všech těchto případech byli znevýhodněni nositelé genotypu GG. Genotyp GG tohoto polymorfizmu byl též asociován s častějším vznikem nekalcifikovaných plaků v karotidách (10).
Jednonukleotidový polymorfizmus (SNP) -209 A/G v MT2A
Polymorfizmus -209 A/G leží v promotorové oblasti genu MT2A 209 nukleotidů před počátkem transkripce (viz obr. 4). Tento polymorfizmus byl asociován s chronickým zánětem (vysoké plazmatické hladiny IL-6), hyperglykemií, se zvýšenou hladinou glykovaného hemoglobinu a nedostatkem zinku. Nositelé genotypu AA měli též zvýšené riziko vzniku diabetes mellitus 1. typu v asociaci s aterosklerózou (p=0.0015 odds ratio=2.617) a jejími komplikacemi jako je ischemická kardiomyopatie (p=0.0050 odds ratio=12.6) (9).
Závěr
Metalothioneiny hrají významnou roli při transportu a hospodaření s kovy. Mají rovněž nezastupitelnou úlohu při detoxikaci organizmu vystaveného působení těžkých kovů v toxických koncentracích. Míra exprese metalothioneinů a jejich schopnost vázat kovy může být mimo jiné narušena změnami na úrovni DNA. Některé jednonukleotidové polymorfizmy již byly asociovány s predispozicemi k různým chorobám a rychlejšímu stárnutí, což potvrzuje klíčovou úlohu metalothioneinů při ochraně organizmu a možnost využití těchto polymorfizmů jako ukazatelů rizika pro nositele rizikových genotypů. Nadměrná exprese MT může však vést k ochraně buněk, které by za správných okolností měly podlehnout apoptóze. Tento mechanizmus můžeme sledovat u mnoha typů nádorů. Zvýšená exprese MT může být tedy cenným markerem pro včasnou diagnostiku nádorových onemocnění.
Poděkování
Práce na tomto projektu byla podpořena projekty: CYTORES GA CR P301/10/0356, IGA IP 19/2012 a NanoBioMetalNet CZ.1.07/2.4.00/31.0023
RNDr. Michal Masařík, Ph.D.
Masarykova univerzita, Lékařská fakulta
Ústav patologické fyziologie
Kamenice 5
625 00 Brno
E-mail: masarik@med.muni.cz
Zdroje
1. Al-Saleh, I., Shinwari, N., Mashhour, A. et al. Heavy metals (lead, cadmium and mercury) in maternal, cord blood and placenta of healthy women. Int. J. Hyg. Environ. Health 2011, 214, p. 79–101.
2. Amiard, J.C., Amiard-Triquet, C., Barka, S. et al. Metallothioneins in aquatic invertebrates: their role in metal detoxification and their use as biomarkers. Aquat. Toxicol., 2006, 76, p. 160–202.
3. Cipriano, C., Malavolta, M., Costarelli, L., et al. Polymorphisms in MT1a gene coding region are associated with longevity in Italian Central female population. Biogerontology, 2006, 7, p. 357–365.
4. Cousins, R.J., Leinart, A.S. Tissue-specific regulation of zinc metabolism and metallothionein genes by interleukin 1. FASEB J., 1988, 2, p. 2884–2890.
5. Dabrio, M., Rodríguez, A.R., Bordin, G., et al. Recent developments in quantification methods for metallothionein. J. Inorg. Biochem., 2002, 88, p. 123–134.
6. Ebadi, M., Leuschen, M.P., El Refaey, H., et al. The antioxidant properties of zinc and metallothionein. Neurochem. Int., 1996, 29, p. 159–166.
7. Ebert, M.P., Günther, T., Hoffmann, J., et al. Expression of metallothionein II in intestinal metaplasia, dysplasia, and gastric cancer. Cancer Res., 2000, 7, p. 1995–2001.
8. Fabrik, I., Kukačka, J., Adam, V., et al. Metalothionein a jeho vztah k protinádorové léčbě na bázi platinových komplexů. Prakt. lék., 2008, 88, s. 90–93.
9. Giacconi, R., Cipriano, C., Muti, E., et al. Novel -209A/G MT2A polymorphism in old patients with type 2 diabetes and atherosclerosis: relationship with inflammation (IL-6) and zinc. Biogerontology 2005, 6, p. 407–413.
10. Giacconi, R., Muti, E., Malavolta, M., et al. The +838 C/G MT2A polymorphism, metals, and the inflammatory/immune response in carotid artery stenosis in elderly people. Mol. Med., 2007, 13, p. 388–395.
11. Goulding, H., Jasani, B., Pereira, H., Reid A. Metallothionein expression in human breast cancer. Br J Cancer, 1995, 72, p. 968–972.
12. Gumulec, J., Masarik, M., Krizkova, S., et al. Insight to physiology and pathology of zinc(II) ions and their actions in breast and prostate carcinoma. Curr Med Chem., 2011, 18, p. 5041–5051.
13. Gumulec, J., Masarik, M., Krizkova, S., et al. Evaluation ofalpha-methylacyl-CoA racemase, metallothionein and prostate specific antigen as prostate cancer prognostic markers. Neoplasma, 2012, 59, p. 191–201.
14. Günes, C., Heuchel, R., Georgiev, O., et al. Embryonic lethality and liver degeneration in mice lacking the metal-responsive transcriptional activator MTF-1. EMBO J, 1998, 15, p. 2846–2854.
15. Hidalgo, J., Penkowa, M., Espejo, C., et al. Expression of metallothionein-I, -II, and -III in Alzheimer disease and animal models of neuroinflammation. Exp Biol Med (Maywood), 2006, 9, p. 1450–1458.
16. Horáková, Z., Tóthová, E., Salzman, R., a kol. Význam elevace hladin metalothioneinu v krvi u pacientů s nádory hlavy a krku. Otorinolaryng. a Foniat. /Prague/, 2008, 57, s. 90–97.
17. Hu, H. Bone lead as a new biologic marker of lead dose: recent findings and implications for public health. Environ. Health Perspect., 1998, 106, p. 961–967.
18. Chan, H.M., Cherian, M.G. Mobilization of hepatic cadmium in pregnant rats. Toxicol. Appl. Pharmacol., 1993, 120, p. 308–314.
19. Järup, L. Hazards of heavy metal contamination. Br. Med. Bull., 2003, 68, p. 167–182.
20. Kayaalti, Z., Mergen, G., Söylemezoğlu, T. Effect of metallothionein core promoter region polymorphism on cadmium, zinc and copper levels in autopsy kidney tissues from a Turkish population. Toxicol Appl Pharmacol., 2010, 245, p. 252–255.
21. Kayaalti, Z., Mergen, G., Söylemezoğlu, T. The potential effect of metallothionein 2A -5A/G single nucleotide polymorphism on blood cadmium, lead, zinc and copper levels. Toxicol Appl Pharmacol., 2011, 256, p. 1–7.
22. Kim, H.G., Kim, J.Y., Han, E.H., et al. Metallothionein-2A overexpression increases the expression of matrix metalloproteinase-9 and invasion of breast cancer cells. FEBS Lett, 2011, 585, p. 421–428.
23. Kita, K., Miura, N., Yoshida, M., et al. Potential effect on cellular response to cadmium of a single-nucleotide A /G polymorphism in the promoter of the human gene for metallothionein IIA. Hum. Genet., 2006, 120, p. 553–560.
24. Kizek, R., Vacek, J., Adam, V., a kol. Vztah metalothioneinu k rakovině a protinádorové léčbě. Klin. Biochem. Metab., 2004, 12, s. 72–78.
25. Liu, Y., Liu, J., Habeebu, S.M., et al. Metallothionein-I/II null mice are sensitive to chronic oral cadmium-induced nephrotoxicity. Toxicol. Sci., 2000, 57, p. 167–176.
26. Lu, J., Jin, T., Nordberg, G., Nordberg, M. Metallothionein gene expression in peripheral lymphocytes from cadmium-exposed workers. Cell Stress Chaperones, 2001, 6, p. 97–104.
27. Masarik, M., Gumulec, J., Sztalmachova, M., et al. Isolation of metallothionein from cells derived from aggressive form of high-grade prostate carcinoma using paramagnetic antibody-modified microbeads off-line coupled with electrochemical and electrophoretic analysis. Electrophoresis, 2011, 32, p. 3576–3588.
28. Miura, N. Individual susceptibility to cadmium toxicity and metallothionein gene polymorphisms: with references to current status of occupational cadmium exposure. Ind. Health, 2009, 47, p. 487–494.
29. Prusa, R., Kizek, R., Trnkova, L., et al. Study of relationship between metallothionein and heavy metals by CPSA method. Clin Chem, 2004, 50, p. 28–29.
30. Puca, R., Nardinocchi, L., Bossi, G., et al. Restoring wtp53 activity in HIPK2 depleted MCF7 cells by modulating metallothionein and zinc. Exp Cell Res. 2009, 315, p. 67–75.
31. Qu, W., Diwan, B.A., Liu, J., et al. The metallothionein-null phenotype is associated with heightened sensitivity to lead toxicity and an inability to form inclusion bodies. Am. J. Pathol., 2002, 160, p. 1047–1056.
32. Ruiz-Riol, M., Martínez-Arconada, M.J., Alonso, N., et al. Overexpression of metallothionein I/II: a new feature of thyroid follicular cells in Graves’ disease. J Clin Endocrinol Metab, 2012, 97, p. 446–454.
33. Samson, S.L., Gedamu, L. Molecular analyses of metallothionein gene regulation. Prog. Nucleic Acid Res. Mol. Biol., 1998, 59, p. 257–288.
34. Sciavolino, P.J., Vilcek, J. Regulation of metallothionein gene expression by TNF-alpha and IFN-beta in human fibroblasts. Cytokine, 1995, 7, p. 242–250.
35. Siegsmund, M.J., Marx, C., Seemann, O., et al. Cisplatin-resistant bladder carcinoma cells: enhanced expression of metallothioneins. Urol Res., 1999, 27, p. 157–163.
36. Somji, S., Sens, M.A., Lamm, D.L., et al. Metallothionein isoform 1 and 2 gene expression in the human bladder: evidence for upregulation of MT-1X mRNA in bladder cancer. Cancer Detect Prev., 2001, 25, p. 62–75.
37. Tekin, D., Kayaaltı, Z., Aliyev, V., Söylemezoğlu, T. The effects of metallothionein 2A polymorphism on placental cadmium accumulation: is metallothionein a modifiying factor in transfer of micronutrients to the fetus? J. Appl. Toxicol., 2012, 32, p. 270–275.
38. Vasak, M. Advances in metallothionein structure and functions. J. Trace Elem. Med. Biol., 2005, 19, p. 13–17.
39. Waalkes, M.P., Harvey, M.J., Klaassen, C.D. Relative in vitro affinity of hepatic metallothionein for metals. Toxicol. Lett, 1984, 20, p. 33–39.
40. Yang, L., Li, H., Yu, T., et al. Polymorphisms in metallothionein-1 and -2 genes associated with the risk of type 2 diabetes mellitus and its complications. Am J Physiol Endocrinol Metab., 2008, 294, p. 987–992.
41. Yoshida, M., Ohta, H., Yamauchi, Y., et al. Age dependent changes in metallothionein levels in liver and kidney of the Japanese. Biol. Trace Elem. Res., 1998, 63, p. 167–175.
42. Zelená, J., Potěšil, D., Vacek, J., a kol. Metalothionein jako prognostický marker nádorového onemocnění. Klinická Onkologie, 2004, 17, s. 190–195.
43. Zitka, O., Krizkova, S., Huska, D., et al. Chip gel electrophoresis as a tool for study of matrix metalloproteinase 9 interaction with metallothionein. Electrophoresis, 2011, 32, p. 857–860.
Štítky
Praktické lekárstvo pre deti a dorast Praktické lekárstvo pre dospelých
Článok vyšiel v časopisePraktický lékař
Najčítanejšie tento týždeň
2012 Číslo 6- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Kombinace metamizol/paracetamol v léčbě pooperační bolesti u zákroků v rámci jednodenní chirurgie
- Antidepresivní efekt kombinovaného analgetika tramadolu s paracetamolem
- Vareniklin jako pomocník v léčbě nikotinismu i u psychiatrických pacientů
-
Všetky články tohto čísla
-
Základy kognitivní, afektivní a sociální neurovědy
XIX. Mozek a stres - Poranenia kľbnej chrupky kolenného kľbu a možnosti jej reparácie
- Metalothionein a jeho role v detoxikaci těžkých kovů a predispozici k chorobám
- Hypertenze, spánek a syndrom obstrukční spánkové apnoe
- Vek ako potenciálny faktor ovplyvňujúci patologické ukazovatele a prognózu ochorenia u pacientov s karcinómom obličky
- Budúcnosť nanotechnológie v medicíne a stomatologii
- Vztah konzumace alkoholu a kouření cigaret
- Prevence návykových nemocí v rodině
- Informovaný souhlas u seniorů v dlouhodobé péči
- Mezinárodní výzkum problematiky paliativní péče u pacientů s demencí
- Porovnání péče soukromých a ambulantních porodních asistentek
- Primární zdravotní péče novou kategorií impaktovaných časopisů databáze Journal Citation Reports
- Přírodovědecké, literární a lékařské tradice Faustova domu
-
Miniportréty slavných českých lékařů
Tošovský Václav – dětský chirurg a ortoped - Jedničkou nejen české neurochirurgie
- Jubilea
-
Základy kognitivní, afektivní a sociální neurovědy
- Praktický lékař
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Poranenia kľbnej chrupky kolenného kľbu a možnosti jej reparácie
-
Základy kognitivní, afektivní a sociální neurovědy
XIX. Mozek a stres - Vztah konzumace alkoholu a kouření cigaret
- Metalothionein a jeho role v detoxikaci těžkých kovů a predispozici k chorobám
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



