-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Kombinovaná chelatační léčba u pacienta s myelodysplastickým syndromem a vrozenou hemochromatózou Popis případu
Combined chelation treatment in patients with myelodysplastic syndrome and hereditary hemochromatosis – a case study
There is currently great interest in the diagnosis and treatment of iron overload syndromes. These syndromes are classified as primary (hereditary), for example hereditary hemochromatosis, or secondary (acquired), for example transfusional iron overload. An imbalance between iron uptake and iron elimination leads to its accumulation in the body and the toxic effect of iron overload causes tissue damage (heart, liver, endocrine organs) and can lead to end-organ failure. Therefore, research has focused on means of preventing iron-related morbidity and mortality. Therapeutic management of hereditary hemochromatosis involves venesection, while for transfusion iron overload, iron chelation therapy is useful (deferoxamine, deferiprone or deferasirox) mainly given as monotherapy. We report a complicated case of a patient with hereditary hemochromatosis and simultaneous myelodysplastic syndrome, when venesection was not indicated. In this situation it was necessary to solve anemia and systemic iron overload (hepatopathy, cardiomyopathy, diabetes mellitus) at the same time. This case report demonstrates that combined chelation therapy with deferoxamine and deferiprone was successful, improved patient quality of life and was performed completely in the outpatient clinic.
Key words:
myelodysplastic syndrome, hemochromatosis, iron overload, combined chelation therapy.
Autoři: J. Vondráková 1; J. Procházková 1; K. Indrák 1; L. Kučerová 2
Působiště autorů: Hemato-onkologická klinika Fakultní nemocnice a Lékařská fakulta Univerzity Palackého, Olomouc Přednosta: prof. MUDr. Karel Indrák, DrSc. ; Ústav patologie FN a LF UP, Olomouc Přednosta: doc. MUDr. Martin Tichý, CSc. 2
Vyšlo v časopise: Prakt. Lék. 2008; 88(3): 166-169
Kategorie: Kazuistika
Souhrn
V současné době je věnována velká pozornost diagnostice, prognostickému významu a léčbě stavů spojených s přetížením železem. Přetížení železem je způsobeno primárním onemocněním, tj. vrozenou hemochromatózou, ale i sekundárními příčinami, např. nadměrným přívodem železa u polytransfundovaných nemocných. Nerovnováha mezi přívodem a eliminací železa vede k jeho hromadění v organismu, a tím k toxickému poškození srdce, jater, endokrinních orgánů, případně dalších tkání, které může vyústit i v život ohrožující stavy. Hledají se proto cesty, jak tomuto poškození předejít. V případě vrozené hemochromatózy je touto možností provádění venepunkcí, u polytransfundovaných pacientů jsou k dispozici léky chelatující železo (desferioxamin, deferiprone, deferasirox), obvykle podávané v monoterapii. Předmětem sdělení je kazuistika pacienta s vrozenou hemochromatózou komplikovanou dysplastickým postižením kostní dřeně, u kterého bylo nutno řešit anémii a známky orgánového přetížení železem (hepatopatie, kardiopatie, diabetes mellitus). Teprve až použitím kombinované chelatační léčby (desferioxamin + deferiprone) bylo dosaženo požadovaného terapeutického efektu při zachování uspokojivé kvality života pacienta, plně ambulantně vedenou terapií.
Klíčová slova:
myelodysplastický syndrom, hemochromatóza, přetížení železem, chelatační léčba.Úvod
Nadbytek železa v organismu vzniká v důsledku nerovnováhy mezi jeho příjmem a schopností organismu přebytečné železo eliminovat (13). Může se jednat o systémové přetížení železem, nebo o jeho regionální akumulaci na buněčné či orgánové úrovni (10). Stavy spojené s přetížením železem jsou obvykle klasifikovány jako primární (vrozené), nebo sekundární (získané). Příkladem primární poruchy je defekt v regulaci železa u vrozené hemochromatózy. K sekundárnímu přetížení dochází u řady onemocnění, např. u chorob s inefektivní erytropoézou, při chronické hemolýze, při nadměrném přívodu železa transfúzemi, případně při vysokém obsahu železa v potravě (1, 8).
Termínem hemochromatóza označujeme chronické přetížení organismu železem genetického původu, jehož diagnostika se opírá nejen o zjišťování specifických genových mutací, ale vychází i z fenotypové manifestace hemochromatózy (3, 6, 12). K typickým klinickým projevům hemochromatózy patří slabost, letargie, váhový úbytek, artropatie, impotence, hyperpigmentace, postižení jater, diabetes mellitus, kardiomyopatie, hyperpigmentace kůže (3, 5).
Typický šedavý nádech kůže, tzv. bronzový diabetes, vzniká hromaděním Fe a melaninu v kůži (5). Akumulace Fe v jiných orgánech způsobuje jejich dysfunkci až selhání. Důležitým ukazatelem stavu zásob železa v organismu je stanovení saturace transferinu a hladina ferritinu v séru. Zvýšená saturace transferinu (nad 40 % u žen a nad 45 % u mužů) a vzestup ferritinu (nad 200 μg/l u žen a nad 300 μg/l u mužů) jsou časnými ukazateli latentního přetížení železem (3, 5). Další metody umožňující diagnostiku, monitoring či kvantifikaci zásob železa jsou jaterní biopsie, sternální punkce, trepanobiopsie, nukleární magnetická rezonance jater a srdce (3, 5, 13).
Terapie hemochromatóz spočívá v odstraňování přebytečného Fe. U vrozených poruch se pravidelně provádějí venepunkce k dosažení cílové hodnoty ferritinu ≤ 50 μg/l a hodnoty hemoglobinu (Hb) < 110 g/l (3). Při sekundárním přetížení železem u polytransfundovaných nemocných je třeba včas, v závislosti na základním onemocnění, počtu podaných transfúzí, intenzitě transfúzního režimu, zahájit chelatační léčbu, obvykle při hodnotě ferritinu > 1 000 μg/l (7).
Donedávna u nás byl k dispozici jen parenterální preparát desferioxamin (Desferal) podávaný v dlouhodobých infuzích. Nověji se objevuje perorální lék deferiprone (Ferriprox), perspektivně bude uveden na trh i další perorální chelatátor deferasirox (Exjade). V současnosti jsou tyto léky většinou používány v monoterapii, ale v poslední době jsou publikovány i práce zkoumající jejich kombinované podání (4).
Vlastní pozorování
S využitím uvedených poznatků a literárních dat jsme řešili komplikovaný případ pacienta, který má multifaktoriální poruchu utilizace železa, tj. současně vrozenou hemochromatózu a dysplastickou krvetvorbu. Jedná se o 54 letého muže, který byl odeslán na naše pracoviště v srpnu 2005 ze spádové hematologické ambulance k dořešení a zvážení dalšího léčebného postupu. Nemocný, který dosud vážněji nestonal (nekuřák, abstinent, bez chronické medikace či vlivu toxických látek), udával asi 3 – 4 roky postupně progredující slabost, únavu, námahovou dušnost. V únoru 2005 byla zjištěna lehká makrocytární anémie, hyperferritinémie (ferritin 2 162 μg/l), v kostní dřeni zmnožení erytropoézy s přítomností prstenčitých sideroblastů a molekulárně-genetickým vyšetřením byla prokázána vrozená hemochromatóza typu 1 s heterozygocií H63D genu HFE.
V květnu 2005 byl nemocnému nasazen inzulín pro diabetes mellitus, v červenci 2005 se objevují symptomy městnavé srdeční slabosti. V srpnu 2005, kdy byl pacient předán do naší péče, jsme provedli celkové přešetření, včetně kontrolních odběrů kostní dřeně.
Laboratorní vyšetření
Hodnoty krevního obrazu (KO) v VIII/2005 byly: leukocyty 3,96.109/l, erytrocyty 2,56.1012/l, Hb 97 g/l, hematokrit 0,28, MCV 109 fl, trombocyty 219.109/l, retikulocyty 0,024, RDW 16, dále ALT 0,92 μkat/l, GMT 0,99 μkat/l, hladina Fe 58,4, FeVK 63,9, ferritin 1 029 μg/l, hladina erytropoetinu 91 IU/l; jinak bilirubin, jaterní soubor, minerály, renální parametry, hladina vitaminu B12 a folátu v normě.
Nátěry sternální punkce ukazovaly na normocelulární kostní dřeň s výrazně zmnoženou dysplastickou erytropoezou (s megaloblastoidními změnami, plazmojadernou asynchronií, nalezeny i vícejaderné formy, mitózy, současně zaznamenána pseudopelgerizace v granulopoeze), barvením na Fe potvrzeno 66 % prsténčitých sideroblastů, v tkáňových kulturách prokázán nízký růst.
Uzavíráno tedy jako myelodysplastický syndrom typu refrakterní anémie s prstenčitými sideroblasty (MDS-RARS). Klasické cytogenetické vyšetření odhalilo normální karyotyp (46 XY). Jednalo se o prognosticky příznivé onemocnění (dle IPSS skóre 0, low risk). Trepanobiopsie kostní dřeně odpovídala uvedené diagnóze (obr. 1)
Obr. 1. Trepanobiopsie kostní dřeně, HE 400x – nerovnoměrně buněčná, většinou hypercelulární kostní dřeň s redukovanou granulopoezou s intratrabekulární prekurzorovou složkou (ALIP), dysplastickou erytropoezou s prstenčitými formami, nález odpovídá MDS typu RARS 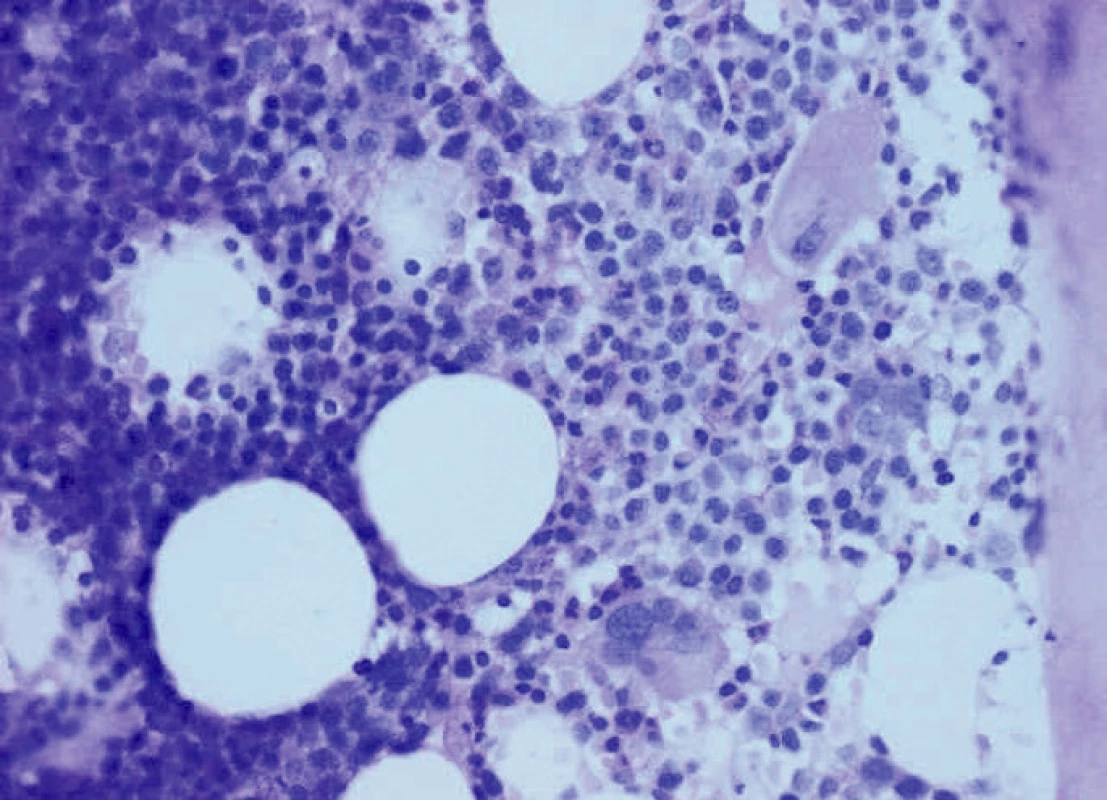
Terapie a průběh
Na základě provedených vyšetření jsme stav hodnotili jako MDS typu RARS při prokázané hemochromatóze typu 1 s mutací genu HFE a heterozygocií (H63D). Podávání vitaminu B6 bylo bez efektu. Vzhledem k známkám přetížení železem a jeho orgánové toxicitě (hepatopatie, inicipientní kardiopatie, diabetes mellitus závislý na inzulínu), byla v říjnu 2005 zahájena perorální chelatační léčba deferiprone, to znamená Ferriprox v dávce 6 tbl denně při vstupním Hb 88 g/l a ferritinu 1 273 μg/l.
Pro trvající pokles Hb při současně relativně nízké hladině endogenního erytropoetinu byla v říjnu 2006 indikována léčba rekombinantním erytropoetinem – Neorecormon 30 000 j.s.c. 1x týdně. Přesto vzniká intermitentně potřeba substituce KO transfuzemi, a tím dochází k další zátěži organismu nadměrným přívodem Fe.
Chelatační léčba je bez dalšího efektu, a proto se rozhodujeme o její intenzifikaci přidáním desferioxaminu (Desferal). Před zahájením kombinované chelatační léčby jsme současně provedli jaterní biopsii k ozřejmění stavu přetížení železem. Histologicky byla prokázána hemochromatóza s infiltrací jater Fe pigmentem 4. stupně a mírná steatóza. Závažnou akumulaci Fe v játrech a pankreatu potvrdila i nukleární magnetická rezonance (NMR) – obraz „černých jater“ (obr. 2, 3).
Obr. 2. Jaterní biopsie, Fe, 200x – mírná steatóza, hemochromatóza, patrna hojná depozita Fe pigmentu v hepatocytech i Kuppferových buňkách s intenzitou 4. stupně. 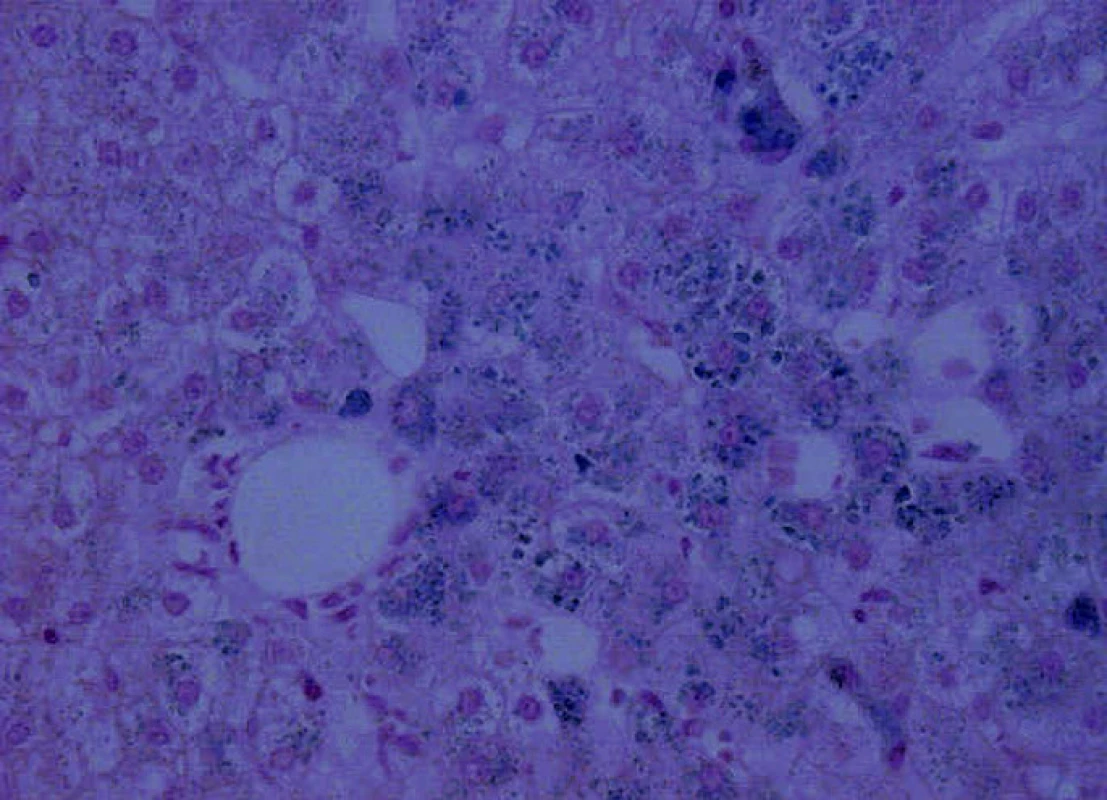
Obr. 3. Nukleární magnetická rezonance jater a sleziny – homogenně snížená intenzita signálu T2 i T1 v.o. v játrech („černá játra“), odpovídající klin. dg., slezina bez odchylek. 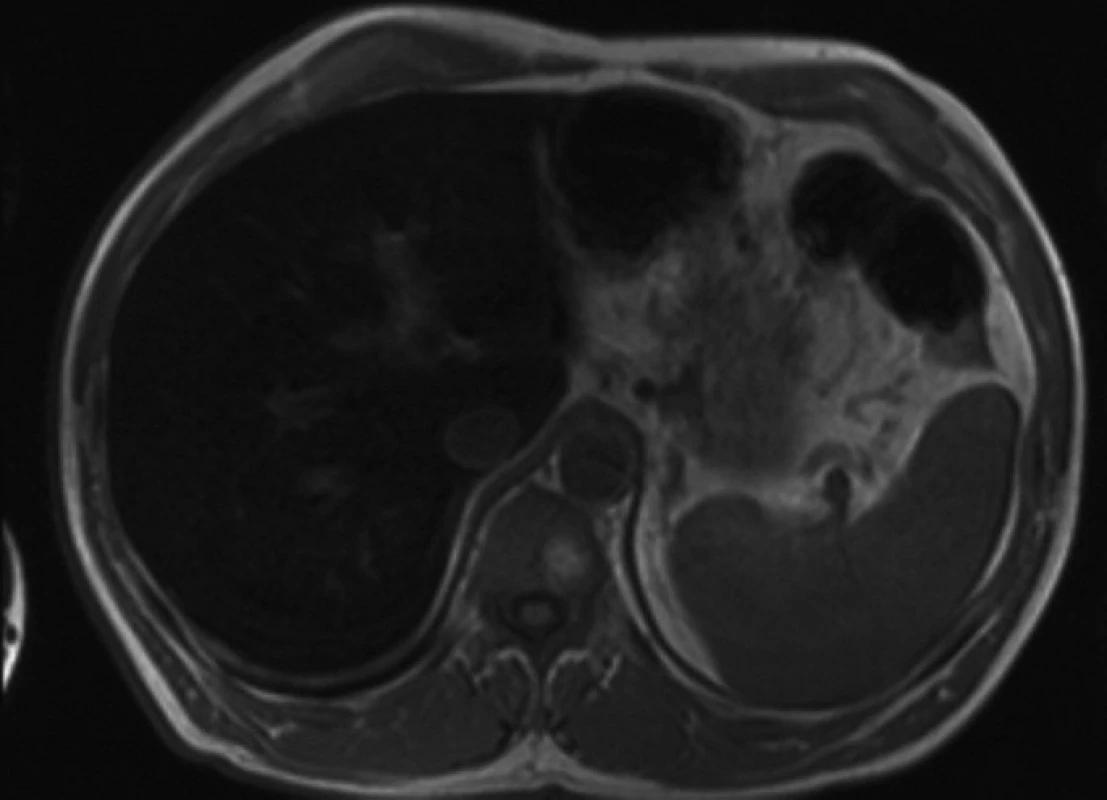
V únoru 2007 jsme zahájili kombinovanou chelatační terapii tak, aby došlo k vyšší mobilizaci Fe s využitím terapeutického potenciálu obou preparátů (predilekční působení v odlišných kompartmentech, srdce – deferiprone, játra – deferoxamine).
Ferriprox podáváme 3x2 tbl denně jen 5 dní v týdnu, zbývající 2 dny aplikujeme Desferal 2 g i.v. 12 hodin v kontinuální infúzi. Jedná se o dávkování dle individuálního schématu deferiprone 40 mg/kg/den 5 dní + deferoxamine 28 mg/kg/den 2 dny. Dosud tato léčba nebyla všeobecně akceptována a její efekt je teprve studován. Dle různých autorů je deferiprone nejčastěji podáván v dávce 75 mg/kg/den a deferioxamin v dávce 40–50 mg/kg/den, respektive 2 g/den 2–4x týdně (4, 5).
Vzhledem k obavám z toxicity (např. možné leukopenie), použití dosud nestandardního léčebného postupu, a s přihlédnutím na praktickou stránku věci (počet tablet, ředění injekcí, ale i ekonomické náročnosti, apod.) jsme proto volili dávky chelatátorů nižší. Později léčbu dále modifikujeme a optimalizujeme – Desferal aplikujeme cestou periferních žil pomocí infuzoru, což umožňuje kontinuální podání léku v dávce 4 g na 48 hodin (celková dávka ani léčebné schéma se nemění). Léčba je tak zahájena při ambulantní návštěvě a dále pokračuje v domácím prostředí.
Asi po šesti měsících léčby jsme pro insuficienci periferních žil zavedli podkožní venózní port cestou vena subclavia l. sin., a tím jsme zabezpečili pohodlnější a kvalitnější žilní přístup k chelataci i transfúzím. I nadále potencujeme chelatační efekt stávající léčbou erytropoetinem. Kombinovaná chelatační léčba je pacientem dobře tolerována, bez komplikací, stabilizují se zásoby železa dokumentované poklesem ferritinu (348 ug/l) i při současném intermitentním podávání transfúzí (hodnoty Hb 70–80 g/l), ustupují známky městnané srdeční slabosti, snižuje se spotřeba dávek inzulínu, normalizují se jaterní testy (obr. 4).
Obr. 4. Infusor ke kontinuální i.v. aplikaci Desferalu 
Graf 1. Vývoj hodnot hemoglobinu 
Graf 2. Monitorace léčby sledováním hladin ferritinu, příznivý efekt kombinované chelatace na pokles zásob Fe 
Graf 3. Efekt léčby – regrese hepatopatie 
Diskuse
Dle literárních údajů (3, 6, 12) představuje HFE hemochromatóza nejčastější formu chronického přetížení železem genetického původu. Reprezentuje více než 90 % případů hemochromatózy, vztahuje se k mutacím HFE genu a bývá též označována jako klasická hemochromatóza dospělých. Mutace HFE genu na pozici 63, označovaná jako H63D, hraje důležitou roli u vrozených hemochromatóz, může se uplatňovat i v patogenezi některých forem MDS a vést tak k vyšší akumulaci železa, zejména u pacientů s MDS typu RARS i bez předchozího podávání transfúzí (10). Uvedený příklad našeho nemocného ukazuje na možnost multifaktoriální příčiny nadměrného hromadění železa v organismu a způsob řešení jeho orgánové toxicity využitím kombinované chelatační terapie. Progredující anémie nedovolila provádět venepunkce indikované u vrozených poruch, hodnoty Hb i přes léčbu erytropoetinem vyžadovaly intermitentní podávání transfúzí.
Byla proto zahájena chelatační léčba. Nejprve byl přednostně zvolen perorální preparát v monoterapii. Tato terapie neměla dostatečný efekt, a proto byla chelatace doplněna o další preparát v parenterálním podání. Kombinovaná chelatační léčba (deferiprone + desferioxamin) znamenala razantnější redukci nadměrného železa v organismu, došlo k snížení jeho orgánové toxicity a omezení další akumulace Fe v organismu, i když bylo Fe intermitentně iatrogenně dodáváno transfuzemi.
K monitoraci léčby jsme využili běžně dostupného, rychlého a nenáročného biochemického stanovení hladiny ferritinu v séru. Perspektivně by bylo vhodné sledovat efekt terapie i kvantitativně pomocí NMR jater a srdce či odpadem Fe močí.
Závěr
Informujeme o naší zkušenosti s kombinovanou chelatační léčbou u poměrně neobvyklého případu nemocného s vrozenou hemochromatózou a mye-lo-dysplastickým syndromem. V souladu s literárními údaji (2, 11) a naší zkušeností se zdá, že kombinovaná chelatační terapie může být prospěšná i u jiných stavů přetížení železem, zejména tehdy, pokud dosud obvyklá chelatační monoterapie selhává. Tato léčba byla naším pacientem dobře tolerována; probíhá kompletně v ambulantním režimu a zachovává nemocnému uspokojivou kvalitu života. Během sledovaného období jsme nepozorovali žádné nežádoucí účinky 3.–4. stupně a byl dosažen požadovaný terapeutický efekt.
Poděkování
Zvláštní poděkování věnují autoři článku prim. MUDr Mileně Vránové z oddělení klinické hematologie Městské nemocnice Ostrava – Fifejdy za odeslání pacienta ze spádové hematologické ambulance a za výjimečnou spolupráci při jeho léčbě.
MUDR.Jana Vondráková
Hemato-onkologická klinika
Fakultní nemocnice, Olomouc
I. P. Pavlova 6, 775 20 Olomouc
Zdroje
1. Anderson, J.G. Mechanisms of iron loading and toxicity. Am. J. Hematol. 2007, 82, p. 1128–1131.
2. Brissot, P. Diagnosis and current treatments for primary iron overload. Am. J. Hematol. 2007, 82, p. 1140-1141.
3. Brissot, P., de Bels, F. Current approaches to the management of hemochromatosis. Hematology 2006, ASH Education Program Book, p 36 – 41, ISSN 1520 – 4383, dostupný též na http://asheducationbook.hematologylibrary.org/content/vol2006/issue1/.
4. Cohen, A.R. New advances in iron chelation therapy. Hematology 2006, ASH Education Program Book, p. 42-47.
5. Čermák, J. Některé nové poznatky v diagnostice a léčbě stavů s přetížením železem. Transfuze a Hematologie dnes 2006, 12, 3, s. 140-145.
6. Čimburová, M., Půtová, I., Provazníková, H. Hereditární hemochromatóza. Hygiena 2002, 47, 1, s. 41-48.
7. Gattermann, N., Porter, J., Lopes, L.F., Seymour, J. Iron overload in myelodysplastic syndromes. Hematology/oncology clinics 2005; 19(Suppl 1), p. 18-25.
8. Hershko, Ch. Iron loading and its clinical implications. Am. J. Hematol. 2007, 82, p. 1147 -1148.
9. Nearman, Z.P., Szpurka, H., Serio, B. et al. Hemochromatosis-associated gene mutations in patients with myelodysplastic syndromes with refraktory anemia with ringed sideroblasts. Am. J. Hematol. 2007, 82, p. 1076-1079.
10. Pietrangelo, A. Iron chelation beyond transfusion iron overload Am. J. Hematol. 2007, 82, p. 1142–1146.
11. Porter, J.B. Concepts and goals in the management of transfusional iron overload. Am. J. Hematol. 2007, 82, p 1136-1139.
12. Půtová, I., Čimburová, M., Cieslarová, B. et al. Mutace genu HFE u nemocných s hereditární hemochromatózou a dalšími chorobami s akumulací železa v játrech. Čes. a slov. Gastroenter. a Hepatol. 2002, 56, 6, s. 214-219.
13. Wood, J.C. Diagnosis and management of transfusion iron overload. The role of imaging. Am. J. Hematol. 2007, 82, p 1132-1135, dostupný také na www.interscience.wiley.com.
Štítky
Praktické lekárstvo pre deti a dorast Praktické lekárstvo pre dospelých
Článek Vztah obezity a osteoartrózy
Článok vyšiel v časopisePraktický lékař
Najčítanejšie tento týždeň
2008 Číslo 3- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Když se ve střevech děje něco nepatřičného...
- Kombinace metamizol/paracetamol v léčbě pooperační bolesti u zákroků v rámci jednodenní chirurgie
- Gastroezofageální reflux a gastroezofageální refluxní onemocnění u kojenců a batolat
- Naděje budí časná diagnostika Parkinsonovy choroby založená na pachu kůže
-
Všetky články tohto čísla
- Reforma zdravotnictví a vztahy mezi zdravotníky a pacienty
- Vztah obezity a osteoartrózy
- Urogenitální tuberkulóza – současný stav
- Zrakové poznávání a jeho poruchy
- Psychosomatika bolesti Konvergence neurologické a psychogenní etiopatogeneze a možnosti psychoterapie
- Úloha orální hygieny v prevenci plakem plakem podmíněných onemocnění dutiny ústní
- Nadváha, jídelní zvyklosti a dietní tendence dospívajících
- Mezinárodní klasifikace funkčních schopností, disability a zdraví WHO jako nástroj moderní rehabilitace
- Kombinovaná chelatační léčba u pacienta s myelodysplastickým syndromem a vrozenou hemochromatózou Popis případu
- Profesní neimunologické asthma bronchiale
- Endoskopická cytoskopie – nová metoda k vyšetření trávicí trubice
- K článku Strunecká A., Blaylock, R.L.: Etiopatogeneze autismu z pohledu buněčné a molekulární biologie Praktický lékař 2, 88, č. 2, s. 78–81.
- Miniportréty slavných českých lékařů Profesor MUDr. Jan Zahradníček – ortopéd
- Food, Nutrition, Physical Activity and the Prevention od Cancer: a Global Perspective
- Medailon k životnímu jubileu prof. MUDr. Vladimíra Bencka, DrSc.
- Nový preparát pro léčbu pacientů s chronickou hepatitidou typu B
- Pětistá transplantace kostní dřeně v režii ČNRDD
- Informovaný souhlas. Proč a jak?
- Praktický lékař
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Urogenitální tuberkulóza – současný stav
- Psychosomatika bolesti Konvergence neurologické a psychogenní etiopatogeneze a možnosti psychoterapie
- Úloha orální hygieny v prevenci plakem plakem podmíněných onemocnění dutiny ústní
- Kombinovaná chelatační léčba u pacienta s myelodysplastickým syndromem a vrozenou hemochromatózou Popis případu
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



