-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Helicobacter pylori a jeho úloha v patogenezi a patologii orofaryngu a epifaryngu ve vztahu k ORL onemocněním
Helicobacter Pylori in Oropharyngeal/epipharyngeal Pathology and Pathogenesis in Relation to ORL Diseases
Helicobacter pylori (HP) is a gram negative, microaerophilic bacterium. This bacterium is associated with chronic gastritis, gastric ulcers and gastric carcinoma. HP infection is often acquired in childhood. High prevalence of HP infection was reported in developing countries. The prevalence in Central and Eastern Europe is estimated from 60 to 90%. The question of colonization of oro/epipharyngeal lymphatic tissue has been recently discussed. HP was detected in dental plaque, saliva, adenoid tissue in children, palatines and middle ear fluid. The most sensitive technique for HP detection is PCR, specifically real – time PCR. The role of HP in oropharyngeal carcinogenesis remains unresolved. This theory is based on the fact that HP induces cytokine production, esp. EGF, TGF and NOS, which involves cell proliferation and tumour transformation. Possible modes of transmission of bacteria have not been fully explained. Person to person transmission can occur through several routes, e.g., oral–oral and fecal–oral route. The association between simultaneous colonization of HP in the oral cavity and that in stomach has not been understood yet. Some scientific works showed the difference in genotypes between oropharyngeal and gastric isolates.
Our review shows recent results of scientific works about HP in oropharynx, relationship between oro/epipharyngeal and gastric HP infection and discusses the value of diagnostic tests for HP detection .Key words:
Helicobacter pylori (HP), detection methods, PCR.
Autoři: E. Nártová 1; J. Astl 1; P. Lukeš 1; R. Katra 2; E. Pavlík 3; J. Betka 1
Působiště autorů: Klinika ORL a chirurgie hlavy a krku 1. LF UK a FN Motol, Praha, Katedra otorinolaryngologie IPVZ, Praha, přednosta prof. MUDr. J. Betka, DrSc. 1; Klinika dětské ORL 2. LF UK a FN Motol, Praha, přednosta doc. MUDr. Z. Kabelka, Ph. D. 2; Ústav imunologie a mikrobiologie 1. LF UK a VFN, Praha, přednostka prof. RNDr. L. Kolářová, CSc. 3
Vyšlo v časopise: Otorinolaryngol Foniatr, 61, 2012, No. 2, pp. 120-129.
Kategorie: Přehledový článek
Souhrn
Helicobacter pylori (HP) je gramnegativní, mikroaerofilní bakterie, podílející se v lidské populaci na vzniku gastritid, gastroduodenálních vředů a žaludečních malignit. Infekce může být získána již během dětství a probíhat latentně po celý život. Zvýšený výskyt je zaznamenán v rozvojových zemích. Ve státech střední a východní Evropy se promořenost udává od 60 do 95 % . V posledních letech je diskutována otázka kolonizace orofaryngeální a epifaryngeální lymfatické tkáně tímto mikrobem a její možná funkce jako extragastrického zdroje infekce HP. Mikrob byl detekován v dentálním plaku, ve slinách, v adenoidních vegetacích u dětí, v tonzilární tkáni a rovněž v tekutině ze středouší. K záchytu infekčního agens byla použita řada detekčních metod. Za vysoce citlivou metodu je považována detekce genetické informace pomocí specifické hybridizační sondy v rámci techniky PCR, resp. real–time PCR . Dále zůstává otevřena otázka vlivu HP infekce na vzniku a vývoji orofaryngeálního karcinomu. Tato teorie je podpořena faktem, že HP zvyšuje produkci některých cytokinů a regulačních molekul, např.: EGF, TGF a NOS, způsobujících zvýšenou buněčnou proliferaci a nádorovou transformaci. Zda takto HP působí i v lymfatické tkáni orofaryngu, nebylo dosud zkoumáno.
Cesty přenosu uvedeného patogenu nejsou doposud zcela objasněny, předpokládá se cesta oro–orální či oro–fekální. Souvislost mezi přítomností HP v ústní dutině a v žaludku není dosud zcela ozřejmena. Některé práce dokládají nález odlišných genotypů HP v orofaryngu a v žaludku.
V následujícím článku jsou shrnuty výsledky publikací zabývajících se výskytem HP v orofaryngu, vztahem oro/epifaryngeální a žaludeční infekce HP a rovněž jsou diskutovány možnosti diagnostiky HP v orofaryngu.Klíčová slova:
Helicobacter pylori (HP), metody průkazu, PCR.ÚVOD
Mikrobiologická charakteristika a patogenetické mechanismy působení Helicobacter pylori
Helicobacter pylori (HP) je spirální pohyblivá gramnegativní bakterie, jejíž přítomnost je typická téměř výhradně pro lidskou populaci, u primátů byla detekována výjimečně. Řada studií dokládá výskyt některých kmenů HP u dalších zvířat, mimo jiné u delfínů či ledních medvědů (59).
Patologické působení HP je podmíněno interakcemi mezi hostitelem a mikrobem. Je ovlivněno stupněm virulence jednotlivých kmenů HP (56). Progrese nemoci je závislá na bakteriálním genotypu, vlivu prostředí a životního stylu i genetických predispozicích hostitele (58). Bakteriální buňka HP se vyznačuje produkcí celé řady faktorů virulence. Z nich nejdůležitější jsou dva sekreční proteiny: vakuolizační cytotoxin A (VacA) a cytotoxin-asociovaný gen A (CagA). CagA je produkován cca 60 % kmenů HP a je kódován genem cagA, který se nalézá v tzv. ostrůvku patogenity – PAI (43). Tento ostrůvek kóduje sekreční systém typu IV. Kmeny s přítomností cagA jsou označovány jako CagA+. U pacientů s těmito kmeny byl zaznamenán vyšší výskyt peptických vředů, atrofických gastritid a rakoviny žaludku. CagA protein se dostává do hostitelské buňky prostřednictvím sekrečního systému typu IV (T4SS) (25). T4SS je řízen řadou genů, mimo jiné cagI, cagL, cagY a cagA. Proteiny kódované těmito geny jsou integrovány prostřednictvím vazby s integrinem ß1 do hostitelské buňky, kde dochází k jejich fosforylaci za účasti onkogenních tyrosinkináz. Tento proces vede k produkci různých cytokinů a růstových faktorů (48). Důležitým faktorem virulence je rovněž VacA protein. VacA protein interaguje s receptory hostitelské buňky, což má za následek modifikaci endolyzosomálních funkcí, buněčnou vakuolizaci, apoptózu a inhibici některých imunitních mechanismů (5, 23). Všechny kmeny HP jsou nositelem vacA genu. VacA protein je však produkován zhruba u 50 % kmenů. Je to dáno tím, že jednotlivé kmeny vykazují rozdílnou strukturu vacA genu. Jsou známy alely s1 a s2 signální sekvence vacA a m1 a m2 střední části sekvence vacA. Za vysoce toxické jsou považovány kmeny genotypu s1 m1, které jsou spojovány s vysokým výskytem intestinálních metaplazií a gastritid (25). Dalšími faktory virulence jsou např. lipopolysacharidy, adheziny (babA1, babA2) a enzym ureáza kódovaný ureázovým genem C.
Po proniknutí HP do lamina propria sliznice hrají hlavní roli v imunitní odpovědi hostitele dendritické buňky a monocyty. Tyto buněčné elementy mají na svém povrchu receptory TLRs (Toll–like–receptors) (48). Vazbou receptorů na tyto buňky dochází k aktivaci NK buněk (natural killers) a Th1 imunitní odpovědi. Th1 imunitní odpověď je dominantní imunitní reakcí v patogenezi HP. Indukuje expresi IFN–γ. Po kontaktu s bakterií dochází k vyplavování prozánětlivých cytokinů TNF–α, IL–1ß, IL–8, 12, 18 (48).
Podíl Helicobacter pylori na karcinogenezi
Helicobacter pylori je řazen mezi karcinogeny I. typu dle IARC (34). Existují tři základní možné cesty karcinogeneze (35). Jednou z možností vzniku karcinogeneze je působení HP jako přímého mutagenu (24). Další možnou cestou karcinogeneze je imunitní inhibice T – buněk prostřednictvím vakuolizačního cytotoxinu (9). Je také zvažováno karcinogenní působení HP zvýšením hladin řady cytokinů a regulačních molekul. Zejména vzestup hladin EGF, TGF a NOS je spojován s vyšším výskytem žaludečních neoplazí a existuje předpoklad, že zvýšená exprese těchto molekul se podílí na orofaryngeální karcinogenezi (35). Práce Lukeše a spol. z roku 2007 ukazuje na základě imunohistochemického průkazu zvýšené hladiny eNOS, iNOS a kaspázy-3 u chronických zánětů a u tonzilárních karcinomů (11).
Metody průkazu Helicobacter pylori
V jednotlivých pracích, zabývajících se otázkou detekce HP, byly užity různé metody detekce HP infekce. Existují dva zásadní přístupy – invazivní a neinvazivní (63). K průkazu infekce v orofaryngu je nutné využít metod invazivních. Invazivní testy zahrnují odběr bioptického materiálu a jeho následné zpracování kultivací, PCR (polymerase chain reaction), RUT (rapid urease test), histopatologicky. Mezi neinvazivní testy patří UBT (urea breath test), detekce HP antigenů ve stolici, detekce protilátek v séru či v moči (22).
Kultivační průkaz je metodou se 100% specificitou, senzitivita však velmi závisí na řadě různých faktorů, mimo jiné i na zkušenostech dané laboratoře (65). Touto metodou byl detekován daný patogen řadou autorů (3, 7, 17, 41, 44, 47, 69). Kultivačním průkazem HP v ústní dutině se jako první ve své práci zabývali Krajden a spol. (31). Jednou z podmínek úspěšné kultivace je dostatečně dlouhá doba bez užívání antibiotických preparátů. Kultivace probíhá na speciálních agarových půdách s přidanými obohacovadly, vhodnými pro růst této bakterie (Columbia agar, Wilkins Chalgren agar atd.) (37). Hodnocení probíhá po třech až čtyřech dnech. Uvedená metoda je velmi časově náročná a může přinášet falešně negativní výsledky, neboť v orofaryngu se vyskytují i jiné bakteriální kmeny, které mohou růst HP inhibovat (26). Dále se předpokládá skutečnost, že HP přežívá v orofaryngu v tzv. kokoidních formách, které jsou velmi špatně kultivovatelné (8). Vzhledem k těmto skutečnostem je použití kultivačního průkazu v orofaryngu značně limitováno (18).
Ureázové testy patří mezi rychlé, levné a jednoduché detekční metody. Tato forma detekce HP byla užita v řadě studií (29, 54, 61). Jsou založeny na ureázové aktivitě HP (50), která spočívá v hydrolýze urey na oxid uhličitý a amonný iont. Koncentrace amonného iontu určuje pH, a tím vyvolává změnu barevného indikátoru (63). Mezi nejvíce užívané ureázové testy patří CLO test (Campylobacter–like–organism) a RUT test (Rapid Urease Test). Madani a spol. ve své práci ukazují významnou souvislost mezi pozitivitou RUT a histologickým průkazem HP (36). Užití těchto metod v orofaryngu je značně omezeno, protože v ústní dutině existují i jiné bakteriální kmeny produkující ureázu – Streptococcus spp., Haemophilus spp., Actinomyces spp. atd. Zvyšuje se tak pravděpodobnost falešně pozitivních výsledků (18).
Histopatologický průkaz HP se v současné praxi příliš neužívá. Jedná se o metodu, která může jako jediná detekovat léze související s HP infekcí (atrofie a buněčná metaplazie) (22). Vzorky k histopatologickému průkazu jsou fixovány v 10% formaldehydu. Tkáň je barvena nejčastěji metodou hematoxylin – eosin, Giemsa, Warthin Starry či Genta (51). V rámci histopatologických průkazů se rovněž využívá imunohistochemická detekce či elektronová mikroskopie. Na rozdíl od kultivace je imunohistochemický způsob detekce schopen zachytit i kokoidní formy HP. Elektronová mikroskopie je časově velmi náročná a není doposud součástí rutinních diagnostických postupů. Hodnocení histologických řezů závisí především na správně odebraném vzorku tkáně a na zkušenostech dané laboratoře rozpoznat morfologické rysy daného mikroba (37). Histopatologickým průkazem detekce HP infekce v orofaryngeální tkáni se zabývala řada studií (2, 6, 39, 62, 67). Na rozdíl od vzorků žaludeční sliznice jsou metody histopatologické detekce v orofaryngu značně limitovány přítomností velkého množství dalších bakteriálních kmenů (18).
Při posuzování možných falešně pozitivních a falešně negativních výsledků se z výše uvedených metod jeví jako nejcitlivější detekce HP infekce v oro/epifaryngeální tkáni prostřednictvím molekulárně diagnostických postupů. V současné době je nejrozšířenější metodou PCR (polymerázová řetězová reakce). Tato technika byla koncipována v roce 1983 Kary Mullisem v rámci řešení exponenciální amplifikace oligonukleotidů v beta - globinovém genu (45). Základním principem PCR je opakovaná řízená denaturace dvouřetězcové DNA a následná renaturace osamocených řetězců se specifickými oligonukleotidy, které jsou v reakční směsi v nadbytku. Amplifikace DNA probíhá v opakujících se cyklech, které mají tři kroky: denaturace, hybridizace a elongace. Denaturace probíhá při teplotě 95°C a spočívá v rozpadu vodíkových můstků spojujících vlákna DNA. Vzniká tak jednořetězcová DNA, neboli templát. Hybridizace (annealing) se uskutečňuje při teplotě 50 – 60 °C, spočívá v dosednutí primerů a rovněž vede k obnově dimerů DNA. Elongace je fází , kdy dochází polymerací k syntéze nového řetězce DNA komplementárního s templátem. Pro PCR se používají termostabilní DNA polymerázy, převážně Taq polymerasa. Průkaz HP v orofaryngu pomocí PCR metody je popsán v řadě prací (1, 6, 7, 14, 19, 66). Pro detekci HP je často používána detekce ureC genu pomocí 16S rRNA primeru. Identifikace tohoto genu však nevypovídá nic o virulenci mikroba. Ve většině publikovaných prací byly proto nejčastěji detekovány geny cagA a další geny ostrůvku patogenity, vacA (a jeho polymorfismy). Pomocí PCR lze také detekovat geny kódující adherenční proteiny – Bab A2, Sab A, či další geny důležité pro patogenitu – oipA, dupA, iceA (37). Všechny tyto geny určují virulenci HP. Nejčastěji využívanými systémy jsou klasická end-point PCR a PCR v reálném čase (real–time PCR). Real–time PCR je založena na měření množství produktu v průběhu amplifikace a v multiplexní aplikaci umožňuje provádět genotypizaci jednotlivých kmenů HP pomocí různě značených hybridizačních sond. End point PCR je klasickou PCR metodou a užívá se zejména k detekci cagA a vacA genů. Úspěšnost PCR metody v detekci HP v orofaryngeální lymfatické tkáni ukazuje graf 1.
Graf 1. Detekce Helicobacter pylori metodou PCR. 
V posledních třech letech byla publikována rovněž řada významných prací zabývajících se detekcí HP v žaludku prostřednictvím PCR metody. Espinoza a spol. se ve své práci zabývali detekcí glmM genu pomocí Novel – primeru (20). V roce 2008 se Kumar a spol. zabýval analýzou vacA genotypů a cagA genu PCR metodou (32). Naopak, detekcí babA2 a iceA genů u pacientů s benigní žaludeční diagnózou, se ve své práci věnoval Montealegre a spol. (40). PCR genotypizací HP u dětské populace v Gambii se v roce 2011 zabývali Secka a spol. (52). Je třeba zdůraznit, že senzitivita PCR metody je podstatně závislá na typu transportního média a rovněž na způsobu uchovávání vzorku do doby izolace nukleové kyseliny.
Graf 2. Přehled užitých metod k detekci Helicobacter pylori v ORL oblasti 
Helicobacter pylori v orofaryngu
Výskyt HP v orofaryngeální lymfatické tkáni a v ústní dutině je intenzivně studován v řadě prací (10, 14, 68, 29, 61, 6, 69, 30, 64). Přítomnost HP byla prokázána ve slinách a v zubním plaku (4, 7, 13, 15, 19, 28, 53, 57). Byl vysloven závěr, že ústní dutina může představovat extragastrický zdroj infekce HP. Význam tonzilární tkáně pro kolonizaci HP jako první zdůraznili Minocha a spol. (38.) Předpokládá se, že oro/epifaryngeální lymfatická tkáň je svými vlastnostmi velmi podobná té žaludeční a vytváří tak podmínky pro možnou existenci HP. V roce 2003 Cirak a spol. (14) prokázali v tonzilární tkáni Cag A pozitivní kmeny HP metodou PCR s použitím 16 S ribosomálního primeru. Stejný poznatek učinili o tři roky později Bulut a spol. (10). Yilmaz M. a spol. detekovali pomocí 23S ribosomálního primeru HP v adenoidní tkáni (68), Yilmaz T. a spol. dále pak detekovali v roce 2006 HP v tonzilární i adenoidní tkáni prostřednictvím 16S ribosomálního primeru (69). Khademi a spol. prokázali přítomnost HP v tonzilární tkáni metodou CLO testu (29). Tato metoda byla užita rovněž v roce 2001 k úspěšné detekcí HP v adenoidní tkáni (61). Ve studii Bitara a spol. byl zjištěn HP v adenoidní tkáni metodou RUT (rapid urease test) a histologickým průkazem (6, 7).
Někteří autoři se zabývali průkazem HP i ve středoušní tekutině (7, 68, 69). Rovněž byl srovnáván výskyt HP na povrchu a uvnitř tonzil (30). Práce Jelavice a spol. dokazuje prostřednictvím RUT, kultivace a UBT na skupině dětí z oblasti Bosny a Hercegoviny nezávislost přítomnosti HP infekce v tonzilární tkáni na socioekonomických faktorech daného prostředí (27). Práce dále dokládá, že tonzilární tkáň není důležitým rezervoárem infekce HP u dětí podstoupivších tonzilektomii. Vayisoglu a spol. se v roce 2008 zabývali vztahem chronické tonzilitidy ve vztahu k infekci HP. Zjistili pozitivitu HP ve dvou adenoidních vegetacích z celkového počtu 91 dětských pacientů pomocí RUT a ve dvou případech byl pozitivní rovněž imunohistochemický průkaz. Ve své práci zpochybňují funkci tonzilární tkáně jako extragastrického zdroje infekce HP a rovněž vyvracejí možnou souvislost chronické tonzilitidy s infekcí HP (64). Metodou RUT a imunohistochemickým průkazem daného mikroba v palatinálních tonzilách se též zabývali ve své práci Dagtekin – Ergür a spol. (16). Eyigor a spol. se v roce 2009 pokoušeli detekovat glm gen v tonzilární tkáni pomocí GJB2 primeru metodou PCR. V žádném vzorku tkáně tento gen nalezen nebyl, což vedlo k závěru, že tonzilární tkáň není extragastrickým zdrojem infekce HP (21). Jabbari Moghaddam a spol. ve své práci dokládají výskyt HP infekce v tonzilární tkáni pomocí metody RUT, kterou rovněž stavějí do pozice málo senzitivní metody pro detekci této infekce (39). V roce 2010 se zabývali detekcí HP infekce v tonzilární tkáni Vilarinho a spol. (66). Pomocí RUT a imunohistochemického půkazu detekovali daný patogen v tonzilární tkáni pěti dětských pacientů. Metody PCR a FISH (Fluorescence in situ hybridization) v dané práci pozitivní výsledky nepřinesly, což dle autorů rovněž vyvrací teorii tonzilární tkáně, jakožto extragastrického zdroje infekce HP. Souvislostí kokoidních forem HP v tonzilární tkáni a IgA nefropatií se ve svém výzkumu zabývali Kusano a spol. (33). Výstupy této práce ukazují na možnou souvislost onemocnění ledvin ve výskytu kokoidních forem HP. V roce 2011 se studiem přítomnosti HP v tonzilární tkáni zabývaly dvě práce - Toros a spol. pomocí metody RUT a histologického průkazu přítomnost HP v tonzilární tkáni neprokázali (60), Abdel Monem a spol. (1) publikovali prospektivní studii, ve které zachytili pozitivitu daného patogenu v tonzilární tkáni metodou RUT a rovněž metodou PCR, v rámci které detekovali ureC gen. U některých z dětí byly rovněž pozitivní hladiny IgG v séru.
Helicobacter pylori v oblasti nosohltanu
Možný příčinný vztah HP a extragastrointestinálních chorob je zkoumán od roku 1993. Oblast nosohltanu může být vystavena působení HP zvláště u nemocných s refluxní chorobou jícnu (RCHJ), zahrnující onemocnění vznikající na podkladě gastroezofageálního refluxu (GER), který je častý především v dětském věku. Při sledování výskytu HP v oblasti nosohltanu je třeba zvážit, které metody detekce HP umožňují průkaz agens s dostatečnou senzitivitou i specificitou. Předpoklad, že HP může kolonizovat tkáň adenoidních vegetací, se dosud nepodařilo jasně prokázat. V literatuře dosud chybí podrobnější údaje o působení infekce HP v oblasti nosohltanu zvláště v souvislosti ke vzniku adenoidní vegetace. Některé práce popírají teorii o trvalé kolonizaci HP v oro/epifaryngu, jiné ji naopak připouštějí. Jelavic a spol. neprokázali RUT metodou přítomnost HP ve vzorku adenoidní vegetace (27). Zatímco Skinner a spol. (55), Bayramicli a spol. (62) a Yilmaz a spol. (68) neprokázali přítomnost HP v žádném vzorku tkáně patrových mandlí či adenoidních vegetací, Unver a spol. (61) prokázali přítomnost HP pomocí CLO (Campylobacter-like organism) testu ve vzorcích adenoidních vegetací u 58 % osob. Cirak a spol. (14) prokázali přítomnost DNA HP ve vzorcích adenotonzilektomií pomocí PCR u 30 % vyšetřovaných osob. Bulut a spol. (10) prokázali přítomnost DNA HP pomocí PCR u 25 % adenoidních vegetací, z toho u více než poloviny byl potvrzen cagA gen. Z uvedených prací je možno konstatovat, že pro oblast nosohltanu u dětí je nejvhodnější PCR detekce, která zaručuje dostatečnou senzitivitu i specificitu.
Hyperplazie Waldeyerova okruhu je stimulována zatěžováním imunologického systému, opakovanými záněty horních dýchacích cest, ale i drážděním regurgitovaným žaludečním obsahem. Při aktivaci je povrch sliznice nosohltanu krytý větším či menším množstvím hlenu. Tyto podmínky mohou být velice příhodné pro přežívání, a tím i působení HP. Adenoidní vegetace mají poměrně značný klinický význam, především pak jako možný zdroj fokální infekce.
Vztah orofaryngeálního a žaludečního HP
Souvislost infekce HP v orofaryngu a v žaludku je intenzivně zkoumána. Většina publikovaných prací je zaměřena na pacienty se žaludečními obtížemi, případně s již prokázanou žaludeční infekcí HP. Několik publikovaných prací ukazuje na rozdílné kmeny mikroba v orofaryngu a v žaludku. Jako první se typizací kmenů HP v ústní dutině a žaludku věnovali Shames a spol. (1989). V 90. letech se publikované vědecké práce zabývaly především stanovením kmenů HP v supragingiválním nebo v subgingiválním dentálním plaku u pacientů s žaludeční symptomatologií. Pavlík a spol. v roce 2007 prováděli genotypizaci kmenů HP v orofaryngu s chronickou tonzilitidou a karcinomem orofaryngu. Svojí prací doložili odlišnost genotypů HP v orofaryngu od genotypů převážně detekovaných ve vzorcích žaludeční sliznice (46). Tato práce rovněž otevírá otázku existence kmenů HP v orofaryngu u pacientů bez žaludečního onemocnění. Dle Burgerse a spol. se HP může nacházet v ústní dutině, aniž by byl zároveň přítomen v žaludku (12). Rovněž práce Nártové a spol. upozorňuje na existenci HP v orofaryngu u pacientů bez žaludečního nálezu (42). Metaanalýza Qing–Hua Zou a spol. z roku 2011 ukazuje na významně vyšší prevalenci HP infekce v ústní dutině u pacientů s detekovaným HP v žaludku, ve srovnání s pacienty s negativním nálezem HP v žaludku (49).
DISKUSE
V současné době existuje řada publikací, jejichž cílem byla detekce HP v orofaryngeální tkáni. Metody detekce HP jsou invazivní a neinvazivní. V rámci jednotlivých prací byly užity různé detekční metody, zejména invazivní (tab. 1). Úspěšnost metod se liší v závislosti na typu zvolené metody a rovněž na typu tkáňového vzorku. Je třeba zdůraznit, že detekce HP v oblasti orofaryngu je značně limitována. Při použití histologie se setkáváme s problémem, který je představován výskytem jiných bakteriálních kmenů v orofaryngu a rovněž s velmi malou specificitou této metody. Z tabulky 1 je patrné, že v naprosté většině případů byl histologický průkaz mikroba neúspěšný (6, 60, 62). Falešně pozitivní výsledky mohou vykazovat metody RUT a CLO, které jsou založeny na barevné reakci substrátu s ureou. Při porovnání těchto dvou metod se jako úspěšnější jeví použití metody RUT. Tuto metodu použila ve své práci řada autorů (6, 7, 21, 64, 66) s pozitivními výstupy. Uvedené metody však v běžné praxi nejsou příliš užívány, zejména pro již zmíněné zvýšené riziko falešně pozitivních výsledků.
Tab. 1. Přehled užitých metod k detekci Helicobacter pylori v ORL oblasti 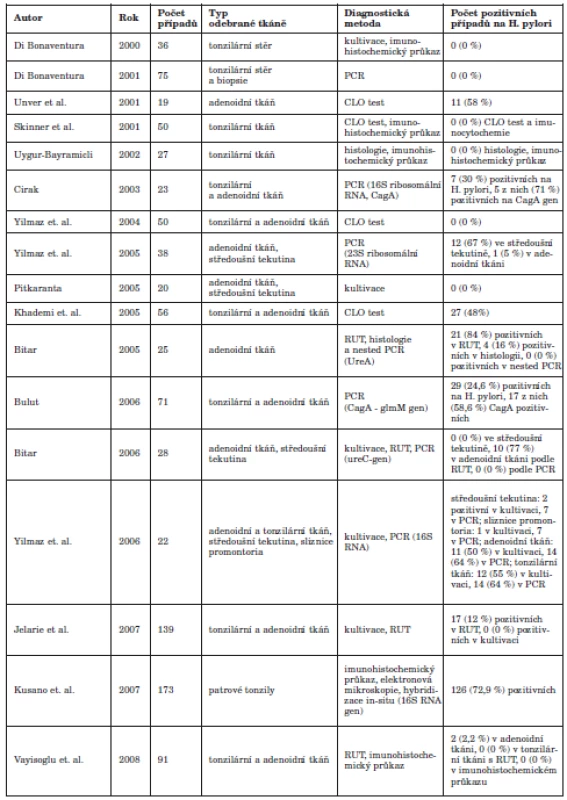
Za zlatý standard pro detekci HP v žaludku je považována kultivace. V ústní dutině je však její užití značně limitováno pro možnou inhibici HP jinými orálními druhy bakterií. Za vysoce specifickou a senzitivní detekční metodu pro orofaryngeální tkáň je považována PCR. V tabulce 2 jsou shrnuty výstupy recentních prací, jejichž autoři užili tuto metodu k detekci HP v orofaryngu. V posledních letech je využívána také real–time PCR, která představuje zlom v diagnostice HP, neboť umožňuje provádět genotypizaci HP přímo z tkáňových vzorků. PCR metoda je rezistentní vůči externím faktorům a je zatížena nejmenším rizikem falešně pozitivních či falešně negativních výsledků (35).
Tab. 2. Detekce Helicobacter pylori metodou PCR. 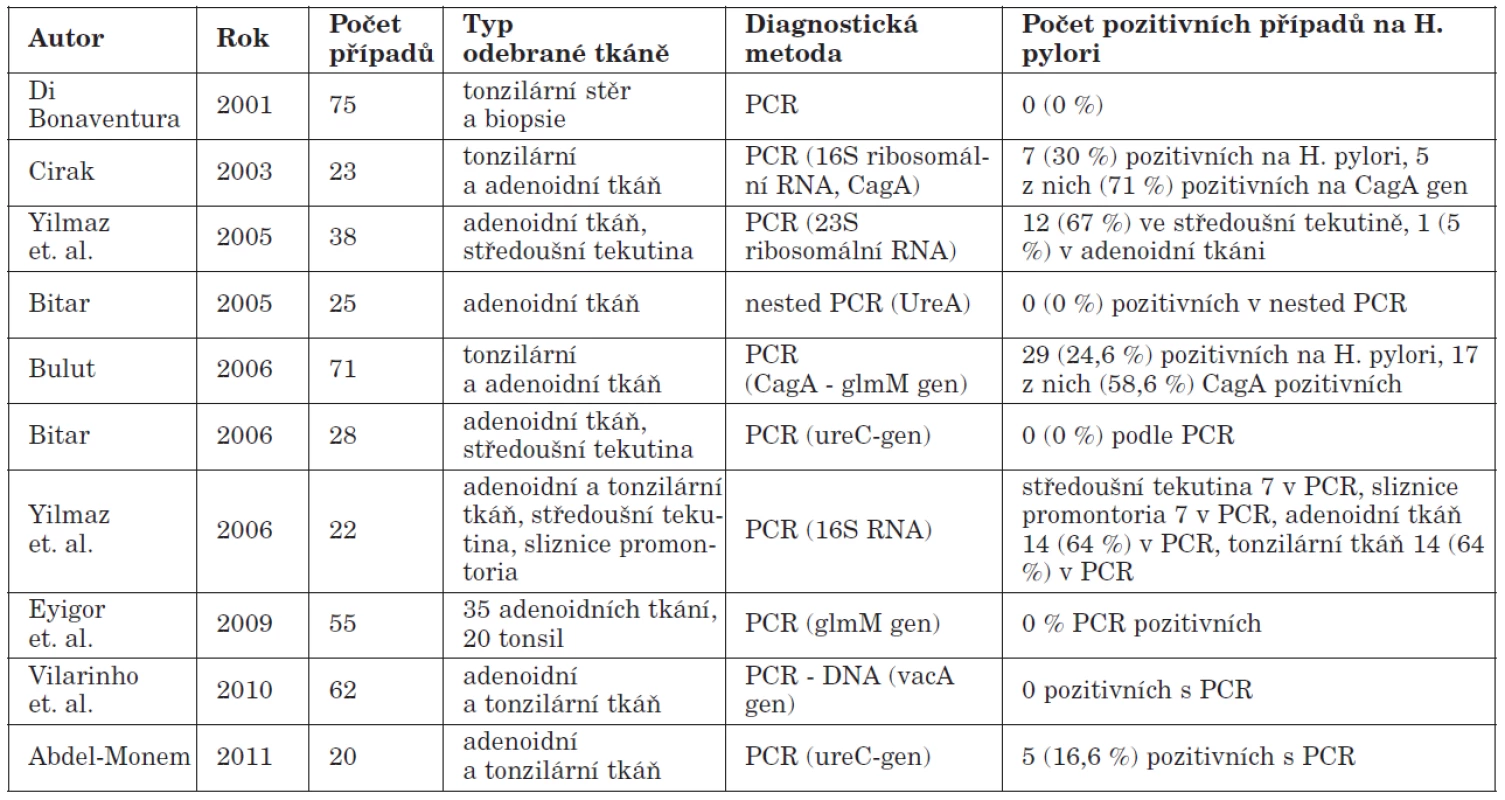
ZÁVĚR
Na základě výše uvedeného je možno učinit následující závěry:
- Při zpracování výsledků dosud publikovaných prací se zdá být pravděpodobné, že HP se může vyskytovat v lymfatické tkáni orofaryngu. Velké množství rozdílných detekčních metod použitých různými autory však vylučuje možnost vyvození jednoznačných závěrů.
- Jako metody s dostatečnou senzitivitou a specificitou se jeví PCR a real-time PCR.
- Význam Helicobacter pylori v oblasti orofaryngu není v současnosti ještě plně znám a popsán.
Práce vznikla za podpory projektu IGA NT 11523.
MUDr. Eva Nártová
Klinika ORL a chirurgie hlavy a krku
1. LF UK a FNM
V Úvalu 84
150 06 Praha 5
Zdroje
1. Abdel–Monem, M. H., Magdy, E. A., Nour, Y. A. et al.: Detection of Helicobacter pylori in adenolar tissue of children with chronic adenolitis using rapid urease test, PCR and blood serology: A prospective study. Int. J. Pediatr. Othorinolaryngol., 75, 2011, s. 568-572.
2. Akbayir, N., Basak, T., Seven, H. et al.: Investigation of Helicobacter pylori colonization in laryngeal neoplasia. Eur Arch Othorinolaryngol., 2005, 262, s. 170-172.
3. Allaker, R. P., Young, K. A., Hardie, J. M. et al.: Prevalence of Helicobacter pylori at oral and gastrointestinal sites in children: Evidence for possible oral – to – oral transmission. J. Med. Microbiol., 51, 2002, s. 312-317.
4. Assumpcao, M. B., Martins, L. C. et al.: Helicobacter pylori in dental plaque and stomach of patients from Northern Brazil. World J. Gastroenterol., 16, 2010, s. 3033-3039.
5. Backert, S., Selbach, M.: Role of type IV secretion in Helicobacter pylori pathogenesis. Cell Microbiol, 2008, 10, s. 1573–1581.
6. Bitar, A., Soweid A. et al.: Is Helicobacter really present in the adenoids of children? Eur Arch. Otorinolaryngol., 262, 2005, s. 987-992.
7. Bitar, M., Mahfouz, R., Soweid, A. et al.: Does Helicobacter pylori colonized the nasopharynx of children and contribute to their middle ear disease? Acta Otorinolaryngol, 126, 2006, s. 154-159.
8. Bode, G., Mauch, F., Malfertheiner, P.: The coccoid forms of Helicobacter pylori. Criteria for their viability. Epidemiol. Infect., 111, 1993, s. 483-490.
9. Boncristiano, M., Paccani, S. R., Barone, S. et al.: The Helicobacter pylori vacuolating toxin inhibits T cell activation by two independent mechanisms. J. Exp. Med., 198, 2003, s. 1887-1897.
10. Bulut,Y., Agacayak, A., Karlidag, T. et al.: Association of CagA+ Helicobacter pylori with adenolar hypertrophy. Tohoku J. Exp. Med., 209, 2006, 3, s. 229-233.
11. Bureš, J., Kopáčová, M., Koupil, I. et al.: Epidemiology of Helicobacter pylori infection in the Czech Republic. Helicobacter, 11, 2006, s. 56-65.
12. Bürgers, R., Schneider–Brachert, W., Reischl, U. et al.: Helicobacter pylori in human oral cavity and stomach. Eur J. Oral Sci., 2008, 116, s. 297-304.
13. Cellini, L., Grande, R., Artese, L., Marzio, L. : Detection of Helicobacter pylori in saliva and esophagus. New Microbiol., 33, 2010, s. 351-357.
14. Cirak, M. Y., Ozdek, A., Yilmaz, D. et al.: Detection of Helicobacter pylori and its CagA gene in and adenoid tissues by PCR. Arch. Otolaryngol Head Neck Surg., 129, 2003, s. 1225-1229.
15. Czesnikiewicz-Guzik, M., Bielanski, W., Guzik, T. J., Loster, B., Konturek, S. J.: Helicobacter pylori in the oral cavity and its implications in gastric infection, periodontal health, immunology and dyspepsia. J. Physiol. Pharmacol., 56, 2005, Suppl. 6, s. 77-89.
16. Dagtekin–Ergür, E. N., Eren, F., Ustün, M. B. et al.: Investigation of Helicobacter pylori colonization in pharyngeal and palatine s with rapid urease test and immunohistochemical analysis. Kulak Burun Bogaz Ihtis Derg., 18, 2008, s. 85-89.
17. Di Bonaventura, G., Catamo, G., Neri, M. et al.: Absence of Helicobacter pylori in lar swabs from dyspeptic patients. New Microbiol., 23, 2000, s. 445‑448.
18. Dowsett, S. A., Kowolik, M. J.: Oral Helicobacter pylori: Can we stomach it? Crit. Rev. Oral Biol. Med., 14, 2003, 3, s. 226-233.
19. Eskandari, A., Mahmoudpour, A., Abolfazli, N., Lafzi, A.: Detection of Helicobacter pylori using PCR in dental plaque of patients with and without gastritis. Med. Oral Patol. Oral Cir. Bucal, 15, 2010, s. 28-31.
20. Espinoza, M. G., Gonzalez, V. R., Morales, M. I. et al.: Detection of the glM Gene in Helicobacter pylori Isolates with a novel primer by PCR. S. J. Clin. Microbiol., 49, 2011, 4, s. 1650-1652.
21. Eyigor, M., Eyigor, H., Gultekin, B. et al: Detection of Helicobacter pylori in adenoler tissue specimens by rapid urease test and polymerase chain reaction. Eur Arch. Otorinolaryngol, 266, 2009, s. 1611-1613.
22. Guarner, J., Kalach, N., Elitsur, Y. et al.: Helicobacter pylori dignostic test in children: review of the literature from 1999 to 2009. Eur J. Pediatr., 169, 2010, s. 15-25.
23. Hatakeyama, M.: SagA of CagA in Helicobacter pylori pathogenesis. Curr. Opin. Microbiol. 11, 2008, s. 30-37.
24. Hatakeyama, M. : The role of Helicobacter pylori CagA in gastric carcinogenesis. Int. J. Hematol., 2006, 84, S. 304-308.
25. Höcker, M., Hohenberger, P.: Helicobacter pylori virulence factors – one part of a big picture. Lancet, 362, 2003, 2, s. 1231-1233.
26. Ishihara, K., Miura, T., Kimizuka, R. et al.: Oral bacterua inhibit Helicobacter pylori growth. FEMS Microbiol. Lett., 152, 1997, s. 355-361.
27. Jelavic, B., Bevanda, M., Ostojic, M. et al.: Lar colonization is unlikely to play important role in Helicobacter pylori infection in children. Int. J. Pediatr. Othorinolaryngol, 71, 2007, s. 585-590.
28. Karczewska, E., Konturek, J. E., Konturek, P. C. et al.: Oral cavity as apotential source of gastric reinfection by Helicobacter pylori. Dig. Dis. Sci., 47, 2002, s. 978-986.
29. Khademi, B., Imanieh, M. H.: Investigation of H. pylori colonization in adenolectomy specimens by means of rapid urease (CLO) test. Iran J. Med. Sci., 30, 2005, s. 138-140.
30. Khademi, B., Niknejad, N., Gandomi, B. ,Yeganeh, F.: Comparison of Helicobacter pylori colonization on the lar surface versus lar core tissue as determined by the CLO test. Ear Nose Throat, 86, 2007, 8, s. 498-501.
31. Krajden, S., Fuksa, M., Anderson, J. et al.: Examination of human stomach biopsies, saliva, and dental plaque for campylobacter pylori. J. Clin. Microbiol., 27, 1989, s. 1397-1398.
32. Kumar, S., Kumar, A., Dixit, V. K.: Direct detection and analysis of vacA genotypes and cagA gene of Helicobacter pylori from gastric biopsies by a novel multiplex polymerase chain reaction assay. Dian. Microbiol. Infect. Dis., 62, 2008, s. 366-373.
33. Kusano, K., Inokuchi, A., Fujimoto, K. et al.: Coccoid Helicobacter pylori exists in the palatines of patients with IgA nephrophathy. J. Gastroenterol., 45, 2010, s. 406-412.
34. Logan, R. P.: Helicobacter pylori and gastric cancer. Lancet, 344, 1994, s. 1078-1079.
35. Lukeš, P., Astl, J., Pavlík, E.et al.: Helicobacter pylori in lar and adenoid tissue and its possible role in oropharyngeal carcinogenesis. Folia Biol., 54, 2008, s. 33‑39.
36. Madami, S., Rabah, R., Tolia, V.: Diagnosis of Helicobacter pylori infection from antral biopsies in pediatric patients is urease test that reliable? Dig. Dis. Sci., 45, 2000, s. 1233-1237.
37. Mégraud, F., Lehours, P.: Helicobacter pylori detection and antimicrobial susceptibility testing. J. Clin. Microbiol., 20 2007, s. 280-322.
38. Minocha, A., Raczkowski, C. A., Richards, R. J. : Is a history of lectomy associated with a decreased risk of Helicobacter pylori infection? J. Clin. Gastroenterol., 25, 1997, s. 580 - 582.
39. Moghaddam, Y. J., Rafeey, M., Radfar, R.: Comparative assessment of Helicobacter pylori colonization in children lar tissues. Int. J. Pediatr. Othorinolaryngol, 73, 2009, s. 1199-1201.
40. Montealegre, O. M. C., Jaramillo, H. C. A., Montealegre, L. G. et al.: Molecular and histological detection of Helicobacter pylori and genotyping based on BabA2 and IceA inpatients with benign gastric pathologies. P. Rev. Chilena Infectol., 27, 2010, 2, s. 112-118.
41. Namavar, F., Roosendaal, R., Kuipers, E. J. et al.: Presence of Heliconcter pylori in the oral cavity, oesophagus, stomach and faeces of patients with gastritis. Eur J. Clin. Microbiol. Infect Dis., 14, 2001, s. 234.
42. Nártová, E., Lukeš, P., Pavlík, E, Šterzl, I., Astl, J., Betka, J.: Přítomnost Helicobacter pylori v orofaryngu a její vztah k žaludeční infekci. Otorinolaryng. a Foniat. /Prague/ 58, 2009, č. 2, s. 97-101.
43. Olivares, D., Gisbert, J. P. et al.: Factrors involved in the pathogenesis of Helicobacter pylori infection. Rev. Esp. Enferm. Dig., 98, 2006, 5, s. 374 -386.
44. Oshowo, A., Tunio, M., Gillam, D. et al.: Oral colonization is unlikely to play an important role in Helicobacter pylori infection. Br. J. Surg, 85, 1998, s. 850-852.
45. Pavlík, E., Pavlíková, A.: Molekulárně biologické techniky pro mikrobiologickou diagnostiku – část 11. Labor Aktuell, 0304.
46. Pavlík, E., Lukeš, P., Potužníková, B., Astl, J. et al.: Helicobacter pylori Isolated from patients with lar cancer or litis chronica could be of different gnotype compared to isolates from gastrointestinal tract. Folia Microbiol., 52, 2007, s. 91-94.
47. Pitkaranta, A., Kolho, K. L., Rautelin, H.: Helicobacter pylori in children who are prone to upper respiratory tract infections. Arch. Otolaryngol. Head Neck Surg., 131, 2005, s. 256-258.
48. Portal–Celhay, C., Perez–Perez, G.: Immune responses to Helicobacter pylori colonization: Mechanism and clinical outcomes. Clin. Sci.,110, 2006, 3, s. 305-314.
49. Qing–Hua, Z., Ren–Qing, L.: Helicobacter pylori in the oral cavity and gastric mucosa: a metaanalysis. J. Oral Pathol. Med., 40, 2011, s. 317-324.
50. Qureshi, H., Ahmed, W., Zuberi, S. et al.: Use of CLO test in the detection of Helicobacter pylori infection and its correlation with histologic gastritis. J. Pak.Med. Assoc., 42, 1992, s. 292-293.
51. Rotimi, O., Cairns, A., Gray, S. et al.: Histological identification of Helicobacter pylori: comparison of staining methods. J. Clin. Pathol., 53, 2000, s. 756-759.
52. Secka, O., Antonio, M., Tapgun, M. et al.: PCR – based genotyping of Helicobacter pylori of Gambian children and adults directly from biopsy specimens and bacterial cultures. Gut Pathos., 20, 2011, 3, s. 5.
53. Silva, D. G., Stevens, R. H., Macedo, J. M., Albano, R. M. et al.: Detection of cytotoxin genotypes of Helicobacter pylori in stomach, saliva and dental plaque. Arch. Oral. Biol., 54, 2009, s. 684-688.
54. Skinner, D. D., Denoya, C. D.: A simple DNA polymerase chain reaction method to locate and define orientation of specific sequences in cloned bacterial genomic fragments. Microbios., 75, 1993, s. 125-129.
55. Skinner, L. J., Winter, D. C., Curran, A. J. et al.: Helicobacter pylori and tonsillectomy. Clin. Otolaryngol. Allied Sci, 26, 2001, 6, s. 505-509.
56. Stromberg, E., Edebo, A., Svennerholm, A. M., Landholm, C.: Decreased epithelial cytokine response in the duodenal mucosa of HP infected duodenal ulcer patients. Clin. Dian. Lab. Immunol., 10, 2008, s. 116-124.
57. Suzuki, N., Yoneda, M., Naito, T.: Detection of Helicobacter pylori DNA in the saliva of patients complaining of halitosis. J. Med. Microbiol., 57, 2008, s. 1553-1559.
58. Tegtmeyer, N., Wessler, S., Backert, S.: Role of the cag-pathogenicity island encoded type IV secretion system in Helicobacter pylori pathogenesis. FEBS J., 278, 2011, s. 1190-1202.
59. Terio K. A., Munson L., Marker L. et al.: Comparison of Helicobacter spp. In Cheetahs (Acinonyx jubatus) with and without gastritis. J. Clin. Microbiol., 43, 2005, s. 229-234.
60. Toros, S. Z., Toros, A. B., Kaya, K. S. et al.: A study to detect Helicobacter pylori in adenolar tissue. Ear Nose Throat J., 90, 2011, s. 32.
61. Unver, S., Kubilay, U., Sezen, O. S., Coskuner, T.: Investigation of Helicobacter pylori colonization in adenolectomy specimens by means of CLO-test. Laryngoscope, 111, 2001, s. 2183-2186.
62. Uygur–Bayramicli, O., Yavuzer, D., Dabak, R. et al.: Helicobacter pylori colonization on tissue. Am. J. Gastroenterol., 97, 2002, s. 2470-2471.
63. Vaira, D., Holton, J., Menegatti, M. et al.: Review article: invasive and noninvasive test for Helicobacter pylori infection. Aliment Pharmacol. Ther., 14, 2000, s. 13-22.
64. Vayisoglu, Y., Ozcan, C., Polat, A. et al.: Does Helicobacter pylori play a role in the development of chronic adenolitis? Int. J. Pediatr. Othorinolaryngol, 72, 2008, s. 1497-1501.
65. Velapatino, B., Balgini, J., Gilman, R. H. et al.: Validation of string test for string test for diagnosis of Helicobacter pylori infections. J. Clin. Microbiol., 44, 2006, s. 976-980.
66. Vilarinho, S., Guimaraes, N. M., Ferreira, R. M. et al.: Helicobacter pylori colonization of the adenolar tissue: Fact or fiction? Int. J. Pediatr. Othorinolaryngol, 74, 2010, s. 807-811.
67. Vinette, K. M., Gibney, K. M., Proujansky R. et al.: Comparison of PCR and clinical laboratory tests for diagnosing Helicobacter pylori infection in pediatric patients. BMC. Microbiol., 2004, 4, s. 5.
68. Yilmaz, M., Kara, C. O., Kaleli, I., Demir, M., Tumkaya, F., Buke, A. S., Topuz, B.: Are tonsils a reservoir for Helicobacter pylori infection in children? Int. J. Pediatr. Otorhinolaryngol, 68, 2004, s. 307-310.
69. Yilmaz, T., Ceylan, M., Akyon, Y., Ozcakyr, O., Gursel, B.: Helicobacter pylori: A possible association with otitis media with effusion. Otolaryngol Head Neck Surg., 134, 2006, s. 772-777.
Štítky
Audiológia a foniatria Detská otorinolaryngológia Otorinolaryngológia
Článek Erythema multiforme v ORLČlánek Extranodální NK/T buněčný lymfom nazálního typu - neobvyklá příčina jednostranné nosní obstrukceČlánek Vyhlášení soutěže o nejlepší publikaci České společnosti ORL a CHHK za r. 2011 (Kutvirtova cena)
Článok vyšiel v časopiseOtorinolaryngologie a foniatrie
Najčítanejšie tento týždeň
2012 Číslo 2- fSCIG v reálnej klinickej praxi u pacientov s hematologickými malignitami
- Subkutánne vs. intravenózne imunoglobulíny u pacientov s CLL
- Facilitovaná subkutánna imunoglobulínová terapia u seniorov s imunodeficienciami v reálnej praxi
-
Všetky články tohto čísla
- Využití CT navigace v chirurgii hlavy
- Okamžité revize u pacientů s oboustrannou obrnou zvratných nervů po operaci štítné žlázy a příštítných tělísek
- Otázky související se zaváděním plošného screeningu sluchu v Moravskoslezském kraji
- Helicobacter pylori a jeho úloha v patogenezi a patologii orofaryngu a epifaryngu ve vztahu k ORL onemocněním
- Extranodální NK/T buněčný lymfom nazálního typu - neobvyklá příčina jednostranné nosní obstrukce
- Kurz Sanační a rekonstrukční chirurgie středního ucha
- Worskhop – velké slinné žlázy
- Vzpomínka na prim. MUDr. Arnošta Pellanta, CSc.
- Sekce lékařů lůžkových pracovišť
- Vyhlášení soutěže o nejlepší publikaci České společnosti ORL a CHHK za r. 2011 (Kutvirtova cena)
- V. W. Rawool: Hearing Conservation In Occupational, Recreational, Educational and Home Settings
- M. S. Godin: Rhinoplasty, Cases and Techniques
- Erythema multiforme v ORL
- Současný pohled na adenotomii a tonzilektomii v České republice (dotazníková studie)
- Postterapeutické hodnotenie priamej endoskopickej autofluorescencie a ej použitie v enežmente liečby rakoviny hrtana
- Otorinolaryngologie a foniatrie
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Erythema multiforme v ORL
- Extranodální NK/T buněčný lymfom nazálního typu - neobvyklá příčina jednostranné nosní obstrukce
- Současný pohled na adenotomii a tonzilektomii v České republice (dotazníková studie)
- Okamžité revize u pacientů s oboustrannou obrnou zvratných nervů po operaci štítné žlázy a příštítných tělísek
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy




