-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Komentár k vývoju konceptu prognostických faktorov chronickej lymfocytovej leukémie: Cesta od prognostických faktorov k prediktorom liečebnej odpovede
Commentary on Development of the Prognostic Factors Concept in Chronic Lymphocytic Leukaemia: The Route from Prognostic Factors to Therapy Response Predictors
Chronic lymphocytic leukaemia (CLL) is a lymphoproliferative disorder with variable clinical course. Determination of disease prognosis is based on the identification of different prognostic factors. The concept of CLL prognostic factors is still developing and has undergone several fundamental changes. Traditional (old) prognostic factors and staging systems are useful in describing the extent of the disease at any given moment, in determining clinical progression and in the identification of patients who need to start treatment. However, traditional prognostic factors are not sufficient for predicting a long‑term prognosis because they are not able to identify potentially aggressive forms of CLL in the early stages. Nevertheless, clinical staging systems maintain their importance and in contrast to other traditional factors also their independent prognostic role. Otherwise, traditional prognostic factors play the role of disease activity descriptors rather than the role of actual prognostic factors. CLL risk profile determination is based on the identification of so ‑ called new prognostic factors, the most relevant of which are chromosomal aberrations, TP53 gene mutations, mutational status of IgVH genes, ZAP ‑ 70 and CD38 expression. These factors are able to predict the prognosis already at the time of the initial diagnosis. In contrast to previous ideas, they are not incorporated into recommendations regarding indications for treatment. This is due to the risks associated with early treatment and the lack of data validated in prospective clinical trials demonstrating the justifiability of such procedure. In patients being treated, new prognostic factors may be useful for predicting the response to the therapy and some of them may directly influence the choice of treatment regime. New CLL treatment modalities have also raised the question of their influence on the prognostic and predictive power of new prognostic factors.
Key words:
chronic lymphocytic leukemia – treatment outcome – prognosis – prognostic factors
Autoři: T. Balhárek 1; M. Barthová 1; P. Szépe 1; J. Marcinek 1; T. Burjanivová 2; L. Plank 1
Působiště autorů: Ústav patologickej anatómie a Konzultačné centrum bioptickej diagnostiky ochorení krvotvorby JLF UK a MFN, Martin, Slovenská republika 1; Ústav molekulovej biológie JLF UK, Vrútky, Slovenská republika 2
Vyšlo v časopise: Klin Onkol 2009; 22(6): 254-263
Kategorie: Přehledy
Souhrn
Chronická lymfocytová leukémia (CLL) je lymfoproliferatívne ochorenie s variabilným klinickým priebehom. Určenie prognózy ochorenia je založené na identifikácii rôznych prognostických faktorov. Koncept prognostických faktorov CLL sa neustále vyvíja a prešiel niekoľkými zásadnými zmenami. Klasické (staré) faktory a stagingové systémy opisujú rozsah ochorenia v danom momente, determinujú klinickú progresiu a identifikujú pacientov, ktorí vyžadujú liečbu. Nie sú však vhodné na paušálne určovanie dlhodobej prognózy, pretože nie sú schopné identifikovať potenciálne agresívne formy CLL vo včasnom štádiu. Stagingové systémy si aj napriek tomu naďalej zachovávajú svoj význam a na rozdiel od väčšiny ostatných klasických faktorov aj svoju nezávislosť. Inak klasické faktory plnia skôr úlohu deskriptorov stavu a aktivity ochorenia než úlohu skutočných prognostických faktorov. Určenie rizikového profilu CLL je založené na identifikácii tzv. nových prognostických faktorov, z ktorých najvýznamnejšími sú chromozómové aberácie, mutácie TP53 génu, mutačný stav IgVH génov a expresia ZAP ‑ 70 a CD38. Tieto faktory umožňujú predikovať prognózu ochorenia v zásade už v čase diagnózy. V kontraste k pôvodným predstavám sa však neuplatňujú pri rozhodovaní o zahájení liečby. Dôvodom sú riziká včasnej liečby a nedostatok klinicky validizovaných dát dokazujúcich opodstatnenosť takéhoto konania. U liečených pacientov sa však nové prognostické faktory môžu uplatniť ako prediktory odpovede na liečbu, pričom niektoré z nich môžu priamo ovplyvniť výber konkrétnej liečebnej schémy. V súvislosti s novými modalitami liečby CLL sa taktiež otvára otázka ich vplyvu na prognosticko‑prediktívnu silu nových prognostických faktorov.
Kľúčové slová:
chronická lymfocytová leukémia – odpoveď na liečbu – prognóza – prognostické faktoryÚvod
Chronická lymfocytová leukémia (CLL) je leukemický B NHL, ktorý vzniká malígnou transformáciou periférnych pamäťových antigén skúsených a aktivovaných B lymfocytov [1–2]. CLL je známa ako heterogénne ochorenie s variabilným priebehom a prognózou. Klinická variabilita CLL vyplýva z jej biologickej nehomogénnosti, ktorú je možné rozpoznať tak na genetickej, ako aj fenotypovej a morfologickej úrovni. Analýza profilu génovej expresie však potvrdila, že ide o jedno ochorenie [2]. Štúdium fenoménu biologickej heterogenity CLL prinieslo poznatky o mnohých parametroch, z ktorých viaceré korelujú, resp. korelovali s klinickým priebehom ochorenia, a preto sú využiteľné ako tzv. prognostické faktory. Záujem o prognostické faktory CLL vyplýva zo snahy individualizovať prístup k pacientovi a zohľadniť ho aj v liečbe. Je umocnený absenciou kuratívnej liečby CLL, variabilnou aktivitou a klinickým priebehom ochorenia, ako aj používaním rôznych terapeutických schém s rozdielnou účinnosťou a komplikáciami. Podľa pôvodných predstáv sa znalosť rizikového profilu determinovaného prognostickými faktormi mala stať jedným z rozhodujúcich kritérií pre manažment liečby CLL.
Keďže prognóza CLL závisí od vlastností pacienta, nádoru a liečby, možno aj prognostické faktory rozdeliť na faktory 1) vo vzťahu k pacientovi, 2) vo vzťahu k nádoru (k jeho biológii, veľkosti nádorovej masy a kinetike) a 3) vo vzťahu k liečbe. Koncom 90. rokov 20. storočia sa pozornosť upriamila na štúdium molekulovo biologických a genetických vlastností CLL. Dovtedy známe faktory sa začali označovať ako klasické (staré, resp. klinické) a molekulové markery, počínajúc mutačným stavom génov kódujúcich variabilné oblasti ťažkých reťazcov imunoglobulínov (IgVH gény), sa začali označovať ako nové (moderné, resp. molekulové). Extenzívny záujem o CLL a prognostické faktory viedol k neúmernému nárastu počtu opísaných prognostických markerov, pričom tento trend pokračuje dodnes. Vzniklo tak značne nespojité spektrum markerov, v ktorom sa dnes už pomerne ťažko orientuje. Pritom len časť známych faktorov je skutočne klinicky relevantná. Zvyšnú časť tvoria faktory, ktoré sú buď nedostatočne preskúmané, sporné, obtiažne reprodukovateľné, alebo dokonca klinicky irelevantné [3–4]. Okrem toho zohľadňovanie väčšieho počtu prognostických faktorov je v praxi nepraktické až nemožné. Nárast počtu prognostických faktorov otvára otázku ich vzájomnej korelácie a v prípade ich diskordancie aj otázku, ktorý z týchto faktorov je významnejší. Hlbšie poznanie molekulovej podstaty ochorenia, progres v diagnostike, väčšinový podiel pacientov diagnostikovaných v asymptomatickom štádiu a nové možnosti liečby v súčasnosti nútia zásadne prehodnotiť význam doposiaľ známych prognostických faktorov [3–5]. V dôsledku toho prešiel koncept prognostických faktorov CLL za posledné obdobie zásadným vývojom (obr. 1).
Obr. 1. Vývoj konceptu prognostických faktorov CLL. 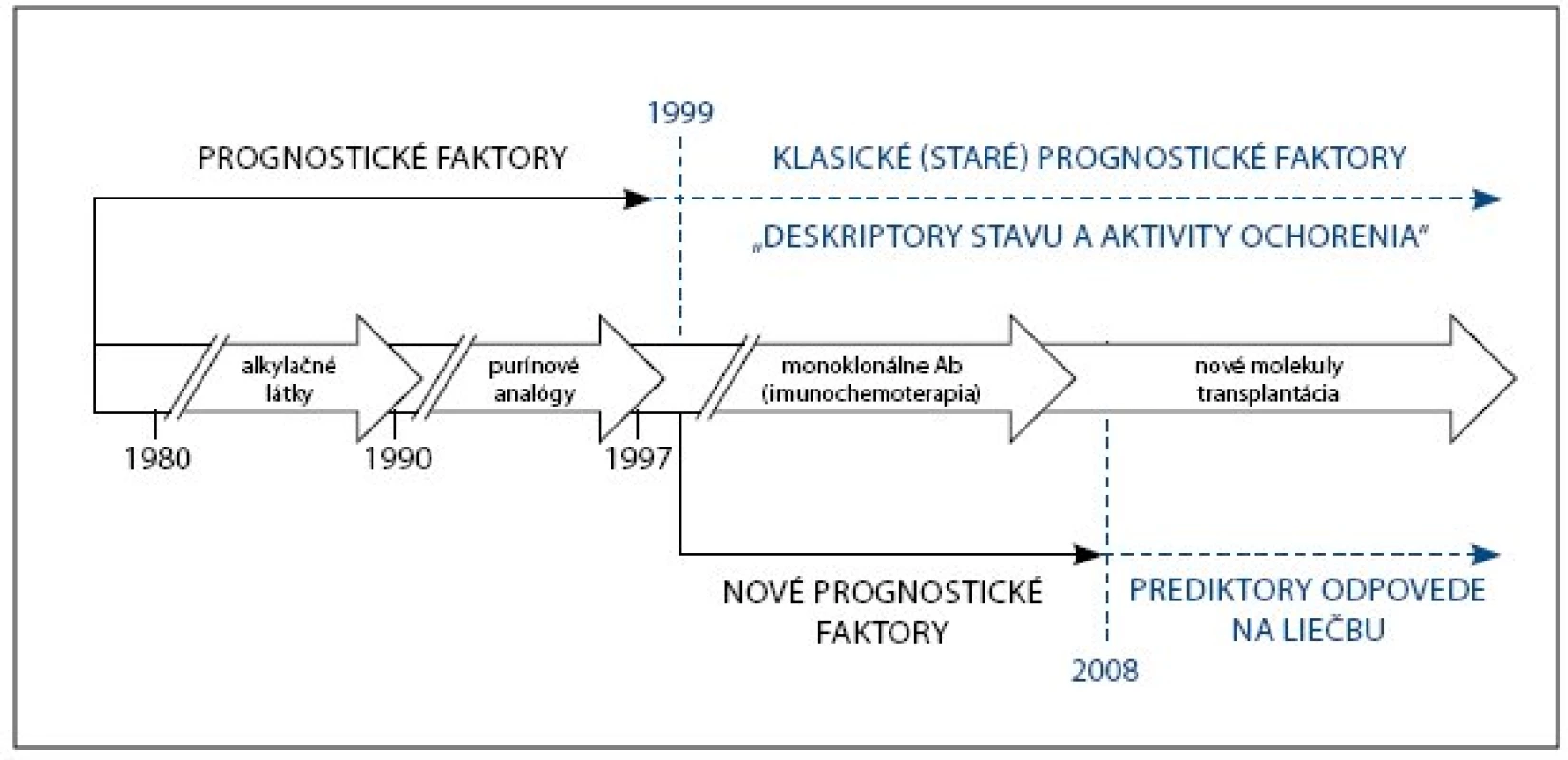
Stagingové systémy
V rokoch 1975 a 1977 boli do praxe implementované klinické stagingové systémy, resp. neskôr ich modifikácie (Binet A C, Rai 0–IV) [6–7]. Stagingové systémy si odvtedy aj napriek určitým limitom zachovávajú status základného klinicko prognostického parametra, ktorý je navyše rozhodujúci pre zahájenie liečby. Stagingové systémy opisujú aktuálny stav ochorenia pomocou jednoduchých parametrov identifikovateľných fyzikálnym vyšetrením a analýzou krvného obrazu. Nepochybnou výhodou stagingových systémov je ich ľahká identifikovateľnosť a reproducibilita. Tým, že vyjadrujú pokročilosť ochorenia, zákonite vypovedajú aj o prežívaní a prognóze pacientov. V pôvodných štúdiách si stagingové systémy túto vlastnosť zachovávali aj bez ohľadu na aplikovanú liečbu [6–7]. Ukazuje sa, že nezávislú výpovednú hodnotu si zachovávajú aj dnes, a to aj pri porovnaní s novými prognostickými faktormi. Pokročilejšie štádium sa totiž zákonite spája s horšou prognózou a kratším prežívaním pacientov. Existuje však predpoklad, že by moderná a efektívna liečba CLL mohla prekonať prognostický význam stagingových systémov, resp. by mohla oslabiť ich vplyv [5]. Nevýhodou stagingových systémov je ich statickosť a prognostická nehomogénnosť jednotlivých štádií. Stagingové systémy totiž nie sú schopné diskriminovať potenciálne indolentné a agresívne (progresívne) formy CLL vo včasnom štádiu ochorenia, čo je pri väčšinovom podieli tejto skupiny pacientov (70–80%) závažný nedostatok [8]. Taktiež nezohľadňujú mechanizmus vzniku niektorých komplikácií (napr. cytopénií) a nie sú schopné predikovať odpoveď na liečbu. Práve tieto nedostatky klinického stagingu mali byť podľa pôvodných predstáv saturované inkorporáciou ďalších prognostických faktorov do indikačných kritérií.
Staré (klasické) prognostické faktory
Identifikácia klinickej progresie je založená na analýze parametrov, ktoré reflektujú aktuálny stav a aktivitu ochorenia. Patria sem periférna lymfocytóza, zdvojovací čas lymfocytov (LDT), typ infiltrácie kostnej drene (KD), rozsah infiltrácie KD v biopsii alebo aspiráte, periférne cytopénie, rozsah lymfadenopatie (LAP), prítomnosť hepatosplenomegálie, hypogamaglobulinémia a sérové markery, ako je napr. laktátdehydrogenáza (LDH), β2-mikroglobulín (β2-MG), sérová tymidínkináza (sTK) a solubilný CD23 (sCD23). Stagingové systémy a spomenuté parametre patria s výnimkou sérových markerov do skupiny tzv. klasických (resp. starých) prognostických faktorov. Sérové markery sa síce zvyknú zaraďovať do skupiny nových prognostických parametrov, ale vo svojej podstate sú to „staronové“ faktory súvisiace s kinetikou a veľkosťou nádorovej masy. Okrem toho pri niektorých z nich (napr. sTK alebo sCD23) nie sú jednoznačne definované hodnoty, pri ktorých má byť marker považovaný za prognosticky nepriaznivý.
Osobitné postavenie medzi klasickými faktormi má cytomorfológia nádorových buniek v náteroch periférnej krvi alebo kostnej drene. Ešte v kontexte Francúzsko americko britskej (FAB) klasifikácie (1989), ktorá zaviedla pojem typickej a atypickej CLL [9], je známe, že zvýšený podiel atypických elementov (prolymfocytov, veľkých lymfocytov, paraimunoblastov, buniek s naštiepenými jadrami a pod.) koreluje s horšou prognózou. Prognostický význam atypickej cytomorfológie CLL v náteroch pripomína aj recentná SZO klasifikácia nádorov hemopoetického a lymfoidného tkaniva z roku 2008 [10]. Ďalšia subtypizácia atypickej CLL na variant so zvýšeným podielom prolymfocytov (CLL/PL) a pleomorfnú CLL, tak ako ich definovala FAB klasifikácia, však už nie je aktuálna. Okrem toho zvýšený podiel prolymfocytov a paraimunoblastov netreba chápať len ako znak morfologicky atypických variantov CLL, ale treba si uvedomiť aj ich možnú súvislosť so zvýšenou rastovou (proliferačnou) aktivitou nádoru, alebo dokonca s počínajúcou vysokomalígnou transformáciou. Otvorenou otázkou ostáva vzťah cytomorfológie v náteroch a histocytomorfológie v tkanivových rezoch KD a lymfatických uzlín (LU), aj keď bioptické vyšetrenie nie je pre diagnostiku CLL potrebné. Medzi atypickou cytomorfológiou v náteroch a biopsii KD pravdepodobne existuje určitá paralela. Ukazuje sa, že morfológia infiltrátov KD má nielen význam faktora reflektujúceho aktuálny stav ochorenia (v zmysle typ a rozsah infiltrácie KD, stav reziduálnej krvotvorby), ale môže reflektovať aj stav, resp. vplyv niektorých nových prognostických faktorov (napr. del17p, del11q, ZAP 70 alebo IgVH). Prognostický význam morfologickej variability CLL v tkanive LU ostáva na rozdiel od KD nejasný, v mnohých prípadoch sa dokonca javí ako kontroverzný. Plazmocytoidná diferenciácia buniek CLL podľa našich výsledkov nemá prognostický význam, neovplyvňuje čas do zahájenia liečby a ani prežívanie pacientov po liečbe.
Väčšina klasických faktorov opisuje aktivitu ochorenia, resp. s ňou súvisí. Klasické faktory sa teda uplatňujú ako deskriptory aktuálneho stavu ochorenia, ktoré logicky korelujú, resp. v pôvodných štúdiách korelovali aj s prežívaním pacientov. Nepochybnou výhodou klasických faktorov je ich jednoduchá identifikovateľnosť a reprodukovateľnosť. Ich prognostický význam a najmä miera využiteľnosti pri voľbe liečebnej stratégie vo včasnom stádiu ochorenia sú však značne limitované. Treba si uvedomiť, že prognostický význam klasických faktorov bol verifikovaný pomerne dávno, a to väčšinou len univariantnými analýzami. V multivariantných analýzach si tieto parametre spravidla nezachovávajú nezávislosť a aplikovaná liečba významne znižuje ich prognostickú významnosť. Okrem toho väčšina klasických faktorov bola analyzovaná v 80. a 90. rokoch 20. storočia, teda v ére, kedy boli pilierom liečby CLL alkylačné látky. V štúdiách analyzujúcich novú a efektívnejšiu liečbu CLL (fludarabín, rituximab, alemtuzumab, transplantácie) už tieto faktory neboli tak intenzívne sledované. Preto u viacerých z nich nie sú k dispozícii recentné údaje, ako sa zmenil ich význam v kontexte novej terapie [8]. Aj z toho dôvodu klasické faktory s výnimkou stagingových systémov ustúpili do úzadia. Úloha klasických faktorov býva častokrát vnímaná skepticky a ich význam býva nezriedka neprimerane podceňovaný.
Nové prognostické faktory
Stav IgVH génov
Obdobie od konca 90. rokov 20. storočia možno považovať za éru tzv. nových (moderných, resp. molekulových) prognostických faktorov. Kľúčovým novým prognostickým faktorom sa stal mutačný stav génov kódujúcich variabilné oblasti génov pre ťažké reťazce imunoglobulínov (IgVH status). Homológia vo > 98% sekvencií, tj. nemutovaný stav IgVH génov (UM IgVH), koreluje s horšou prognózou a kratším prežívaním. Naopak prítomnosť somatických mutácií v ≥ 2% sekvencií, tj. mutovaný stav IgVH génov (M IgVH), je považovaný za prognosticky priaznivý, definujúci potenciálne indolentnú formu CLL [11–12].
Pozornosť sa následne zamerala na nové prognostické faktory, ktoré sa správali ako nezávislé prediktory biologických vlastností ochorenia a umožňovali identifikovať potenciálne agresívne formy CLL už vo včasnom štádiu. V súvislosti s tým sa objavili úvahy o využití nových prognostických faktorov v liečbe CLL. Stav IgVH génov je síce základným a nezávislým molekulovým prognostickým faktorom, ktorý navyše ostáva stabilný v priebehu ochorenia, ale platí preň tradičný mýtus o nevhodnosti pre rutinnú prax z dôvodu metodologickej náročnosti analýzy. Preto celkom logicky nasledovali snahy nahradiť tento parameter inými faktormi, ktorých analýza by bola jednoduchšia, a teda aj dostupnejšia pre praktické využitie.
Odvtedy začal počet nových prognostických faktorov excesívne narastať, čo spôsobilo značný chaos a frustráciu. Okrem toho vysoký počet prognostických faktorov je pre klinickú prax nežiadúci. Klinické štúdie pritom ukazujú, že skupinu nových prognostických faktorov je možné zásadne zredukovať na relatívne nízky počet nezávislých, potenciálne využiteľných parametrov, resp. skupín parametrov: mutačný stav IgVH génov, pričom za samostatný nezávislý faktor sa považuje expresia génov oblasti VH3-21 [13]; expresia CD38; expresia ZAP 70; chromozómové abnormality (del17p, del11q, del6q, trizómia 12 a del13q) a mutácie génu TP53. Ako ďalšia skupina prakticky využiteľných prognostických faktorov sa javia aj vybrané sérové a solubilné markery, ako sú β2-MG, sTK a sCD23.
V poslednom období narastá množstvo poznatkov o význame krátkych nekódujúcich molekúl RNA (microRNA), ktoré sa zúčastňujú na regulácii génovej expresie. Ukazuje sa, že microRNA (napr. miR 15a, miR 16-1, miR 34a, miR 29c) sa pravdepodobne uplatňujú nielen v patogenéze CLL, ale možno ich využiť aj pri rizikovej subtypizácii CLL, resp. pri objasňovaní niektorých jej vlastností (napr. refraktérnosti na liečbu) [14]. Vychádzajúc z poznania reálneho stavu vyšetrovania nových prognostických faktorov u slovenských pacientov sme sa v nasledovnom prehľade zamerali len na tie faktory, ktorých diagnostika bola štandardizovaná a ich vyšetrenie je rutinne dostupné pre relevantnú časť našich pacientov s CLL.
Expresia CD38
Expresia CD38 bola považovaná za prvý faktor, ktorý mal nahradiť analýzu IgVHgénov. Expresia CD38 v pôvodných štúdiách korelovala s kratším prežívaním, horšou prognózou, kratším intervalom bez liečby a horšou odpoveďou na liečbu [15]. Za klinicky relevantnú mieru expresie je dnes považovaná arbitrárne štatisticky determinovaná hodnota ≥ 30% detegovaná prietokovou cytometriou. Expresia CD38 síce koreluje so stavom IgVH génov, ale táto korelácia nie je absolútna a diskordantné prípady tvoria až 30% [16]. Diskordancia sa vyskytuje tak v prípadoch so stabilným, ako aj progresívnym ochorením. CD38 teda nie je náhradným, ale samostatným nezávislým prognostickým faktorom. Bežne sa uvádza, že v neprospech praktickej využiteľnosti CD38 svedčí nestabilita expresie CD38 v priebehu ochorenia. Podľa literárnych údajov sa bimodalita, tj. zmena CD38– na CD38+, a dokonca CD38+ na CD38–, vyskytuje asi v 10–25% prípadov CLL [17]. Viaceré nedávne štúdie však ukázali, že variabilita expresie CD38 je v skutočnosti nižšia, než sa pôvodne predpokladalo. Avšak je známe, že počet CD38+ buniek v nádorovom klone narastá v súvislosti s aplikovanou chemoterapiou. Niektoré štúdie taktiež poukázali na neschopnosť ≥ 30% expresie CD38 predikovať prežívanie alebo potrebu liečby vo včasnom štádiu alebo u mladších pacientov [15]. Dokonca bola spochybnená aj nutnosť arbitrárnej hodnoty ≥ 30% a objavil sa názor, že samotná prítomnosť CD38+ buniek v leukemickom klone, bez ohľadu na jeho veľkosť, identifikuje progresívne ochorenie [18]. Nakoniec treba konštatovať, že znak CD38 sa nikdy nestal a pravdepodobne sa už ani nestane všeobecne akceptovaným prognostickým faktorom.
Expresia ZAP 70
Ďalším parametrom, ktorý mal pôvodne nahradiť IgVH, bola expresia ZAP 70 proteínu. Gén kódujúci ZAP 70 totiž patrí do skupiny génov, v ktorých expresii sa prípady CLL s mutovanými a nemutovanými IgVH génmi jednoznačne odlišujú [2]. Ide o 70 kDa ζ(zeta) reťazec tyrozínovej kinázy asociovanej s CD3-receptorom, ktorý sa uplatňuje v signalizácii T lymfocytov a NK buniek. ZAP 70 je exprimovaný v rôznej miere aj B lymfocytmi a nádorovými bunkami viacerých typov B NHL, vrátane CLL. Expresia ZAP 70 pritom koreluje s horšou prognózou a kratším prežívaním pacientov s CLL. Viaceré štúdie potvrdili silnú koreláciu medzi expresiou ZAP 70 a stavom IgVH génov. Táto korelácia však nie je absolútna. V závislosti od výberu pacientov a použitej metódy detekcie sa podiel diskordantných prípadov pohybuje od 8% do 25% [19–21]. Korelácia medzi IgVH a ZAP 70 je zjavne vyššia než korelácia medzi IgVH a CD38. Existencia IgVH/ZAP 70 diskordantných prípadov potvrdzuje, že ZAP 70 je podobne ako CD38 taktiež nezávislým prognostickým parametrom. Expresia ZAP 70 je v predikcii času do progresie dokonca lepším parametrom než samotný IgVH status [20,22]. ZAP 70 a CD38 navzájom nekorelujú, preto sa uvádza, že v kombinácii poskytujú komplementárnu prognostickú informáciu. K výhodám ZAP 70 ako prognostického faktora patrí relatívna stabilita, aj keď už sa objavilo niekoľko prác dokumentujúcich kategorickú zmenu expresie v priebehu ochorenia. Tá zvyčajne nepresahuje 10% a býva zriedkavá v skupine s nízkou expresiou ZAP 70, teda zmena z negativity na pozitivitu je veľmi zriedkavá [23]. Za prognosticky relevantnú hranicu pozitivity sa dnes považuje prietokovo cytometricky stanovená expresia v ≥ 20% buniek CLL. Táto hodnota bola rovnako ako v prípade CD38 určená štatisticky, nie biologicky. Prietokovo cytometrická analýza expresie má svoje úskalia, najmä pokiaľ ide o nastavenie izotypovej kontroly. Stav ZAP 70 je však možné vyšetriť aj inými metódami, a to imunohistochemicky v tkanivových rezoch alebo imunocytochemicky v náteroch, Western blottingom alebo na úrovni mRNA kvantitatívnou RT PCR. Pri imunohistochemickej detekcii sa expresia ZAP 70 nekvantifikuje, ale skóruje, ako negatívna (0), slabo pozitívna (1+) a silno pozitívna (2+). Význam imunohistochemickej detekcie ZAP 70 je ešte nutné verifikovať ďalšími štúdiami. ZAP 70 pritom nie je len dôležitým prognostickým faktorom, ale inhibícia jej kinázovej aktivity sa javí aj ako potenciálny molekulový cieľ cielenej liečby.
Chromozómové abnormality a mutácie TP53 génu
Metódou fluorescenčnej in situ hybridizácie (FISH) možno v 80–85% neliečených prípadov CLL dokázať prítomnosť chromozómových abnormalít, pričom v 70–75% prípadov ide o niektorú z abnormalít del(11q22–3), del(13q14), del(17p13), trizómia 12 a del(6q21) [24–25]. Tieto abnormality sa vyskytujú samostatne alebo v kombinácii. Cut off hodnoty pozitivity sa pri vyšetrení metódou interfázovej FISH pohybujú v intervale 5–10% pre delécie a 1–4% pre trizómiu 12. Tieto hodnoty určujú, od akého podielu je nález cytogenetickej abnormality považovaný za patologický, ale nie sú totožné s hodnotami definujúcimi biologický efekt príslušnej abnormality. Napríklad prognosticky najvýznamnejšia abnormalita del17p je klinicky relevantná až vtedy, ak abnormálny subklon tvorí prinajmenej 20% leukemickej populácie [26].
Význam prognosticky najnepriaznivejšej aberácie del17p súvisí s lokalizáciou génu TP53 na krátkom ramienku chromozómu 17. Del17p predikuje extrémne zlú prognózu pacientov s CLL a je známa jej asociácia aj s ďalšími negatívnymi klinickými vlastnosťami a prejavmi ochorenia. Prípady s del17p častejšie charakterizuje atypická morfológia a vyšší počet prolymfocytov. Býva asociovaná s častejším výskytom splenomegálie, extenzívnej LAP, B symptómami, difúznou infiltráciou KD, anémiou a trombocytopéniou [24]. Väčšinou (> 80%) sa vyskytuje u pacientov s nemutovanými IgVH génmi [25]. Zvyčajne ide o monoalelickú deléciu, pričom táto býva v časti prípadov sprevádzaná mutáciami a stratou funkcie homológnej alely TP53 génu [27]. Pritom mutácie TP53 génu sa vyskytujú aj samostatne (tj. bez asociácie s del17p), a to asi v 4–5% (resp. menej ako 10% u neselektovaných neliečených pacientov s CLL). Viacerými štúdiami bolo potvrdené, že mutácie TP53 génu sú nezávislým prognostickým faktorom, ktorý je podobne ako del17p asociovaný s kratším prežívaním, horšou odpoveďou na liečbu, rýchlejšou progresiou, komplexnými abnormalitami karyotypu a chemorezistenciou [28–30]. Dysfunkcia p53 proteínu teda môže byť dôsledkom štrukturálnych (delécia) alebo funkčných (mutácie) zmien TP53 génu. V dôsledku defektu apoptózy u týchto pacientov zlyháva liečba alkylačnými látkami a purínovými analógmi [31–32], objavili sa aj údaje o nižšej účinnosti rituximabu [33]. Strata funkcie p53 v dôsledku del17p a/alebo mutácie TP53 je známou príčinou refraktérnosti na liečbu, pričom inaktivácia p53 objasňuje jej príčinu takmer v 50% prípadov CLL rezistentnej na fludarabín [34]. Vo zvyšnej časti prípadov vzniká refraktérnosť na fludarabín na podklade iného mechanizmu. Svoju úlohu by tu mohli zohrávať aj microRNA.
Najsilnejší nepriaznivý efekt na prežívanie pacientov má bialelická inaktivácia TP53 v dôsledku simultánnej delécie jednej a mutácie druhej alely (del/mut) alebo mutácie oboch alel TP53 génu (mut/mut). Vzhľadom k tomu, že TP53 je recesívny tumor supresor, klinicky sa prejavujú aj monoalelické abnormality TP53. Efekt monoalelickej inaktivácie TP53 v dôsledku delécie alebo mutácie jednej alely je síce slabší než bialelickej, ale je stále signifikantne vyšší než prognostický efekt del11q a nemutovaného stavu IgVH génov [28,35]. Del17p a mutácie TP53 si v multivariantných štúdiách zachovávajú nezávislosť a postavenie najsilnejšieho negatívneho prognostického faktora. Anomálie v oblasti 17p a mutácie génu TP53 sú genetickými léziami, ktorých početnosť sa zvyšuje v dôsledku selekčného tlaku aplikovanej liečby. Ide o fenomén tzv. klonálnej selekcie, v dôsledku ktorého prežívajú bunky, ktoré získali určitú výhodu zabezpečujúcu ich odolnosť voči aplikovanej liečbe. Abnormality TP53 sú tiež jedným z molekulových mechanizmov vysokomalígnej transformácie CLL.
Druhou prognosticky významnou chromozómovou aberáciou je del11q. Prítomnosť tejto aberácie koreluje s kratším prežívaním pacientov, horšou odpoveďou na liečbu a kratším trvaním odpovede. Prežívanie pacientov s del11q je však lepšie ako pacientov s del17p. Pacientov s del11q častejšie charakterizuje masívna LAP a vyššie klinické štádium v čase diagnózy. Väčšinou ide o prípady s typickou morfológiou a častejšie s nemutovaným stavom IgVH génov [25]. Prognostický význam del11q závisí od veku pacientov. Pacienti s del11q mladší ako 55 rokov prežívajú signifikantne kratšie než pacienti bez tejto aberácie [36]. Vo väčšine štúdií si del11q zachovala nezávislú prognostickú funkciu. Objavili sa však aj práce, v ktorých del11q v multivariantných analýzach svoj prognostický význam strácala. Význam del11q sa odvodzuje od alterácie ATM génu lokalizovaného na dlhom ramienku chromozómu 11. Pri poškodení alebo strate ATM génu bunka neodpovedá adekvátne na poškodenie DNA. ATM dráha súvisí s dráhou p53. Preto možno predpokladať, že aj pacienti s abnormalitami ATM génu by mohli profitovať z liečby, ktorá obchádza p53 apoptotickú dráhu [37]. V dôsledku toho by aj prítomnosť del11q mohla mať vplyv na voľbu liečebnej stratégie, podobne ako je tomu pri abnormalitách TP53. Vzťah ATM a p53 dráhy však nie je úplne objasnený. Biologický efekt abnormalít ATM sa navyše prejavuje len pri jeho úplnej inaktivácii, ku ktorej dochádza kombináciou delécie s mutáciou zostávajúcej alely alebo kombináciou delécie s inými zmenami ovplyvňujúcimi proapoptotickú funkciu buniek CLL. V praxi je však dostupné len vyšetrovanie prípadnej del11q. Pritom bolo dokázané, že izolovaná heterozygotná (monoalelická) del11q nezvyšuje rezistenciu buniek CLL na fludarabín alebo jeho kombináciu s rituximabom [38]. Účinnosť mnohých chemoterapeutík v skutočnosti nezávisí od intaktnosti ATM. Nepriaznivý prognostický efekt del11q tak nemusí byť spôsobený neefektívnou iniciálnou odpoveďou na liečbu, ale môže byť dôsledkom vyššej kapacity týchto buniek znovuosídľovať jednotlivé kompartmenty zostávajúcimi bunkami nádorového klonu [38].
Incidencia chromozómových abnormalít, ktoré predikujú zlú terapeutickú odpoveď, je u neliečených pacientov relatívne nízka. Del17p sa vyskytuje asi v 5–7% a del11q asi v 10–20% prípadov [24–25]. Ich incidencia sa však zvyšuje s aplikovanou liečbou. Uvádza sa, že výskyt del17p môže u liečených pacientov dosiahnuť 25–30% a u pacientov refraktérnych na liečbu 40–50% [27,29,39]. Vplyvom liečby sa nezvyšuje len incidencia del17p, ale aj mutácií TP53 génu [35]. Recentná štúdia českých autorov dokonca potvrdila, že u liečených pacientov s prognosticky menej priaznivým profilom (vyšší podiel pacientov s UM IgVH a pacientov vo vyššom klinickom štádiu) dochádza častejšie k zisku monoalelickej mutácie TP53 než delécie 17p [35].
Prípady, v ktorých abnormálny subklon prerastie reziduálne bunky pôvodného klonu, majú oveľa horšiu prognózu. Ak sa v priebehu ochorenia objaví nová cytogenetická abnormalita alebo abnormality, ide o tzv. klonálnu evolúciu. K takejto zmene karyotypu dochádza cca v 15–20% prípadov CLL [40]. Prognostický efekt závisí aj od typu sekundárne získanej abnormality, pochopiteľne najnepriaznivejší je pri získaní del17p alebo del11q. Klonálna evolúcia a selekcia sú asociované s horšou odpoveďou na terapiu, kratším intervalom bez progresie a kratším celkovým prežívaním [40–41]. Význam klonálnej evolúcie a selekcie narastá vo vzťahu k liečbe relabovaných prípadov, preto sa odporúča opakovať FISH vyšetrenie chromozómových abnormalít pred zahájením každej ďalšej línie liečby.
Prognostický význam trizómie 12 je sporný. Viaceré štúdie potvrdili jej asociáciu s atypickou cytomorfológiou, netypickým imunofenotypom [42] a niektorými ďalšími klasickými faktormi, čo by svedčilo pre jej nepriaznivý prognostický význam. Neskoršie štúdie však nepotvrdili horšiu prognózu a ani kratšie prežívanie pacientov s trizómiou 12, s výnimkou kratšieho intervalu bez liečby [24]. Existuje reálny predpoklad, že údaje starších štúdií mohli byť skreslené súčasnou prítomnosťou iných abnormalít, ktoré vtedy unikali detekcii. Na druhej strane trizómiu 12 nemožno paušálne považovať ani za prognosticky neutrálnu. Význam chromozómu 12 vzrástol v súvislosti s lokalizáciou génu CLLU1 (CLL up regulated gene 1) na lokuse 12q22. Ukázalo sa, že CLLU1 gén by mohol byť zapojený do patogenézy CLL a jeho expresia by mohla mať aj prognostický význam [43]. Nebola však dokázaná žiadna súvislosť medzi expresiou CLLU1 a trizómiou 12.
Najčastejšia chromozómová abnormalita del13q býva prítomná v 40–55% prípadov. Na rozdiel od predchádzajúcich abnormalít sa del13q pri izolovanom výskyte spája s lepšou prognózou a dlhším prežívaním než u pacientov s normálnym karyotypom [24]. V prípade kombinácie s niektorou z predchádzajúcich abnormalít, čo býva asi v 30% prípadov, sa jej pozitívny prognostický význam stráca.
Ktoré prognostické faktory má význam vyšetrovať a kedy ich vyšetrovať?
Po stanovení diagnózy CLL nasleduje určenie klinického štádia. V rámci realizovaných laboratórnych a stagingových vyšetrení je možné získať údaje o viacerých klasických prognostických faktoroch (morfológia v náteroch, periférna lymfocytóza, cytopénie, rozsah LAP, LDT, β2-MG, sTK a pod.). Vyšetrovanie týchto parametrov je súčasťou monitoringu aktivity ochorenia. Pokiaľ ide o bioptické vyšetrenie KD, z vlastných skúseností vieme, že jednotlivé pracoviská pristupujú k tomuto vyšetreniu rozdielne. Niektoré pracoviská vykonávajú stagingovú biopsiu KD už v čase diagnózy, potom zvyčajne pred zahájením liečby a po liečbe na zhodnotenie jej efektu. Iné pracoviská pristupujú k biopsii KD rezervovane a realizujú ju len pri objasňovaní vzniknutých komplikácií alebo progresie, spravidla až v postterapeutickej fáze. Biopsia LU je u pacientov s CLL indikovaná v zásade len pri podozrení na vysokomalígnu transformáciu.
V súvislosti s vyšetrovaním nových prognostických faktorov treba pripomenúť, že ani kľúčové nové prognostické faktory spomenuté v tomto prehľade nie sú prognosticky ekvivalentné. Prognostický význam del17p, mutácií TP53 a del11q je vzhľadom k výrazne nepriaznivému prežívaniu pacientov vyšší ako stavu IgVH, ZAP 70 a CD38 [17,44]. U každého pacienta s CLL by preto mali byť v prvom rade vyšetrené chromozómové abnormality. Ich vyšetrenie sa odporúča realizovať v čase diagnózy a u liečených pacientov potom pred začiatkom každej ďalšej línie liečby [40]. To isté by sa v budúcnosti malo stať pravidlom aj vo vzťahu k mutáciám génu TP53. Pragmaticky však treba dodať, že z abnormalít TP53 je zatiaľ rutinne dostupné len FISH vyšetrenie del17p.
Pre odporúčanie vyšetrovania ďalších nových prognostických faktorov možno vychádzať z nedávnej štúdie amerických autorov z CLL Research Consortium (dnes súčasť CLL Global Research Foundation). Pri porovnaní schopnosti IgVH, ZAP 70 a CD38 predikovať čas do zahájenia liečby, najvyššiu mieru rizika vykazovali ZAP 70+ pacienti (medián ≤ 3 roky). Údaj o stave IgVH a CD38 u týchto pacientov už signifikantne nezlepšoval schopnosť predikcie času do zahájenia liečby. U ZAP 70– pacientov sa ukázala ako relevantná ešte stratifikácia podľa mutačného stavu IgVH, nakoľko ZAP 70–/UM IgVH pacienti vykazovali intermediárne riziko (medián ≤ 6 rokov) a ZAP 70-/M IgVH pacienti vykazovali len nízke riziko (medián 10 rokov) do zahájenia liečby. Údaj o expresii CD38 neovplyňoval mieru rizika do zahájenia liečby ani u ZAP 70– pacientov [45]. Na základe uvedeného by bolo možné odporučiť, aby v rámci panela rizikových faktorov bola okrem chromozómových abnormalít vyšetrená aj expresia ZAP 70, a pokiaľ to bude možné, tak aj stav IgVH génov.
Využiteľnosť prognostických faktorov v praxi
Nakoniec treba zodpovedať otázku reálnej využiteľnosti prognostických faktorov v klinickej praxi. Určenie rizikového profilu pacienta s CLL môže determinovať klinický prístup k pacientovi v zmysle počtu kontrol, realizovaných vyšetrení a pod. Aký je však vzťah prognostických faktorov k liečbe? Odporúčania pre diagnostiku a liečbu CLL publikované v júni 2008, neskôr doplnené a korigované v decembri 2008 (tab. 1) potvrdili, že rozhodnutie o liečbe CLL je aj naďalej založené výlučne na klinickom štádiu a aktivite ochorenia [46]. Odporúča sa, aby klinická progresia bola zdokumetovaná pri dvoch následných kontrolách. Nové prognostické faktory pritom vôbec nie sú zohľadňované pri indikovaní liečby. Stále absentujú dáta porovnávajúce výsledky „watch and wait“ stratégie s efektom včasnej liečby. Zatiaľ nebolo jednoznačne dokázané, že benefit včasnej liečby prevyšuje jej riziká reprezentované nežiadúcimi účinkami liečby, infekčnými komplikáciami a výskytom sekundárnych malignít. Na zohľadnenie nových prognostických faktorov v liečbe CLL ako indikátorov pre zahájenie liečby teda chýbajú relevantné údaje validizované prospektívnymi klinickými štúdiami. Navyše je známe, že popri eliminácii senzitívnych nádorových buniek môže dôjsť vplyvom liečby k selekcii rezistentného subklonu nádorových lymfocytov, ktorý môže časom nadobudnúť prevahu. Liečba vedie v prežívajúcich CLL lymfocytoch k zisku a akumulácii sekundárnych genetických abnormalít, čo môže byť spojené s nadobudnutím agresívnejších biologických vlastností. K prognosticky najvýznamnejším patrí selekcia nádorových buniek s del17p alebo mutáciami TP53 génu. Opísané riziká včasnej liečby potom významne limitujú jej benefit. Platí, že liečebná intervencia by mala byť u pacientov s CLL indikovaná s veľkou obozretnosťou a len vtedy, keď je skutočne nevyhnutná. V súvislosti s liečbou sa však v poslednom období otvára možnosť využitia nových prognostických faktorov ako prediktorov odpovede na liečbu [3–4].
Tab. 1. Aktuálne NCI-WG (2008) odporúčania pre zahájenie liečby CLL [46]. ![Aktuálne NCI-WG (2008) odporúčania pre zahájenie liečby CLL [46].](https://www.prelekara.sk/media/cache/resolve/media_object_image_small/media/image/095ce8140e10cf4dbb93cf08a7b045ef.png)
RQ – liečba nie je všeobecne doporučená, je to otázka pre klinický výskum, *liečba je indikovaná ak ochorenie spĺňa kritériá aktivity. Prediktory odpovede na liečbu
Prognóza pacientov s aktívnym ochorením vyžadujúcim liečbu je apriórne horšia než neliečených. Väčšina pacientov vyžadujúcich liečbu pravdepodobne zomrie na komplikácie základného ochorenia. U liečených pacientov sú preto najdôležitejšími klinickými parametrami odpoveď na liečbu a schopnosť dosiahnuť kompletnú remisiu. Vzhľadom k tomu, že nové prognostické faktory umožňujú predikovať biologické správanie ochorenia, môžu sa niektoré z nich uplatniť aj ako prediktory liečebnej odpovede, ktoré môžu ovplyvniť výber konkrétnej liečebnej schémy [4,47]. Ešte donedávna bol výber liečebnej schémy založený len na fyzickej kondícii a komorbidite pacienta. Defekty p53 proteínu v dôsledku jeho straty (del17p) a/alebo mutácií TP53 génu sa u pacientov s CLL spájajú s najhoršou prognózou prejavujúcou sa kratším celkovým prežívaním, horšou odpoveďou na liečbu a kratším trvaním liečebnej odpovede. Predikujú rezistenciu na alkylačné látky a fludarabín [31–32], horšia odpoveď na rituximab nebola spoľahlivo potvrdená. Pacienti s del17p alebo inými abnormalitami p53 však odpovedajú na liečbu alemtuzumabom, a to samostatne alebo v kombinácii [48]. Vzhľadom k vysokému riziku refraktérnosti na liečbu je u týchto pacientov potrebné v budúcnosti počítať aj s možnosťou alogénnej transplantácie krvotvorných kmeňových buniek. Pacienti s del11q odpovedajú horšie na liečbu fludarabínom a alemtuzumabom, dosahujú kratší interval bez progresie (PFS) a skoršie relabujú po autológnej transplantácii kmeňových krvotvorných buniek. Profitujú však z chemoimunoterapie kombinujúcej rituximab s cyklofosfamidom a pentostatínom [49]. Prognostický význam trizómie 12 je údajne anulovaný liečbou obsahujúcou fludarabín [50]. Klonálna evolúcia predikuje horšiu odpoveď na liečbu a kratší PFS.
Pacienti s del17p, mutáciami TP53, del11q, s nemutovanými IgVH génmi a pozitivitou ZAP 70, liečení chemoimunoterapiou kombinujúcou fludarabín s rituximabom, dosahujú približne rovnaký počet liečebných odpovedí aj kompletných remisií, ale dosahujú signifikatne kratší PFS a kratšie celkové prežívanie než pacienti bez týchto negatívnych prognostických faktorov [26,51–54]. Schopnosť ZAP 70 a IgVH predikovať odpoveď na terapiu je teda otázna [4] a v prípade liečby kombinujúcej fludarabín s rituximabom sa nepotvrdila. V ZAP 70+, UM IgVH a aj CD38+ prípadoch je však možné očakávať kratší PFS pri kratšom trvaní liečebnej odpovede. Objavili sa úvahy, že u pacientov s týmito negatívnymi prognostickými faktormi, ktorí dosiahli po liečbe kompletnú alebo parciálnu remisiu, by bolo možné predĺžiť PFS konsolidačnou liečbou. To bolo zatiaľ potvrdené u ZAP 70+ pacientov prostredníctvom konsolidačnej liečby rituximabom [53]. Objasnenie vzťahu chromozómových abnormalít, ZAP 70, IgVH a CD38 k odpovedi na ďalšie liečebné schémy musí byť ešte overené prospektívnymi štúdiami homogénne liečených pacientov. Pre úplnosť ešte možno dodať, že zvýšené sérové koncentrácie β2-MG predikovali horšiu odpoveď na imunochemoterapiu [55].
Žiadna z metód modernej konvenčnej liečby CLL nie je schopná pacientov vyliečiť. Nádorové bunky je možné eradikovať len pomocou transplantácie krvotvorných kmeňových buniek. Autológna transplantácia stráca v ére imunochemoterapie svoj význam, preto jedinou, ale rizikovou možnosťou, ako vyliečiť pacientov s CLL, je alogénna transplantácia krvotvorných kmeňových buniek. Bolo potvrdené, že alogénna transplantácia je efektívna aj u vysokorizikových foriem CLL. Alogénna transplantácia je indikovaná u mladších pacientov (< 55 rokov) nereagujúcich na purínové analógy (fludarabín rezistentná CLL), u pacientov, ktorí po tejto liečbe progredujú v priebehu 12 mesiacov alebo relabujú v priebehu 24 mesiacov po autológnej transplantácii alebo po liečbe kombinovanou chemoterapiou na báze fludarabínu. Treba zdôrazniť, že v žiadnej z uvedených kategórií pacientov nebolo nutné stanovenie biologických rizikových faktorov. Kandidátmi na alogénnu transplantáciu po dosiahnutí prvej remisie sú aj pacienti s abnormalitami TP53 génu vyžadujúci liečbu [56–57]. Vzhľadom k tomu, že asi v 50% prípadov sú príčinou refraktérnosti na fludarabín práve abnormality TP53 génu, možno tieto vnímať ako jeden z faktorov predikujúcich potrebu alogénnej transplantácie. Opodstatnenosť a efekt transplantácie v prvej remisii u vysokorizikových pacientov definovaných inými novými nepriaznivými faktormi musí byť ešte overená v klinických štúdiách. Ukázalo sa, že alogénna transplantácia je jednou z mála liečebných modalít schopných prekonať negatívny biologický efekt nemutovaného stavu IgVH génov, ZAP 70+, del11q a pravdepodobne aj del17p [58–59]. Riziko úmrtia po transplantácii sa však signifikantne zvyšuje s výrazným predliečením pacientov (> 2 línie liečby) [58]. Okrem počtu línií predchádzajúcej liečby bolo vyššie riziko relapsu po transplantácii dokázané aj u chemorefraktérnych pacientov a pacientov s cytogenetickými abnormalitami del17p a del11q [60]. Pretrvávajúci impakt del17p a del11q však aj tu možno vysvetliť predliečenosťou, pretože u pacientov s horším rizikovým profilom možno očakávať vyšší počet aplikovaných línií liečby.
V súvislosti s novou liečbou (kombinovaná chemoterapia, imunochemoterapia, liečba monoklonálnymi protilátkami, auto a alogénna transplantácia krvotvorných kmeňových buniek) sa objavili aj ďalšie nové prognostické faktory. Okrem spomenutej odpovede na terapiu je to najmä stav minimálnej reziduálnej choroby (minimal residual disease – MRD). Je známe, že liečení pacienti, ktorí odpovedali na liečbu, prežívajú dlhšie. Rovnako vymiznutie MRD po liečbe (MRD negatívny status) koreluje s dlhším intervalom bez progresie a dlhším celkovým prežívaním [61–62]. Schopnosť dosiahnuť MRD a MRD negativita zároveň otvárajú priestor pre úvahy o konsolidačnej a udržiavacej liečbe CLL [53]. S tým súvisí narastajúci význam detekcie MRD u pacientov s CLL. Najčastejšími metódami detekcie je 4-farebná prietoková cytometria s citlivosťou 1 nádorovej bunky na 104–5 leukocytov [63] a kvantitatívna RT PCR, ktorá je schopná detegovať MRD s citlivosťou 1/108 [64].
Zhrnutie a záver
Stagingové systémy si aj naďalej zachovávajú postavenie kľúčového klinicko prognostického parametra, ktorý má rozhodujúcu úlohu v indikovaní liečby. Recentné štúdie navyše potvrdzujú, že stagingové systémy si zachovávajú nezávislosť a prognostický význam aj v súčasnosti. V rámci nového pohľadu na úlohu prognostických faktorov došlo k určitej rehabilitácii aj ostatných klasických faktorov. Ak uvážime ich povahu, je celkom logické, že tieto nemajú najmä vo včasnom štádiu schopnosť dostatočne spoľahlivo predikovať dlhodobú prognózu a ani spoľahlivo diskriminovať stabilné a progresívne formy CLL. Ich skutočný význam však spočíva v tom, že definujú rozsah ochorenia v určitom momente a determinujú klinickú progresiu. Keďže klasické faktory (periférna lymfocytóza, cytopénie, rozsah a typ infiltrácie KD, LDT, nárast počtu atypických elementov, periférna LAP, splenomegália a pod.) opisujú aktivitu ochorenia, podieľajú sa taktiež na rozhodovaní o zahájení liečby. Aktivitu ochorenia pritom tieto faktory vyjadrujú priamo, ale aj nepriamo. Nepriamo tým, že reflektujú prítomnosť, resp. vplyv niektorých nových nepriaznivých prognostických faktorov na priebeh ochorenia (del17p, del11q, ZAP 70+ alebo UM IgVH status). Napr. v prípadoch s prognosticky nepriaznivými chromozómovými abnormalitami sa častejšie stretávame s difúznou infiltráciou KD a zvýšeným podielom atypických elementov, čo svedčí pre zvýšenú rastovú aktivitu nádoru. V prípade viacerých klasických faktorov by preto bolo vhodné nahradiť čiastočne neúčelné označenie prognostické faktory termínom deskriptory stavu a aktivity ochorenia, resp. parametre vyjadrujúce stav a aktivitu ochorenia.
Naopak nové prognostické faktory umožňujú to, čo uniká klasickým faktorom, čiže diskriminovať potenciálne indolentné a progresívne formy ochorenia už vo včasnom štádiu. Sú teda schopné identifikovať skupinu pacientov s CLL, ktorých možno označiť za „časovanú bombu“. Títo pacienti sa totiž vzhľadom k prítomnosti nepriaznivých prognostických faktorov určite nedožijú 10–20 rokov bez liečby, ako je tomu u pacientov s typicky indolentným priebehom ochorenia. Schopnosť týchto nových prognostických faktorov determinovať rizikový profil pacienta s CLL sa však pri rozhodovaní o zahájení liečby v praxi nevyužíva, pretože zatiaľ na to absentujú relevantné dáta validizované prospektívnymi randomizovanými klinickými štúdiami. Zatiaľ nie je jasné, či pacienti s nepriaznivým rizikovým profilom môžu profitovať zo včasnej liečby. Okrem toho je možné, že faktory predikujúce agresívnejšiu formu ochorenia, môžu predikovať aj suboptimálnu odpoveď na súčasné liečebné režimy. Koncept liečby zohľadňujúcej individuálnu mieru rizika sa tak zatiaľ nenaplnil a v kontexte nového pohľadu na prognostické faktory CLL sa už asi ani nenaplní. Doposiaľ nebol vytvorený ani už viacerými prácami avizovaný prognostický index CLL zohľadňujúci viaceré prognostické faktory.
Ukazuje sa, že extenzívnu skupinu nových prognostických faktorov je možné zredukovať na parametre, ktorých klinicko biologický význam bol už jednoznačne overený, metodika ich detekcie bola štandardizovaná a ich vyšetrenie je dostupné pre relevantný počet pacientov. V rámci skupiny takto vyselektovaných faktorov je možné určiť hierarchiu ich významnosti v poradí: del17p a mutácie TP53 > del11q > expresia ZAP 70 > stav IgVH génov > expresia CD38.
Možný algoritmus využitia prognostických faktorov v kontexte dnešného poznania znázorňuje obr. 2. Poznanie rizikového profilu pacienta definovaného uvedenými novými prognostickými faktormi môže byť užitočné napr. pre stanovenie frekvencie kontrol. Kontroly sú zamerané na monitoring stavu a aktivity ochorenia, čiže sú pri nich vyšetrované aj niektoré parametre známe ako klasické prognostické faktory. U aktívneho, resp. progredujúceho ochorenia vyžadujúceho liečbu sa potom úloha nových prognostických faktorov môže zmeniť na úlohu prediktorov odpovede na liečbu. Tieto prediktory môžu ovplyvniť výber terapeutickej stratégie. Tým sa v podstate napĺňa primárna idea o individualizácii klinického prístupu k pacientovi s CLL a otvárajú sa možnosti cielenej liečby zohľadňujúcej prítomnosť prognosticky nepriaznivých znakov.
Obr. 2. Algoritmus možného klinického využitia prognostických faktorov CLL. 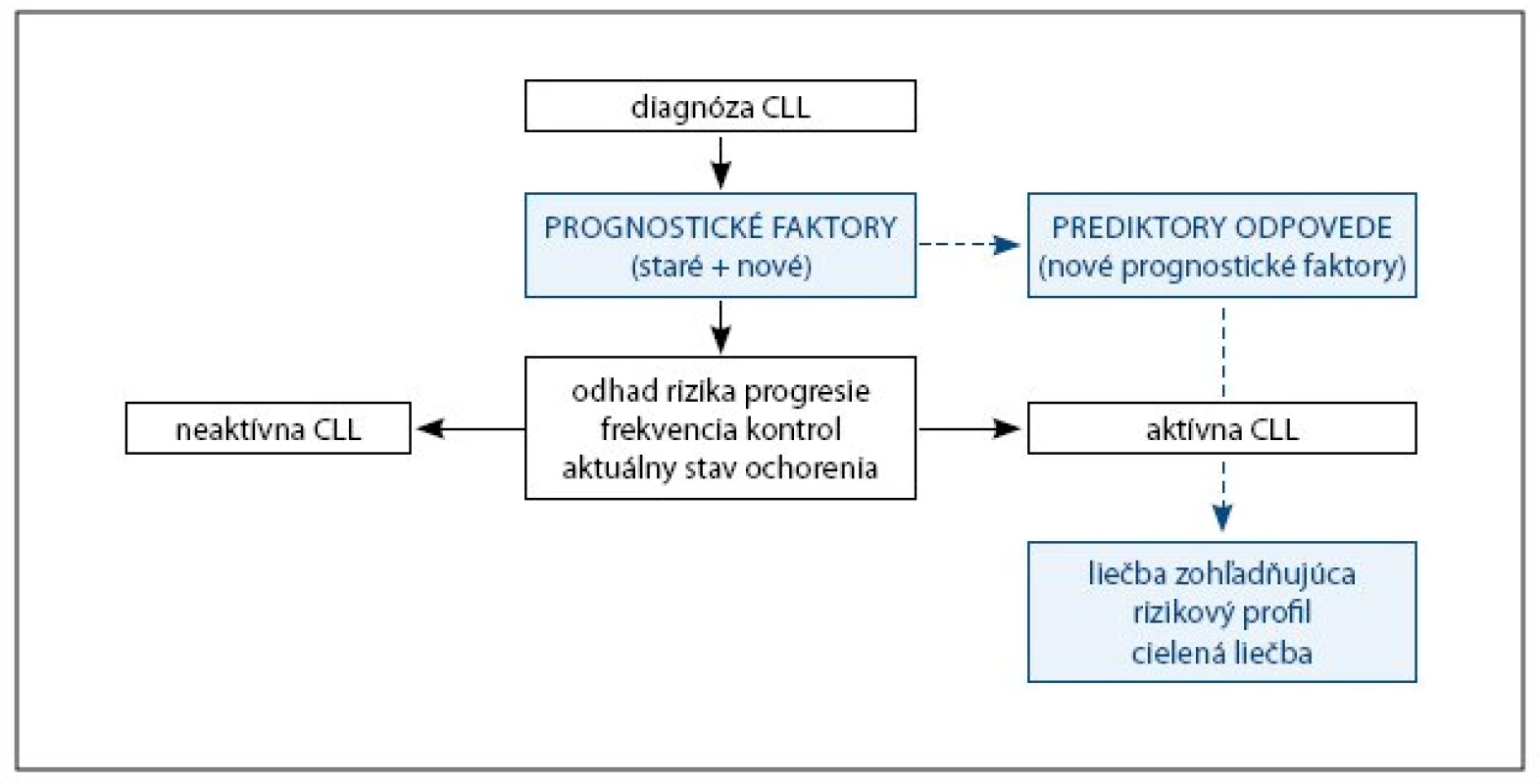
V súvislosti s modernou a efektívnou liečbou CLL sa však ponúka otázka, ako sa v jej dôsledku mení prognostický a prediktívny význam (resp. sila) nových prognostických faktorov. Logicky sa dá očakávať, že nová liečba by mohla mať tlmivý efekt na negatívny biologický vplyv niektorých nových prognostických faktorov. Doposiaľ sa však ukázalo, že ani imunochemoterapia na báze fludarabínu a rituximabu, považovaná za dnešný štandard v liečbe CLL, nie je schopná eliminovať negatívny vplyv nových prognostických faktorov. Ten sa totiž okrem celkového prežívania v prípade viacerých z nich prejavuje vo forme kratšieho PFS po liečbe. Pokiaľ ide o prežívanie pacientov, najväčší význam a jednoznačnú silu si aj napriek novým modalitám konvenčnej liečby zachovávajú zmeny funkcie TP53 génu v dôsledku delécie a/alebo mutácie. Del17p je pritom v súčasnosti jediným rutinne vyšetrovaným prognostickým faktorom schopným skutočne ovplyvniť výber terapeutickej stratégie u liečených pacientov. Zatiaľ jedinou, ale rizikovou, liečbou schopnou vyliečiť pacientov s CLL a eliminovať negatívny vplyv nových prognostických faktorov je alogénna transplantácia krvotvorných kmeňových buniek. Jej efekt však závisí od ďalších parametrov, ako je napr. stav predliečenosti pacientov.
Poďakovanie
Práca bola podporená Grantom Ministerstva zdravotníctva Slovenskej republiky č. 2005/12-MFN 04 a Grantom Vedeckej grantovej agentúry Ministerstva školstva Slovenskej republiky a Slovenskej akadémie vied (VEGA) č. 1/4285/07. Menované granty boli zamerané na monitoring, podporu a harmonizáciu vyšetrovania relevantných prognostických faktorov CLL v Slovenskej republike. Práca je súčasťou aktivít Pracovnej skupiny CLL v rámci Lymfómovej skupiny Slovenska, o.z.
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
The authors declare they have no potential conflicts of interest concerning drugs, pruducts, or services used in the study.Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
The Editorial Board declares that the manuscript met the ICMJE “uniform requirements” for biomedical papers.MUDr. Tomáš Balhárek
Ústav patologickej anatómie a Konzultačné centrum bioptickej diagnostiky ochorení krvotvorby
JLF UK a MFN
Kollárova 2
036 59 Martin
Slovenská republika
e-mail: balharek@jfmed.uniba.sk
Zdroje
1. Chiorazzi N, Rai KR, Ferrarini M. Mechanisms of disease: Chronic lymphocytic leukemia. N Eng J Med 2005; 352(8): 804 – 815.
2. Rosenwald A, Alizadeh AA, Widhopf G et al. Relation of gene expression phenotype to immunoglobulin mutation genotype in B cell chronic lymphocytic leukemia. J Exp Med 2001; 194(11): 1639 – 1647.
3. Moreno C, Montserrat E. New markers in chronic lymphocytic leukemia. Blood Reviews 2008; 22(4): 211 – 219.
4. Montserrat E. Find your way around prognostic factors in CLL. Abstract book: Looking to the future: How evidence changes clinical practice – Expert Investigator Forum. Budapest 2008; 22 – 23.
5. Mayer J, Schwarz J, Doubek M et al. Co nám v každodenní praxi skutečne říkají tzv. moderní prognostické faktory u chronické lymfatické leukemie? Transfuze a Hematologie Dnes 2007; 3 : 106 – 116.
6. Rai KR, Sawitsky A, Cronkite EP et al. Clinical staging of chronic lymphocytic leukemia. Blood 1975; 46 : 219 – 234.
7. Binet JL, Lepoprier M, Dighiero G et al. A clinical staging system of chronic lymphocytic leukemia: prognostic significance. Cancer 1977; 40 : 855 – 864.
8. Montserrat E. Classical and new prognostic factors in chronic lymphocytic leukemia: Where to now? Haematol J 2002; 3 : 7 – 9.
9. Bennett JM, Catovsky D, Daniel MT et al. Proposals for the classification of chronic (mature) B and T lymphoid leukemias. J Clin Pathol 1989; 42 : 567 – 584.
10. Müller ‑ Hermelink HK, Montserrat E, Catovsky D et al. Chronic lymphocytic leukaemia/ small lymphocytic lymphoma. In: Swerdlow SH, Campo E, Harris NL et al (eds.). WHO Classification of Tumours of Haematopoietic and Lymphoid Tissues, IARC, Lyon, 2008; 180 – 182.
11. Damle RN, Wasil T, Fais, F et al. IgV gene mutation status and CD38 expression as novel prognostic indicators in chronic lymphocytic leukemia. Blood 1999; 94 : 1840 – 1847.
12. Hamblin TJ, Davis Z, Gardiner A et al. Unmutated IgVH genes are associated with a more aggressive form of chronic lymphocytic leukemia. Blood 1999; 94 : 1848 – 1854.
13. Thorsélius M, Kröber A, Murray F et al. Strikingly homologous immunoglobulin gene rearrangements and poor outcome in VH3 – 21 – using chronic lymphocytic leukemia patients independent of geographic origin and mutational status. Blood 2006; 107(7): 2889 – 2894.
14. Mraz M, Pospisilova S, Malinova K et al. MicroRNAs in chronic lymphocytic leukemia pathogenesis and disease subtypes. Leuk Lymphoma 2009; 50(3): 506 – 509.
15. Mainou ‑ Fowler T, Dignum HM, Proctor SJ et al. The prognostic value of CD38 expression and its quantification in B cell chronic lymphocytic leukemia (B ‑ CLL). Leuk Lymphoma 2004; 45(3): 455 – 462.
16. Hamblin TJ, Orchard JA, Ibbotson RE et al. CD38 expression and immunoglobulin variable region mutations are independent prognostic variables in chronic lymphocytic leukemia, but CD38 expression may vary during the course of the disease. Blood 2002; 99(3): 1023 – 1029.
17. Kröber A, Seiler T, Benner A et al. VH mutation status, CD38 expression level, genomic aberrations and survival in chronic lymphocytic leukemia. Blood 2002; 100 : 1410 – 1416.
18. Ghia P, Guida G, Stella S et al. The pattern of CD38 expression defines a distinct subset of chronic lymphocytic leukemia (CLL) patients at risk of disease progression. Blood 2003; 101 : 1262 – 1269.
19. Crespo M, Bosch F, Villamor N et al. ZAP ‑ 70 expression as a surrogate for immunoglobulin‑variable ‑ region mutations in chronic lymphocytic leukemia. N Eng J Med 2003; 348(18): 1764 – 1775.
20. Orchard JA, Ibbotson RE, Davis Z et al. ZAP ‑ 70 expression and prognosis in chronic lymphocytic leukaemia. Lancet 2004; 363 : 105 – 111.
21. Wiestner A, Rosenwald A, Barry TS et al. ZAP ‑ 70 expression identifies a chronic lymphocytic leukemia subtype with unmutated immunoglobulin genes, inferior clinical outcome and distinct gene expression profile. Blood 2003; 101(12): 4944 – 4951.
22. Rassenti LZ, Huynh L, Toy TL. ZAP ‑ 70 compared with immunoglobulin heavy‑chain gene mutation status as a predictor of disease progression in chronic lymphocytic leukemia. N Eng J Med 2004; 351(9): 893 – 901.
23. Villamor N, Crespo M, Bosch F et al. ZAP ‑ 70 expression remains stable during the course of chronic lymphocytic leukemia. Leuk Lymphoma 2005; 49 (Suppl 1): S43.
24. Döhner H, Stilgenbauer S, Benner A et al. Genomic aberrations and survival in chronic lymphocytic leukemia. N Eng J Med 2000; 343(26): 1910 – 1916.
25. Castoldi G, Cuneo A. Cytogenetic and molecular cytogenetic features in chronic lymphocytic leukemia. Haematologica 2003; 88 (Suppl 17): 9 – 13.
26. Catovsky D, Richards S, Matutes E et al. Assessment of fludarabine pluscyclophosphamide for patients with chronic lymphocytic leukaemia (the LRF CLL4 Trial): a randomised controlled trial. Lancet 2007; 370(9583): 230 – 239.
27. Thornton PD, Gruszka ‑ Westwood AM, Hamoudi RA et al. Characterisation of TP53 abnormalities in chronic lymphocytic leukaemia. Hematol J 2004; 5 : 47 – 54.
28. Zenz T, Kröber A, Scherer K et al. Monoallelic TP53 inactivation is associated with poor prognosis in chronic lymphocytic leukemia: results from a detailed genetic characterization with long‑term follow‑up. Blood 2008; 112(8): 3322 – 3329.
29. Rossi D, Cerri M, Deambrogi C et al. The prognostic value of TP53 mutations in chronic lymphocytic leukemia is independent of Del17p13: implications for overall survival and chemorefractoriness. Clin Cancer Res 2009; 15(3): 995 – 1004.
30. Dicker F, Herholz H, Schnittger S et al. The detection of TP53 mutations in chronic lymphocytic leukemia independently predicts rapid disease progression and is highly correlated with a complex aberrant karyotype. Leukemia 2009; 23(1): 117 – 124.
31. Döhner H, Fischer K, Bentz M. p53 gene deletions predicts for poor survival and non‑response to therapy with purine analogues in chronic B ‑ cell leukemias. Blood 1995; 85 : 1580 – 1589.
32. Grever MR, Lucas DM, Dewald GW et al. Comprehensive assessment of genetic and molecular features predicting outcome in patients with chronic lymphocytic leukemia: results from the US Intergroup Phase III Trial E2997. J Clin Oncol 2007; 25(7): 799 – 804.
33. Byrd JC, Smith L, Hackbarth ML et al. Interphase cytogenetic abnormalities in chronic lymphocytic leukemia may predict response to Rituximab. Cancer Res 2003; 63 : 36 – 38.
34. Zenz T, Häbe S, Denzel T et al. Detailed analysis of p53 pathway defects in fludarabine ‑ refractory chronic lymphocytic leukemia (CLL): dissecting the contribution of 17p deletion, TP53 mutation, p53 – p21 dysfunction, and miR34a in a prospective clinical trial. Blood 2009; 114(13): 2589 – 2597.
35. Malcikova J, Smardova J, Rocnova L et al. Monoallelic and biallelic inactivation of TP53 gene in chronic lymphocytic leukemia: selection, impact on survival and response to DNA damage. Blood 2009.
36. Döhner H, Stilgenbauer S, Jemes MR et al. 11q deletions identify a new subset of B ‑ cell chronic lymphocytic leukemia characterized by extensive nodal involvement and inferior prognosis. Blood 1997; 89 : 2516 – 2522.
37. Austen B, Powell JE, Alvi A et al. Mutations in the ATM gene lead to impaired overall and treatment‑free survival that is independent of IGVH mutation status in patients with B ‑ CLL. Blood 2005; 106(9): 3175 – 3182.
38. Cejkova S, Rocnova L, Potesil D et al. Presence of heterozygous ATM deletion may not be critical in the primary response of chronic lymphocytic leukemia cells to fludarabine. Europ J Haematol 2008; 82 : 133 – 142.
39. Stilgenbauer S, Lichter P, Döhner H. Genetic features of B ‑ cell chronic lymphocytic leukemia. Reviews in Clin Experiment Hemat 2000; 4 : 48 – 72.
40. Brejcha M, Mayer J, Klodová D et al. Klonální evoluce u chronické lymfocytární leukemie. Transfuze a Hematologie Dnes 2009; 2 : 103 – 106.
41. Stilgenbauer S, Sander S, Billinger L et al. Clonal evolution in chronic lymphocytic leukemia: acquisition of high‑risk genomic aberrations associated with unmutated VH, resistance to therapy and short survival. Haematologica 2007; 92(9): 1242 – 1245.
42. Matutes E, Oscier DG, Garcia ‑ Marco J et al. Trisomy 12 defines group of CLL with atypical morphology. Correlation between cytogenetic, clinical and laboratory features in 544 patients. Br J Haematol 1996; 92 : 382 – 388.
43. Buhl AM, Jurlander J, Geisler CH et al. CLLU1 expression levels predict time to initiation of therapy and overall survival in chronic lymphocytic leukemia. Europ J Haematol 2006; 76(6): 455 – 464.
44. Stilgenbauer S, Bullinger L, Lichter P et al. Genetics of chronic lymphocytic leukemia: genomic aberrations and VH gene mutation status in pathogenesis and clinical course. Leukemia 2002; 16 : 993 – 1007.
45. Rassenti LZ, Jain S, Keating MJ et al. Relative value of ZAP ‑ 70, CD38 and immunoglobulin mutation status in predicting aggressive disease in chronic lymphocytic leukemia. Blood 2008; 112(5): 1923 – 1930.
46. Hallek M, Cheson BD, Catovsky D et al. Guidelines for the diagnosis and treatment of chronic lymphocytic leukemia: a report from the International Workshop on Chronic Lymphocytic Leukemia updating the National Cancer Institute – Working Group 1996 guidelines. Blood 2008; 111(12): 5446 – 5456.
47. Montserrat E. New prognostic markers in CLL. Hematology – ASH Education Program Book 2006; 279 – 284.
48. Lozanski G, Heerema NA, Flinn IW et al. Alemtuzumab is an effective therapy for chronic lymphocytic leukemia with p53 mutations and deletions. Blood 2004; 103 : 3278 – 3281.
49. Kay NE, Geyer SM, Call TG et al. Combination chemoimmunotherapy with pentostatin, cyclophosphamide and rituximab shows significant clinical activity with low accompanying toxicity in previously untreated B chronic lymphocytic leukemia. Blood 2007; 109(2): 405 – 411.
50. Hauswirth AW, Jäger U. Impact of genetic and molecular prognostic markers on the clinical management of chronic lymphocytic leukemia. Haematologica 2008; 93(1): 14 – 19.
51. Del Poeta G, Del Principe MI, Consalvo MAI et al. The addition of rituximab to fludarabine improves clinical outcome in untreated patients with ZAP ‑ 70 – negative chronic lymphocytic leukemia. Cancer 2005; 104(12): 2743 – 2752.
52. Byrd JC, Gribben JG, Peterson BL et al. Select high‑risk genetic features predict earlier progression following chemoimmunotherapy with fludarabine and rituximab in chronic lymphocytic leukemia: justification for risk‑adapted therapy. J Clin Oncol 2006; 24(3): 437 – 443.
53. Del Poeta G, Del Principe MI, Buccisano F et al. Consolidation and maintenance immunotherapy with rituximab improve clinical outcome in patients with B ‑ cell chronic lymphocytic leukemia. Cancer 2008; 112(1): 119 – 128.
54. Lin KI, Tam CS, Keating MJ et al. Relevance of the immunoglobulin VH somatic mutation status in patients with chronic lymphocytic leukemia treated with fludarabine, cyclophosphamide, and rituximab (FCR) or related chemoimmunotherapy regimens. Blood 2009; 113(14): 3168 – 3171.
55. Keating MJ, O’Brien S, Albitar M et al. Early results of a chemoimmunotherapy regimen of fludarabine, cyclophosphamide and rituximab as initial therapy for chronic lymphocytic leukemia. J Clin Oncol 2005; 23 : 1 – 8.
56. Dreger P, Corradini P, Kimby E et al. Indications for allogeneic stem cell transplantation in chronic lymphocytic leukemia: the EBMT transplant consensus. Leukemia 2007; 21 : 12 – 17.
57. Papajík T, Raida L, Faber E et al. Chronická B‑lymfocytární leukemie. Část V. Transplantace krvetvorných buněk. Transfuze a Hematologie Dnes 2007; 3 : 100 – 105.
58. Caballero D, Garcia ‑ Marco JA, Martino R et al. Allogeneic transplant with reduced intensity conditioning regimens may overcome the poor prognosis of B ‑ cell chronic lymphocytic leukemia with unmutated immunoglobulin variable heavy‑chain gene and chromosomal abnormalities. Clin Cancer Res 2005; 11(21): 7757 – 7763.
59. Khouri IF, Saliba RM, Keating MJ. ZAP ‑ 70 status may not predict outcome after non‑myeloablative allogeneic transplantation (NMT) in patients with chronic lymphocytic leukemia (CLL) who failed conventional chemotherapy. Blood 2006; 106 (Suppl 1): 577a.
60. Brown JR, Kim HT, Li S et al. Predictors of improved progression‑free survival after nonmyeloablative allogeneic stem cell transplantation for advanced chronic lymphocytic leukemia. Biol Blood Marrow Transplant 2006; 12(10): 1056 – 1064.
61. Bosch F, Ferrer A, Villamor N et al. Fludarabine, Cyclophosphamide and Mitoxantrone as initial therapy of chronic lymphocytic leukemia: High response rate and disease eradication. Clin Cancer Res 2008; 14(1): 155 – 161.
62. Tam CS, O’Brien S, Wierda W et al. Long‑term results of the fludarabine, cyclophosphamide, and rituximab regimen as initial therapy of chronic lymphocytic leukemia. Blood 2008; 112 : 975 – 980.
63. Rawstron AC, Villamor N, Ritgen M et al. International standardized approach for flow cytometric residual disease monitoring in chronic lymphocytic leukemia. Leukemia 2007; 21(5): 956 – 964.
64. Bezdíčková L, Špaček M, Peková S et al. Minimální reziduální nemoc u chronické lymfocytární leukemie: metody stanovení a klinický význam. Transfuze a Hematologie Dnes 2008; 3 : 124 – 130.
Štítky
Detská onkológia Chirurgia všeobecná Onkológia
Článok vyšiel v časopiseKlinická onkologie
Najčítanejšie tento týždeň
2009 Číslo 6- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Kombinace metamizol/paracetamol v léčbě pooperační bolesti u zákroků v rámci jednodenní chirurgie
- Nejasný stín na plicích – kazuistika
- Antidepresivní efekt kombinovaného analgetika tramadolu s paracetamolem
- Srovnání analgetické účinnosti metamizolu s ibuprofenem po extrakci třetí stoličky
-
Všetky články tohto čísla
- Editorial
- Komentár k vývoju konceptu prognostických faktorov chronickej lymfocytovej leukémie: Cesta od prognostických faktorov k prediktorom liečebnej odpovede
- Vakcinace proti chřipce u dospělých pacientů se solidními nádory
- Inhibítory aromatázy v prevencii rakoviny prsníka: možnosti aplikácie u premenopauzálnych žien
- Neo‑adjuvantná chemoterapia s následnou IDS (interval debulking surgery) v liečbe pokročilého karcinómu ovária – retrospektívna analýza
- Viditelnost na ultrasonografii jako nejsilnější prediktor invazivity u duktálních karcinomů in situ v retrospektivní studii
- Hodnota zobrazenia 18- FDG PET/ CT u pacientov s atypickým metastatickým karcinómom – kazuistika: 18- FDG PET/CT pri kolorektálnych karcinómoch
- Resekce pankreatu pro metastázy karcinomu ledviny
- Způsob života u onkologických pacientů – jak a kdy ho měnit?
- Klub onkologických juniorů
- Chirurgie karcinomu prsu v České republice
- Dispenzarizace osob s familiárním výskytem kolorektálního karcinomu
- Klinické databáze – rozmar, nebo nutnost
- Zápis ze schůze výboru České onkologické společnosti dne 6. 11. 2009 na MOÚ Brno
- Klinická onkologie
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Neo‑adjuvantná chemoterapia s následnou IDS (interval debulking surgery) v liečbe pokročilého karcinómu ovária – retrospektívna analýza
- Inhibítory aromatázy v prevencii rakoviny prsníka: možnosti aplikácie u premenopauzálnych žien
- Vakcinace proti chřipce u dospělých pacientů se solidními nádory
- Dispenzarizace osob s familiárním výskytem kolorektálního karcinomu
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



