-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Tubulo-intersticiální rejekce štěpů ledviny
Tubulointerstitial rejection of renal allografts
Tubulo-intersticial rejection represents T-cell mediated rejection of kidney allografts with the morphology of immune-mediated interstitial nephritis. Diagnosis is dependent on the histopathological evaluation of a graft biopsy sample. The key morphological features are interstitial inflammatory infiltrate and damage to tubular epithelial cell which in severe cases can result in the ruptures of the tubular basement membranes.
The differential diagnosis of tubulo-interstitial rejection includes acute interstitial nephritis and viral inflammatory kidney diseases, mainly polyomavirus nephropathy.Keywords:
kidney allograft – tubulo-interstitial rejection – T-cell mediated rejection
Autoři: Jana Malušková; Eva Honsová
Působiště autorů: Pracoviště klinické a transplantační patologie, Transplantcentrum IKEM
Vyšlo v časopise: Čes.-slov. Patol., 51, 2015, No. 3, p. 113-115
Kategorie: Přehledový článek
Souhrn
Tubulo-intersticiální rejekce představuje T-buňkami zprostředkovanou rejekci renálních štěpů s morfologií imunitně mediované intersticiální nefritidy. Diagnóza je histopatologická a základními morfologickými charakteristikami jsou zánět v intersticiu a poškození epitelu tubulů, které v těžších případech může vést až k rupturám bazálních membrán.
Diferenciální diagnostika tubulo-intersticiálních rejekce zahrnuje akutní intersticiální nefritidu a virové intersticiální nefritidy, mezi nimi především polyomavirovou nefropatii.Klíčová slova:
štěp ledviny – tubulo-intersticiální rejekce – T-buňkami zprostředkovaná rejekce
V počátcích transplantací ledvin, kdy imunosupresivní terapii představovaly azathioprin a steroidy, byla akutní rejekce s horečkou a zduřelým štěpem běžná a postihovala více než polovinu příjemců. Zavedení kalcineurinových inhibitorů (cyklosporin a tacrolimus) do imusupresivních protokolů po roce 1980, zcela změnilo charakter a hlavně počet epizod akutních rejekcí. V současnosti je výskyt epizod akutních rejekcí během prvního roku po transplantaci ledviny velmi nízký a pohybuje se pod 10%. Většinu rejekčních epizod představuje tzv. tubulo-intersticiální rejekce. Podle současné Banffské klasifikace jde o kategorii 4 – Akutní T-buňkami zprostředkovaná (nebo synonymem celulární) rejekce (1,2). Jde v podstatě o imunologicky mediovaný zánět intersticia s morfologií, která je charakterizovaná zánětlivou celulizací v intersticiu s průnikem lymfocytů do epitelu kanálků. Stav, kdy jsou lymfocyty zastiženy intraepiteliálně se nazývá tubulitida.
U všech typů imunitního rozpoznávání je podstatou interakce T lymfocytů příjemce s HLA antigeny dárce (HLA antigeny a MHC systém jsou synonyma). Jde o několik typů reakcí, které využívají různé větve imunitní odpovědi a především spolupráci mezi nimi. V procesu se účastní kostimulační signály, adhezní molekuly, produkce cytokinů a chemokinů, T a B lymfocyty, stejně tak jako další buňky, včetně makrofágů, NK buněk, polynukleárů s eozinofily atd. Proto je složení zánětlivé celulizace ve štěpu velmi proměnlivé a liší se případ od případu. Pokud je poškození tkáně plně vyvinuté, lymfocyty migrují z peritubulárních kapilár do intersticia. Z T lymfocytů jde o CD4 a CD8 lymfocyty. CD8 T lymfocyty mají imunologickou specificitu pro štěp, jejich vyblokováním lze v experimentu prodloužit přežívání štěpů (3). CD8 T lymfocyty jsou přímo cytotoxické, produkují perforin a granzym A a B. Perforin poškozuje buněčné membrány a granzym, který vstoupí do buněk, indukuje kaspázami zprostředkovanou apoptózu. CD4 T lymfocyty rozpoznávají HLA antigeny II. třídy a jejich aktivita je rozdílná podle Th odpovědi, kterou indukují tvorbou cytokinů. Th1 odpověď s IFNγ, IL2, TNFα je typická pro tubulointersticiální zánětlivou reakci a je tedy typická pro celulární rejekci. Stejné buňky mohou ale navodit Th2 odpověď, která vede k aktivaci B lymfocytů a k produkci IgE, které představují spojovací článek s eozinofily. Toto cytokinové prostředí je zřejmě odpovědné za různorodé složení zánětlivé celulizace v průběhu celulární rejekce. Kruh poškození se uzavírá zánětlivými cytokiny a chemokiny, které jsou produkovány aktivovanými/poškozenými tubulárními buňkami, které tímto mechanismem nastartují rozvoj začarovaného kruhu, protože poškozené buňky epitelu přitahují další zánětlivé buňky, které pak dále prohlubují poškození epitelu.
HISTOPATOLOGICKÉ CHARAKTERISTIKY
TUBULO-INTERSTICIÁLNÍ REJEKCE
Typickými diagnostickými znaky tohoto typu rejekce jsou zánětlivá celulizace v intersticiu (v Banffské klasifikaci značeno „i“) a tubulitida (značeno „t“).
Zánětlivá celulizace je fokální a charakteristicky ji doprovází mírný edém intersticia. Hodnotí se zánětlivá celulizace v kůře a mimo ložiska fibrózy (obr. 1, 2). V zánětu lze vedle T lymfocytů identifikovat nejrůznější elementy od B lymfocytů a plazmocytů, přes četné makrofágy, po neutrofily s eozinofily. Eozinofily s edémem jsou známkou aktivního zánětu a nejsou součástí alergické etiologie. Eozinofily jsou také běžné v případech s rejekcí, kde předcházela intenzivní imunosupresivní léčba (zvl. depleční).
Obr. 1. Tubulointersticiální rejekce s mírnou tubulitidou s ojedinělými lymfocyty intraepiteliálně (PAS, objektiv 20x). 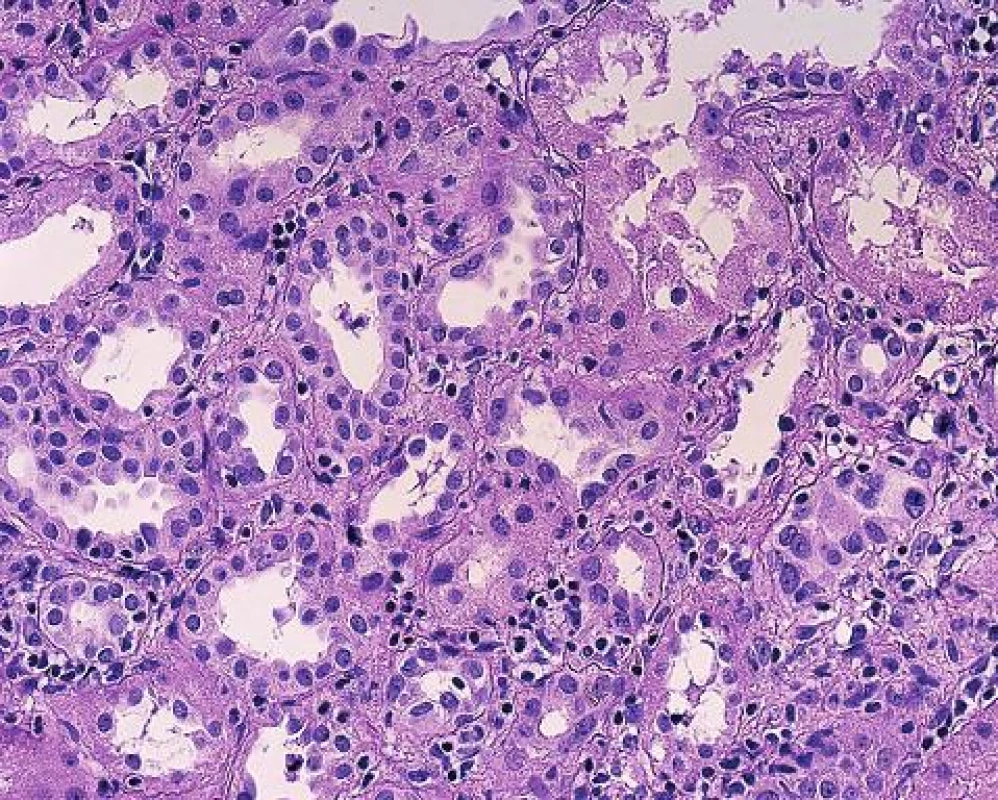
Obr. 2. Tubulo-intersticiální rejekce se zánětlivou celulizací v intersticiu a s významným poškozením tubulů, fokálně s rupturou tubulárních bazálních membrán; šipky (PAS, objektiv 20x). 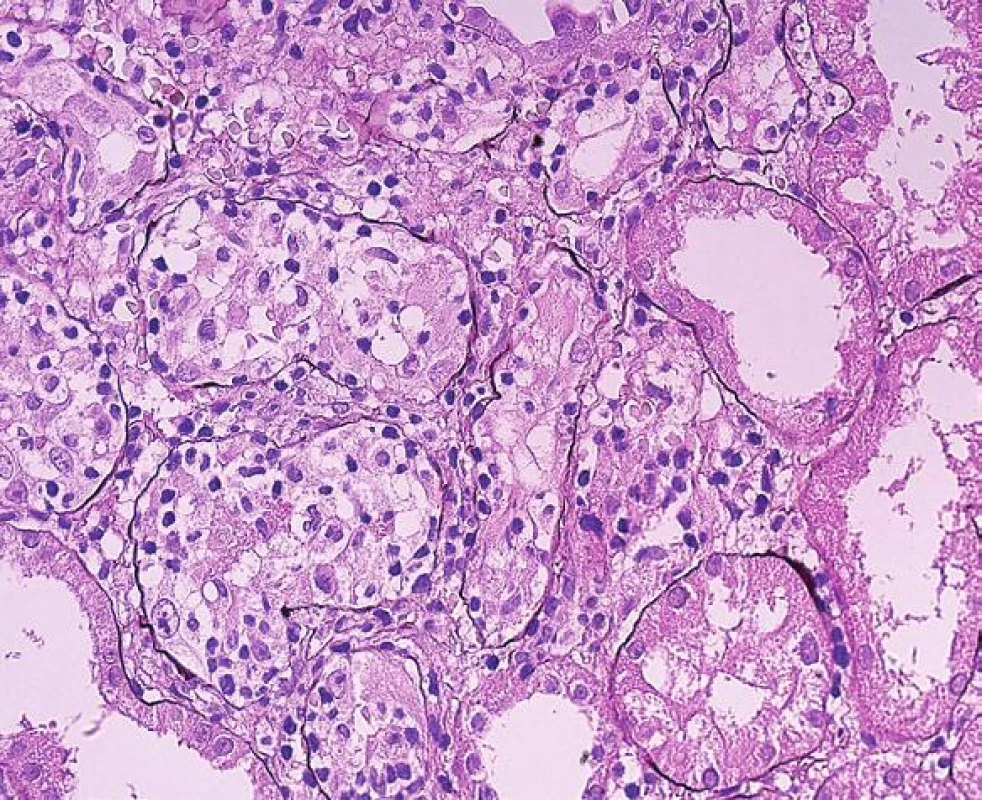
Lymfocyty intraepiteliálně, které jsou diagnostickým znakem tubulitidy, mají v histologických preparátech často tzv. perinukleární haló (obr. 3, 4). Identifikace lymfocytů intraepiteliálně je snazší v řezech barvených PAS nebo např. ve stříbření, které dobře identifikují tubulární bazální membrány. Tubulitida je typicky fokální a začíná v distálních tubulech. Postižení může být těžké, s rupturami bazálních membrán, na které bývá granulomatózní reakce. V případě izolované rejekční epizody jsou ostatní struktury tj. glomeruly a cévy normální nebo mají změny, které byly přítomny před rejekcí (např. transfer cévních změn od dárce). Lymfocyty lze běžně najít v úsecích jizev/intersticiální fibrózy a tubulitida je běžná v atrofických tubulech; v současnosti se tyto změny nehodnotí a jsou považovány za nediagnostické. Není jisté, zda nepředstavují pro štěp riziko z dlouhodobého hlediska. Spíše se zdá, že ano, protože každý zánět svými cytokiny a chemokiny značně ovlivňuje okolí.
Obr. 3. Detail těžkého poškození tubulů při tubulo-intersticiální rejekci s pestrou zánětlivou celulizací. Dobře rozpoznatelné halo v okolí intraepiteliálních lymfocytů a téměř cirkulární/kompletní destrukce tubulární bazální membrány (PAS, objektiv 40x). 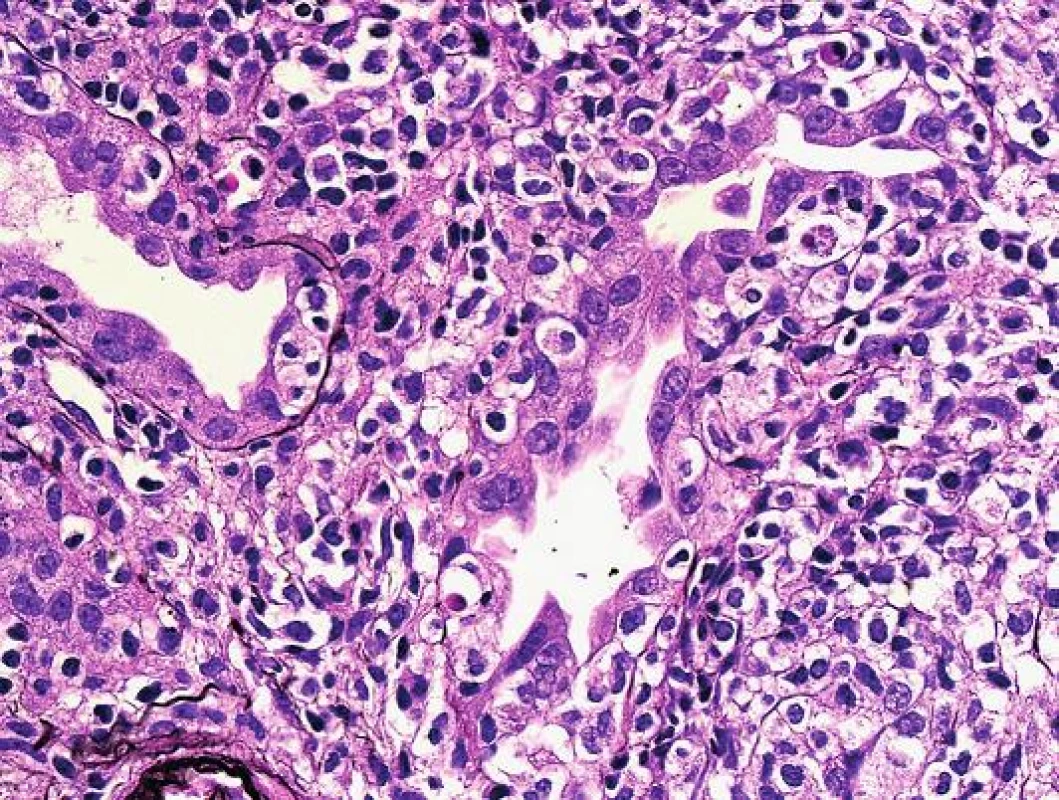
Obr. 4. Těžká forma tubulo-intersticiální rejekce s rozsáhlou destrukcí tkáně je v dnešní době vzácná a lze ji pozorovat u pacientů, kteří buď nespolupracují a vysadí si imunosupresi nebo tam, kde imunosuprese musela být vysazena např. u pacienta s pneumonií (PAS, objektiv 20x). 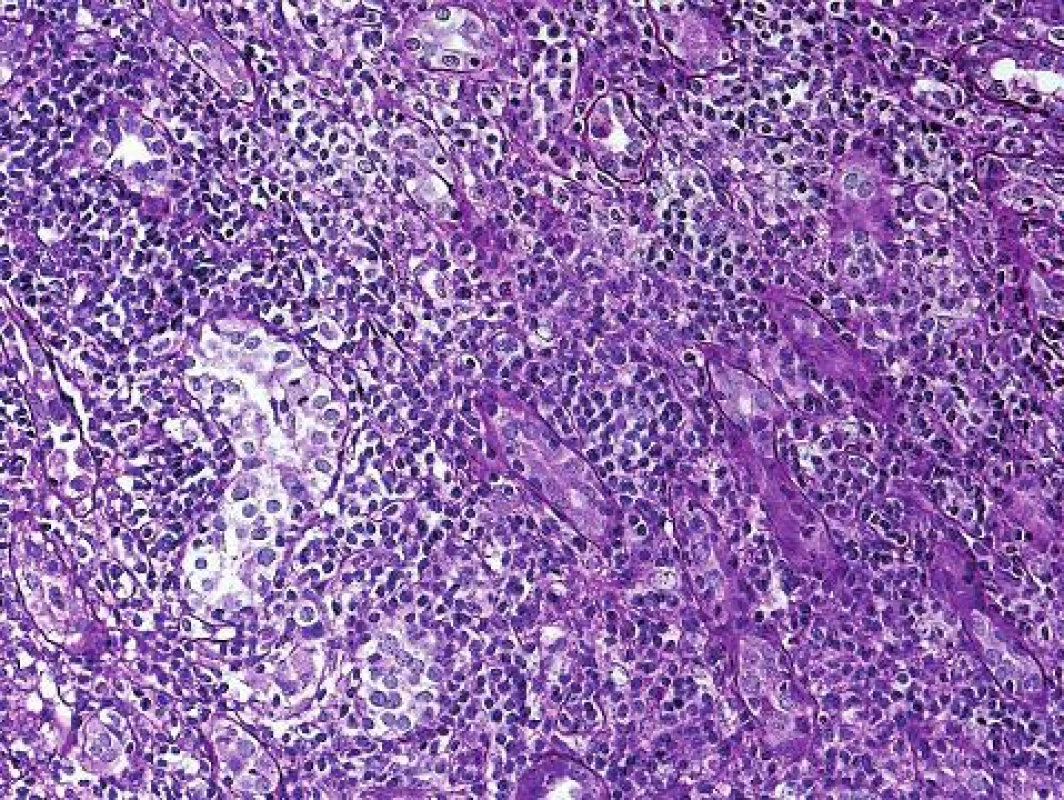
Průměrně 20 - 65 % epizod celulární rejekce má současně pozitivní průkaz C4d v peritubulárních kapilárách (C4d je jedním z diagnostických znaků protilátkami zprostředkované rejekce, viz následující článek). Tyto případy dokumentují spolupráci více složek imunitního systému na rejekční epizodě a jsou považovány za smíšenou buněčnou a protilátkami zprostředkovanou rejekci. Odhalení humorální rejekční komponenty je důležité především z terapeutických důvodů, protože časně po transplantaci lze terapeuticky většinu rejekcí zvrátit a zachovat dobrou funkci štěpu.
BANFFSKÁ KLASIFIKACE TUBULO-INTERSTICIÁLNÍ REJEKCE
Banffská klasifikace využívá kvantitativní kriteria pro rozsah zánětu a pro intenzitu poškození tubulů.
Kvantitativní kritéria pro zánětlivou celulizaciv intersticiu („i“score):
- i0: žádná nebo minimální zánětlivá celulizace v intersticiu (méně než 10% parenchymu v oblastech mimo fibrózu)
- i1: 10 - 25 % je infiltrováno zánětlivou celulizací
- i2: 26 - 50 % je infiltrováno zánětlivou celulizací
- i3: více než 50 % je infiltrováno zánětlivou celulizací
Kvantitativní kritéria pro tubulitidu („t“score):
- t0: žádná zánětlivá celulizace v tubulech
- t1: místa s 1 - 4 zánětlivými elementy v příčném řezu tubulem nebo na 10 tubulárních epitelií
- t2: místa s 5 - 10 zánětlivými elementy v příčném řezu tubulem
- t3: místa s více než 10 zánětlivými elementy v příčném řezu tubulem nebo přítomnost alespoň dvou oblastí s destrukcí tubulární bazální membrány doprovázenou i2/i3 zánětlivou celulizací v intersticiu a t2 tubulitidou v jiné části bioptického vzorku
Kombinace těchto 2 znaků vede k zařazení do jednoho ze dvou stupňů:
Akutní T buňkami zprostředkovaní rejekce stupeň IA nebo IB:
Stupeň IA představuje mírné postižení s významnou zánětlivou celulizací v intersticiu (více než 25 % parenchymu je infiltrováno, i2 nebo i3) a se středně těžkou tubulitidou (t2).
Stupeň IB je vyhrazen pro těžké změny s obdobnou zánětlivou celulizací jako při IA (více než 25 % parenchymu je infiltrováno, i2 nebo i3), ale současně je těžká tubulitida (t3), často s rupturami bazálních membrán tubulů.
Biopsie, které nesplňují kriteria akutní celulární rejekce rozsahem zánětu, jsou zahrnuty do kategorie: Hraniční změny.
Část zkušených patologů z velkých center má s touto kategorií problém a některá centra ji nediagnostikují. Současně používají modifikovaná kriteria pro tubulo-intersticiální rejekci. V našem centru používáme modifikaci, která byla původně součástí klasifikačního schématu CCTT (Collaborative Clinical Trials in Transplantation) a používají ji ve většině center v USA (4). Podle naší zkušenosti jsou tato kriteria prospěšnější, protože využívají přítomnost edému jako jednoho ze znaků, který vždy doprovází akutní zánětlivé změny (a tou rejekční epizoda nepochybně je).
Minimální histologická kriteria pro dg. tubulo-intersticiální rejekce jsou (4):
- zánětlivá celulizace v kůře mimo fibrózu ≥ 5 %.
- mírný nebo středně významný edém v intersticiu
- tubulitida ( ≥1 lymfocyt) ve ≥ 3 neatrofických tubulech v oblasti s nejvýznamnějším zánětem.
Tato kriteria umožní dobře diagnostikovat časné změny, které se vyskytují zvl. v prvním roce po transplantaci a které dobře reagují na terapii. Jsou-li tyto epizody dobře zvládnuty, nedojde k progresi poškození s mírným, ale dlouhodobě aktivním zánětem, s pozvolnou dysfunkcí štěpu. Pomalu postupující zánětlivý proces zůstává terapeuticky téměř neovlivnitelný, protože se začnou uplatňovat další komponenty imunitního systému, na které nelze terapeuticky optimálně reagovat.
DIFERENCIÁLNÍ DIAGNOSTIKA
Ne vždy léze se zánětlivou celulizací v intersticiu a s tubulitidou představují epizodu T buňkami zprostředkované rejekce. Stejnou morfologii mohou mít nerejekční příčiny dysfunkce štěpu ledviny. I po transplantacích se mohou vyskytovat „klasické“ akutní intersticiální nefritidy, které bývají reakcí na léky (zvl. běžně používaná antibiotika). Jasné odlišení tubulo-intersticiální rejekce a „alergické“ intersticiální nefritidy není prakticky možné. Naštěstí obě afekce dobře reagují na léčbu steroidy. V praxi je důležité pečlivě vyhodnotit morfologické změny ve všech dalších strukturách (v glomerulech, v cévách), protože zde lze diagnostikovat další typy rejekce a intersticiální zánět pak k rejekci přiřadit. Daleko významnější je identifikace polyomavirové nefropatie. Polyomavirovou infekci v kůře vždy doprovází zánětlivá celulizace, která může být neodlišitelná od zánětlivé celulizace při rejekci. Protože virových inkluzí může být ve štěpu velmi málo a mohou být bez imunohistochemického průkazu nezjistitelné, v praxi postupujeme tak, že kontrolujeme výsledky screeningu polyomaviru v moči a v séru. Dále provádíme rutině imunohistochemický průkaz polyomaviru ze všech biopsií odebraných déle než 3 měsíce po transplantaci. V morfologicky nejistých případech na úrovni HE, doporučíme odložit léčbu na druhý den, podle výsledků imunohistochemického průkazu viru. Je tomu tak proto, že u těchto afekcí je zcela protichůdný terapeutický přístup; léčba infekce spočívá ve snížení imunosuprese. Případný bolus steroidů podávaný u rejekcí téměř vždy vede ke zvýšené replikaci viru, poškození štěpu a někdy i k dalším velmi závažným komplikacím.
ZÁVĚR
S používáním imunosupresivních protokolů 3. generace počet tubulo-intersticiálních rejekčních epizod značně poklesl a dnes se v 1. roce po transplantaci pohybuje pod 10 %. Typickými diagnostickými znaky tubulo-intersticiální rejekce jsou zánětlivá celulizace v intersticiu a tubulitida. Stejnou zánětlivou morfologii mohou mít „klasické“ intersticiální nefritidy, které naštěstí reagují na stejnou terapii jako rejekce. V případě diferenciální diagnózy polyomavirové nefropatie je situace složitější a často vyžaduje imunohistochemickou verifikaci virových inkluzí, spolu s cíleným screeningem.
PODĚKOVÁNÍ
Práce byla podpořena: MZ ČR – RVO („Institut klinické a experimentální medicíny – IKEM, IČ 00023001“)
PROHLÁŠENÍ
Autor práce prohlašuje, že v souvislosti s tématem, vznikem a publikací tohoto článku není ve střetu zájmů a vznik ani publikace článku nebyly podpořeny žádnou farmaceutickou firmou. Toto prohlášení se týká i všech spoluautorů.
Adresa pro korespondenci:
Doc. MUDr. Eva Honsová, Ph.D.
Pracoviště klinické a transplantační patologie
Transplantcentrum IKEM
Vídeňská 1958/9, 140 21 Praha 4
Email: eva.honsova@ikem.cz
Zdroje
1. Solez K, Colvin RB, Racusen LC, Haas M, et al. Banff 07 classification of renal allograft pathology: updates and future directions. Am J Transplant 2008; 8 : 753-760.
2. Haas M, Sis B, Racusen LC, et al. Banff 2013 meeting report: inclusion of C4d-negative antibody-mediated rejection and antibody-associated arterial lesions. Am J Transplant 2014; 14 : 272-283.
3. Koyama I, Nadazdin O, Boskovic S, et al. Depletion of CD8 memory T cells for induction of tolerance of a previously transplanted kidney allograft. Am J Transplant 2007; 5 : 1055-1061.
4. Colvin RB, Cohen AH, Saiontz C, et al. Evaluation of pathologic criteria for acute renal allograft rejection: reproducibility, sensitivity, and clinical correlation. J Am Soc Nephrol 1997; 8 : 1930-1941.
Štítky
Patológia Súdne lekárstvo Toxikológia
Článek Jaká je Vaše diagnóza?
Článok vyšiel v časopiseČesko-slovenská patologie

2015 Číslo 3-
Všetky články tohto čísla
- Transplantační patologie - I. díl
- Aby mohl patolog morfologii interpretovat, musí nejdříve tkáni rozumět
- MONITOR aneb nemělo by vám uniknout, že
- Úvod do problematiky transplantační patologie
- Specializační kurz v patologii
- Transplantace ledviny z pohledu nefrologa
- MONITOR aneb nemělo by vám uniknout, že
- Tubulo-intersticiální rejekce štěpů ledviny
- Humorální rejekce a aktualizace Banffské klasifikace 2013
- MONITOR aneb nemělo by vám uniknout, že
- Infekce po transplantaci ledviny
- “Shadow cell” diferenciácia v endometrioidných karcinómoch tela maternice. Jej častý výskyt a pozitivita na beta-katenín
- Jaká je Vaše diagnóza?
- Neuroendokrinní nádor prsu – metastáza či primární karcinom prsu? Kazuistika
- MONITOR aneb nemělo by vám uniknout, že
- Jaká je Vaše diagnóza? Odpověď
- Melanocytární matrikom - kazuistika
- Adenom pylorických žlázek: histologické, imunohistochemické a molekulárně genetické zhodnocení 23 nádorů
- MONITOR aneb nemělo by vám uniknout, že
- Česko-slovenská patologie
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Adenom pylorických žlázek: histologické, imunohistochemické a molekulárně genetické zhodnocení 23 nádorů
- Infekce po transplantaci ledviny
- Úvod do problematiky transplantační patologie
- Neuroendokrinní nádor prsu – metastáza či primární karcinom prsu? Kazuistika
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



