-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Kolageny v lidské rohovce – jejich typy, lokalizace a role
Autoři: K. Jirsová 1,2; S. Merjavá 1; P. Lišková 1
Působiště autorů: Laboratoř biologie a patologie oka, Institut dědičných metabolických chorob, 1. LF UK a VFN, Praha, vedoucí pracoviště prof. Milan Elleder, DrSc. 1; Oční tkáňová banka, VFN a 1. LF UK, Praha, vedoucí pracoviště MUDr. Marcela Černická, MBA 2
Vyšlo v časopise: Čes. a slov. Oftal., 64, 2008, No. 4, p. 167-170
Kategorie: Souborný referát
ÚVOD
Kolageny jsou fibrilární proteiny tvořící 25–30 % všech proteinů v těle savců. U člověka byla dosud potvrzena exprese 27 typů, které se liší strukturou, funkcí a distribucí v tkáních. Kolageny jsou kódovány více než 40 geny, podle struktury se dělí do osmi skupin, tabulka 1.
Tab. 1. Kategorizace kolagenů podle struktury a jejich distribuce v lidských tkáních. (BM: bazální membrána, FACIT: kolageny asociované s fibrilami s přerušením trojšroubovice 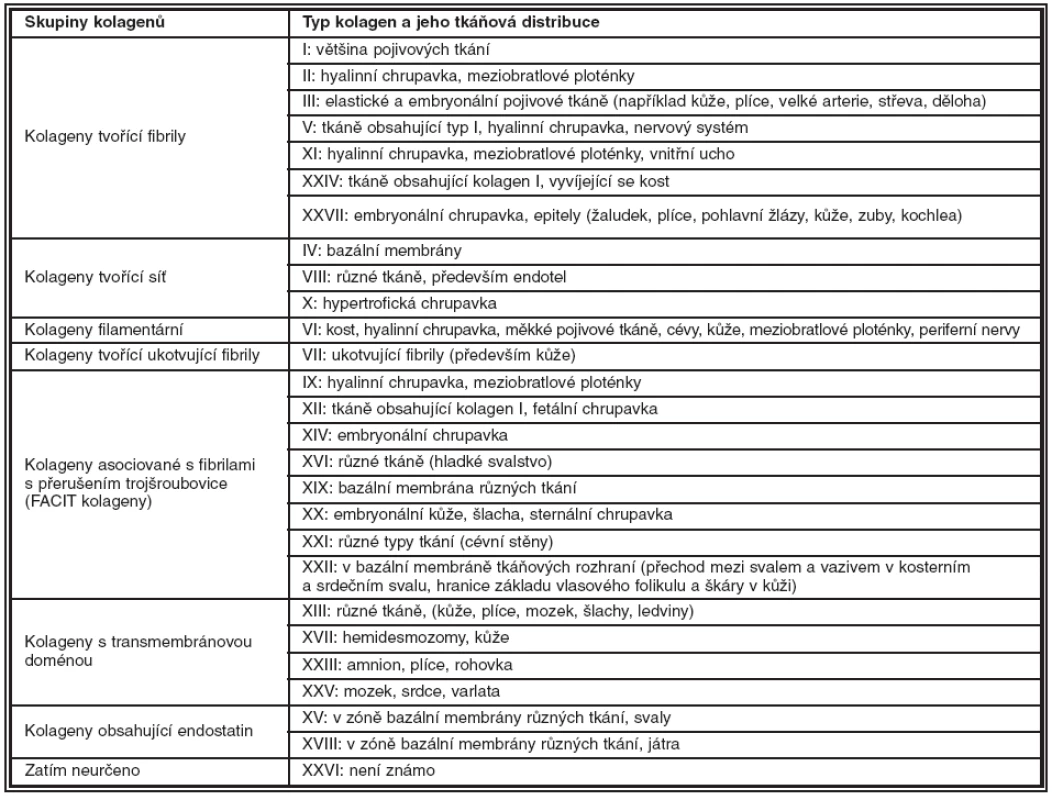
K syntéze kolagenů dochází na hrubém endoplazmatickém retikulu, proces zrání pokračuje řadou posttranslačních úprav. Kolageny tvořící fibrily vznikají spojením tří syntetizovaných pro-alfa řetězců v trojitou levotočivou šroubovici prokolagenu (tropokolagenu) o tloušťce asi 1,5 nm; pro tuto reakci je nezbytný glycin, který je každou třetí aminokyselinou v řetězci. Vznikající pro-alfa řetězce jsou potranslačně upravovány především hydroxylací prolinu a lysinu a glykosylací hydroxylysinu. Tato úprava je nezbytná pro prodlužování řetězců a následné vytvoření stabilních vazeb. Tropokolagen složený ze tří stejných či různých alfa řetězců příslušného kolagenu prochází Golgiho aparátem, ve kterém dochází k agregaci molekul a zvýšení stupně jejich kondenzace. To je předpokladem pro vznik sekrečních vakuol, ve kterých se prokolageny exocytózou dostávají z buněk do extracelulární matrix (ECM). V ECM dochází k enzymatickému odštěpení N - a C-terminálních prokolagenních peptidů. Následná rychlá agregace do fibril není regulována enzymaticky a její mechanismus není dosud znám. Vazba mezi řetězci ve fibrilách je stabilizována vytvořením pevné vazby (crosslinking). Fibrilogeneze je dále regulována reakcí s dalšími typy kolagenů a proteoglykany.
V lidském oku je přítomno nejméně 16 typů kolagenů. V rohovce byly detekovány kolageny I, III–VIII, dále XII, XIII, XV, XVIII a XXIII. Ve skléře se nacházejí kolageny I–III, V, VI, VIII a IX–XII. V trámčině je přítomen kolagen I, III–V, VIII a XVIII. V čočce jsou zastoupeny kolageny I, III–VI v duhovce a v řasnatém tělesu kolageny I, III, IV a VI, pouze v řasnatém tělesu byl detekován kolagen XVIII. Ve sklivci je nejhojněji zastoupen kolagen II, přítomny jsou i kolageny VI, IX a XI. V sítnici byly lokalizovány kolageny I, II, V, VIII, XIII a XVIII. V embryonální tkáni lidského oka byly detekovány kolageny VIII a XIII.
METODY DETEKCE KOLAGENŮ V ROHOVCE
Studium kolagenů v rohovce se provádí různými metodami. Na buněčné úrovni lze lokalizovat příslušný kolagen imunohistochemicky. Princip metody spočívá v navázání protilátky (či řady dvou a více protilátek) na příslušný kolagen (respektive jeho řetězec) a jeho zviditelnění ve fluorescenční nebo světelné mikroskopii. Větší zvětšení a rozlišení elektronové mikroskopie umožňuje poskytnout detailní informace o výskytu kolagenů, a to jak na úrovni detekce kolagenu protilátkami (imunoelektronová mikroskopie), či sledování jejich lokalizace včetně bližšího určení typu kolagenu dle morfologické struktury. Vzhledem k absenci protilátek proti některým z kolagenů nemohlo být studium výskytu jednotlivých kolagenních řetězců zatím detailně provedeno.
Expresi genu pro určitý řetězec příslušného kolagenu lze zjistit reverzní transkriptázovou polymerázovou řetězovou reakcí, případně reverzní transkriptázovou polymerázovou řetězovou reakcí na základě přítomnosti transkribované mRNA sloužící jako templát k syntéze odpovídajícího proteinu. Nevýhodou je, že pokud se mRNA neizoluje z oddělených struktur rohovky (např. epitelu, stromatu a endotelu), což je technicky obtížné, ale z rohovky celé, nelze získat informace o lokalizaci jednotlivých kolagenů v jejích jednotlivých vrstvách, ale pouze o přítomnosti či nepřítomnosti mRNA v celé rohovce. Lokalizaci mRNA v tkáni (buňkách) lze provést pomocí in situ hybridizace.
Uspořádání stromatu, především strukturu a velikost fibril a proteoglykanů můžeme studovat metodou rentgenové difrakční analýzy. K detailní charakterizaci molekul kolagenu se používá metoda mikroskopie atomárních sil, umožňující vysoké rozlišení blížící se velikosti atomů. Nevýhodou této metody je omezení pouze na studium povrchu sledované struktury.
KOLAGENY V ROHOVCE
V lidské rohovce se vyskytuje nejméně 12 typů kolagenů. Tvoří 71 % její suché hmotnosti. Nacházejí se především ve stromatu, ale jsou i nepostradatelnou součástí bazálních membrán (BM) rohovky. Výskyt kolagenů ve zdravé lidské rohovce a jejich lokalizace je zobrazena v tabulce 2.
Tab. 2. Výskyt a lokalizace kolagenů ve zdravé lidské rohovce 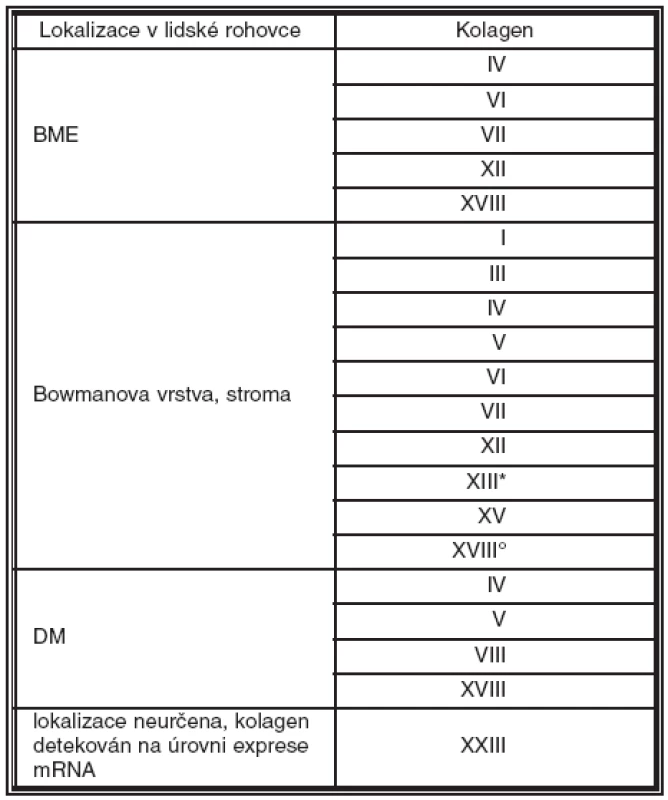
* pouze zadní 2/3 stromatu ° pouze Bowmanova vrstva Schematické znázornění struktury a lokalizace kolagenů přítomných v jednotlivých vrstvách rohovky dospělého člověka je uvedeno na obrázku 1.
Obr. 1. Kolageny v lidské rohovce. Vlevo parafinový řez rohovkou, obarveno hematoxylinem-eosinem. Měřítko 10 nm. Vpravo schematické znázornění struktury a lokalizace kolagenů nejhojněji zastoupených v jednotlivých částech lidské rohovky, zpracováno dle Prockopa a Kivirikka a Hulmese 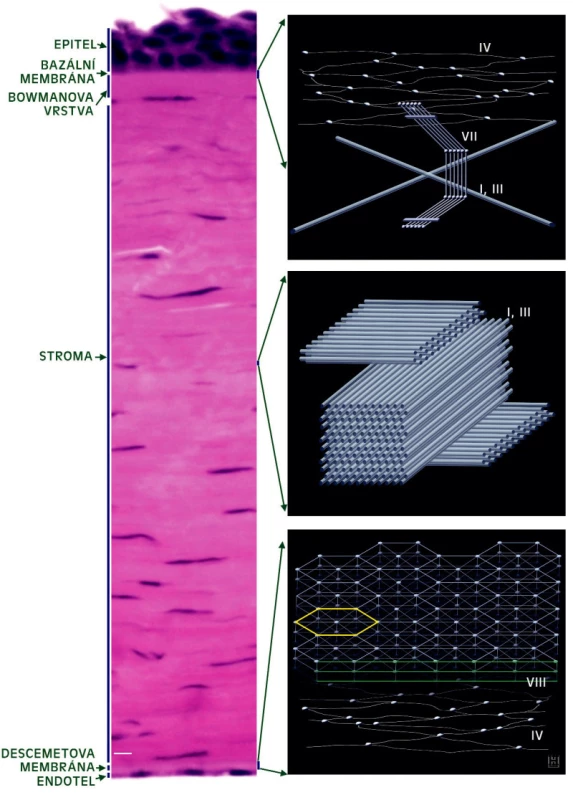
Kolagenní fibrily utvářejí ve stromatu rohovky asi 300 s povrchem paralelních lamel, fibrily v sousedních lamelách leží v úhlu 0–90°, obrázek 2. Počet lamel se na hranici s limbem zvyšuje na téměř 500. Lamely tvoří asi 0,5–250 Ķm široké pásy, které se mohou vertikálně a zejména horizontálně štěpit a vzájemně protínat. Některé lamely zasahují ze stromatu do Bowmanovy vrstvy a podílejí se na udržení stabilního tvaru přední části rohovky.
Obr. 2. Elektronová transmisní mikroskopie stromatu rohovky zdravého dárce zobrazující kolagenní lamely tvořené pravidelně uspořádanými fibrilami ležícími v úhlu 0–90°. Příčný řez rohovkou, měřítko 500 nm (poskytnuto Dr. R. D.Youngem, Dept. of Optometry & Vision Sciences, Cardiff University, Velká Británie) 
Kolagenní fibrily v rohovkovém stromatu mají jednotný průměr, jehož hodnoty jsou udávány 23–33 nm v závislosti na metodách použitých při zpracování měřeného vzorku.Tento pro jiné tkáně neobvykle malý průměr fibril a pravidelná vzdálenost mezi nimi (20–41 nm), (obr. 2) jsou předpokladem transparence rohovky (průměr fibril v neprůhledné skléře je mezi 25–300 nm).
Vysoce organizované fibrily stromatu jsou tvořeny kolageny I, III a V. Nejhojněji je zastoupen kolagen I, který dává tkáni pevnost v tahu. Množství kolagenu I a III je v poměru 15 : 1 (kolagenu V je o něco méně než kolagenu III). Ke zmnožení kolagenu III dochází s rostoucím věkem, při hojení a zánětu. Kolagen V se nachází ve stromatu rohovky ve vyšších koncentracích než v jiných tkáních, interakcí s kolagenem I ovlivňuje tloušťku fibril. Kolagen VI vytváří mikrofilamentární struktury a vazbou na kolagenní fibrily se pravděpodobně podílí na jejich stabilizaci a udržení konstantní vzdálenosti mezi nimi. Podél fibril se vyskytuje i kolagen XII, v zadních dvou třetinách stromatu byl detekován kolagen XIII. Obnova kolagenu ve stromatu je pomalá, trvá 2–3 roky, degradace je zajištěna enzymaticky, matrixmetaloproteinázami, především kolagenázami a želatinázami.
Vzdálenost a orientace kolagenních fibril ve stromatu je regulována vazbou s další složkou ECM – proteoglykany. Proteoglykany rohovky se skládají z proteinového jádra (dekorin, keratokan, lumikan, mimekan, biglykan) a polysacharidových řetězců složených z disacharidových jednotek – glykosaminoglykanů (GAG). Mezi hlavní proteoglykany rohovkového stromatu patří keratansulfát s korovým proteinem lumikanem či keratokanem, dermatansulfát s korovým proteinem dekorinem a chondroitinsulfát. Ve zdravé rohovce není exprimován GAG heparansulfát, jeho exprese je buňkami stromatu a zřejmě i epitelu aktivována při hojení. Vazby s kolageny se účastní jak proteiny (vazba na kolagen I), tak i glykosaminoglykanová složka (vazba na kolagen IX a XII, XVIII) proteoglykanů. GAG, respektive jejich uspořádání a zejména stupeň hydratace, se významně podílejí na udržení fyziologické vzdálenosti mezi kolagenními fibrilami. Podle zatím posledního modelu, získaného na základě měření jednotlivých struktur stromatu (kolageny, proteoglykany), je na kolagenní fibrile vázáno šest korových proteinů proteoglykanů, jejichž GAG se paprsčitě rozbíhají a vážou k šesti nejbližším nesousedním kolagenním fibrilám.
Za přední část stromatu je v poslední době považována nebuněčná Bowmanova vrstva. Zřetelně ji lze u člověka detekovat v devatenáctém gestačním týdnu.Jedná se o vrstvu 8–12 μm silnou, jejíž složky jsou produkovány keratocyty stromatu. Je tvořena především kolageny I, III a V; přítomen je i kolagen VII, tvořící kotvící vlákna mezi hemidesmozomy a kotvícími plaky ve stromatu. Hraje tak důležitou roli při stabilizaci buněk epitelu, bazální membrány epitelu (BME) a Bowmanovy vrstvy. V Bowmanově vrstvě se nachází i kolagen XVIII, ze kterého štěpením proteázami vzniká inhibitor angiogeneze endostatin, jenž se podílí na kompartmentalizaci vaskulárních a avaskulárních oblastí oka. Kolagenní fibrily nejsou v denzní Bowmanově vrstvě uspořádány do lamel a mají menší průměr než vlákna ve stromatu rohovky. Kromě oddělení buněk epitelu a stromatu, a tedy i vzájemného ovlivňování jimi sekretovanými faktory, není další fyziologická funkce Bowmanovy vrstvy známa.
Kolageny se v rohovce nacházejí i v BM rohovky; tj. v BME a Descemetově membráně (DM). Obě jsou tvořeny ECM, přičemž BME vzniká sekrecí epitelových buněk, DM sekrecí endotelu. Hlavní funkcí BM rohovky je oddělení epitelových nebo endotelových buněk od podložní pojivové tkáně. BM mohou modulovat fyziologické (embryonální vývoj, buněčná diferenciace, regenerace) i patologické (invaze nádoru) procesy.
BME rohovky se skládá především z kolagenu IV, který je majoritní strukturní komponentou všech bazálních membrán, dále z adhezivních molekul lamininu, fibronektinu a nidogenu. Z kolagenů byl v BME prokázán i typ VII (viz výše), XII a XVIII. Kolagen IV a XII se svým výskytem v BME a absencí v BM limbu a spojivky podílejí na vytvoření rozhraní mezi rohovkou a spojivkou.
K nejvýznamnějším stavebním složkám DM patří kolageny IV, VIII a laminin, v menší míře jsou zastoupeny kolageny V, VI a XVIII. DM je složena ze dvou častí: asi 3 μm silné přední vrstvy formující se od 4. měsíce fetálního vývoje, a části, která se utváří až po narození a během života se ztlušťuje na 8–10 μm. Část DM vznikající během intrauterinního vývoje je vysoce uspořádaná struktura tvořená především kolagenem VIII. Tato vrstvaje v příčném řezu uspořádaná v pruzích (anterior banded layer), podélně byla pomocí imunoelektronové mikroskopie detekovaná hexagonální síť (obr.1). Role kolagenu VIII v DM není zcela prozkoumána. Je možné, že hexagonální matrix poskytuje strukturální oporu před tlakem komorové vody z přední komory. Kolagen VIII byl ve zdravých rohovkách kromě Descemetovy membrány detekován i v místě svého vzniku, tedy v buňkách endotelu. Zadní, spíše amorfní část membrány (posterior non-banded layer) je tvořena převážně různými řetězci kolagenu IV.
ONEMOCNĚNÍ ROHOVKY PROJEVUJÍCÍ SE ZMĚNAMI NA ÚROVNI KOLAGENŮ
Změny na úrovni kolagenů (mutace genů, poruchy ve zrání a struktuře, změny lokalizace) byly zaznamenány u řady očních onemocnění; často mohou být i jejich příčinou. U některých chorob je postižení rohovky charakteristickým a výjimečně také jediným znakem, většinou se však jedná o onemocnění zasahující více orgánů.
Příkladem onemocnění bez dokumentovaného postižení jiných orgánů je Fuchsova endotelová dystrofie rohovky. Pro tuto chorobu je charakteristický pokles denzity buněk endotelu vedoucí ke ztrátě jeho funkčnosti, následně dochází ke vzniku edému rohovky a ztrátě zrakové ostrosti. Typické jsou i změny v DM; vznikají kapkovité prominence (guttae) směrem do přední komory oka, které narušují integritu endotelu. Rozeznáváme Fuchsovu dystrofii s manifestací v raném věku a typ s pozdní manifestací. Bylo prokázáno, že první uvedený typ je podmíněn mutacemi v genu kódujícím řetězec α2 kolagenu VIII (COL8A2); detekovány byly i změny v expresi lamininu, fibronektinu a kolagenu IV. Mutace v genu COL8A2 byly zjištěny i u pacientů trpících zadní polymorfní dystrofií, onemocněním charakterizovaným epitelizací a proliferací endotelu rohovky.
V rohovkách získaných od pacientů se zadní polymorfní dystrofií podmíněnou mutacemi v genu ZEB1 (TCF8) byl v endotelu popsán ektopický výskyt α3 řetězce kolagenu IV. Gen ZEB1 kóduje transkripční faktor, který se váže do promotorové oblasti genu pro tento řetězec.
U obou výše zmíněných dystrofií, ale i u kongenitální hereditární endotelové dystrofie a iridokorneálního endotelového syndromu, je častý vznik patologické zadní kolagenové vrstvy, ve které byly detekovány kolageny I, III, IV, V, VI a VIII.
U jednoho z nejčastěji se vyskytujících onemocnění rohovky – keratokonu – byly zjištěny abnormality v organizaci stromálních lamel s nerovnoměrnou distribucí kolagenních fibril, dále byla popsána zvýšená degradace kolagenu VI matrixmetaloproteinázou 2 a snížení množství kolagenu IV (řetězců α3–α5) v BME. Příčinná mutace v genech pro kolageny ovšem zjištěna nebyla. Patogeneze keratokonu v souvislosti s poruchami kolagenů je intenzivně studována.
Pigmentové skvrny v makule a ve střední periferii sítnice, přední lentikonus, vzácně zadní polymorfní dystrofie rohovky se objevují u pacientů s Alportovým syndromem, který je klinicky charakterizován nefritidou, často progredující do renálního selhání a ztrátou sluchu. Podstatou onemocnění jsou mutace kolagenu IV (řetězce α3–α6) vedoucí k významným poruchám BM, především glomerulů ledvin.
Oční postižení: modrá skléra, syndrom ochablého víčka, ztenčení až ruptura rohovky, mikrokornea a různé abnormality zakřivení rohovky byly zaznamenány u Ehlersova-Danlosova syndromu. Jedná se o heterogenní skupinu dědičných onemocnění pojivové tkáně charakterizované ve své klasické formě především hyperextenzibilitou a fragilitou kůže, opožděným hojením ran, snadným vznikem hematomů a generalizovanou kloubní hypermobilitou. Příčinou tohoto syndromu je řada mutací, včetně změn v genech pro různé řetězce kolagenů V, I a III. K onemocnění vedou i poruchy genů kódujících enzymy podílející se na posttranslačních modifikacích těchto kolagenů.
Osteogenesis imperfecta je skupina dědičných onemocnění podmíněných mutacemi v genech pro řetězce α1 a α2 kolagenu I, charakterizovaná náchylností ke snadné lomivosti kostí a k deformitám skeletu. Z očního postižení byly popsány modré skléry, snížení centrální tloušťky rohovky, zmenšení jejího průměru, kratší délka bulbu, myopie, keratokonus, opacity rohovky, glaukom i kongenitální ageneze Bowmanovy vrstvy.
Epidermolysis bullosa je skupina onemocnění s abnormalitami BM kůže a sliznic zahrnující několik typů, které vykazují různý stupeň postižení kůže a oka. Charakteristickým znakem je fragilita kůže, s tvorbou puchýřů po minimálním traumatu. Postižení spojivky a rohovky, projevující se poruchami ukotvení buněk epitelu k BM, může vést k opakovaným rohovkovým erozím, jizvení a v konečné fázi až ke slepotě. Dystrofická forma epidermolysis bullosa, při níž byly zjištěny mutace v α1 řetězci kolagenu VII, patří mezi nejzávažnější. U junkční formy tohoto onemocnění mohou být příčinou mutace v genu pro α1 řetězec kolagenu XVII.
Nepravidelnosti v průměru kolagenních fibril či vzdálenosti mezi nimi byly zaznamenány u mukopolysacharidózy I, III, IV a VI a také u makulární dystrofie rohovky.
Z výše uvedeného vyplývá, že zachování správné struktury a zastoupení jednotlivých kolagenů včetně jejich množství a lokalizace je nezbytné pro udržení normální funkce rohovky, a že jejich poškození je spojeno s celou řadou patologických stavů.
ZÁVĚR
Kolageny jsou základní strukturní složkou extracelulární matrix rohovky a zásadně se podílejí i na udržení její funkčnosti. Poruchy kolagenů se vyskytují u celé řady onemocnění rohovky a mohou být i jejich příčinou.
PODĚKOVÁNÍ
Tato studie byla podpořena projektem Interní grantové agentury GIGH-0561-00-3-238 a výzkumným záměrem MŠMT 002160806/20610011.
Článek s odkazy na použitou literaturu v textu a seznam literatury je k dispozici u autorů.
Mgr. Kateřina Jirsová, PhD.
Laboratoř biologie a patologie oka
a Oční tkáňová banka, VFN a 1. LF UK, Praha
U Nemocnice 2
128 08 Praha 2
e-mail.: katerina.jirsova@vfn.cz
Štítky
Oftalmológia
Článok vyšiel v časopiseČeská a slovenská oftalmologie
Najčítanejšie tento týždeň
2008 Číslo 4- Cyklosporin A v léčbě suchého oka − systematický přehled a metaanalýza
- Dlouhodobé výsledky lokální léčby cyklosporinem A u těžkého syndromu suchého oka s 10letou dobou sledování
- Účinnost a bezpečnost 0,1% kationtové emulze cyklosporinu A v léčbě těžkého syndromu suchého oka − multicentrická randomizovaná studie
- Pomocné látky v roztoku latanoprostu bez konzervačních látek vyvolávají zánětlivou odpověď a cytotoxicitu u imortalizovaných lidských HCE-2 epitelových buněk rohovky
- Konzervační látka polyquaternium-1 zvyšuje cytotoxicitu a zánět spojený s NF-kappaB u epitelových buněk lidské rohovky
-
Všetky články tohto čísla
- VNÚTROOČNÝ TLAK KRÁLIKOV PO INSTILÁCII ZMESI AMINOKYSELINY ARGINÍNU S DVOJKOMBINÁCIOU ANTIGLAUKOMATÍK (TRUSOPT + XALATAN)
- Verteporfin s ranibizumabem u neovaskulární makulární degenerace
- Zrakové funkce nedonošených dětí po operaci posthemoragického hydrocefalu
- Srovnání fixní kombinace bimatoprostu 0,03% a timololu 0,5% s jinými kombinacemi antiglaukomatik v léčbě glaukomu
- Triamcinolon v léčbě diabetického makulárního edému – roční výsledky
- Imunohistochemická detekce exprese genu p53 a p21 v buňkách maligního melanomu uvey
- Dlouhodobé výsledky anteriorizace a myektomie dolního šikmého svalu u vertikálních deviací
- Nové poznatky o retinopatii předčasně narozených dětí
- Kolageny v lidské rohovce – jejich typy, lokalizace a role
- Zpráva z kongresu American Academy of Ophthalmology, Las Vegas
- Česká a slovenská oftalmologie
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Kolageny v lidské rohovce – jejich typy, lokalizace a role
- Nové poznatky o retinopatii předčasně narozených dětí
- Dlouhodobé výsledky anteriorizace a myektomie dolního šikmého svalu u vertikálních deviací
- Imunohistochemická detekce exprese genu p53 a p21 v buňkách maligního melanomu uvey
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



