-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Zlyhanie farmakologickej antiepileptickej liečby
Failure of pharmacological antiepileptic treatment
The treatment of epilepsy is a challenging process. Correct diagnosis, accurate classification of epileptic seizures and epilepsies, and adequate selection of the antiepileptic alone are not a guarantee of a successful treatment. There are always patients who do not meet the expectations associated with pharmacological antiepileptic treatment. Failure to attain the expected effect of treatment is most often due to the following reasons: wrong diagnosis of epilepsy, wrong drug selection for the specific type of epileptic seizure, underdosing of the antiepileptic drug, insufficient absorption of the drug or its rapid metabolism, worsening of epileptic seizures after antiepileptic treatment, pseudoseizures and real epilepsy at the same time, progression of the underlying metabolic, toxic, cancerous or degenerative brain disease, toxicity of the antiepileptic drug, non-compliance of the patient, and pharmacoresistant epilepsy.
Key words:
epilepsy - failure of treatment of epilepsy – antiepileptic treatment – epileptic seizure – pharmacoresistant epilepsy
Autori: V. Donáth
Pôsobisko autorov: Banská Bystrica ; II. neurologická klinika SZU FNsP F. D. Roosevelta
Vyšlo v časopise: Cesk Slov Neurol N 2008; 71/104(2): 134-138
Kategória: Přehledný referát
Súhrn
Liečba epilepsie je náročný proces. Korektná diagnostika, správna klasifikácia epileptických záchvatov a epilepsií a primeraný výber antiepileptického preparátu nezaručí úspech v liečbe. Zostávajú pacienti, u ktorých farmakologická antiepileptická liečba nedosiahne očakávania. Pokiaľ predpokladaný účinok liečby zlyhá, ukazuje sa, že najčastejšími príčinami tohto zlyhania sú: nesprávna diagnóza epilepsie, nesprávny výber lieku pre typ epileptického záchvatu, poddávkovanie antiepileptika, nedostatočná absorpcia lieku alebo rýchly metabolizmus, zhoršenie epileptických záchvatov po antiepileptickej liečbe, pseudozáchvaty popri skutočnej epilepsii, progresia základného metabolického, toxického, nádorového či degeneratívneho mozgového ochorenia, toxicita antiepileptického preparátu, nekompliancia pacienta a farmakorezistentná epilepsia.
Kľúčové slová:
epilepsia – zlyhanie liečby epilepsie – antiepileptická liečba – epileptický záchvat – farmakorezistentná epilepsiaÚvod
Liečba epilepsie sa dramaticky zmenila za posledné desaťročie. Uviedli sa tzv. novogeneračné antiepileptiká, ktoré obohatili naše možnosti. Cieľom antiepileptickej liečby stále zostáva:
- dosiahnutie bezzáchvatového stavu
- minimalizovanie dávky nutného antiepileptika
- minimalizovanie nežiaducich účinkov
- umožnenie pacientovi plnej integrácie v spoločnosti
- zvýšenie jeho kvality života.
Antiepileptické lieky (AE) síce môžu potlačiť epileptické záchvaty, ale zatiaľ ani jeden preparát nemá vplyv na dynamický proces, ktorý epilepsiu spôsobuje, t.j. na epileptogenézu [1]. V liečbe novodiagnostikovaných epilepsií sa po prvom antiepileptiku dosiahne bezzáchvatový stav u takmer 50 % pacientov a približne v 10,5 % prípadov z rozličných príčin antiepileptická liečba zlyháva [2]. Najčastejšie príčiny zlyhania antiepileptickej liečby sú uvedené v tab. 1. Cieľom prehľadného článku je priblíženie výberu najhlavnejších a najčastejších príčin zlyhania antiepileptickej farmakologickej liečby.
Tab. 1. Najčastejšie príčiny zlyhania antiepileptickej liečby. 
Zhoršenie epileptických záchvatov po antiepileptickej liečbe
Antiepileptiká nielenže môžu zhoršovať existujúce epileptické záchvaty, ale dokonca môžu samotné záchvaty spôsobiť [3–6]. Existuje viacero vysvetlení tohto pre lekára neočakávaného účinku:
- Nesprávny výber preparátu pri liečbe epilepsie. Tento fenomén sa niekedy nazýva aj ako selektívne zhoršenie epileptických záchvatov. Najčastejšie sa vyskytuje, ak sa predpíše nevhodné antiepileptikum u špecifického epileptického syndrómu. Ide o dôsledok farmakologického účinku nesprávneho preparátu, ktorý priamo pôsobí na generáciu alebo propagáciu špecifických epileptických syndrómov. Selektívne zhoršenie sa môže vyskytnúť u pacientov liečených preparátmi, ktoré blokujú sodíkové kanály (karbamazepín oxkarbazepín, fenytoín) a liekmi (gabapentín, tiagabín, vigabatrín), ktoré účinkujú prostredníctvom systému gamaaminomaslovej kyseliny (GABA). O problematike selektívneho zhoršenia epileptických záchvatov sa nedávno publikovalo aj v našej literatúre [7].
- Pokles sérovej hladiny predtým účinného antiepileptika.
- „Paradoxná intoxikácia“ je situácia so známkami predávkovania. Klinicky sa objavuje zvýšenie frekvencie, alebo objavenie sa nového typu epileptických záchvatov pri použití odporučených dávok. Najskôr ju podmieňujú individuálne rozdiely vo farmakokinetike antiepileptík. Ide o nepredvídateľnú reakciu.
- Zhoršenie epileptických záchvatov ako prejav paradoxnej reakcie; paradoxnou reakciou sa nazýva situácia, ak (a) antiepileptikum zhorší záchvaty, proti ktorým by malo účinkovať, alebo (b) spustí úplne iný, nový typ záchvatov. Rozdiel medzi paradoxnou reakciou a neprimeraným výberom antiepileptika nemusí byť vždy zjavný.
- Liekmi indukovaná encefalopatia.
- Progresia základného neurologického ochorenia, ktorú sprevádza zvýšenie frekvencie záchvatov.
- Strata účinku predtým efektívneho antiepileptika [6]. Môže sa tiež vysvetliť porušenou reguláciou senzitivity alebo denzity receptorov. Pôvodne inhibičný vplyv lieku potom spustí alternatívne mechanizmy [23].
- Interakcie antiepileptík s inými liekmi, ktoré privodia zvýšenie alebo pokles sérovej hladiny antiepileptík.
- Špecifické nežiaduce účinky antiepileptík.
- Záchvaty pri elektrolytovom rozvrate, ktorý spôsobili antiepileptiká; napr. hyponátremia navodená karbamazepínom.
- Liekovo indukovaná IgA deficiencia, ktorá má za následok systémový lupus erythematosus (SLE); SLE sa spája s 10% incidenciou záchvatov. Známa je asociácia liečby karbamazepínom alebo ethosuximidom s SLE [8,9]
- Zníženie biologickej dostupnosti antiepileptík; k tejto situácii môže dôjsť pri výmene antiepileptika obsahujúceho to isté generikum, ale s rozdielnymi liekovými formami; napr. použitie iných liekových foriem karbamazepínu malo za následok status epilepticus u pacienta, ktorý bol predtým stabilizovaný [10].
- Neprimerane rýchle vysadenie antiepileptickej liečby môže spôsobiť zvýšenie frekvencie epileptických záchvatov.
Neindikované predpisovanie antiepileptík
Antiepileptiká by sa mali indikovať v takých prípadoch epilepsie, kedy prevažuje benefit nad rizikom. Existuje množstvo stavov, keď nie sú žiadne pochybnosti o účelnosti ich predpisovania. Rozhodnutie, či nasadenie liečby je alebo nie je indikované, môže byť niekedy problematické. V tab. 2 sa uvádzajú situácie, pri ktorých sa nepovažuje za správne indikovať antiepileptickú liečbu [11]. Za zbytočné sa považuje liečenie antiepileptikami v prípadoch benígnej epilepsie s centrotemporálnymi hrotmi, alebo ako prevencia neskorej poúrazovej epilepsie. Preventívna liečba antiepileptikami zlyháva aj v prípadoch preventívneho podania po operáciách mozgových nádorov. Takáto liečba nepôsobí proti epileptogenéze, a preto zlyháva [12].
Tab. 2. Nesprávne indikácie antiepileptík. 
Neprimerane rýchla eskalácia dávky
Rýchlosť titrácie antiepileptickej liečby má svoje zásady pre každý liek. Agresívna eskalácia môže spôsobiť závažné nežiaduce účinky, a tým aj zlyhanie liečby. K rozvoju tohto problému prispievajú aj klinické štúdie nových antiepileptík. Ako príklad môže slúžiť topiramát, ktorého neurotoxicita sa ukázala pri rýchlej titrácii 100–200 mg/týždeň s cieľovou dávkou 400 mg/deň. Pre nežiadúce účinky sa liečba musela prerušiť takmer u 1/3 pacientov. Spomalenie titrácie na 50 mg/týždeň malo za následok lepšiu znášanlivosť v 50 % prípadov [13]. Rýchla titrácia karbamazepínu, fenytoínu a lamotrigínu môže spôsobiť kožný raš. Riziko kožnej reakcie a nasledujúca nevyhnutnosť vysadenia lieku sa výrazne zvyšuje tiež v prípadoch rýchlej titrácie lamotrigínu ako prídavnej liečby ku kyseline valproovej.
Ďalším problémom je rozvoj tolerancie (adaptácie) centrálneho nervového systému na antiepileptickú liečbu. Tento fenomén sa pozoroval pri primidone, benzodiazepínoch, tiagabíne a aj pri vigabatríne [11].
Neprimerane vysoké dávky antiepileptík
Neprimerane vysoké dávky môžu spôsobiť tak závažné nežiaduce účinky, že si vynútia vysadenie liečby. Každý pacient vyžaduje individualizáciu dávky antiepileptika, pretože tá istá dávka môže byť pre jedného znesiteľná a pre ďalšieho toxická [11].
Neprimerane vysoké dávky môžu byť ako následok:
- neadekvátne vysokej cieľovej dávky
- titrácie neprimerane vysokými dávkami
- nesprávnej interpretácii výsledku monitorovania sérových hladín
Neadekvátne vysoká iniciálna cieľová dávka
S ohľadom na existenciu farmakokinetickej a farmakodynamickej variability, interindividuálnych charakteristík pacienta, ako aj typu jeho epilepsie, je potrebné vopred odhadnúť dávkovanie. Pacienti s idiopatickou generalizovanou epilepsiou často vyžadujú nižšie dávky v porovnaní s pacientmi, ktorí majú iné formy epilepsie [14]. Vysoká frekvencia záchvatov po začatí liečby, symptomatická epilepsia, parciálne záchvaty, viacpočetné typy záchvatov, závažná komorbidita a neúspech predošlej antiepileptickej liečby sú rizikovými faktormi pre zlyhanie antiepileptickej liečby.
Titrácia neprimerane vysokými dávkami
Ak iniciálna dávka nie je účinná (zlyhá), zvyčajne sa odporúča pomaly a postupne zvyšovať dennú dávku. Meradlom je priaznivá klinická odpoveď s redukciou záchvatov a minimom nežiadúcich účinkov. Klinické štúdie sa vo väčšine prípadov nezaoberajú dopadom pomeru benefitu a rizika pri zvyšovaní antiepileptickej liečby. Zvyšovanie dávky však vo väčšine prípadov popri benefite zníženia frekvencie záchvatov prináša aj zvýšenie rizika nežiadúcich účinkov. Obzvlášť to platí pre fenytoín, pretože pri zvyšovaní dávkovania môže dôjsť k tzv. Michaelis-Mentenovej kinetike s neproporcionálnym zvýšením jeho sérovej hladiny [15]. Dekompenzácia epilepsie po neprimeranom zvýšení dávky sa vyskytuje aj pri iných antiepileptikách ako tzv. paradoxná reakcia. Okrem fenytoínu je častá aj pri vigabatríne. Tento fenomén sa môže vyskytnúť bez iných príznakov toxicity. Každý klinický lekár by mal preto počítať s eventualitou výskytu tohto fenoménu. Ďalšie neprimerané zvyšovanie antiepileptika môže privodiť bludný kruh s dekompenzáciou záchvatov.
Neprimerané používanie monitorovania sérových hladín
Sledovanie sérovej hladiny antiepileptík môže mať význam pri optimalizácii liečby klasickými antikonvulzívami, pretože nemajú lineárnu kinetiku. Niektorí lekári zabúdajú, že existujú pacienti, ktorí dosiahnu bezzáchvatový stav aj v prípadoch, keď je hodnota sérovej hladiny lieku pod zvyčajne odporúčaným terapeutickým rozmedzím. Neodôvodnené zvýšenie dávky môže spustiť nežiadúce mechanizmy, a tým spôsobom prispieť k zlyhaniu liečby [16]. Popísaný postup vyplýva z nedostatočného porozumenia farmakokinetickým princípom medzi koncentráciou v sére, dávkou a klinickým účinkom. Napríklad u pacientov s hypoalbuminémiou alebo s urémiou dochádza k redukcii plazmatických proteínov a antikonvulzíva s vysokým stupňom väzby na bielkoviny sa nenaviažu. Optimálna, farmakologicky aktívna koncentrácia sa síce dosiahne, ale celková odmeraná koncentrácia v sére je nižšia ako zvyčajne. Takéto zistenie môže lekára priviesť k mylnému rozhodnutiu o zvýšení dávky, čo môže viesť k zvýšeniu rizika a objaveniu sa nežiaducich účinkov a k vysadeniu liečby [11].
Neprimeraná – neodôvodnená polyfarmácia
Výhody a limitácie monoterapie a polyterapie
Ak iniciálne nasadené antiepileptikum zlyhá a nedosiahne sa bezzáchvatový stav, alternatívna monoterapia môže mať úspech u 15–30 % prípadov [11]. V štúdii pacientov s neefektívnou iniciálnou monoterapiou sa v 17 % prípadoch dosiahol úspech kombináciou antiepileptík [17]. Monoterapia v porovnaní s polyterapiou sa v súčasnosti hodnotí ako výhodnejší postup. Nepochybne existuje skupina pacientov, kde kombinačná liečba môže mať svoj význam, pretože sa dosiahne dobrý terapeutický efekt s akceptačnou úrovňou nežiadúcich účinkov.
V prípadoch chronickej refraktérnej epilepsie je častá zmena liečby len zdanlivo výhodnejšia v porovnaní s jej účinkom. U týchto pacientov dochádza k fluktuáciam vo frekvencii záchvatov. V poradí 2. alebo 3. antiepileptikum sa veľmi často pridáva v čase exacerbácie procesu. Následné zlepšenie nie je prejavom účinku pridaného antiepileptika, ale dôsledkom zlepšenia vlastného procesu v rámci fluktuácie ochorenia. Tento jav sa nazýva fenomén regresie. Pridané antiepileptikum je nefunkčné (zlyháva), zvyšuje riziko nežiadúcich účinkov a ako je aj vyššie uvedené, paradoxne môže zhoršiť kontrolu epileptických záchvatov. Indikácia kombinačnej liečby by sa mala opakovane prehodnocovať a podľa možnosti sa odporúča návrat k monoterapii [11].
Nežiaduce liekové účinky
Kombinácia 2 alebo viacerých antiepileptík môže tak mať za následok farmakokinetické ako aj farmakodynamické interakcie. Tieto sa môžu závažným spôsobom podieľať na výskyte nežiadúcich liekových účinkov. Farmakokinetické interakcie zahŕňajú zmeny v absorpcii, distribúcii, alebo v eliminácii hodnotených liekov. Najzávažnejšie až toxické farmakokinetické interakcie zapríčiňujú lieky, ktoré pôsobia inhibične na enzýmový mechanizmus ich vlastného hepatálneho metabolizmu. Klasickým príkladom je zvýšenie plazmatickej hladiny fenobarbitalu alebo lamotrigínu po pridaní kyseliny valproovej alebo zvýšenie plazmatickej hladiny fenytoínu po oxkarabazepíne [18]. Na základe vedomostí o mechanizme účinku jednotlivých antiepileptík sa dajú predpovedať nepriaznivé liekové interakcie. Správna kombinácia a primerané dávkovanie umožnia predísť zlyhaniu antiepileptickej liečby.
Farmakodynamické interakcie majú za následok aditívny, infraaditívny (antagonistický) alebo supraaditívny (synergický) účinok v mieste pôsobenia liekov. Zlyhanie antiepileptickej liečby je zvyčajne výsledkom aditívneho alebo supraadditívneho neurotoxického účinku ako dôsledku potenciácie nežiadúcich účinkov z viacerých miest. Farmakodynamickými interakciami sa vysvetľuje aj mechanizmus tolerancie (návyku) s následnou stratou účinku. Zdá sa, že nežiaduce farmakodynamické účinky sa objavia skôr, ak súčasne aplikované antiepileptiká pôsobia tým istým mechanizmom. Napríklad nežiadúce neurotoxické príznaky pri kombinácii lamotrigínu a karbamazepínu sa pripisujú aditívnemu alebo supraaditívnemu účinku na blokádu sodíkových kanálov [19].
Farmakorezistentná epilepsia
Asi 20–30 % pacientov s epilepsiou má záchvaty, ktoré nie sú primerane kontrolované antiepileptickou farmakoterapiou. Nedávno vyšla publikácia, ktorá komplexne rieši tento problém [20]. Definícia farmakorezistentnej epilepsie nie je celkom jednotná. V podstate ide o zlyhanie antiepileptickej liečby s pokračujúcim výskytom záchvatov. Zlyhanie liečby sa vysvetľuje:
- záchvatové stavy nie sú epileptické
- nesprávny terapeutický plán
- nedostatočná spolupráca s pacientom (nekompliancia)
- genetické faktory – poruchy v transportných systémoch
- špeciálne symptomatické epilepsie (tab. 3) [21].
Tab. 3. Najčastejšie stavy, ktoré sa spájajú s farmakorezistentnou epilepsiou. 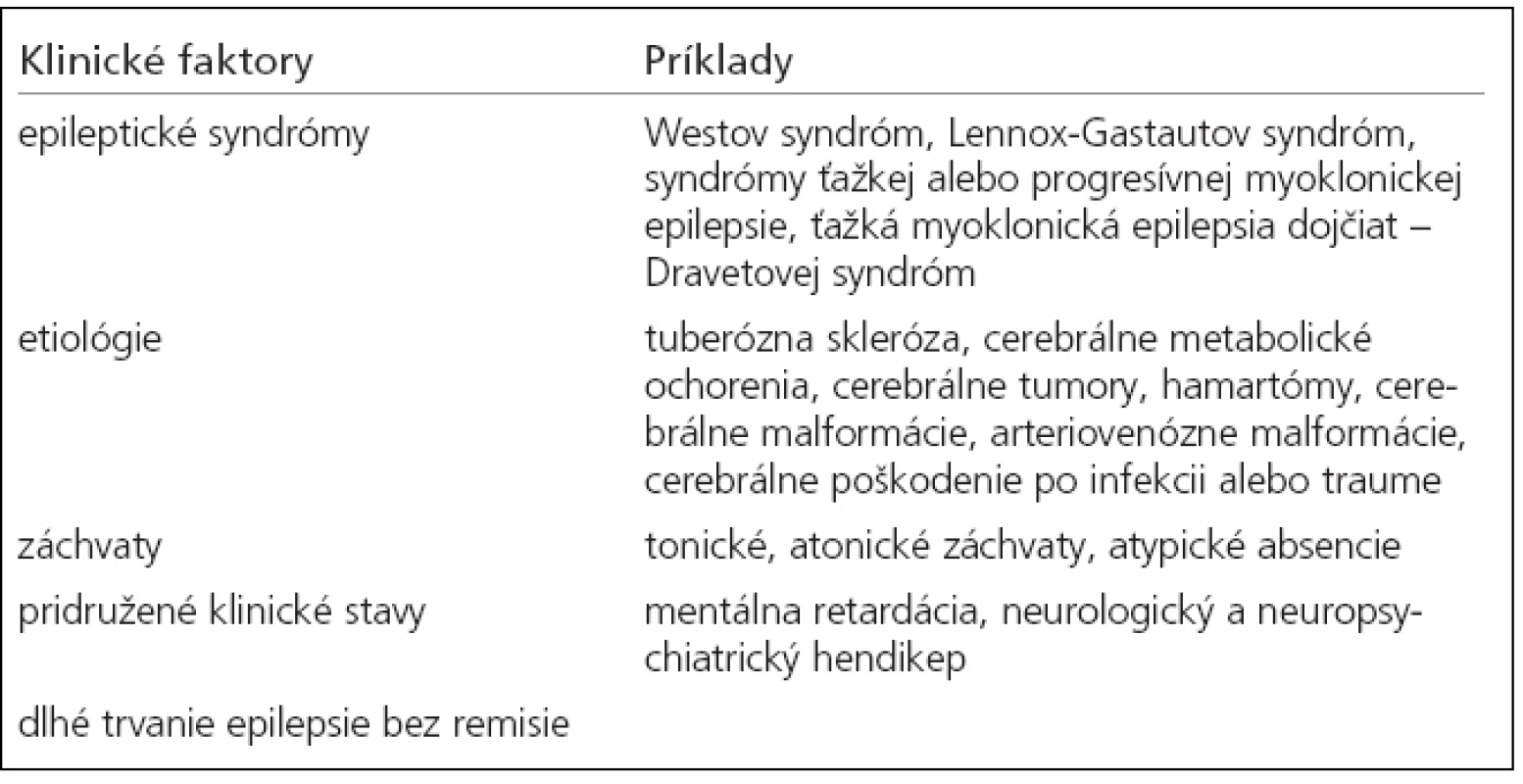
Farmakorezistencia sa môže považovať za opačnú stranu epileptogenézy. V poslednej dobe sa sústreďuje pozornosť na úlohu tzv. liekových transportných systémov. Významnú pozíciu môže mať P-glykoproteín (PGP) a skupina proteínov, ktorá sa v angličtine označuje ako multidrug resistance-associated protein (MRP). Tieto pôsobia ako transportéri cez hematoencefalickú bariéru. Predpokladá sa, že účinkujú aktívnym defenzívnym mechanizmom, ktorý bráni penetrácii lipofilných častíc do mozgu [22]. Genetické zmeny v liekových transportných systémoch môžu spôsobiť, že antiepileptikum nedosiahne cieľ a týmto spôsobom zlyháva [1].
Záver
Antiepileptické lieky môžu potlačiť samotný epileptický záchvat, avšak nie mechanizmus jeho vzniku. Počiatočný priaznivý priebeh ochorenia nie je zárukou neskoršieho zlyhania antepileptickej liečby. Napriek existencii nesporne účinných preparátov asi v 30 % prípadov liečba zlyháva. Vysvetlenie je komplikované, pretože ide o multifaktoriálny problém. Komplikácie môžu vzniknúť následkom výberu preparátu lekárom, v neuspokojivej spolupráci pacienta, v charakteristike lieku, ale aj v komplikovanosti samotného ochorenia, kde môže ísť o progresiu ochorenia a aj o geneticky determinované faktory. K tomuto pristupuje aj naša neznalosť všetkých neurobiologických faktorov, prípadne farmakokinetických a farmakodynamických vlastností. V prehľadnom článku sme priblížili najvýznamnejšie činitele, ktoré môžu viesť k zlyhaniu antiepileptickej liečby. Ak nastane prípad zlyhania antiepileptickej liečby, je vždy dôležité opätovne prehodnotiť správnosť našich diagnostických a terapeutických postupov ako aj sa uistiť o primeranej spolupráci s pacientom.
doc. MUDr. Vladimír Donáth, CSc.
II. neurologická klinika SZU FNsP F. D. Roosevelta
Nám. L. Svobody 1
975 17 Banská Bystrica
vdonath@isternet.sk
Přijato k recenzi: 21. 8. 2007
Přijato do tisku: 26. 10. 2007
Zdroje
1. Brodie MJ, Leach JP. Success or failure with antiepileptic drug therapy: Beyond empiricizm? Neurology 2003; 60 : 162–163.
2. Kwan P, Brodie MJ. Effectiveness of first antiepileptic drug. Epilepsia 2001; 42 : 1255–1260.
3. Genton P, McMenamin J. Summary. Aggravation of seizures by antiepileptic drugs: what to do in clinical practice. Epilepsia 1998; 39(Suppl 3): S26 –S29.
4. Perucca E, Gram L, Avanzini G, Dulac O. Antiepileptic drugs as a cause of worsening seizures. Epilepsia 1998; 39 : 5–17.
5. Donáth V. Iatrogénna problematika antiepileptík. Neurologie pro praxi 2003; 3 : 116–120.
6. Sýkora P, Sýkora J. Môžu antiepileptiká zhoršiť priebeh epilepsie? Farm obzor 1999; 68 : 219 –222.
7. Ošlejšková H. Zhoršování epileptických záchvatů a epilepsií antiepileptiky – je to možné? Cesk Slov Neurol N 2007; 2 : 137–142.
8. Jain KK. Sytemic lupus erythematosus (SLE)-like syndromes associated with carbamazepine therapy. Drug Saf 1991; 6 : 350 –360.
9. Aarli JA. Immunological aspects of epilepsy. Brain Dev 1993;15 : 41–49.
10. Bell WL, Crawford IL, Shiu GK. Reduced bioavailability of moisture-exposed carbamazepine resulting in status epilepticus. Epilepsia 1993; 34 : 1102 –1104.
11. Perucca E. Overtreatment in epilepsy: adverse consequences and mechanisms. Epilepsy Res 2002; 52 : 25–33.
12. Temkin NR. Antiepileptogenesis and seizure prevention trials with antiepileptic drugs: meta-analysis of controlled trials. Epilepsia 2001; 42 : 515–524.
13. Biton V, Edwards KR, Montouris GD et al. Topiramate titration and tolerability. Ann Pharmacother 2001; 35 : 173–179.
14. Richens A, Davidson DL, Cartlidge NEF, Easter DJ. A multicentre comparative trial of sodium valproate and carbamazepine in adult onset epilepsy. Adult EPITEG Collaborative Group. J Neurol Neurosurg Psychiatry 1994; 57 : 682–687.
15. Perucca E, Dulac O, Shorvon S, Tomson T. Harnessing the clinical potential of antiepileptic drug therapy: dosage optimisation. CNS Drugs 2001; 15 : 609–621.
16. Chadwick, DW. Overuse of monitoring of blood concentrations of antiepileptic drugs. Br Med J 1987; 294 : 723–724.
17. Kwan P, Brodie MJ. Early identification of refractory epilepsy. N Engl J Med 2000; 342 : 314–319.
18. Patsalos P, Fröscher W, Pisani F, van Rijn CM. The importance of drug interactions in epilepsy therapy. Epilepsia 2002; 43 : 365–385.
19. Besag FM, Berry DJ, Pool F, Newbery JE, Subel KB. Carbamazepine toxicity with lamotrigine: pharmacokinetic or pharmacodynamic interaction? Epilepsia 1998; 39 : 183–187.
20. Brázdil M, Hadač J, Marusič P a kol. Farmakorezistentní epilepsie. Praha: Triton 2004.
21. Engel J jr. Intractable epilepsy: definition and neurobiology. Epilepsia 2001; 42(Suppl 6): 3.
22. Löscher W, Potschka H. Role of multidrug transporters in pharmacoresistance to antiepileptic drugs. J Pharmacol Exp Ther 2002; 301 : 7–14.
23. Sazgar M, Bourgeois BF. Aggravation of epilepsy by antiepileptic drugs. Pediatr Neurol 2005; 33 : 227–234.
Štítky
Detská neurológia Neurochirurgia Neurológia
Článek Roztroušená sklerózaČlánek Žena a iktusČlánek Soutěž o nejlepší publikaceČlánek Webové okénko
Článok vyšiel v časopiseČeská a slovenská neurologie a neurochirurgie
Najčítanejšie tento týždeň
2008 Číslo 2- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Kombinace metamizol/paracetamol v léčbě pooperační bolesti u zákroků v rámci jednodenní chirurgie
- Antidepresivní efekt kombinovaného analgetika tramadolu s paracetamolem
- Neuromultivit v terapii neuropatií, neuritid a neuralgií u dospělých pacientů
- Srovnání analgetické účinnosti metamizolu s ibuprofenem po extrakci třetí stoličky
-
Všetky články tohto čísla
- Roztroušená skleróza
- Zlyhanie farmakologickej antiepileptickej liečby
- Patofyziologie bloku vedení u neuromuskulárních chorob
- Žena a iktus
- Soutěž o nejlepší publikace
- Diagnostika hyponatremií v neurointenzivní péči: úloha renálních funkčních parametrů
- Úskalí diagnostiky a léčby flekčně-distrakčních poranění hrudní a bederní páteře: prospektivní studie
- Efekt endoskopické a klasické operace pro syndrom karpálního tunelu
- Mírná řízená hypotermie jako neuroprotektivní metoda při pozdních ischemických komplikacích v resuscitační péči u pacientů s těžkým spontánním subarachnoidálním krvácením při ruptuře aneuryzmatu
- Komentář ke článku Charvát F, Mašková J, Lacman J, Beneš V. Intrakraniální angioplastika a implantace stentu u aterosklerotických lézí.
- Intrakraniální angioplastika a implantace stentu u aterosklerotických lézí
- Familiárna agregácia Parkinsonovej choroby: genealogická štúdia
- PCR diagnostika herpetických virů u pacientů s akutní „idiopatickou“ parézou lícního nervu
- Výsledky léčby gliomů nízkého stupně malignity u dětí (retrospektivní analýza dat)
- Komentář k článku Valchář J et al. Hemangioblastom a jeho léčba pomocí Leksellova gama nože
- Hemangioblastom a jeho léčba pomocí Leksellova gama nože
- Syndrom Smithové-Magenisové: kazuistika
- Webové okénko
-
Analýza dat v neurologii
VIII. Binomické rozdělení -
Zpráva z Prvního kongresu Mezinárodní společnosti intraoperační neurofyziologie
Luzern, Švýcarsko 15.–18. 11. 2007 - Závěry „Winter GLIO TRACK Meeting“ 2008
- Zpráva z Neurovaskulárního kongresu, Ostrava 2008
- K životu a práci prof. MUDr. P. Varsika, DrSc. (18. 9. 1941–29. 12. 2005)
- Česká a slovenská neurologie a neurochirurgie
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Roztroušená skleróza
- Hemangioblastom a jeho léčba pomocí Leksellova gama nože
- Syndrom Smithové-Magenisové: kazuistika
- Výsledky léčby gliomů nízkého stupně malignity u dětí (retrospektivní analýza dat)
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



