-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Inhibitory protonové pumpy – up to date
Proton-pump inhibitors – up to date
To date, five proton pump inhibitors (PPIs) are available: The first generation of PPIs includes omeprazole, lansoprazole and pantoprazole; the second generation is represented by rabeprazole and esomeprazole which have several advantages over the older agents, particularly in terms of rapid action and profound and consistent acid inhibition. The older PPIs, mainly omeprazole and lansoprazole are predominantly metabolised by CYP2C19, whereas pantoprazole and esomeprazole are metabolized also by other metabolic pathways and only to a lesser extent by CYP2C19. The PPIs have been developed and licensed in different dosages; omeprazole 20 mg, esomeprazole 40 mg, lansoprazole 30 mg, pantoprazole 40 mg and rabeprazole 20 mg. First generation of PPIs have comparable antisecretion efficacy which is influenced by enzymatic activity of CYP2C19. Currently, PPis are used in several indication of acid-related diseases. They have significant role in therapy of gastric and duodenal ulcers; gastro-oesophageal reflux disease; therapy and prophylaxis of NSAIDs gastropathy; co-therapy in eradication of Helicobacter pylori infection; therapy of functional dyspepsia and treatment and prophylaxis of recurrent non-variceal upper GI bleeding. The safety profile of PPIs seems to be favourable, both in short-term and long-term use.
Key words:
proton pump inhibitors – omeprazole – lansoprazole – pantoprazole – esomeprazole – rabeprazole – Helicobacter pylori – gastroesophageal reflux disease
Autoři: J. Martínek 1; M. Lukáš 2,3
Působiště autorů: Interní klinika 1. LF UK a ÚVN Praha 1; Klinické a výzkumné centrum pro střevní záněty, ISCARE Lighthouse a. s. a 1. LF UK v Praze 2; Ústav klinické biochemie a laboratorní diagnostiky, 1. LF UK v Praze 3
Vyšlo v časopise: Gastroent Hepatol 2011; 65(6): 331-342
Kategorie: Klinická a experimentální gastroenterologie: přehledová práce
Souhrn
V současné době je v klinické praxi využíváno celkem pět inhibitorů protonové pumpy (IPP). Léčiva první generace představují omeprazol, lansoprazol a pantoprazol; látky druhé generace IPP jsou esomeprazol a rabeprazol, které mají rychlejší nástup účinku a trochu silnější a trvalejší antisekreční efekt. IPP první generace jsou preferenčně metabolizovány enzymem CYP2C19, jde především o omeprazol a lanzoprazol. Pro pantoprazol a esomeprazol představuje systém cytochromu P450 pouze jednu z metabolických cest. V klinické praxi se IPP obvykle používají v následujícím dávkování: omeprazol 20 mg denně, lanzoprazol 30 mg, pantoprazol 40 mg, esomeprazol 40 mg a rabeprazol 20 mg denně. Míra antisekrečního účinku IPP první generace je u všech tří preparátů srovnatelná a je mimo jiné ovlivněna aktivitou klíčového enzymu CYP2C19. Klinické využití IPP zahrnuje celé spektrum tzv. acidopeptických chorob. V současné době jsou IPP základními léky v terapii refluxní choroby jícnu, peptického vředu žaludku a duodena, eradikačních schémat helikobakterové infekce, profylaxi a terapii NSA gastropatie, funkční žaludeční dyspepsie a v profylaxi časné recidivy krvácení z peptického vředu. Jedná se o velmi bezpečná léčiva s minimálním výskytem nežádoucích účinků, a to i přes nutnost mnohaleté terapie u některých pacientů.
Klíčová slova:
inhibitory protonové pumpy – omeprazol – lansoprazol – pantoprazol – esomeprazol – rabeprazol – Helicobacter pylori – refluxní choroba jícnuInhibice sekrece žaludeční kyseliny byla vždy cílem snažení mnoha lékařů, vědců, fyziologů i farmaceutických koncernů. Kyselina se od jejího objevu v 19. stol. stala jakousi metlou, které byly přisuzovány mnohé problémy, zvláště pak vznik peptické ulcerace.
Historie inhibice sekrece kyseliny je stručně popsána v následujícím článku. Je zřejmé, že na konci tohoto letitého snažení stálo uvedení inhibitorů protonové pumpy (IPP) do klinické praxe v 80. letech. Tyto léky se posléze v letech 90. staly hlavními, a v současné době v podstatě jedinými blokátory sekrece, které lékařska obec k léčbě pacientů používá. K „první“ generaci IPP patří omeprazol, pantoprazol a lansoprazol. Později byly na trh uvedeny IPP „druhé generace“ rabeprazol a esomeprazol.
V ČR jsme byli svědky určitého specifika. Byli jsme v podstatě jedinou evropskou zemí, kde nebyl originální esomeprazol, produkt firmy Astra Zeneca, vůbec k dispozici. Proto je v ČR tento lék, který lékařům přináší určité, byť ne zásadní či dramatické výhody, k dispozici až nyní, kdy přichází již jako generikum.
Cílem článku je shrnout problematiku farmakologických vlastností, účinku, indikací a interakcí této lékové skupiny.
Historie objevu IPP
Současnou gastroenterologii poznamenaly dvě revoluční události. První událostí byl objev a vývoj léků, které zcela specificky blokují žaludeční sekreci kyseliny chlorovodíkové. Druhou událostí byl překvapivý a nečekaný objev infekce Helicobacter pylori.
Objev IPP znamenal revoluci v gastroenterologii a celé medicíně a do jisté míry navázal na objev a používání AH2R. V r. 1967 inicioval vedoucí výzkumu švédské firmy Astra Hässle Ivan Östholm projekt, jehož cílem bylo nalézt lék blokující sekreci žaludeční kyseliny. Prvním konceptem bylo použití lokálních anestetik na bázi již dobře zavedeného lidocainu. Již tehdy bylo z experimentu známo, že lokální anestezie žaludečního antra vedla k potlačení sekrece gastrinu. Předpokládalo se, že tímto mechanizmem by se mohla účinně blokovat sekrece kyseliny. Jelikož všechna lokální anestetika byla po změně struktury v kyselém prostředí žaludku inaktivní a většinou též toxická, nalezla se řada nových chemických látek, přičemž nejméně toxické a přitom aktivní se zdály karbamáty. Ačkoli karbamáty blokovaly sekreci kyseliny u krys, nevedly ke stejnému efektu u psů. „Nejvíce účinný“ zástupce této skupiny, tzv. H 81/75, byl v r. 1971–1972 testován u lidí. Zjistilo se však, že stejně jako u psů je zcela neúčinný.
V r. 1973 se konal první kongres Maďarské společnosti farmakologů v Budapešti. Maďarští autoři zde publikovali experimentální práci o antisekrečních účincích 2-pyridil-thioacetamidu (tzv. CMN 131), který byl vyvinut francouzskou společností Servier. Tento preparát měl významné antisekreční účinky u krys i psů. Vývoj „léku“ však dále nepokračoval vzhledem k výrazné toxicitě. Přesto si tohoto abstraktu všimli v Astře a rozhodli se, že další vývoj se bude odvíjet od této molekuly.
Program chemické syntézy se zaměřil na možnosti doplnění pyridinového prstence původní molekuly CMN 131 buď látkami na bázi thiomočoviny, nebo thioamidů. Mezi první skupinu se zařadila molekula thioeterů s imidazolinovým prstencem, jedním z nich byl H 77/67. Druhou skupinu reprezentovaly molekuly, kde došlo k „zamaskování“ atomu síry do kruhu (např. H 116/18). U psů však nebyl H 116/18 vůbec aktivní. Naopak CMN 131 i H 77/67 byly v rukách švédských výzkumníků velmi silnými inhibitory sekrece. Benzimidazolový analog látky H 77/67, tzv. H 124/26, byl syntetizován v r. 1973 a jednalo se do té doby o nejsilnější inhibitor žaludeční sekrece, jaký kdy spatřil světlo světa. Projekt tudíž mohl dále pokračovat ve spolupráci a s podporou firmy Abbott Laboratories v Chicagu. H 124/26 se logicky stal středem hlavního zájmu – z dnešního pohledu je nutné zdůraznit, že se vlastně jednalo o první substituovaný benzimidazol [1].
Další vývoj nebyl bez problémů a je třeba zdůraznit, že mechanizmus, jakým uvedené látky blokovaly sekreci kyseliny, nebyl vůbec znám.
V r. 1977 se v Uppsale konala vědecká konference na téma iontových transportů v buňkách sliznice. Američan George Sachs zde přednášel své výsledky o H+/K+ATP jakožto konečném kroku sekrece žaludeční kyseliny. Sachs též ukázal výsledky imunohistologických experimentů, když nalezl výraznou imunoreaktivitu mimo žaludek také ve štítné žláze. Jaké bylo Sachsovo překvapení, když mu švédští autoři řekli, že kdyby studoval brzlík, nalezl by pravděpodobně též pozitivní reakci. Sachs byl velice překvapen a otázal se, jak na to přišli, neboť on brzlík studoval a tyto údaje zatím nepublikoval. Švédi jej tudíž informovali o vývoji a účincích molekuly H 83/69 a navrhli mu, zda by nechtěl vyšetřit, zda tato molekula „náhodou“ neblokuje právě objevenou H+/K+ATP. Sachs se usmál a poradil Švédům, aby nebyli příliš optimističtí, a protože právě pracoval na dalším vývoji nových AH2R, další spolupráci odmítl.
Začalo tedy rozsáhlé studium H+/K+ATP a charakterizace jejího fosfátového komplexu. Klíčovým bylo zjištění, že k inhibici sekrece kyseliny docházelo pouze v kyselém prostředí. To naznačovalo, že substituované benzimidazoly nejsou aktivní jako takové a že musí dojít k jejich transformaci a jejím prvním krokem je protonace. Další experimenty prokázaly vazbu substituovaných benzimidazolů na H+/K+ATP.
Další molekulou se stala H 83/88, která byla stejně účinná jako předešlá H 83/69 (timoprazole) a přitom neměla jakýkoli efekt na štítnou žlázu či brzlík. Problémem se stal výskyt nekrotizující vaskulitidy. Projekt byl opět v ohrožení. Byla zkoušena i další molekula, H 194/94, tzv. picoprazole. Picoprazole byl dalším „do té doby nejsilnějším“ inhibitorem žaludeční sekrece a naštěstí bez vlivu na štítnici či thymus. Nekrotizující vaskulitida některých psů však byla popsána i s picoprazolem v r. 1978 a toxikologičtí experti doporučovali zastavit další práce. Jeden ze členů vědecké rady však upozornil, že ve skupině neléčených zvířat se také vyskytla vaskulitida. Celý problém se nakonec uzavřel jako vaskulitida na podkladě alergické reakce po léčbě antiparazitárními léky u geneticky predisponovaných jedinců, která vůbec nesouvisela s podáváním antisekrečního léku. U psů, kteří nikdy nebyli léčeni antiparazitárními léky, se žádné vaskulitidy nevyskytovaly. Proto se opakovala celá série toxikologických studií a tentokrát se nevyskytly žádné problémy. Následovaly studie se zdravými dobrovolníky a studie u pacienta se Zollinger-Ellisonovým syndromem. Tento pacient měl recidivující ulcerace a epizody krvácení do GIT navzdory vysokým dávkám cimetidinu. Léčba s picoprazolem byla úspěšná, vedla k vyhojení vředů a pacient dále nekrvácel.
Poslední úpravou molekuly byla změna substituentů na heterocyklickém kruhu tak, aby sloučenina byla slabou zásadou s optimální disociační konstantou pKa za účelem maximální koncentrace sloučeniny na místě akce, tj. v oblasti sekrečního kanalikulu. Touto molekulou se stala v r. 1979 (tj. 12 let po zahájení prvních prací) H 168/68 a byla pojmenována omeprazol. Byla netoxická, doposud nejúčinnější a první klinické výsledky byly představeny na satelitním sympoziu Světového gastroenterologického kongresu ve Stockholmu v r. 1982. Léčba dvanáctníkových vředů u 26 pacientů se 40 mg denně po dobu čtyř týdnů vedla k vyléčení u 25 z nich [2].
Na obr. 1 je znázorněna chemická struktura všech molekul od prvního karbamátu až po konečný omeprazol.
Obr. 1. Přehled vývoje jednotlivých molekul, které vedly až k syntéze omeprazolu. Fig. 1. The overview of particular molecules which led to omeprazole synthesis. 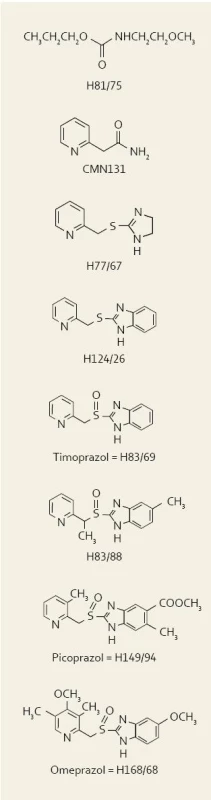
Klinická farmakologie IPP
Mechanizmus účinku a farmakokinectiké vlastnosti
Mechanizmus účinku všech IPP je totožný. IPP jsou substituované benzimidazoly (lépe pyridinmethylsulphinylbenzimidazoly). Všechny léky této skupiny jsou slabé báze s pKa kolem 4, které jsou podávány ve formě neaktivního proléku. V tomto neaktivním a elektricky neutrálním stavu IPP snadno pronikají biologickými membránami. To umožňuje jejich rychlou absorpci a distribuci do oblasti s nízkým pH, tj. do oblasti sekrečního kanálku. Např. koncentrace omeprazolu je zde až tisíckrát větší než koncentrace omeprazolu v plazmě. V sekrečním kanálku dochází k jejich protonaci a následné změně konformačního uspořádání (vytvoří se tzv. aktivní sulfenamid). Aktivní sulfenamid se ireverzibilně váže na extracytoplasmatickou část katalytické podjednotky (alfa) protonové pumpy v sekrečním kanálku. Vazba probíhá na SH-skupiny, čímž se utvoří kovalentní disulfidické můstky. Tím se ihned zastaví proudění vodíkových iontů navenek a draslíkových iontů dovnitř buňky. Je důležité, že sulfenamid nemůže díky svému pozitivnímu náboji pronikat skrze biologické membrány, a proto se nemůže dostat nikam jinam.
IPP blokují jak bazální, tak stimulovanou sekreci kyseliny nezávisle na charakteru stimulu. Stupeň inhibice není závislý na plazmatické koncentraci léku. Naopak přesná korelace byla nalezena mezi plochou pod křivkou koncentrace (AUC) a produkovaným účinkem. Jinými slovy síla účinku IPP je dána množstvím léku, které se dokáže koncentrovat do cílové oblasti sekrečního kanálku.
Plazmatický poločas omeprazolu i jiných IPP je přibližně 60 min. Přesto většinou stačí pouze jedna dávka (ráno), která zabezpečí účinnou inhibici sekrece kyseliny po celých 24 hod (obr. 2). Je to proto, že kovalentní vazba na pumpu je stálá a další sekrece kyseliny je závislá na syntéze nebo aktivaci nových pump. Účinnost IPP se v prvních dnech po započetí léčby kumulativně zvyšuje a během 2–3 dnů se dosáhne rovnovážného stavu (tzv. steady state). Je to tím, že s opakovaným podáváním též vzrůstá hodnota AUC, a tím i biodostupnost léku. Pokud chceme zvýšit účinnost léku, je výhodnější zvýšit frekvenci než výši dávek. Jelikož IPP nejsou kompetitivní antagonisté, nevyskytuje se při jejich užívání fenomén tolerance. Také klinicky významný „rebound“ fenomén, který se vyskytuje u AH2R, nebyl u této skupiny léků popsán. Naopak, inhibice sekrece přetrvává až 96 hod po vysazení IPP. Srovnáme-li hodinový poločas a čtyřdenní přetrvávání účinku, je jasné, že aktivní sloučenina zůstává na místě akce, ačkoli IPP ani jeho metabolity nejsou již přítomné v plazmě.
Obr. 2. Žaludeční pH při léčbě omeprazolem 20 mg denně. Vlevo medián pH 5,8 (léčení pacienti byli infikováni H. pylori), po eradikaci infekce účinnost omeprazolu klesá – vpravo medián pH 3,6 [7]. Fig. 2. Gastric pH during omeprazole therapy 20 mg daily. On the left side median pH 5.8 (patients were infected by H. pylori), after H. pylori eradication the omeprazole efficacy diminishes – on the right side median pH 3.6 [7] ![Žaludeční pH při léčbě omeprazolem 20 mg denně. Vlevo medián pH 5,8 (léčení pacienti byli infikováni H. pylori), po eradikaci infekce účinnost omeprazolu klesá – vpravo medián pH 3,6 [7].
Fig. 2. Gastric pH during omeprazole therapy 20 mg daily. On the left side median pH 5.8 (patients were infected by H. pylori), after H. pylori eradication the omeprazole efficacy diminishes – on the right side median pH 3.6 [7]](https://www.prelekara.sk/media/cache/resolve/media_object_image_small/media/image/11bfcd6e416f8b95c952c990bad04334.jpeg)
IPP jsou kompletně metabolizovány v játrech (cytochrom P-450, nejdůležitější izoenzym představuje tzv. CYP 2C19) a dále jsou vylučovány ledvinami. Podle exprese CYP 2C19 rozlišujeme tzv. rychlé a pomalé metabolizátory. U pacientů s rychlou metabolizací IPP se mnohdy můžeme setkat s jejich nižší účinností. Metabolity IPP jsou netoxické a farmakologicky neúčinné. Jejich farmakokinetika se nemění u pacientů s renálním selháním a ani jejich lékové interakce nepředstavují v klinické praxi závažný problém.
IPP se při standardním dávkování jednou denně podávají ráno, protože ranní dávka je s ohledem na 24hodinový efekt účinnější než stejná dávka večerní.
Rozdíly mezi jednotlivými IPP
V současnosti jsou k dispozici tyto IPP: omeprazol (uveden na světový trh v roce 1988) a jeho izomerická forma esomeprazol (2001); lansoprazol (1995), pantoprazol (1997), rabeprazol (1999) a tenatoprazol. V ČR je k dispozici mnoho generických preparátů omeprazolu, lansoprazolu, pantoprazolu a esomeprazolu, jsou k dostání jak „na recept“, tak i nově jako volně prodejné léky (tzv. OTC).
Souhrně lze říci, že všechny tradiční IPP (omeprazol, pantoprazol, lanzoprazol) jsou klinicky stejně účinné a mají podobný výskyt nežádoucích účinků. Novější IPP (rabeprazol, esomeprazol) mají výhodnější farmakokinetické a farmakodynamické charakteristiky, které mohou být v určitých případech pacientům ku prospěchu. Nicméně tyto „novější“ IPP rozhodně nepředstavují nějakou „revoluci“, jako tomu bylo při uvedení omeprazolu na trh.
Zvláště u rezistentních případů nebo u pacientů, kteří netolerovali daný preparát IPP, měl ještě donedávna český gastroenterolog oproti svým kolegům nejen na západě, ale i např. na Slovensku, menší možnost účinně pacientovi pomoci, neboť dva nejmodernější preparáty, tj. esomeprazol a rabeprazol na českém trhu chyběly. To se naštěstí změnilo na podzim 2011 s příchodem esomeprazolu (již jako generika).
Rozdíly mezi jednotlivými IPP spočívají v mechanizmu účinku, farmakokinetice, použití v klinické praxi, nežádoucích účincích a interakci s ostatními farmaky. Souhrn základních informací o jednotlivých IPP přináší tab. 1.
Tab. 1. Přehled IPP dostupných v ČR se shrnutím jejich základních vlastností. Tab. 1. The overview of IPPs which are available at the Czech market and their basic characteristics. 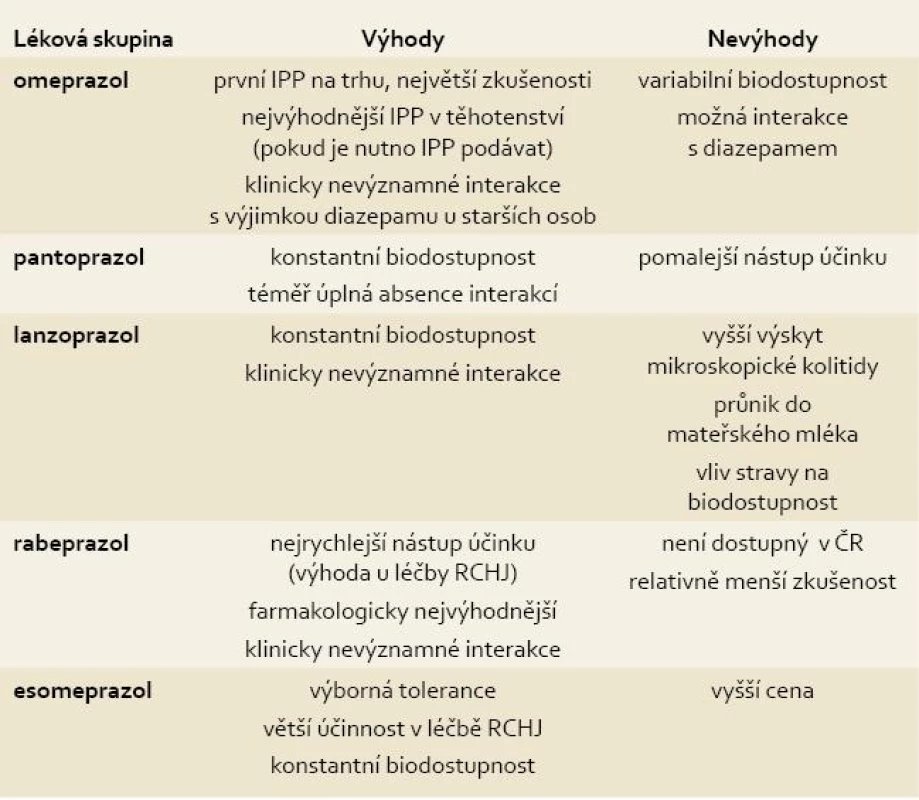
Mechanizmus a rychlost nástupu účinků
Všech šest IPP má stejný mechanizmus účinku, který byl popsán výše: v žaludečních parietálních buňkách dochází k akumulaci inaktivní molekuly, následné kyselinou katalyzované aktivaci na sulfenamidovou formu a k blokádě protonové pumpy. Všechny IPP jsou slabé báze a jejich stabilita v kyselém prostředí (pKa) určuje rychlost akumulace a následně aktivace v parietálních buňkách. In vitro studie ukázaly, že IPP se liší rychlostí pH-závislé aktivace, a tím i rychlostí inhibice protonových pump. V kyselém prostředí nestabilní rabeprazol (pKa = 4,9) zablokuje žaludeční H+,K+-ATP rychleji (5 min) než stabilnější lansoprazol (pKa = 4,01; 30 min), omeprazol (pKa = 4,13; 30 min) nebo pantoprazol (pKa=3,96; 90 min) [3].
Stupeň inhibice žaludeční sekrece je přímo závislý na počtu dostupných protonových pump. pH v okolí většiny parietalních buněk se pohybuje okolo 1,0, nicméně v určitých případech může dosáhnout hodnoty 3,0. Všechny IPP jsou stejně účinné v silně kyselém prostředí. Avšak ve slabě kyselém prostředí inaktivních nebo zanikajících parietálních buněk (tj. právě při pH ~ 3) je rabeprazol (diky své vyšší hodnotě pKa) 10× silnějším inhibitorem než ostatní IPP (Sachs G, osobní komunikace). Rabeprazol tedy zasáhne větší množství protonových pump než ostatní IPP s následnou vyšší rychlostí nástupu a intenzitou inhibičního účinku. Teoreticky je tento rozdíl mezi jednotlivými IPP nejvíce vyznačen v prvních 24 hod po zahájení terapie a postupně vymizí při dlouhotrvající léčbě, kdy je většina protonových pump již zablokována předcházející dávkou IPP.
Jedna ze studií srovnávající jednotlivé IPP z hlediska rychlosti nástupu jejich účinku na skupině H. pylori neinfikovaných dobrovolníků prokázala významně vyšší žaludeční pH během prvních 24 hod s rabeprazolem (3,4) než s lanzoprazolem (2,9), pantoprazolem (2,2) a omeprazolem 20 mg (1,8) (p ≤ 0,03, rabeprazol vs ostatní IPP) [4].
Většina studií prokázala určitý benefit podávání esomeprazolu (vyvinutý jako S-izomer omeprazolu s lepšími farmakokinetickými vlastnostmi) oproti všem ostatním IPP. Esomeprazol ve standardní dávce 1 × 40 mg vedl k silnější inhibici žaludeční sekrece oproti ostatním IPP [5]. Tato (farmaceutickým průmyslem nesponzorovaná studie) porovnávala účinnost pěti základních IPP ve standardních dávkách u H. pylori neinfikovaných osob s refluxními příznaky. Měření probíhalo pátý den léčby. Statisticky významně vyšší procento s pH nad 4 bylo zaznamenáno s esomeprazolem (58,5 %) ve srovnání s rabeprazolem (50,5 %), omeprazolem (49,0 %), lansoprazolem (48,0 %) a pantoprazolem (42,0 %), rozdíly mezi ostatními IPP nebyly statisticky významné [5].
U esomeprazolu, který se stal „nejpreferovanějším“ IPP v západní Evropě či USA, zůstává otázka vyšší účinnosti sporná – definice základní dávky (1 × 40 mg) oproti ostatním IPP (omeprazol 20 mg, lanzoprazol 30 mg, pantoprazol 40 mg) může být vysvětlením této „výhody“. Nicméně je jednoznačné, že esomeprazol má menší interindividuální variabilitu účinku oproti omeprazolu, což je jeho nesporná výhoda.
Rychlost nástupu účinku je důležitým parametrem zejména z hlediska léčby refluxní choroby jícnu. Nevýhodou standardních IPP je pomalejší nástup účinku (1. a 2. den), který lze řešit např. dočasným podáním antacida, je-li to nutné. Z tohoto hlediska by použití rabeprazolu mohlo být výhodnější, avšak nezávislé studie zásadní klinickou výhodu oproti jiným IPP neprokázaly.
Rychlost nástupu účinku byla i důvodem snahy o uvedení na trh tzv. reverzibilních inhibitorů protonové pumpy. Díky kompetitivnímu mechanizmu je počátek jejich účinku okamžitý. Navzdory klinickým zkouškám několika molekul nedosáhla žádná z nich klinického použití [6].
Farmakodynamické vlastnosti
Rychlost nástupu a intenzita inhibičního efektu závisí také na celkovém množství absorbovaného IPP. Rychlost a úplnost resorpce ze střeva je ovlivněna galenickou formou léčiva. Některé IPP jsou k dispozici jako tvrdé želatinové kapsle (omeprazol, esomeprazol a lansoprazol) nebo dražé (omeprazol a esomeprazol MUPS – „Multiple Unit Pelet System“) obsahující jednotlivé enterosolventní granule, jiné jako tablety s enterosolventním povlakem (rabeprazol, pantoprazol).
Rozdíly byly popsány ohledně biodostupnosti po perorálním podání. Biodostupnost omeprazolu je nízká po první dávce (35–40 %) a zvyšuje se s opakovaným podáváním na 65 %. To může reflektovat vyšší absorpci léku, je-li v žaludku zásaditější prostředí. Naopak pantoprazol a lansoprazol mají stálou biodostupnost (77 %, event. 80–90 %). Esomeprazol má také konstantní biodostupnost (64–90 %). Jaká je výhoda „konstantní“ dostupnosti? Ve standardních dávkách jsou IPP podobně účinné, avšak v dávkách malých (např. omeprazol 10 mg, což je dávka volně prodejného léku) je u pacientů s nízkou biodostupností efekt této látky podobný jako placebový efekt. V malých dávkách je proto výhodnější podávat nebo doporučovat jiné IPP než omeprazol.
Dalším neméně důležitým parametrem je tzv. AUC (area under the plasma-concentration time curve). Je známo, že AUC přímo koreluje se stupněm inhibice kyseliny. AUC (μg ×h/ml) je 0,2–1,2 pro omeprazol, 1,7–5 pro lansoprazol, 2–5 pro pantoprazol, 0,8 pro rabeprazol a 4,3–11 pro esomeprazol. Z hlediska tohoto parametru má nejvýhodnější vlastnosti esomeprazol.
Ohledně základních farmakokinetických a farmakodynamických vlastností lze shrnout, že všechny uvedené léky mají stejný mechanizmus účinku. Liší se některými základními parametry, jako je disociační konstanta (pKa) (zde nejvýhodnější pro rabeprazol), biodostupností (nevýhoda omeprazolu v nekonstantní biodostupnosti) a AUC (nejvýhodnější parametr pro esomeprazol).
Hlavní otázkou však je, jak se tyto rozdíly uplatňují v klinické praxi. A jak vyplyne z dalšího textu, z hlediska klinického efektu nejsou tyto rozdíly příliš vyjádřeny.
Klinické využití IPP
IPP se užívají v léčbě všech forem RCHJ, peptických vředů žaludku a duodena, hyperstenické, funkční žaludeční dyspepsie, Zollinger-Ellisonova syndromu. Jsou součástí trojkombinací IPP + 2 antibiotika při eradikační léčbě H. pylori. Užívají se také u pacientů s chronickou pankreatitidou ke zvýšení účinnosti pankreatické substituce, u pacientů se syndromem krátkého střeva nebo u kriticky nemocných pacientů při prevenci vzniku stresových vředů. Velmi účinné jsou také v prevenci i léčbě gastropatie při užívání nesteroidních antirevmatik. IPP jsou ve všech indikacích účinnější než AH2R. Důvodem proto je delší a silnější antisekreční účinnost IPP, což vede k dosažení vyššího pH v žaludku (pH > 4,0). Hojení většiny vředovitých a zánětlivých lézí v duodenu, v žaludku nebo v jícnu pozitivně koreluje s délkou zvýšení pH nad 4,0. Tento parametr je významně vyšší u všech IPP ve srovnání s ostatními léky blokující sekreci žaludeční kyseliny. Významné je také intravenózní podávání IPP při krvácení do GIT, kdy byla prokázána efektivita léčby (kontinuální perfuzí v dávce 8 mg/h u omeprazolu) v minimalizaci recidiv krvácení z peptického vředu po dosažení endoskopické hemostázy a také při prevenci stresových vředů u těžce nemocných pacientů.
Refluxní choroba jícnu
Léčbu RCHJ můžeme rozdělit na akutní a udržovací. U obou typů léčby jsou bezesporu nejúčinnější inhibitory protonové pumpy. Při akutní léčbě (první záchyt, hojení ezofagitidy) používáme nejčastěji IPP (např. omeprazol 1–2 × 20 mg, lansoprazol 1–2 × 30 mg, pantoprazol 1–2 × 40 mg nebo esomeprazol 1–2 × 20–40 mg). Klinické studie s pacienty s gastroezofageálním refluxem prokázaly, že symptomatická úleva nastává až na určitém stupni inhibice žaludeční sekrece, kdy žaludeční pH stoupne na 3–4. Rychlý nástup účinku IPP je žádoucí zvláště u pacientů léčených v moderním režimu „on-demand“ (na požádání), kdy jsou pacienti léčeni pouze při vzniku či recidivě obtíží a v období bez příznaků neberou žádné léky. Je logické, že u tohoto režimu je důležité, aby již první dávka léku účinně a rychle pomohla.
V účinnosti IPP nejsou zásadní rozdíly, byť esomeprazol je v mnohých studiích považován za účinnější a někdy i lépe tolerovaný lék. Tato léčba vede k vyhojení ezofagitidy u 80 % pacientů během 4–8 týdnů a k symptomatické úlevě až u 90 % pacientů. AH2R jsou významně méně účinné (40–60 % vyhojení během 4–8 týdnů). Při udržovací léčbě jsou též IPP nesporně účinnější než AH2R. Pokud budeme léčit po dobu pěti let pacienty s RCHJ, můžeme očekávat asi 10–20 % relapsů s IPP. Pokud však budeme používat AH2R, můžeme očekávat, že až 50 % pacientů bude mít relaps onemocnění [7].
Bylo potvrzeno, že u pacientů s endoskopicky negativní RCHJ dochází k symptomatické úlevě již během prvního dne léčby s rabeprazolem, lansoprazolem a esomeprazolem, ale až po 2–3 dnech léčby omeprazolem či pantoprazolem [8]. Klinicky byla léčba RCHJ esomeprazolem (1 × 40 mg i 1 × 20 mg) lepší nebo podobně účinná (akutní léčba i udržovací léčba) ve srovnání se standardními IPP [9]. Respektovaná metaanalýza 18 klinických studií ukázala, že po osmi týdnech léčby dochází k hojení ezofagitidy u vyššího procenta pacientů léčených esomeprazolem oproti omeprazolu, pantoprazolu, lansoprazolu či rabeprazolu [10].
U některých pacientů se lze setkat s kombinací IPP a večerní dávky AH2R. Bylo prokázáno, že při dávkování omeprazolu i jiných IPP dvakrát denně nemusí být zabezpečena dostatečná inhibice sekrece kyseliny v noci, kdy dochází k náhlým poklesům žaludečního pH, při kterém může docházet k refluxu. Fenomén dostal název „noční průlomy acidity“ (NAB = nocturnal acid breakthrough). Tyto poklesy může eliminovat noční dávka AH2R, ačkoli účinek AH2R díky toleranci během několika týdnů ustupuje, možná i zcela vymizí. S podobnou kombinací se můžeme setkat např. u některých pacientů s Barrettovým jícnem nebo u pacientů, kterým ani vyšší dávka IPP neuleví plně od příznaků. Význam takové léčby je však sporný, proto by ji měl indikovat nejlépe gastroenterolog.
Antirefluxní léčba pacientů s Barrettovým jícnem se neliší od obecných principů léčby RCHJ. Doporučuje se podávat IPP dvakrát denně, a to i pacientům bez refluxních příznaků. Cílem je reflux eliminovat, a zabránit tak progresi BJ. Někteří autoři doporučují provedení pH-metrie při léčbě protonovými inhibitory k vyloučení významného zbytkového refluxu. V takovém případě je pak nutné zvýšit dávku, přejít na jiný, event. novější preparát (např. esomeprazol), přidat noční dávku AH2R či zvážit operační řešení. V klinické praxi se však pH-metrie neprovádí příliš často. Důležitou otázkou u pacientů s BJ je, zda adekvátní inhibice sekrece kyseliny (nebo antirefluxní operace) chrání před rozvojem karcinomu. Odpověď není jednoznačná a rozhodně není přímý důkaz, že tomu tak opravdu je. To platí také o fundoplikaci, kdy nebylo potvrzeno snížení rizika adenokarcinomu po provedení operace.
Jako „refrakterní“ RCHJ označujeme stav, kdy jsou příznaky přítomny navzdory podávání IPP (méně než 50% zlepšení při dávkování IPP dvakrát denně). Častěji se u refrakterní RCHJ setkáváme u pacientů s neerozivní RCHJ. U těchto pacientů je role přetrvávajícího refluxu navzdory léčbě IPP (nebo refluxu jako takového) jakožto příčiny obtíží sporná. Slaughter et al recentně prokázali na skupině 254 „refrakterních“ pacientů [11], že abnormální kyselý reflux se vyskytl jen u 8 % (při léčbě) pacientů a pouze 24 % pacientů mělo patologickou impedanci.
Úloha prokinetik a jejich kombinace s IPP
Prokinetika zlepšují motilitu jícnu a někdy mohou zvýšit bazální tonus jícnového svěrače a snížit výskyt jeho transientních relaxací. Účinek žádného z komerčně dostupných prokinetik není zásadní a výrazný. Lze si těžko představit, že prokinetikum zvýší tonus svěrače u pacienta s velkou hiátovou hernií a insuficiencí bráničního hiátu. Obecně platí, že prokinetika v monoterapii jsou podobně účinná jako AH2R. To znamená, že jsou mnohem méně účinná než IPP, proto by se v monoterapii neměla používat. Kombinace prokinetikum + AH2R byla v udržovací léčbě lepší než monoterapie s jedním nebo druhým typem preparátu. Bylo potvrzeno, že kombinace prokinetika + IPP (omeprazol) je stejně účinná jako léčba IPP samotným [7]. Proto se paušálně nedoporučuje podávat IPP s prokinetikem. V ČR se však na rozdíl od jiných zemí jedná o kombinaci často používanou. Předpokládáme, že se nejspíše jednalo o dobrou firemní obchodní strategii v dobách, kdy byl na našem trhu velice úspěšný cisaprid. Rozhodně není mnoho „evidence-based“ údajů, proč rutinně kombinovat prokinetikum s IPP.
Léčba peptického vředu
Peptický vřed patřil v podstatě mezi první indikace léčby IPP. Není proto nutné příliš zdůrazňovat, že právě u tohoto onemocnění prokázaly IPP svoji jednoznačně vyšší účinnost ve srovnání s AH2R. V léčbě peptického vředu dochází k symptomatické úlevě rychleji u pacientů léčených rabeprazolem, esomeprazolem a lanzoprazolem ve srovnání s pacienty léčených pantoprazolem a omeprazolem. Tyto poznatky jsou v souladu s výsledky pH-metrických studií, které naznačují rychlý nástup antisekrečního účinku v prvních dnech po zahájení terapie [12]. K vyhojení vředu však dochází u stejného procenta pacientů léčených jakýmkoli IPP a mezi jednotlivými IPP nejsou z tohoto hlediska významnější rozdíly.
Léčba infekce H. pylori
Všechny IPP vykazují určitou vnitřní antibakteriální aktivitu proti H. pylori. V in vitro studiích prokazují lanzoprazol a rabeprazol vyšší baktericidní účinek než omeprazol a pantoprazol. Tento efekt je však považován za minimální a klinicky nepodstatný.
Na druhé straně rychlý nástup antisekrečního účinku je teoreticky důležitý v léčbě infekce H. pylori infekce s antibiotiky, jako např. s amoxicilinem či klaritromycinem. V klinické praxi tento efekt nebyl potvrzen. Eradikace H. pylori infekce je dosaženo u stejného procenta pacientů léčených amoxycilinem a klaritromycinem v kombinaci s rabeprazolem (88 %), lansoprazolem (85 %), pantoprazolem (80 %), omeprazolem a esomeprazolem (86 %) [13]. Existují studie, které naznačují, že procento eradikace je lepší při užití toho či onoho IPP, avšak tyto jsou zatíženy komerčním bias a výhoda jakéhokoli IPP oproti jinému není všeobecně akceptována [14]. Podobně nebyly popsány rozdíly mezi jednotlivými IPP ani v nové, tzv. sekvenční eradikací léčbě.
Gastropatie z nesteroidních antirevmatik
IPP jsou lékem volby v prevenci i léčbě gastropatie z nesteroidních antirevmatik. V léčbě se užívají většinou vyšší dávky (dávkování dvakrát denně), v prevenci gastropatie postačí dávkování základní (tj. jednou denně). Ani v této indikaci není jednoznačně potvrzena výhodnost jednoho IPP oproti ostatním, některé studie naznačovaly výhodu rabeprazolu a esomeprazolu v rychlosti symptomatického efektu.
Italští a kanadští kolegové publikovali recentně zajímavou experimentální studii [15]. Ta dochází k závěru, že léčba IPP významně zhoršuje ulcerace a krvácení v tenkém střevě laboratorních potkanů, kterým byl podáván naproxen nebo celecoxib. Vysvětlení spočívá nejspíše ve změně střevní mikroflóry při léčbě omeprazolem. Při podávání selektivních střevních komenzálů nebyl tento nepříznivý efekt léčby IPP přítomen. Pro další klinickou praxi je to důležitý poznatek, který potvrzuje, že i s tak tradičními léky, jakými IPP jsou, se můžeme dočkat ještě mnohých překvapení.
Funkční žaludeční dyspepsie
IPP jsou velmi účinnými léky v léčbě funkční dyspepsie, zvláště tzv. ulcer-like dyspepsie (tj. pacient si stěžuje na bolesti v epigastriu, které připomínají bolesti „vředové“). Tuto skutečnost prokázalo množství randomizovaných studií [16]. Funkční dyspepsie je však stav, který IPP nevyléčíme, a kde IPP jsou pouze jedním z možných léčebných opatření.
Nebyly nalezeny žádné klinicky významné rozdíly mezi jednotlivými IPP v léčbě či symptomatické odpovědi u pacientů s funkční dyspepsií.
Lze tedy shrnout, že v klinické praxi jsou rozdíly mezi jednotlivými IPP minimální. Rabeprazol či esomeprazol mohou být doporučeny pacientům s endoskopicky negativní RCHJ, kde je cílem léčby rychlá symptomatická úleva. K dlouhodobé léčbě refluxní ezofagitidy, H. pylori infekce, peptického vředu nebo gastropatie z nesteroidních antirevmatik lze použít jakýkoli IPP. Kritériem volby by měla být cenová dostupnost a tolerance. U vyšších věkových skupin, u kterých předpokládáme léčbu více léky, lze volit rabeprazol či pantoprazol, tj. IPP s nejnižším výskytem lékových interakcí.
Lékové interakce
V posledních letech se tato problematika dostala do centra pozornosti kardiologů, gastroenterologů a praktických internistů. Důvodem je fakt, že IPP se velmi často užívají jako profylaktická léčba NSA-gastropatie, která je relativně častou komplikací dlouhodobé antiagregační terapie kyselinou acetylsalicylovou. Lékové interakce vznikají na podkladě farmakodynamického efektu podávaných léčiv a/nebo jejich vzájemného ovlivnění farmakokinetických vlastností.
Lékové interakce IPP podmíněné farmakodynamickým účinkem
Hlavním farmakodynamickým efektem IPP je inhibice tvorby kyseliny solné a zvýšení pH žaludečního obsahu. Zvýšení pH žaludečního obsahu může teoreticky ovlivnit absorpci jiných léčiv, avšak jen výjimečně má tento alkalizující efekt klinicky významný vliv na farmakokinetiku současně podávaných léčiv. Výjimkou je v tomto ohledu ketokonazol a digoxin. Ketokonazol je antimykotikum ze skupiny imidazolových derivátů. Pro to, aby byl po perorálním podávání dostatečně absorbován v tenkém střevě, je nutná přítomnost kyselého žaludečního obsahu. Při terapii IPP je absorpce ketokonazolu zcela nedostatečná. V těchto případech je vhodné zvolit jiné antimykotikum, jehož absorpce není alkalizací žaludečního obsahu ovlivněna. Opačná situace je při současném podávání digoxinu. Při alkalizaci žaludečního obsahu vlivem IPP se významně zvyšuje absorpce tohoto srdečního glykosidu z tenkého střeva. Nemocného pak může ohrozit nebezpečí vyplývající z vysokých plazmatických koncentrací digoxinu a jeho toxických účinků. K minimalizaci nežádoucích účinků je při současném podávání IPP doporučováno monitorovat plazmatickou hladinu digoxinu a podle toho upravit jeho dávkování. Současné podávání žaludečních sekretolytik (např. AH2R) nebo antacid s IPP ve snaze dosáhnout ještě vyšší inhibici kyselé žaludeční sekrece nebo zvýšení pH žaludečního obsahu může být kontraproduktivní. Snížení kyselosti žaludečního sekretu snižuje i množství neaktivního léčiva, které je právě v kyselém prostředí žaludku konvertováno v aktivní sulfenamid. Kombinace neutralizačních nebo absorpčních antacid a sekretolytik s IPP je považováno proto za nevhodné. Výjimkou je v tomto ohledu alginát, který nemění pH žaludečního obsahu a je možné ho využít v úvodu terapii při refluxní chorobě jícnu společně s IPP.
Lékové interakce IPP podmíněné farmakokinetickými vlastnostmi
Potenciálně nejzávažnější lékové interakce vyplývají z farmakokinetického vlivu IPP především inhibicí aktivity enzymů CYP systému v komplexu cytochromu P450. Inhibice enzymů v cytochromu P450 může významně ovlivňovat metabolizmus jiných podávaných léčiv, jejichž clearence nebo metabolická přeměna v aktivní látku je na tomto enzymatickém systému závislá. Platí, že nejvýznamnější vliv na potlačení aktivity izoenzymu CYP2C19 má omeprazol a lanzoprazol, u ostatních léčiv této skupiny je výrazně nižší (pantoprazol, esomeprazol) nebo se nevyskytuje vůbec (rabeprazol).
Omeprazol snižuje clearence, prodlužuje biologický poločas a plazmatické koncentrace současně podávaného diazepamu, warfarinu a také fenytoinu. To by mělo být zohledněno při dlouhodobé terapii těmito léky a měly by se volit jiné IPP (pantoprazol), které tento nepříznivý efekt nevykazují.
Potenciálně závažná může být interakce IPP s antiagregačně působícím klopidogrelem. Klopidogrel je blokátor adenosindifosfátových receptorů (ADPr) typu P2Y12 a patří do skupiny thienopyridinů. Ireverzibilní blokádou ADPr snižuje klopidogrel agregaci a chemotaxi krevních destiček. Podobně jako IPP také klopidogrel je podáván ve formě proléčiva v inaktivní podobě. Jeho aktivní a klinicky účinná forma (2-oxo klopidogrel) vzniká až účinkem několika enzymů z komplexu CYP v cytochromu P450, kde má klíčovou úlohu enzym označovaný CYP2C19. Důležité je zmínit, že ne všechny IPP vykazují stejný inhibiční vliv na tento systém. Omeprazol a lanzoprazol jsou silnými, kdežto jiné – pantoprazol a esomeprazol – slabými inhibitory CYP2C19 a rabeprazol je metabolizován jinou cestou a na aktivitu CYP 2C19 nemá žádný vliv. Jestliže množství aktivního produktu metabolické přeměny klopidogrelu klesne pod 15 %, pak dochází ke klinicky významnému snížení jeho protidestičkového působení. Studie in vitro potvrdily, že současné podávání omeprazolu nebo lanzoprazolu s klopidogrelem vede k významně nižšímu antiagregačnímu působení než monoterapie klopidogrelem. Bultas uvádí, že v ČR bylo v minulých letech léčeno cca 20 % pacientů, kteří dostávali tzv. duální antiagregační terapii (kyselina acetylosalicylová a klopidogrel) a kteří byli současně léčeni omeprazolem nebo lanzoprazolem [17].
Data vycházející z klinických studií jsou však poněkud rozporuplná. Kwok provedl metaanalýzu, do které bylo vybráno 23 studií. Z nich 20 bylo retrospektivních, dvě byly „post hoc“ analýzy prospektivních randomizovaných studií a pouze jedna byla prospektivní randomizovaná zkouška. Problém této metaanalýzy, do které bylo zařazeno více než 93 000 probandů, je především v tom, že jednotlivé studie jsou obtížně srovnatelné nejen pro odlišný design, ale především v odlišně definovaných kriteriích (mortalita, akutní infarkt myokardu nebo jen obecně kardiovaskulární příhody). Jestliže se provedla pouze metaanalýza „post hoc analýz“ (které jsou vždy zatíženy velkým rizikem tzv. „bias“) prospektivních studií, bylo zjištěno jen minimální zvýšení kardiovaskulárních příhod o 7 % (RR = 1,07; 95%CI: 0,90–1,28) a koronárních příhod pouze o 15 % (RR = 1,15; 95%CI: 0,89–1,48). Jestliže autoři spojili všechny výsledky observačních a prospektivních „post hoc analýz“, pak na obrovském souboru vychází zvýšení kardiovaskulárního rizika o 41 % (RR = 1,41; 95%CI 1,34–1,48; p < 0,001) a vzestup celkové mortality na pětinu [17,18]. Vysvětlení v rozdílech metaanalýz spočívá pravděpodobně v tom, že nemocní z observačních studií měli podstatně vyšší riziko recidiv kardiovaskulárních příhod v porovnání s probandy zařazenými do prospektivních studií. Tento názor podporuje také závěr Hulotovy práce, který na základě analýzy rizikovosti nemocných, vyjádřené podle míry rizika recidivy kardiovaskulární příhody, stanovil, že u pacientů s nízkým rizikem (méně než 10 % v kalendářním roce) není kombinace klopidogrelu a IPP spojena s navýšením kardiovaskulárních příhod a mortality. Naopak u pacientů s vysokým rizikem (jako jsou nemocní v prvním roce po akutní koronární příhodě) se výsledky zásadně odlišují. U těchto pacientů je frekvence kardiovaskulárních příhod při terapii IPP a klopidogrelu o 50 % vyšší v porovnání s pacienty léčeným jen klopidogrelem [19]. Výsledky randomizované klinické zkoušky COGENT porovnávající výskyt kardiovaskulárních a gastrointestinálních komplikací v průběhu roční terapie omeprazolem a klopidogrelem s ramenem nemocných užívající placebo a klopidogrel nezjistila žádné rozdíly v obou skupinách. Studie byla však předčasně ukončena pro bankrot sponzorující firmy, aniž bylo docíleno zamýšleného náboru 5 000 nemocných. Přesto počet 3 627 pacientů zařazených do projektu je tak velký, že výsledky je potřeba brát s respektem.
Vyšší bezpečnost nové generace IPP (esomeprazolu) přinesla recentní publikace Hsua, jenž ukázala, že současné podávání esomeprazolu a klopidogroelu u nemocných s anamnézou peptického vředu a zvýšeným kardiovaskulárním rizikem vedla k významnému snížení výskytu recidiv vředu a krvácení, aniž by byl klinicky snížen antitrombotický efekt klopidogrelu [20].
Jak minimalizovat možné riziko nepříznivé lékové interakce?
Chceme-li používat IPP v klinické praxi racionálně, musíme vycházet ze základních znalostí klinické farmakologie. To se odráží v doporučení, jak správně IPP používat. Na rozdíl od terapie AH2R, které inhibovaly především noční, vagem mediovanou žaludeční sekreci a byly podávány v jedné denní dávce na noc, je terapie IPP cílená na ireverzibilní blokádu H+/K+ -ATP aktivovaných parietálních buněk; proto se podávají IPP ráno na lačno. Není-li efekt dostatečný, může se přidat ještě druhá dávka, opět na lačno večer před jídlem. Vzhledem k nutnosti inaktivace protonové pumpy je maximální farmakodynamický efekt léčby opožděn o 24–48 hod od první dávky léku. Dlouhodobá kombinace s jinými žaludečními sekretolytiky a antacidy, vyjma alginátu, je nevhodná.
U nemocných, u kterých je nutná duální protidestičková terapie a kteří mají vyšší riziko gastrointestinální toxicity a také následných komplikací, jako je krvácení do trávicího traktu, je vhodné zvážit podání dvojnásobných dávek klopidogrelu a současně IPP. Alternativou je volit jiná léčiva ze skupiny IPP s menší inhibicí CYP2C19, jako jsou pantoprazol nebo esomeprazol. Jinou možností je vybrat jiný inhibitor ADP receptorů lék ze skupiny theinopyrimidůnů, jako je prasugrel (Efient tbl). Podávání AH2R antagonistů jako náhradu za IPP nepovažujeme za adekvátní, a to vzhledem k jejich slabému protektivnímu efektu na trávicí trakt.
Nežádoucí účinky a bezpečnost dlouhodobé léčby s IPP
Výskyt nežádoucích účinků s IPP (alergické reakce, zvýšené hodnoty jaterních testu, bolesti hlavy, průjem, zácpa) je minimální. Nežádoucí účinky jednotlivých IPP by se teoreticky neměly lišit, neboť rozdíly v chemické struktuře a mechanizmu účinku mezi jednotlivými IPP jsou zanedbatelné. Vyšší výskyt mikroskopické kolitidy (až 4 % léčených) udávaly některé databáze s lanzoprazolem, zatímco s ostatními IPP nebyl tento nežádoucí účinek pozorován (nebo jen velice vzácně).
Bezpečnost dlouhodobého užívání IPP
Otázka bezpečnosti dlouhodobého podávání IPP byla po dlouhou dobu ve středu zájmu lékařské veřejnosti. V současné době lze tvrdit, že IPP jsou léky vysoce bezpečnými, mohou být podávány dlouhodobě i v řádu desítek let a jedná se o jedny z nejlépe dokumentovaných léků v historii medicíny.
Za normálních okolností kyselina působí baktericidně, čímž chrání tělo před infekcemi, podílí se na prvotním zpracování potravy a je zapojena do regulace sekrece gastrinu. Teoreticky může dlouhodobá suprese kyseliny vést k těmto důsledkům
- ztráta baktericidní schopnosti žaludeční šťávy s možností přemnožení různých bakterií
- zvýšení plazmatické hladiny gastrinu s eventuelním trofickým vlivem na sliznici žaludku
- zhoršení absorpce nutritivních složek stravy a některých léků s následným důsledkem výživovým
Přemnožení bakterií v žaludku
Žaludeční kyselina představuje účinnou antibakteriální bariéru. Při zvýšení žaludečního pH vzrůstá v žaludku počet bakterií, od pH 5–6 k dalšímu růstu počtu již nedochází. Též se mění spektrum bakterií – při pH nad 4 převládá ústní flóra a při pH nad 5 dochází k rozmnožení bakterií střevního typu. Přemnožení anaerobních bakterií může teoreticky vést k poruše trávení, resorpci a rozvoji malabsorpčního syndromu; nitráty-redukující bakterie mohou vést k syntéze tzv. N-nitrózosloučenin, které byly mnohými považovány za kancerogenní. V neposlední řadě může hrozit nebezpečí jakékoli systémové infekce organizsmu. Žádná studie neprokázala známky malabsorpce nejrůznějších látek (např. vitamin B12, beta karoten, ferritin atd.) při dlouhodobé léčbě IPP. Některé studie se zajímaly o vzájemnou spojitost infekční gastroenteritidy a dlouhodobé léčby omeprazolem (více než 170 000 pacientů). Bylo zjištěno pouze nepatrné, statisticky nevýznamné riziko infekční gastroenteritidy u pacientů léčených omeprazolem. Ani nebezpečí nosokomiálních pneumonií u nemocných na jednotkách intenzivní péče nebylo při podávání IPP prokázáno. K otázce možného urychlení kancerogeneze (Correova hypotéza bakteriální kolonizace nitráty redukujícími bakteriemi) lze dodat, že sama tato hypotéza byla v podstatě vyvrácena mnohými autory a není v současnosti akceptována. K přemnožení bakterií při dlouhodobé léčbě IPP tedy skutečně dochází, nemá však žádných významných klinických důsledků. Dlouhodobá léčba IPP ani nevede ke zvýšené koncentraci N-nitrózosloučenin, které vznikají jednak při vysokém pH díky vlivu bakterií, ale také při nízkém pH díky chemickým reakcím bez vlivu bakterií.
Riziko střevních infekcí
Dlouhodobé užívání IPP může být spojeno s větším rizikem získání infekce některými bakteriálními patogeny. Nedávná metaanalýza výsledků 27 studií naznačila, že léčba IPP může být spojena s vyšší rizikem infekce salmonelou, kampylobakterem nebo nasokomiální infekcí Clostridium difficile. Relativní riziko těmito patogeny se při terapii IPP pohybuje od 1,2–5,0 [21].
Hypergastrinemie a hyperplazie ECL buněk a žaludeční karcinoid
Při léčbě s AH2R i s IPP dochází k elevaci plazmatické hladiny gastrinu (2–4×) (obr. 3). Hladina gastrinu dosáhne svého maxima během prvních tří měsíců léčby a dále se nezvyšuje. Jen pro srovnání, hladina gastrinu při léčbě IPP je daleko nižší než u pacientů s achlorhydrií při perniciózní anémii. Hypergastrinemie během léčby s IPP je vyšší u jedinců infikovaných H. pylori. Pouze u některých infikovaných jedinců vystoupí během léčby IPP hladina gastrinu nad 500 pg/ml, avšak ani u nich se z klinického hlediska nejedná o významný fenomén [22]. K hypergastrinemii vede mimo léčby IPP i mnoho jiných vlivů. Gastrin má trofický vliv na ECL buňky. U pacientů s achlorhydrií při perniciózní anémii občas dochází k proliferaci ECL buněk a výjimečně byly popisovány i žaludeční karcinoidy. Mnozí lékaři se obávali těchto změn při dlouhodobé léčbě s AH2R a ještě více s IPP s tím, že je to právě hypergastrinemie zodpovědná za vznik karcinoidů. Tato obava byla podpořena zjištěním, že se u krys léčených vysokými dávkami IPP déle než dva roky vyskytly žaludeční karcinoidy. U člověka se však tento jev nikdy nepotvrdil a i mnohaletá inhibice sekrece kyseliny IPP vedla pouze ke klinicky nevýznamné hypertrofii (během dnů) a hyperplazii (během týdnů) ECL buněk [22]. Ostatně krysí žaludek není identický s lidským, např. denzita ECL buněk je u krys 2–4× vyšší ve srovnání s člověkem a navíc krysí ECL buňky jsou ke gastrinu až 10× citlivější. Dysplastické a neoplastické změny byly pozorovány pouze při hypergastrinemii u pacientů s A typem autoimunní gastritidy a u pacientů s MEN-I syndromem, kdy jsou hladiny gastrinu zvýšeny až dvacetkrát, čili nikoli u pacientů léčených IPP.
Obr. 3. Hladina gastrinu před léčbou IPP (první a druhý sloupec – před eradikací infekce Hp a po ní) a během léčby omeprazolem (třetí a čtvrtý sloupec). Patrná hypergastrinemie při léčbě IPP [7]. Fig. 3. Gastrin plasmatic level before IPPs therapy (first and second column – before and after H. pylori eradication) and during omeprazole therapy (third and fourth column). Hypergastrinemia due to IPPs therapy is an evident [7]. ![Hladina gastrinu před léčbou IPP (první a druhý sloupec – před eradikací infekce Hp a po ní) a během léčby omeprazolem (třetí a čtvrtý sloupec). Patrná hypergastrinemie při léčbě IPP [7].
Fig. 3. Gastrin plasmatic level before IPPs therapy (first and second column – before and after H. pylori eradication) and during omeprazole therapy (third and fourth column). Hypergastrinemia due to IPPs therapy is an evident [7].](https://www.prelekara.sk/media/cache/resolve/media_object_image_small/media/image/dc3fd6dafa1e2842b874b00c3bcdbd52.jpeg)
Polypy žaludku a riziko kolorektálního karcinomu
Mezi další často citované potenciální následky inhibice sekrece žaludeční kyseliny patřilo riziko vzniku žaludečních polypů. Jedná se o tzv. fundické žlázové polypy, které nejsou spojeny s infekcí H. pylori. Z klinického hlediska jsou spíše asymptomatické, benigní a nacházíme je pouze v oblasti fundu. Dále se jedná o tzv. hyperplastické polypy, které jsou asociovány s infekcí H. pylori a chronickou gastritidou, přičemž s léčbou IPP nemají žádnou souvislost. Jsou též benigní, pouze polypy větší velikosti mohou nést riziko maligní transformace. Incidence nových polypů je 0,2 % (3/1 397) u pacientů léčených IPP jeden rok, 0,2 % (1/463) u pacientů léčených ranitidinem a 0,4 % (1/227) u pacientů s placebem [23]. Dalším problémem byla otázka možného vyššího rizika vzniku rakoviny tlustého střeva (eventuelně i karcinomu žaludku a pankreatu) při užívání IPP (patogeneticky se uvažovalo o trofickém vlivu hypergastrinemie). Klinická data však možnost rizika vzniku těchto dvou malignit v souvislosti s léčbou IPP jednoznačně vyvrátila [24].
Vliv inhibice tvorby kyseliny solné na rozvoj atrofické gastritidy a riziko vzniku karcinomu žaludku
Jedna nerandomizovaná studie naznačovala, že dlouhodobá léčba IPP může urychlit rozvoj atrofické gastritidy u osob infikovaných H. pylori [25]. Podle několika studií však inhibice žaludeční sekrece takové riziko nepředstavuje. Podle současných údajů lze tudíž konstatovat, že dlouhodobá pravidelná léčba s IPP (či s AH2R) nepředstavuje významné riziko vzniku atrofie, intestinální metaplazie či dokonce karcinomu žaludku ani u osob infikovaných H. pylori [26,27].
Malabsorpce vitaminu B12 a kalcia
Další otázky bezpečnosti se soustředily na možnost sníženého vstřebávání vitaminu B12 či kalcia s následkem možné osteoporózy a patologických zlomenin. Klinicky významné nežádoucí účinky tohoto typu nebyly jednoznačně potvrzeny. Např. velká case-control studie z r. 2010 na více než 160 000 pacientech nalezla lehce vyšší riziko zlomenin v oblasti pánve s „odds ratio“ 1,3 u pacientů, kteří byli léčeni IPP (ale i AH2R) [28]. Nicméně riziko bylo přítomné jen u osob, které měly přítomný ještě minimálně jeden rizikový faktor ke vzniku těchto zlomenin.
V tab. 2 jsou uvedeny možné a v minulosti vyšetřované fenomény bezpečnosti dlouhodobé léčby s IPP a zvláště pak u infikovaných osob H. pylori.
Tab. 2. Otázky dlouhodobé bezpečnosti léčby s IPP a interakce s H. pylori. Tab. 2. Unsolved issues focused on long-term IPPs therapy safety and potential interactions with H. pylori infection. 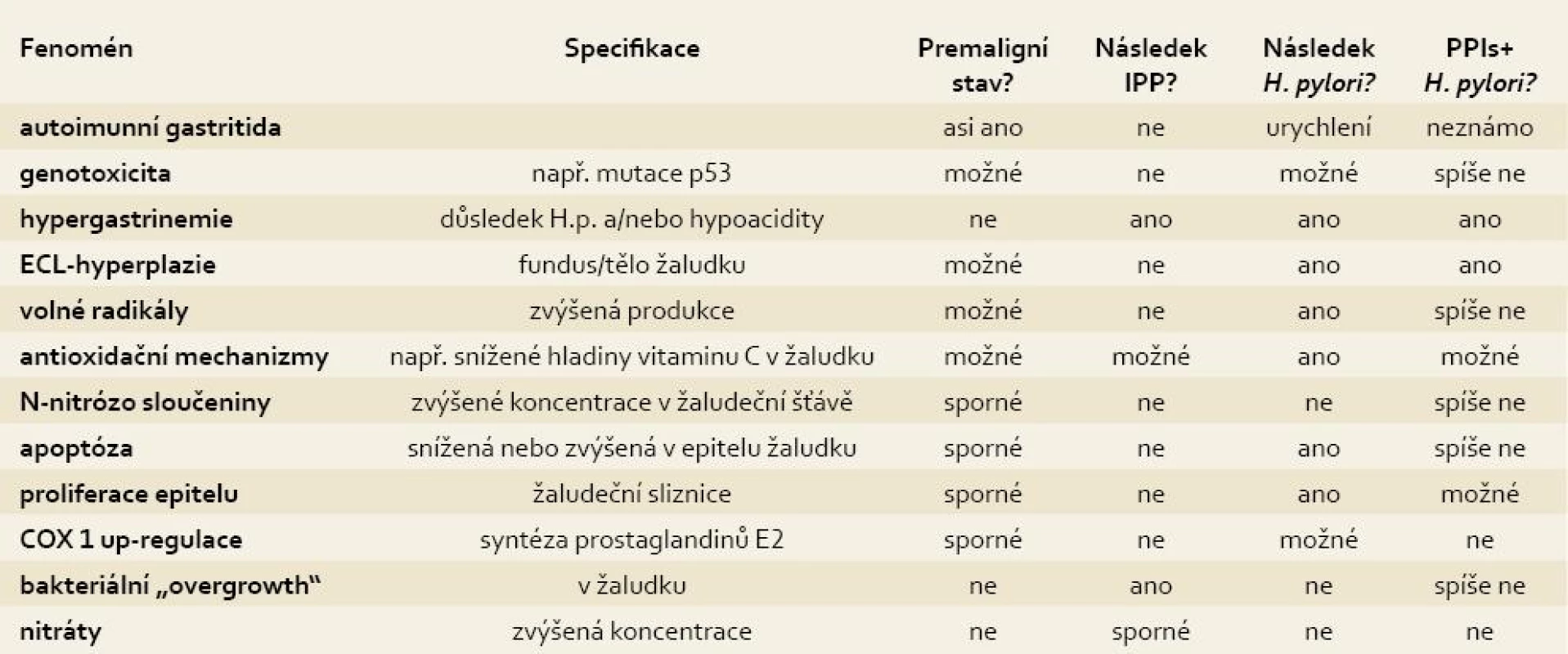
Závěr
Pro klinickou praxi je důležité, že dlouhodobá silná inhibice sekrece žaludeční kyseliny není pro pacienty nebezpečná. Dlouhodobá léčba IPP vede k většinou mírné hypergastrinemii, která dosáhne po několika týdnech plateau fáze a vrací se k normálu po skončení léčby. U některých pacientů může tato léčba vést k hyperplazii ECL buněk. Při léčbě s IPP sice dochází ke zvětšení absolutního počtu bakterií v žaludku, což však nevede k vyšší frekvenci infekcí, malabsorpci či vyššímu riziku žaludeční rakoviny. Občas někteří chirurgové argumentují ve prospěch chirurgického řešení u pacientů s RCHJ právě možnými nežádoucími účinky chronické léčby s IPP. Na základě výše zmíněného se jedná o „čirý nesmysl“ a takové argumenty nejsou relevantní. IPP jsou v podstatě jedny z nejlépe prostudovaných, dokumentovaných a zároveň nejbezpečnějších léků v historii medicíny. Přesto lze doporučit, aby tyto léky byly užívány jen tam, kde je jich opravdu třeba, a to v nejnižší účinné dávce.
Seznam zkratek
- AH2R – antagonisté H2 receptorů
- AUC – area under the concentration curve
- cAMP – cyklický adenozin monofosfát
- BJ – Barrettův jícen
- ECL – buňka podobná enterochromafinní buňce
- GIT – gastrointestinální trakt
- IPP – inhibitory protonové pumpy
- NAB – nocturnal acid breakthrough
- RCHJ – refluxní choroba jícnu
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
The authors declare they have no potential conflicts of interest concerning drugs, products, or services used in the study.Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
The Editorial Board declares that the manuscript met the ICMJE „uniform requirements“ for biomedical papers.Doručeno/Submitted: 30. 11. 2011
Přijato/Accepted: 15. 12. 2011
MUDr. Jan Martínek, Ph.D.
Interní klinika – OGHM
ÚVN, U vojenské nemocnice 1200
169 02 Praha 6
jan.martinek@volny.cz
Zdroje
1. Sachs G, Prinz C, Persey SJ. Acid related disorders. Sushu Publishing Inc. 1995.
2. Bonnevie O, Nielsen AM, Matzen P et al. Gastric acid secretion and duodenal ulcer healing during treatment with omeprazole. Scand J Gastroenterol 1984; 19(7): 882–884.
3. Kromer W, Kruger U, Huber R et al. Differences in pH-dependent activation rates of substituted benzimidazoles and biological in vitro correlates. Pharmacology 1998; 56(2): 57–70.
4. Pantoflickova D, Dorta G, Jornod P et al. Acid inhibition on the first day of dosing: comparison of four proton pump inhibitors. Aliment Pharmacol Ther 2003; 17(12): 1507–1514.
5. Miner P, Katz P, Sostek M. Gastric acid control with esomeprazole, lansoprazole, omeprazole, pantoprazole, and rabeprazole: a five-way crossover study. Am J Gastroenterol 2003; 98(12): 2616–2620.
6. Martinek J, Blum AL, Stolte M et al. Effects of Pumaprazole (BY841), a novel reversible proton pump antagonist, and of Omeprazole on intragastric acidity before and after cure of Helicobacter pylori infection. Aliment Pharmacol Ther 1999; 13(1): 27–34.
7. Vigneri S, Termini R, Leandro G et al. A comparison of five maintenance therapies for reflux esophagitis.N Engl J Med 1995; 333(17): 1106–1110.
8. Pipkin GA, Mills JG. Onset of action of antisecretory drugs: beneficial effects of a rapid increase in intragastric pH in acid reflux disease. Scand J Gastroenterol Suppl 1999; 230 : 3–8.
9. Kalaitzakis E, Björnsson E. A review of esomeprazole in the treatment of gastroesophageal reflux disease. Ther Clin Risk management 2007; 3(4): 653–663.
10. Edwards SJ, Lind T, Lundell L. Systematic review of proton pump inhibitors for the acute treatment of reflux esophagitis. Aliment Pharmacol Ther 2001; 15(11): 1729–1736.
11. Slaughter JC, Goutte M, Kymer JA et al. Caution about overinterpretation of symptom indexes in reflux monitoring for refractory gastroesophageal reflux disease. Clin Gastroenterol Hepatol 2011; 9(10): 868–874.
12. Wolfe M, Sachs G. Acid suppression: Optimizing therapy for gastroduodenal ulcer healing, gastroesophageal reflux disease, and stress related erosive syndrome. Gastroenterology 2000; 118 (2 Suppl 1): S9–S31.
13. Chuah SK, Tsay FW, Hsu PI et al. A new look at anti-Helicobacter pylori therapy. World J Gastroenterol 2011; 17(35): 3971–3975.
14. Hsu PI, Lai KH, Lin CK et al. A prospective randomized trial of esomeprazole versus pantoprazole based triple therapy for Helicobacter pylori eradication. Am J Gastroenterol 2005; 100(11): 2387–2392.
15. Wallace JL, Syer S, Denou E et al. Proton pump inhibitors exacerbate NSAID-induced small intestinal injury by inducing dysbiosis. Gastroenterology 2011; 141(4): 1314–1322.
16. Blum AL, Talley NJ, O´Morrain C et al. Lack of effect of treating Helicobacter pylori infection in patients with nonulcer dyspepsia. Omeprazole plus Clarithromycin and Amoxicillin Effect One Year after Treatment (OCAY) Study Group. N Engl J Med 1998; 339(26): 1875–1881.
17. Bultas J. Význam kombinace klopidogrelu s inhibitory protonové pumpy. Čes a Slov Gastroent a Hepatol 2010; 64(4): 25–31.
18. Kwok CS, Loke YK. Meta-analysis: the effects of proton pump inhibitors on cardiovascular events and mortality in patients receiving clopidogrel. Aliment Pharmacol Ther 2010; 31(8): 810–823.
19. Hulot JS, Collet JP, Silvain J et al. Cardiovascular risk in clopidogrel-treated patients according to cytochrome P450 2C19*2 lossof-function allele or proton pump inhibitor coadministration: a systematic meta-analysis. J Am Coll Cardiol 2010; 56(2): 134–143.
20. Hsu PI, Lai KH, Liu CP et al. Esomeprazole with clopidogrel reduces peptic ulcer recurrence, compared with clopidogrel alone, in patients with atherosclerosis. Gastroenterology 2011; 140(3): 791–798.
21. Bavishi C, DuPont HL. Systemic review: the use of proton pump inhibitors and increased susceptibility to enteric infection. Aliment Pharmacol Ther 2011; 34(11–12): 1269–1981.
22. Solcia E, Fiocca R, Villani L et al. Hyperplastic, dysplastic, and neoplastic ECL-like proliferation of the gastric mucosa. Am J Surg Pathol 1995; 19 (Suppl 1): S1–S7.
23. Joelson S, Joelson IB, Lundborg P et al. Safety experience from long term treatment with omeprazole. Digestion 1992; 51 (Suppl 1): 93–101.
24. Penman ID, El-Omar E, Ardill JES et al. Plasma gastrin concentration are normal in patients with colorectal neoplasia and unaltered following tumor resection. Gastroenterology 1994; 106(5): 1263–1270.
25. Kuipers EJ, Lundell L, Klinkenberg-Knol E et al. Atrophic gastritis and H. pylori infection in patients with reflux esophagitis treated with omeprazole or fundoplication. N Engl J Med 1996; 334(16): 1018–1022.
26. Lundell L, Miettinen P, Myrvold HE et al. Lack of effect of acid suppression therapy on gastric atrophy. Gastroenterology 1999; 117(2): 319–326.
27. Genta RM, Rindi G, Fiocca R et al. Effect of 6-12 months of esomeprazole treatment on gastric mucosa. Am J Gastroenterol 2003; 98(6): 1257–1265.
28. Corley DA, Kubo Ai, Zhao W et al. Proton Pump Inhibitors and Histamine-2 Receptor Antagonists are Associated with Hip Fractures among At-Risk Patients. Gastroenterology 2010; 139(1): 93–101.
Štítky
Detská gastroenterológia Gastroenterológia a hepatológia Chirurgia všeobecná
Článok vyšiel v časopiseGastroenterologie a hepatologie
Najčítanejšie tento týždeň
2011 Číslo 6- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Kombinace metamizol/paracetamol v léčbě pooperační bolesti u zákroků v rámci jednodenní chirurgie
- Parazitičtí červi v terapii Crohnovy choroby a dalších zánětlivých autoimunitních onemocnění
- Antidepresivní efekt kombinovaného analgetika tramadolu s paracetamolem
- I „pouhé“ doporučení znamená velkou pomoc. Nasměrujte své pacienty pod křídla Dobrých andělů
-
Všetky články tohto čísla
- November 17th 1989 and today
- Erratum
-
Prof. MUDr. Petr Dítě, DrSc., jubilující
Prof. MUDr. Petr Dítě, DrSc., celebrant -
Rozhovor s prof. MUDr. Juliem Špičákem, CSc.,
předsedou České gastroenterologické společnosti o 32. českém a slovenském gastrontereologickém kongresu v Brně (3.–5. 11. 2011) - Kvíz – Neobvyklý případ z klinické praxe
- Chronická radiačná proktitída – rieši argón plazma koagulácia tento terapeutický problém?
-
Elektrogastrografie u pokusných prasat
Analýza amplitud - Inhibitory protonové pumpy – up to date
- Od drenáže cystoidu po karcinom pankreatu
- Virtuální simulátor pro digestivní endoskopii
- 20th Congress of the Gastroenterology Society of Central Germany in Magdeburg from 12 to 14 May 2011
- Odpověď na kvíz
- Mladý český výzkumník, hepatolog MUDr. Jan Petrášek, Ph.D., obdržel za mimořádné vědecké objevy prestižní ocenění Česká hlava
- S lítostí oznamujeme, že dne 29. 11. 2011 zemřel ve věku 66 let pan doc. MUDr. Milan Kaláb, CSc.
- Rejstřík 65. ročníku 2011
- Gastroenterologie a hepatologie
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Chronická radiačná proktitída – rieši argón plazma koagulácia tento terapeutický problém?
-
Prof. MUDr. Petr Dítě, DrSc., jubilující
Prof. MUDr. Petr Dítě, DrSc., celebrant - Inhibitory protonové pumpy – up to date
- Od drenáže cystoidu po karcinom pankreatu
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



