-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Vliv modifikace implantátů pro náhrady osteochondrálních defektů na genovou expresi chondrocytů
Impact of modification of implants for replacement of osteochondral defects on the gene expression of chondrocytes
Introduction:
Polymers represent materials suitable for replacement of subchondral defects. The aim of this study was to evaluate the impact of superficial modification of cycloolefin copolymer (COC) and COC blend with collagen type II on the viability and gene expression of chondrocytes.Material and methods:
Human chondrocytes were grown in cell culture medium on the surface of COC and COC blend biomaterials. The surface of a half of the materials was plasmatically modified by atoms of nitrogen and oxygen for bond of collagen type II. The gene expression of matrix metalloproteinases (MMP-1,-3,-13), proinflammatory cytokines (IL-1, TNF-alfa) and apoptotic molecules (BAX, Bcl-2) was evaluated by quantitative Taq-Man PCR after 48 hours of incubation. Viability of chondrocytes was evaluated by MTT test after 2, 4, and 8 days of incubation. The synthesis of MMPs was measured by ELISA in cell medium after 48 hours of incubation.Results:
Chondrocytes cultured on the surface of copolymers plasmatically modified had an average mRNA expression 2.8-fold increased for IL-1 and 8.2-fold increased for MMP-1. All of tested MMPs were increasingly produced into cell medium by chondrocytes cultured on the plasmatically modified surface of expression of MMPs mRNA. Modified materials, compared to unmodified polymers, decreased viability of chondrocytes according to the length of exposition. The gene expression of TNF-α and apoptotic molecules by chondrocytes did not differ among tested materials.Conclusion:
Cycloolefin copolymers COC and COC blend can represent suitable materials for tissue engineering, but their plasmatic modification can, at least in „in vitro“ conditions, decrease viability of chondrocytes and induce their pro-destructive potential. The advantages and disadvantages of the plasmatic modification of materials for replacement of osteochondral defects may be unveiled by further studies.Key words:
osteochondral defects biomaterials, chondrocytes, gene expression, cytokines
Autori: M. Polanská 1; H. Hulejová 1; M. Petrtýl 2; Z. Bastl 3; Z. Kruliš 4; Z. Horák 4; D. Veigl 5; L. Šenolt 1
Pôsobisko autorov: Revmatologický ústav, Praha 1; České vysoké učení technické, Fakulta stavební, Praha 2; Ústav fyzikální chemie, Akademie věd, Praha 3; Ústav molekulární chemie, Akademie věd, Praha 4; I. ortopedická klinika 1. LF UK a FN Motol, Praha 5
Vyšlo v časopise: Čes. Revmatol., 17, 2009, No. 1, p. 17-22.
Kategória: Původní práce
Súhrn
Úvod:
Polymery představují materiály vhodné pro náhrady subchondrálních defektů. Cílem této práce bylo zhodnotit vliv povrchové modifikace cykloolefinového kopolymeru (COC) a COC-blendu kolagenem typu II na viabilitu a genovou expresi chondrocytů.Materiál a metody:
Humánní chondrocyty byly pěstovány v kultivačním médiu na povrchu biomateriálů COC a COC-blend. Polovina materiálů měla plazmaticky modifikovaný povrch atomy dusíku a kyslíku pro vazbu kolagenu typu II. Genová exprese matrixových metaloproteináz (MMP-1,-3,-13), prozánětlivých cytokinů (IL-1, TNF-α) a apoptotických molekul (BAX, Bcl-2) byla hodnocena pomocí kvantitativní Taq-Man PCR po 48 hodinách inkubace. Viabilita chondrocytů byla hodnocena MTT testem po 2, 4 a 8 dnech inkubace. Syntéza MMPs byla měřena pomocí ELISA eseje v buněčném médiu po 48 hodinách inkubace.Výsledky:
Chondrocyty pěstované na plazmaticky modifikovaném povrchu kopolymerů kolagenem typu II vykazovaly průměrně až 2,8násobně vyšší expresi mRNA IL-1 a 8,2násobně vyšší expresi mRNA MMP-1. Všechny testované MMPs byly zvýšeně produkované do buněčného média chondrocyty pěstovanými na plazmaticky modifikovaném povrchu polymerů. Nemodifikované COC a COC-blend polymery naopak expresi mRNA MMPs snižovaly. Modifikované materiály oproti nemodifikovaným polymerům snižovaly v závislosti na délce expozice viabilitu chonodrocytů. Genová exprese TNF-α a apoptotických molekul chondrocyty se významně mezi testovanými materiály nelišila.Závěr:
Cykloolefinové kopolymery COC a COC-blend mohou představovat vhodné materiály pro tkáňové inženýrství, ale jejich plazmatická modifikace může, alespoň v podmínkách „in vitro“, snižovat viabilitu chondrocytů a indukovat jejich pro-destruktivní potenciál. Výhody nebo nevýhody plazmatické modifikace materiálů pro náhrady osteochondrálních defektů ukáží až další studie.Klíčová slova:
osteochondrální defekty, biomateriály, chondrocyty, genová exprese cytokinyÚvod
Osteoartróza (OA) patří mezi nejčastější kloubní onemocnění, jejímž základem je poškození hyalinní chrupavky, postupná ztráta proteoglykanů a narušení struktury kolagenu (1). Předpokladem rozvoje těchto změn je omezená reparační kapacita extracelulární matrix hyalinní chrupavky. Velmi důležitou úlohu při vzniku OA mají mechanické faktory. Významným rizikovým faktorem je věk. Nicméně již v mladém věku mohou po traumatickém poranění kloubů vznikat osteochondrální defekty, které jsou předpokladem mechanické nestability kloubu a následného rozvoje artrotického degenerativního procesu (3). Na patogenezi OA se aktivně podílejí chondrocyty, zvýšeně tvoří prozánětlivé cytokiny, např. tumor nekrotizující faktor (TNF)-alfa, interleukin (IL)-1, IL-6 nebo prostaglandiny, oxid dusnatý (NO) a matrixové metaloproteinázy (MMPs) (4). Předpokládá se, že v pokročilých stadiích choroby se na patogenezi OA významně podílí zvýšená apoptóza chondrocytů (5).
Těžké kloubní postižení artrotickým procesem nebo významné defekty chrupavky se často neobejdou bez totální náhrady kloubu. Předmětem diskuse jsou menší, ale symptomatické chondrální a osteochondrální defekty, které lze potenciálně řešit metodou tkáňového inženýrství, implantací autologních chondrocytů, transplantací osteochondrálního autografu nebo umělé náhrady defektu (6). Cílem takového zákroku je snížení bolesti, navození regenerace porušené kloubní chrupavky a zabránění progrese OA. Výzkum a aplikace biologických materiálů pro umělé náhrady skeletálních elementů je zaměřen na materiály, jejichž biomechanické charakteristiky se co nejvíce blíží organickým tkáním a jsou tolerovány biologickým prostředím.
Mimořádné postavení v biomateriálech mají syntetické polymery, které jsou dobře tolerovány biologickým prostředím, a u kterých za vhodných podmínek vzniká a trvale existuje bioadheze (7). Pro naší studii byl vybrán cykloolefínový kopolymer, aktivní hybridní kompozit, který má homogenní amorfní strukturu a je velmi dobře tolerován živými tkáněmi a lze plynule měnit jeho materiálové charakteristiky (8). V této práci jsme hodnotili vliv povrchové modifikace biologických implantátů atomy dusíku a kyslíku s následnou aplikací kolagenu typu II na viabilitu a genovou expresi humánních chondrocytů.
Materiál a metody
Biomateriály a jejich příprava
Pro testování in vitro byly použity tyto biomateriály:
- a) cykloolefínový kopolymer (COC),
- b) COC s plazmatickou modifikací povrchu (N, O) a aplikací 0,3% kolagenu typu II,
- c) COC blend, který představuje kombinaci vhodně zvolených polymerů a
- d) COC blend s plazmatickou modifikací povrchu (N, O) a aplikací 0,3 % kolagenu typu II.
Cykloolefínové kopolymery (COC, 60 mol% ethylenu a 40 mol% norbormenu) byly připraveny mícháním základního polymeru v tavenině pomocí laboratorního hnětiče W 50EHT Brabender (obsah komory 50 cm3), při temperaci komory 190 °C, otáčkách hnětáků 60 min-1 po dobu 8 min. Pro zlepšení mechanických vlastností COC materiálů bylo zajištěno míchání (blendování) základního polymeru s modifikující polymerní složkou, která vykazuje dostatečnou elasticitu a kompatibilitu s polycykloolefinickou matricí. Získaný modifikovaný materiál se označuje jako COC blend. Všechny komponenty směsi byly dávkovány do komory hnětiče najednou na počátku míchání. Tavenina směsi byla po zamíchání vyjmuta a lisována do tvaru desek, ze kterých byly následně vyraženy zkušební vzorky dané velikosti. U poloviny vzorků COC a COC blend byl povrch plazmaticky modifikován působením dusíkového MW plazmatu. Biomateriály byly před použitím sterilizovány ethylénoxidem. Materiály s plazmaticky modifikovaným povrchem byly sterilně potaženy 0,3% kolagenem typu II za 2 h inkubace při pokojové teplotě.
Buněčné kultury
Pro „in vitro“ testy byly použity dvě různé buněčné linie komerčně dodávaných humánních chondrocytů (Normal Human Articular Chondrocytes, Knee cryopreserved – NHAC-kn, DIAGENES sro., Česká republika). Buněčná kultura chondrocytů byla pěstována ve specifickém diferenciačním médiu (Chondrocyte Differntiation Medium CDM BulletKit, DIAGENES sro., Česká republika) obsahujícím 5% FCS ve 37 °C v atmosféře s 5% CO2. Pro experimenty byly použity chondrocyty páté pasáže. Testování biomateriálů bylo provedeno ve 12jamkových destičkách, kam byly těsně na dno vsazeny materiály o průměru 21 mm.
Genová exprese
Obě buněčné linie chondrocytů byly nasazeny v počtu 100 000 buněk na jamku a pěstovány po dobu 48 hodin na jednotlivých biomateriálech, které byly umístěny na dno příslušných jamek. Všechny experimenty byly prováděny v tripletech. Negativní kontrolu, ke které se vztahovala exprese jednotlivých genů, představovala jamka se stejným počtem chondrocytů v médiu bez přítomnosti biomateriálu. Buňky byly po uplynutí časového intervalu lyzovány pomocí RLT Lysis Buffer (Qiagen). Z buněčného lyzátu byla izolována totální RNA a metodou reverzní transkripce byla převedena do komplementární (c)DNA, která byla použita jako templát kvantitativní Taq-Man PCR reakce. Hodnocena byla exprese genů pro matrixové metaloproteinázy (MMP-1, -3 a -13), pro-zánětlivé cytokiny (IL-1, TNF-α) a apoptotické molekuly (BAX, Bcl-2) (Sigma, Česká republika). Jako endogenní kontrola byla použita sonda pro 18 S (Applied Biosystems).
Průkaz viability buněk a cytotoxicity testovaných materiálů pomocí MTT testu
Průkaz viability buněk byl proveden MTT testem (Sigma, Česká republika). MTT je kolorimetrická metoda, rozlišení živých a mrtvých buněk je založeno na schopnosti živých buněk redukovat žlutou, rozpustnou tetrazoliovou sůl MTT (3-4,5-dimethylazol-2-yl)-2,5-diphenyl tetrazolium) mitochondriálním enzymem sukcinát-dehydrogenázou na nerozpustný modrý formazan. Formazan je pak rozpuštěn dimethyl sulfoxidem (DMSO), případně jiným organickým rozpouštědlem. Absorbance barevného produktu je měřena fotometricky při 570 nm (ELISA reader SUNRISE). Jedna buněčná linie chondrocytů byla pěstována na testovaných materiálech po dobu 2, 4 a 8 dnů. Jako kontrola byla použita současně pěstovaná linie chondrocytů na destičce bez biomateriálu. Po ukončení jednotlivých intervalů bylo provedeno MTT barvení pro kontrolu viability buněk.
ELISA
Metodou ELISA byly stanoveny hladiny aktivních MMP-1, -3, -13 (Ray Biotech, Inc., Norcross GA) v buněčném supernatantu po 48 hodinách inkubace. Měření bylo provedeno na ELISA readeru SUNRISE (Tecan, Salzburg, Rakousko) ve vlnové délce 450 nm. Změřená absorbance byla vztažena na počet buněk v daném experimentu. Testování bylo provedeno ve dvou nezávislých experimentech.
Výsledky
Plazmatická modifikace biomateriálů indukuje expresi matrixových metaloproteináz
Ovlivnění genové exprese jednotlivých MMPs humánními chondrocyty po 48hodinové inkubaci s jednotlivými biomateriály je uvedeno na obrázku 1 (a-c). Oba materiály s plazmatickou modifikací povrchu a následnou aplikací kolagenu typu II indukovaly v chondrocytech významně vyšší expresi genů pro MMPs. Rozdíl v expresi mezi modifikovanými a nemodifikovanými materiály byl statisticky významný pro MMP-1 (p < 0,05), MMP-3 (p < 0,05) i MMP-13 (p < 0,001). Největší rozdíl byl pozorován u materiálu COC blend s plazmatickou modifikací povrchu, který vedl až k 8,2násobnému zvýšení exprese MMP-1 chondrocyty (obr. 1a). Naopak materiály nemodifikované, COC a COC blend, expresi jednotlivých MMPs snižovaly průměrně o 30 až 70%. Nejvíce byla redukována genová exprese MMP-13 a to o více než 70% oproti bazální expresi MMP-13 kontrolními chondrocyty rostoucími v jamkách bez přítomnosti polymeru (obr. 1c). Zvýšená genová exprese uvedených MMPs byla potvrzena na proteinové úrovni měřením uvolněných aktivních forem jednotlivých MMPs chondrocyty do buněčného supernatantu (tab. 1). Stejně jako na genové úrovni, modifikované materiály vykazovaly vyšší hladiny všech metaloproteináz, než materiály nemodifikované. Rozdíly v hladinách všech MMPs produkovanými chondrocyty do buněčného média mezi plazmaticky modifikovanými a nemodifikovanými materiály byly statisticky významné, nejvíce u MMP 13 a MMP-3 (p < 0,001), pak MMP-1 (p < 0,05).
Obr. 1. Relativní genové exprese na úrovni mRNA pro MMP-1, MMP-3 a MMP-13. Exprese jsou vztaženy relativně k negativní kontrole (chondrocyty pěstované v jamce s médiem bez přítomnosti materiálu), která byla stanovena jako K=1. 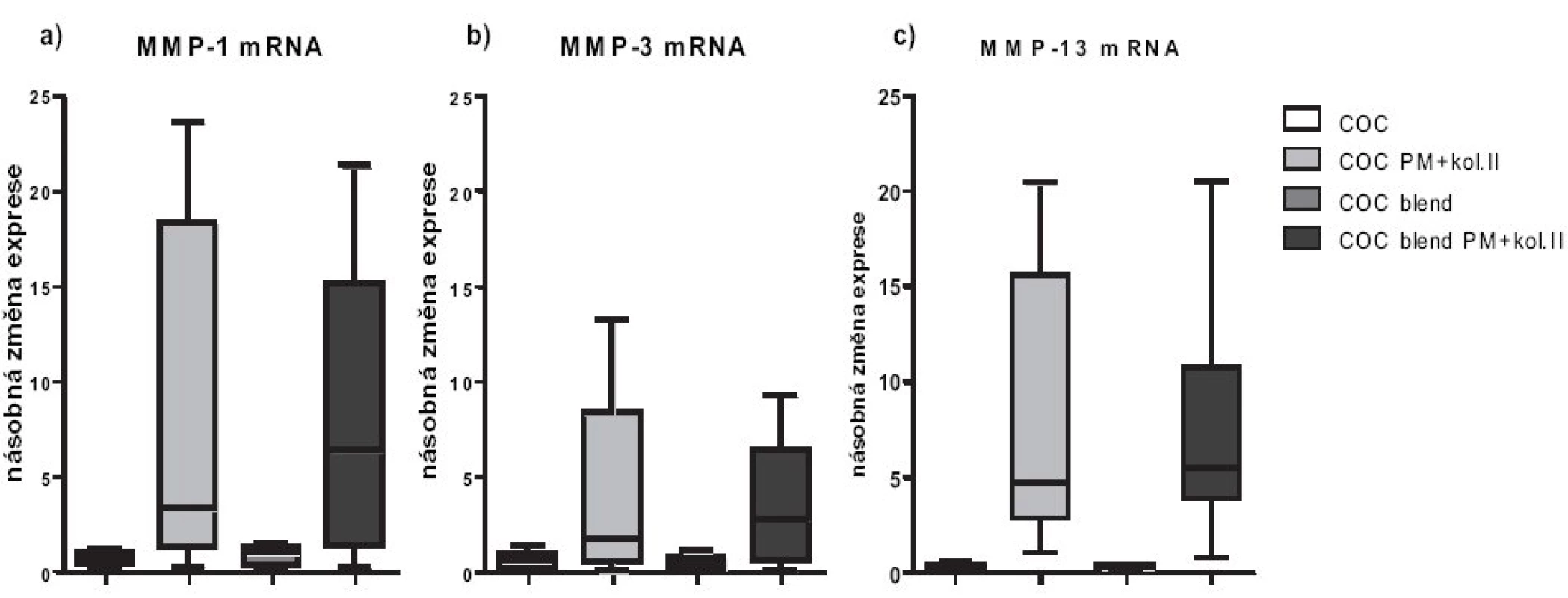
Tab. 1. Rozdíl v koncentraci aktivních forem jednotlivých metaloproteináz produkovaných chondrocyty rostoucích na nemodifikovaných a plazmaticky modifikovaných materiálech. 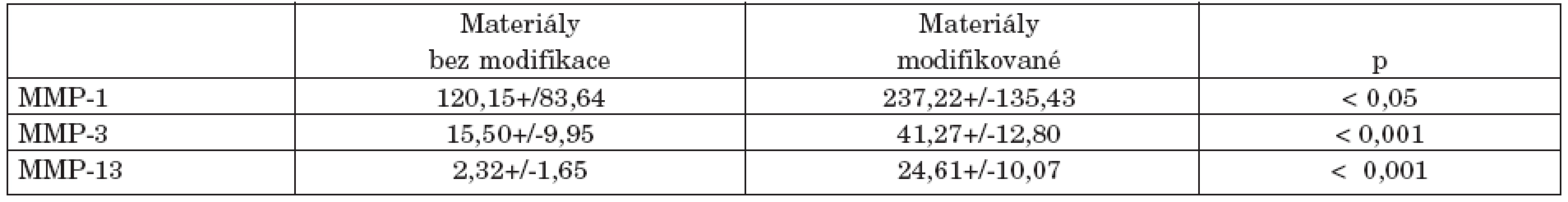
Vliv plazmatické modifikace polymerů na zánětlivé cytokiny a apoptotické molekuly
Nemodifikované biomateriály COC a COC blend exprese pro-zánětlivých cytokinů chondrocyty nezvyšovaly (obr. 2a,b). Nicméně, inkubace humánních chondrocytů s materiály s plazmaticky modifikovaným povrchem vedla po 48 hodinách průměrně k více než dvojnásobné expresi genu pro IL-1 (p < 0,05). Exprese TNF-α mRNA u nemodifikovaných biomateriálů byla snížena o 30–50 %, zatímco u modifikovaných materiálů byla srovnatelná s kontrolou (obr. 2b). Exprese apoptotických molekul byla u všech materiálů srovnatelná s kontrolou, jen u modifikovaných materiálů byla exprese obou apoptotických molekul snížená o přibližně 20%. Statisticky významně nižší exprese pro-apoptotické molekuly BAX byla pozorována u modifikovaného oproti nemodifikovanému materiálu (p < 0,05). Testované materiály neovlivňují zásadně expresi anti-apoptotické molekuly Bcl-2 (obr. 3a,b).
Obr. 2. Relativní genové exprese na úrovni mRNA pro zánětlivé cytokiny TNF-α a IL-1. Exprese jsou vztaženy k negativní kontrole (chondrocyty pěstované v jamce s médiem bez přítomnosti materiálu), která byla stanovena jakov K=1. 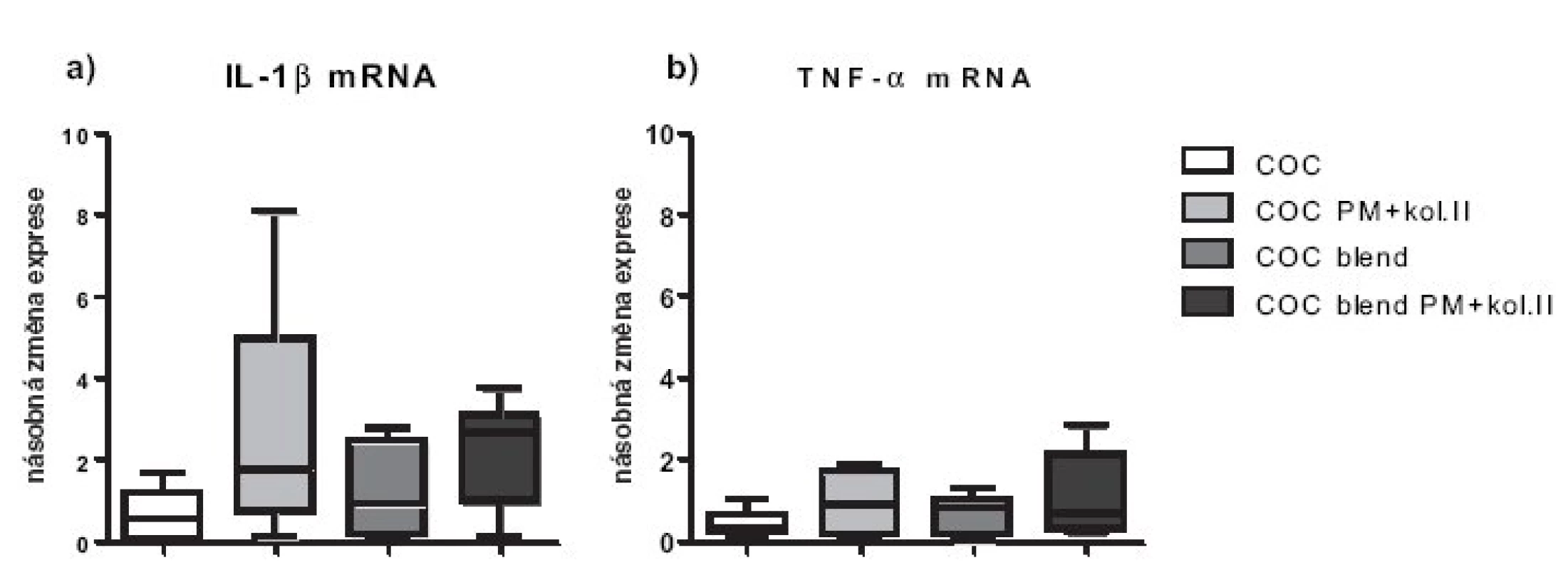
Obr. 3. Relativní genové exprese na úrovni mRNA pro apoptotické molekuly BAX a Bcl-2. Exprese jsou vztaženy relativně k negativní kontrole (chondrocyty pěstované v jamce s médiem bez přítomnosti materiálu), která byla stanovena jako K=1. 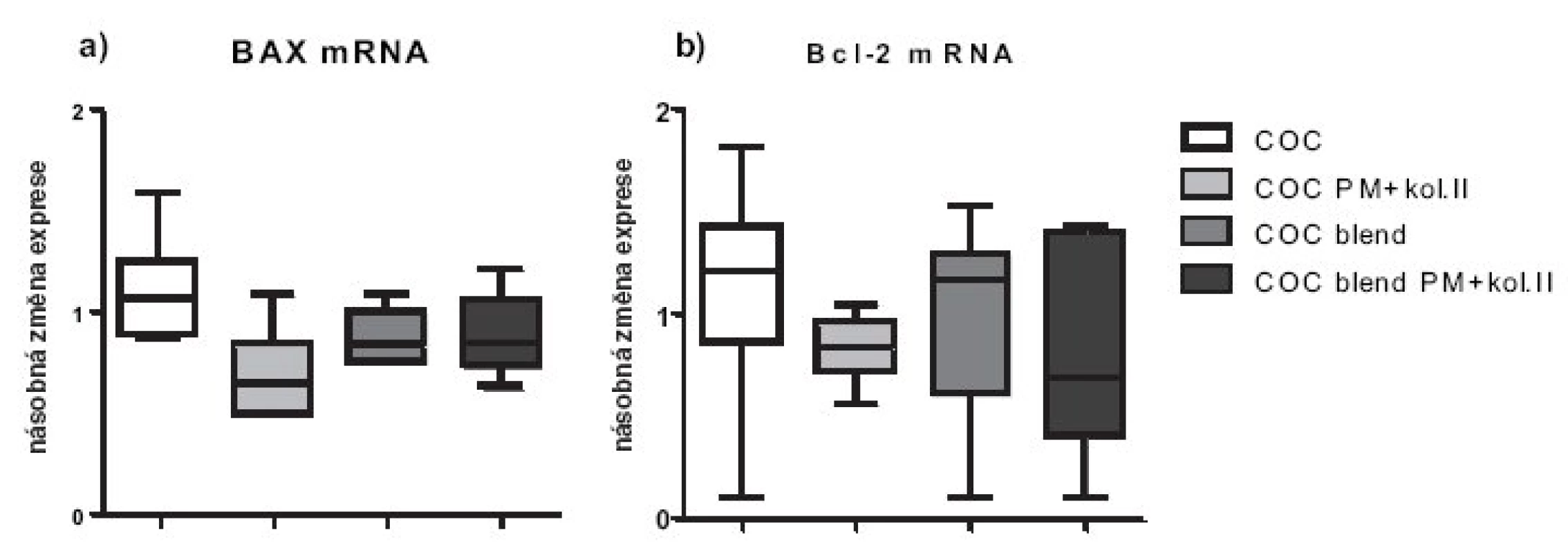
Ovlivnění viability chondrocytů modifikací polymeru
Viabilita buněk a cytotoxicita hodnocených biomateriálů pomocí MTT testu v intervalech den 2, 4 a 8 je znázorněna na obrázku 4. Viabilita mezi testovanými materiály bez plazmatické modifikace se významněji nelišila. Nicméně, od čtvrtého dne již bylo zřetelně méně viabilních chondrocytů rostoucích na modifikovaných materiálech COC a COC blend oproti materiálům bez modifikovaného povrchu. Největší rozdíl mezi viabilitou chondrocytů byl pozorován mezi modifikovaným a nemodifikovaným materiálem COC a COC blend osmý den inkubace.
Obr. 4. MTT test viability chondrocytů pěstovaných na biomateriálech v intervalu 2, 4 a 8 dní. 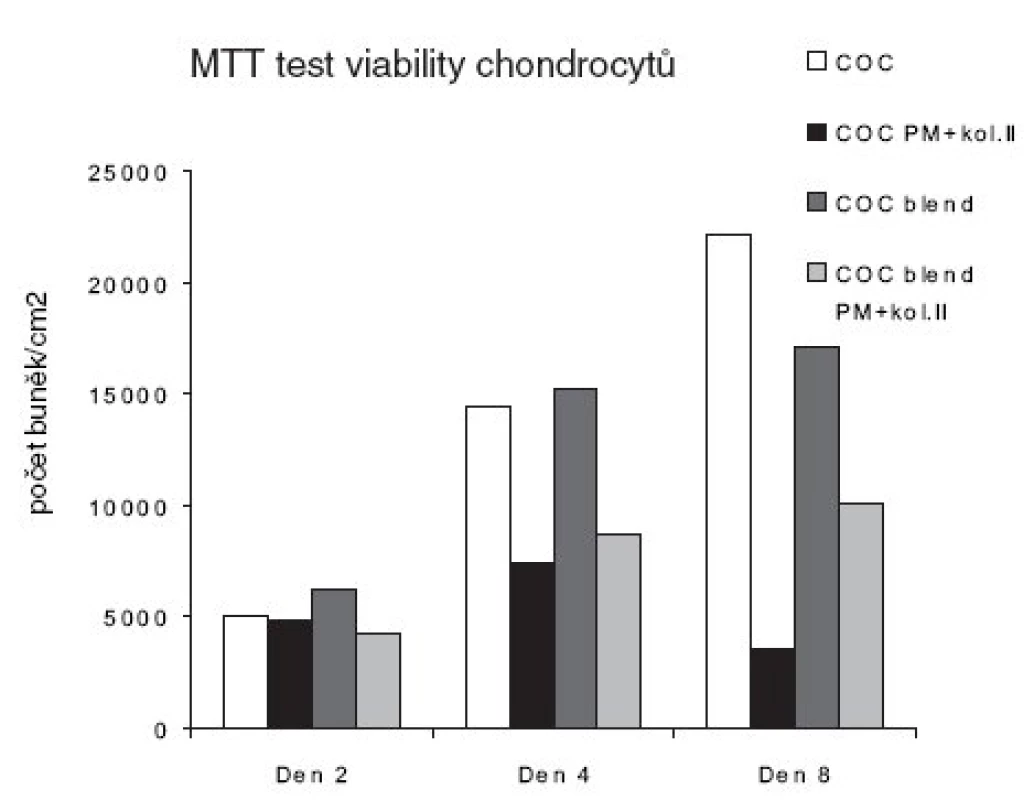
Diskuse
V této práci byl hodnocen vliv povrchové modifikace biomateriálů na chondrocyty a bylo prokázáno, že v podmínkách „in vitro“ mohou modifikované polymery snižovat viabilitu humánních chondrocytů a indukovat expresi cytokinu IL-1 a produkci matrixových metaloproteináz.
Poranění kloubní chrupavky představuje problém dospělé i dětské traumatologie a ortopedie, a to především pro její omezený reparační potenciál. Stěžejní část výzkumu léčby osteochondrálních defektů se přesouvá do roviny hledání vhodného materiálu neboli „scaffoldu“ s ideálními vlastnostmi (9). V dnešní době je známo mnoho různých materiálů jako jsou např. kovy, keramika nebo organické polymery. V této práci byl k testování zvolen polymer na bázi cyklických olefinů (COC a COC blend), protože kompozitní polymerové materiály umožňují aktivně řídit vlastnosti materiálů, např. modul pružnosti v tlaku nebo modul pružnosti v tahu (10). Vedle nezbytných fyzikálně-chemických parametrů pro danou aplikaci je důležitá biokompatibilita materiálu. Toxické substance mohou způsobit oslabení metabolické aktivity, snížení buněčné proliferace a viability, předčasnou apoptózu chondrocytů nebo zvýšenou produkci stresových proteinů a cytokinů (11, 12). Buněčná proliferace a viabilita jsou jedním z nejlepších parametrů pro stanovení cytotoxicity studovaných materiálů a pro jejich hodnocení se často používá MTT test (13, 14). Nedávno bylo zjištěno, že větší množství hydrofilních skupin na řetězcích polymerů může snížit adhezi, proliferaci a viabilitu chondrocytů (15). V naší práci jsme pozorovali mírné zvýšení exprese pro-apoptotické molekuly BAX chondrocyty rostoucími na modifikovaných materiálech, ale to již neplatilo pro anti-apoptotickou molekulu Bcl-2. Nicméně bylo evidentní, že modifikované povrchy polymerů potažené kolagenem typu II oproti nemodifikovaným polymerům snižovaly v závislosti na délce expozice viabilitu chondrocytů. Dále jsme zjistili, že modifikované povrchy materiálů indukovaly expresi IL-1, klíčového cytokinu regulujícího degradaci hyalinní chrupavky. V souladu s tímto jsme pozorovali zvýšenou produkci MMPs chondrocyty rostoucími na materiálech s modifikovaným povrchem. Na druhé straně exprese sledovaných MMPs chondrocyty na nemodifikovaných površích biomateriálů byla snížená. Tyto výsledky studií „in vitro“ tedy přímo nepodporují výhody kolagenem typu II modifikovaných povrchů implantátu ostechondrálních defektů. Na podkladě získaných dat však nelze definitivně posuzovat situaci „in vivo“. Naše předběžné výsledky totiž ukazují obdobnou biologickou toleranci modifikovaných i nemodifikovaných polymerů při jejich implantaci do uměle vytvořených osteochondrálních defektů prasečích kondylů femuru (nepublikovaná data). Navíc práce z poslední doby ukazuje obdobnou proliferaci a expresi kolagenů typu I, II a X, včetně katalytických enzymů bovinními chondrocyty v případě modifikovaných „scaffoldů“ založených na kolagenu (16). Další studie by měly potvrdit vhodnost či nevhodnost modifikace biomateriálů používaných pro náhrady osteochondrálních defektů.
Závěrem lze konstatovat, že cykloolefinové kopolymery COC a COC-blend mohou představovat vhodné materiály pro tkáňové inženýrství. Na podkladě výsledků „in vitro“ testů mohou mít plazmaticky modifikované povrchy implantátů s následnou aplikací kolagenu typu II neblahý efekt na reparaci hyalinní chrupavky, nicméně bližší objasnění by měly přinést další experimenty a „in vivo“ studie náhrad ostechondrálních defektů.
Poděkování
Předložená práce vznikla za podpory grantu GAČR, reg. č. 106/06/0761.
Mgr. Markéta Polanská
Revmatologický ústav
Na Slupi 4
128 50 Praha 2
e-mail: polanska@revma.cz
Zdroje
1. Goldring MB, Goldring SR. Osteoarthritis. J Cell Physiol 2007; 213 : 626–34.
3. van der Kraan PM, Buma P, van Kuppevelt T, van den Berg WB. Interaction of chondrocytes, extracellular matrix and growth factors: relevance for articular cartilage tissue engineering. Osteoarthritis Cartilage 2002; 10 : 631–7.
4. Hedbom E, Häuselmann HJ. Molecular aspects of pathogenesis in osteoarthritis: the role of inflammation. Cell Mol Life Sci 2002; 59 : 45–53.
5. Del Carlo M. Jr, Loeser RF. Cell death in osteoarthritis. Curr Rheumatol Rep 2008; 10 : 37–42.
6. Chajra H, Rousseau CF, Cortial D, RonziŹre MC, Herbage D, Mallein-Gerin F, Freyria AM. Collagen-based biomaterials and cartilage engineering. Application to osteochondral defects. Biomed Mater Eng 2008;18: S33–45.
7. Martin I, Miot S, Barbero A, Jakob M, Wendt D. Osteochondral tissue engineering. J Biomech 2007; 40 : 750–65.
8. Hulejová H, Adam M, Petrtýl M. Cycloolefin Copolymers. Bone. 2005; 36 : 172–173.
9. Zwingmann J, Mehlhorn AT, Südkamp N, Stark B, Dauner M, Schmal H. Chondrogenic differentiation of human articular chondrocytes differs in biodegradable PGA/PLA scaffolds. Tissue Eng 2007; 13 : 335–43.
10. Ramakrishna S., Mayer J, Wintermantel E, Leong KW. Biomedical applications of polymer-composite materials: a review. Composites Science and Technology 2001; 61 : 1189–1224.
11. Cornelis M, Dupont C, Wepierre J. In vitro cytotoxicity tests on cultured human skin fibroblasts to predict the toxic potential of surfactants. ATLA.1991; 19 : 324–337.
12. Tanzi MC, Verdeiro P, Lampugnani MG, Resnati M, Dejana E, Sturani E. Cytotoxicity of some catalysts commonlyused in the synthesis of copolymers for biomedical use. J. Mat. Sci.: Mat. Med. 1992; 10 : 9–12.
13. Willumeit R, Schossig M, Clemens H, Feyerabend F. In-vitro interactions of human chondrocytes and mesenchymal stem cells, and of mouse macrophages with phospholipid-covered metallic implant materials. Eur Cell Mater 2007; 13 : 11–25.
14. Shaw AJ. Defining cell viability and cytotoxicity. ATLA. 1994; 22 : 124–126.
15. Pérez Olmedilla M, Garcia-Giralt N, Pradas MM, et al. Response of human chondrocytes to a non-uniform distribution of hydrophilic domains on poly (ethyl acrylate-co-hydroxyethyl methacrylate) copolymers. Biomaterials 2006; 27 : 1003–12.
16. Chajra H, Rousseau CF, Cortial D, RonziŹre MC, Herbage D, Mallein-Gerin F, Freyria AM. Collagen-based biomaterials and cartilage engineering. Application to osteochondral defects. Biomed Mater Eng 2008; 18 : 33–45.
Štítky
Dermatológia Detská reumatológia Reumatológia
Článok vyšiel v časopiseČeská revmatologie
Najčítanejšie tento týždeň
2009 Číslo 1- První zkušenosti s léčbou psoriázy bimekizumabem v české reálné praxi – kazuistika z FNUSA
- Na český trh přichází biosimilar adalimumabu s prokázanou terapeutickou ekvivalencí
- Nehoňte nemocné s mMCC od čerta k ďáblu!
-
Všetky články tohto čísla
- Doporučení České revmatologické společnosti pro monitorování bezpečnosti nesteroidních antirevmatik při léčbě revmatoidní artritidy
- Předoperační příprava pacienta s revmatoidní artritidou
- Vliv modifikace implantátů pro náhrady osteochondrálních defektů na genovou expresi chondrocytů
- Degradační produkty kolagenu a elastinu jako možné ukazatele aktivity sklerodermie
- Interleukin 6 u revmatických onemocnění
- Novinky v biologické terapii revmatoidní artritidy a výhled do budoucna
- Doporučení České revmatologické společnosti pro monitorování bezpečnosti léčby revmatoidní artritidy
- Rituximab v terapii Wegenerovy granulomatózy refrakterní na standardní léčbu
- Česká revmatologie
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Interleukin 6 u revmatických onemocnění
- Novinky v biologické terapii revmatoidní artritidy a výhled do budoucna
- Rituximab v terapii Wegenerovy granulomatózy refrakterní na standardní léčbu
- Degradační produkty kolagenu a elastinu jako možné ukazatele aktivity sklerodermie
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



