-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Současné limity prevence karcinomu děložního hrdla v České republice
Current limits of cervical cancer prevention in the Czech republic
Objective:
Cervical cancer represents disease with an unique possibilities of prevention. Despite this fact, it´s still detected excessive number of new cases and deaths annualy in our country. The aim of this work was to identify major limits of cervical cancer prevention in the Czech republic.Design:
Review article.Setting:
Department of Obstetrics and Gynecology, General University Hospital and 1st Medical Faculty, Charles University, Prague.Materials and methods:
The main limit of primary and secondary prevention of cervical cancer is low participation rate of target population. Limits of screening include also inadequate age stratification of examination visits and usage of tests with a limited sensitivity.Results:
Combination of prophylactic vaccination in HPV-naive population with screening based on HPV DNA testing with selective genotyping are the strategies showing high efficacy, sensitivity and long-term negative predictive value. Essential requirement is as high as possible participation of young girls in national vaccination program and adult women in screening program.Conclusions:
It cannot be expected further improvement of current results if primary and secondary prevention programs remain unchanged. Necessary steps comprise rising of public education about advantages of vaccination and legislative changes in screening program.Keywords:
HPV test, cervical cancer, screening, vaccination
Autoři: J. Sláma
Působiště autorů: Gynekologicko-porodnická klinika VFN a 1. LF UK, Praha, přednosta prof. MUDr. A. Martan, DrSc.
Vyšlo v časopise: Ceska Gynekol 2017; 82(6): 482-486
Souhrn
Cíl studie:
Karcinom děložního hrdla je onemocnění s unikátními možnostmi prevence. Přesto je u nás každoročně zaznamenáno nepřiměřené množství nových případů a úmrtí. Cílem práce je identifikovat hlavní limity prevence karcinomu děložního hrdla v České republice.Typ studie:
Přehledová práce.Pracoviště:
Gynekologicko-porodnická klinika VFN a 1. LF UK, PrahaMateriál a metodika:
Hlavním limitem primární i sekundární prevence karcinomu děložního hrdla je nízká účast cílové populace. K limitům screeningu navíc přispívá i nevhodné věkové rozložení kontrol a používání testů s omezenou citlivostí.Výsledky:
Kombinace profylaktické vakcinace HPV naivní populace se screeningem využívajícím HPV DNA test se selektivní genotypizací jsou strategiemi s vysokou účinností, citlivostí a dlouhou negativní predikcí. Zásadním požadavkem je co nejvyšší účast mladých dívek na očkování a dospělých žen na screeningových kontrolách.Závěry:
Od aktuálního průběhu a nastavení programů primární i sekundární prevence nelze očekávat další výrazné zlepšování výsledků. Nutnými kroky jsou zvýšení osvěty o prospěšnosti vakcinace a legislativní změny metodiky screeningu.Klíčová slova:
HPV test, karcinom děložního hrdla, screening, vakcinaceÚVOD
Mimořádně široké možnosti prevence činí z karcinomu děložního hrdla výjimečné onemocnění. Díky znalostem o vyvolávající příčině převážné většiny případů karcinomu děložního hrdla – lidském papilomaviru (human papillomavirus, HPV) je k dispozici vysoce efektivní primární prevence využívající vakcinace proti nejčastějším onkogenním genotypům HPV [2]. Kromě toho je legislativně i organizačně zajištěn národní screeningový program, jehož cílem je rozpoznat a adekvátně řešit prekancerózy, které předcházejí rozvoji karcinomu děložního hrdla obvykle o řadu let. Kombinace obou postupů má schopnost dosáhnout signifikantní redukce případů karcinomu děložního hrdla [2, 5, 8].
Smutným paradoxem tak zůstává fakt, že je v naší republice každoročně zaznamenán nepřiměřeně vysoký počet žen, kterým je karcinom děložního hrdla diagnostikován, nezřídka navíc v pokročilém stadiu. Dlouhodobý trend sice se zavedením organizovaného screeningu v roce 2007 vykazuje pokles incidence, minimálně se ale dotýká prevalence pokročilých stadií s omezenými možnostmi na vyléčení. V roce 2015 tak bylo diagnostikováno 871 nových případů, z nichž 39,4 % (n = 343) tvořily pacientky ve III. a IV. stadiu podle klasifikace FIGO. V témže roce zemřelo v důsledku onemocnění 380 žen. Populační prevalence v roce 2015 zahrnovala více než 18 000 žen, které byly léčeny nebo které byly sledovány po ukončené léčbě pro invazivní nádor děložního hrdla, ale nadále žijí s rizikem recidivy nebo progrese onemocnění [11].
PRIMÁRNÍ PREVENCE
Unikátní možností prevence významného množství případů karcinomu děložního hrdla je očkování proti nejčastějším onkogenním genotypům HPV. Dostupné vakcíny jsou schopné zabránit více než 90 % případů bez ohledu na vyvolávající genotyp HPV. Dopady profylaktické vakcinace na incidenci karcinomu děložního hrdla se ale s ohledem na etiopatogenezi vyžadující dlouhodobou perzistenci HPV infekce mohou projevit až s odstupem desetiletí. Z populačního hlediska se navíc přínosy vakcinace významně uplatní až při dosažení více než 80 % proočkovanosti cílové skupiny dívek. Ta je reprezentována kohortou žen, které se ještě nesetkaly s HPV. V naší republice je proto pro hrazené očkování z prostředků veřejného zdravotního pojištění zvolena věková skupina dospívajících v rozmezí mezi 13. a 14. rokem života. Původně vysoký podíl proočkovanosti této kohorty z prvních let, kdy došlo k zavedení národního vakcinačního programu, však trvale klesá a v posledních letech se pohybuje pouze okolo 60 % [2]. Důvodů je pravděpodobně více, ale důležitou roli sehrává i kontroverzní mediální obraz vakcinace a negativní vliv tzv. odmítačů očkování, kterým je překvapivě poskytován výrazný prostor pro vyjádření jejich radikálních postojů. Značná část ženské populace tak nakonec zůstává odkázána pouze na možnosti sekundární prevence.
SEKUNDÁRNÍ PREVENCE
Principem sekundární prevence je aktivní vyhledávání prekanceróz během screeningových vyšetření. Legislativní vymezení screeningu v České republice doporučuje roční frekvenci vyšetření s odběrem cervikovaginálního cytologického stěru a jeho vyšetřením v akreditované cytologické laboratoři. Věkové vymezení kontrolních vyšetření odkazuje na vyhlášku MZ ČR č. 70/2012 Sb. upravující rozsah a pravidla preventivní gynekologické kontroly, kterou by měla podstupovat každá žena od 15 let (tab. 1).
Tab. 1. Historické milníky národního screeningu karcinomu děložního hrdla 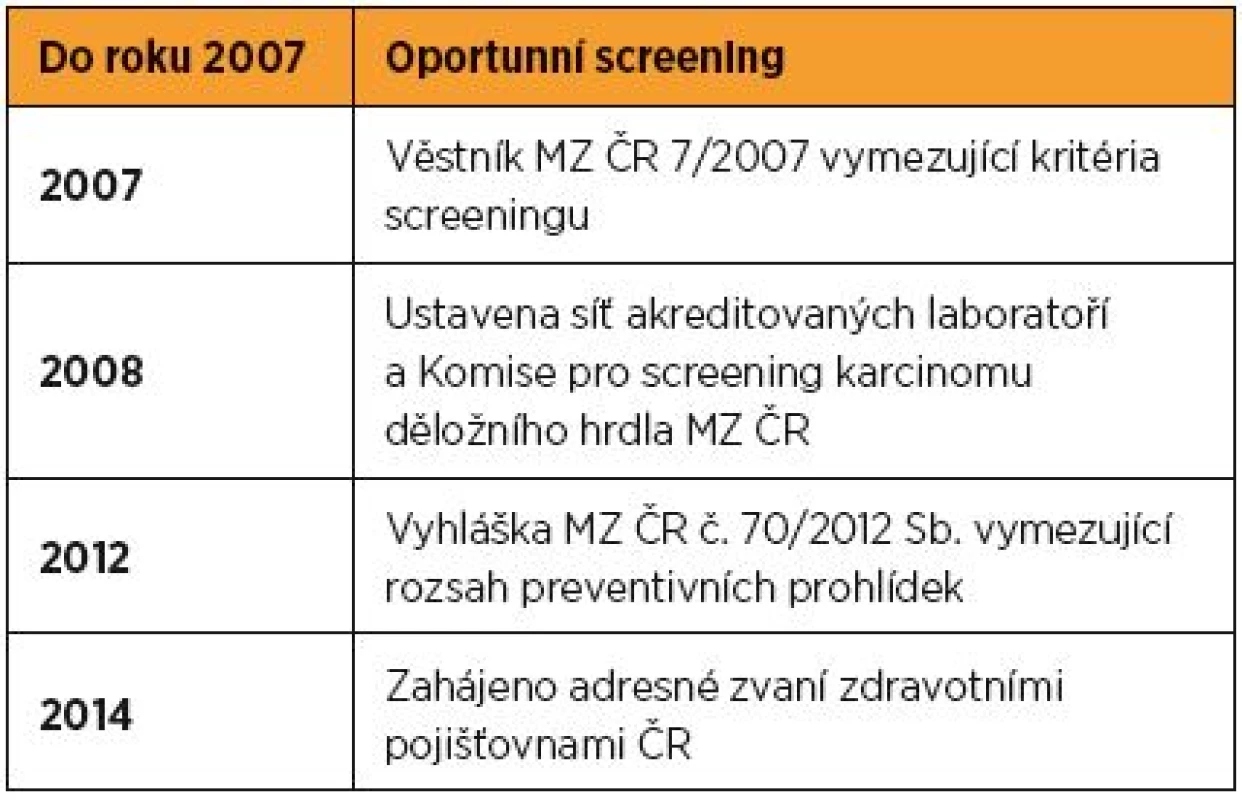
Od zavedení organizovaného screeningu v České republice dosud nedošlo ke skutečně signifikantní redukci incidence ani mortality. Hlavním důvodem a zároveň nejvážnějším problémem našeho screeningu je velmi nízká participace žen na preventivních gynekologických kontrolách, jejíž hodnota v posledních letech stagnuje a jen mírně přesahuje 50 %. Mimořádně nízká účast se týká především populace žen ve věku vyšším než 50 let, ve které jsou ale zároveň nejčastěji diagnostikována pokročilá stadia onemocnění. V roce 2013 byl medián věku žen ve III. stadiu 56 let a ve IV. stadiu 61 let. Zajímavé jsou i regionální rozdíly v účasti žen na screeningu odrážející sociální skladbu a lokální zdravotní osvětu. Na jedné straně stojí poměrně vysoká účast žen z Plzeňského kraje a na druhé naopak mizivá účast žen z Jesenicka [11].
Možností, jak zlepšit participaci žen na screeningových kontrolách, je systém aktivního zvaní. Ve Velké Británii došlo po zavedením takového systému k promptnímu nárůstu účasti s rychlým pokrytím více než 85 % všech žen ve věkovém pásmu 25 až 65 let [7]. Oproti České republice však neúčast na screeningové kontrole znamenala citelné ekonomické postihy a taková motivace byla jedním z hlavních hybatelů širokého zapojení cílové skupiny žen. V roce 2014 bylo rovněž u nás zahájeno zdravotními pojišťovnami adresné zvaní žen, které v posledních dvou letech nepodstoupily preventivní gynekologické vyšetření. Efekt adresného zvaní bez rizika postihu, a zejména pak ekonomické zodpovědnosti při neúčasti, ale vykazoval velmi nízkou míru. Při prvním pozvání byla míra účasti 11,2 % a při druhém pozvání dokonce jen 7,6 % [11]. Lze předpokládat, že pouhé adresné zvaní bez současného sankcionování těch, které na výzvy nereflektují, nemá v naší zemi naději na výrazný úspěch. Návrh jakékoliv formy postihu je ale ve své podstatě politickým krokem a je velmi nepravděpodobné, že by mohlo dojít k jednoduchému prosazení zjevně nepopulárního opatření. Jinou alternativou, která může významně navýšit účast na screeningu, je zapojení testování v domácím prostředí pomocí samoodběrových sad [6]. V naší republice však dosud není takový postup k dispozici.
Třebaže je nedostatečná účast žen na screeningu zároveň i jeho zcela zásadním limitem, problematika dlouhodobě vysoké incidence i mortality karcinomu děložního hrdla souvisí i s metodikou screeningu. Z pohledu věkového vymezení není přínosné příliš časné zahájení screeningu. V kontradikci k tomuto faktu stojí naše legislativa doporučující zahájení preventivních gynekologických kontrol již v 15 letech. S ohledem na epidemiologii a přirozený vývoj karcinomu děložního hrdla je organizovaný screening přínosný až v populaci dívek a žen starších než 25 let. V mladší věkové kategorii je u nás průměrně zjištěno pouze šest až osm případů ročně a vzhledem k časovému průběhu vývoje karcinomu děložního hrdla od HPV infekce po invazivní nádor je velmi pravděpodobné, že by oportunní screening v této populaci při nižších nákladech přinášel srovnatelná data [11].
Aktuálně diskutovanou otázkou je rovněž volba vhodné metody screeningu. Cytologický stěr je metoda s vysokou specifitou, ale nízkou senzitivitou. Falešná negativita stěru se pohybuje průměrně mezi 15 a 40 % [8]. Dokladem jsou i dvě velké studie, které hodnotily ve skupinách 1180 a 833 žen s karcinomem děložního hrdla podíl případů, u nichž došlo k selhání cytologického vyšetření, a které tak měly diagnostikován karcinom děložního hrdla, třebaže pravidelně podstupovaly screeningový stěr. Ve švédské práci dosahoval podíl případů falešně negativního výstupu screeningového stěru 24 % (300/1180) a v americké práci dokonce 32 % (263/833) [1, 5].
Cytologický stěr je bez pochybností testem, který dokázal zásadním způsobem snížit výskyt karcinomu děložního hrdla [7]. V současnosti je ale zřejmé, že jej lze nahradit postupy s vyšší citlivostí a déle trvající negativní predikcí. Limity cytologického stěru zahrnují kromě vysoké falešné negativity také nízkou reprodukovatelnost výsledků v kategorii ASC-US a LSIL, vysokou inter-laboratorní a intra-laboratorní variabilitu a velmi omezenou schopnost detekovat žlázové léze [8].
Vhodnějším screeningovým nástrojem je detekce genomu (DNA) HPV. Od ní je třeba odlišit detekci aktivní infekce HPV pomocí průkazu messenger RNA. Ta je sice citlivější při třídění hraničních cytologických stěrů, ale jako screeningový nástroj nepřináší potřebnou negativní predikci. Pro screening se uplatní validizované HPV DNA testy založené na in situ hybridizaci nebo moderněji na amplifikaci pomocí PCR s přiměřenou analytickou senzitivitou. Všechny recentní srovnávací studie doložily výrazně vyšší senzitivitu HPV DNA testu při detekci závažných prekanceróz ve srovnání s cytologickým stěrem. Ve většině větších prací se navíc citlivost HPV testu pohybovala nad 95 % a průměrný rozdíl ve srovnání s citlivostí cytologického stěru činil 35,7 % [3, 8].
Nevýhodou HPV testu je však nižší specificita. Tu lze vyvážit několika postupy. V prvé řadě je nutné HPV test v rámci screeningu používat v populaci, která zahrnuje převážně ženy s perzistentní infekcí a naopak vynechává ženy s tranzientní infekcí bez onkologického potenciálu. Zatímco cytologický stěr lze využít u všech žen bez ohledu na věk, HPV test má v naší populaci smysl až po 30. roce života. Některá zahraniční doporučení vycházející z lokální epidemiologické situace doporučují použití HPV testu ve screeningu již po 24. roce života a řada zemí jej od tohoto věku implementovala do praxe nebo vydala oficiální doporučení pro rutinní použití (tab. 2). Druhou možností je využití selektivní genotypizace prokazující izolovaně infekci nejrizikovějšími genotypy HPV 16 a HPV 18 a skupinově infekci dalšími onkogenními genotypy [10]. Několik epidemiologických studií doložilo, že onkogenní potenciál jednotlivých genotypů HPV je odlišný. V případě pozitivity HPV testu tak vedle sebe stojí dvě skupiny pacientek s odlišným onkologickým rizikem. Na jedné straně jsou pacientky s HPV 16/18 infekcí, které mají signifikantně vyšší riziko dosud nezjištěné závažné prekancerózy nebo invazivního karcinomu ve srovnání s pacientkami s infekcí ostatními onkogenními genotypy. Riziko se pro HPV 16 pohybuje mezi 13,6 až 21 % a pro HPV 18 mezi 7 až 18 % [3, 4, 10]. U obou genotypů navíc s délkou perzistence a věkem pacientky trvale narůstá. U skupiny žen s infekcí jinými onkogenními genotypy HPV je aktuální i dlouhodobé riziko výrazně nižší (1,5–4,6 %) [3, 4].
Tab. 2. Současný stav HPV screeningu ve světě 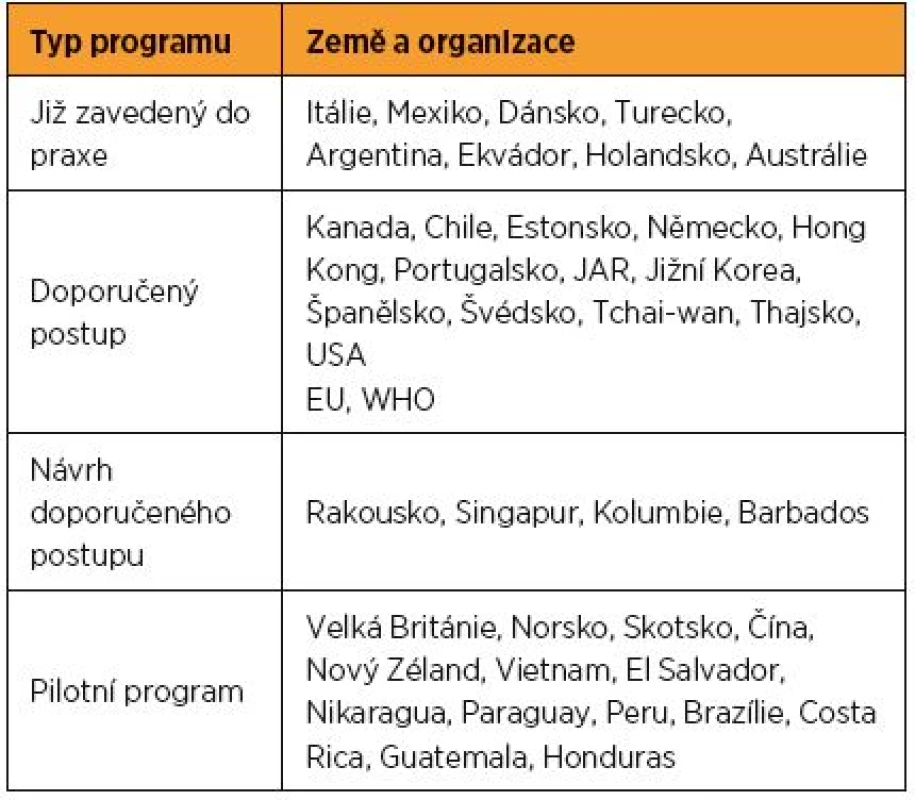
Studie ATHENA, která hodnotila přínos selektivní genotypizace ve screeningu s využitím HPV DNA testu Cobas 4800 (Roche Molecular Diagnostics), doložila, že využití selektivní genotypizace nevede k nárůstu počtu pacientek referovaných k expertní kolposkopii, ve srovnání se současnou praxí ale vykazuje výrazně vyšší výtěžnost v záchytu závažných prekanceróz nebo invazivních karcinomů. Základem metodiky studie bylo přímé referování případů HPV 16/18 pozitivních žen ke kolposkopii a třídění rizika u pacientek s pozitivitou jiného genotypu HPV pomocí cytologického stěru. Ženy non-HPV 16/18 pozitivní, ale cytologicky negativní byly referovány ke kontrole za rok, ženy s cytologickou abnormitou byly kolposkopicky vyšetřeny (schéma 1). Pravděpodobně vyšší riziko lze očekávat ještě i u žen s průkazem infekce HPV 45, který je často asociován s rozvojem obtížně diagnostikovatelných adenokarcinomů. Přínos selektivní genotypizace HPV 45 však nebyl dosud jasně doložen [10].
Schéma 1 Základní schéma HPV screeningu (upraveno podle studie ATHENA) 
Významným rozdílem mezi screeningem založeným na cytologickém stěru a HPV DNA testu je odlišná úroveň negativní predikce. Již díky primárně vyšší senzitivitě HPV testu pro detekci závažných lézí je negativní prediktivní hodnota HPV testu asi dvakrát nižší než cytologického stěru (0,27 versus 0,6) [10]. Zásadní je ale především délka přetrvávání negativní predikce. Normální výsledek cytologického stěru přináší setrvalou úroveň negativní prediktivní hodnoty přibližně pod dobu tří let a poté prudce narůstá. Iniciální HPV DNA negativita vykazuje negativní prediktivního hodnotu s velmi pomalým nárůstem. Podle Khana et al. dosahovalo riziko rozvoje závažné prekancerózy nebo invazivního karcinomu po 119 měsících sledování u pacientek starších než 30 let se vstupní HPV DNA negativitou pouze 0,8 % (0,6–1,1) [4].
Studie srovnávající screening založený pouze na HPV DNA testu a screening s kombinací cytologického stěru a HPV testu doložily srovnatelnou citlivost při významně vyšších nákladech při kombinovaném screeningu [3, 10]. Složitější otázkou je vhodný způsob třídění HPV pozitivních pacientek. V takové situaci se nabízí několik možných postupů. V kategorii žen nad 30 let lze v evropské populaci očekávat přibližně 6 až 10 % HPV DNA pozitivních případů. Pacientky s vysoce agresivními genotypy je nejvhodnější referovat přímo ke kolposkopii. Ostatní případy mohou být tříděny s využitím cytologického stěru nebo vyšetření specifických biologických markerů spojených s transformující HPV infekcí. Výhodou takových testů je absence podílu subjektivního hodnocení a možnost automatizace. Nejvyšší potenciál má kombinovaný test p16/Ki67, vyšetření metylačních změn nebo průkaz aktivity HPV infekce pomocí messenger RNA [9].
ZÁVĚR
Současné možnosti primární i sekundární prevence karcinomu děložního hrdla mají schopnost přeměnit karcinom děložního hrdla ve vzácné onemocnění. Kombinace profylaktické vakcinace HPV naivní populace se screeningem využívajícím HPV DNA test se selektivní genotypizací jsou jednoduchými a bezpečnými strategiemi s vysokou účinností, citlivostí a dlouhou negativní predikcí. Zásadním požadavkem je co nejvyšší účast mladých dívek na očkování a dospělých žen na screeningových kontrolách. Od aktuálního průběhu a nastavení obou preventivních programů nelze očekávat další výrazné zlepšování výsledků. Nezbývá než ve spolupráci s pediatry šířit osvětu o prospěšnosti vakcinace a vést aktivní kroky k legislativní změně metodiky screeningu.
Práce byla podpořena projektem IBA 1132.
Doc. MUDr. Jiří Sláma, Ph.D.
Gynekologicko-porodnická klinika
VFN a 1. LF UK
Apolinářská 18
128 51 Praha 2
e-mail: Jiri.Slama@vfn.cz
Zdroje
1. Andrae, B., Kemetli, L., Sparén, P., et al. Screening-preventable cervical cancer risks: evidence from a nationwide audit in Sweden. J Natl Cancer Inst, 2008, 7, 100(9), p. 622–629.
2. European Centre for Disease Prevention and Control. Introduction of HPV vaccines in EU countries – an update. Stockholm: ECDC, 2012.
3. Katki, HA., Kinney, WK., Fetterman, B., et al. Cervical cancer risk for women undergoing concurrent testing for human papillomavirus and cervical cytology: a population-based study in routine clinical practice. Lancet Oncol, 2011, 12(7), p. 663–672.
4. Khan, MJ., Castle, PE., Lorincz, AT., et al. The elevated 10-years risk of cervical precancer and cancer in women with human papillomavirus (HPV) type 16 or 18 and the possible utility of type-specific HPV testing in clinical practice. J Natl Cancer Inst, 2005, 20, 97(14), p. 1072–1079.
5. Leyden, WA., Manos, MM., Geiger, AM., et al. Cervical cancer in women with comprehensive health care access: attributable factors in the screening process. J Natl Cancer Inst, 2005, 4, 97(9), p. 675–683.
6. Madzima, TR., Vahabi, M., Lofters, A. Emerging role of HPV self-sampling in cervical cancer screening for hard-to-reach women: Focused literature review. Can Fam Physician, 2017, 63(8), p. 597–601.
7. Quinn, M., Babb, P., Jones, J., Allen, E. Effect of screening on incidence of and mortality from cancer of cervix in England: evaluation based on routinely collected statistics. BMJ, 1999, 3, 318(7188), p. 904–908.
8. Whitlock, EP., Vesco, KK., Eder, M., et al. Liquid-based cytology and human papillomavirus testing to screen for cervical cancer: a systematic review for the U.S. Preventive Services Task Force. Ann Intern Med, 2011, 15, 155(10), p. 687–697, W214-5.
9. Wright, TC. Jr, Behrens, CM., Ranger-Moore, J., et al. Triaging HPV-positive women with p16/Ki-67 dual-stained cytology: Results from a sub-study nested into the ATHENA trial. Gynecol Oncol, 2017, 144(1), p. 51–56.
10. Wright, TC., Stoler, MH., Behrens, CM., et al. Primary cervical cancer screening with human papillomavirus: end of study results from the ATHENA study using HPV as the first-line screening test. Gynecol Oncol, 2015, 136(2), p. 189–197.
11. www.svod.cz
Štítky
Detská gynekológia Gynekológia a pôrodníctvo Reprodukčná medicína
Článok vyšiel v časopiseČeská gynekologie
Najčítanejšie tento týždeň
2017 Číslo 6- Ne každé mimoděložní těhotenství musí končit salpingektomií
- Mýty a fakta ohledně doporučení v těhotenství
- I „pouhé“ doporučení znamená velkou pomoc. Nasměrujte své pacienty pod křídla Dobrých andělů
- Gynekologické potíže pomáhá účinně zvládat benzydamin
- Jak podpořit využití železa organismem bez nežádoucích účinků
-
Všetky články tohto čísla
- Léčebný efekt a perzistence na léčbě mirabegronem u pacientů s příznaky hyperaktivního močového měchýře v multicentrické klinické studii
-
Vaginální rekonstrukce prolapsu pánevních orgánů: efekt, komplikace, vliv na močové a pohlavní funkce a kvalitu života ve dvouletém follow-up
Část I. Vaginální nález a komplikace - Výskyt děložních sarkomů v západních Čechách, Gynekologicko-porodnická klinika LF UK a FN Plzeň
- Obrat plodu zevními hmaty z polohy podélné koncem pánevním po 36. týdnu gravidity – hodnocení úspěšnosti a komplikací
- Ambulantní miniinvazivní léčba funkčních cyst ovaria
- Hypercholesterolémie v těhotenství: úvahy o jejich etiologii a diagnostickém významu
- Souvisí postoje žen k těhotenství, porodu a mateřství s délkou porodu?
- Cystická adenomatoidná malformácia plodu
- Placenta percreta a její atypická lokalizace jako příčina silného nitrobřišního krvácení
- Současné limity prevence karcinomu děložního hrdla v České republice
- Úloha T-regulačních lymfocytů v patogenezi předčasného porodu
- Kvalita DNA ve spermiích je negativně ovlivněna věkem mužů a je rizikovým faktorem početí
-
DOPIS EDITOROVI
Vyjádření k indikacím ulipristal acetátu v léčbě děložních myomů - Seriál o EET
- Rejstříky
- Česká gynekologie
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Obrat plodu zevními hmaty z polohy podélné koncem pánevním po 36. týdnu gravidity – hodnocení úspěšnosti a komplikací
- Ambulantní miniinvazivní léčba funkčních cyst ovaria
- Kvalita DNA ve spermiích je negativně ovlivněna věkem mužů a je rizikovým faktorem početí
- Placenta percreta a její atypická lokalizace jako příčina silného nitrobřišního krvácení
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



