-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Nealkoholová tuková choroba jater: Jak nejúčinněji bojovat s nejčastějším hepatologickým onemocněním současnosti?
Non-alcoholic fatty liver disease – how to effectively fight the nowadays most common liver disease?
Non-alcoholic fatty liver disease (NAFLD) is the most common chronic liver disease nowadays. It is referred to as liver manifestation of metabolic syndrome. Given the growing incidence of diabetes and obesity, we can confidently say that we will be, or even are facing, a NAFLD pandemic in the near future. Despite strenuous efforts, there is no causal therapy and the only effective therapeutic modality is a complex lifestyle change encompasses diet and regime changes leading to a weight loss. However, it is clear from many published papers that putting these recommendations into practice and their long-term compliance with patients is very difficult. What can be offered to patients with NAFLD in clinical practice and how can they be rationally treated?
Keywords:
non-alcoholic fatty liver disease – NAFLD – non-alcoholic steatohepatitis – NASH – liver fibrosis – metabolic syndrome – Physical activity – Mediterranean diet – lifestyle modifications
Autori: Václav Šmíd
Pôsobisko autorov: IV. interní klinika – klinika gastroenterologie a hepatologie 1. LF UK a VFN v Praze
Vyšlo v časopise: Čas. Lék. čes. 2021; 160: 65-70
Kategória: Přehledový článek
Súhrn
Nealkoholová tuková choroba jater (NAFLD – non-alcoholic fatty liver disease) dnes postihuje až 30 % dospělé populace vyspělých zemí, jedná se o nejčastější chronické onemocnění tohoto orgánu. Je označována za jaterní manifestaci metabolického syndromu. Vzhledem k rostoucímu výskytu diabetu a obezity můžeme s jistotou tvrdit, že se potýkáme s pandemií NAFLD. I přes usilovnou snahu nebyla nalezena kauzální terapie a jedinou účinnou léčebnou možnost představuje komplexní změna životního stylu, zahrnující dietní a režimová opatření vedoucí k redukci tělesné hmotnosti. Z mnoha publikovaných prací je však zřejmé, že uvedení těchto doporučení do praxe, a především jejich dlouhodobé dodržení ze strany pacientů je velmi obtížné. Co lze tedy v klinické praxi pacientům s NAFLD nabídnout a jak je racionálně léčit?
Klíčová slova:
nealkoholová tuková choroba jater – NAFLD – nealkoholová steatohepatitida – NASH – jaterní fibróza – metabolický syndrom – fyzická aktivita – středomořská dieta – změny životního stylu
ÚVOD
Nealkoholová tuková choroba jater (NAFLD – non-alcoholic fatty liver disease) zahrnuje široké spektrum patologických stavů od prosté jaterní steatózy, přes steatohepatitidu (NASH – non-alcoholic steatohepatitis) s rozvojem různě těžké jaterní fibrózy až po cirhózu, a to při absenci významného příjmu alkoholu (nad 20 g denně u žen, resp. 30 g u mužů). NAFLD představuje zásadní zdravotní problém mj. v důsledku své vysoké prevalence (1), která celosvětově dosahuje přibližně 20–30 %, stejně jako úzkého vztahu k metabolickému syndromu. Odhaduje se, že NAFLD postihuje až 75 % pacientů s diabetem 2. typu (DM2) (2). U jedinců s nadváhou (BMI 25–30 kg/m2) se vyskytuje ve dvou třetinách případů, při BMI nad 30 kg/m2 až v 91 %. Asi čtvrtina pacientů s NASH má v době diagnózy již pokročilou jaterní fibrózu, cirhózu pak přibližně 10–15 % (3).
Jaterní tkáň hraje klíčovou roli v patogenezi celé řady civilizačních nemocí a NAFLD je asociována s vyšším rizikem vzniku kardiovaskulárních a nádorových onemocnění (4). Pacienty neméně ohrožuje samotná progrese jaterního postižení, která představuje třetí nejčastější příčinu úmrtí osob s NAFLD (zejména jaterní cirhóza a její komplikace). U nemocných s metabolickým syndromem (resp. jeho složkami) je proto cílené vyhledávání NAFLD žádoucí (neinvazivní skórovací indexy, abdominální ultrasonografie, jaterní elastografie). V nejbližších letech bude NAFLD ve vyspělých zemích pravděpodobně představovat jednu z hlavních indikací k transplantaci jater. I proto je zcela klíčová identifikace pacientů s touto chorobou, přesné určení jejího stadia a stratifikace pacientů podle rizika progrese ve vztahu k implementaci terapeutických opatření. Jedině tak lze zabránit nepříznivým důsledkům progrese onemocnění.
Hlavní roli v rozvoji NAFLD hraje trojí negativní fenotyp chování: 1. sedavý způsob života (doma i v práci); 2. nedostatek fyzické aktivity; 3. špatné dietní návyky. Zjednodušeně řečeno nerovnováha příjmu a výdeje energie. Významný podíl na patogenezi onemocnění hrají nesporně také genetické vlivy – především polymorfismus genu PNPLA3, jehož nepříznivá varianta v homozygotní konstituci představuje 3krát vyšší riziko vzniku NAFLD, a dále polymorfismy genů TM6SF2 a MBOAT7, které mají přídatný efekt v riziku vzniku a progrese onemocnění (5, 6).
FYZICKÁ (NE)AKTIVITA
Sedavý způsob života
Lidské tělo je uzpůsobeno k pohybu. Fyzická inaktivita ve smyslu sedavého způsobu života hraje v patogenezi NAFLD významnou úlohu a publikovaná data jednoznačně potvrzují souvislost mezi jejím vznikem a nízkou fyzickou aktivitou (7), která tvoří nezávislý rizikový faktor (8). Již 3 a více hodin sezení během dne je asociováno s vyšší mortalitou (9) a rozvojem kardiometabolických onemocnění (10). Důležitým faktorem není jen celková doba sezení, ale také počet a frekvence přestávek. Jejich zvýšený počet příznivě ovlivňuje metabolismus glukózy, triacylglycerolů (TAG) a vývoj obezity (11). Sedavý způsob života je také asociován se sklonem k příjmu nevhodné stravy a tzv. mlsání, tedy příjmu vysoce kalorických pokrmů mimo hlavní jídla (snacking) (12).
Fyzická aktivita a cvičení
Cvičení ve smyslu plánované, systematicky a cyklicky prováděné fyzické aktivity je jedním ze základních bodů terapie NAFLD. V poslední době přibývá prací zabývajících se touto problematikou, stejně jako jejich metaanalýz (13–15). Za dostatečnou je považována středně intenzivní fyzická aktivita (cca 55–69 % maximální tepové frekvence za minutu) po dobu alespoň 150 minut týdně. Některými autory bývá zjednodušeně definována jako více než 10 000 kroků denně. Z dat vyplývá, že nezáleží na druhu pohybu (posilování vs. aerobní pohyb) a jako velmi vhodné se jeví motivování a podporování pacienta k self-monitoringu denní aktivity pomocí „chytrých“ zařízení („chytré“ hodinky, fitness náramky, případně krokoměry). Již prostý nárůst fyzické aktivity bez poklesu BMI vede k redukci tuku v játrech o 20–30 %. Ukazuje se, že pouze dostatečná míra fyzické aktivity (ideálně 200–300 minut týdně) je dobrým předpokladem redukce tělesné hmotnosti (16). Pokud však dojde k přerušení cvičení, pozitivní dopady se ztrácejí (17).
Mechanismy odpovědné za snížení obsahu tuku v játrech reflektují změny v energetickém (lipidovém) metabolismu, a především periferní inzulinové senzitivitě vedoucí k poklesu de novo lipogeneze, změnám přísunu lipidů a metabolismu lipoproteinů (především VLDL) (18, 19). Na efekt těchto změn má vliv také genetická dispozice. Nositelé „nepříznivé“ konstituce polymorfismu genu PNPLA3 (GG) vykazují lepší odpověď na zvýšení fyzické zátěže než heterozygoti (CG), respektive „zdraví“ homozygoti (CC) (20). Redukce viscerálního tuku cvičením potencuje pokles jaterního zánětu a fibrogeneze. Také proto se v literatuře stále častěji setkáváme s názorem, že kontrola míry fyzické aktivity ze strany lékaře bude jedním z nezbytných postupů správné terapie NAFLD.
VÝZNAM SLOŽENÍ STRAVY A ROLE RESTRIKCE ENERGETICKÉHO PŘÍJMU
Energetický příjem
Nadbytečný příjem kalorií je asociován nejen se vznikem obezity a jejích komorbidit, nýbrž představuje také hlavní rizikový faktor rozvoje NAFLD (3). I mírný nárůst tělesné hmotnosti (o 3–5 kg) vede ke vzniku této choroby bez ohledu na výchozí hmotnost (21) a je prokázáno, že větší význam má častější příjem potravy během dne, včetně již zmíněného mlsání, než velikost porcí (22). Omezení energetického příjmu bez ohledu na fyzickou aktivitu vede k redukci ztukovatění jater a zlepšení jaterních testů i míry zánětu v jaterní tkáni (23). Denní restrikce mezi 500 až 1000 kcal je považována za extrémně účinnou intervenci nejen v prevenci rozvoje a další progrese NAFLD, ale také pro zlepšení histologického nálezu. Jako možnou alternativou trvalé kalorické restrikce je některými autory popisováno snížení denního energetického příjmu alespoň o 60 % na 2–3 dny v týdnu, nebo časové omezení přijmu potravy na 8–10 hodin po většinu dnů v týdnu. Výhodou této metody má být relativně lepší adherence pacientů při obdobných výsledcích (24).
Kromě restrikce energetického příjmu má zásadní vliv také složení stravy. Mezi nejčastěji uváděné potraviny přímo související se vznikem a progresí NAFLD patří: červené maso, průmyslově zpracované maso (uzeniny), výrazně slané potraviny, pikantní jídla, dresinky a omáčky, sladkosti obecně (sladké pečivo, moučníky, dezerty) a slazené nápoje (tab. 1).
Tab. 1. Výčet prosteatogenních potravin, které jsou nejčastěji dávány do souvislosti s rozvojem NAFLD, resp. které pacienti s NAFLD konzumují ve zvýšené míře oproti kontrolní populaci. 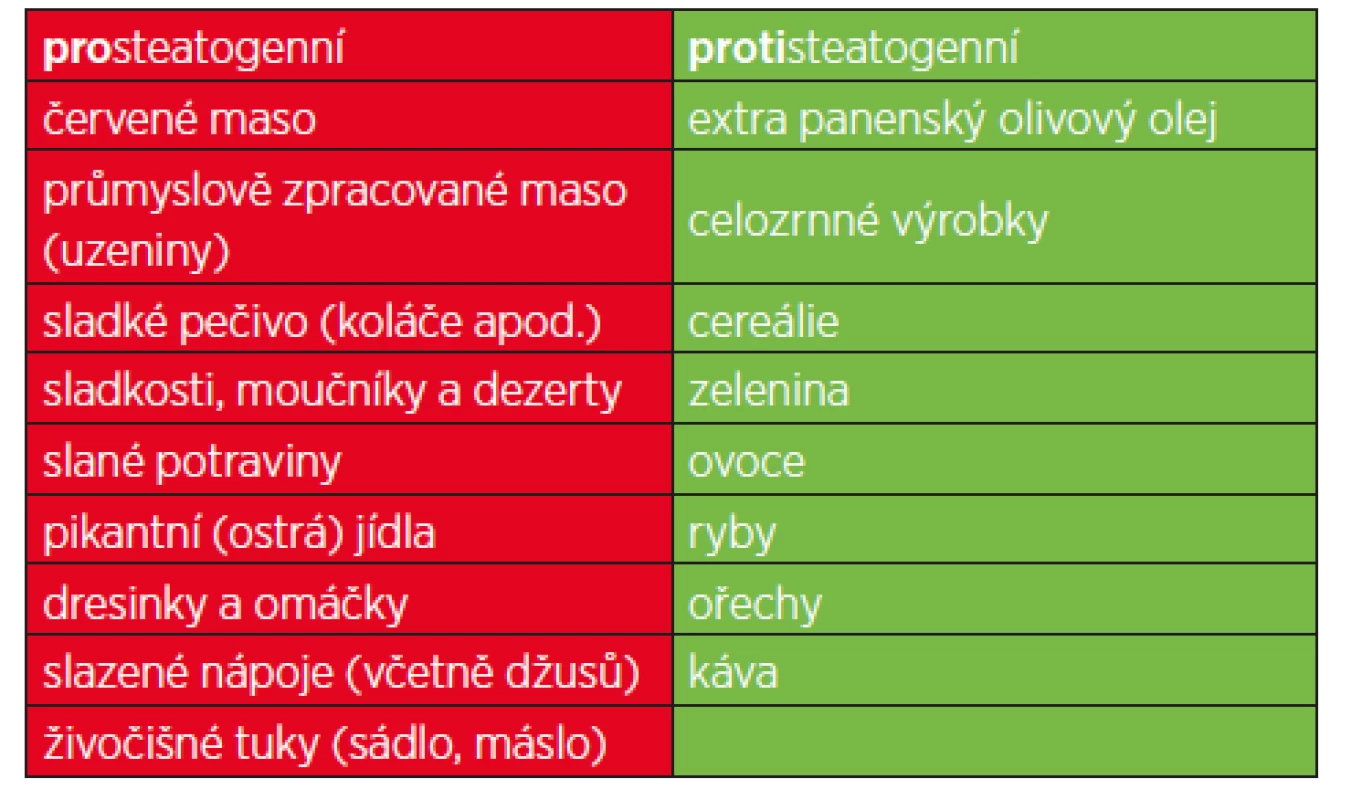
Bílkoviny
Příjem bílkovin živočišného původu, zejména červeného a průmyslově zpracovaného masa (uzenin), je jednoznačně spojeno s rozvojem kardiovaskulárních a onkologických onemocnění. Stejně tak je známo, že pacienti s NAFLD konzumují až o 30 % těchto produktů více oproti běžné populaci a že tato skutečnost koreluje s rozvojem NAFLD bez ohledu na vstupní BMI, fyzickou aktivitu či celkový energetický příjem (25). Doporučuje se proto jedince s NAFLD od konzumace těchto potravin odrazovat.
Cukry
Často podceňovaný význam mají jednoduché cukry (fruktóza, sacharóza a kukuřičný sirup s vysokým obsahem fruktózy ad.), nejčastěji přidávané do slazených nápojů, cukrovinek, ale i běžných potravin a „ovocných“ nápojů a džusů. Existují nesporná data potvrzující vztah mezi konzumací těchto cukrů (zejména fruktózy) a NAFLD (26). U animálních modelů i v humánních studiích zvyšují produkci prozánětlivých působků v játrech (TNF-α a další) a indukují endotoxémii cestou zvýšení střevní permeability. Fruktóza stimuluje de novo lipogenezi v játrech s následnou akumulací tuku (27) a její zvýšená konzumace se také pojí s vyšším stupněm jaterní fibrózy u pacientů s NAFLD (28). Současně však platí, že negativní dopady jejího příjmu bývají pozorovány zejména v důsledku nadměrného celkového energetického příjmu jedince.
Tuky
Epidemiologické studie prokazují, že jedinci s NASH mají významně nižší příjem polynenasycených mastných kyselin (PUFA) a současně vyšší příjem nasycených mastných kyselin (NMK) a cholesterolu oproti kontrolní populaci (29). NMK podporují rozvoj inzulinové rezistence, oxidačního stresu, zvyšují lipolýzu a de novo lipogenezi ústící v indukci jaterní steatózy. Zcela opačně působí PUFA a částečně také mononenasycené mastné kyseliny, jejichž nejvýznamnější mechanismy v redukci akumulace tuku v játrech, a tedy prevenci vzniku a progrese NAFLD/NASH, představují: snížení syntézy mastných kyselin (cestou inhibice SREBP-1c), zvýšení mitochondriální oxidace (aktivací PPAR-α), zvýšení inzulinové senzitivity a v neposlední řadě změna poměru n-6/n-3 PUFA ve prospěch n-3. To vše vede k redukci volných MK i TAG v játrech. Z tohoto pohledu se jako nejvýznamnější n-3 PUFA jeví kyseliny eikosapentaenová 20 : 5(n-3) a dokosahexaenová 22 : 6(n-3) (30). Účinek n-3 PUFA se prokazatelně odráží nejen ve snížení množství jaterního tuku, ale také aktivity GGT, klíčového parametru mortality pacientů s NAFLD (31). Nemalý význam má také jejich inhibiční působení na mediátory zánětu (deaktivace prozánětlivých buněčných elementů). Obecně lze tedy pacientům s NAFLD poradit, aby příjem NKM nahradili dietou bohatou na PUFA.
Středomořská dieta
Z výše uvedeného vyplývá, že složení stravy hraje v patogenezi NAFLD klíčovou roli. Současná doporučení se proto opírají o zařazení tzv. středomořské diety do jídelníčku pacientů s NAFLD, a to se všemi jejími aspekty – nízkým celkovým obsahem tuků, vysokým podílem n-3 PUFA, dostatkem zeleniny a vlákniny obecně (32). Někteří autoři připisují příznivý efekt nejen složení, ale také prostředí, v jakém se středomořská strava konzumuje (typicky delší, společný oběd/večere v rodinném kruhu v klidném prostředí u jednoho stolu). Jedním z principů pozitivních dopadů středomořské diety je také minimální obsah průmyslově upravených látek, především tuků a cukrů (AGE – advanced glycation end products). AGE jsou spojovány s rozvojem DM2 i dalších civilizačních chorob a existují nesporná data o vztahu příjmu AGE a progresí NAFLD, resp. rozvojem NASH (33). Pokud z nějakého důvodu pacient středomořskou dietu neakceptuje, lze obecně doporučit stravu bohatou na vlákninu a PUFA. Možnou alternativu představuje např. dieta DASH (dietary approaches to stop hypertension), tedy strava zaměřená na prevenci vzniku hypertenze (34).
Nápoje
Mnozí autoři opakovaně poukazují na prospěšný vliv střídmé konzumace alkoholu na vývoj NAFLD (35, 36). Zde je však potřeba zdůraznit, že data popisující příznivý vliv konzumace alkoholu se týkají pouze vína, nikoli ostatních alkoholických nápojů. Také je zapotřebí zdůraznit, že konzumace alkoholu musí být velmi střídmá (< 1 sklenička/den), představuje značný energetický příjem a má příznivý efekt pouze v určité fázi onemocnění. Navíc nesmíme zapomínat na fakt, že pacienti významně podhodnocují míru konzumace alkoholu. Z výše uvedeného vyplývá, že nemocným s NAFLD nelze pití vína přímo doporučovat, pouze jej v nízké míře tolerovat. U pacientů s pokročilou jaterní fibrózou a cirhózou konzumace alkoholu mj. signifikantně zvyšuje riziko vzniku hepatocelulárního karcinomu (HCC), a je proto nepřípustná (37).
Konzumace sladkých (colových) nápojů vede prokazatelně k jaterní steatóze, a tito jedinci tak mají vyšší riziko vzniku NAFLD (38). Je proto nezbytné dotazovat se při anamnéze nejen na konzumaci alkoholu, ale také těchto nápojů a pacienty v tomto směru řádně edukovat.
V současné době máme prokazatelné poznatky o nižším riziku vzniku HCC u konzumentů kávy (39). Dále je konzumace kávy spojována s menším rizikem vzniku metabolického syndromu, vede k redukci oxidačního stresu a podle některých studií také míry ztukovatění jater (40). Proti konzumaci kávy tak nelze u pacientů s NAFLD nic namítat (na rozdíl od jejího slazení).
Další mikronutrienty
V progresi NAFLD hraje nezastupitelnou úlohu oxidační stres. I proto je intenzivně studován vliv antioxidantů. Z nich má efekt podložený dostatečným množstvím dat pouze vitamin E, a to ve vysoké dávce (41). Jeho zvýšený příjem však bývá spojen např. s rizikem vzniku karcinomu prostaty, a proto se mezi jednoznačnými doporučeními také neobjevuje. Z dalších látek mají významnější soubory dat především vitamín A, C, D, zinek a měď (42). Souhrnně lze otázku antioxidantů zahrnout do doporučení dostatečného příjmu zeleniny a ovoce při adekvátním celkovém energetickém příjmu.
REDUKCE TĚLESNÉ HMOTNOSTI
Z doposud publikovaných prací vyplývá, že tíži jaterní steatózy největší měrou ovlivňuje redukce tělesné hmotnosti. V případě cvičení hovoříme o redukci tuku v játrech o 20–30 %, zhubnutím lze dosáhnout více než 80 % (13). Pro maximální účinnost režimových opatření vedoucích ke snížení tělesné hmotnosti je nezbytná kombinace zvýšené fyzické aktivity se souběžnou úpravou dietních návyků zmíněnou výše. Tato komplexní opatření již během 6–12 měsíců prokazatelně vedou k snížení množství TAG v játrech, zlepšení jaterních testů, parametrů metabolismu cukrů (glykémie nalačno, inzulinová senzitivita) (43) a významnému zlepšení mikroskopických známek NAFLD/NASH (steatóza, zánět, ballooning hepatocytů, fibróza) (44). Pozitivní efekt těchto opatření prokazují také studie zabývající se jejich vlivem na obezitu (45), kardiovaskulární rizika (46) a mimojaterní malignity (47).
Máme-li efekt snížení tělesné hmotnosti kvantifikovat, setkáváme se nejčastěji se dvěma hranicemi: první je redukce o cca 5 %, která vede k zmírnění steatózy jater, zlepšení jaterních testů a dalších biochemických parametrů (TAG, glykémie, glykovaný hemoglobin), druhou pak redukce o ≥ 10 %, která přináší také změny histologické, především je-li vyjádřena jako hodnota NAS (NASH Activity Score) vycházející z již zmíněných faktorů, jako jsou zánětlivé změny, ballooning, fibróza ad. (obr. 1) (48, 49).
Obr. 1. Vztah redukce tělesné hmotnosti a zlepšení histopatologického nálezu pacientů s NAFLD (modifikováno dle: 23, 34) 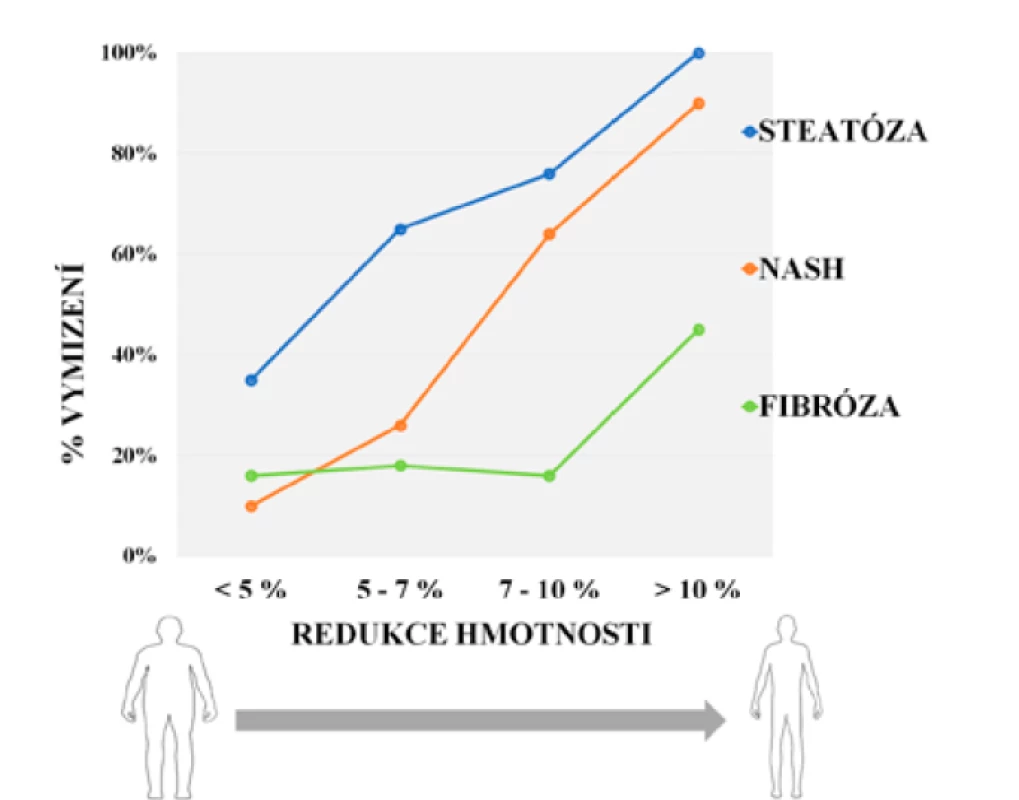
Pozn.: NASH – nealkoholová steatohepatitida Doporučení EASL uvádějí jako cíl změn životního stylu redukci tělesné hmotnosti o 7–10 % (50). Rizikové skupiny pacientů s NAFLD, tedy osoby s DM2 a obezitou (BMI > 35 kg/m2), by měly k dosažení nejlepšího možného výsledku snížit svou hmotnost nejméně o 10 %. Jakým způsobem bude redukce hmotnosti dosaženo, není podstatné (včetně chirurgických metod). Je ovšem zapotřebí počítat s tím, že pacienti s NAFLD hůře přijímají a dodržují principy tzv. zdravého životního stylu a mají nižší motivaci si tyto principy osvojit.
Dlouhodobý pozitivní efekt docílený výše uvedenými změnami životního stylu se odvíjí od několika faktorů: 1. komplexní změna životního stylu – monitorování úpravy jídelníčku a zvýšené fyzické aktivity; 2. pravidelný kontakt léčeného s lékařem/terapeutem; 3. maximální možný pokles tělesné hmotnosti během prvního roku léčby (16). Jako nejúčinnější se proto jeví multidisciplinární přístup, kdy je pacient sledován lékařem, nutričním terapeutem, psychologem a fyzioterapeutem či instruktorem cvičení. Tento postup je dosud v naší klinické praxi realizován jen zřídka, většinou ho nahrazuje pravidelný kontakt s lékařem. Ten zvyšuje šanci na udržení nastolených změn a také motivaci redukovat tělesnou hmotnost. Za významný benefit lze považovat zkušenost lékaře s behaviorální terapií (51). Dále je nezbytné poučit pacienty s NAFLD o přirozeném vývoji onemocnění, možných rizicích, která z něj vyplývají (nádory jater, DM2, kardiovaskulární choroby ad.), a zdůraznit zásadní význam změn životního stylu, které tato rizika snižují. Doporučení lze shrnout do „5P“: ptát se, posoudit, poradit, (na)plánovat a podpořit.
FARMAKOTERAPIE
V současné době neexistuje lék určený výhradně pro léčbu NAFLD/NASH. Kromě již zmíněných n-3 PUFA a vitaminu E se při NAFLD používá farmakoterapie jednotlivých komponent metabolického syndromu, zejména dyslipidémie a DM2.
Z hypolipidemické terapie bývají nejčastěji zmiňovány statiny (52) a z antihypertenziv antagonisté AT1 (telmisartan a irbesartan), a to ve vztahu ke snížení rizika rozvoje jaterní fibrózy (53). Použití obou zmíněných lékových skupin je bezpečné i u pacientů s NAFLD při zohlednění ostatních rizik a kontraindikací. Z perorálních antidiabetik je ve vztahu k biopticky prokázanému NASH často zmiňován agonista PPAR-γ pioglitazon (54). Jako velmi slibné se jeví využití gliflozinů, tj. inhibitorů sodíkoglukózového kotransportéru (SLGT-2), v proximálním tubulu ledvin. Jejich mechanismus účinku blokuje zpětné vstřebávání glukózy a zvyšuje glykosurii, přispívá tak k redukci tělesné hmotnosti. Dále jsou intenzivně studována analoga glukagonu-podobného peptidu 1 (GLP-1; např. semaglutid nebo liraglutid), které v klinických studiích vykazují příznivé účinky na sledované parametry NAFLD (redukce tuku v játrech, pokles aktivity jaterních enzymů, zlepšení histopatologického nálezu).
V současné době jsou velmi intenzivně vyvíjeny přípravky určené především k potlačení zánětlivého procesu a fibrogeneze v jaterní tkáni. Slibné se zdálo použití kyseliny obeticholové (agonista FXR), avšak pokročilé fáze klinických studií nenaplňují původní tolik optimistická očekávání. Ursodeoxycholová kyselina není v terapii NAFLD přímo doporučena, ačkoli existují práce prokazující její pozitivní vliv (55). Jako velmi nadějné se jeví klinické studie s využitím duálních agonistů PPAR-α/-δ (elafibranor) a inhibitorů chemokinových receptorů CCR2/5 (cenicriviroc). Žádný z výše uvedených preparátů však zatím není schválen pro běžné klinické využití a bude třeba vyčkat na výsledky dlouhodobých pozorování. Výše uvedené studie navíc používají jako vstupní kritérium histologický průkaz NASH a/nebo jaterní fibrózy. Jejich klinické využití tak bude nejspíše podmíněno provedením jaterní biopsie.
ZÁVĚR
NAFLD je zcela přirozenou reakcí jedince na život ve zcela nepřirozeném prostředí nadbytku energetického příjmu a nedostatku výdeje energie. Je podceňovaným zdravotním rizikem a jeho význam bude v budoucích letech narůstat. Cílené vyhledávání NAFLD u rizikových skupin pacientů se jeví jako klíčové (metabolický syndrom, diabetes, nadváha/obezita). Nejlepší způsob péče o tyto pacienty v současné době představuje multidisciplinární přístup s aktivním vyhledáváním možných rizik a zdravotních komplikací. Všechny jedince s NAFLD je zapotřebí řádně dispenzarizovat a s ohledem na tíži onemocnění adekvátně léčit. Nemocní se známkami jaterní fibrózy jsou indikováni ke specializované péči v hepatologické ambulanci. Stejně tak musejí být pacienti s NAFLD vyšetřeni stran rizika DM2, dyslipidémie, arteriální hypertenze a kardiovaskulárních onemocnění.
Péče o pacienty s NAFLD by měla vycházet z platných doporučení České hepatologické společnosti ČLS JEP, případně Evropské společnosti pro studium jater (EASL) (50, 56). Jako 1. linie léčby by měla být uplatněna komplexní změna životního stylu, která je považována za jedinou účinnou modalitu (obr. 2). Redukce tělesné hmotnosti je nejúčinnější terapií NAFLD s jasně definovaným vztahem mezi dávkou (poklesem hmotnosti) a odezvou (zlepšením histopatologického nálezu v jaterní biopsii) a vede také k redukci metabolických, kardiovaskulárních a onkologických rizik. V případě pokročilého onemocnění (NASH, jaterní fibróza) je nezbytné dosažení redukce o > 7 % tělesné hmotnosti, které je asociováno s významným klinickým zlepšením. Jako velmi vhodná se jeví tzv. středomořská dieta, vedoucí mj. k redukci kalorického příjmu. Pozitivní vliv jejího složení lze pozorovat i tehdy, pokud pacient neakceptuje celkovou energetickou restrikci, která je jinak pro tuto dietu typická. Aktivní cvičení v porovnání s redukcí hmotnosti ovlivňuje jaterní parenchym pouze částečně, avšak významně ovlivňuje kardiovaskulární systém a snižuje riziko vzniku kardiovaskulárních komplikací, které u pacientů s NAFLD představují nejčastější příčinu úmrtí. I proto cvičení představuje velmi vhodný, ne-li nezbytný doplněk změn dietních návyků (34). V budoucnu lze také očekávat personalizaci péče, kdy návrh a monitorace změn dietních i pohybových návyků bude vypracována jednotlivci na míru umělou inteligencí.
Obr. 2. Přehled režimových opatření v terapii NAFL 
Pozn.: HCC – hepatocelulární karcinom; NASH – nealkoholová steatohepatitida. Farmakoterapie NAFLD je zaměřena na léčbu jednotlivých komponent metabolického syndromu, zejména dyslipidémie a DM2. Přípravky cílené na zpomalení jaterní fibrogeneze či potlačení prozánětlivého stavu jaterního parenchymu lze v klinické praxi očekávat v řádu několika málo let.
Čestné prohlášení
Autor práce prohlašuje, že v souvislosti s tématem, vznikem a publikací tohoto článku není ve střetu zájmů a vznik ani publikace článku nebyly podpořeny žádnou farmaceutickou firmou.
Poděkování
Podpořeno grantem MZ ČR – RVO-VFN-64165.
Seznam použitých zkratek
AGE konečné produkty pokročilé glykace
CCR chemokinový receptor
DM2 diabetes mellitus 2. typu
FXR farnesoidní receptor X
GGT gamaglutamyltransferáza
HCC hepatocelulární karcinom
MK mastné kyseliny
n-3 PUFA omega-3 polynenasycené mastné kyseliny
NAFLD nealkoholová tuková choroba jater, steatóza
NASH nealkoholová steatohepatitida
NMK nenasycené mastné kyseliny
PPAR peroxisome proliferator-activated receptor
PUFA polynenasycené mastné kyseliny
SREBP1c sterol regulatory element-binding protein-1c
TAG triacylglyceroly
TNF-α tumor nekrotizující faktor alfa
VLD lipoprotein s velmi nízkou denzitou
Adresa pro korespondenci:
MUDr. Václav Šmíd, Ph.D.
IV. interní klinika 1. LF UK a VFN
U Nemocnice 499/2, 128 08 Praha
Tel.: 224 962 580
e-mail: vaclav.smid@lf1.cuni.cz
Zdroje
- Loomba R, Sanyal AJ. The global NAFLD epidemic. Nat Rev Gastroenterol Hepatol 2013; 10(11): 686–690.
- Kwok R, Choi KC, Wong GL et al. Screening diabetic patients for non-alcoholic fatty liver disease with controlled attenuation parameter and liver stiffness measurements: a prospective cohort study. Gut 2016; 65(8): 1359–1368.
- Younossi ZM, Koenig AB, Abdelatif D et al. Global epidemiology of nonalcoholic fatty liver disease – meta-analytic assessment of prevalence, incidence, and outcomes. Hepatology 2016; 64(1): 73–84.
- Adams LA, Anstee QM, Tilg H et al. Non-alcoholic fatty liver disease and its relationship with cardiovascular disease and other extrahepatic diseases. Gut 2017; 66(6): 1138–1153.
- Romeo S, Kozlitina J, Xing C et al. Genetic variation in PNPLA3 confers susceptibility to nonalcoholic fatty liver disease. Nat Genet 2008; 40(12): 1461–1465.
- Krawczyk M, Rau M, Schattenberg JM et al. Combined effects of the PNPLA3 rs738409, TM6SF2 rs58542926, and MBOAT7 rs641738 variants on NAFLD severity: a multicenter biopsy-based study. J Lipid Res 2017; 58(1): 247–255.
- Zelber-Sagi S, Nitzan-Kaluski D, Goldsmith R et al. Role of leisure-time physical activity in nonalcoholic fatty liver disease: a population-based study. Hepatology 2008; 48(6): 1791–1798.
- Ryu S, Chang Y, Jung HS et al. Relationship of sitting time and physical activity with non-alcoholic fatty liver disease. J Hepatol 2015; 63(5): 1229–1237.
- Grontved A, Hu FB. Television viewing and risk of type 2 diabetes, cardiovascular disease, and all-cause mortality: a meta-analysis. JAMA 2011; 305(23): 2448–2455.
- Levine JA. Sick of sitting. Diabetologia 2015; 58(8): 1751–1758.
- Healy GN, Dunstan DW, Salmon J et al. Breaks in sedentary time: beneficial associations with metabolic risk. Diabetes Care 2008; 31(4): 661–666.
- Santaliestra-Pasias AM, Mouratidou T, Huybrechts I et al. Increased sedentary behaviour is associated with unhealthy dietary patterns in European adolescents participating in the HELENA study. Eur J Clin Nutr 2014; 68(3): 300–308.
- Thoma C, Day CP, Trenell MI. Lifestyle interventions for the treatment of non-alcoholic fatty liver disease in adults: a systematic review. J Hepatol 2012; 56(1): 255–266.
- Keating SE, Hackett DA, George J et al. Exercise and non-alcoholic fatty liver disease: a systematic review and meta-analysis. J Hepatol 2012; 57(1): 157–166.
- Hashida R, Kawaguchi T, Bekki M et al. Aerobic vs. resistance exercise in non-alcoholic fatty liver disease: a systematic review. J Hepatol 2016; 66(1): 142–152.
- Jensen MD, Ryan DH, Apovian CM et al. 2013 AHA/ACC/TOS guideline for the management of overweight and obesity in adults: a report of the American College of Cardiology/American Heart Association Task Force on Practice Guidelines and The Obesity Society. Circulation 2013; 129(25 Suppl 2): S102–138.
- Pugh CJ, Sprung VS, Jones H et al. Exercise-induced improvements in liver fat and endothelial function are not sustained 12 months following cessation of exercise supervision in nonalcoholic fatty liver disease. Int J Obes (Lond) 2016; 40(12): 1927–1930.
- Cuthbertson DJ, Shojaee-Moradie F, Sprung VS et al. Dissociation between exercise-induced reduction in liver fat and changes in hepatic and peripheral glucose homoeostasis in obese patients with non-alcoholic fatty liver disease. Clin Sci (Lond) 2016; 130(2): 93–104.
- Shojaee-Moradie F, Cuthbertson DJ, Barrett M et al. Exercise training reduces liver fat and increases rates of VLDL clearance, but not VLDL production in NAFLD. J Clin Endocrinol Metab 2016; 101(11): 4219–4228.
- Shen J, Wong GL, Chan HL et al. PNPLA3 gene polymorphism and response to lifestyle modification in patients with nonalcoholic fatty liver disease. J Gastroenterol Hepatol 2015; 30(1): 139–146.
- Zelber-Sagi S, Lotan R, Shlomai A et al. Predictors for incidence and remission of NAFLD in the general population during a seven-year prospective follow-up. J Hepatol 2012; 56(5): 1145–1151.
- Koopman KE, Caan MW, Nederveen AJ et al. Hypercaloric diets with increased meal frequency, but not meal size, increase intrahepatic triglycerides: a randomized controlled trial. Hepatology 2014; 60(2): 545–553.
- Vilar-Gomez E, Martinez-Perez Y, Calzadilla-Bertot L et al. Weight loss through lifestyle modification significantly reduces features of nonalcoholic steatohepatitis. Gastroenterology 2015; 149(2): 367–378.
- Rynders CA, Thomas EA, Zaman A et al. Effectiveness of intermittent fasting and time-restricted feeding compared to continuous energy restriction for weight loss. Nutrients 2019; 11(10).
- Zelber-Sagi S, Ivancovsky-Wajcman D, Fliss Isakov N et al. High red and processed meat consumption is associated with non-alcoholic fatty liver disease and insulin resistance. J Hepatol 2018; 68(6): 1239–1246.
- Howard BV, Wylie-Rosett J. Sugar and cardiovascular disease: a statement for healthcare professionals from the Committee on Nutrition of the Council on Nutrition, Physical Activity, and Metabolism of the American Heart Association. Circulation 2002; 106(4): 523–527.
- Chiu S, Mulligan K, Schwarz JM. Dietary carbohydrates and fatty liver disease: de novo lipogenesis. Curr Opin Clin Nutr Metab Care 2018; 21(4): 277–282.
- Abdelmalek MF, Suzuki A, Guy C et al. Increased fructose consumption is associated with fibrosis severity in patients with nonalcoholic fatty liver disease. Hepatology 2010; 51(6): 1961–1971.
- Zelber-Sagi S, Nitzan-Kaluski D, Goldsmith R et al. Long-term nutritional intake and the risk for non-alcoholic fatty liver disease (NAFLD): a population-based study. J Hepatol 2007; 47(5): 711–717.
- de Castro GS, Calder PC. Non-alcoholic fatty liver disease and its treatment with n-3 polyunsaturated fatty acids. Clin Nutr 2018; 37(1): 37–55.
- Williams KH, Sullivan DR, Nicholson GC et al. Opposite associations between alanine aminotransferase and gamma-glutamyl transferase levels and all-cause mortality in type 2 diabetes: analysis of the Fenofibrate Intervention and Event Lowering in Diabetes (FIELD) study. Metabolism 2016; 65(5): 783–793.
- Abenavoli L, Boccuto L, Federico A et al. Diet and non-alcoholic fatty liver disease: the Mediterranean way. Int J Environ Res Public Health 2019; 16(17).
- Hyogo H, Yamagishi S, Iwamoto K et al. Elevated levels of serum advanced glycation end products in patients with non-alcoholic steatohepatitis. J Gastroenterol Hepatol 2007; 22(7): 1112–1119.
- Romero-Gomez M, Zelber-Sagi S, Trenell M. Treatment of NAFLD with diet, physical activity and exercise. J Hepatol 2017; 67(4): 829–846.
- Dunn W, Sanyal AJ, Brunt EM et al. Modest alcohol consumption is associated with decreased prevalence of steatohepatitis in patients with non-alcoholic fatty liver disease (NAFLD). J Hepatol 2012; 57(2): 384–391.
- Hashimoto Y, Hamaguchi M, Kojima T et al. Modest alcohol consumption reduces the incidence of fatty liver in men: a population-based large-scale cohort study. J Gastroenterol Hepatol 2015; 30(3): 546–552.
- Ascha MS, Hanouneh IA, Lopez R et al. The incidence and risk factors of hepatocellular carcinoma in patients with nonalcoholic steatohepatitis. Hepatology 2010; 51(6): 1972–1978.
- Ma J, Fox CS, Jacques PF et al. Sugar-sweetened beverage, diet soda, and fatty liver disease in the Framingham Heart Study cohorts. J Hepatol 2015; 63(2): 462–469.
- Setiawan VW, Wilkens LR, Lu SC et al. Association of coffee intake with reduced incidence of liver cancer and death from chronic liver disease in the US multiethnic cohort. Gastroenterology 2015; 148(1): 118–125.
- Vitaglione P, Morisco F, Mazzone G et al. Coffee reduces liver damage in a rat model of steatohepatitis: the underlying mechanisms and the role of polyphenols and melanoidins. Hepatology 2010; 52(5): 1652–1661.
- Hoofnagle JH, Van Natta ML, Kleiner DE et al. Vitamin E and changes in serum alanine aminotransferase levels in patients with non-alcoholic steatohepatitis. Aliment Pharmacol Ther 2013; 38(2): 134–143.
- Pickett-Blakely O, Young K, Carr RM. Micronutrients in non-alcoholic fatty liver disease pathogenesis. Cell Mol Gastroenterol Hepatol 2018; 6(4): 451–462.
- Patel NS, Doycheva I, Peterson MR et al. Effect of weight loss on magnetic resonance imaging estimation of liver fat and volume in patients with nonalcoholic steatohepatitis. Clin Gastroenterol Hepatol 2015; 13(3): 561–568.e1.
- Eckard C, Cole R, Lockwood J et al. Prospective histopathologic evaluation of lifestyle modification in nonalcoholic fatty liver disease: a randomized trial. Therap Adv Gastroenterol 2013; 6(4): 249–259.
- Ross R, Hudson R, Stotz PJ et al. Effects of exercise amount and intensity on abdominal obesity and glucose tolerance in obese adults: a randomized trial. Ann Intern Med 2015; 162(5): 325–334.
- Wing RR, Bolin P, Brancati FL et al. Cardiovascular effects of intensive lifestyle intervention in type 2 diabetes. N Engl J Med 2013; 369(2): 145–154.
- Byers T, Sedjo RL. Body fatness as a cause of cancer: epidemiologic clues to biologic mechanisms. Endocr Relat Cancer 2015; 22(3): R125–R134.
- Promrat K, Kleiner DE, Niemeier HM et al. Randomized controlled trial testing the effects of weight loss on non-alcoholic steatohepatitis. Hepatology 2010; 51(1): 121–129.
- Glass LM, Dickson RC, Anderson JC et al. Total body weight loss of ≥ 10 % is associated with improved hepatic fibrosis in patients with non-alcoholic steatohepatitis. Dig Dis Sci 2015; 60(4): 1024–1030.
- European Association for the Study of the Liver (EASL); European Association for the Study of Diabetes (EASD); European Association for the Study of Obesity (EASO). EASL-EASD-EASO Clinical Practice Guidelines for the management of non-alcoholic fatty liver disease. J Hepatol 2016; 64(6): 1388–1402.
- Bellentani S, Dalle Grave R, Suppini A et al. Behavior therapy for non-alcoholic fatty liver disease: The need for a multidisciplinary approach. Hepatology 2008; 47(2): 746–754.
- Amor AJ, Perea V. Dyslipidemia in non-alcoholic fatty liver disease. Curr Opin Endocrinol Diabetes Obes 2019; 26(2): 103–108.
- Goh GB, Pagadala MR, Dasarathy J et al. Renin-angiotensin system and fibrosis in non-alcoholic fatty liver disease. Liver Int 2015; 35(3): 979–85.
- Sanyal AJ, Chalasani N, Kowdley KV et al. Pioglitazone, vitamin E, or placebo for non-alcoholic steatohepatitis. N Engl J Med 2010; 362(18): 1675–1685.
- Ratziu V. Treatment of NASH with ursodeoxycholic acid: pro. Clin Res Hepatol Gastroenterol 2012; 36 Suppl 1: S41–S45.
- Brůha R, Dvořák K, Fejfar T et al. Doporučený postup České hepatologické společnosti ČLS JEP pro diagnostiku a léčbu nealkoholové tukové choroby jater (NAFLD). Gastroent Hepatol 2020; 74(2): 103–110.
Štítky
Adiktológia Alergológia a imunológia Angiológia Audiológia a foniatria Biochémia Dermatológia Detská gastroenterológia Detská chirurgia Detská kardiológia Detská neurológia Detská otorinolaryngológia Detská psychiatria Detská reumatológia Diabetológia Farmácia Chirurgia cievna Algeziológia Dentální hygienistka
Článek ÚVODEMČlánek Představujeme publikaci
Článok vyšiel v časopiseČasopis lékařů českých
Najčítanejšie tento týždeň
2021 Číslo 2-3- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- fSCIG v reálnej klinickej praxi u pacientov s hematologickými malignitami
- Kombinace metamizol/paracetamol v léčbě pooperační bolesti u zákroků v rámci jednodenní chirurgie
- Subkutánne vs. intravenózne imunoglobulíny u pacientov s CLL
-
Všetky články tohto čísla
- Alokace vzácných zdrojů v době pandemie
- Protilátkové repetitorium – vyšetření protilátek proti koronaviru v běžné praxi
- Techniky zvládání stresu jako součást profesní výbavy zdravotníků (nejen) pro boj s pandemií COVID-19
- Využití kognitivně-behaviorálního přístupu k terapii nadváhy a obezity
- Nealkoholová tuková choroba jater: Jak nejúčinněji bojovat s nejčastějším hepatologickým onemocněním současnosti?
- ATP-senzitivní draslíkové kanály: klíčoví hráči v patofyziologii mnoha chorob
- Rizika přenosu nemocí hmyzem na území Česka a Slovenska
- Principy medicíny založené na důkazu: od postulátů Roberta Kocha po současnou EBM
- K počátkům evropské gynekologie: archeologické a literární prameny k vývoji gynekologie v Řecku před rokem 500 př. Kr.
-
Gertrude Belle Elionová
(1918–1999) - Zamyšlení nad Spolkem českých lékařů v Praze
-
K devadesátinám prof. MUDr.
Jany Pařízkové, DrSc. - Sedmdesát let prof. Aleše Žáka
- Vzpomínka na prof. Rostislava Koďouska
- ÚVODEM
- Syndrom počítačového vidění – projevy a možnosti předcházení
- Pitvy před Vesaliem a Jeseniem
- Špitální péče řádu sv. Jana na evropské půdě do 18. století
- Představujeme publikaci
- Časopis lékařů českých
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Protilátkové repetitorium – vyšetření protilátek proti koronaviru v běžné praxi
- Rizika přenosu nemocí hmyzem na území Česka a Slovenska
- Syndrom počítačového vidění – projevy a možnosti předcházení
- Nealkoholová tuková choroba jater: Jak nejúčinněji bojovat s nejčastějším hepatologickým onemocněním současnosti?
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



