-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Současné možnosti diagnostiky a léčby imunologických příčin ženské neplodnosti
Current possibilities of diagnostics and treatment of immunological causes of female infertility
The immune system plays an important role in many processes of human reproduction. During pregnancy, mother's body has to accept the semialogenic fetus, therefore the role of immune processes has a high importance. Tolerance of the fetus by the mother's immune system is ensured by a complex of immune mechanisms, the knowledge of which brings us to the new insights into human reproduction processes and in seeking of new ways to modulate immunity in repeated embryo implantation failures, miscarriages, premature births, preeclampsia, and other fertility disorders and pregnancy complications. The review article is a summary of current possibilities of immunological laboratory diagnostics in reproductive immunology, presents indications for these tests and their interpretation, and mentions possible methods of therapeutic immune intervention.
Keywords:
infertility – Miscarriage – Immunity – In vitro fertilization – Autoantibodies – cellular immunity – NK cells – immunomodulation
Autori: Karin Malíčková 1,2; Zuzana Ambrusová 2,3; Slávka Belvončíková 4; Katarína Bergendiová 5; Zuzana Krátká 2; Martin Lešťan 4; Štěpánka Luxová 2; Jiří Novák 6; Elena Tibenská 7,8; Jana Vydláková 2,9; Lenka Sedláčková 2
Pôsobisko autorov: Klinické centrum ISCARE, a. s., Praha 1; Oddělení alergologie a klinické imunologie, GENNET, s. r. o., Praha 2; Ambulance pro alergologii a imunologii, Nemocnice s poliklinikou Mělník 3; Alergoimunologické centrum EMED, s. r. o., Prešov, SR 4; ImunoVital Centrum, Bratislava, SR 5; Centrum klinické imunologie, Nemocnice České Budějovice 6; MEDIREX, a. s., Bratislava, SR 7; Jednotka klinického výskumu, Lekárska fakulta Univerzity Komenského v Bratislave, SR 8; Ambulance klinické imunologie a alergologie, IKEM, Praha 9
Vyšlo v časopise: Čas. Lék. čes. 2021; 160: 5-13
Kategória: Přehledový článek
Súhrn
Imunitní systém má důležitou úlohu v řadě procesů lidské reprodukce. V průběhu gravidity, kdy organismus matky musí akceptovat semialogenní plod, je úloha imunitních procesů obzvlášť důležitá. Tolerance plodu imunitním systémem matky je zajišťována komplexem navzájem souvisejících imunitních mechanismů, jejichž pochopení přináší nové pohledy na procesy lidské reprodukce a je výchozím bodem pro hledání nových perspektivních způsobů modulace imunity u opakovaných selhání implantace embrya, habituálního potrácení, předčasných porodů, preeklampsie a dalších poruch plodnosti a těhotenských komplikací. Přehledový článek představuje souhrn současných možností imunologické laboratorní diagnostiky v reprodukční imunologii, uvádí indikace těchto vyšetření a jejich interpretaci a zmiňuje možné způsoby léčebné imunointervence.
Klíčová slova:
neplodnost – potrat – imunita – in vitro fertilizace – autoprotilátky – buněčná imunita – NK buňky – imunomodulace
ÚVOD
Neplodnost je definována jako neschopnost počít dítě přirozenou cestou a/nebo neschopnost donosit a porodit živé dítě. Pojem sterilita se používá pro stav, kdy se páru nedaří spontánně otěhotnět po roce pravidelného nechráněného styku. Termín infertilita je používán pro stav, kdy je pár schopen spontánního početí, ale žena není schopna donosit živý plod a opakovaně gravidity potrácí.
Ženská neplodnost může mít řadu příčin. Jednu velkou skupinu tvoří poruchy imunity. V současnosti je dobře popsána řada imunopatologií, které mohou vyústit ve sterilitu nebo infertilitu. Imunopatologie jako hlavní diagnóza vedoucí k neplodnosti a k potřebě léčby některou z technik asistované reprodukce je v Národním registru asistované reprodukce ČR zastoupena necelými 6 % (1). Nejčastější klinickou situací však je kombinace několika faktorů poruchy plodnosti.
INDIKACE K IMUNOLOGICKÉMU VYŠETŘENÍ
Vyšetření neplodné ženy reprodukčním imunologem je indikováno v konkrétních situacích (tab. 1). Někdy není vhodné provádět imunologické vyšetření se zaměřením na neplodnost a je nutné jej odložit na pozdější dobu (tab. 2).
Tab. 1. Indikace pro vyšetření neplodné ženy reprodukčním imunologem 
Tab. 2. Dočasné kontraindikace reprodukčně imunologických laboratorních vyšetření 
PORUCHY HUMORÁLNÍ SLOŽKY IMUNITNÍHO SYSTÉMU
Do skupiny humorálních poruch imunity vedoucích k neplodnosti patří především patologická imunitní odpověď na vlastní antigeny (autoimunita), destruktivní imunitní odpověď na antigeny cizí tkáně (aloimunita) a některé imunodeficience.
PROTILÁTKY PROTI ZONA PELLUCIDA
Kolem oocytu se nachází extracelulární matrix označovaná jako zona pellucida (ZP), která je tvořena čtyřmi typy glykoproteinů a produkována oocytem v průběhu oogeneze. Jedná se o klíčové místo, v němž dochází k vzájemné interakci spermie a vajíčka při fertilizaci. Oplodnit vajíčko mohou pouze kvalitní spermie. Po kontaktu spermie se ZP se při akrosomové reakci uvolní akrosomové proteiny, které štěpí ZP a spermii spolu s pohybem jejího bičíku umožní proniknout do perivitelinního prostoru a poté do oocytu. ZP tak slouží k selekci kvalitních spermií. Spermie se na oocyt váže díky specifickým receptorům. Po oplození oocytu dochází k odvržení vazebných receptorů, další spermie se už navázat nemohou, a je tak zabráněno, aby došlo k polyspermii. ZP přetrvává kolem vyvíjejícího se zárodku až do stadia blastocysty.
Protilátky proti ZP (AZP – anti-zona pellucida antibodies) brání vstupu spermie do vajíčka při přirozené nebo umělé fertilizaci. Hladiny AZP mohou stoupat úměrně počtům odběrů oocytů ze stimulované ovariální tkáně, ke kterým dochází během fertilizace in vitro (IVF), častější je jejich výskyt také u pacientek s endometriózou s postižením ovarií nebo po mykoplazmových urogenitálních infekcích (2, 3). Výskyt těchto orgánově specifických autoprotilátek je vzácný (přibližně 5 %).
Stanovení sérových AZP se provádí buď metodou ELISA, nebo nepřímou imunofluorescencí na tkáních prasečího či opičího původu. Dostupné metody však nemají vysokou senzitivitu a specificitu a je třeba podpořit vývoj nových lepších diagnostických souprav. Mezi indikace stanovení AZP patří zejména opakované mikroaborty, opakovaně neúspěšné embryotransfery a endometrióza.
Pozitivita AZP je indikací k IVF ICSI. Jelikož lze mechanicky odstranit ZP před transferem embrya (tedy před zavedením embrya do dělohy), přistupuje se na některých pracovištích asistované reprodukce k provádění této zona-free metody. Před přikročením k technikám asistované reprodukce může být indikována také imunointervenční léčba kortikoidy s cílem snížit sérové hladiny zmíněných autoprotilátek.
PROTILÁTKY PROTI OVARIÍM
V některých případech dochází k tvorbě heterogenní skupiny protilátek namířených proti různým strukturám ovaria (AOA – anti-ovarian antibodies), například folikulárním strukturám, membrana granulosa, buňkám theca folliculi interna nebo buňkám žlutého tělíska. Jejich přítomnost naznačuje možnost ovariálního poškození či dysfunkce a snížení ovariální rezervy a upozorňuje na vhodnost vyšetření dalších orgánově specifických či nespecifických autoimunitních onemocnění. Přítomnost AOA může snižovat úspěšnost hormonální stimulace při IVF. Pozitivita AOA není indikací imunointervenční terapie, pro klinika představuje spíše výzvu k hledání souvislostí mezi poruchou plodnosti a možným poškozením ovarií z různých příčin.
AOA se vyskytují přibližně u 4 % běžné populace. Dlouho byly dávány do souvislosti s předčasnou menopauzou, poruchami funkce nadledvin a polyglandulární autoimunitou. V současnosti již víme, že AOA se podílejí i na snížené plodnosti, souvisejí s horší odpovědí na stimulaci gonadotropiny, se sníženou kvalitou oocytů a embryí, jakož i se selháváním implantace embrya (4). Přesný mechanismus spoluúčasti AOA na patogenezi těchto stavů není přesně identifikován. U některých pacientek byly zjištěny mutace v genu AIRE (autoimunitní regulační gen) či polymorfismy v alelách HLA DR3/DR4. Zvýšený záchyt AOA je i u pacientek s Turnerovým syndromem. Byla popsána rovněž infekční geneze AOA, například při chlamydiových infekcích (5).
K molekulárním cílům AOA patří především enzymy důležité při tvorbě steroidních hormonů – 17α-hydroxylázy, desmolázy, 3β-hydroxysteroid dehydrogenázy a 21-hydroxylázy. Autoprotilátky proti těmto enzymům se vyskytují i u jiných autoimunitně vyvolaných onemocnění, například Addisonovy nemoci nebo polyglandulárních syndromů. Dysfunkce steroidních enzymů je příčinou poruchy plodnosti. AOA se mohou vázat rovněž na receptory gonadotropních hormonů (například na β-subjednotku FSH). To způsobuje zhoršení vazby FSH na jeho receptor a zhoršenou funkci ovarií (6).
Následkem četných hormonálních ovariálních stimulací a opakovaných punkcí folikulů může dojít s nadměrnému uvolňování ovariálních antigenů, které stimulují imunitní systém k produkci AOA. Záchyt AOA může být cenným prognostickým znakem neuspokojivé odpovědi pacientek na stimulaci gonadotropiny při IVF (odhad tzv. poor responders). K daným mechanismům nejspíše přispívá cytotoxické působení AOA na granulózové buňky a následné snížení produkce progesteronu těmito buňkami (7).
Sérové AOA jsou stanovovány nejčastěji enzymovou imunoanalýzou nebo nepřímou imunofluorescencí. Dostupné metody jsou zatíženy vysokým stupněm falešné pozitivity (v případě testů ELISA) nebo falešné negativity (u nepřímé imunofluorescence). Opět je třeba podpořit vývoj nových diagnostických souprav, které by umožnily stanovit AOA proti konkrétním autoantigenům ovarií, čímž by přinesly větší možnosti diagnostické, ale snad i terapeutické.
Pozitivita AOA není důvodem pro paušální imunointervenční léčbu. Je-li přítomna, zaměřujeme se na možné příčiny poškození ovarií, autoimunitní procesy v organismu, genetické příčiny, infekce či souvislost s léčbou metodou IVF.
ANTIFOSFOLIPIDOVÉ PROTILÁTKY
Heterogenní skupinu představují též antifosfolipidové protilátky (APLA – antiphospholipid antibodies), které působí na různých úrovních koagulační kaskády. Dochází k jejich vazbě na negativně nabité fosfolipidy nebo na komplexy fosfolipidů s proteiny a mohou vyvolat rozvoj trombofilního stavu.
Nejčastěji zjišťovanými APLA jsou antikardiolipinové protilátky, protilátky proti fosfatidylserinu, fosfatidylinositolu, kyselině fosfatidové a proti jejich kofaktorům proteinové povahy, tj. nejčastěji protrombinu, annexinu V a β2 glykoproteinu 1. Screeningově se vyšetřuje lupus antikoagulans (lupusový inhibitor koagulace), který vypovídá o přítomnosti autoprotilátek proti negativně nabitým fosfolipidům nebo koagulačním faktorům, zejména protrombinu. Ke stanovení APLA se používají metody imunoenzymové a k průkazu lupus antikoagulans testy koagulační. APLA se vyšetřují nejčastěji v izotypech IgM a IgG. Při laboratorním průkazu přítomnosti APLA ve dvou a více měřeních provedených v časovém odstupu nejméně 12 týdnů (8) a současně při klinické manifestaci trombózy ve venózním či arteriálním řečišti nebo při výskytu potratů je třeba myslet na diagnózu antifosfolipidového syndromu (APS – antiphospholipid syndrome). Ten může být primární nebo sekundární (pokud doprovází jiné systémové autoimunitní onemocnění). Diagnostická kritéria APS uvádí tab. 3. Jistá diagnóza vyžaduje splnění alespoň jednoho klinického a alespoň jednoho laboratorního kritéria.
Tab. 3. Diagnostická kritéria antifosfolipidového syndromu (45) 
APLA, obvykle ve třídě IgM v nižším titru, bez průkazu lupus antikoagulans a bez klinických projevů, se někdy zachycují jako parainfekční fenomény. Protilátky, které se uplatňují v patogentických mechanismech APS, jsou převážně izotypu IgG, pozitivita ve třídě IgM ale může být indikátorem počínajícího autoimunitního onemocnění. Popisována je rovněž asociace výskytu APLA s hematologickými malignitami a užíváním některých léčiv (9).
S těhotenskými komplikacemi však může být sdružena již samotná přítomnost sérových antifosfolipidových protilátek, tj. nemusejí být splněna klasifikační kritéria APS. APLA jsou asociovány s vyšším rizikem časných i pozdních těhotenských ztrát, předčasného porodu, preeklampsie, intrauterinní retardace plodu, syndromu HELLP, oligohydramnionu a placentární insuficience (8).
Při léčbě se v případě potvrzeného APS v graviditě uplatňují kyselina acetylsalicylová nebo nízkomolekulární hepariny, případně kombinovaná terapie. Alternativně, při selhání rutinního přístupu, je doporučeno podávání intravenózních imunoglobulinů (Ig), hydroxychlorochinu, kortikosteroidů nebo provedení plazmaferézy (10).
PROTILÁTKY PROTI TKÁŇOVÉ TRANSGLUTAMINÁZE, PROTILÁTKY PROTI ENDOMYZIU A CELIAKIE
Celiakie je imunopatologické onemocnění tenkého střeva, jehož základ tvoří nesnášenlivost (intolerance) některých bílkovin, zejména lepku (glutenu). Kombinace genetické predispozice (konkrétně alel HLA DQ-2, DQ-8) s environmentálními faktory určují individuální imunitní reaktivitu daného jedince (11). Klinické projevy nesnášenlivosti lepku nejsou vždy vyjádřeny v gastrointestinálním traktu (trávicí potíže udává pouze 10‒20 % nemocných), ale projevuje se i opožděnou menstruací, časnou menopauzou, sekundární amenoreou, sterilitou a komplikacemi v těhotenství – opakovanými potraty, intrauterinní růstovou restrikcí, nízkou porodní hmotností, předčasnými porody či narozením mrtvého plodu (12).
Tkáňová transglutamináza je ubikviterní enzym, který se podílí na buněčné proliferaci, přenosu signálů z receptorů do nitra buňky, výstavbě extracelulární matrix a adhezi a pohybu buněk a rovněž se účastní procesů implantace embrya, při nichž především podporuje angiogenezi a invazi mateřské decidui do extravilózního trofoblastu. Vazbou autoprotilátek na tkáňovou transglutaminázu dochází k patologické apoptóze buněk extravilózního trofoblastu a k inhibici angiogeneze (13).
K diagnostice sérových protilátek proti tkáňové transglutamináze (ATTA – anti-tissue transglutaminase antibodies) v izotypu IgA (nebo v izotypu IgG při selektivním deficitu sérového IgA) je nejčastěji využívána metoda ELISA (14). Specificita a senzitivita ATTA je velmi vysoká – senzitivita dosahuje téměř 100 %, specificita 97,8 % (15). Při pozitivním nálezu se doplňuje imunofluorescenční vyšetření protilátek proti endomyziu (EMA – endomysial antibodies) (obr. 1). Při pozitivním nálezu autoprotilátek se provádí gastroskopie se slizniční biopsií z duodena, preferenčně pod Vaterovou papilou, s cílem zjistit přítomnost autoimunitní enteritidy (16). U nemocných s celiakií je doporučeno striktní dodržování bezlepkové diety za účelem eliminace prozánětlivé imunitní odpovědi vyvolané lepkem. Gravidita se doporučuje až po dosažení negativity ATTA, což může trvat i několik měsíců. Dieta musí být celoživotní.
Obr. 1. Protilátky proti endomyziu 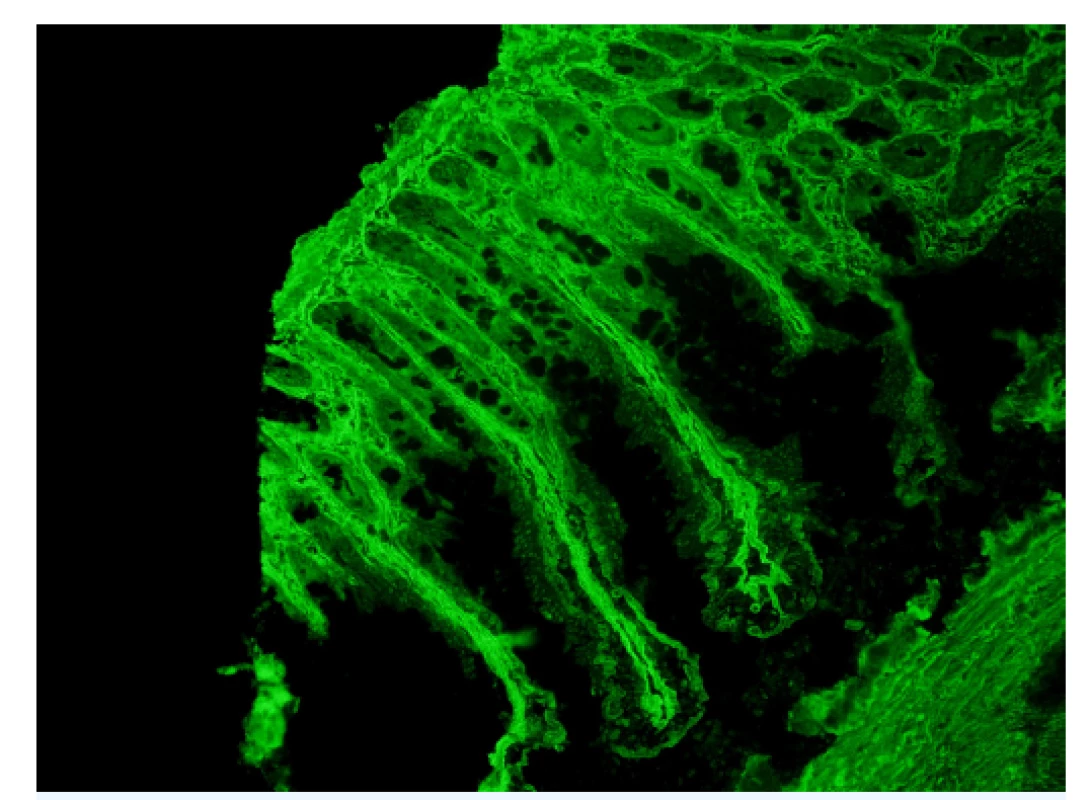
Nepřímá imunofluorescence. Substrát: opičí střevo (Střevo /opice/ IgA, Euroimmun, SRN). Zvětšení: 200×. Mikroskop: Olympus BX 41. (Foto: RNDr. Zdeňka Vrajová, Pracoviště imunologie, Nemocnice České Budějovice) PROTIJADERNÉ PROTILÁTKY
Označení antinukleární protilátky (ANA – antinuclear antibodies) se používá pro různé druhy autoprotilátek namířených proti strukturám buněčného jádra (proti histonům, DNA, jadérkům, RNA atd.). Přítomnost ANA může být asociována s širokým spektrem systémových autoimunitních chorob (tab. 4). V nízkých titrech však ANA bývají detekovány i u zdravých jedinců, zejména ve vyšším věku.
Tab. 4. Procentuální zastoupení protijaderných protilátek u jednotlivých diagnóz (46) 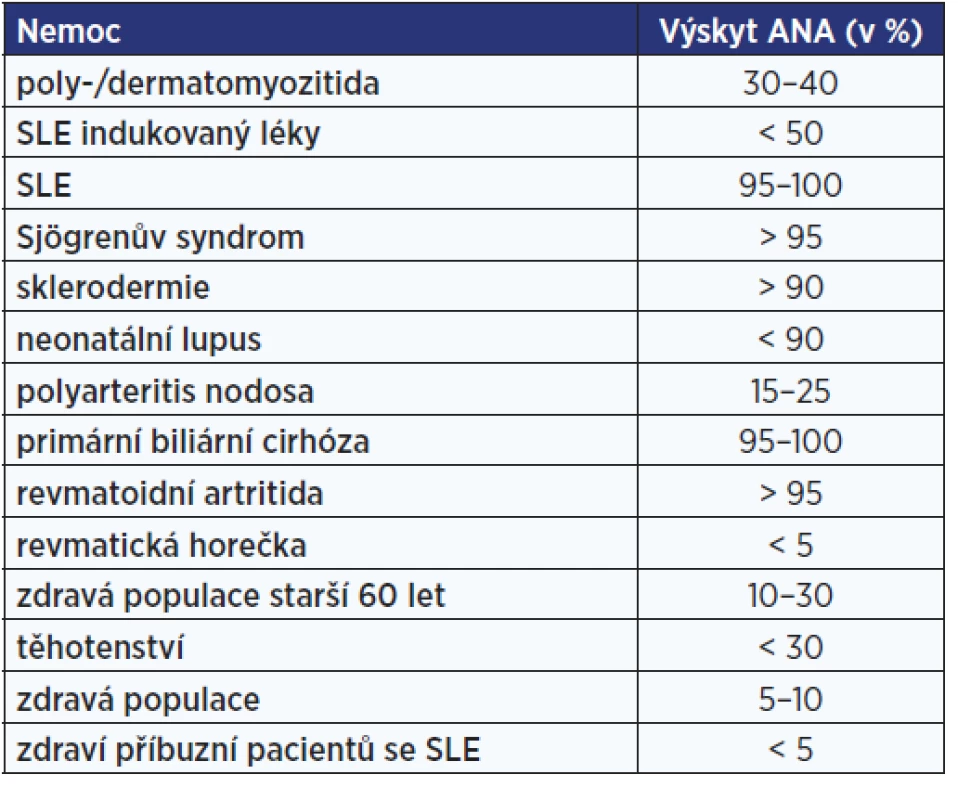
Nejrozšířenější metodou stanovení těchto protilátek je test nepřímé imunofluorescence, který využívá buněčnou linii Hep-2 (lidské epitelové buňky karcinomu laryngu). Hodnocení se provádí semikvantitativně, výsledek je vyjadřován posledním pozitivním titrem ředění (17). Rozlišujeme různé typy fluorescencí ANA: homogenní, zrnitý (jemně, hrubě), nukleolární, centromerový, jaderné tečky, různé cytoplasmatické typy (zrnitý, Golgiho aparát, cytoskeletální) a jiné (obr. 2).
Obr. 2. Protijaderné protilátky (ANA) homogenního typu 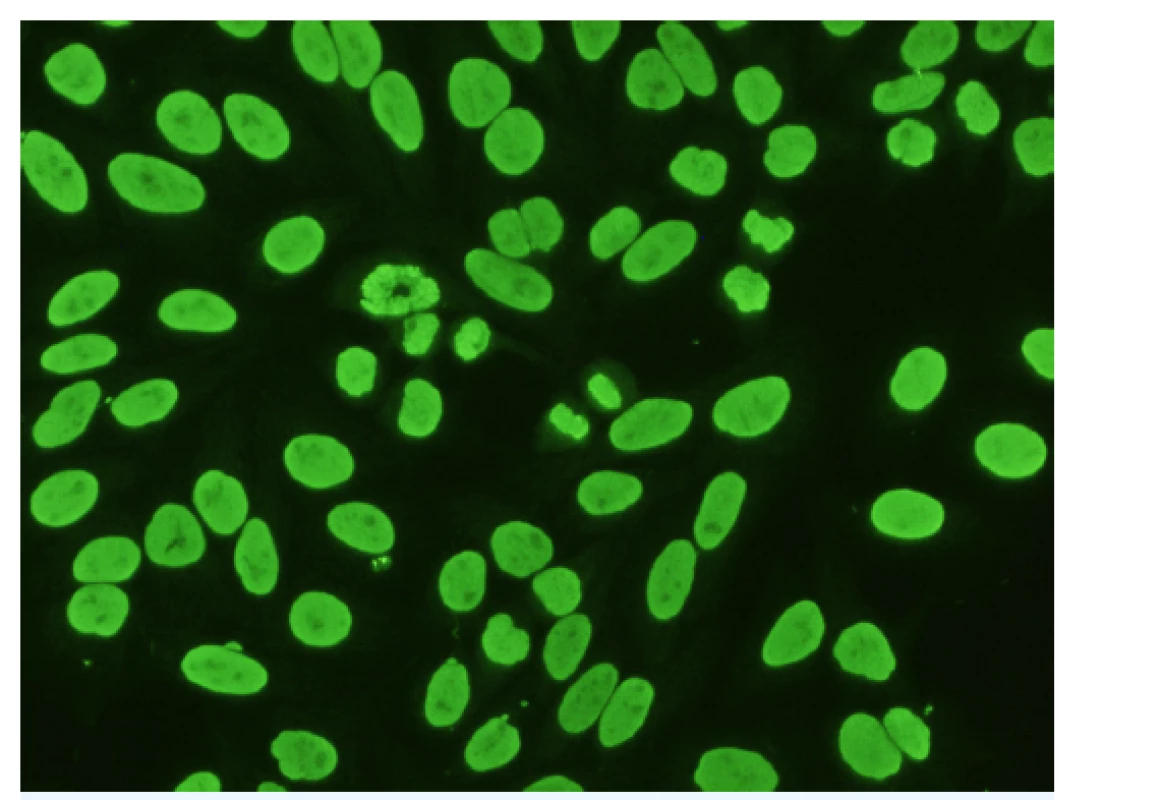
Nepřímá imunofluorescence. Substrát: Hep-2 buňky. Zvětšení: 400×. (Foto: archiv MUDr. Lenky Sedláčkové) Pozitivita vyšetření ANA sama o sobě není automaticky spojována s diagnózou autoimunitního onemocnění. Velmi důležité je určení konkrétního typu ANA, jelikož může směrovat lékaře k dalšímu cílenému dovyšetření pacienta. Výše titru antinukleárních protilátek obvykle neslouží k sledování aktivity daného onemocnění, na rozdíl například od sledování titru protilátek anti-dsDNA, které s aktivitou choroby zpravidla dobře korelují. Možný výskyt falešné pozitivity ANA u zdravých osob, resp. záchyt protijaderných protilátek ve velmi nízkých titrech, může být někdy matoucí a vždy je třeba vyšetření hodnotit v kontextu klinického stavu, věku a dalších diagnóz.
V reprodukční imunologii se nejčastěji setkáváme s nízkými titry ANA zrnitého typu u pacientek s autoimunitní tyreoiditidou. V ostatních pozitivních případech je obvykle nutné dovyšetřit protilátkovou specificitu, zejména zjistíme-li výskyt protilátek proti extrahovatelným nukleárním antigenům (anti-ENA) anti-SS-A, anti-SS-B. Jejich pozitivita je rizikovým faktorem v graviditě i při absenci klinické symptomatologie.
Přítomnost anti-ENA protilátek anti-Ro (anti-SS-A) je v graviditě vždy varovným signálem. Pojí se s rizikem vzniku neonatálního lupusu, resp. kompletního AV bloku plodu. Gravidní mají také zvýšené riziko abortů v prvním trimestru, jakož i komplikací v pozdějších fázích gravidity (preeklampsie, syndrom HELLP, IUGR). K ovlivnění autoimunitního procesu poškozujícího srdce plodu lze použít fluoridované kortikosteroidy. V běžné praxi se těhotné pří výskytu AV bloku 1. a 2. stupně podává perorální dexamethason v dávce 4 mg denně. Je-li léčba zahájena včas, může díky transplacentárnímu přenosu zabránit vzniku ireverzibilní AV blokády 3. stupně. Zejména od 20. týdne těhotenství jsou důležité časté pravidelné kontroly srdce plodu ultrazvukem. Terapie již vzniklých kompletních AV bloků 3. stupně bývá bohužel bez efektu a kardiostimulace plodu je prenatálně nemožná (18).
PROTILÁTKY PROTI TYREOPEROXIDÁZE, TYREOPATIE
Tyreoperoxidáza (TPO) je enzym mikrozomů tyreocytů, který se nachází na povrchu a v cytoplazmě apikálních buněk štítné žlázy. V součinnosti s tyreoglobulinem (TG) má esenciální funkci při jodaci L-tyrosinu a tvorbě mono-a dijodotyrosinu i při následné syntéze hormonů štítné žlázy (19). Protilátky proti tyreoperoxidáze (anti-TPO) jsou specifické autoprotilátky namířené proti tomuto enzymu. V klinické praxi se setkáváme i se starším označením protilátky proti mikrozomům štítné žlázy (anti-TM). Protilátky anti-TPO způsobují poškození buněk štítné žlázy aktivací komplementu a buněčnou cytotoxicitou závislou na protilátkách (20). Jejich hladina je zvýšená u více než 90 % pacientů s autoimunitní tyreoiditidou a u více než 70 % pacientů s Gravesovou-Basedowovou nemocí. Tyto autoprotilátky nacházíme i u zdravých jedinců s normální funkcí štítné žlázy (10‒15 %). Až 20 % seniorů vykazuje jejich pozitivitu při eutyreóze. Protilátky anti-TPO mohou indikovat přítomnost i jiného autoimunitního onemocnění, než je autoimunitní tyreoiditida, např. Addisonovy nemoci, diabetu mellitu 1. typu, vitiliga nebo systémového lupusu. Oproti tomu negativní výsledek anti-TPO protilátek nevylučuje přítomnost autoimunitního onemocnění štítné žlázy. Výše hladiny autoprotilátek nekoreluje s klinickou aktivitou onemocnění (21).
Onemocnění štítné žlázy je velmi častou endokrinní poruchou postihující ženy v reprodukčním věku. Subklinická hypotyreóza je charakterizována zvýšenou koncentrací hormonu stimulujícího štítnou žlázu (TSH – thyroid-stimulating hormone) s normální koncentrací volného tyroxinu (fT4). Pro autoimunitní onemocnění štítné žlázy je typická přítomnost autoprotilátek štítné žlázy a lymfocytární infiltrace detekovatelná sonograficky, a to bez ohledu na koncentraci hormonů štítné žlázy.
Jakákoli dysfunkce štítné žlázy snižuje pravděpodobnost těhotenství a může nepříznivě ovlivnit i jeho úspěšnost. Zvýšené hladiny protilátek anti-TPO jsou pozorovány u téměř 10 % všech těhotných. Tyto pacientky mají po porodu zvýšené riziko rozvoje dočasné nebo trvalé hypotyreózy.
U neplodných žen trpících syndromem polycystických vaječníků (PCOS – polycystic ovary syndrome) je elevace protilátek anti-TPO signifikantně častější, jedná-li se o pacientky rezistentní vůči klomifencitrátu. Zvýšené hladiny protilátek anti-TPO tedy mohou u žen s PCOS do jisté míry predikovat odpovídavost na tuto terapii (22). Pacientky s autoimunitní tyreoiditidou mají také vyšší riziko předčasného ovariálního selhání, plodný věk je u těchto žen kratší. Velká metaanalýza dat ze studií, jež proběhly v letech 1990‒2015, zkoumající vliv autoimunitního zánětu štítné žlázy na výsledek IVF, prokázala, že autoimunitní tyreoiditida nemá vliv na výtěžnost oocytů ani na míru implantace embrya (23). Přítomnost autoprotilátek proti štítné žláze však může mít nepříznivý vliv na průběh těhotenství ve všech třech trimestrech – zvyšuje riziko potratu a preeklampsie a snižuje pravděpodobnost porodu živého plodu (24).
Screening protilátek anti-TPO v těhotenství může pomoci při včasné identifikaci rizikových žen. Je vhodný u těhotných s diabetem 1. typu. Pozitivita protilátek anti-TPO je indikací ke sledování jak v těhotenství, tak i po porodu, a to z důvodu rizik rozvoje hypotyreózy či poporodního zánětu štítné žlázy. Doporučovaná cílová hodnota TSH před graviditou je < 2,5 mIU/l, v graviditě je u žen s hypotyreózou upravována na hodnoty doporučené pro příslušnou metodu a trimestr (25).
PROTILÁTKY PROTI SPERMIÍM
Příklad aloantigenní stimulace vedoucí k neplodnosti představují protilátky proti spermiím (ASA – anti-sperm antibodies). ASA mohou být důvodem nemožnosti přirozeného početí a snižují šanci na úspěch intrauterinní inseminace. Za fyziologických okolností je ejakulát vybaven četnými mechanismy, kterými je spermie jako cizorodá buňka chráněna před vlivem imunitního systému ženy. Patří k nim mj. proteiny seminální plazmy s protimikrobiálním účinkem, „maskování“ povrchových spermatických antigenů složkami glykokalyxu nebo ochranný vliv beta-defenzinů před vazbou spermie na Ig a receptory makrofágů. K prolomení této ochranné bariéry dochází při patologiích ejakulátu (infekci), jakož i v důsledku zánětlivých změn na sliznici reprodukčního ústrojí ženy (26).
Cílovými antigeny ASA jsou akrosomové proteiny, antigeny hlavičky, krčku, bičíku. ASA mohou negativně ovlivňovat pohyb spermií, mohou způsobit jejich shlukování (aglutinaci). Jiné typy ASA mohou reagovat s receptory na akrozomu, čímž negativně ovlivňují kapacitaci spermie, indukují předčasnou akrosomovou reakci, a alterují tak schopnost spermie prostupovat přes zona pellucida (27).
Sérové ASA jsou stanovovány nejčastěji metodou nepřímé imunofluorescence, substrátem je nátěr lidských spermií (obr. 3). Alternativní metody představují enzymová imunoanalýza, IBT (immunobead test), nepřímý test MAR (mixed antiglobuline reaction) a průtoková cytometrie. Přítomnost ASA v ovulačním hlenu lze prokázat Kremerovým testem nebo testem MAR.
Obr. 3. Protilátky proti spermiím 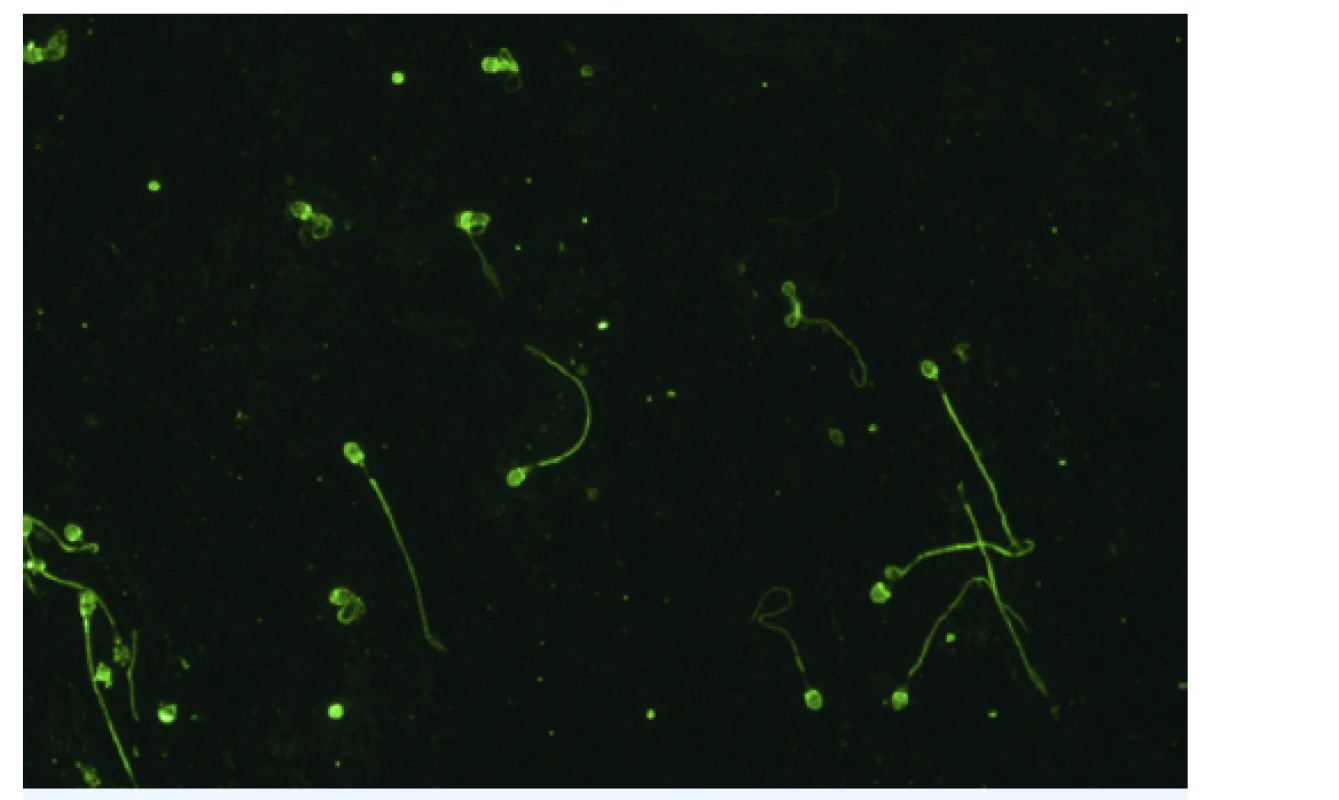
Nepřímá imunofluorescence. Substrát: nátěr lidských spermií (The Infertility Mosaic-7, Euroimmun, SRN). Zvětšení: 400×. Mikroskop: EUROStar III plus. (Foto: Ing. Štěpánka Luxová, Imunologická laboratoř, GENNET, s. r. o., Praha) Je-li příčina indukce tvorby ASA u ženy daná kvalitou spermií jejího partnera, je potřeba primárně léčit muže. Není-li možné zlepšit kvalitu spermií (například v případě těžké oligoteratoastenozoospermie), nemá smysl ovlivňovat imunitní odpověď ženy a namístě je použít některou z technik asistované reprodukce. Pokud je příčinou indukce ASA změna imunitního mikroprostředí na ženském genitálu, může být přínosem imunomodulační dávka kortikosteroidu, avšak za podmínky důsledné sanace jakéhokoliv infekčního gynekologického zánětu. Je-li z jakéhokoli důvodu indikována léčba páru metodou fertilizace in vitro, obvykle ztrácí přítomnost ASA na klinickém významu a kortikoterapie u ženy není indikována.
PORUCHY KOMPLEMENTOVÉHO SYSTÉMU
Komplement tvoří soustava několika desítek membránových a sérových proteinů, které jsou schopny lyzovat buňky. Tento rozsáhlý soubor bílkovin navzájem interaguje v kaskádovém sledu, přičemž k aktivaci může dojít v zásadě třemi způsoby. Jedna z drah aktivace komplementu je nazývána lektinovou, protože je aktivována proteinem přítomným v plazmě, který se s vysokou afinitou váže na polysacharidy (lektiny) stěn bakterií, kvasinek a plísní. Ústředním proteinem v lektinové dráze aktivace komplementu je lektin vázající manózu (MBL – mannan-binding lectin).
Deficit MBL je velmi častou komplementopatií. V české populaci je deficience MBL nalézána u 24,8 % jedinců a úplný deficit byl zjištěn u 11,4 % osob (28). Obvykle je zcela asymptomatický. Deficience až deficit MBL však může být sdružen s těhotenskými komplikacemi. Je dáván do souvislosti s funkčními poruchami placenty typu placentární insuficience vedoucí k intrauterinní růstové retardaci plodu. Deficit MBL je častější u žen s opakovanými časnými potraty a u žen s komplikacemi pokročilé gravidity typu preeklampsie, chorioamnionitidy nebo syndromu HELLP (29). Nelze dát rovnítko mezi těhotenské komplikace a poruchu lektinové dráhy aktivace komplementu. Komplementopatie se na těhotenských komplikacích podílí v kombinacích s dalšími faktory, významnou roli hraje konkrétní individuální uterinní mikrobiom a mykobiom.
Vyšetření komplementu je indikováno u pacientek s anamnézou opakovaných těhotenských ztrát, pro které není jiné vysvětlení, a u žen s komplikacemi pokročilé gravidity spojenými se zánětlivými stavy typu chorioamnionitidy nebo funisitidy. Pro vyšetření lektinové dráhy aktivace komplementu lze použít jak stanovení koncentrace MBL v séru, tak i komplexní funkční vyšetření aktivace lektinové dráhy enzymovou imunoanalýzou.
Kauzální terapie deficitu MBL není dostupná. Zvýšenou náchylnost k infekcím lze u rizikových těhotných s deficitem MBL léčebně ovlivňovat polyspecifickými Ig aplikovanými nitrosvalově, podkožně nebo nitrožilně. Protektivní efekt imunoglobulinů je dán pasivní imunizací antiinfekčními IgG od zdravých dárců, které opsonizují mikroby, podporují fagocytózu anebo likvidují infekční agens mechanismy cytotoxicity závislé na protilátkách. Imunomodulační účinek vaginálně podávaného progesteronu u rizikových těhotných s deficitem MBL spočívá v přímém pozitivním vlivu progesteronu na lokální syntézu MBL buňkami epitelu sliznic genitálu, a v modulaci in situ cytokinové odpovědi směrem k TH2 fenotypu, čímž se nepřímo snižují rizika, která vyplývají z aberantního fungování lektinové dráhy aktivace komplementu (30). Off-label možností léčby je podávání nízkomolekulárních heparinů a využití jejich protizánětlivých a imunomodulačních vlastností, včetně interakce se složkami komplementových kaskád (31).
PORUCHY BUNĚČNÉ SLOŽKY IMUNITNÍHO SYSTÉMU
Rozhodující imunologickou zbraní v boji proti buněčným strukturám, a tedy i proti spermiím a embryonálním buňkám, je celulární imunita. Její ústřední součást tvoří lymfocyty různých imunofenotypů a jimi produkované cytokiny, enzymy a další solubilní a membránové molekuly.
IMUNOFENOTYPIZACE LYMFOCYTŮ PERIFERNÍ KRVE
Imunofenotypizace lymfocytů periferní krve se provádí průtokovou cytometrií, metodou, jež umožňuje velmi rychlou analýzu mnoha set tisíc buněk a zároveň detekci více znaků najednou. Základní buněčnou populaci specifické imunity představují T a B lymfocyty, které jsou zodpovědné za antigenně specifické imunitní reakce. V reprodukční imunologii se věnuje zvýšená pozornost především NK a NKT buňkám.
Hlavním fyziologickým úkolem NK buněk je cytotoxicita zajišťovaná perforiny a granzymy, jakož i produkce cytokinů a chemokinů, které ovlivňují imunitní reakci. Tato buněčná populace je definována sadou diferenciačních antigenů, přičemž k nejdůležitějším patří molekuly CD16 (Fc receptor pro IgG) a CD56 (adhezní molekula). NKT buňky jsou zvláštní skupina lymfocytů, které exprimují současně jak T-buněčný receptor (TCR), tak receptor NK 1.1, který je typický pro NK lymfocyty (32). Subpopulace NK buněk za fyziologických okolností představuje asi 5–15 % z celkového počtu přítomných lymfocytů, zastoupení NKT buněk by nemělo převyšovat 10 %.
Účast NK buněk na reprodukčním selhání je jednou z nejkontroverznějších oblastí reprodukční imunologie. NK buňky představují první kontakt v buněčné imunitní odpovědi, hrají důležitou roli v protinádorové a protivirové imunitě a v procesu implantace embrya jsou právě ony v těsném kontaktu s choriových klky v intervilózních prostorech. Je proto možné, že zvýšení jejich počtu a aktivity může být příčinou neúspěšného těhotenství. Navzdory opakovaným diskusím o významu vyšetření periferních NK buněk při diagnostice neplodnosti několik studií potvrdilo, že zvýšené počty NK a NKT buněk jsou asociovány s reprodukčním selháním a habituálním potrácením. NK buňky v periferní krvi sice nevykazují fluktuaci během menstruačního cyklu, avšak během těhotenství jejich množství i aktivita klesají. U žen s opakovanými potraty bylo zjištěno vyšší zastoupení NK buněk a vyšší cytotoxicita v době transferu a implantace embrya (33, 34).
Důležitou roli v nastavení a udržení imunologické tolerance hrají regulační T lymfocyty (Treg), které jsou fenotypově charakterizovány mj. přítomností znaků CD4, FoxP3, CD25 a zároveň nízkou expresí molekuly CD127. Základní funkcí Treg je regulace imunitních reakcí: potlačují aktivaci, proliferaci a efektorovou funkci většiny imunitních buněk, inhibují produkci cytokinů pomocných i cytotoxických typů lymfocytů, koordinují produkci protilátek a jejich izotopový přesmyk, inhibují cytotoxické vlastnosti NK buněk a maturaci a diferenciaci makrofágů a dendritických buněk. Hrají tak důležitou roli v udržení fetomaternální tolerance. Nedostatek nebo dysfunkce Treg jsou sdruženy s těhotenskými komplikacemi – preeklampsií, opakovaným potrácením nebo předčasnými porody (35, 36).
UTERINNÍ NK BUŇKY
Uterinní NK buňky (uNK) jsou přítomny ve vysokém počtu v decidui. Jejich počet se během menstruačního cyklu výrazně mění a maxima dosahuje v rané fázi těhotenství. Za fyziologických podmínek je jejich hlavní biologickou funkcí produkce angiogenních faktorů a cytokinů, které hrají důležitou roli v implantaci embrya, remodelaci spirálních arterií a invazi trofoblastu (37). Dojde-li k navození prozánětlivé (TH1) imunitní odpovědi, mění se uNK v cytotoxické buňky, které jsou schopné např. způsobit destrukci trofoblastu, a tím se podílet na abortu.
Kompletní fenotyp uNK není dosud řádně popsán. Podle exprese povrchových znaků lze odlišit dva základní fenotypy. Většinovou subpopulaci (> 80 %) tvoří NK buňky s vysokou expresí molekuly CD56 a nízkou nebo žádnou expresí znaku CD16 (CD3-CD56brightCD16-CD45+/uNKbright) (38). Pro tyto NK buňky jsou typické snížená cytotoxická aktivita, zvýšená exprese řady povrchových proteinů a výrazná produkce cytokinů a angiogenních faktorů. Minoritní populaci (< 20 %) tvoří NK buňky exprimující na svém povrchu slabě molekulu CD56 a silně aktivační nízkoafinitní receptor pro Fc fragment IgG, molekulu CD16 (CD3-CD56dimCD16+CD45+/uNKdim). Tato populace vykazuje značnou cytotoxickou aktivitu (39).
Stanovení uNK se standardně provádí z bioptického vzorku endometria (39). Druhou možností je detekce uNK ve výplachu děložní dutiny (40). Analýzu lze provést imunohistochemicky (ve tkáni) nebo průtokovou cytometrií (v obou materiálech). Výhodou průtokové cytometrie je objektivní hodnocení velkého množství buněk a možnost využití víceparametrové analýzy, včetně rozlišení slabě a silně exprimovaných znaků. Nevýhodou je problematická kvantifikace počtu buněk. Vzhledem k významné variabilitě zastoupení NK buněk během menstruačního cyklu je nezbytné správné načasování odběru. Obvykle se provádí v době implantačního okna, tj. 21.‒23. den menstruačního cyklu, nebo při hormonální stimulaci 6. den užívání progesteronu. Pro stanovení uNK neexistuje standardizovaný postup ani referenční rozmezí. Je nezbytné, aby každá laboratoř při zavádění metody provedla validaci metody včetně stanovení vlastního referenčního rozmezí.
FUNKČNÍ TESTY LYMFOCYTŮ
Hlavním mechanismem odpovědným za nastavení a udržení antigenně specifické tolerance je imunitní odpověď zprostředkovaná T lymfocyty, kterou zajišťují různé subpopulace pomocných T lymfocytů. U těhotných žen fyziologicky převažuje tzv. TH2 imunitní reakce nad TH1 imunitní odpovědí (41). Progesteron stimuluje sekreci TH2 cytokinů a tlumí sekreci TH1 cytokinů.
Ženy s opakovanými potraty nebo opakovaným selháním implantace se mohou vyznačovat převažující TH1 buněčnou imunitní odpovědí. V jejich periferní krvi je zvýšený poměr TH1/TH2 cytokinového mikroprostředí v porovnání se zdravými kontrolami. U potrácejících žen bylo zjištěno v děloze vysoké množství cytokinu IL-17. Zvýšené zastoupení TH17 buněk je popisováno i v periferní krvi a děloze žen s nejasnými opakovanými ztrátami těhotenství oproti zdravým těhotným (42).
Pro identifikaci funkčních vlastností jednotlivých subpopulací pomocných T lymfocytů lze použít stanovení intracelulárních cytokinů po nespecifické stimulaci (kombinací forbol 12-myristát 13-acetátu a ionomycinu) nebo po specifické stimulaci (buňkami trofoblastu nebo spermiemi). Plná krev odebraná do zkumavek s heparinem sodným je naředěna kultivačním médiem a po přidání stimulačního činidla a inhibitoru transportu proteinů je inkubována při 37 °C v prostředí 5% CO2. Délka inkubace se odvíjí od použitého stimulantu – při polyklonální stimulaci postačí 3‒4 hodiny, při stimulaci spermiemi nebo trofoblastem je nutné prodloužit inkubaci na 18‒24 hodin. Po inkubaci jsou buňky zafixovány, permeabilizovány a pomocí monoklonálních protilátek jsou označeny povrchové antigeny (CD3, CD4) a intracelulární cytokiny (IFN-γ, TNF-α, IL-4, IL-10, IL-17) (43). Akvizice a vyhodnocení naměřených dat je provedeno na průtokovém cytometru.
Ke stanovení funkční aktivity NK buněk lze využít cytotoxický nebo aktivační test, případně lze sledovat produkci cytokinů nebo expresi povrchových znaků. Principem cytotoxického testu je sledování počtu terčových buněk, které jsou usmrceny NK lymfocyty. Tento test je však poměrně náročný a nákladný, proto se rutinně neprovádí. Mnohem jednodušší, a také v našich podmínkách rozšířenější, je cytometrické stanovení aktivace NK buněk (44). Test je založen na detekci aktivačního antigenu CD69 na povrchu NK lymfocytů, resp. NKT buněk, která následuje po 24–48hodinové kultivaci vzorku periferní krve in vitro s různými stimulanty (mitogeny, trofoblast, spermie atd.). Po inkubaci je stanovena exprese znaku CD69 a míra jeho exprese porovnána s hodnotou zjištěnou u vzorku inkubovaného za stejných podmínek, ale bez přítomnosti stimulačního činidla (tedy u negativní kontroly).
Pokud jsou výše popsanými metodami nalezeny významné odchylky parametrů buněčné imunity od normálu a pacientka má příslušné klinické problémy, může jít o indikaci k léčebné imunointervenci. Přehled dostupných imunomodulátorů a mechanismů jejich účinku shrnuje tab. 5.
Tab. 5. Imunomodulační terapie buněčných imunopatologií vedoucích k poruše plodnosti (47) 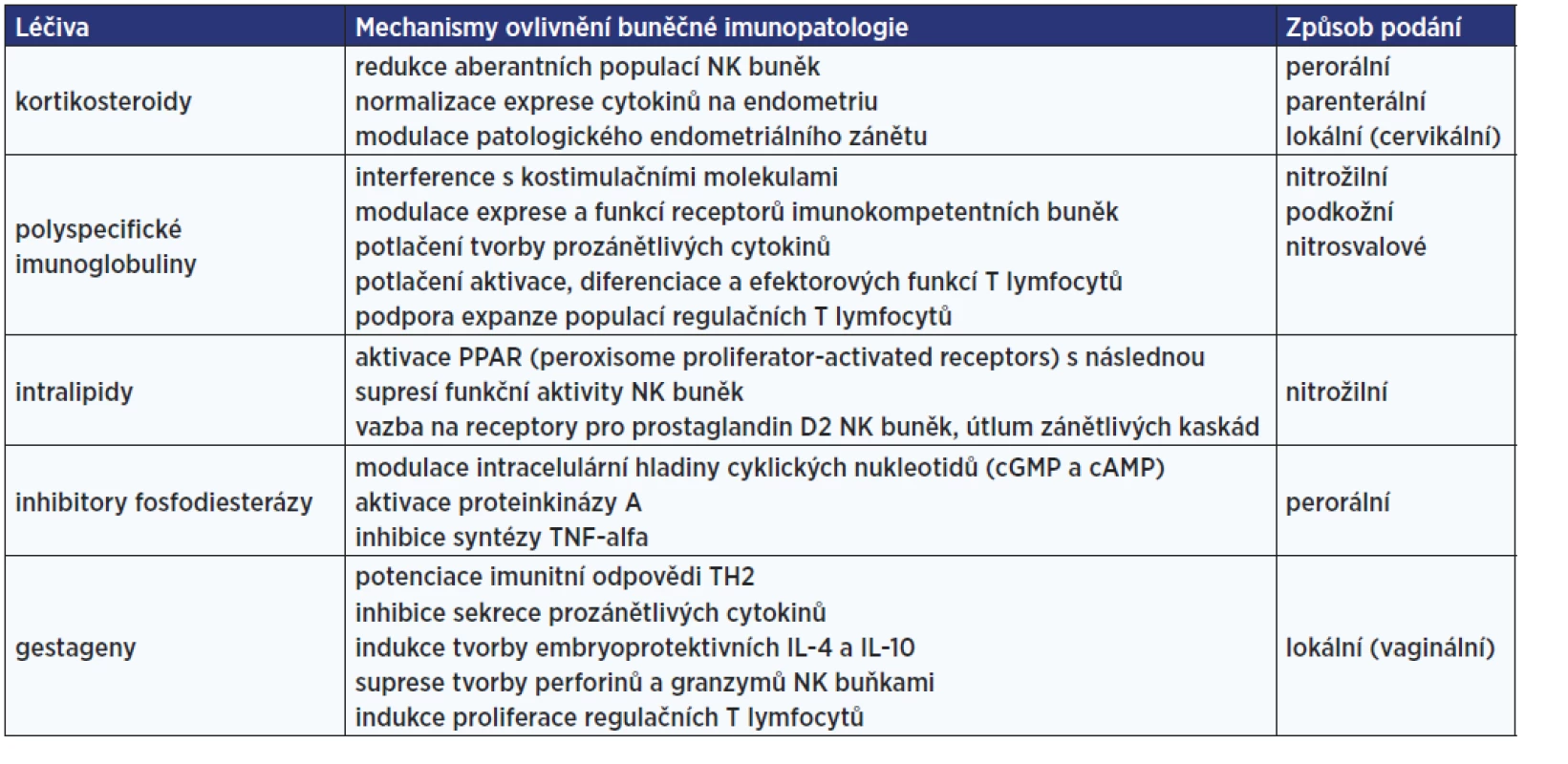
ZÁVĚR
Reprodukční imunologie je relativně mladý obor, který se nachází na hranici reprodukční medicíny a klinické imunologie. V posledním desetiletí značně pokročil náhled na účast imunitního systému v procesech oplození, implantace embrya, vzniku a udržení těhotenství. V klinické praxi jsme schopni do určité míry identifikovat nesprávné funkce složek nespecifické i specifické humorální i buněčné imunity, které ve svém důsledku mohou negativně ovlivnit schopnost početí a donošení dítěte. Takové imunopatologie pak lze terapeuticky ovlivňovat různými léčivými přípravky s imunomodulačními účinky.
V každém jednotlivém případě však musí být rozhodnutí o léčebné imunointervenci v souvislosti s léčbou technikami asistované reprodukce a/nebo v těhotenství učiněno individuálně, na základě pečlivého zvážení anamnézy, fyzikálního vyšetření a posouzení výsledků pomocných laboratorních vyšetření, po konzultaci s pacientkou a s přihlédnutím k aktuálně platným pravidlům preskripce. Rutinní zařazování imunomodulátorů do protokolů léčby metodou IVF u žen bez průkazu poruchy imunity nemá opodstatnění. Rovněž tak se neléčí laboratorní nálezy, ale vždy pacientky.
Čestné prohlášení
Autoři prohlašují, že v souvislosti s tématem, vznikem a publikací tohoto článku nejsou ve střetu zájmů a vznik ani publikace článku nebyly podpořeny žádnou farmaceutickou firmou. Práce nebyla publikována v jiném periodiku.
Seznam zkratek
ANA protijaderné protilátky (anti-nuclear antibodies)
AOA protilátky proti ovariím (anti-ovarian antibodies)
APLA protilátky proti fosfolipidům (anti-phospholipid antibodies)
APS antifosfolipidový syndrom (anti-phospholipid syndrome)
ASA protilátky proti spermiím (anti-sperm antibodies)
ATPO protilátky proti tyreoperoxidáze (anti-thyroid-peroxidase antibodies)
ATTA protilátky proti tkáňové transglutamináze (anti-tissue transglutaminase antibodies)
AZP protilátky proti zona pellucida (anti-zona pellucida)
CD diferenciační skupina membránových buněčných antigenů (cluster of differentiation)
ELISA enzymová imunoanalýza (enzyme-linked immunosorbent assay)
EMA protilátky proti endomyziu (endomysial antibodies)
HLA lidský hlavní histokompatibilní systém (human leukocyte antigen)
IL interleukin IVF in vitro fertilizace MAR smíšená antiglobulinová reakce (mixed antiglobuline reaction)
MBL lektin vázající manózu (mannose-binding lectin)
NK přirození zabíječi (natural killers)
PCOS syndrom polycystických vaječníků (polycystic ovary syndrome)
syndrom HELLP
syndrom preeklampsie komplikovaný hemolýzou, patologickými jaterními testy a trombocytopenií (hemolysis/elevated liver enzymes/low platelet syndrome)
Treg regulační T lymfocyty
TSH tyreotropin (thyroid-stimulating hormone)
uNK uterinní NK buňky
ADRESA PRO KORESPONDENCI:
MUDr. Lenka Sedláčková
Oddělení alergologie a klinické imunologie,
GENNET, s. r. o.
Na Poříčí 26, 110 00 Praha 1
Tel.: 226 226 205
e-mail: lenka.sedlackova@gennet.cz
Zdroje
1. Řežábek K, Pohlová R. Asistovaná reprodukce v České republice 2017. Ústav zdravotnických informací a statistiky ČR. Dostupné na: www.uzis.cz/ res/f/008274/asistreprodukce2017.pdf
2. Madar J, Ulčová-Gallová Z a kol. Imunologie a imunopatologie lidské reprodukce. Vybrané kapitoly. Mladá fronta, Praha, 2016 : 113.
3. Hasegawa A, Tanaka H, Shibahara H. Infertility and Immunocontraception based on zona pellucida. Reprod Med Biol 2013; 13(1): 1-9.
4. Pires ES. Multiplicity of molecular and cellular targets in human ovarian autoimmunity: an update. J Assist Reprod Genet 2010; 27 : 519-524.
5. Gleicher N, Kushnir VA, Barad DH. Prospectively assessing risk for premature ovarian senescence in young females: a new paradigm. Reprod Biol Endocrinol 2015; 13 : 34.
6. Sharif K, Watad A, Bridgewood C et al. Insights into the autoimmune aspect of premature ovarian insufficiency. Insights into the autoimmune aspect of premature ovarian insufficiency. Best Pract Res Clin Endocrinol Metab 2019; 33(6): 101323.
7. van Weissenbruch MM, Hoek A, van Vliet-Bleeker I et al. Evidence for existence of immunoglobulins that block ovarian granulosa cell growth in vitro. A putative role in resistant ovary syndrome? J Clin Endocrinol Metab 1991; 73 : 360-367.
8. Buliková A, Zavřelová J, Penka M. Antifosfolipidový syndrom v roce 2009. Vnitřní lékařství 2009; 55 : 253–262.
9. Ulčová-Gallová Z. Antiphospholipid antibodies and reproductive failure. Chem Immunol Allergy 2005; 88 : 139-149.
10. Bulíková A, Smejkal P, Kissová J a kol. Profylaxe a léčba antifosfolipidového syndromu – současné možnosti, úskalí a perspektivy do budoucna. Vnitřní lékařství 2012; 58 : 110-122.
11. Dobrowolski C, Erkan D. Treatment of antiphospholipid syndrome beyond anticoagulation. Clin Immunol 2019; 206 : 53-62.
12. Krejsek J, Andrýs C, Krčmová I. Imunologie člověka. Garamon, Hradec Králové, 2016 : 274-276.
13. Eliakim R, Sherer DM. Celiac disease: fertility and pregnancy. Gynecol Obstet Invest 2001; 51 : 3-7.
14. Frič P, Keil R. Celiakie pro praxi. Medicína pro praxi 2011; 8(9): 354-359.
15. Di Simone N, Silano M, Castellani R et al. Anti-tissue transglutaminase antibodies from celiac patients are responsible for trophoblast damage via apoptosis in vitro. Am J Gastroenterol 2010; 105 : 2254-2261.
16. Lukáš K, Hroch J. Nemoci střev. Grada, Praha, 2018, 128-130.
17. Lochman I, Martinek J. Titrace autoprotilátek detekovaných metodami nepřímé imunofluorescence (IIFA). Alergie 2010; (4): 294-296.
18. Tomek V, Gilík J, Kovanda J a kol. Prenatální diagnostika kardiálního postižení u lupus neonatorum. Česká revmatologie 2019, 27(3): 136-141
19. Marek J, Hána V a kol. Endokrinologie. Galén, Praha, 2017 : 201-220.
20. Zhu, L. Wu, B. Xu G et al. A retrospective study on IVF/ICSI outcome in patients with anti-nuclear antibodies: the effects of prednisone plus low-dose aspirin adjuvant treatment. Reprod Biol Endocrinol 2013; 11 : 98.
21. Lukeš J, Koranda P. Laboratorní diagnostika onemocnění štítné žlázy. Interní medicína pro praxi. 2001; 3 : 120-123.
22. Vrbíková J. Syndrom polycystických ovarií. Vnitřní lékařství 2015; 61(10): 886-895.
23. Busnelli A, Paffoni A, Fedele L et al. The impact of thyroid autoimmunity on IVF/ICSI outcome: a systematic review and meta-analysis. Hum Reprod Update. 2016; 22(6): 775-790.
24. Springer D, Límanová Z, Zima T, Calda P. Vyšetření funkce štítné žlázy v těhotenství – naše výsledky. Aktuální gynekologie a porodnictví 2009; 1 : 50-54.
25. Límanová Z, Jiskra J, Springer D a kol. Doporučení pro diagnostiku a léčbu onemocnění štítné žlázy v těhotenství a pro ženy s poruchou fertility. Praktická gynekologie 2013; 17(2): 173-199.
26. Řezáčová J et al. Reprodukční medicína. Mladá fronta, Praha, 2018 : 497-498.
27. Barbonetti A, Castellini C, D'Andrea S et al. Prevalence of anti-sperm antibodies and relationship of degree of sperm auto-immunization to semen parameters and post-coital test outcome: a retrospective analysis of over 10 000 men. Hum Reprod 2019; 34(5): 834-841.
28. Skalníková H, Freiberger T, Chumchalová J et al. Cost-effective genotyping of human MBL2 gene mutations using multiplex PCR. J Immunol Methods 2004; 295(1-2): 139-147.
29. Koucký M, Malíčková K, Kopřivová H et al. Low maternal serum concentrations of mannose-binding lectin are associated with the risk of shorter duration of pregnancy and lower birthweight. Scand J Immunol 2018; 88(1): e12675.
30. Pařízek A, Koucký M, Dušková M. Progesterone, inflammation and preterm labor. J Steroid Biochem Mol Biol 2014; 139 : 159-165.
31. Oberkersch R, Attorresi AI, Calabrese GC. Low-molecular-weight heparin inhibition in classical complement activation pathway during pregnancy. Thromb Res 2010; 125(5): e240-e245.
32. Buc M. NK - a NKT-bunky – ich charakteristika, biologický a medicínsky význam. MEFANET LF UK v Bratislave, 2013. Dostupné na: portal.fmed.uniba. sk/clanky.php?aid=223
33. Ebina Y, Nishino Y, Deguchi M et al. Natural killer cell activity in women with recurrent miscarriage: Etiology and pregnancy outcome. J Reprod Immunol 2017; 120 : 42-47.
34. Karami N, Boroujerdnia MG, Nikbakht R et al. Enhancement of peripheral blood CD56(dim) cell and NK cell cytotoxicity in women with recurrent spontaneous abortion or in vitro fertilization failure. J Reprod Immunol 2012; 95(1-2): 87-92.
35. Malíčková K, Koucký M, Vráblíková H. T-lymfocyty ve fyziologické a patologické graviditě. Alergie 2014; 2 : 115-121.
36. Saito S, Tomoko S, Kumiko I et al. Which types of regulatory T cells play important roles in implantation and pregnancy maintenance. Am J Reprod Immunol 2013; 69(4): 340-345.
37. Faas MM, de Vos P. Uterine NK cells and macrophages in pregnancy. Placenta 2017; 56 : 44-52.
38. Kofod L, Lindhard A, Hviid TVF. Implications of uterine NK cells and regulatory T cells in the endometrium of infertile women. Hum Immunol 2018; 79(9): 693-701.
39. Ulčová-Gallová Z, Pešek M, Chaloupka P et al. Screeningové vyšetření endometriálních NK buněk u vybraných infertilních pacientek 1. část – metodika a průběžné výsledky. Česká gynekologie 2017; 82(5): 366-371.
40. Hannan NJ, Nie G, Rainzcuk A et al. Uterine lavage or aspirate: which view of the intrauterine environment? Reprod Sci 2012; 19(10): 1125-1132.
41. Arora R, Rathee A, Sachdeva M et al. Unexplained repeated pregnancy loss and T helper cells. Eur J Obstet Gynecol Reprod Biol 2020; 254 : 277-283.
42. Wang W, Sung N, Gilman-Sachs A et al. T helper (Th) cell profiles in pregnancy and recurrent pregnancy losses: Th1/Th2/Th9/Th17/Th22/Tfh cells. Front Immunol 2020; 11 : 2025.
43. Horká P, Jarošová R, Malíčková K et al. Intracellular cytokine production in peripheral blood lymphocytes: a comparison of values in infertile and fertile women. Am J Reprod Immunol 2011; 65(5): 466-469.
44. Instruction NKFlowEx Kit, REF ED7078. Exbio Diagnostics. Dostupné na: www.exbio.cz/clinical-products/reproductive-immunology/kits/nkflowex-kit
45. Miyakis S, Lockshin MD, Atsumi T et al. International consensus statement on an update of the classification criteria for definite antiphospholipid syndrome (APS). J Thromb Haemost 2006; 4(2): 295-306.
46. Bradwell AR, Hughes RG, Karim AR. Immunofluorescent antinuclear antibody tests. In: Manual of Clinical Laboratory Immunology (7th ed.). ASM Press, 2006.
47. Řezáčová J a kol. Reprodukční medicína. Mladá fronta, Praha, 2018 : 505-522.
Štítky
Adiktológia Alergológia a imunológia Angiológia Audiológia a foniatria Biochémia Dermatológia Detská gastroenterológia Detská chirurgia Detská kardiológia Detská neurológia Detská otorinolaryngológia Detská psychiatria Detská reumatológia Diabetológia Farmácia Chirurgia cievna Algeziológia Dentální hygienistka
Článek ÚVODEMČlánek Lékařský dům 1931–2021
Článok vyšiel v časopiseČasopis lékařů českých
Najčítanejšie tento týždeň
2021 Číslo 1- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Kombinace metamizol/paracetamol v léčbě pooperační bolesti u zákroků v rámci jednodenní chirurgie
- Subkutánne vs. intravenózne imunoglobulíny u pacientov s CLL
- Facilitovaná subkutánna imunoglobulínová terapia u seniorov s imunodeficienciami v reálnej praxi
-
Všetky články tohto čísla
- ÚVODEM
- Imunologie – inspirativní přítelkyně materno-fetální medicíny
- Současné možnosti diagnostiky a léčby imunologických příčin ženské neplodnosti
- Péče o těhotnou ženu s opakovanými těhotenskými ztrátami a prokázaným imunodeficitem z pohledu porodníka
- Diagnostika neplodnosti mužů v 21. století – tradiční pojetí, či moderní přístup?
- Vyšetření NK a NKT buněk v diagnostice a léčbě imunologických příčin ženské neplodnosti – retrospektivní analýza dat terciárního klinického centra
- COVID-19 a imunomodulační léčba u žen s reprodukčním selháním
- Konspirační teorie jako přirozená součást pandemií
-
Proměny času, proměny zdraví
100 let české populace z pohledu klinika, patologa a reprezentantů medicínských specializací -
Lékařský dům
1931–2021 -
Vzpomínka na profesora
Přemysla Strejce - Zesnul profesor Jan Evangelista Dyr
- PŘEDNÁŠKOVÉ VEČERY SPOLKU ČESKÝCH LÉKAŘŮ V PRAZE (DUBEN – ČERVEN 2021)
- Časopis lékařů českých
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Vyšetření NK a NKT buněk v diagnostice a léčbě imunologických příčin ženské neplodnosti – retrospektivní analýza dat terciárního klinického centra
- Současné možnosti diagnostiky a léčby imunologických příčin ženské neplodnosti
- Diagnostika neplodnosti mužů v 21. století – tradiční pojetí, či moderní přístup?
- Péče o těhotnou ženu s opakovanými těhotenskými ztrátami a prokázaným imunodeficitem z pohledu porodníka
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



