-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Pleurální výpotek v intenzivní péči
Pleural effusion in intensive care
Pleural effusion (fluidothorax) is characterized by the presence of excessive amount of fluid in the pleural space caused by various pathological clinical conditions. Pleural effusion leads to increased morbidity and adversely affects the prognosis and clinical outcome of critically ill patients in the intensive care setting. Early recognition of pleural effusion and diagnosis of the causal factors belong to the standard components of its management in intensive care. Diagnosis is usually made by chest X-ray and computer tomography followed by pleural aspiration. Nowadays, chest ultrasonography has become an invaluable diagnostic tool. Moreover, it also plays an important role as a guide for invasive pleural procedures. Therapeutic management of pleural effusion is based on treatment of causal factors whenever possible, or on symptomatic approaches.
Keywords:
pleural effusion – pleural tap – thoracic drainage – chest ultrasonography
Autoři: J. Máca 1,2; F. Burša 1,2
Působiště autorů: Klinika anesteziologie, resuscitace a intenzivní medicíny, Fakultní nemocnice Ostrava-Poruba 1; Katedra intenzivní medicíny a forenzních oborů, Lékařská fakulta, Ostravská univerzita v Ostravě 2
Vyšlo v časopise: Anest. intenziv. Med., 27, 2016, č. 3, s. 149-161
Kategorie: Intenzivní medicína - Přehledový článek
Souhrn
Pleurální výpotek (fluidothorax, PV) je klinicko-patologický stav, charakterizovaný přítomností nadměrného množství tekutiny v pleurální dutině. Etiologie PV je velmi různorodá. Časný záchyt přítomnosti výpotku, správné určení vyvolávajícího onemocnění a volba adekvátní léčby jsou standardní součástí péče o kriticky nemocného pacienta. K základním diagnostickým metodám patří zobrazovací metody (RTG plic a počítačová tomografie) a pleurální punkce. V posledních letech je v popředí ultrasonografie hrudníku, jejíž význam je nejen diagnostický, ale je možné tuto metodu využít i jako asistenci při invazivních terapeutických procedurách. Terapie fluidothoraxu je založena na současném řešení vyvolávajícího onemocnění (pokud je možná), a symptomatické terapii včetně punkce nebo drenáže pleurálního dutiny.
Klíčová slova:
pleurální výpotek – pleurální punkce – hrudní drenáž – ultrasonografie hrudníkuÚVOD A EPIDEMIOLOGIE
Onemocnění pleury patří k častým onemocněním nejen na standardních odděleních chirurgického i interního zaměření, ale i na jednotkách intenzivní péče (JIP). Incidence je odhadována na 3 tisíce nových případů na 1 milión obyvatel za rok [1]. Pleurální výpotek (PV), syn. fluidotorax, je nejčastější formou pleurální patologie a v literatuře je popsáno až 50 různých příčin. K nejčastějším patří srdeční selhání, parapneumonická pleuritida, a přímé onemocnění pleury (infekční pleuritida). PV se může rozvinout i jako poléková reakce [2, 3].
Výskyt jedné z nejčastějších příčin PV, infekční pleuritidy, se odhaduje na 80 tisíc za rok vztaženo na populaci Velké Británie a Spojených států amerických a její incidence se zvyšuje o 1,8–2,8 % za rok [4]. Infekční postižení pleury je spojeno s vysokou mortalitou a morbiditou (v UK zhruba 20 % pacientů s empyémem zmírá, dalších 20 % vyžaduje chirurgickou intervenci) [5, 6]. Mezi rizikové faktory patří: diabetes mellitus, imunosuprese (včetně kortikosteroidní terapie), gastroezofageální reflux, abúzus alkoholu a intravenózních drog [7] a iatrogenní faktory, především invazivní pleurální intervence včetně kardiochirurgie, hrudní a jícnové chirurgie [6]. Až u 57 % pacientů s pneumonií lze zjistit přítomnost klinicky nevýznamného PV, který při adekvátní terapii postupně ustoupí [8]. V literatuře je jen málo recentních epidemiologických dat týkajících se problematiky PV u kriticky nemocných. Výskyt onemocnění pleury na jednotkách intenzivní péče (JIP) se ale obecně považuje za častý.
Za standard diagnostiky PV byl tradičně považován prostý RTG snímek plic, později CT hrudníku. V posledních letech je při diagnostice pleurální patologie patrný stoupající trend využití ultrazvukových (UZ) metod. Výhodou UZ je minimální radiační zátěž pacienta, rychlé použití přímo u lůžka (bed-side) a možnost UZ navigace při punkci nebo drenáži pleurální dutiny. Další výhodou je zhodnocení nálezu nejen v pleurální dutině, ale i posouzení plic, mediastina a srdeční činnosti.
Základní součástí diagnostiky pleurální patologie je také laboratorní analýza PV a její správná interpretace.
Terapie PV spočívá především v důsledné terapii základního onemocnění (pokud je možná) a dále v symptomatické léčbě, která je indikovaná v situaci, kdy je výpotek zdrojem klinicky významných příznaků.
PATOGENEZE PV A ROZDĚLENÍ
Pleurální prostor (dutina) je za fyziologické situace pouze virtuální, protože listy nástěnné (parietální) a orgánové (viscerální) pleury na sebe těsně naléhají. V pleurálním prostoru je přítomno jen minimální množství tekutiny (1–10 ml) tvořící cca 10 μm tenkou vrstvu, která má za úkol snižovat tření, a usnadňovat tak vzájemný posun pleurálních listů při ventilaci. Pleurální tekutina svým složením zhruba odpovídá intersticiální tekutině a její pH je cca 7,6. Buněčná složka je tvořena především buňkami pleury, lymfocyty a makrofágy. Dále tekutina obsahuje bikarbonát, glukózu, ionty a některé proteiny, např. laktát dehydrogenázy (LDH). Voda a malé molekuly (např. glukóza, urea) pleurou prochází volně. Větší molekuly pak transcelulárním transportem nebo pleuro-lymfatickým systémem, který je zodpovědný za tvorbu a odstraňování pleurální tekutiny [9]. V různých patologických stavech, kdy je porušena rovnováha mezi tvorbou a odstraňováním pleurální tekutiny, dochází ke stagnaci tekutiny v pleurální dutině a vzniká výpotek. Jednotlivé patologické jednotky narušují tuto rovnováhu různým způsobem.
Mezi patogenetické mechanismy vzniku PV patří:
- a) zvýšený hydrostatický tlak v plicních kapilárách (např. při srdečním selhání a plicní embolizaci),
- b) zvýšená plicní kapilární permeabilita (např. u pneumonie),
- c) snížený intrapleurální tlak (např. u atelektázy),
- d) snížený onkotický tlak plazmy (např. u hypoalbuminémie),
- e) zvýšená permeabilita pohrudnice společně s obstrukcí lymfatické drenáže (např. u malignit a u infekční pleuritidy),
- f) transdiafragmatický prostup tekutiny z dutiny břišní (např. u pankreatitidy a obstrukce močových cest),
- g) defekt hrudního mízovodu (např. po traumatu mediastina),
- h) potraumatické krvácení do pleurální dutiny po traumatu hrudníku anebo plic,
- i) zvýšená koncentrace osmoticky aktivních látek v extracelulárním a pleurálním prostoru (např. při urémii).
Klinicko-patogeneticky se rozlišují dva základní subtypy pleurálního výpotku:
- transudát
- exsudát (tab. 1)
Tab. 1. Seznam nejčastějších etiologií exsudátu a transudátu* 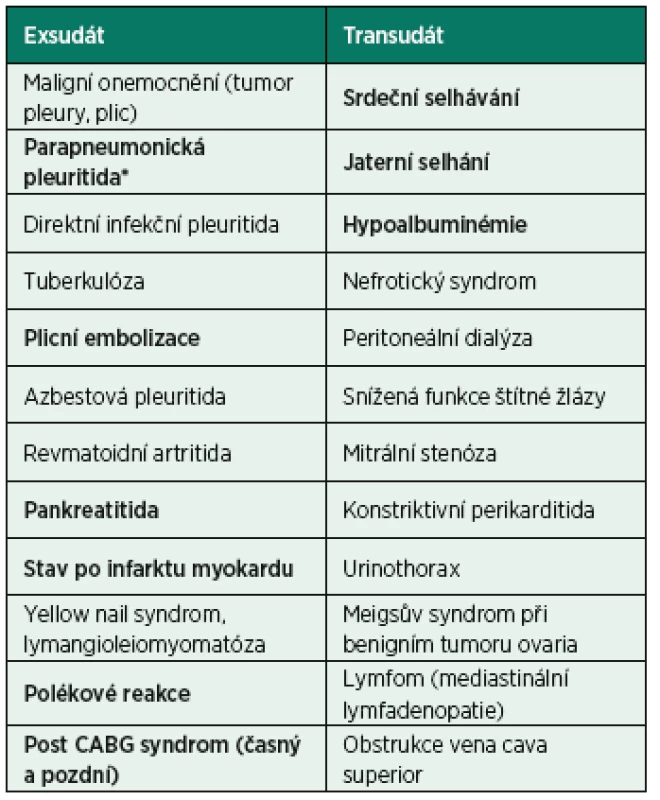
(volně podle British thoracic society guidelines, Hooper et al.) *seřazeno podle častosti výskytu Tučně jsou označeny jednotky s klinickým významem pro intenzivní péči. K rozlišení těchto subtypů se doporučuje užít Lightovo kritérium (tab. 2). Diagnostická hranice mezi transudátem a exsudátem je ovšem někdy neostrá a rozlišení je obtížné. V některých klinických případech, např. u pacientů léčených diuretiky, je vhodné doplnit základní biochemické vyšetření výpotku o další parametry k určení definitivní diagnózy (tab. 3). Specifickými podjednotkami fluidotoraxu jsou hemotorax, chylotorax, pseudochylotorax, urinotorax apod.
Tab. 2. Lightova kritéria pro rozlišení exsudátu a transudátu 
LDH v PV je > 2/3 horního limitu laboratorního rozmezí pro LDH v séru. Pleurální výpotek je exsudátem, pokud je splněno alespoň jedno kritérium. Tab. 3. Doplňující parametry biochemické analýzy pleurálního výpotku (např. při terapii diuretiky) 
*při splnění podmínky se pravděpodobně jedná o transudát Z praktického hlediska je důležitá lokalizace PV. Výpotek může být unilaterální anebo bilaterální. Význam tohoto rozlišení spočívá v rozdílné diferenciální diagnostice a iniciální terapeutické strategii. Například srdeční selhání je nejčastější příčinou bilaterálního PV a efektivní terapie základního onemocnění obvykle vede k rychlé rezoluci PV bez nutnosti indikace k diagnostickému nebo terapeutickému invazivnímu výkonu (pleurální aspirace nebo hrudní drenáž).
U infekční pleuritidy (parapneumonické i přímé) lze rozlišit tři neostře ohraničené vývojové fáze:
- prostý exsudát: zvýšené hladiny IL-8 a TNF-α při zvýšené permeabilitě zánětem alterovaných pleurálních listů,
- komplikovaný exsudát (fibrinopurulentní stadium): přítomnost bakteriální invaze do pleurální dutiny, lokální akumulace neutrofilních granulocytů, prokoagulační stav a snížení fibrinolytické aktivity (↑ hladiny inhibitoru aktivátoru plazminogenu – PAI-1, ↓ tkáňového aktivátoru plazminogenu – tPA)
- empyém: obvykle je přítomno fibrózní ztluštění pleury (syn. pachypleura, angl. pleural peel), je redukovaná schopnost plíce reexpandovat po evakuaci empyému (angl. trapped lung).
Laboratorní analýza pleurálního aspirátu je schopna často jednotlivá stadia identifikovat.
DIAGNOSTIKA
V intenzivní péči je možné se setkat s PV v několika klinických situacích:
- a) komplikace základního akutního onemocnění (např. parapneumonický výpotek, plicní embolizace, akutní pankreatitida, hemotorax po traumatu hrudníku apod.);
- b) komplikace přidruženého, většinou chronického onemocnění (např. výpotek při revmatoidní artritidě, při TBC pleuritidě, při srdečním selhávání, při nádorovém onemocnění plic a pleury apod.);
- c) stav vzniklý iatrogenně v souvislosti s invazivními výkony při hospitalizaci (např. po torakochirugickém výkonu, po kardiochirurgickém výkonu, komplikace kanylace centrální žíly apod.)
Anamnestické údaje mohou o etiologii PV významně napovědět. V osobní anamnéze je třeba pátrat po přítomnosti chronického srdečního nebo jaterního onemocnění, expozici různým toxickým látkám včetně azbestu. Udává se, že až 75 % plicních embolizací je provázeno pleurálním výpotkem a jeho objem je úměrný závažnosti klinického stavu pacienta [10]. Tvorba PV může být vyvolána i nežádoucím účinkem léků. Jedním z nich je metotrexát, který je schopen vyvolat těžké polékové intersticiální plicní onemocnění (tzv. metotrexátová plíce). Dalšími léky jsou např. amiodaron, fenytoin, některé betablokátory apod. Výčet potenciálně rizikových léků je k dispozici na internetových stránkách www.pneumotox.com [11].
Klasické fyzikální vyšetření s nálezem ztemnělého poklepu a poslechového oslabení dýchání nad výpotkem jsou nadále součástí každodenního rutinního hodnocení pacienta. Jejich význam v rámci intenzivní péče ovšem pozvolna klesá.
Mezi hlavní diagnostické metody patří zobrazovací vyšetření (RTG, CT, UZ) a analýza pleurálního aspirátu, detailnější popis viz níže.
Obecné schéma úvodního diagnosticko-terapeutického algoritmu u pacientů s PV v podmínkách intenzivní péče zachycuje obrázek 1.
Obr. 1. Schéma úvodního diagnosticko-terapeutického algoritmu u pacientů s pleurálním výpotkem v intenzivní péči 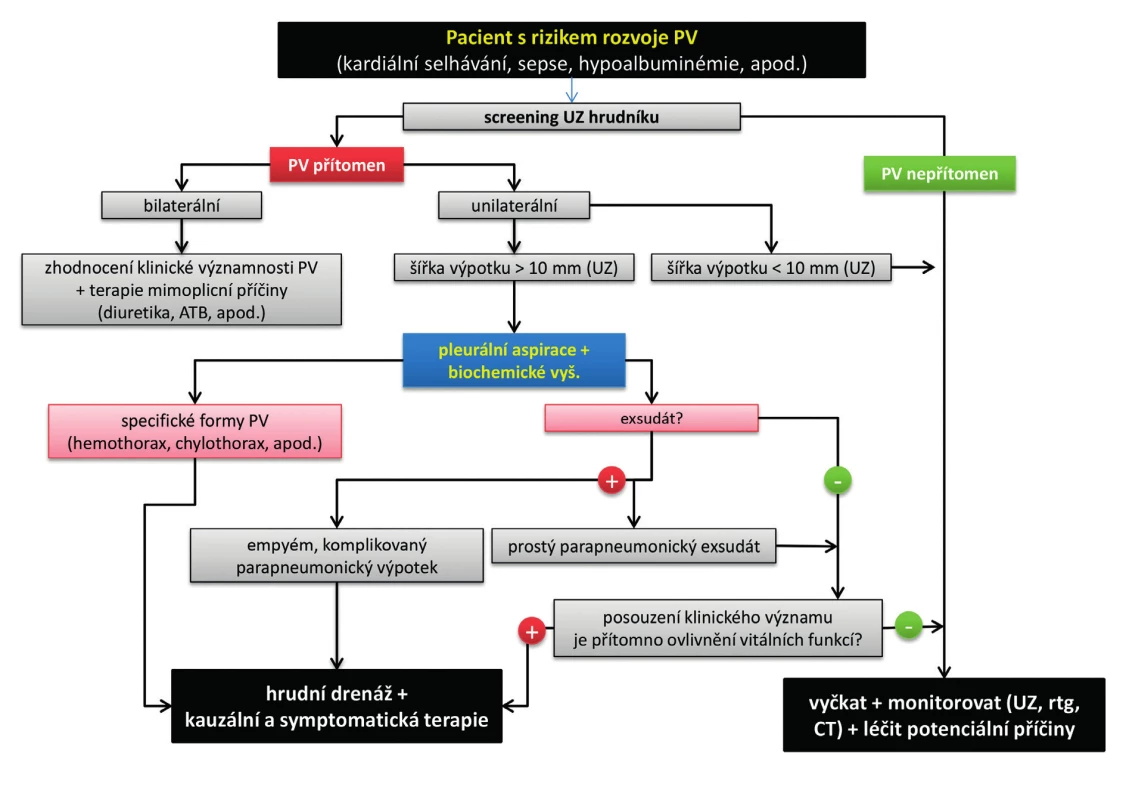
- Rentgenové metody
Skiagram hrudníku a plic (RTG)
Rentgenové vyšetření plic v PA projekci (zado-přední) a boční snímek patří k základním vyšetřením k diagnostice PV. Výpotek se v sedě (popř. ve stoje) hromadí bazálně nad bránicí a lze zachytit i malé množství, které se zobrazuje jako zastření především zevního kostofrenického (k. f.) úhlu. Obvykle se udává, že na PA snímku plic je možné zachytit výpotek od 200 ml, na bočním RTG lze pozorovat otupení zevního k. f. úhlu už od 50 ml [12].
Na JIP je záchyt PV obtížnější. Díky tomu, že pacienti jsou obvykle analgosedovaní, v supinační poloze, bez možnosti posazení, je klasická PA nebo boční projekce téměř vždy neproveditelná. Vyšetřuje se v AP projekci (předo-zadní), kdy je deska RTG umístěna pod zády pacienta vleže, kdy se PV obvykle rozprostře na větší ploše v dependentní části hrudníku. Nález se může jevit jako lehce snížená transparence celého hemitoraxu se zachovanými stíny bronchovaskulárních svazků, rozostření kontury bránice (obr. 2). Objem pleurální tekutiny je obvykle podhodnocen a zdánlivě normální nález na RTG nevylučuje přítomnost klinicky významného PV [13].
Obr. 2. RTG obraz pleurálního výpotku v supinaci 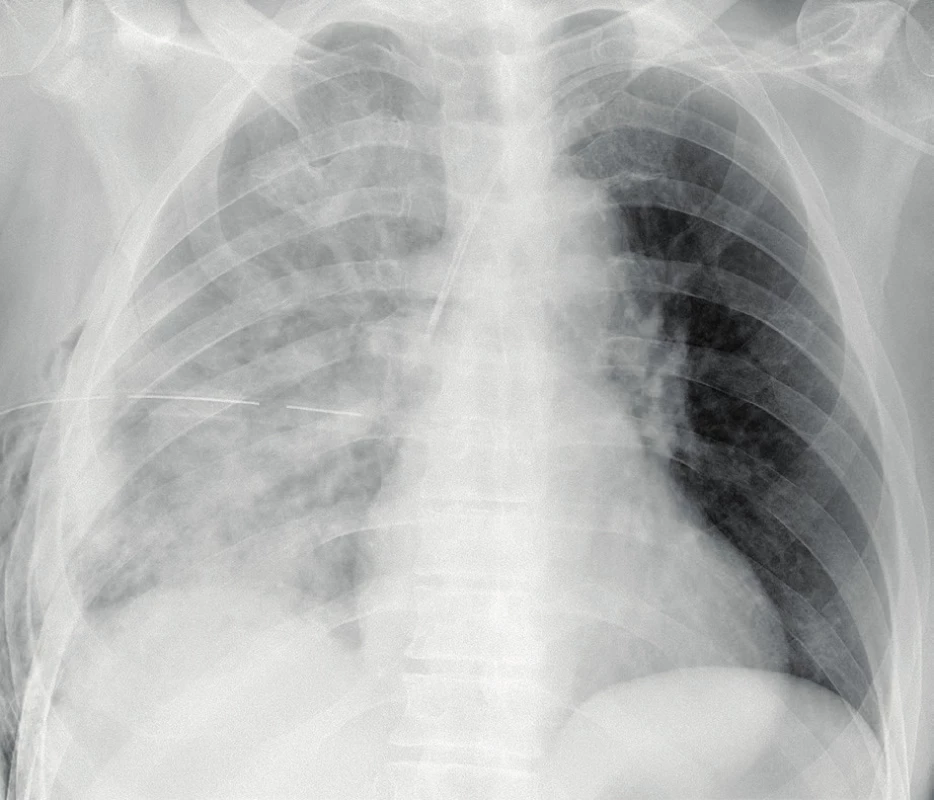
Počítačová tomografie
Mezi nejpřesnější a nejpřehlednější rentgenová vyšetření pohrudniční dutiny patří CT plic a hrudníku. Indikací k CT je především upřesnění lokalizace, velikosti (objemu) a charakteru (fluidita, přítomnost sept) PV. CT je také možné využít při pleurální punkci nebo hrudní drenáži, ke kontrole polohy drénu a posouzení jeho efektivity (úbytek výpotku). Důležité je současné hodnocení okolních struktur v hrudníku – plicní parenchym (vyloučení bronchogenního karcinomu), mediastinum (lymfadenopatie, velké cévy, jícen, srdce) a hrudní stěna včetně bránice.
Je doporučováno zvolit CT vyšetření s vysokým rozlišením (angl. high resolution CT, HRCT) po aplikaci kontrastní látky. Tekutý výpotek se ve většině případů zobrazuje typicky v dependentní oblasti jako bikonkávní srpkovitý tvar, zatímco empyém může vypadat jako extrapulmonálně uložený lentikulární (čočkovitý) útvar s výrazněji syceným pleurálním ohraničením, při kterém jsou oba listy pleury roztlačeny empyémem (ang. split pleura sign) – obrázek 3. Ztluštění pleury je nalezeno v 86–100 % případů [14].
Obr. 3. CT nález empyému, „split pleura sign“. 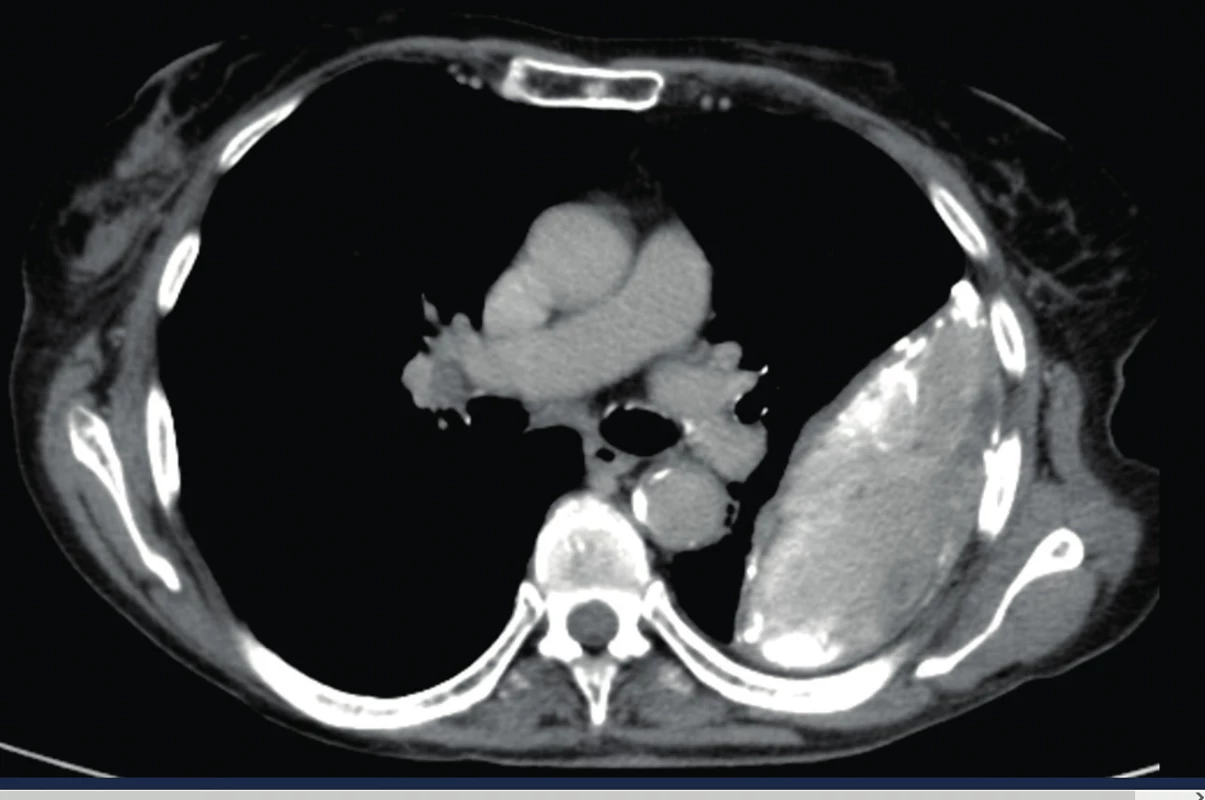
(Převzato se svolením autora, zdroj www.sonoatlas.cz) - Ultrasonografie hrudníku
Pro diagnostické, ale i terapeutické intervence v intenzivní péči má v současnosti zásadní význam ultrasonografické (UZ) vyšetření hrudníku a plic [15]. Mezi hlavní výhody UZ ve srovnání s rentgenovými metodami patří: absence radiační zátěže, neinvazivita, snadná použitelnost bed-side a možnost průběžného monitorování vývoje choroby. Při diagnostice PV je ultrasonografické vyšetření mnohem citlivější ve srovnání s prostým RTG snímkem hrudníku a plic [16]. UZ dokáže odlišit PV od prostého zesílení pleury [17]. Pleurální punkce pod přímou kontrolou UZ je úspěšnější (až v 88 %) ve srovnání s punkcí pod RTG kontrolou [18, 19]. UZ navigace se vyznačuje také nižší incidencí vzniku pneumotoraxu (PNO) [20] a nižším rizikem punkce jater nebo sleziny [2]. Velkou výhodou UZ je přímá, v reálném čase (tzv. real-time) vizualizace pleurálního prostoru a možnost přímého posouzení kvality a kvantity PV nebo jiné pleurální patologie (např. nádorového procesu). Také lze hodnotit přilehlý plicní parenchym včetně funkčního posouzení plicní ventilace. Limitací metody prozatím zůstává lokální dostupnost a do určité míry i možnost subjektivního zkreslení vyšetřujícím [22]. Jiná omezení vyplývají z fyzikálního principu metody: omezená možnost vyšetření u podkožního emfyzému nebo problematické zobrazení hlubokých struktur. Zkreslení vyšetření lze částečně odstranit změnou nastavení některých parametrů UZ přístroje (úprava frekvence, změna typu sondy apod.). Řada „artefaktů“ provázejících UZ vyšetření plic je ale specifická pro určité patologické procesy, a proto jich lze také využít k diagnostice, např. plicního edému. Detailní popis UZ plic přesahuje záměr textu.
Vlastní vyšetření nevyžaduje žádnou specifickou přípravu pacienta. Vyšetření probíhá obvykle v supinaci. Elevací horní končetiny lze do jisté míry dosáhnout rozšíření interkostálního prostoru, ovšem toto polohování obvykle není nutné během vyšetření provádět. Pro získání komplexního přehledu je potřeba vyšetřit hrudník v několika bodech. Existuje řada doporučení a protokolů, týkajících se vhodných projekcí. Minimální počet projekcí jsou 3 na každé straně hrudníku (anterior, lateral a dorsal point – tzv. BLUE-protocol) [23], ale jako výhodnější se jeví vyšetření alespoň 6 projekcí na každé straně (s důrazem na vyšetření dorzálních partií hrudníku u pacienta v supinaci, kde očekáváme maximum výpotku). Hrudník lze pomyslně rozdělit na horní a dolní polovinu a dále pak na konečných 6 oddílů pomoci medioklavikulární a přední a zadní axilární čáry (obr. 4a).
Obr. 4. Hrudnik UZ projekce 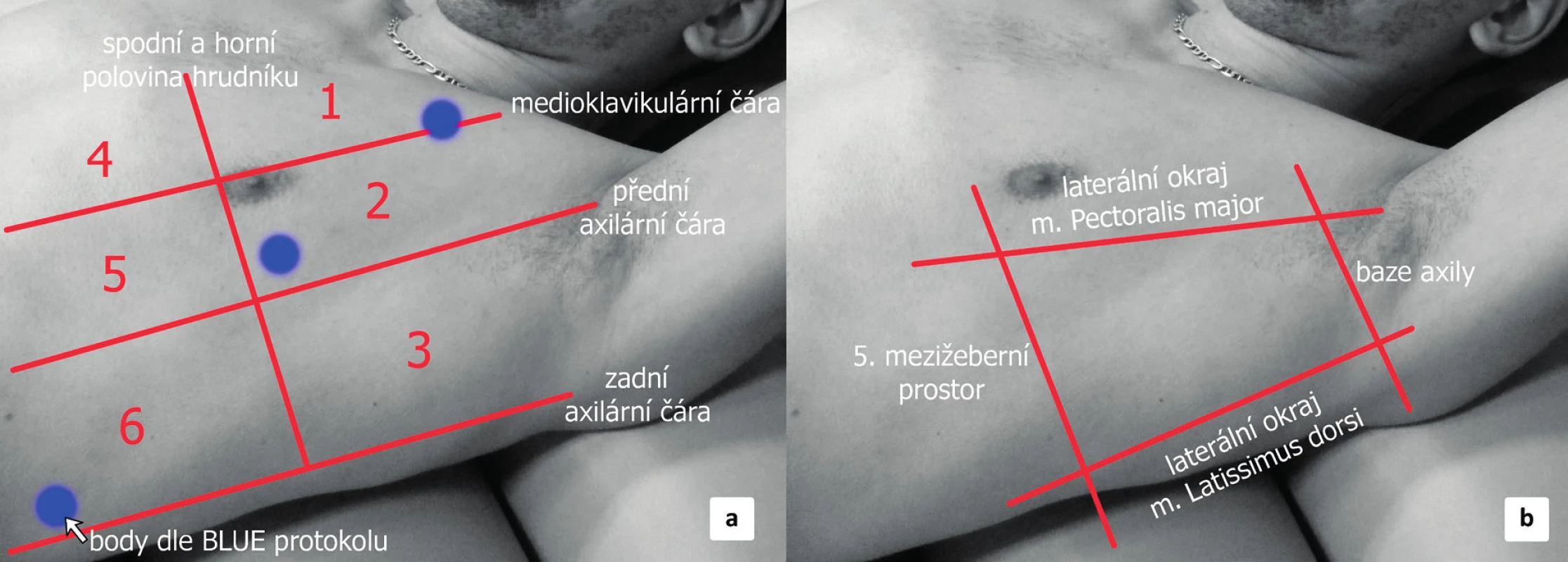
a) rozdělení hemithoraxu na 6 vyšetřovaných oblastí (červeně zobrazené linie) a na 3 body podle BLUE-protokolu (modré tečky) b) oblast pro bezpečnou pleurální punkci. V UZ obraze je za fyziologických podmínek viscerální a parietální pleura těžko rozeznatelná. Pleura je obvykle zobrazena jako jasně hyperechogenní struktura rovnoběžná s hrudní stěnou s hypoechogenní subpleurální linií (obr. 5). Někdy je možné vidět mezi listy pleury hypoechogenní vrstvičku intrapleurální tekutiny. Fyziologicky je možné vidět „klouzání“ obou listů pleury po sobě navzájem způsobené ventilací plíce (angl. lung-sliding). Pod viscerální pleurou je pak přilehlý plicní parenchym s typickým obrazem vznikajícím odrazem a tzv. reverberací viscerální pleury, tzv. A-profil (obr. 6). UZ je schopen odhalit, obdobně jako CT, peridiafragmatickou kolekci tekutin a odlišit pleurální afekci i od patologie plicní tkáně [24]. Tekutina v interlobiu nebo atypicky hluboce (mediálně, paramediastinálně) uložené výpotky mohou uniknout ultrazvukové diagnostice a CT je zde suverénní metodou. CT je rovněž přesnější, pokud se týče odhadu nebo výpočtu množství tekutiny v pleurální dutině. Jako jednoduchý a přitom uspokojivě přesný výpočet objemu PV pomocí UZ u lůžka nemocného v supinaci je:
Obr. 5. Fyziologické UZ zobrazení pleurální linie a žeber konvexní sondou (vlevo) a lineární sondou (vpravo) 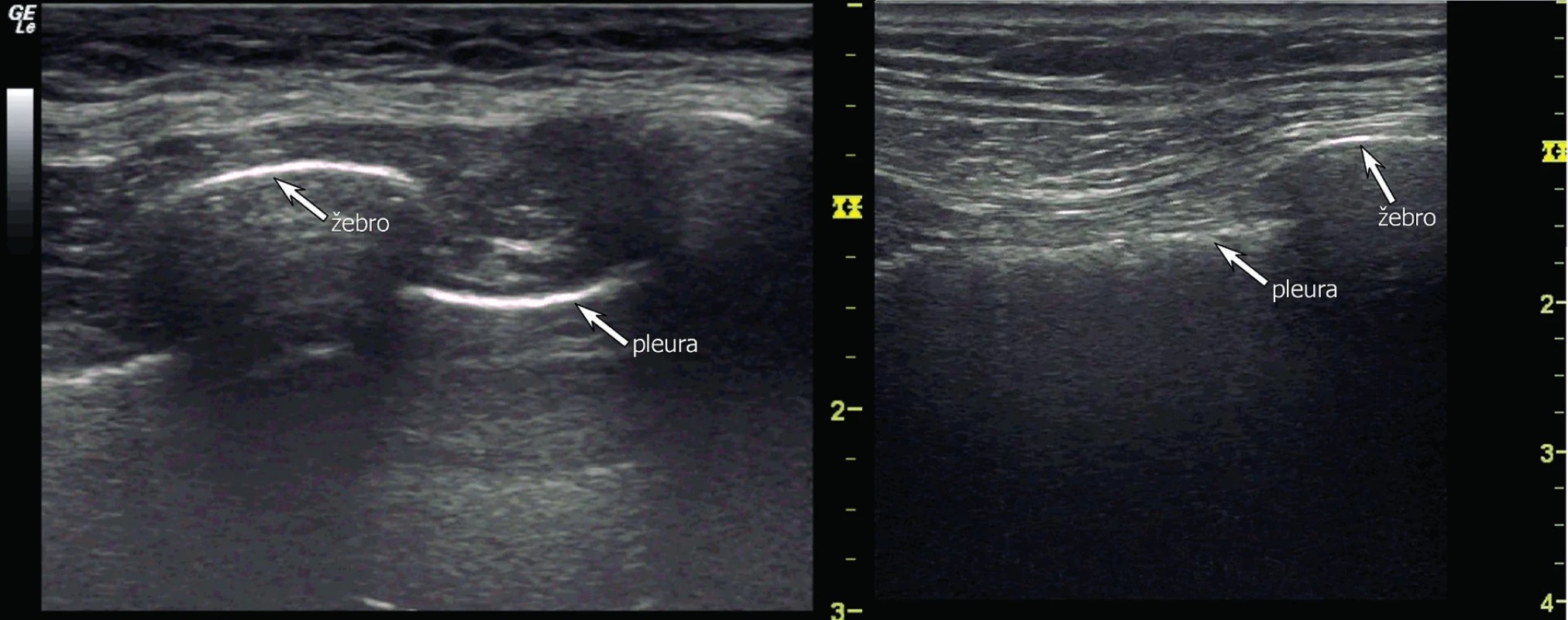
Obr. 6. Fyziologický nález při UZ vyšetření plic konvexní sondou, A-profil 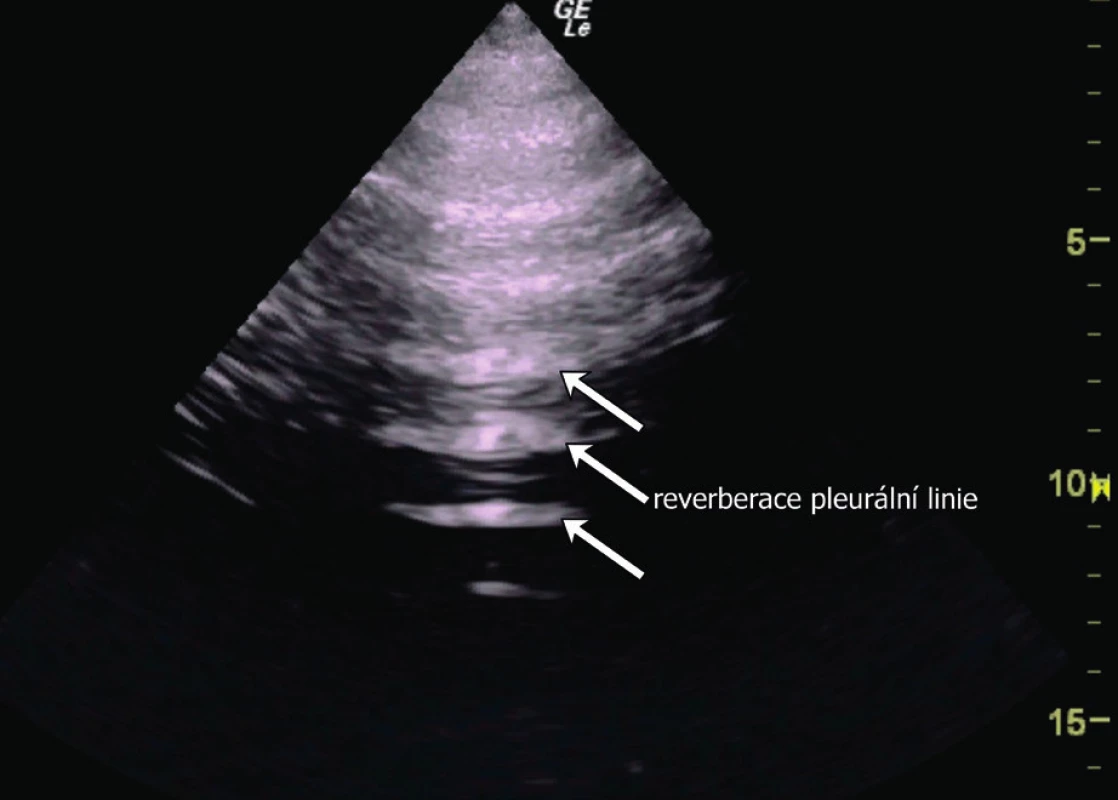
V (objem výpotku v ml) = 20 x vzdálenost mezi listy pleury (mm) [25]
Podle echogenity a charakteru zobrazeného výpotku je možné odhadnout na jeho etiologii (obr. 7). Transudát je obvykle anechogenní a homogenní, exsudát pak s četnými hyperechogenními shluky volně plovoucích ve výpotku a empyém ještě o něco více hyperechogenní [26]. Rozlišení etiologie výpotku podle UZ obrazu neplatí absolutně a často je nutné přihlédnout k celkovému klinickému stavu pacienta a okolnostem vzniku PU. Nicméně, Chen et al. prokázal, že diagnóza exsudátu podle UZ silně koreluje s nízkým pH, hladinou glukózy a vysokou hladinou LDH v PU [27]. U hemotoraxu je popisován tzv. plankton-sign, tedy výskyt výrazně hyperechogenních drobných struktur volně plavoucí v anechogenní tekutině [15], což platí zejména pro starší krev. Čerstvé krvácení bývá anechogenní a nerozeznatelné od transudátu. Je možné zobrazit septovaný výpotek, kdy specificita ultrasonografie je zde dokonce vyšší ve srovnání s CT [2]. Maligní výpotky jsou častěji echogenní a současně bývá přítomno zesílení pleury a bránice.
Obr. 7. UZ obraz fluidothoraxu 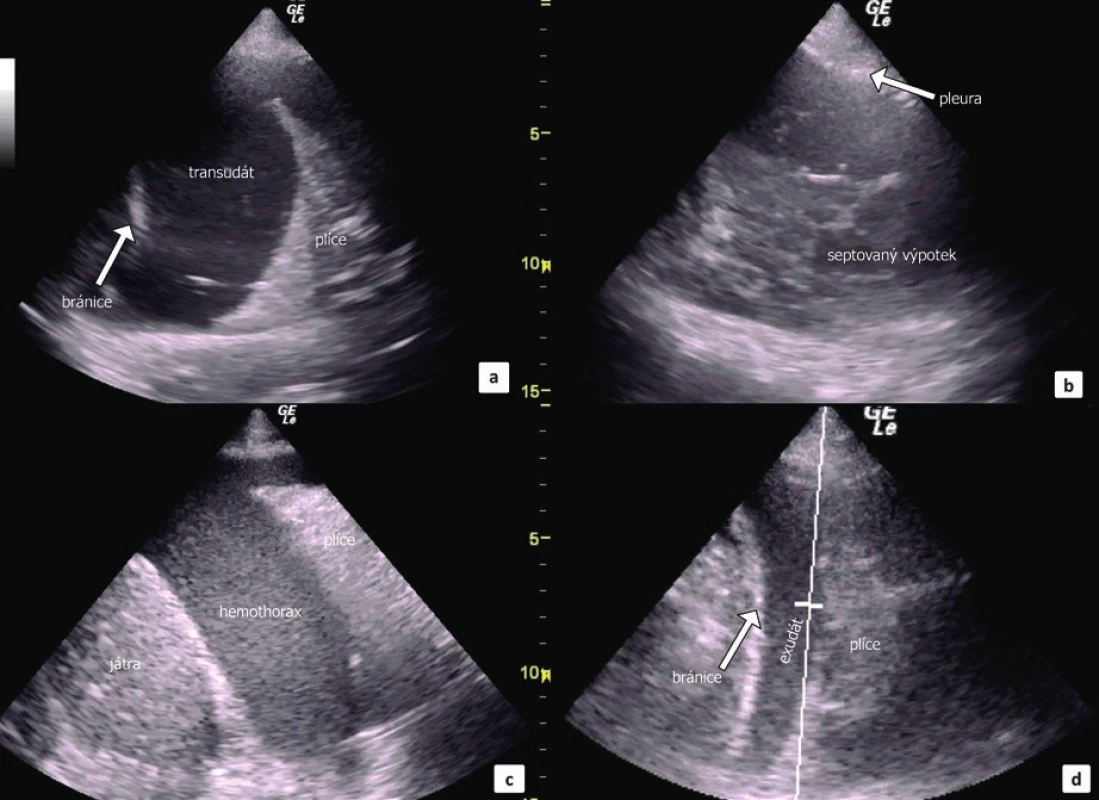
a) hypoechogenní transudát, b) septovaný výpotek, c) hemotorax a d) exsudát s konsolidovanou plicní tkání a zobrazením bránice a jater. UZ hrudníku má zásadní význam i jako navigace při torakocentéze [28]. Srovnání UZ navigované punkce s torakocentézou naslepo jen podle předchozího prostého RTG snímku plic je riziko pneumotoraxu 3% versus 18% [29]. Indikace k evakuaci výpotku nebo diagnostické aspiraci výpotku musí být vždy pečlivě zvážena, protože se jedná o rizikový invazivní výkon. Časová prodleva mezi UZ a punkcí a změna polohy pacienta musí být co nejmenší. Pomocí UZ lze následně sledovat průběh zavedeného drénu, stejně jako ověřit účinnost drenáže hodnocením úbytku PV. Dále lze snadno sledovat relaps výpotku nebo míru provzdušnění přilehlého plicního parenchymu. Jako minimální velikost separace listů pleury výpotkem bezpečné pro drenáž je 10 mm v inspiriu. Výpotek by měl být viditelný v několika (alespoň třech) sousedních mezižeberních prostorech, kraniálně a kaudálně od zamýšleného místa vpichu.
- Pleurální punkce a laboratorní analýza pleurálního aspirátu
Provedení diagnostické pleurální punkce (syn. pleurální aspirace, torakocentéza, toracentéza) je doporučeno zvažovat u pacientů s prokázaným pleurálním výpotkem, kteří mají:
- a) unilaterální plicní výpotek nebo bilaterální s významným stranovým rozdílem,
- b) známky sepse nebo pneumonie (febrilie, pleurální bolest),
- c) šířku výpotku větší než 10 mm podle UZ v supinaci,
- d) není souběžně přítomna kardiomegalie,
- e) není adekvátní odpověď na terapii předpokládané základní příčiny,
- f) je-li potřeba umělé plicní ventilace (UPV) [30, 31]. Časná evakuace PV je indikována v situaci hemotoraxu a empyému.
Punkce bývá indikována nejen ke stanovení diagnózy, ale zároveň jako terapeutický výkon, např. k jednorázovému odsátí velkého symptomatického výpotku. Provádí se za plně aseptických podmínek. U elektivních výkonů je nutno zajistit adekvátní korekci hemostázy (international normalized ratio, INR <1,5, trombocyty >50 x 109). Mezi nejčastější komplikace patří: selhání procedury, pneumotorax, bolest a krvácení. Nejzávažnější komplikací je punkce viscerálních orgánů [28]. Místo vpichu se řídí především lokalizací výpotku podle zobrazovacích metod. Punkci lze často provést v tzv. bezpečném trojúhelníku (angl. triangle of safety), který je ohraničen ventrálně laterálním okrajem m. pectoralis, dorzálně laterálním okrajem m. latissimus dorsi, hrot trojúhelníku je v axile a baze je 5. mezižeberní prostor (viz obr. 4b). Jehla by měla procházet hrudní stěnou nad horním okrajem žebra, aby nedošlo k poškození mezižeberního neurovaskulárního svazku.
Podle British Thoracic Society (BTS) je doporučeno provádět pleurální aspirace soupravou skládající se z jehly (fine bore needle, 21 G) a injekční stříkačky (objem 50 ml).
Ke standardním součástem procedury patří UZ navigace. Preferován je laterální přístup, protože posteriorní a mediální punkce jsou rizikovější stran narušení integrity interkostálních cév a následného významného krvácení. Získaný pleurální aspirát (vzorek pleurální tekutiny) je považován za tzv. vzácný vzorek a musí být neprodleně vyšetřen.
Zaznamenává se vzhled vzorku a zápach. Putridní zápach naznačuje možnost empyému. Mléčně zbarvený popř. zkalený výpotek by měl vést k podezření na chylotorax (přítomnost lymfy bohaté na triacylglyceroly a chylomikrony), pseudochylotorax (chylózně zbarvená tekutina obsahující převážně cholesterol a krystaly cholesterolu, ale jen minimum triacylglycerolů a chylomikronů), anebo empyém. Rozlišení empyému od chylotoraxu/pseudochylotoraxu je možné provést analýzou složení zmíněných lipidů nebo laboratorní centrifugací. Pokud výpotek sedimentuje a vytváří čistý supernatant, je pravděpodobnou diagnózou empyém. Pokud tekutina zůstává zkalená a/nebo mléčně zbarvená, pak je vyšší pravděpodobnost diagnózy lipidového chylotoraxu, eventuálně pseudochylotoraxu. Zápach čpavku může naznačit diagnózu urinotoraxu. Přítomnost zbytků potravy v pohrudniční dutině zase vede k diagnóze ruptury jícnu, popř. přítomnosti ezofagopleurální fistule. Červeně zbarvená tekutina je suspektní z přítomnosti erytrocytů v (hemoragickém) PV, popř. hemotoraxu (krev v pleurální dutině). Detailnější popis specifických typů fluidotoraxu podává tabulka 4.
Tab. 4. Specifické typy fluidotoraxu, jejich nejčastější příčiny a nálezy 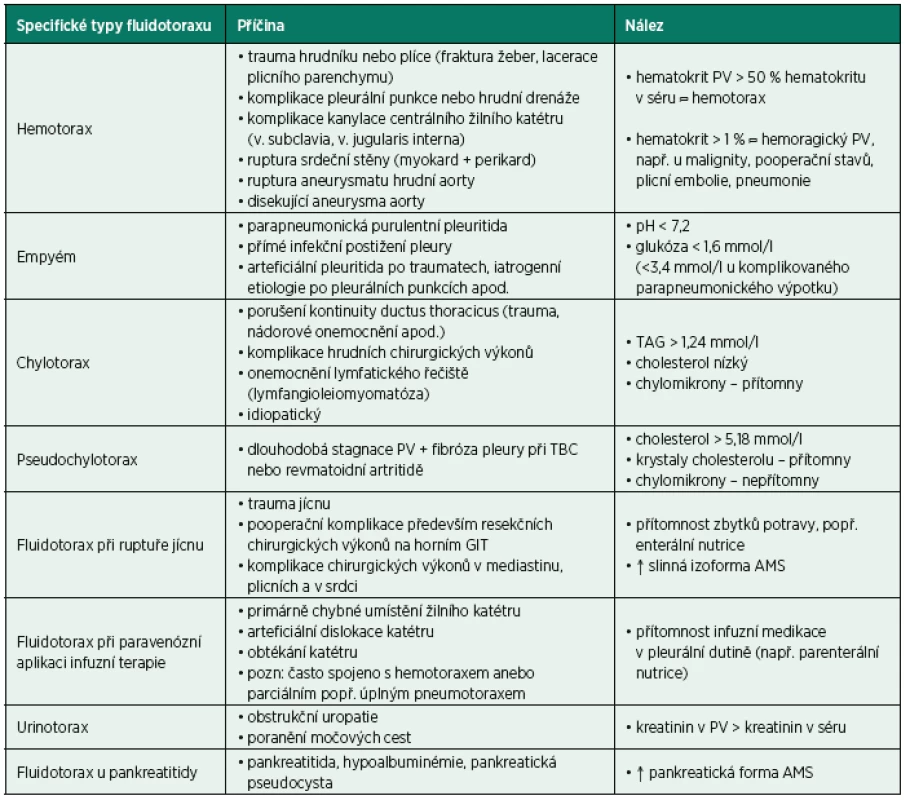
AMS – amyláza, GIT – gastrointestinální trakt, PV – pleurální výpotek, TBC – tuberkulóza, TAG – triglyceridy Při podezření na infekční etiologii PV je nutno vyšetřit pH vzorku (uzavřená heparinizovaná zkumavka k zabránění kontaktu se vzduchem). Zbytek tekutiny je rozdělen a odeslán k mikrobiologickému vyšetření (5 ml), biochemickému vyšetření (2–5 ml) a cytologickému vyšetření zahrnující diferenciální rozpočet buněk PV a vyloučení malignity (20–40 ml) [2]. Kromě klasického kultivačního mikrobiologického vyšetření je doporučeno vyšetření na acidorezistentní tyčky (TBC), polymerázová řetězová reakce (PCR) na nejtypičtější potenciální patogeny, rychlé metabolické metody vyšetření a další specializované metody. Dále je vhodné provést i rychlou mikroskopickou diagnostiku PV sedimentu po barvení podle Gramma a také odeslat část aspirátu (stříkačka pro hemokultury) k záchytu anaerobních mikroorganismů [32].
Biochemická analýza je důležitou součástí diagnostiky PV. Pomocí ní lze často stanovit diagnózu vyvolávající příčiny PV, nebo alespoň rozlišit, zdali se jedná o exsudát nebo transudát. Rozlišení je založeno především na již zmíněných Lightových kritériích, která srovnávají hodnoty celkové bílkoviny a LDH ve výpotku a v séru [33]. Tato kritéria mají téměř 100% senzitivitu. Ke zkreslení výsledku může ovšem vést terapie diuretiky, používaná např. v rámci terapie městnavého srdečního selhávání. Diuretika vedou k sekundárnímu navýšení hladiny LDH v PV (téměř až ve 20 % případů), a tudíž k riziku nesprávně stanovené diagnózy exsudátu [31, 34]. Ke zpřesnění diagnostiky lze poté zvážit výpočet gradientu mezi sérovou a pleurální bílkovinou (hodnota gradientu >31 g/l svědčí pro diagnózu transudátu) [35], anebo výpočet gradientu sérum/výpotek albuminu (hodnota gradientu > 12 g/l odpovídá transudátu) [36]. Další zpřesnění diagnostiky umožňuje měření sérové hladiny natriuretického peptidu typu B, tzv. NT-proBNP (angl. N-terminal pro b-type natriuretic peptide), který patří mezi rutinní markery srdečního selhávání. NT-proBNP se vyplavuje při selhání srdečních síní i komor, na rozdíl od atriálního natriuretického peptidu (ANP), který se vyplavuje především při přetížení síní. Nejčastěji udávanou laboratorní mezí, nad níž je velice pravděpodobná kardiální příčina PV, je 1500 pg/ml [37]. Doporučená doplňující vyšetření k rozlišení exsudátu a transudátu jsou shrnuta v tabulce 4.
Stanovení pH pleurálního výpotku je důležité při podezření na infekční pleuritidu. Lokální zánětlivé procesy vedou ke zvýšené metabolické aktivitě a poruše prostupnosti pleury pro vodíkové ionty. Za indikaci k hrudní drenáži (HD) je považováno pH < 7,2, což je nejdůležitější klinický indikátor komplikovaného parapneumonického PV [38]. Vyšetření pH je nutné provést podle přesných pravidel, aby nedocházelo ke zkreslení výsledku. Jedná se především o redukci doby kontaktu se vzduchem v odběrové jehle (riziko navýšení pH o ≥ 0,05 až v 71 % výsledků) a kontaktu s lokálním anestetikem (pokles pH až o 0,15) [39]. Pokud není PV zjevným empyémem (putridně páchnoucí zkalená vazká tekutina, od bělavé až po nažloutlou barvu), je možné vyšetření provést bed-side v analyzátoru krevních plynů [40]. Výjimečně je přítomna infekční pleuritida i přesto, že pH výpotku je > 7,6. Bývá to u infekce Proteus spp., který štěpením urey produkuje alkalický amoniak [41].
Vzhledem k volné propustnosti pleury pro glukózu jsou hladiny glukózy v pohrudniční dutině za fyziologických okolností obvykle ekvivalentní glykémii. Pokles hladiny glukózy pod 3,4 mmol/l lze nalézt u komplikovaných parapneumonických výpotků, empyému, TBC, ruptuře jícnu apod. Nejčastější příčinou poklesu pod 1,6 mmol/l je revmatoidní pleuritida a empyém. Hladina glukózy v PV poměrně úzce koreluje s pH, ale z pohledu indikace k provedení hrudní drenáže je považována za marker s nižší validitou [38, 42]. Její použitelnost u diferenciální diagnostiky infekční pleuritidy je také sporná, protože pokles hladiny glukózy může být způsoben i jiným onemocněním než infekčním (např. revmatoidní artritida).
Vyšetření celkové amylázy (AMS) nepatří k rutinně doporučovaným vyšetřením, ale stanovení izoenzymů může přinést významnou pomoc při diferenciální diagnostice příčiny PV. Hodnoty slinné AMS bývají elevovány, např. u ruptury jícnu, naopak pankreatický izoenzym lze detekovat u akutní pankreatitidy, pankreatické pseudocysty apod [43]. O významu stanovení pankreatické lipázy v PV je doposud publikováno jen málo informací [2].
Pokud je podezření na urinotorax, doporučuje se vyšetřit hladinu kreatininu v PV, která bývá větší než v séru [44].
Stanovení hladiny adenosin deaminázy (ADA) > 40 U/l může vést k diagnóze TBC pleuritidy (senzitivita > 90%) nebo empyému (> 60 %). V zemích s nízkou prevalencí TBC spočívá význam vyšetření ADA především v jeho vysoké negativně prediktivní hodnotě [31].
Zvýšené hladiny některých markerů infekčního zánětu v PV mohou pomoci v diagnóze parapneumonické etiologie. Jedná se zejména o C-reaktivní protein (CRP). Pozitivní výsledek je hladina > 45 mg/l, u komplikovaného parapneumonického výpotku je to > 100 mg/l. V běžné praxi se tento marker rutinně nevyšetřuje. Výpovědní hodnota prokalcitoninu (PCT) je značně limitovaná [45].
Cytologická analýza jednotlivých subtypů leukocytů v PV zlepšuje diferenciální diagnostiku. Její nevýhodou je nízká specificita. Vysoké zastoupení lymfocytů > 50 % může svědčit pro malignitu a TBC, > 80 % pak lymfom, sarkoidózu apod. Dominující neutrofilie se nachází u akutních parapneumonických výpotků. Pleurální eozinofilie (> 10 % rozpočtu) je silně nespecifická a může být způsobena např. azbestózou, syndromem Church--Strausové, plicním infarktem, parazitární infekcí apod. [46].
Cytologické vyšetření zaměřené na vyloučení maligního onemocnění má v intenzivní péči jen malý význam. Senzitivita záchytu maligních buněk ve výpotku se udává až v 60 % [47]. Imunocytochemické vyšetření pak přispívá k rozlišení subtypů nádorových buněk a může pomoci v prognózování a volbě onko-terapeutické strategie.
V diagnostice maligních onemocnění, především maligního mezoteliomu, se v posledních letech popisuje přínos stanovení hladiny ve výpotku i sérové koncentrace relativně specifického biomarkeru; mezotelinu 2.
- Torakoskopické metody, VATS
Využití torakoskopických metod se zvažuje v případě, kdy aspirace pleurálního výpotku nevede ke stanovení konečné diagnózy. Doporučovanou formou je tzv. torakoskopie v lokální anestezii (angl. local anaesthetics toracoscopy). Její rizika jsou malá a diagnostická senzitivita pro maligní onemocnění vysoká (92,6%). Lze ji využít i pro paliativně-terapeutickou aplikaci různých preparátů určených k pleurodéze, např. talku [48]. V podmínkách intenzivní péče prozatím není tato metoda aktivně využívána. Další možností je tzv. torakoskopická chirurgie asistovaná pomocí videa (angl. video-assisted toracoscopy surgery, VATS). VATS vyžaduje téměř vždy celkovou anestezii a provádí se na operačním sále a její výhodou je možnost v jedné době rozšířit výkon i o další chirurgické procedury [2].
TERAPIE
Terapeutický přístup PV lze zjednodušeně rozdělit na dvě základní skupiny:
- terapie vyvolávající příčiny,
- symptomatická terapie.
V intenzivní péči je často nutné se rozhodnout, zdali je přítomný výpotek natolik klinicky závažný, aby ho bylo nutné evakuovat. Ačkoliv se názory obvykle různí, lze obecně konstatovat, že je vhodné zvážit evakuaci výpotku při splnění následujících podmínek:
- a) nelze uspokojivě a v krátké době terapeuticky vyřešit patologický stav, který vedl k tvorbě výpotku;
- b) velikost a charakter výpotku omezuje další fyziologické funkce pacienta (např. ztěžuje odpojení od UPV, je limitace ve spontánní ventilaci, je podezření na superinfekci pleurální tekutiny a riziko vzniku empyému).
Malé unilaterální či bilaterální výpotky bez vlivu na mechanické vlastnosti plic ve většině případů není nutné aktivně řešit, ale je nutné sledovat jejich vývoj (dynamika základního onemocnění a změna velikosti a charakteru výpotku pomocí UZ).
- Terapie základního onemocnění
Kauzální terapie je nejvýznamnější součástí kritické péče o pacienta s PV a liší se podle typu vyvolávající příčiny. Efektivní léčba např. srdečního selhání (nitráty, diuretika), popř. pneumonie (ATB) může fungovat i jako prevence vzniku PV. Při již existujícím výpotku pak může dojít k zastavení jeho progrese, popř. redukci jeho velikosti až do úplného vymizení. Odpadne tak nutnost indikace invazivní diagnostické nebo terapeutické procedury.
ATB terapie se řídí mikrobiologickým nálezem. Při vyšetření aspirátu PV je mikrobiologické vyšetření pozitivní zhruba v 60 % [6, 7]. Hemokultury jsou u pacientů s infekční pleuritidou pozitivní až ve 14 %, často jako jediný pozitivní nález. Jejich rutinní odběr je doporučen [7].
Volba antibiotické terapie se tedy řídí obecnými pravidly. V terapii je často nutné pokračovat delší dobu (až 3 týdny). Empirická ATB léčba by měla obsahovat preparáty s dobrou penetrací do pleurální dutiny: vyšší penicilinové generace obsahující inhibitory beta-laktamázy, cefalosporiny, dále metronidazol. V případě nozokomiální infekce by antimikrobiální terapie měla obsahovat ATB zaměřené proti anaerobům a MRSA, pokud není jednoznačně prokázána pneumokoková infekce. Není doporučeno použití makrolidových a aminoglykozidových ATB. Intrapleurální podání ATB není doporučeno [6].
V případě protrahovaných známek sepse, která neustupuje při ATB terapii, a trvajícímu PV navzdory správně lokalizovanému HD, je nutné po uplynutí 5–7 dnů kontaktovat hrudního chirurga k indikaci operačního výkonu obvykle formou VATS. Jako alternativa se u komplikovaných případů indikuje otevřená hrudní drenáž, popřípadě torakotomie.
- Symptomatická terapie
Základním cílem symptomatické terapie je evakuace PV. Indikací evakuace na JIP bývá nejčastěji porucha mechaniky plicní ventilace, především u pacientů na UPV. Pleurální výpotek v takovýchto případech vede k redukci funkční reziduální kapacity plic (FRC), která se u ventilovaných pacientů v anglosaské literatuře označuje jako end-exspirační plicní objem (end-expiratory lung volume – EELV). Dochází tak k:
- a) redukci ventilovatelného objemu plic s vyšším rizikem rozvoje ventilátorem indukovaného plicního poškození (VILI), patogeneticky především ve formě volutraumatu střižných sil v dependentních oblastech plic;
- b) vzniku kompresivních atelektáz, zvýraznění poruchy ventilačně/perfuzního poměru v místě tlaku na plicní parenchym negativním vlivem na oxygenaci;
- c) zvýšení nároků na dechovou práci u pacienta se spontánní ventilací při zvýšené elasticitě respiračního systému (při snížení poddajnosti plic).
Dalším důvodem k evakuaci PV je podezření na rozvoj superinfekce PV a vznik plicního empyému, který v řadě případů ještě nemusí být patrný podle vzhledu (transparentní tekutina) PV, ale biochemické parametry (především pH) již diagnózu empyému splňují. Vlastní evakuace by měla být prováděna pozvolna a šetrně. Není doporučeno odsátí většího objemu než 1500 ml najednou. Zbylá tekutina by se pak měla odstraňovat v maximálním objemu 1500 ml ve 2hodinových intervalech. Mělo by se tak předejít reexpanznímu otoku plic (angl. reexpansion pulmonary oedema, RPO), což je vzácně se vyskytující závažný stav, vznikající při jednorázovém odstranění většího objemu PV, často v kombinaci s excesivním pleurálním sáním. Patofyziologicky se uvažuje o rozvoji kapilární hyperpermeability po opětovném zvýšeném průtoku krve dříve hypoxickým plicním parenchymem. Při rozvoji RPO většinou postačí aplikace oxygenoterapie a hemodynamické a respirační monitorování pacienta. V závažnějších případech je nutná UPV s aplikací kontinuálního přetlaku v dýchacích cestách (např. CPAP s tlakovou podporou) [49].
U pacientů při vědomí je limitací evakuace PV vznik některých respiračních symptomů jako hrudní diskomfort, úporný kašel, vazovagální reakce [50, 51].
Hrudní drenáž
Hrudní drenáž (HD, syn. torakostomie) je invazivní výkon, jehož provedení by mělo být součástí dovedností všech lékařů pracujících v intenzivní péči. Indikací k HD je obvykle přítomnost vzduchu (pneumotorax, PNO) nebo tekutiny v pohrudniční dutině. Jde o vysoce invazivní proceduru, která by měla být vždy zvážena ve vztahu k možnému benefitu pro pacienta. Udává se, že opožděné zavedení hrudního drénu v opodstatněných případech je spojeno se zvýšením morbidity a délky hospitalizace a může vést ke zvýšení mortality pacientů s komplikovaným parapneumonickým výpotkem [52–54]. V případě nepurulentního výpotku bylo prokázáno, že pokud jsou přítomny biochemické známky infekce, zavedení HD zvyšuje šanci na zvládnutí sepse [6]. Obdobně, u pacienta s podezřením na rozvoj empyému, je pH < 7,2 v PV indikací k HD.
Vlastní proceduru se (obdobně jako pleurální aspirace) doporučuje provádět za aseptických podmínek pod kontrolou UZ. O volbě místa zavedení platí obdobné doporučení jako pro torakocentézu. Před definitivním zavedením drénu je vhodné provést ve zvoleném místě probatorní punkční aspiraci PV. U pacientů při vědomí je doporučováno užít lokálního anestetika (např. lidocain). Mezi nejčastější komplikace patří: selhání výkonu – chybná lokalizace drénu, bolest, intrapleurální infekce, dislokace a ucpání drénu. Je doporučováno několik základních technik zavedení HD, z nichž dominující je Seldingerova technika, kdy je cestou duté jehly zaveden vodicí drát (vodič) do pleurální dutiny. Vodič je směřován do apexu nebo na bázi pleurální dutiny. Následuje zavedení série dilatátorů o zvyšujícím se průměru přes stěnu hrudníku a nakonec inzerce HD pod mírným tlakem a jemně krouživým pohybem. Drén je nutné adekvátně fixovat ke kožnímu krytu. Doporučuje se tzv. technika omentální pásky (angl. omental tape technique), kdy je drén obkroužen náplastí a zavěšen v určité vzdálenosti od kůže. Smyslem tohoto uchycení je redukce rizika zalomení nebo nadměrného tahu v místě vstupu drénu [28].
Hrudní drény o malém průměru (10–14 F) mají menší množství komplikací a jejich použití je vyhovující i ve většině případů infekční pleuritidy. Bylo popsáno také úspěšné použití i menších drénů, tzv. pigtail katétrů (8,3 F), při evakuaci různých typů fluidotoraxu [55]. Jsou doporučeny pravidelné proplachy HD (20–30 ml fyziologického roztoku každých 6 hodin) k zamezení rizika blokády průchodnosti fibrinózním a buněčným detritem [6]. V případě chybné pozice drénu je možné se pokusit drén povytáhnou ke korekci polohy, ale není doporučeno drén posouvat dovnitř hrudníku vzhledem k riziku rozvoje infekce. V případě nekorigovatelné malpozice drénu je nutné zvážit redrenáž, která nesmí být prováděna kanálem po předchozím drénu.
Strategie odsávání PV při HD je obdobná jako u pleurální aspirace. Je několik typů drenážních systémů, nejčastěji používaný je jedno - až tříkomorový systém s využitím vodního zámku a možností aplikace kontinuálního nebo intermitentního podtlaku (obvykle -15 až -20 cm H2O). V současnosti jsou k dispozici také automatizované odsávací systémy (např. ThopazTM, ATMOS E 201 Thorax apod.), jejichž popis přesahuje záměr textu. Je nutné každodenní opakované sledování funkčnosti HD (průchodnost, množství odváděné tekutiny, lokální známky infekce apod.). Zrušení HD by mělo být zváženo v situaci, kdy množství drénované tekutiny klesne pod 200 ml za den [28].
Pleurodéza
Arteficiální sklerotizace pleurálních listů (pleurodéza) je používána především s paliativním záměrem při rekurentní maligním PV. Cílem je vyvolání sterilního zánětu a lokální aktivace prokoagulační aktivity obou listů pohrudnice a jejich následné slepení. Tím se dosahuje obliterace pleurální dutiny spojené s požadovaným zamezením tvorby PV. Po překonání průvodní symptomatologie akutní pleuritidy (febrilní stav, pleurální bolest) obvykle dochází ke zlepšení klinické symptomatologie a kvality života pacientů, zejména zmírnění dušnosti. Pleurodézu lze provést i mechanicky snesením pleury (abraze, pleurektomie) nebo chemicky. Standardně doporučovanou látkou, která je schopna efektivně vyvolat pleurodézu, je minerál talek (syn. mastek, klouzek, chem. Mg3Si4O10(OH)2). Používá se ve dvou formách, jako suspenze prášku a aerosol [50]. Procedura je někdy prováděna v rámci hrudního chirurgického výkonu. Z dalších látek, které se k pleurodéze používaly dříve, lze uvést tetracyklin (doxycyklin) a bleomycin.
ZÁVĚR
Základem péče o pacienty s pleurálním výpotkem je rychlé stanovení etiologie za použití minimálně invazivních vyšetřovacích postupů. To umožní zvýšit efektivitu terapie a vyvarovat se rizikových, pro pacienta nepříjemných a stresujících procedur, jako je např. opakovaná pleurální punkce nebo drenáž hrudníku.
Analýza pleurálního aspirátu má nesporný diagnostický význam a měla by se provádět vždy u první pleurální punkce. Zároveň by se měla opětovně zvážit při změně klinického stavu pacienta nebo jakékoliv diagnostické nejistotě.
Bed-side UZ vyšetření je v současnosti dominující a do budoucna perspektivní vyšetřovací metoda s komplexním využitím v intenzivní péči. Přináší zlepšení kvality péče o kriticky nemocné, je bezpečná, ekonomicky nenáročná a šetří čas ošetřujícího personálu.
Poděkování
Za poskytnutí některých obrázků autoři srdečně děkují primáři MUDr. Jiřímu Tesařovi a MUDr. Rastislavu Šimkovi, web: http://www.sonoatlas.cz/.
Adresa pro korespondenci:
MUDr. Jan Máca
Klinika anesteziologie, resuscitacea intenzivní medicíny FNO
17. listopadu 1790
708 52 Ostrava-Poruba
e-mail: jan.maca@fno.cz
Zdroje
1. Rand, I. D., Maskell, N. Introduction and methods: British Thoracic Society pleural disease guideline 2010. Torax, 2010, 65, Suppl 2, p. ii1–ii3.
2. Hooper, C., Lee, Y. C. G., Maskell, N. on behalf of the BTS Pleural Guideline Group Investigation of a unilateral pleural effusion in adults: British Thoracic Society pleural disease guideline 2010. Torax, 2010, 65, Suppl 2, p. ii4–ii17.
3. Sahn, S. A., Heffner, J. E. Pleural fluid analysis In: Light, R. W., Lee, Y. C. G. eds. Textbook of pleural diseases. 2nd edn. London: Arnold Press, 2008: p. 209–226.
4. Finley, C., Clifton, J., Fitzgerald, J. M. et al. Empyema: an increasing concern in Canada. Can. Respir. J., 2008, 15, p. 85–89.
5. Ferguson, A. D., Prescott, R. J., Selkon, J. B. et al. The clinical course and management of thoracic empyema. Q. J. Med., 1996, 89, p. 285–289.
6. Davies, H. E., Davies, R. J. O., Davies, C. W. H. on behalf of the BTS Pleural Disease Guideline Group Management of pleural infection in adults: British Thoracic Society pleural disease guideline 2010. Torax, 2010, 65, Suppl 2, p. ii41–ii53.
7. Maskell, N. A., Batt, S., Hedley, E. L. et al. The bacteriology of pleural infection by genetic and standard methods and its mortality significance. Am. J. Respir. Crit. Care Med., 2006, 174, p. 817–823.
8. Light, R. W., Girard, W. M., Jenkinson, S. G. et al. Parapneumonic effusions. Am. J. Med., 1980, 69, p. 507–512.
9. Wang, N. S. Anatomy of the pleura. Clin. Chest Med., 1998, 19, p. 229–240.
10. Yap, E., Anderson, G., Donald, J. et al. Pleural effusion in patients with pulmonary embolism. Respirology, 2008,13, p. 832–836.
11. http://www.pneumotox.com/pattern/view/31/V.a/pleural-effusion/
12. Blackmore, C. C., Black, W. C., Dallas, R. V. et al. Pleural fluid volume estimation: a chest radiograph prediction rule. Acad Radiol., 1996, 3, p. 103–109.
13. Ruskin, J. A., Gurney, J. W., Thorsen, M. K. et al. Detection of pleural effusions on supine chest radiographs. AJR Am. J. Roentgenol., 1987, 148, p. 681–683.
14. Waite, R. J., Carbonneau, R. J., Balikian, J. P. et al. Parietal pleural changes in empyema: appearances at CT. Radiology, 1990, 175, p. 145–150.
15. Lichtenstein, D. A. General ultrasound in the critically ill. 1st ed., 2005, Springer, p. 199. ISBN 978-3-540-26816-1.
16. Yousefifard, M., Baikpour, M., Ghelichkhani, P., Asady, H., Shahsavari Nia, K., Moghadas Jafari, A., Hosseini, M., Safari, S. Screening Performance Characteristic of Ultrasonography and Radiography in Detection of Pleural Effusion; a Meta-Analysis. Emerg. (Tehran), 2016, 4, 1, p. 1–10.
17. Eibenberger, K. L., Dock, W. I., Ammann, M. E. Quantification of pleural effusions: sonography versus radiography. Radiology, 1994, 191, p. 681–684.
18. Kohan, J. M., Poe, R. H., Israel, R. H. et al. Value of chest ultrasonography versus decubitus roentgenology for thoracentesis. Am. Rev. Respir. Dis., 1986, 133, p. 1124–1126.
19. O’Moore, P. V., Mueller, P. R., Simeone, J. F. et al. Sonographic guidance in diagnostic and therapeutic interventions in the pleural space. AJR Am. J. Roentgenol., 1987, 149, p. 1–5.
20. Barnes, T. W., Morgenthaler, T. I., Olson, E. J. et al. Sonographically guided thoracentesis and rate of pneumothorax. J. Clin. Ultrasound, 2005, 33, p. 442–446.
21. Hooper, C., Lee, Y. C. G., Maskell, N. on behalf of the BTS Pleural Guideline Group Investigation of a unilateral pleural effusion in adults: British Thoracic Society pleural disease guideline 2010. Torax, 2010, 65, Suppl 2, p. ii4–ii17. doi:10.1136/thx.2010.136978.
22. Expert Round Table on Ultrasound in ICU International expert statement on training standards for critical care ultrasonography. Intensive Care Med., 2011, 37, 7, p. 1077–1083. doi: 10.1007/s00134-011-2246-9. Epub 2011 May 26.
23. Lichtenstein, D., Mezière, G. The BLUE-points: three standardized points used in the BLUE-protocol for ultrasound assessment of the lung in acute respiratory failure. Crit. Ultrasound J., 2011, 4, p. 109–110. doi: 10.1007/s13089-011-0066-3.
24. Dietrich, C. F., Mathis, G., Cui, X. W., Ignee, A., Hocke, M., Hirche, T. O. Ultrasound of the pleurae and lungs. Ultrasound Med. Biol., 2015, 41, 2, p. 351–365. doi: 10.1016/j.ultrasmedbio.2014.10.002.
25. Balik, M., Plasil, P., Waldauf, P., Pazout, J., Fric, M., Otahal, M., Pachl, J. Ultrasound estimation of volume of pleural fluid in mechanically ventilated patients. Intensive Care Med., 2006, 32, 2, p. 318–321. Epub 2006 Jan 24.
26. Yang, P. C., Luh, K. T., Chang, D. et al. Value of sonography in determining the nature of pleural effusion: analysis of 320 cases. AJR Am. J. Roentgenol., 1992, 159, p. 29–33.
27. Chen, K. Y., Liaw, Y. S., Wang, H. C. et al. Sonographic septation: a useful prognostic indicator of acute thoracic empyema. J. Ultrasound Med., 2000, 19, 837e43. (2+). 77.
28. Himelman, R. B., Callen, P. W. The prognostic value of loculations in parapneumonic pleural effusions. Chest, 1986, 90, p. 852–856.
29. Havelock, T., Teoh, R., Laws, D., Gleeson, F. on behalf of the BTS Pleural Disease Guideline Group Pleural procedures and throracic ultrasound: British Thoracic Society pleural disease guideline 2010. Torax, 2010, 65, Suppl. 2, p. ii61–ii76.
30. Raptopoulos, V., Davis, L. M., Lee, G. et al. Factors affecting the development of pneumothorax associated with thoracentesis. AJR Am. J. Roentgenol., 1991, 156, p. 917–920.
31. Poe, R. H., Marin, M. G., Israel, R. H. et al. Utility of pleural fluid analysis in predicting tube thoracostomy/decortication in parapneumonic effusions. Chest, 1991, 100, p. 963–967.
32. Porcel, J. M., Light, R. W. Diagnostic approach to pleural effusion in adults. Am. Fam. Physician, 2006, 73, p. 1211–1220.
33. Ferrer, A., Osset, J., Alegre, J. et al. Prospective clinical and microbiological study of pleural effusions. Eur. J. Clin. Microbiol. Infect. Dis., 1999, 18, p. 237–241.
34. Light, R. W. Textbook of Pleural Diseases. 3rd ed. 1995, p633, Baltimore: Williams and Wilkins, ISBN 978-1-4822-2251-7.
35. Gotsman, I., Fridlender, Z., Meirovitz, A. et al. The evaluation of pleural effusions in patients with heart failure. Am. J. Med., 2001, 111, p. 375–378.
36. Romero-Candeira, S., Fernández, C., Martín, C., Sánchez-Paya, J., Hernández, L. Influence of diuretics on the concentration of proteins and other components of pleural transudates in patients with heart failure. Am. J. Med., 2001, 110, p. 681–686.
37. Romero-Candeira, S., Hernández, L. The separation of transudates and exudates with particular reference to the protein gradient. Curr. Opin. Pulm. Med., 2004, 10, p. 294–298.
38. Hann, C. H., Choi, J. E., Chung, J. H. Clinical utility of pleural fluid NT-pro Brain Natriuretic peptide (NT-proBNP) in patients with pleural effusions. Intern. Med., 2008, 47, p. 1669–1674.
39. Heffner, J. E., Brown, L. K., Barbieri, C. et al. Pleural fluid chemical analysis in parapneumonic effusions. A meta-analysis. Am. J. Respir. Crit. Care Med., 1995, 151, p. 1700–1708.
40. Rahman, N. M., Mishra, E. K., Davies, H. E. et al. Clinically important factors influencing the diagnostic measurement of pleural fluid pH and glucose. Am. J. Respir. Crit. Care Med., 2008,178, p. 483–490.
41. Cheng, D. S., Rodriguez, R. M., Rogers, J. et al. Comparison of pleural fluid pH values obtained using blood gas machine, pH meter, and pH indicator strip. Chest, 1998, 114, p. 1368–1372.
42. Pine, J. R., Hollman, J. L. Elevated pleural fluid pH in Proteus mirabilis empyema. Chest, 1983, 84, p. 109–111.
43. Sahn, S. A. Pathogenesis and clinical features of diseases associated with low pleural fluid glucose. In: Chretien, J., Bignon, J., Hirsch, A., eds. The pleural in health and disease. New York: Marcel Dekker, 1985, p. 267–285.
44. Joseph, J., Viney, S., Beck, P. et al. A prospective study of amylase-rich pleural effusions with special reference to amylase isoenzyme analysis. Chest, 1992, 102, p. 1455–1459.
45. Garcia-Pachon, E., Padilla-Navas, I. Urinothorax: case report and review of the literature with emphasis on biochemical diagnosis. Respiration, 2004, 71, p. 533–536.
46. Moon, J. N. Diagnostic tools of pleural effusion. Tuberc. Respir. Dis., 2014, 76, p. 199–210.
47. Martinez-Garcia, M. A., Cases-Viedma, E., Cordero-Rodriguez, P. J. et al. Diagnostic utility of eosinophils in the pleural fluid. Eur. Respir. J., 1999, 15, p. 166–169.
48. Garcia, L. The value of multiple fluid specimens in the cytological diagnosis of malignancy. Mod Pathol., 1994, 7, p. 665–668.
49. Blanc, F. X., Atassi, K., Bignon, J. et al. Diagnostic value of medical thoracoscopy in pleural disease: a 6-year retrospective study. Chest, 2002, 121, p. 1677–1683.
50. Tariq, S. M., Sadaf, T. Reexpansion pulmonary edema after treatment of pneumothorax. N. Engl. J. Med., 2006, 354, p. 204.
51. Roberts, M. E., Neville, E., Berrisford, R. G., Antunes, G., Ali, N. J. on behalf of the BTS Pleural Disease Guideline Group Management of a malignant pleural effusion: British Thoracic Society pleural disease guideline 2010. Torax, 2010, 65, Suppl. 2, p. ii32–ii40.
52. Tarver, R. D., Broderick, L. S., Conces, D. J. Jr. Reexpansion pulmonary edema. J. Thorac. Imaging, 1996, 11, p. 198–209.
53. Ashbaugh, D. G. Empyema thoracis. Factors influencing morbidity and mortality. Chest, 1991, 99, p. 1162–1165.
54. Galea, J. L., De Souza. A., Beggs, D. et al. The surgical management of empyema thoracis. J. R. Coll. Surg. Edinb., 1997, 42, p. 15–18.
55. LeMense, G. P., Strange, C., Sahn, S. A. Empyema thoracis. Therapeutic management and outcome. Chest, 1995, 107, p. 1532–1537.
56. Gammie, J. S., Banks, M. C., Fuhrman, C. R., Pham, S. M., Griffith, B. P., Keenan, R. J., Luketich, J. D. The pigtail catheter for pleural drainage: a less invasive alternative to tube thoracostomy. JSLS, 1999, 3, 1, p. 57–61.
Štítky
Anestéziológia a resuscitácia Intenzívna medicína
Článok vyšiel v časopiseAnesteziologie a intenzivní medicína
Najčítanejšie tento týždeň
2016 Číslo 3- Realita liečby bolesti v paliatívnej starostlivosti v Nemecku
- MUDr. Lenka Klimešová: Multiodborová vizita je kľúč k efektívnejšej perioperačnej liečbe chronickej bolesti
- Metamizol v liečbe pooperačnej bolesti u opioid-tolerantnej pacientky – kazuistika
- e-Konzilium.cz — Masivní plicní embolie při tromboembolické nemoci
- DESATORO PRE PRAX: Aktuálne odporúčanie ESPEN pre nutričný manažment u pacientov s COVID-19
-
Všetky články tohto čísla
- Editorial
- Antimykotická terapie na odděleních typu ARO/JIP v České republice: prospektivní observační studie
- Pleurální výpotek v intenzivní péči
- Poškodenie priedušnice ako následok punkčnej dilatačnej tracheostómie – kazuistiky a prehľad literatúry
- Pětapadesátiletý muž s trombocytopenií a život ohrožujícím difuzním alveolárním krvácením: kazuistika
- Lékař a trestní právo I – proces
- Echokardiografické vyšetření při onemocnění mitrální chlopně
- Úloha simulační medicíny v rozvoji anestezie a intenzivní medicíny
- Když srdce tančí paso doble
- Perioperační péče o pacienty s diabetes mellitus
-
Arytmie s vysokým rizikem tromboembolismu.
Fibrilace síní a flutter síní – častý mezioborový problém - Národní implementace konceptu „Enhanced Recovery after Surgery“ (ERAS) v České republice
- Anesteziologie a intenzivní medicína
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Pleurální výpotek v intenzivní péči
- Poškodenie priedušnice ako následok punkčnej dilatačnej tracheostómie – kazuistiky a prehľad literatúry
- Perioperační péče o pacienty s diabetes mellitus
- Echokardiografické vyšetření při onemocnění mitrální chlopně
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



