-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Extrakorporální membránová oxygenace a respirační selhání
Autoři: Martin Balík
Vyšlo v časopise: Anest. intenziv. Med., 25, 2014, č. 2, s. 78-79
Kategorie: Editorialy
Extrakorporální membránová oxygenace (ECMO) je v terapii respiračního selhání indikována většinou jako rescue při selhání standardních postupů. Indikací je kritické selhání oxygenace u těžkého ARDS (venovenózní ECMO), nebo u srdečního selhání v podobě náhrady plic a srdeční pumpy (venoarteriální nebo venoarteriovenózní ECMO). Další indikací je retence CO2 nebo potřeba snížení agresivity umělé plicní ventilace (UPV). Tento moderní koncept částečné nebo úplné eliminace vedlejších efektů UPV na plicní parenchym a pravou komoru srdeční je předmětem stávajících studií zkoumajících dopad na morbiditu a mortalitu pacientů [1, 2, 3]. Samostatnou kapitolou jsou v této indikaci pacienti na čekacím seznamu k plicní transplantaci, neboť stávající registry ukazují významně lepší přežití u transplantovaných spontánně ventilujících než u pacientů transplantovaných z UPV [4, 5]. Indikací k ECMO je též barotrauma a bronchopleurální komunikace, kde eliminace pozitivních inspiračních tlaků může být život zachraňující postup. Podobně je třeba myslet na možnosti ECMO u pacientů s obstrukcí trachey a velkých bronchů [6]. Zavedení ECMO u těchto pacientů umožní získat čas u pacienta zmírajícího na globální respirační selhání, mezitím může dojít k endoskopickému (stenting) nebo chirurgickému řešení stenózy a samozřejmě k její definitivní diagnostice.
V současnosti dochází k určitému posunu od konzervativní terapie těžkého respiračního selhání směrem k extrakorporálním technikám. Tento posun se v dosavadních studiích týká především indikace u těžkého ARDS. U pacientů léčených antivirotiky a antibiotiky, se zavedeným konceptem protektivní plicní ventilace a open lung concept, časně otáčených do pronační polohy, s optimalizovanou tekutinovou strategií a hemodynamikou jsou aplikovány ultrazvukem vedené drenážní techniky, terapeutická a/nebo diagnostická bronchoskopie, někdy recruitment s pomocí HFOV a v indikovaných případech i inhalovaný oxid dusnatý nebo prostacyklin. Přesto jsou tito pacienti vystavováni hypoxii, hyperkapnii a agresivnímu režimu plicní ventilace se všemi vedlejšími efekty na plicní parenchym, hemodynamiku a svalový aparát. Tento stav vede k vysoké JIP a nemocniční mortalitě a/nebo významně zhoršené kvalitě života v dlouhodobém horizontu, pokud pacient přežije. Četnost těchto stavů v populaci je v případě chřipkové epidemie cca 2–3 případy na 1 milion [7], v případě České republiky se tak v tomto kontextu jedná cca o 30 pacientů za sezonu.
Pokud je v této indikaci kontaktováno centrum poskytující ECMO terapii, které zajistí kanylaci v lokální nemocnici a transport do ECMO centra [8, 9], lze podle stávajících studií očekávat cca 20–50% zlepšení mortality a morbidity v 6měsíčním horizontu [10, 11] oproti pokračování v terapii bez ECMO. Důležitý je včasný kontakt ECMO centra a indikace k metodě do 5–7 dní agresivní UPV [7, 9, 10, 11, 12, 13]. Po zavedení venovenózního ECMO lze očekávat dobu pobytu na metodě s mediánem 8–9 dní, přežití na metodě u dvou třetin až tří čtvrtin pacientů, dlouhodobé přežití 55–60% a prakticky nelimitované přežití od třech měsíců po skončení ECMO terapie [7, 10, 11, 12, 13]. Z hlediska výběru metody bude u těchto pacientů ve více než 90 % indikováno venovenózní ECMO, u 4–10 % lze očekávat i z primární respirační indikace indikaci ke kanylaci arteriovenózní z důvodu současného selhávání levé nebo pravé komory srdeční [1, 13].
Kanylace sama je u venovenózního ECMO buď dvěma přístupy současně, tj. nasávací kanyla 22–24F via vena femoralis a návratová 18–22F do vena jugularis interna. Preferovanější možností je použití dvouluminové venózní kanyly via vena jugularis interna (Novaport® nebo Avalon Elitle®), která umožňuje dřívější mobilizaci pa-cienta a eventuální extubaci během ECMO terapie. V širší aplikaci venovenózních dvouluminových kanyl nás limituje jenom jejich cena, která je troj - až čtyřnásobně vyšší než „klasická” kanylace ze dvou přístupů. Samotná poloha kanyl(y) je verifikována echokardiograficky, s cílem omezit recirkulaci okysličené krve. Management UPV je u těchto pacientů po zavedení ECMO veden k ochraně plic a vyvarování se barotraumatu a volumotraumatu. Důležitou determinantou systémového DO2 a ventilace CO2 jsou vedle nastavení průtoku plynů a krve v přístroji i hemodynamika a srdeční výdej (CO) pacienta. Podíl průtoku krve ECMO a CO pacienta má vliv především na oxygenaci, eventuální manipulace s CO podáním betablokátoru má smysl především u hyperkinetické cirkulace v septickém šoku a u pacienta s vysokou BSA (obezita) [14, 15]. Zavedení extrakorporálního oběhu vyžaduje antikoagulační zajištění se všemi vedlejšími efekty. Heparinovou infuzi limitujeme 15 IU/kg . h, v některých případech lze po omezenou dobu provozovat ECMO bez antikoagulace [16, 17]. I přes pokrytí povrchu okruhu a oxygenátoru heparinem omezujícím srážení lze v závislosti na typu a kvalitě krevní pumpy očekávat vznik vedlejších efektů, jako jsou získaný von Willebrandův syndrom, trombocytopenie a hemolýza [1, 18]. Denní sonografické monitorování, zahrnující echokardiografii, hrudní sonografii, žilní sonografii s kontrolou polohy kanyl, považujeme za rutinní součást léčebného protokolu. Případné komplikace a léčba plicního selhání samotná vyžaduje stand by bronchoskopii 24 hodin denně.
Vedle venovenózního ECMO zajišťujícího oxygenaci i ventilaci byl vyvinut koncept arteriovenózního “pumpless extracorporeal lung assist (pECLA)”.Přístroj Novalung® měl za cíl pomoci řešit těžké selhání plic s převahou hyperkapnie a zachovanou funkcí srdce [19]. Jednalo se o arteriovenózní kanylaci 15F kanylami ve femorálních cévách a set s oxygenátorem cca o polovičním objemu a nižší potřebě antikoagulace oproti klasickému ECMO. Účinnost spočívala především v cca 50% eliminaci CO2, nicméně oxygenaci metoda zvyšovala jen cca o 10–20 %. Kontraindikací metody je vedle hypoxie též srdeční selhání a končetinová ischémie. Tato metoda znamenala však určitou změnu filosofie v léčbě selhání respiračního aparátu, neboť možnost snížení agresivity UPV při mimotělní eliminaci CO2 dělá z „kritického selhání“ relativní pojem. Do mimotělní eliminace byla postupně vložena peristaltická pumpa podobná pumpě na přístroji pro kontinuální náhradu funkce ledvin a tato „venovenózní respirační dialýza” již ztratila kontraindikaci srdečního selhání nebo končetinové ischémie, neboť je možno ji připojit po zavedení standardního high flux centrálního žilního 14F katétru [20, 21, 22]. Průtoky krve jsou nicméně cca 20–25násobně nižší než u klasického ECMO, což limituje významně oxygenaci. Eliminace CO2 souvisí s jeho volnou frakcí v plazmě a ta je ve vztahu k pH [23], lehká acidóza usnadňuje mimotělní „ventilaci”. Tento model „low flow ECMO” reprezentuje např. Decap® od firmy Hemodec. Problém s oxygenací řeší připojení jiného systému, tj. Novalung®, přes 18–22F venovenózní kanylu, např. Novaport® a zapojení s centrifugální magnetickou pumpou používanou u klasického ECMO. Dosahované průtoky krve se blíží klasickému ECMO a například systém ILA-Activve® umožňuje zajistit u kritického respiračního selhání i oxygenaci.
Vývoj konceptu eliminace CO2 vedl tedy od snížení agresivity UPV až k vyvarování se intubace, což má své opodstatnění např. u pacientů čekajících na plicní transplantaci, kde již při selhání NIV je indikován přechod k mimotělní eliminaci CO2 a oxygenaci. Metoda umožní prevenci sedace, plicního traumatu UPV, ventilátorových infektů, zhoršení funkce pravé komory a plicní hypertenze. V konečném důsledku to může znamenat zlepšení 6měsíční mortality u plicních transplantací až o 30 % [4, 5, 24]. Tato filozofie by měla své opodstatnění i u eliminace CO2 u kraniotraumat, nicméně studie umožňující hyperprotektivní ventilaci u ARDS nebyly dosud uzavřeny. Podobně není jednoznačný dopad tohoto postupu u chronické obstrukční choroby bronchopulmonální (COPD) [22, 24, 25].
V terapii kritického respiračního selhání vždy musíme vážit současnou znalost metodiky a studie potvrzující nebo vyvracející význam jejího použití v dané indikaci. I přes tendenci změkčit indikační kritéria k zavedení ECMO [26] nejsou prokázány krátkodobé ani dlouhodobé benefity u pacientů s mírným nebo středně závažným ARDS, stejně jako u COPD. Vedle medicínského zdůvodnění chybí u těchto „měkčích“ indikací i finanční analýza podporující smysluplnost nasazení výše uvedených mimotělních technik. Současný stav ověřených indikačních kritérií shrnuje tabulka 1.
Tab. 1. Indikace ke kontaktu ECMO centra a indikace k zavedení ECMO u respiračního selhání 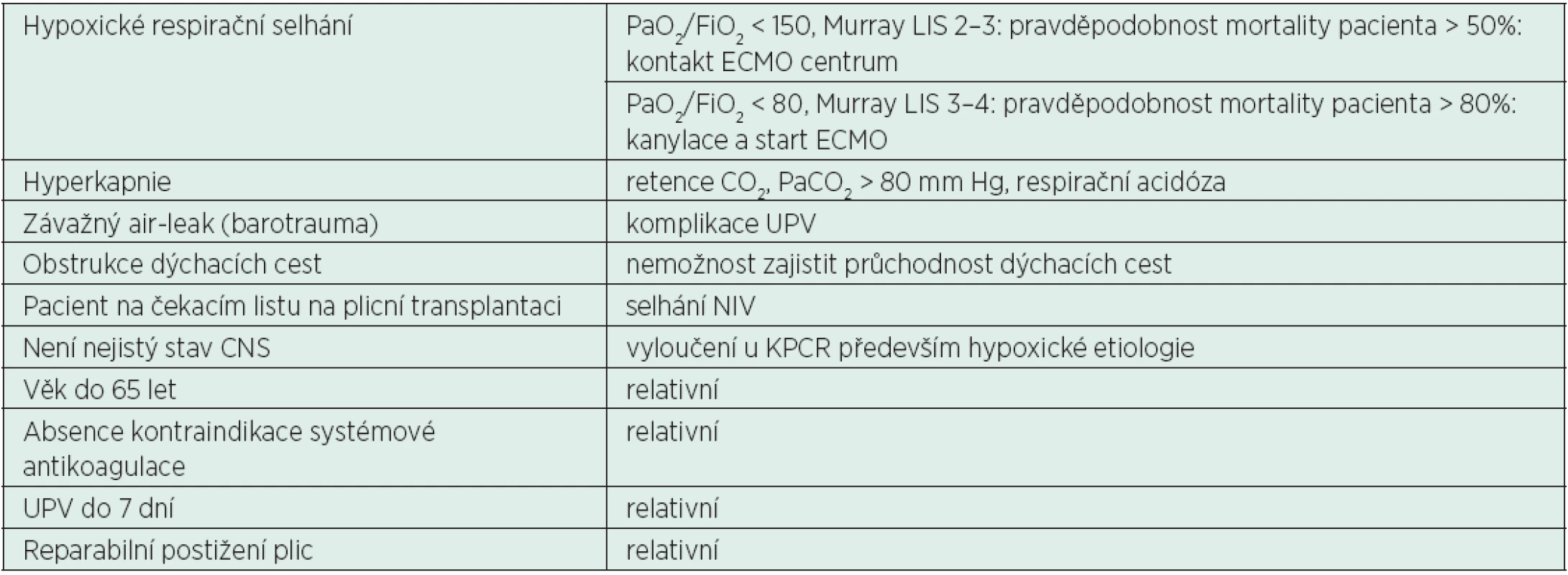
Autor deklaruje, že nemá střet zájmů v souvislosti s popisem produktů firem zmiňovaných v této publikaci.
Doc. MUDr. Martin Balík, Ph.D.
e-mail: martin.balik@vfn.cz
Zdroje
1. Sidebotham, D., Allen, S. J., McGeorge, A., Ibbott, N., Willcox, T.Venovenous Extracorporeal Membrane Oxygenation in Adults: Practical Aspects of Circuits, Cannulae, and Procedures. Journal of Cardiothoracic and Vascular Anesthesia, 2012, 26, p. 893–909.
2. Zangrillo, A., Biondi-Zoccai, G., Landoni, G., Frati, G., Patroniti, N., Pesenti, A., Pappalardo, F. Extracorporeal membrane oxygenation (ECMO) in patients with H1N1 influenza infection: a systematic review and meta-analysis including 8 studies and 266 patients receiving ECMO. Critical Care, 2013, 17:R30 doi:10.1186/cc12512.
3. McLaren, G., Combes, A., Bartlett, R. H. Contemporary extracorporeal membrane oxygenation for adult respiratory failure: life support in the new era. Intensive Care Med., 2012, 38, p. 210–220.
4. Fuehner, T., Kuehn, C., Hadem, J. et al. Extracorporeal membrane oxygenation in awake patients as bridge to lung transplantation. Am. J. Respir. Crit. Care Med., 2012, 185, p. 763–768.
5. Javidfar, J., Bacchetta, M. Bridge to lung transplantation with extracorporeal membrane oxygenation support. Curr. Opin. Organ.Transplant., 2012, 17, p. 496–502.
6. Willms, D. C., Mendez, R., Norman, V., Chammas, J. H. Emergency Bedside Extracorporeal Membrane Oxygenation for Rescue of Acute Tracheal Obstruction. Respir. Care, 2012, 57, p. 646–649.
7. Australia and New Zealand Extracorporeal Membrane Oxygenation (ANZ ECMO) Influenza Investigators: Extracorporeal Membrane Oxygenation for 2009 Influenza A(H1N1) Acute Respiratory Distress Syndrome. JAMA, 2009, 302, p. 1888–1895.
8. Forrest, P., Ratchford, J., Burns, B. et al. Retrieval of critically ill adults using extracorporeal membrane oxygenation: an Australian experience. Intensive Care Med., 2011, 37, p. 824–830.
9. Roch, A., Lepaul-Ercole, R., Grisoli, D. et al. Extracorporeal membrane oxygenation for severe influenza A (H1N1) acute respiratory distress syndrome: a prospective observational comparative study. Intensive Care Med., 2010, 36, p. 1899–1905.
10. Peek, G. J., Mugford, M., Tiruvoipati, R. et al. Efficacy and economic assessment of conventional ventilatory support versus extracorporeal membrane oxygenation for severe adult respiratory failure (CESAR): a multicentre randomised controlled trial. Lancet, 2009, 374, p. 1351–1363.
11. Noah, M. A., Peek, G. J., Finney, S. J. et al. Referral to an Extracorporeal Membrane Oxygenation Center and Mortality Among Patients With Severe 2009 Influenza A(H1N1). JAMA, 2011, 306, 15:doi:10.1001/jama.2011.1471.
12. Paden, M. L., Conrad, S. A., Rycus, P. T., Thiagarajan, R. R., ELSO Registry Extracorporeal Life Support Organization Registry Report 2012. ASAIO J, 2013, 59, 3, p. 202–210, doi: 10.1097/MAT.0b013e3182904a52.
13. Patroniti, N., Zangrillo, A., Pappalardo, F. et al. The Italian ECMO network experience during the 2009 influenza A(H1N1) pandemic: preparation for severe respiratory emergency outbreaks.Intensive Care Med., 2011, 37, p. 1447–1457.
14. Guarracino, F., Zangrillo, A., Ruggeri, L. et al. Blockers to Optimize Peripheral Oxygenation During Extracorporeal Membrane Oxygenation: A Case Series. J. Cardiothoracic Vasc. Anaesth., 2012, 26, p. 58–63.
15. Balik, M., Rulisek, J., Leden, P. et al. Concomitant use of beta-1 adrenoreceptor blocker and norepinephrine in patients with septic shock. Wiener Klinische Wochenschrift, 2012, 124 (15–16), p. 552–556.
16. Arlt, M., Philipp, A., Voelkel, S. Extracorporeal membrane oxygenation in severe trauma patients with bleeding shock. Resuscitation, 2010, 81, p. 804–809.
17. Ried, M., Bein, T., Philipp, A. Extracorporeal lung support in trauma patients with severe chest injury and acute lung failure: a 10-year institutional experience. Critical Care, 2013, 17:R110.
18. Heilmann, C., Geisen, U., Beyersdorf, F. et al. Acquired von Willebrand syndrome in patients with extracorporeal life support (ECLS). Intensive Care Med., 2012, 38, p. 62–68.
19. Bein, T., Scherer, M. N., Philipp, A., Weber, F., Woertgen, C. Pumpless Extracorporeal Lung Assist (pECLA) in Patients With Acute Respiratory Distress Syndrome and Severe Brain Injury.J. Trauma, 2005, 58, p. 1294–1297.
20. Batchinsky, A. I., Jordan, B. S., Regn, D., Necsoiu, C., Federspiel, W. J., Morris, M. J., Cancio, L. C. Respiratory dialysis: Reduction in dependence on mechanical ventilation by venovenous extracorporeal CO2 removal. Crit. Care Med., 2011, 39, p. 1382–1387.
21. Livigni, S., Maio, M., Ferretti, E. et al. Efficacy and safety of a low-flow veno-venous carbon dioxide removal device: results of an experimental study in adult sheep. Critical Care, 2006, 10:R151 (doi:10.1186/cc5082).
22. Terragni, P. P., Del Sorbo, L., Mascia, L. et al. Tidal Volume Lower than 6 ml/kg Enhances Lung Protection. Anesthesiology, 2009, 111, p. 826–835.
23. Zanella, A., Patroniti, N., Isgro, S. et al. Blood acidification enhances carbon dioxide removal of membrane lung: an experimental study. Intensive Care Med., 2009, 35, p. 1484–1487.
24. Kluge, S., Braune, S. A., Engel, M. et al. Avoiding invasive mechanical ventilation by extracorporeal carbon dioxide removal in patients failing noninvasive ventilation. Intensive Care Med., 2012, 38, p. 1632–1639.
25. Burki, N. K., Mani, R. K., Herth, F. J. A Novel Extracorporeal CO2 Removal System. Results of a Pilot Study of Hypercapnic Respiratory Failure in Patients with COPD. Chest, 2013, 143, p. 678–686.
26. Stibor, B., Schwameis, F. Metody mimotělní oxygenace a eliminace CO2 určené primárně k náhradě plicních funkcí. Anest. intenziv. Med., 2014, 25, č. 2, s. 98–106.
Štítky
Anestéziológia a resuscitácia Intenzívna medicína
Článek Acidobazická rovnováhaČlánek XX. kongres ČSARIM Brno 2013Článek Oceněné práce 2013Článek Kongresy a konferenceČlánek Právo, etika, náš obor a my
Článok vyšiel v časopiseAnesteziologie a intenzivní medicína
Najčítanejšie tento týždeň
2014 Číslo 2- Realita liečby bolesti v paliatívnej starostlivosti v Nemecku
- MUDr. Lenka Klimešová: Multiodborová vizita je kľúč k efektívnejšej perioperačnej liečbe chronickej bolesti
- Metamizol v liečbe pooperačnej bolesti u opioid-tolerantnej pacientky – kazuistika
- e-Konzilium.cz — Masivní plicní embolie při tromboembolické nemoci
- DESATORO PRE PRAX: Aktuálne odporúčanie ESPEN pre nutričný manažment u pacientov s COVID-19
-
Všetky články tohto čísla
- Statické a dynamické testy v řízení volumoterapie
- Ultrazvukové vyšetření aorty v urgentní medicíně
- Současné postupy v porodnické anestezii IV. – anesteziologické komplikace u císařského řezu
- Acidobazická rovnováha
- Mozková (mikro)cirkulace – základní struktura a funkce
- iNO a ARDS: Vyšetřování skončilo, zapomeňme!
-
The Canadian Critical Care Nutrition Guidelines in 2013
An Update on Current Recommendationsand Implementation Strategies - Doporučený postup před odběrem orgánů od zemřelých dárcůpo nevratné zástavě oběhu
- Pojem standardu péče v kontextu reformních změn
-
XX. kongres ČSARIM
Brno 2013 - MUDr. Peter Gašparec (14. 12. 1951 – 29. 11. 2013)
- Zemřel emeritní primář MUDr. Jiří Brabec (31. 8. 1925 – 19. 2. 2014)
- European Association of Cardiothoracic Anaesthesiologists v roce 2014
- Oceněné práce 2013
- Jubilejní XX. kongres České společnosti anesteziologie, resuscitace a intenzivní medicíny
- Kongresy a konference
- Stanovisko výboru ČSARIM k návrhu rozsahu požadovaných kompetencí v ultrazvukových metodách pro lékaře oboru Anesteziologiea intenzivní medicína
- Zamyšlení nad XX. kongresem ČSARIM v Brně
- Extrakorporální membránová oxygenace a respirační selhání
- Právo, etika, náš obor a my
- Fast-track není jen fyziologická anestezie
- Hodnoty diference silných iontů (SID) u kriticky nemocných pacientů s normálními hodnotami arteriálního pH, pCO2, BE a HCO3-a jejich vliv na mortalitu
- Metody mimotělní oxygenacea eliminace CO2 určené primárně k náhradě plicních funkcí
- Anesteziologie a intenzivní medicína
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Acidobazická rovnováha
- Statické a dynamické testy v řízení volumoterapie
- Současné postupy v porodnické anestezii IV. – anesteziologické komplikace u císařského řezu
- Extrakorporální membránová oxygenace a respirační selhání
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



