-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Necílená biopsie pleury v diagnostice maligního pleurálního výpotku – naše zkušenosti za posledních 15 let
Closed pleural biopsy in the diagnostics of malignant pleural involvement
Introduction:
Pleural effusion is a frequent reason for a pulmonologist´s investigation. The cornerstone is to distinguish transudative pleural effusion from exudative pleural effusion. In the case of the exudative pleural effusion the next step is detection of malignant etiology of pleural effusion. We have a variety of any non-invasive or invasive examinations. The pleural biopsy is one of the most important methods for diagnostics of malignant pleural effusion.Material and methods:
Two hundred and twenty-two closed pleural biopsies (CPB) were performed in 208 patients with pleural effusion, where the cytologic examination of pleural fluid was negative. The authors evaluated the value of CPB for the diagnosis of malignant pleural involvement.Results and conclusion:
Total sensitivity, specificity, accuracy, positive predictive value and negative predictive value were 63.1 %, 100 %, 73.9 %, 100 % and 52.8 %, but in the group of mesotheliomas these results were 59.1 %, 100 %, 79.4 %, 100 % and 70.7 %. The incidence of complications and representative sampling of the pleura was mentioned. The authors compared the diagnostic value and the incidence of complications of various diagnostic methods in malignant pleural involvement by data in the literature.Key words:
closed pleural biopsy – diagnostic methods – histological diagnosis – malignant pleural involvement – pleural effusion
Autoři: Petr Jakubec 1; Vítězslav Kolek 1; Aleš Václavík 1; Jaromír Zatloukal 1; Stanislav Losse 1; Ladislava Kučerová 2; Tomáš Tichý 2; Kateřina Musilová 2
Působiště autorů: Klinika plicních nemocí a tuberkulózy LF UP a FN Olomouc, přednosta prof. MUDr. Vítězslav Kolek, DrSc. 1; Ústav klinické a molekulární patologie LF UP a FN Olomouc, přednosta prof. MUDr. Zdeněk Kolář, CSc. 2
Vyšlo v časopise: Vnitř Lék 2014; 60(5-6): 423-430
Kategorie: Původní práce
Souhrn
Úvod:
Pleurální výpotek je častým důvodem pneumologického vyšetření. Zásadním krokem je odlišení transsudátu od exsudátu. V případě exsudativního pleurálního výpotku je dalším krokem zjištění možné maligní příčiny výpotku. Existuje velké množství různých neinvazivních i invazivních vyšetřovacích metod. Jednou z nejdůležitějších metod k určení maligního pleurálního výpotku je biopsie pleury.Materiál a metoda:
Bylo provedeno 222 necílených biopsií pleury u 208 pacientů s pleurálním výpotkem, u kterých bylo negativní cytologické vyšetření hrudního punktátu. Byl hodnocen přínos vyšetření pro diagnózu maligního postižení pleury.Výsledky a závěry:
Senzitivita, specificita, přesnost, pozitivní prediktivní hodnota a negativní hodnota u maligních postižení pleury celkem byla 63,1 %, 100 %, 73,9 %, 100 % a 52,8 % případů, ale ve skupině mezoteliomů byly výsledky 59,1 %, 100 %, 79,4 %, 100 % a 70,7 %. Byl uveden výskyt komplikací a reprezentativního odběru vzorku pleury. Byly srovnány diagnostický přínos a výskyt komplikací různých vyšetřovacích metod u maligního postižení pleury dle údajů v literatuře.Klíčová slova:
histologická diagnóza – maligní postižení pleury – necílená biopsie pleury – pleurální výpotek – vyšetřovací metodyÚvod
Pleurální výpotek je jeden z velmi častých stavů, s kterými se všeobecní internisté, ale i lékaři různých specializací v rámci vnitřního lékařství ve své praxi setkávají. Jeho incidence je udávána celosvětově na 300 případů/100 000 obyvatel [1,2]. Marel et al odhadují incidenci v České republice na 320 případů/100 000 obyvatel [3]. V USA je incidence pleurálního výpotku odhadována na 1 000 000–1 500 000 případů [4–6]. Spektrum příčin pohrudničního výpotku je široké a zahrnuje mimo primární postižení respiračního systému příčiny kardiovaskulární, gastroenterologické, renální, endokrinní, gynekologické, metabolické, iatrogenní a traumatické.
Zásadní otázkou v diagnostice pleurálního výpotku je, zda se jedná o transsudát či exsudát. Podle toho se odvíjí další diagnostický a léčebný postup.
Transsudát je vyvolán změnou tlakových poměrů na úrovni kapilár, které vedou k vyššímu průniku tekutiny z cév, a v naprosté většině případů je způsoben systémovými příčinami. Jeho typickým představitelem je výpotek při srdečním selhání.
Exsudát je naproti tomu zapříčiněn lokální poruchou rovnováhy mezi tvorbou a vstřebáváním pleurální tekutiny a je přítomen u primárních postižení pleury a plic, jako jsou malignity, záněty a další. V dnešní době se k odlišení těchto 2 skupin výpotků používají 3 tzv. Lightova kritéria, která zavedli do praxe Light et al v roce 1972 (tab. 1). Pokud z nich byla aspoň jedna hodnota pozitivní, jednalo se o exsudát. Tato kritéria prokázala výbornou 98–99,5% senzitivitu u exsudátů [7,8]. Bohužel nižší je jejich specificita, a proto je část transsudátů hodnoceno jako exsudáty (tzv. pseudoexsudát). Jedná se přibližně o 20 % výpotků při kardiálním selhání léčených diuretiky. Proto byla zavedena tzv. pomocná kritéria (tab. 2), která v těchto případech výrazně zpřesnila diagnostiku [9–13].
Tab. 1. Lightova kritéria exsudátu 
Tab. 2. Pomocná kritéria exsudátu 
Z hlediska četnosti je v populaci v České republice nejčastějším typem výpotku kardiální transsudát (65,46 %), dále maligní výpotek (31,22 %), výpotek u nespecifických zánětů (24,17 %) a výpotek při plicní embolizaci (8,56 %) [14]. V USA je dle Lighta nejčetnější kardiální výpotek, okolo 1/3 všech případů, zánětlivých výpotku je asi 20 %, maligních výpotků asi 15 % a výpotků při plicní embolii asi 10 % [15]. Na pneumologických pracovištích jednoznačně převažuje výpotek maligní v 63 % případů, ve velkém odstupu pak následují výpotky parapneumonické (včetně empyému) v 19 % případů, tuberkulózní v 6 % případů, kardiální v 3,5 % případů a traumatické v 3 % případů [16]. Bohužel i po podrobném vyšetřování zůstává 5–15 % výpotků klasifikováno jako výpotky nejasné etiologie [17].
V případě exsudativního pleurálního výpotku je dalším důležitým krokem zjištění, zda se jedná o nález benigní či maligní. Malignita je nejčastější příčinou exsudativního pleurálního výpotku u lidí starších 60 let [18]. Nejčastějším nádorem metastazujícím na pleuru je u mužů karcinom plic a u žen karcinom prsu [19]. V procentuálním zastoupení je na prvním místě karcinom plic ve 38 % případů, následovaný karcinomem prsu v 17 % případů, lymfomy ve 12 % případů, karcinomy urogenitálního traktu v 9 % případů a karcinomy gastrointestinálního traktu ve 4 % případů [20,21]. U 7–15 % maligních pleurálních výpotků se vyšetřováním nepodaří zjistit primární nádor [22]. Medián přežití od stanovení diagnózy se pohybuje mezi 3–12 měsíci a závisí na histologickém typu a stadiu maligního onemocnění. Nejkratší přežití mají maligní výpotky u bronchogenního karcinomu, zatímco nejdelší přežití je u primárního karcinomu ovaria. Doba přežití u maligních výpotků při neznámém primárním tumoru se pohybuje mezi 6–9 měsíci [23,24].
V diagnostice maligních pleurálních výpotků se uplatňují mimo základní postupy (anamnéza, fyzikální vyšetření) také zobrazovací metody (skiagram hrudníku ve dvou projekcích, ultrasonografie – USG, výpočetní tomografie – CT, zobrazení magnetickou rezonancí – MRI, pozitronová emisní tomografie – PET), vyšetření tumormarkerů a dalších specifických biomarkerů v séru nebo plazmě, komplexní vyšetření hrudního punktátu (z hlediska možné malignity zvláště cytologie, nověji imunohistochemické metody, elektronová mikroskopie) a metody invazivní – necílená biopsie pleury (NBP), cílená biopsie pleury (pod USG nebo CT), pleurální brushing, pleuroskopie, torakoskopie a bronchoskopie [25].
Necílená biopsie pleury (NBP) jako vyšetřovací metoda pleurálních výpotků má na našem pracovišti dlouholetou tradici a patří mezi rutinně prováděné výkony. Proto jsme vyhodnotili naše výsledky této metody tímto vyšetřením za dobu posledních 15 let se zřetelem na maligní etiologii pleurálního výpotku.
Soubor a metodika
Do souboru byli zařazeni pacienti vyšetřovaní pro pleurální výpotek, u nichž byla v letech 1998–2013 provedena necílená biopsie pleury (obr. 1, 2 a 3). Byli to všichni pacienti, u kterých podrobné vyšetření klinické a laboratorní, vyšetření zobrazovacími metodami a komplexní vyšetření pleurálního punktátu včetně opakovaného cytologického vyšetření nevedlo k diagnóze pleurálního výpotku a pacienti neměli kontraindikace výkonu či jejich celkový stav provedení tohoto vyšetření nevylučoval. Jednalo se o 208 pacientů, z toho 130 mužů (62,5 %) a 78 žen (37,5 %). Věkové rozmezí pacientů se pohybovalo mezi 24–88 lety (tab. 3). Celkem bylo provedeno 222 NBP (u 14 pacientů bylo provedeno vyšetření 2krát), z toho bylo pravostranných 121 (54,5 %) a levostranných 101 (45,5 %). NBP byla vždy provedena při hospitalizaci a před výkonem byla odebrána cílená anamnéza krvácivých projevů a vyšetřen krevní obraz a základní koagulační parametry (Quickův test, aPTT). K vyšetření jsme použili Copeho jehlu (obr. 4). Pod skiaskopickou kontrolou bylo označeno vhodné místo k provedení biopsie. Po lokální anestezii byla provedena malá incize k usnadnění vstupu jehly. Potom byl do pleurální dutiny zaveden trokar s punkční jehlou, která byla následně vyměněna za bioptickou jehlu. Pak byl trokar i s bioptickou jehlou pomalu tažen směrem ven z hrudníku až do okamžiku, kdy přestala odtékat pleurální tekutina. To je okamžik, kdy se předpokládá, že je konec jehly právě v parietální pleuře. Tangenciálním, rychlým a zpětným pohybem jehly byl získán bioptický vzorek. Při každém vyšetření byly odebrány 2–4 vzorky, které byly fixovány ve formalínu, standardně zpracovány, nabarveny a zaslány k histologickému hodnocení. Následně byly hodnoceny patologickým anatomem. Do 4 hodin po NBP byl proveden zadopřední skiagram hrudníku k vyloučení pneumotoraxu, při potížích pak ihned.
Obr. 1. Maligní fluidotorax vlevo 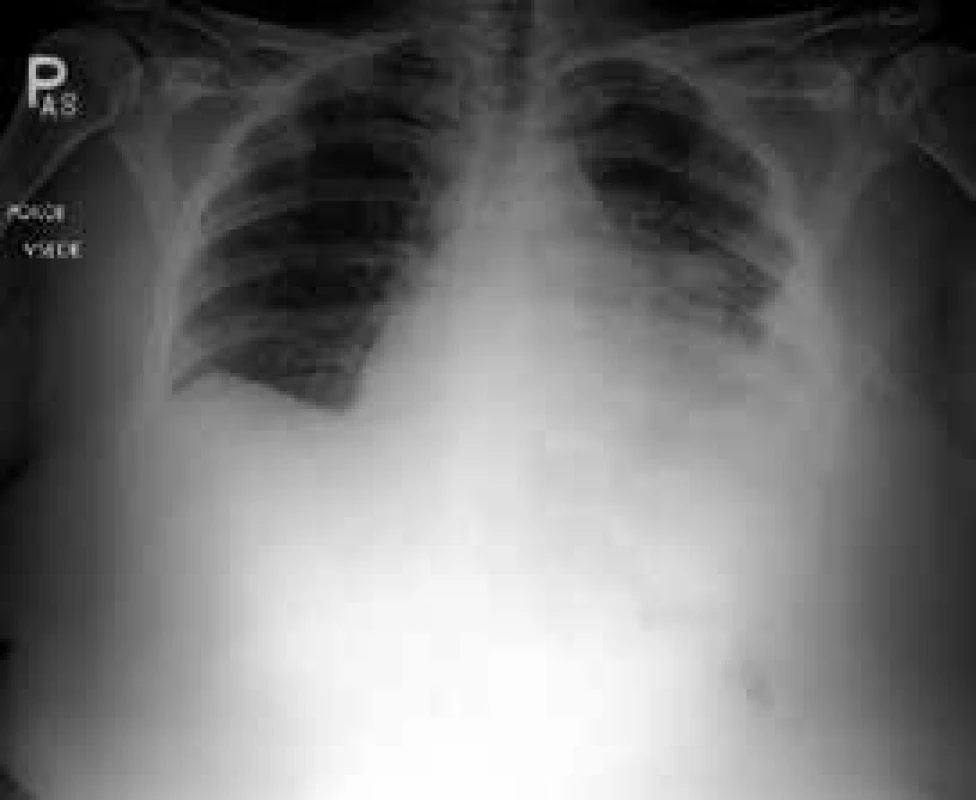
Obr. 2. Maligní mezoteliom vpravo 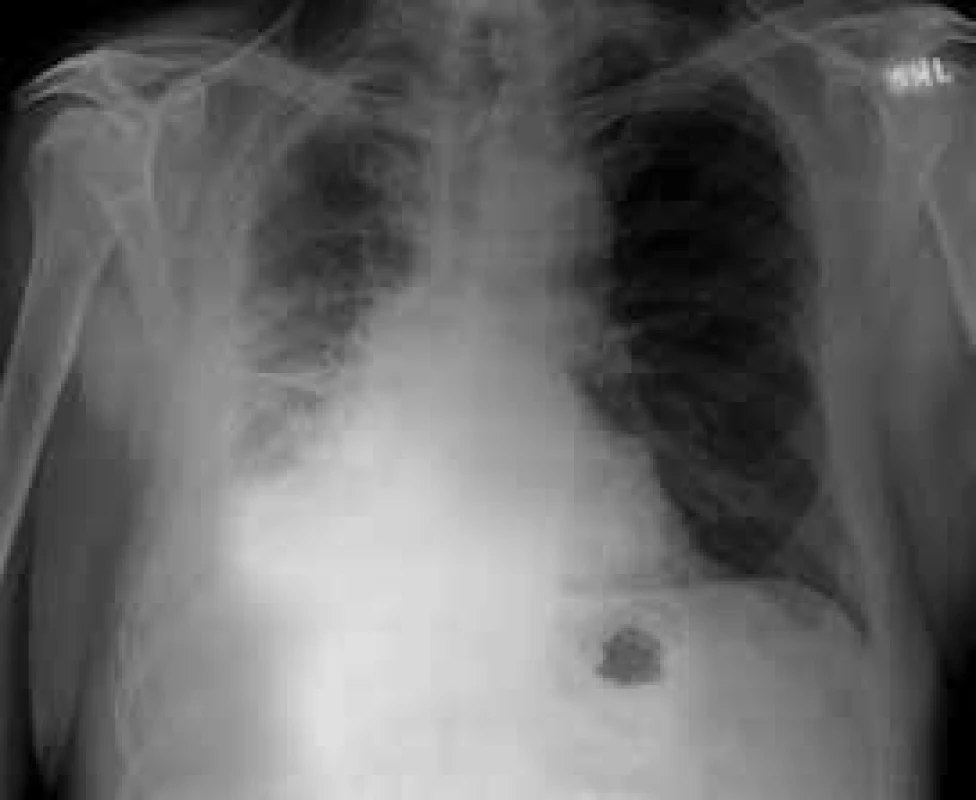
Obr. 3. Tuberkulózní pleuritida vpravo 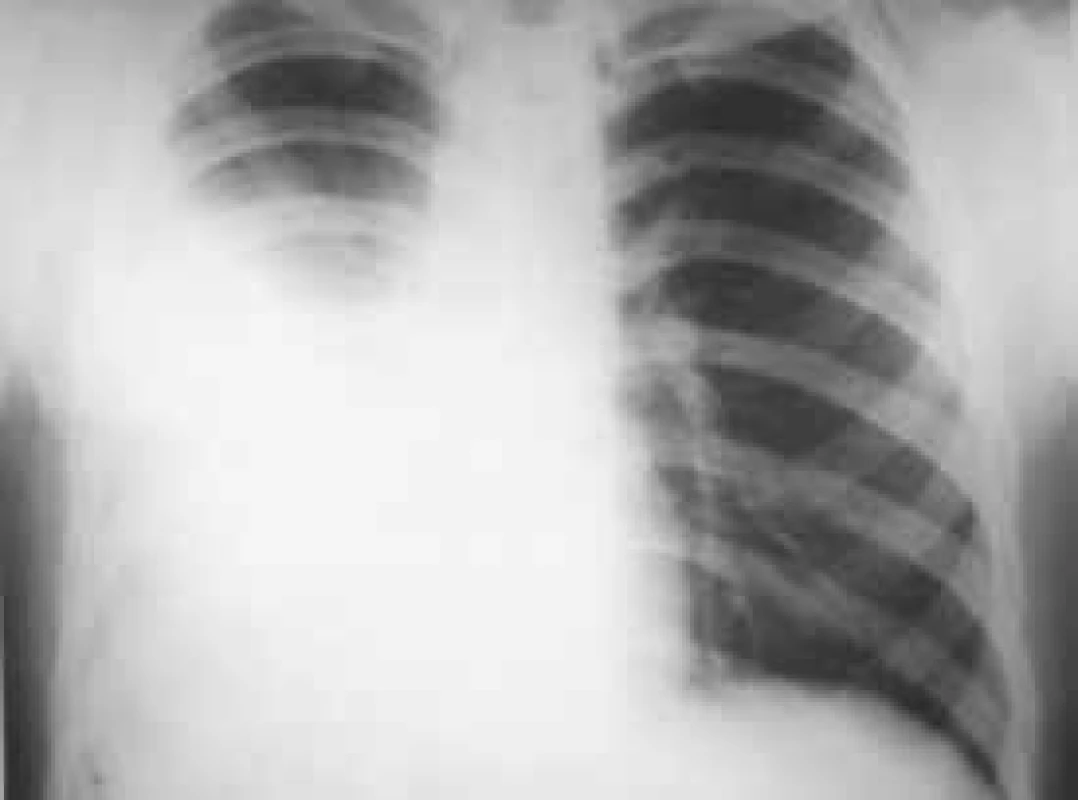
Tab. 3. Soubor pacientů s provedenou NBP 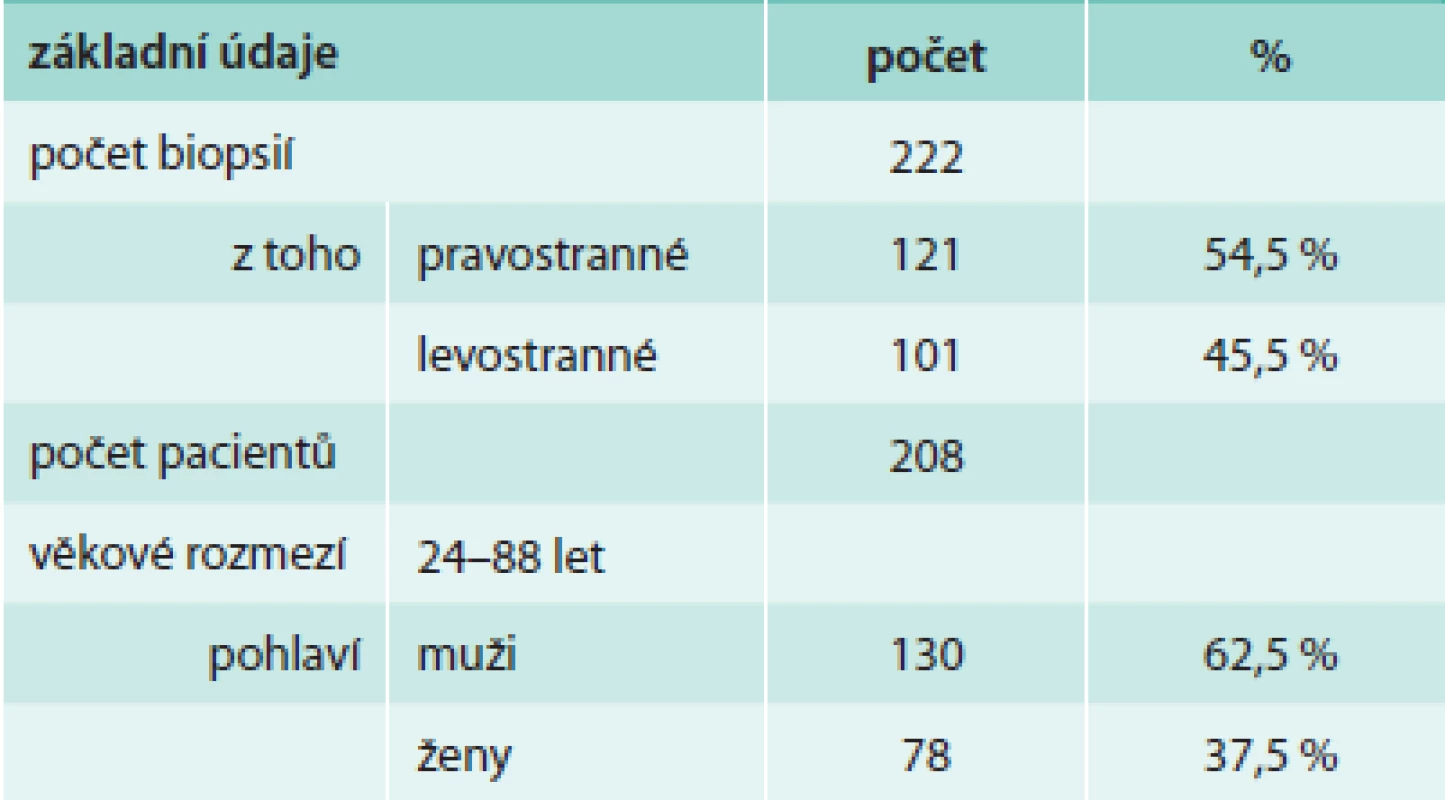
Obr. 4. Bioptická jehla k biopsii pleury 
Histologické nálezy z NBP jsme hodnotili v souvislosti s definitivní diagnózou onemocnění. Jako pozitivní byly hodnoceny NBP s nálezem maligní tkáně. Histologické nálezy NBP, u nichž nebyly nalezeny maligní buňky (včetně histologicky nepřínosných NBP bez získané tkáně pleury či s příliš malým množstvím materiálu), byly zařazeny do skupiny nálezů negativních. Tato skupina se pak dělila na podskupinu nálezů falešně negativních, u nichž se jinými vyšetřeními prokázala maligní etiologie nemoci, a podskupinu správně negativních, u nichž se jednalo o jiné onemocnění než malignitu. Ze získaných výsledků jsme zjistili senzitivitu, specificitu, přesnost, pozitivní prediktivní hodnotu a negativní prediktivní hodnotu NPB vzhledem k malignímu postižení pleury, a to celkově a ve skupině mezoteliomů. Také jsme hodnotili výskyt komplikací a výtěžnost odběru (získání adekvátního bioptického vzorku k histologickému vyšetření).
Výsledky
Z hlediska diagnózy maligního postižení pleury bylo pozitivních 99 biopsií (44,6 %), tab. 4. Z toho se jednalo histologicky v 39 případech o mezoteliom (17,6 %), ve 46 případech o bronchogenní karcinom (20,7 %) a v 14 případech o jiné nádorové postižení (6,3 %). Negativní nález byl zjištěn ve 123 případech (55,4 %), tab. 5. Správně negativní výsledek byl nalezen v 65 případech (29,3 %) a u těchto případů se jednalo o různá nenádorová postižení pohrudnice. Falešně negativních bylo 58 biopsií (26,1 %). Dalším vyšetřováním pak byla definitivní diagnóza postižení pleury určena jako mezoteliom v 27 případech (12,2 %), bronchogenní karcinom v 13 případech (9,0 %) a jiné nádorové postižení v 11 případech (4,9 %). Senzitivita, specificita, přesnost, pozitivní prediktivní hodnota a negativní hodnota u maligních postižení pleury celkem byla 63,1 %, 100 %, 73,9 %, 100 % a 52,8 % případů, ve skupině mezoteliomů byly výsledky 59,1 %, 100 %, 79,4 %, 100 % a 70,7 % (tab. 6). Ke komplikacím došlo u 22 biopsií (9,9 %), tab. 7. Z toho se ve 3 případech jednalo o vazovagální synkopu, ve 2 případech o hematom v hrudní stěně. Nejčastější komplikací byl pneumotorax, který se objevil u 17 pacientů (7,7 %), v 9 případech (4,1 %) bylo nutné zavést hrudní drenáž. Histologicky nepřínosnou biopsii (tedy bez získané tkáně pleury či s příliš malým množstvím materiálu) reprezentovalo 14 případů (6,3 %), v 11 případech nebyla ve vzorku přítomna pleurální tkáň, ve 3 případech bylo získáno příliš malé množství materiálu (tab. 8).
Tab. 4. Histologicky pozitivní nálezy maligního postižení pleury u NBP 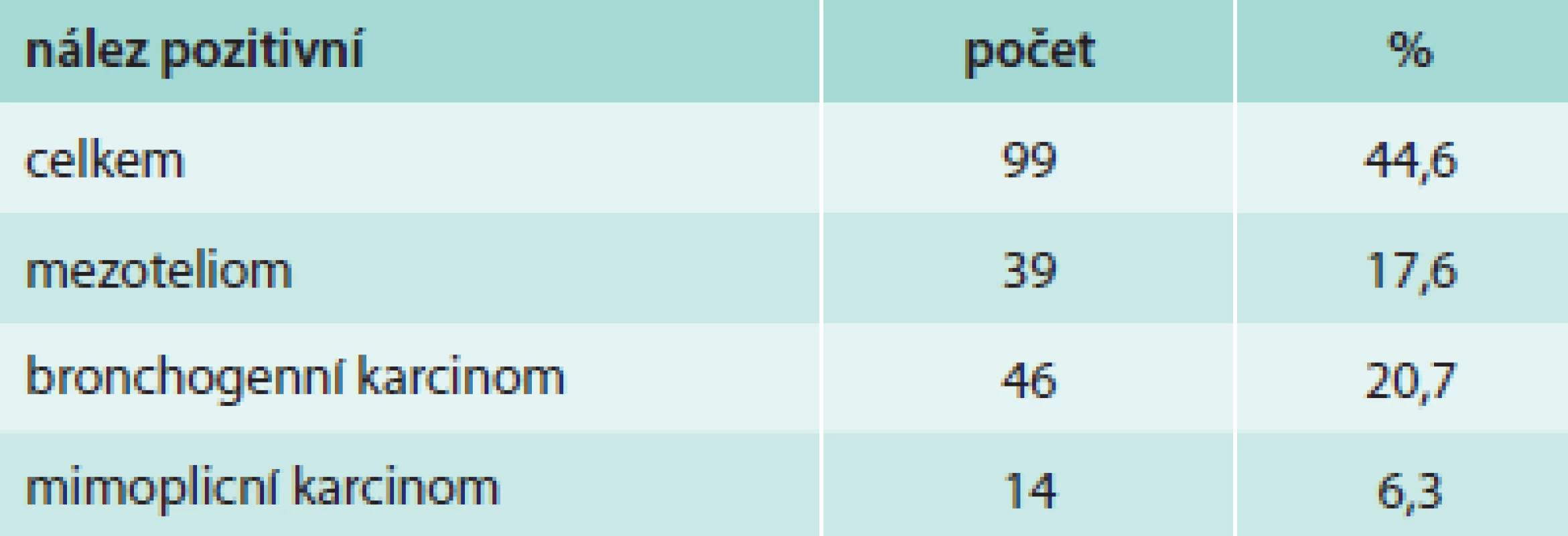
Tab. 5. Histologicky negativní nálezy maligního postižení pleury u NBP 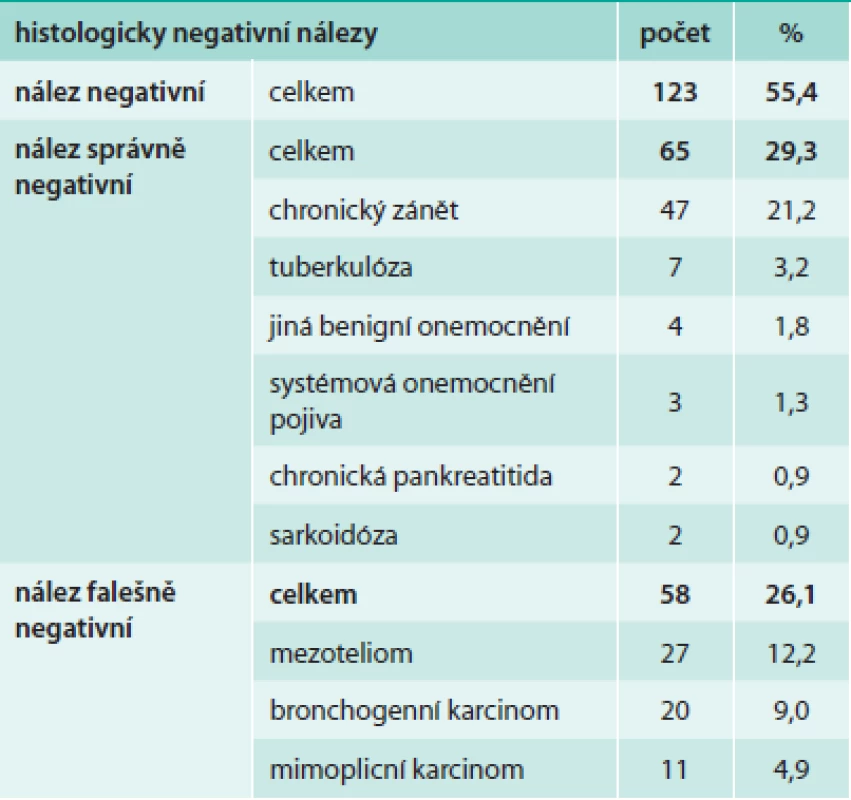
Tab. 6. Senzitivita, specificita, pozitivní prediktivní hodnota a negativní prediktivní hodnota NPB u maligního postižení pleury – celkově a ve skupině mezoteliomů 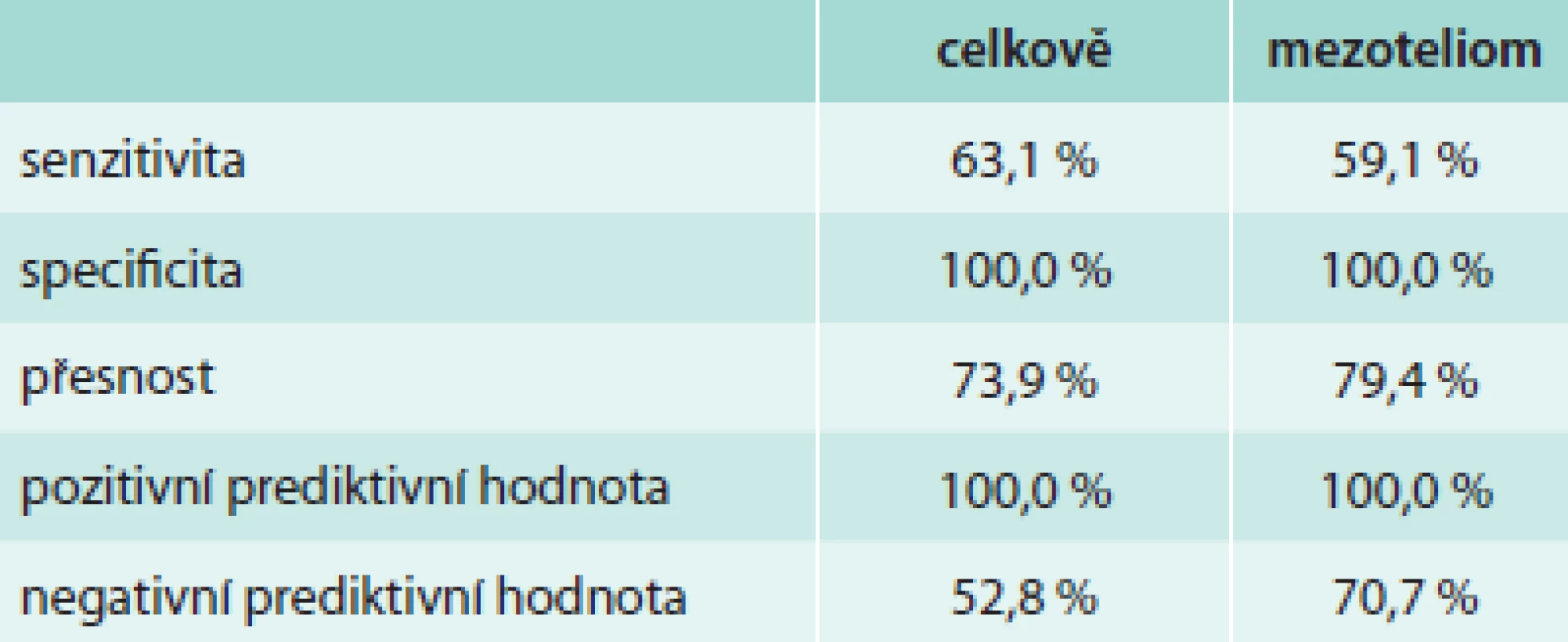
Tab. 7. Výskyt a četnost komplikací NBP 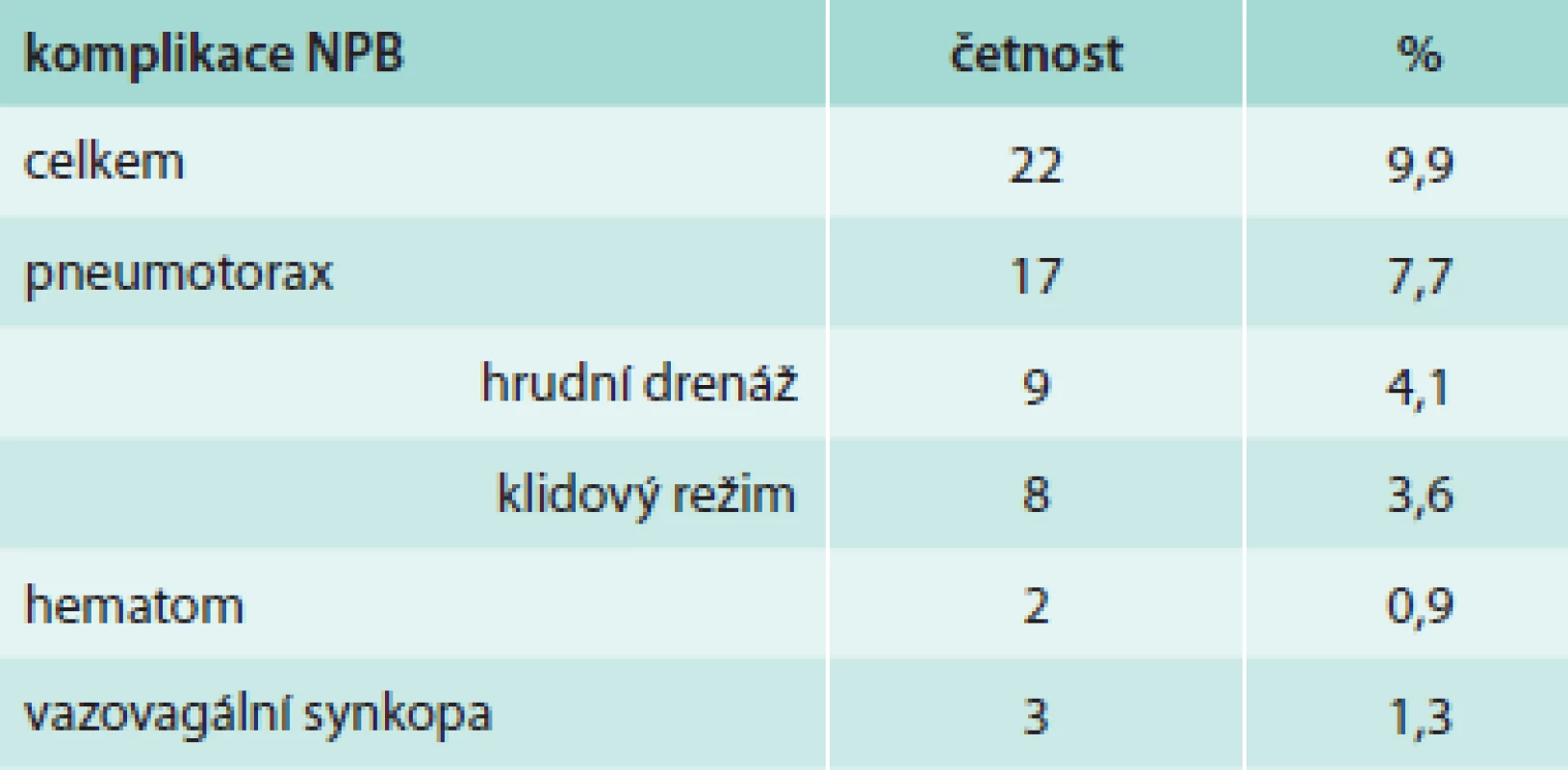
Tab. 8. Reprezentativnost odběru při NPB 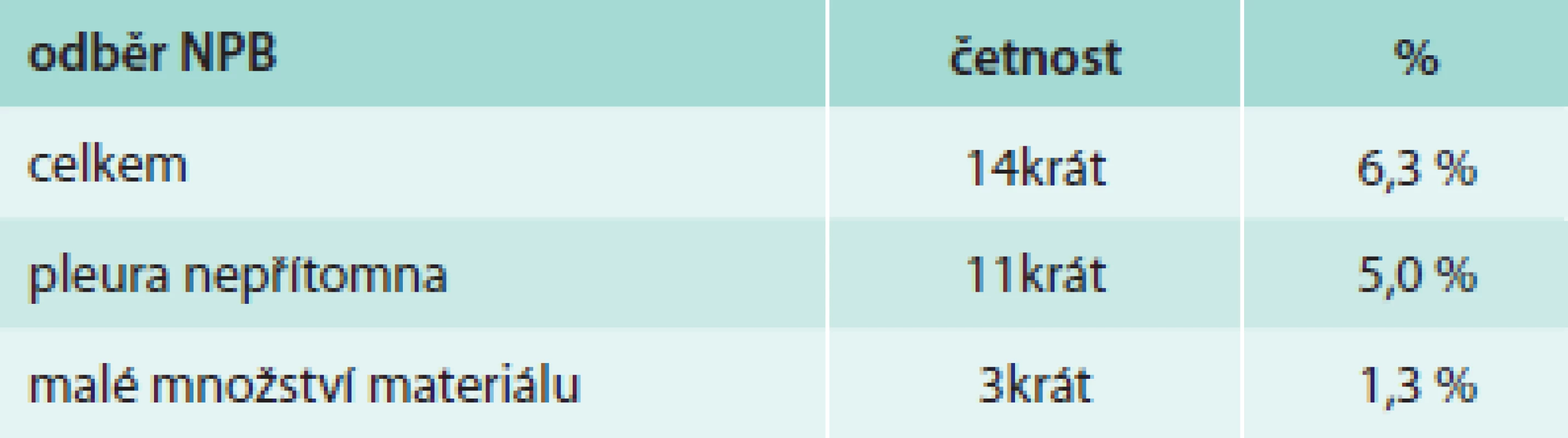
Diskuse
Histologické stanovení typu nádoru zlatým standardem diagnózy maligního pleurálního výpotku a je východiskem pro další léčbu.
V poslední době je snaha predikovat možnou maligní etiologii pleurálního výpotku podle řady specifických makromolekul, tj. biomarkerů, a to jak přímo ve výpotku, tak i v krvi.
Již řadu let se objevují práce studující význam hladin nádorových markerů (karcinomantigenu 125 – CA 125, karcinomembryonálního antigenu – CEA, cytokeratin 19 fragmentů – CYFRA 21–1, karbohydrát antigenu 15–3 – CA 15–3 a neuron specifické enolázy – NSE), resp. jejich kombinací v séru či přímo v pleurálním výpotku v diferenciální diagnostice maligních a nemaligních pleurálních výpotků [25–31]. Nověji se studují možné tumormarkery maligního mezoteliomu pleury v pohrudničním výpotku. Z nich se jeví nejvýtěžnější mezotelin (soluble mesothelin related peptides – SMRP), jehož senzitivita dosahuje 65,1–75,6 % a specificita 68,4–89,0 % [32–35]. Výsledky vyšetření tumormarkerů však nejsou přesvědčivé a pozitivní výsledek vyšetření nádorových markerů nemůže v žádném případě nahradit morfologickou (cytologickou nebo histologickou) verifikaci maligního postižení pleury se stanovením typu nádoru. Elevace nádorových markerů při negativním výsledku cytologického vyšetření ale zvyšuje podezření na maligní původ výpotku a indikuje další (invazivní) vyšetřovací metody.
Je samozřejmostí, že v případě suspekce na nádorové postižení pleury je nutná mikromorfologická verifikace malignity cytologicky nebo histologicky. Je možné použít řadu vyšetřovacích metod. Prvním v pořadí je cytologické vyšetření pleurální tekutiny. Jeho senzitivita je udávána v literatuře průměrně okolo 60 % s širokým rozptylem mezi 33–87 % [36–38]. Senzitivita vyšetření se také liší dle histologického typu nádoru. Light uvádí hodnoty 10 %, 20 % a 70 % pro mezoteliom, spinocelulární karcinom a adenokarcinom [15]. Podobně Hooper et al uvádí vyšší senzitivitu tohoto vyšetření u adenokarcinomu než u spinocelulárního karcinomu, lymfomu a mezoteliomu v sestupném pořadí [39]. Ruffie et al a Boutin et al stanovili senzitivitu cytologie hrudního punktátu u mezoteliomu na 26 % [54,55]. Svůj význam má také opakované cytologické vyšetření pleurální tekutiny. Jak demonstroval Garcia et al druhé cytologické vyšetření punktátu zvýšilo senzitivitu o 27 % [40]. V případě nálezu maligních buněk by mělo být provedeno imunocytochemické vyšetření k přesnému určení typu nádoru [39]. V případě mezoteliomu ale není samotná cytologická diagnostika dostatečná, a to z důvodu nesnadného odlišení aktivovaných mezotelií od nádorových buněk. Je doporučená definitivní verifikace histologickým vyšetřením adekvátního bioptického vzorku pleury [41–43].
Pokud nejsou při cytologickém vyšetření pleurálního výpotku nalezeny maligní buňky, je indikováno provedení biopsie pleury jako minimálně invazivní vyšetřovací metody, prováděné v lokální anestezii. Používají se různé typy bioptických jehel – Abramsova, Copeho, Ramelova, Tru-cut a další. V podstatě jedinou absolutní kontraindikací vyšetření je nezvládnutelná porucha krevní srážlivosti. Komplikace biopsie nejsou ve velké většině případů příliš závažné. Nejčastější komplikací je pneumotorax, který se vyskytuje ve 3–20 % případů, dále bolest v místě výkonu (1–15 % případů), vazovagální synkopa (1–5 % případů), hemotorax (< 2 % případů), hematom (< 1 % případů), empyém. Ke vzácným komplikacím se řadí pneumomediastinum, subkutánní emfyzém, eventuálně poranění jater, sleziny, ledvin [44–46]. V našem souboru počet komplikací nepřesáhl 10 %, ve většině případů nešlo o závažné komplikace a jen v 4 % případů byla nutná aktivní invazivní léčba.
Dle různých autorů zvyšuje biopsie pleury výtěžnost diagnostiky oproti izolované cytologii punktátu o 7–27 % [44,47–49]. Celková senzitivita biopsie pleury se v literatuře dle různých zdrojů pohybuje mezi 33,4–65 % [44,50–53]. Pro mezoteliom je uváděna senzitivita nižší, jen mezi 16–46 % [44,54–58]. Ve srovnání s těmito údaji jsou naše výsledky nadprůměrné, zvláště v případě diagnostiky mezoteliomu, u níž dosahují téměř 60 %.
Mimo diagnostiku maligních pleurálních výpotku je NPB velmi dobrou metodou v diagnostice tuberkulózní pleuritidy, u níž se její výtěžnost pohybuje dle různých autorů mezi 50–97 % [59–61].
Vyšší výtěžnost může přinést cílená biopsie pleury (pod USG nebo CT navigací). Biopsie pleury pod ultrasonografickou kontrolou dosahují 70–86% výtěžnosti [62–64]. Ještě lepší výsledky jsou předkládány při cílených biopsiích pleury pod CT. Scott et al uvádějí senzitivitu 83 %, Maskell et al 87 % a Adams et al 88 % [65,51,66]. Pro samotný mezoteliom je pak uváděna senzitivita tohoto vyšetření v rozmezí 86–87,5 % [67,68]. Málo prací se zabývá významem pleurálního brushingu v diagnostice maligního postižení pleury. Práce Aksoye et al udává senzitivitu pleurálního brushingu této diagnózy 57 % [69].
V posledních letech dochází v diagnostice nemocí pleury k významnému rozvoji semiflexibilní pleuroskopie (nazývané též lékařská torakoskopie). Bývá prováděna pneumology na endoskopických sálech v lokální anestezii a sedaci a používá obvykle 1, maximálně 2 vstupy do hrudníku. Je méně invazivní, levnější a bezpečnější než chirurgické metody. Větší komplikace jako je empyém, krvácení nebo pneumonie se objeví jen u 2,3 % výkonů a mortalita je velmi nízká, pohybuje se mezi 0,01–0,4 % [39,70]. Senzitivita této diagnostické metody pro maligní pleurální výpotky se pohybuje mezi 88,9–97 % [39,70–73]. V této indikaci je tedy srovnatelná s chirurgickými metodami, resp. videoasistovanou hrudní chirurgií (VATS).
Za zlatý standard v diagnostice maligního postižení pleury jsou stále považovány chirurgické metody. Klasická torakoskopie je v dnešní době nahrazována metodou videoasistované hrudní chirurgie (VATS), při níž je operační rána kontrolována pomocí videotorakoskopu. Při chirurgických výkonech se nástroje zavádějí malými řezy v hrudní stěně, obvykle přes duté bodce (trokary), obvykle je potřeba 2–4 řezů. Výkony jsou prováděny na operačním sále v celkové anestezii s použitím biluminální endotracheální kanyly s ventilací pouze jedné, a to kontralaterální plíce, plíce na operované straně hrudníku je kolabovaná. Výtěžnost VATS se pohybuje kolem 95 % i více [70,74,75]. Senzitivita klasické torakoskopie pro maligní postižení pleury včetně mezoteliomu je 91–99% [57,76–79]. Bohužel jsou tyto chirurgické výkony výrazně větší zátěží pro pacienta. Jsou prováděny v celkové anestezii, jsou ekonomicky i časově náročnější a jsou doprovázeny významnějším rizikem většího množství závažných komplikací, ke kterým patří těžké krvácení, arytmie, empyém, vzduchová embolie, rozsáhlý podkožní emfyzém. Výskyt vážných komplikací se udává v rozmezí 3–15 % případů, lehkých komplikací v rozmezí 8–18 % případů, mortalita ve výši 0,4 % případů [39,76,78,80]. Proto je možné torakoskopii vyhradit jen pro tu část pacientů, u nichž byly cytologie punktátu a pleurální biopsie nediagnostické [81].
Vyšší počet mezoteliomů v našem souboru je pravděpodobně dán 2 podniky v naší spádové oblasti, které ještě v relativně nedávné době používaly ve výrobě azbest (Eternitka Hranice, Eternitka Šumperk). Při srovnání s údaji jiných studií odpovídají naše výsledky nejlepším hodnotám zveřejněným ve světové literatuře, v případě diagnostiky mezoteliomu je dokonce překračují. Výkon je prováděn v dostatečné lokální anestezii, pacienty je většinou velmi dobře tolerován a počet komplikací, zvláště závažných, není vysoký. Vzhledem k dlouhodobým zkušenostem našeho pracoviště s tímto vyšetřením je množství nepřínosných odběrů malé a je nižší než průměrně uváděná data. Navíc je z medicínského i lidského hlediska potěšitelné, že více než polovina našich pacientů s pleurálními výpotky nejasné etiologie, které byly nakonec diagnostikovány jako výpotky maligního původu, nebyla nucena podstoupit invazivnější a ekonomicky náročnější torakoskopii. V současné době již preferujeme cílenou biopsii pleury pod sonograficky kontrolou.
Vzhledem k našim dobrým zkušenostem s tímto vyšetřením tak můžeme doporučit zařazení NBP do algoritmu diagnostiky pleurálních výpotků nejasné etiologie (schéma).
Schéma. Doporučený algoritmus diagnostiky exsudativních pleurálních výpotků nejasné etiologie 
Závěr
Necílená biopsie pleury má významné místo v diagnostice pleurálních výpotků nejasné etiologie zvláště maligního původu, u nichž má poměrně dobrou senzitivitu při jisté specificitě. Velmi dobrá je také její výtěžnost v diagnostice tuberkulózní pleuritidy. Jedná se o nenáročnou a minimálně invazivní vyšetřovací metodu, která významně snižuje nutnost provedení torakoskopie. Na tuto vyšetřovací metodu mohou být rozdílné názory, především v řadách pneumologů, kteří indikují nebo sami provádějí torakoskopii. Z našich vlastních zkušeností můžeme říci, že NPB je miniinvazivní, pacienty dobře tolerované vyšetření s nevelkým množstvím komplikací, které má dobrou senzitivitu při jisté specificitě. Proto můžeme doporučit zařazení NPB do algoritmu diagnostiky pleurálních výpotků nejasné etiologie, a to především v případě diagnosticky opakovaně nepřínosného cytologického vyšetření pleurální tekutiny.
MUDr. Petr Jakubec
jakubecp@fnol.cz
Klinika plicních nemocí a tuberkulózy LF UP a FN, Olomouc
www.lf.upol.cz
Doručeno do redakce: 20. 11. 2013
Přijato po recenzi: 10. 3. 2014
Zdroje
1. Light RW. Pleural disease. 2nd ed. Lea and Febiger: Philadelphia 1990. ISBN 0812113187.
2. Du Rand I, Maskell N. Introduction and methods: British Thoracic Society pleural disease guideline. Thorax 2010; 65: (Suppl 2): ii1-ii3.
3. Marel M, Fila L. Novinky v péči o nemocné s pleurálními výpotky. Postgrad Med 2011; 13(6): 656–661.
4. Rubins J. Pleural effusion. eMedicine 2013. Dostupné z: <http://emedicine.medscape.com/article/299959-overview>.
5. Sahn SA. The value of pleural fluid analysis. Am J Med Sci 2008; 335(1): 7–15.
6. Esme H, Calik M. Management of Malignant Pleural Effusion. In: Firstenberg MS (Ed). Principles and Practice of Cardiothoracic Surgery. InTech 2013 : 85–108. ISBN 978–953–51–1156–6. Dostupné z WWW: <http://www.intechopen.com/books/principles-and-practice-of-cardiothoracic-surgery/management-of-malignant-pleural-effusion>.
7. Light RW, MacGregor MI, Luchsinger PC et al. Pleural effusions: the diagnostic separation of transudates and exudates. Ann Intern Med 1972; 77(4): 507–513.
8. Heffner JE, Brown LK, Barbieri CA. Diagnostic value of tests that discriminate between exudative and transudative pleural effussions. Primary Study Investigators. Chest 1997; 111(4): 970–980.
9. Porcel JM, Vives M, Vicente de Vera MC et al. Useful tests on pleural fluid that distinguish transudates from exudates. Ann Clin Biochem 2001; 38(Pt 6): 671–675.
10. Roth BJ, O´Meara TF, Cragun WH. The serum-effusion albumin gradient in the evaluation of pleural effusions. Chest 1990; 98(3): 546–549.
11. Ansari T, Idell S. Management of undiagnosed persistent pleural suffusions. Clin Chest Med 1998; 19(2): 407–417.
12. Romero-Candeira S, Fernández C, Martín C et al. Influence of diuretics on the concentration of proteins and other components of pleural transudates in patients with heart failure. Am J Med 2001; 110(9): 681–686.
13. Romero-Candeira S, Hernandéz L The separation of transudates and exsudates with particular reference to the protein gradient. Curr Opin Pulm Med 2004; 10(4): 294–298.
14. Marel M, Zrůstová M, Stasný B et al. Incidence of pleural effusions in well-defined region: epidemiologic study in Central Bohemia. Chest 1993; 104(5): 1486–1489.
15. Light RW. Clinical practice. Pleural effusion. N Engl J Med 2002; 346(25): 1971–1977.
16. Marel M et al. Diagnosis of pleural effusions. Experience with clinical studies, 1986 to 1990. Chest 1995; 107(6): 1598–1603.
17. Marel M, Fila L Diferenciální diagnostika a léčba maligních pleurálních výpotků. Klin Onkol 2001; 14(zvl č): 16–19.
18. Rahman NM, Chapman SJ, Davies RJO. Pleural effusion: a structured approach to care. Br Med Bull 2005; 72 : 31–47.
19. DiBonito L, Falconieri G, Colautti I et al. The positive pleural effusion. A retrospective study of cytopathologic diagnoses with autopsy confirmation. Acta Cytol 1992; 36(3): 329–332.
20. Johnston WW. The malignant pleural effusion. A review of cytopathologic diagnoses of 584specimens from 472 consecutive patients. Cancer 1985; 56(4): 905–909.
21. Hsu C. Cytologic detection of malignancy in pleural effusion: a review of 5255 samples from 3811 patients. Diagn Cytopathol 1987; 3(1): 8–12.
22. Antunes G, Neville E, Duffy J et al. BTS guidelines for the management of malignant pleural effusions. Thorax 2003; 58(Suppl 2): ii29–38.
23. Molengraft van de FJ, Vooijs GP. Survival of patiens with malignancy-associated effusions. Acta Cytol 1989; 33(6): 911–916.
24. Bonnefoi H, Smith IE. How should cancer presenting as a malignant effusion be managed? Br J Cancer 1996; 74(5): 832–835.
25. Engel G. Diagnostický postup při pleurálním výpotku. Vnitř Lék 2000; 46(2): 126–129.
26. Korczynski P, Krenke R, Safianowska A et al. Diagnostic utility of pleural fluid and serum markers in differentiation between malignant and non-malignant pleural effusions. Eur J Med Res 2009; 14: (Suppl 4): S128-S133.
27. Li CS, Cheng BC, Ge W et al. Clinical value of CYFRA 21–1, NSE, CA 15–3, CA 19–9 and CA 125 assay in the elderly patients with pleural effusions. Int J Clin Pract 2007; 61(3): 444–448.
28. van den Heuvel MM, Korse CM, Bonfrer JMG et al. Non-invasive diagnosis of pleural malignancies: the role of tumour markers. Lung Cancer 2008; 59(3): 350–354.
29. Shitrit D, Zingerman B, Shitrit AB et al. Diagnostic Value of CYFRA 21–1, CEA, CA 19–9, CA 15–3 and CA 125 Assays in Pleural Effusions: Analysis of 116 Cases and Review if the Literature. Oncologist 2005; 10(7): 501–507.
30. Porcel JM, Vives M, Esquerda A et al. Use of a panel of tumor markers (carcinoembryonic antigen, cancor antigen 125, carbohydrate antigen 15–3, and cytokeratin 19 fragments) in pleural fluid for the differential diagnosis of benign and malignant effusions. Chest 2004; 126(6): 1757–1763.
31. Ferrer F, Villarino MA, Encabo G et al. Diagnostic utility of CYFRA 21–1, carcinomembryonic antigen, CA 125, neurol specific enolase, and squamous cell antigen level determinations in the serum and pleural fluid of patients with pleural effusions. Cancer 1999; 86(8): 1488–1495.
32. Scherpereel A, Grigoriu B, Conti M et al. Soluble mesothelin-related peptides in the diagnosis of malignant pleural mesothelioma. Am J Respir Crit Care Med 2006; 173(10): 1155–1160.
33. Pass HI, Wali A, Tang N et al. Soluble mesothelin-related peptide level elevation in mesothelioma serum and pleural effusions. Ann Thorac Surg 2008; 85(1): 265–272.
34. Davies HE, Sadler RS, Bielsa S et al. Clinical impact and reliability of pleural fluid mesothelin in undiagnosed pleural effusions. Am J Respir Crit Care Med 2009; 180(5): 437–444.
35. Fujimoto N, Gemba K, Asano M et al. Soluble mesothelin-related protein in pleural effusion from patients with malignant pleural mesothelioma. Experimental and Therapeutic Medicine 2010; 1(2): 313–317.
36. Fenton KN, Richardson JD. Diagnosis and management of malignant pleural effusions. Am J Surg 1995; 170(1): 69–74.
37. Bueno CE, Clemente MG, Astro BC et al. Cytologic and bacteriologic analysis of fluid and pleural biopsy specimens with Cope´s needle: study of 414 patients. Arch Intern Med 1990; 150(6): 1190–1194.
38. Maskell NA, Butland RJ. BTS guidelineas for the investigation of a unilateral pleural effusion in adults. Thorax 2003; 58(Suppl 2): ii8-ii17.
39. Hooper C, Lee YCG, Maskell N. Investigation of a unilateral pleural effusion in adults: British Thoracic Society Pleural Disease Guideline 2010. Thorax 2010; 65(Suppl 2): ii4-ii17.
40. Garcia L, Ducatman BS, Wang HH. The value of multiple fluid specimen in the cytological diagnosis of malignancy. Mod Pathol 1994; 7(6): 665–668.
41. Scherpereel A, Astoul P, Baas P et al. European Respiratory Society/European Society of Thoracic Surgeons Task Force. Guidelines of the European Respiratory Society and the European Society of Thoracic Surgeons for the management of malignant pleural mesothelioma. Eur Respir J 2010; 35(3): 479–495.
42. Husain AN, Colby T, Ordonez N et al (International Mesothelioma Interest Group). Guidelines for pathologic diagnosis of malignant mesothelioma: 2012 update of the consensus statement from the International Mesothelioma Interest Group. Arch Pathol Lab Med 2013; 137(5): 647–667.
43. Cagle PT, Allen TC. Pathology of the pleura: what the pulmonologists need to know. Respirology 2011; 16(3): 430–438.
44. Chakrabarti B, Ryland I, Sheard J et al. The role of Abrams percutaneous pleural biopsy in the investigation of exudative pleural effusions. Chest 2006; 129(6): 1549–1555.
45. Sriram K, Jersmann H. Pneumothorax, pneumomediastinum and subcutaneous emphysema following closed percutaneous pleural biopsy: a case report. Cases J 2008; 1(1): 274.
46. Baumann MH. Closed pleural biopsy: not dead yet! Chest 2006; 129(6): 1398–1400.
47. Nance KV, Shermer RW, Askin FB. Diagnostic efficacy of pleural biopsy as compared with that of pleural fluid examination. Mod Pathol 1991; 4(3): 320–324.
48. Salyer WR, Eggleston JC, Erozan YS. Efficacy of pleural needle biopsy and pleural fluid cytopathology in the diagnosis of malignant neoplasm involving the pleura. Chest 1975; 67(5): 536–539.
49. Prakash UB, Reiman HM. Comparison of needle biopsy with cytologic analysis for the evaluation of pleural effusion: analysis of 414 cases. Mayo Clin Proc 1985; 60(3): 158–164.
50. Poe RH, Israel RH, Utell MJ et al. Sensitivity, specificity and predictive values of closed pleural biopsy. Arch Intern Med 1984; 144(2): 325–328.
51. Maskell NA, Gleeson FV, Davies RJO. Standard pleural biopsy vs CT-guided cutting needle biopsy for diagnosis of malignant disease in pleural effusions: a randomized controlled trial. Lancet 2003; 361(9366): 1326–1331.
52. Bhattacharya S, Bairagya TD, Das A et al. Closed pleural biopsy is still useful in the evaluation of malignant pleural effusion. J Lab Physicians 2012; 4(1): 35–38.
53. Pandit S, Chaudhuri AD, Datta SB et al. Role of pleural biopsy in etiological diagnosis of pleural effusion. Lung India 2010; 27(4): 202–204.
54. Ruffie P, Feld R, Minkin S et al. Diffuse malignant mesothelioma of the pleura in Ontario and Quebec: a retrospective study of 332 patients. J Clin Oncol 1989; 7(8): 1157–1168.
55. Boutin C, Rey F. Thoracoscopy in malignant mesothelioma: a prospective study of 188 consecutive patients. Part 1: Diagnosis. Cancer 1993; 72(2): 389–404.
56. Achatzy R, Beba W, Ritschler R et al. The diagnosis, therapy and prognosis of diffuse malignant mesothelioma. Eur J Cardiothorac Surg 1989; 3(5): 445–447.
57. Attanoos RL, Gibbs AR. The comparative accuracy of different pleural biopsy techniques in the diagnosis of malignant mesothelioma. Histopathology 2008; 53(3): 340–344.
58. McLaughlin KM, Kerr KM, Currie GP. Closed pleural biopsy to diagnose mesothelioma: dead or alive? Lung Cancer 2009; 65(3): 388–389.
59. Gopi A, Madhavan SM, Sharma SK et al. Diagnosis and treatment of tuberculous pleural effusion in 2006. Chest 2007; 131(3): 880–889.
60. Hira HS, Ranjan R. Role of percutaneous closed needle pleural biopsy among patients of undiagnosed exudative pleural effusion. Lung India 2011; 28(2): 101–104.
61. Diacon AH, Van de Wal BW, Wyser C et al. Diagnostic tools in tuberculous pleurisy: a direct comparative study. Eur Respir J 2003; 22(4): 589–591.
62. Chang DB, Yang PC, Luh KT et al. Ultrasound-guided pleural biopsy with Tru-cut needle. Chest 1991; 100(5): 1328–1333.
63. Koegelenberg CF, Diacon AH. Pleural controversy: close needle pleural biopsy or thoracoscopy – which first? Respirology 2011; 16(5): 738–746.
64. Diacon AH, Schuurmans MM, Theron J et al. Safety and yield of ultrasound-assisted transthoracic biopsy performed by pulmonologists. Respiration 2004; 71(5): 519–522.
65. Scott EM, Marshall TJ, Flower CD et al. Diffuse pleural thickening: percutaneous CT-guided cutting needle biopsy. Radiology 1995; 194(3): 867–870.
66. Adams RF, Gleeson FV. Percutaneous image-guided cutting needle biopsy of the pleura in the presence of a suspected malignant effusion. Radiology 2001; 219(2): 510–514.
67. Adams RF, Gray W, Davies RJO et al. Percutaneous image-guided cutting needle biopsy of the pleura in the diagnosis of malignant mesothelioma. Chest 2001; 120(6): 1798–1802.
68. Metintas M, Ak G, Dundar E et al. Medical thoracoscopy vs CT scan-guided Abrams pleural needle biopsy for diagnosis of patients with pleural effusions: a randomized, controlled trial. Chest 2010; 137(6): 1362–1368.
69. Aksoy E, Atac G, Sevim T et al. Diagnostic yield of closed pleural brushing. Tuberk Toraks 2005; 53(3): 238–244.
70. Davies HE, Rosenstengel A, Gary Lee YC. The diminishing role of surgery in pleural disease. Curr Opin Pulm Med 2011; 17(4): 247–254.
71. Thangakunam B, Devasahayam JC, Prince J et al. Semi-rigid thoracoscopy: initial experience from a tertiary care hospital. Indian J Chest Dis Allied Sci 2010; 52(1): 25–27.
72. Lee P, Hsu A, Lo C et al. Prospective evaluation of flex-rigid pleuroscopy for indeterminate pleural effusion: Accuracy, safety and outcome. Respirology 2007; 12(6): 881–886.
73. Prabhu VG, Narasimhan R. The role of pleuroscopy in undiagnosed exudative pleural effusion. Lung India 2012; 29(2): 128–130.
74. Medford ARL, Awan YM, Marchbank A et al. Diagnostic and therapeutic performance of video-assisted thoracoscopic surgery (VATS) in Investigation and management of pleural exudates. Ann R Coll Surg Engl 2008; 90(7): 597–600.
75. Haberal MA, Tülüce K, Köksal E et al. Videothoracoscopy in pleural effusions: A review of 41 cases. J Exp Clin Med 2013; 30(1): 35–37.
76. Menzies R, Charbonneau M. Thoracoscopy for the diagnosis of pleural disease. Ann Intern Med 1991; 114(4): 271–276.
77. Boutin C, Astoul P, Seitz B. The role of thoracoscopy in the evaluation and management of pleural effusions. Lung 1990; 168(Suppl): S1113-S1121.
78. Harris RJ, Kavuru MS, Mehta AC et al. The impact of thoracoscopy on the management of pleural disease. Chest 1995; 107(3): 845–852.
79. Loddenkemper R. Thoracoscopy – state of the art. Eur Respir J 1998; 11(1): 213–221.
80. Blanc FX, Atassi K, Bignon J et al. Diagnostic value of medical thoracoscopy in pleural disease: a 6-year retrospective study. Chest 2002; 121(5): 1677–1683.
81. Screaton NJ, Flower CD. Percutaneous needle biopsy of the pleura. Radiol Clin North Am 2000; 38(2): 293–301.
Štítky
Diabetológia Endokrinológia Interné lekárstvo
Článok vyšiel v časopiseVnitřní lékařství
Najčítanejšie tento týždeň
2014 Číslo 5-6- Účinnost a bezpečnost vysoce intenzivní hypolipidemické terapie statiny
- Parazitičtí červi v terapii Crohnovy choroby a dalších zánětlivých autoimunitních onemocnění
- Hydroresponzivní krytí v epitelizační fázi hojení rány
- Rizikové období v léčbě růstovým hormonem: přechod mladých pacientů k lékařům pro dospělé
- Nová klasifikace vnímání rizikových faktorů a etiologie kardiovaskulárních onemocnění
-
Všetky články tohto čísla
- Erdheimova-Chesterova choroba – poddiagnostikovaná zriedkavá choroba? – editorial
- Necílená biopsie pleury v diagnostice maligního pleurálního výpotku – editorial
- Přínos natriuretických peptidů v současné klinické praxi – editorial
- Sentinelová biopsie, stručný nástin problematiky – editorial
- Časování chirurgické a endoskopické terapie akutní biliární pankreatitidy v podmínkách terciární nemocnice v České republice
- Necílená biopsie pleury v diagnostice maligního pleurálního výpotku – naše zkušenosti za posledních 15 let
- Význam EKG u pacientov s resynchronizačnou liečbou
- Srdcové zlyhávanie – dá sa liečiť ovplyvnením kardiálneho metabolizmu?
- Difuzní idiopatická skeletární hyperostóza
- Proč a jak působí inzulinové přípravky na hmotnost
- Význam chuti v udržení homeostázy organizmu a patologický dopad vyrušení orocefalických reflexů ve vazbě na sladkou chuť v následku konzumace nekalorických sladidel
- Životní styl a riziko civilizačních nemocí
- Management chronických onemocnění v mezinárodním srovnání
- Rizikové faktory a prediktory progrese Barrettova jícnu do adenokarcinomu
- Přínos natriuretických peptidů v současné klinické praxi
- Sentinelová uzlina pri malígnom melanóme
- Manažment angioedému. Odporúčania Angiologickej sekcie Slovenskej lekárskej komory (2013)
- PET-CT dokumentovaná kompletní 4letá remise Erdheimovy-Chesterovy nemoci po léčbě kladribinem
- Purple urine bag syndrome – raritní, ale nepřehlédnutelný příznak močové infekce
- Extraadrenálny paraganglióm
- Stillova nemoc dospělých – obtížná cesta k diagnóze přes horečku a výpotky nejasné etiologie
- Ruptura jater s hemoperitoneem jako vzácná komplikace kardiopulmonální resuscitace u mladé pacientky s akutním infarktem myokardu
- Near-infrared spectroscopy (NIRS), nová technika intrakoronárního zobrazení nestabilního koronárního plátu
- Význam stanovení natriuretických peptidů a prokalcitoninu u akutního srdečního selhání
- XVII International Congress on Nutrition and Metabolism in Renal Disease
- Rozlúčka s profesorom Ďurišom, nestorom Slovenskej internej medicíny
- Z odborné literatury
- Vnitřní lékařství
- Archív čísel
- Aktuálne číslo
- Iba online
- Informácie o časopise
Najčítanejšie v tomto čísle- Stillova nemoc dospělých – obtížná cesta k diagnóze přes horečku a výpotky nejasné etiologie
- Purple urine bag syndrome – raritní, ale nepřehlédnutelný příznak močové infekce
- Difuzní idiopatická skeletární hyperostóza
- Sentinelová uzlina pri malígnom melanóme
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



