-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Porodní hmotnost a genetické pozadí rizika diabetes mellitus 2. typu u české populace
Birth weight and genetic risk of type 2 diabetes in Czech population
Introduction:
Birth weight is associated with type 2 diabetes mellitus and other late ‑ onset metabolic diseases. Reduced birth weight is associated with an increased risk of insulin resistance, type 2 diabetes, and atherosclerosis. Also high birth weight represents risk factor for development of type 2 diabetes later in life. In this study, we investigate whether type 2 diabetes risk‑confering alleles and biochemical as well as anthropometrical type 2 diabetes risk markers associate with birth weight in our Czech cohort.Results:
Association between high birth weight and higher BMI in adulthood was found. Low birth weight was associated with higher glycaemia and insulinaemia as well as lower peripheral insulin sensitivity during oGTT. The examination of candidate genes provides evidence that Ngn3 and PPARα are involved in final birth weight regulation.Conclusion:
According to our results, we suggest that birth weight should be an integral part of medical history record.Key words:
birth weight – type 2 diabetes mellitus – body composition – insulin sensitivity – type 2 diabetes mellitus candidate genes
Autoři: D. Vejražková; M. Vaňková; P. Lukášová; J. Včelák; O. Bradnová; S. Pražáková; H. Kvasničková; B. Bendlová
Působiště autorů: Oddělení molekulární endokrinologie Endokrinologického ústavu Praha, ředitel doc. MU Dr. Vojtěch Hainer, CSc.
Vyšlo v časopise: Vnitř Lék 2010; 56(12): 1303-1309
Kategorie: 80. narozeniny prof. MUDr. RNDr. Luboslava Stárky, DrSc., bývalého ředitele Endokrinologického ústavu Praha
Souhrn
Úvod:
Riziko vzniku diabetu 2. typu (DM2T) a dalších metabolických poruch je spojováno s porodní hmotností. Nízká porodní hmotnost je asociována s vyšším rizikem inzulinové rezistence, DM2T a aterosklerózy, ovšem i vysoká porodní hmotnost je riziková z hlediska rozvoje DM2T ve vyšším věku. V této studii jsme se zabývali vztahem porodní hmotnosti a přítomností biochemických a antropometrických rizikových markerů DM2T v závislosti na genetickém pozadí kandidátních genů tohoto onemocnění.Výsledky:
Byla nalezena asociace porodní hmotnosti s BMI a se složením těla v dospělosti. Nízká porodní hmotnost byla asociována s vyššími stimulovanými hodnotami glykemie a inzulinemie a s nižší periferní inzulinovou senzitivitou. Genetická analýza nasvědčuje tomu, že geny Ngn3 a PPARα jsou zapojeny do regulace konečné hmotnosti novorozence.Závěr:
Ze studie vyplývá, že údaje o porodní hmotnosti by měly být nedílnou součástí základní anamnézy.Klíčová slova:
porodní hmotnost – diabetes mellitus 2. typu – složení těla – inzulinová senzitivita – kandidátní geny pro diabetes mellitus 2. typuÚvod
Riziko vzniku diabetes mellitus 2. typu (DM2T) a dalších metabolických patologií (obezity, hypertenze, dyslipidemie, kardiovaskulárních poruch) souvisí s porodní hmotností [1,2]. Nízká porodní hmotnost je asociována s vyšším rizikem inzulinové rezistence (IR), DM2T a aterosklerózy [1,3 – 5]. Nejrozsáhlejší projekt zabývající se tímto tématem, metaanalýza 14 studií zahrnující více než 132 180 jedinců, vyčíslila asociaci nízké porodní hmotnosti a rizika DM2T poměrem ODDS o výši 1,32 [4]. Nižší porodní hmotnost vykazuje pozitivní korelaci se zvýšeným rizikem DM2T ve 28 z 31 studovaných populací [5]. Mechanizmus podmiňující tuto asociaci zatím není zcela jasný, nejvíce diskutovaná je v literatuře tzv. hypotéza fetálního programování [6,7] a dále fetální inzulinová hypotéza [8,9]. Obě hypotézy se vzájemně nevylučují, konečná porodní hmotnost a další vývoj dítěte je pravděpodobně výsledkem současného působení a vzájemných interakcí faktorů uvažovaných v obou hypotézách.
Hypotéza fetálního programování před-pokládá, že nitroděložní deprivace způsobí trvalý metabolický posun směrem k IR a dalším poruchám. Jedinci vystavení nedostatku živin v rané fázi vývoje vykazují po optimalizaci jejich příjmu rychlé přibývání na hmotnosti (catch-up-growth), což je predisponuje k rozvoji abdominálního typu obezity [10 – 14], IR [15,16] a hypertenze [17].
Fetální inzulinová hypotéza předpokládá, že běžné genetické varianty, které vedou k mírnému poklesu inzulinové sekrece či sníženému účinku inzulinu, mohou predisponovat k rozvoji diabetu a zároveň být i příčinou nižší porodní hmotnosti, neboť inzulin představuje pro plod zásadní růstový faktor. Studie zabývající se některými monogenně podmíněnými formami diabetu tuto hypotézu potvrzují. Mutace v genech GCK, INS, INSR, IPF1, ABCC8, HNF1B a KCNJ11 vedou u dětí k poruchám glukózového metabolizmu a diabetu, současně jsou však příčinou i jejich nízké porodní hmotnosti [8,18 – 21]. Monogenně podmíněné formy diabetu jsou však příliš vzácné na to, aby vysvětlily asociaci DM2T s nízkou porodní hmotností popisovanou v populačních studiích. Pozornost se tedy zaměřuje ke genetickým variantám, u nichž již byla popsána asociace s DM2T, a studuje se jejich vztah k fetálnímu růstu a porodní hmotnosti. Takto jsou studovány např. varianty v kandidátních diabetogenech CDKAL1, CDKN2A/ B, HHEX-IDE, IGF2BP2, SLC30A8, TCF7L2, PPARγ, KCNJ11, JAZF1 a dalších [22,23].
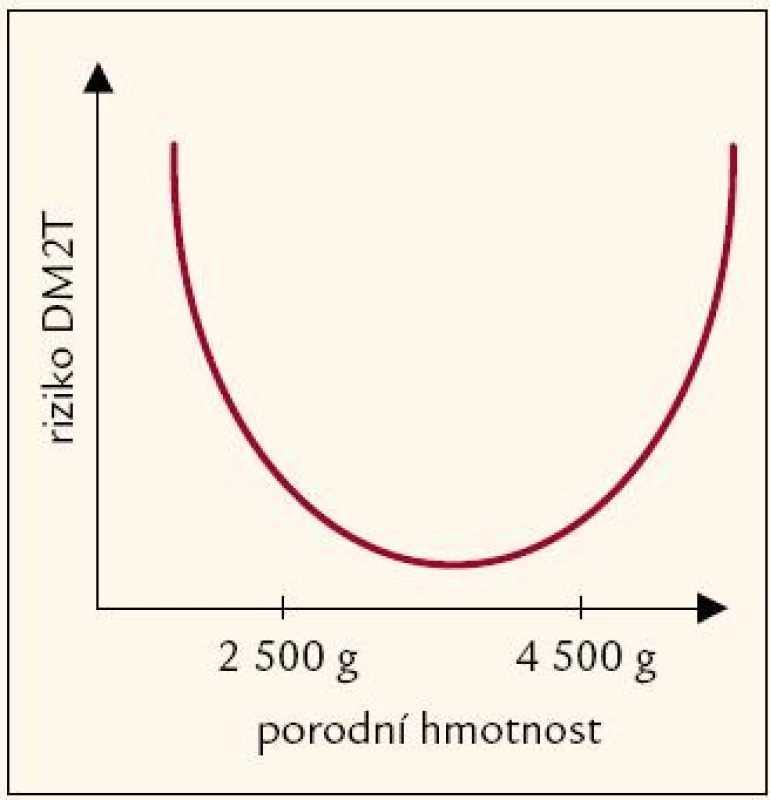
Také vysoká porodní hmotnost je asociována s následným vyšším BMI v dětství i pozdějším věku [4,24] a je riziková z hlediska rozvoje DM2T [25] (obr. 1). Zdá se, že asociace vysoké porodní hmotnosti a rizika DM2T v pozdějším věku odráží především matčin diabetogenní genetický potenciál, projevující se jak vyšší porodní hmotností dítěte (v důsledku zvýšené glykemie matky v průběhu těhotenství a následně zvýšenou sekrecí inzulinu – růstového faktoru – plodem), tak predispozicí dítěte k DM2T v důsledku předání rizikových alel dítěti [26].
Cíl
Cílem předkládané studie je analýza předpokládaných souvislostí mezi porodní hmotností a výskytem faktorů rizikových pro rozvoj DM2T v dospělosti. Těmito faktory jsou jak antropometrická data (centrální typ obezity, nízký podíl aktivní tělesné hmoty), tak biochemické parametry odhalující porušený glukózový a lipidový metabolizmus. Biochemická data byla stanovována jak ve stavu nalačno, tak i během 3hodinového orálního glukózového tolerančního testu (oGTT). Dalším naším cílem je zjistit, zda porodní hmotnost má souvislost s příslušností k určitým genotypům. Sledovali jsme 32 genetických polymorfizmů celkem ve 25 genech, u nichž je prokázán vliv na regulaci glukózového či lipidového metabolizmu. V neposlední řadě nás zajímá, zda některé z testovaných genotypů budou častěji zastoupeny buď přímo u diabetiků či potomků diabetických rodičů, nebo u gestačních diabetiček ve srovnání s kontrolním souborem. A zásadní otázka závěrem: Nalezneme-li alely genů asociující s porodní hmotností a nalezneme-li i alely genů v asociaci s DM2T, budou některé z nich totožné? Odhalení takových genetických variant by bylo velkým přínosem, fetální inzulinová hypotéza by se tak mohla opřít o exaktní data, byla by podložena konkrétními genetickými polymorfizmy.
Metody
Pro studii jsme použili data celkem 622 jedinců ve věku 20 – 60 let, z toho 482 bylo žen, 140 mužů. Soubor se dále dělí na diabetiky 2. typu (soubor D, 54 jedinců, 40 žen, 14 mužů, věk 58 ± 11 let, BMI 31 ± 5 kg/ m2), přímé dospělé potomky diabetiků, kteří ovšem nejsou příbuzní se souborem D, jejichž alespoň jeden rodič trpí/ trpěl diabetem 2. typu, ale oni sami ještě žádné projevy onemocnění nevykazují (soubor P,123 jedinců, 85 žen, 38 mužů, věk 36 ± 11 let, BMI 25 ± 4 kg/ m2), gestační diabetičky, u nichž se onemocnění objevilo až v souvislosti s těhotenstvím (soubor G, 163 žen, věk 33 ± 5 let, BMI 24 ± 5 kg/ m2) a kontrolní soubor zdravých jedinců, kteří ani v rodinné anamnéze neuvádějí onemocnění diabetem 2. typu (soubor K, 282 jedinců, 194 žen, 88 mužů, věk 30 ± 10 let, BMI 23 ± 4 kg/ m2). Porodní hmotnost byla zjišťována v dotazníku spolu s dalšími osobními a rodinnými anamnestickými údaji. Ze studie byli vyloučeni předčasně narození jedinci a jedinci z vícečetných těhotenství. Antropometrické charakteristiky BMI, WHR, tělesné složení, obvody pasu, boků a břicha jsme stanovili u účastníků studie nalačno, standardní antropometrickou technikou [27,28], změřen byl též krevní tlak. Biochemické parametry glukózového metabolizmu zahrnují bazální glykemii, glykované proteiny, imunoreaktivní inzulin, proinzulin, C-peptid a glukagon. Lipidový profil je charakterizován celkovým cholesterolem (CH), HDL-CH, LDL-CH, triglyceridy, volnými mastnými kyselinami (VMK) a doplněn je mastnými kyselinami klasifikovanými podle stupně saturace do kategorií SFA, MUFA a PUFA. Glykemie, inzulin, proinzulin, C-peptid, glukagon a VMK byly u skupiny G, P a K sledovány i v průběhu 3hodinového oGTT (75 g glukózy). Studována byla variabilita těchto genů: ADIPOQ (polymorfizmus rs2241766), ApoE (polymorfizmus alel ε2, ε3, ε4), β2AR (polymorfizmus rs1042714), β3AR (polymorfizmus rs4994), FABP2 (polymorfizmus rs1799883), FTO (polymorfizmy rs1121980, rs17817449, rs1421085 a rs9939609), GCK promotor (polymorfizmus rs1799884), INSR (polymorfizmus rs1799817), INS VNTR (polymorfizmus rs689), IL6 (polymorfizmus rs1800795), KCNJ11 (polymorfizmus rs5219), LRP5 (polymorfizmus rs3736228), Ngn3 (polymorfizmy rs41277236 a rs4536103), NMB (poly-morfizmus rs1051168), NME7 (polymor-fizmus rs4656671), PGC1A (polymorfiz-mus rs8192678), PPARα (polymorfiz-mus rs1800206), PPARγ2 (polymor-fizmus rs1801282), SHBG (polymorfizmy rs6258 a rs6259), SLC30A8 (polymorfizmus rs13266634), SREBF1c (polymorfizmus rs2297508), UCP1 (po-lymorfizmus rs1800592), UCP2 (polymorfizmus rs659366), TCF7L2 (poly-morfizmy rs12255372, rs7903146 a rs7901695) a mitochondriální polymorfizmus T16189C. Varianty jednotlivých kandidátních genů byly stanoveny metodou RFLP, SSCP (ALFexpres II, Amersham Pharmacia Biotech), popř. metodou TaqMan genotyping assays (Real-Time PCR LC-480 Roche, Applied Biosystems). Při statistické analýze dat byly použity neparametrický Mann Whitneyův test, χ2 test, případně Fisherův exaktní test (NCSS 2004, Utah, USA). Parametry závislé na pohlaví byly vyhodnocovány pro muže a ženy samostatně.
Výsledky
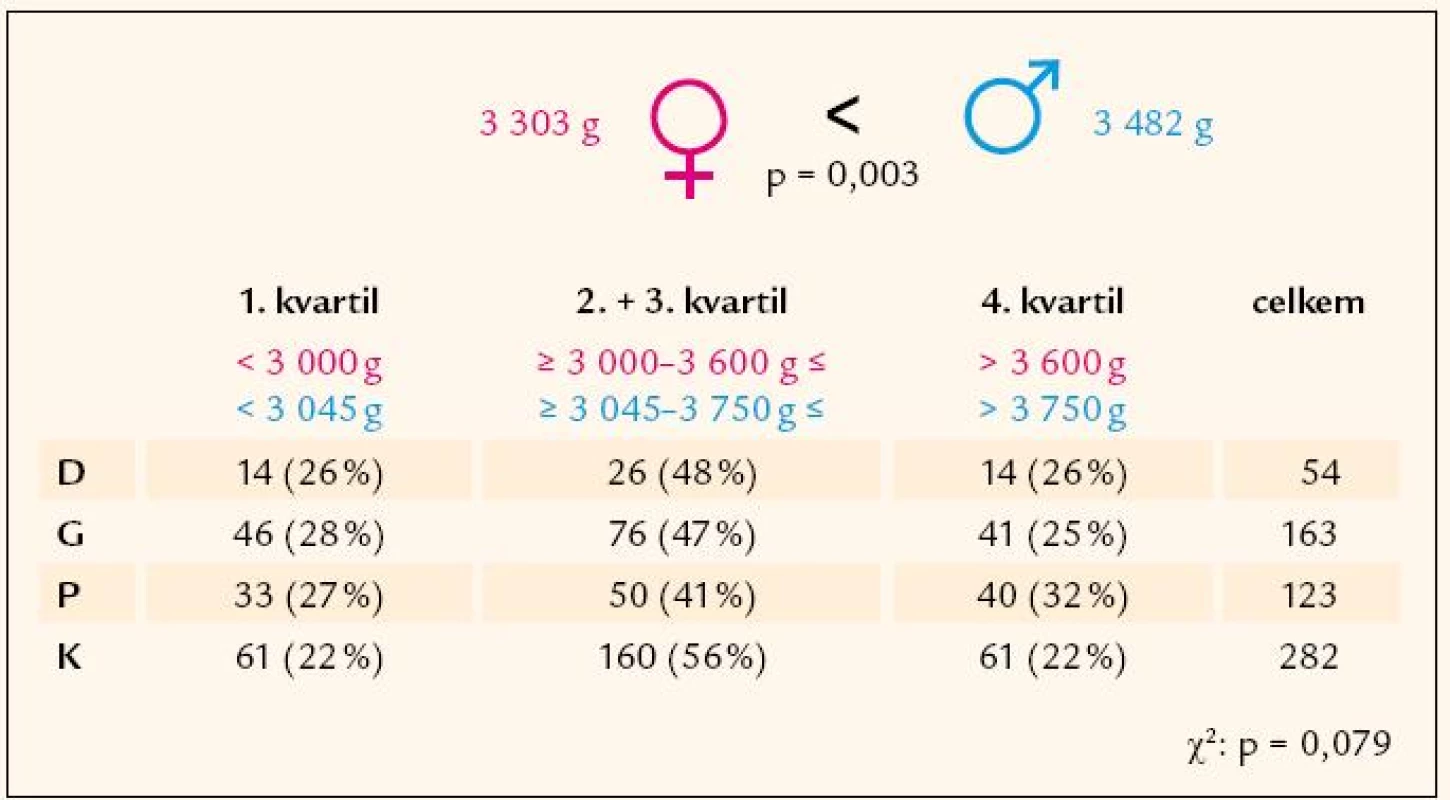
Porodní hmotnost byla v souladu s očekáváním v průměru o 180 g vyšší u chlapců než u děvčat (p = 0,003) (obr. 2). Četnost jedinců s nízkou porodní hmotností (< 25. percentilem) a vysokou porodní hmotností (> 75. percentilem) byla ve skupinách diabetiků, zdravých potomků diabetiků, gestačních diabetiček i kontrolních jedinců podobná (obr. 2). Byla pozorována souvislost porodní hmotnosti s tělesným složením v dospělosti. Muži spadající svou porodní hmotností do horního kvartilu (> 75. percentil), vykazovali v porovnání s muži středních (2. a 3. kvartil) a nízkých (< 25. percentil) hodnot porodní váhy statisticky významně vyšší tělesnou hmotnost v dospělosti (p < 0,01), vyšší BMI (p < 0,05), vyšší obvod pasu (p < 0,01), obvod boků (p < 0,01) i obvod břicha (p < 0,01). U žen byl tento trend patrný nejsilněji ve skupině zdravých kontrol, kde výsledky dosáhly statistické významnosti u tělesné hmotnosti (p < 0,01), BMI (p < 0,05) a u procentuálního zastoupení tukové tkáně (p < 0,05). Ženy s nejvyšší porodní hmotností měly v tomto souboru oproti ženám s porodní hmotností ve středním a nejnižším pásmu také nižší procento svaloviny (p < 0,05).
Pokud jde o biochemické parametry, v bazálních hodnotách jsme nezjistili přímou souvislost s porodní hmotností. Lipidový profil ani hlavní charakteristiky glukózového metabolizmu se na 5% hladině statistické významnosti nelišily mezi jednotlivými kvartily porodní hmotnosti. Nelišily se ani hodnoty krevního tlaku. Zajímavější výstup však poskytla statistická analýza stimulovaných hodnot během oGTT. Protože provedení testu je nepřípustné u diabetiků, byli z celkového souboru vyřazeni a všechny stimulované hodnoty jsou měřeny jen u souborů P, G a K (gestační diabetičky oGTT podstoupily, neboť u nich byla porucha glykoregulace omezena jen na dobu těhotenství). Ukázalo se, že po 1. hodině probíhajícího testu začíná být vyšší hladina glukózy v krvi u jedinců spadajících svou porodní hmotností do 1. kvartilu. Počínaje 90. minutou testu je tento rozdíl statisticky významný (p < 0,05), udržuje se i ve 120. minutě a významnost ztrácí až v průběhu 3. hodiny (tab. 1). Chování glukózy během testu kopíruje inzulin, kdy počínaje 90. minutou jsou hladiny imunoreaktivního inzulinu v séru u jedinců nejnižší porodní hmotnosti statisticky významně vyšší než u zbytku souboru (p < 0,05) a významnost rozdílu v inzulinemii se opět ztrácí až v průběhu 3. hodiny (tab. 1). S tímto pozorováním korespondují i hodnoty stimulovaného C-peptidu, jehož koncentrace v séru je u skupiny s nejnižší porodní hmotností statisticky významně vyšší již od 30. minuty testu (tab. 1). Zvýšené stimulované hladiny glukózy a inzulinu u jedinců nejnižší kategorie porodní hmotnosti se promítají i v hodnotách indexů inzulinové senzitivity (IS). Na snížení IS u této skupiny poukazuje v naší studii nejvýrazněji Cederholmův index [29], jehož výpočet vychází z hodnot glykemie a inzulinemie v prvních 2 hodinách oGTT [30] a odráží především periferní IS. U normálních zdravých neobézních jedinců se výše indexu pohybuje blízko hodnot 79 ± 14 mg * l2 * mmol–1 * mU–1 * min–1 [29]. Snížený bývá tento index u obézních a u osob se sníženou tolerancí glukózy. Nám vyšel index snížený u jedinců spadajících do kategorie nejnižší porodní hmotnosti ve srovnání s jedinci spadajícími do středního (p < 0,01) a nejvyššího (p < 0,05) pásma porodní váhy (tab. 1). Porovnáme li výši indexu mezi jednotlivými soubory, potvrzuje se, že index je snížený u osob s genetickou zátěží diabetem. Nejnižší hodnotu vykazují potomci diabetiků (74,35 ± 23,87 mg * l2 * mmol–1 * mU–1 * min–1) a gestační diabetičky (75,53 ± 20,38 mg * l2 * mmol–1 * mU–1 * min–1), v jejich rámci pak skupina s nejnižší porodní hmotností (66,26 ± 20,52 mg * l2 * mmol–1*mU–1 * min–1). Průměrná hodnota u kontrolního souboru byla naproti tomu významně vyšší (84,50 ± 22,50 mg * l2 * mmol–1 * mU–1 * min–1, p < 0,01).
Tab. 1. Biochemická data průběhu oGTT nediabetiků v závislosti na kvartilech porodní hmotnosti. 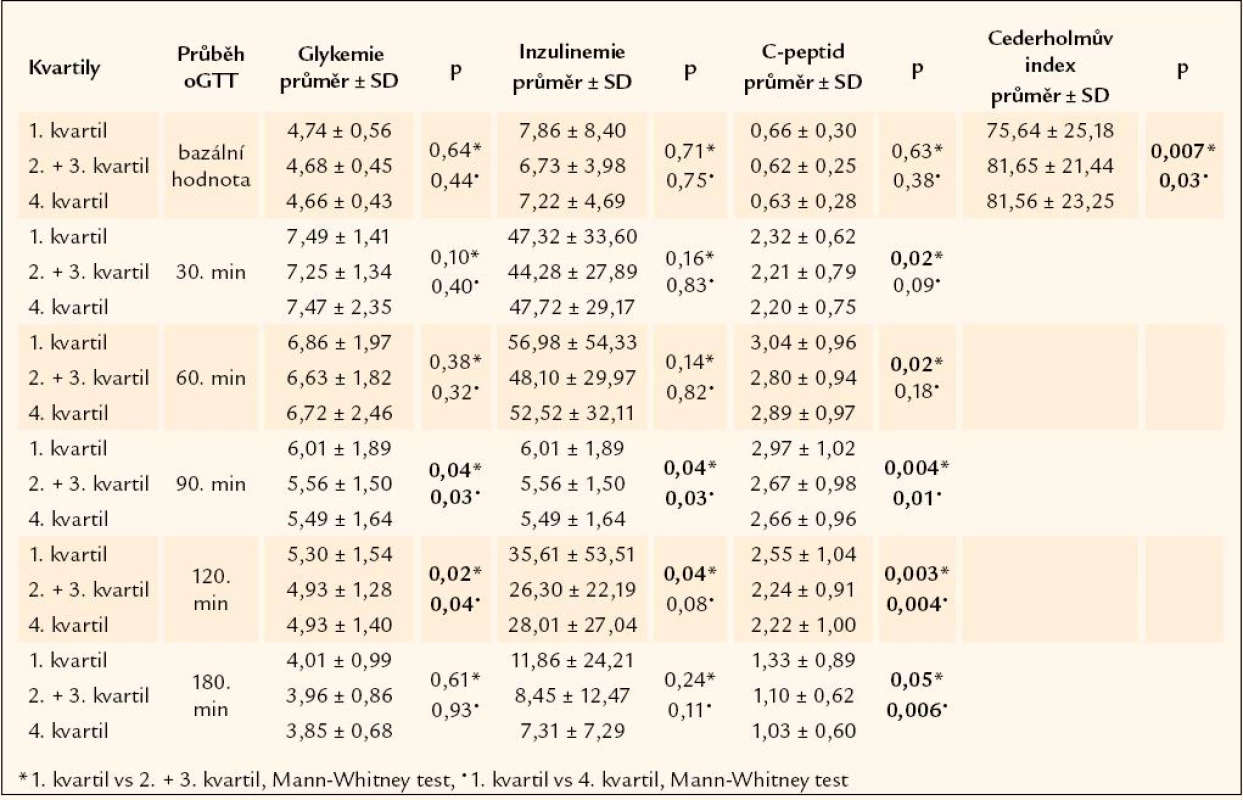
Genetická analýza ukazuje na možnousouvislost porodní hmotnosti a příslušnosti k určitému genotypu u dvou z testovaných genů. Prvním z nich je polymorfismus rs41277236 genu Ngn3. Hodnocení komplikuje extrémní vzácnost minoritní alely, která se v homozygotní formě vyskytuje pouze u 7 z celkového počtu 481 genotypovaných jedinců. Četnost minoritní alely polymorfizmu je nejvyšší u těch účastníků studie, jejichž porodní hmotnost převyšovala 75. percentil (8,1 %), u jedinců střední kategorie porodní hmotnosti (2. a 3. kvartil) je zastoupena 4,5 % a u jedinců s nejnižší porodní váhou (pod 25. percentilem) pouhými 2,5 % (χ2 = 8,6, p = 0,013) (tab. 2). Druhým zajímavým polymorfizmem v souvislosti s porodní hmotností je rs1800206 genu PPARα. Opět je nutné upozornit na velice vzácnou minoritní alelu polymorfizmu, v celém souboru 441 genotypovaných jedinců byl nalezen pouze jediný homozygotní nosič. Alelická četnost je zde rozložena opačně než u předchozího genu, minoritní alela je četnější v nejlehčí kategorii novorozenců (7,8 %) ve srovnání se středním hmotnostním pásmem (2,7 %) a s nejtěžší kategorií, kde je zastoupena 3,4 % (χ2 = 9,77, p = 0,007) (tab. 3).
Tab. 2. Rozložení četností alel rs41277236 genu <em>Ngn3</em> mezi kvartily porodní hmotnosti. 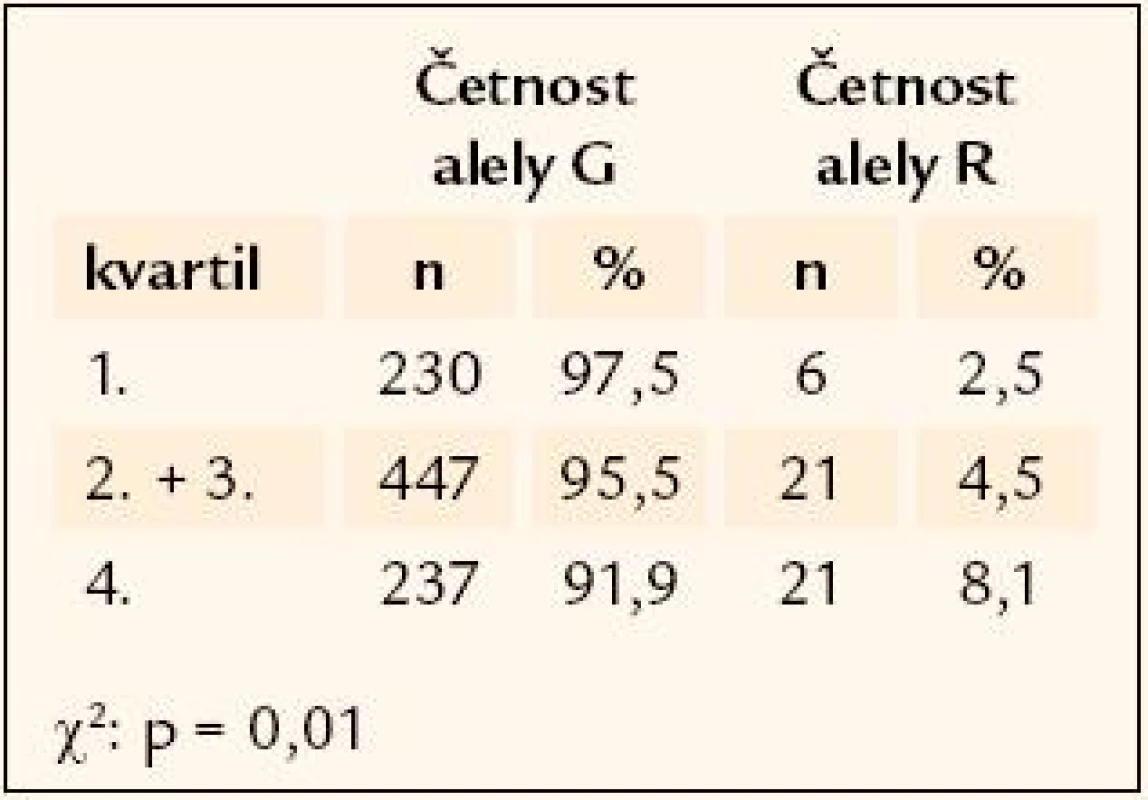
Tab. 3. Rozložení četností alel rs1800206 genu <em>PPARα</em> mezi kvartily porodní hmotnosti. 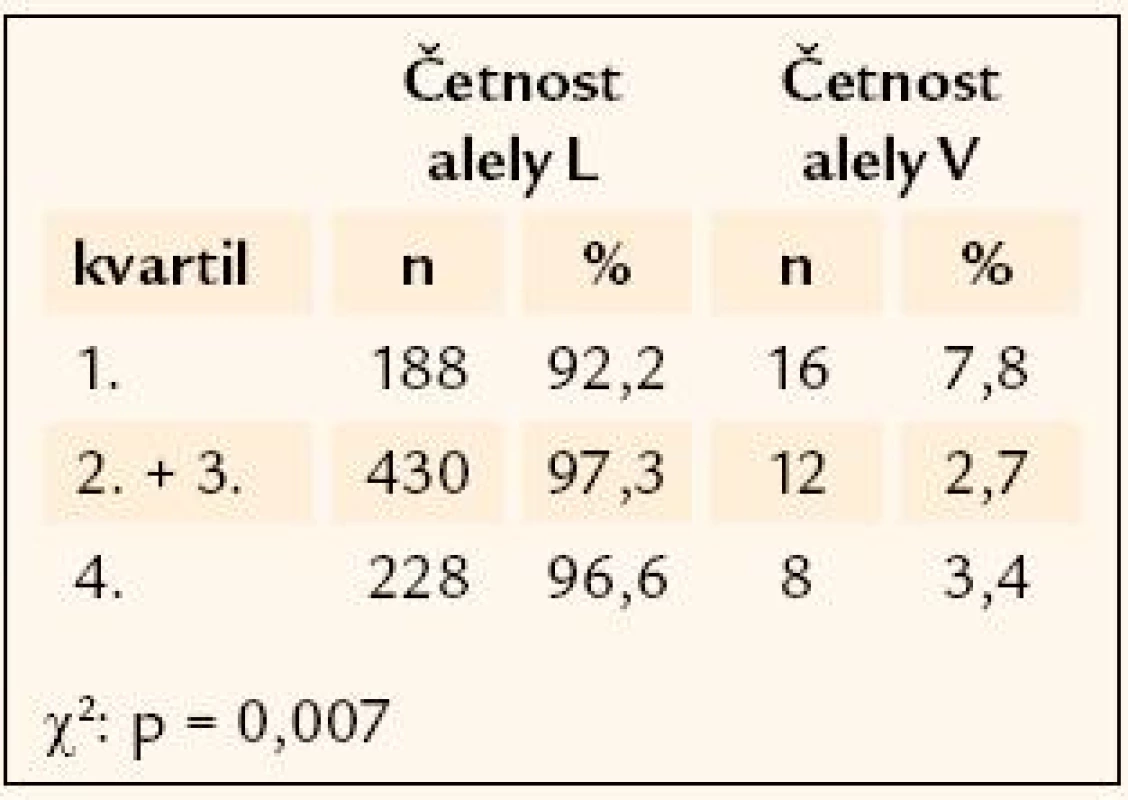
Testování, zda některé z hodnocených genotypů budou častěji zastoupeny u diabetiků, popř. jejich potomků či gestačních diabetiček, oproti kontrolnímu souboru, poukázalo hned na několik genů. Distribuce minoritních alel se na 5% hladině statistické významnosti mezi soubory lišila u genů ApoE, IL6, PGC1a, PPARγ2, SREBF1c, INS VNTR a genu SHBG. Žádný z těchtogenů se však neshodoval s těmi, u nichžbyla nalezena asociace s porodní hmotností.
Diskuze
Z hodnocení antropometrických údajů vyplývá asociace porodní hmotnosti se složením těla v dospělosti. Výraznější je u mužů, ti s porodní váhou nad 75. percentilem vykazují v dospělosti vyšší tělesnou hmotnost i BMI, a jak lze předpokládat z vyšších obvodů pasu, břicha i boků, mají tito muži i větší obsah viscerálního, a tedy z hlediska DM2T rizikového tuku. U žen je patrný obdobný trend. Zjištění, že děti s vysokou porodní hmotností mají v dospělosti vyšší BMI a více tuku, je v souladu s již popsanými závěry mnoha předešlých studií (obr. 1). Zpracování biochemických hodnot a především stimulovaných hladin glykemie a inzulinemie během oGTT naproti tomu vyhodnotilo jako skupinu s nejnižší IS, a tedy z hlediska pozdějšího rozvoje DM2T nejrizikovější tu, jejíž porodní hmotnost spadá pod 25. percentil. Tento závěr je zdánlivě v rozporu se závěrem plynoucím z antropometrických dat, tvar křivky „U“ na obr. 1 však dokumentuje, že o rozpor jít nemusí. Navíc je třeba mít na paměti, že zatímco soubor antropometricky charakterizovaných jedinců zahrnuje i diabetiky (starší jedinci s průměrným BMI již v pásmu obezity), soubor hodnocený v průběhu oGTT diabetiky zahrnovat nemohl.
Genetická analýza odhalila dva geny, u nichž je pravděpodobná účast na regulaci konečné hmotnosti novorozenců. Je jimi Ngn3 a PPARα. Ngn3 neboli neurogenin3 je transkripční faktor nepostradatelný pro správný vývoj pankreatu a střeva [31]. V ontogenezi se podílí na formování neuroektodermu, odtud název. Polymorfizmy v tomto genu jsou v současnosti zkoumány v souvislosti s diabetem a obezitou [32 – 35]. Studie zabývající se vztahem mezi tímto genem a porodní hmotností dosud nebyly publikovány. Jak je patrné z našeho výzkumu, tento polymorfizmus se může na regulaci hmotnosti novorozenců podílet, a stát tak i v pozadí budoucí případné predispozice těchto dětí k DM2T. Druhým genem, který prokázal statistickou významnost ve vztahu k porodní hmotnosti, je PPARα a polymorfizmus rs1800206. Gen je opět transkripčním faktorem z rodiny jaderných receptorů a účastní se oxidace mastných kyselin. Již několik let patří k nejintenzivněji studovaným genům v souvislosti s diabetem [36 – 38]. Závěry studií hodnotících asociaci polymorfizmu rs1800206 s DM2T jsou značně kontroverzní, některé asociaci nepotvrzují vůbec [36], většina však považuje minoritní alelu 162V za rizikovou [38]. Studií zabývajících se souvislostí genu s porodní hmotností není mnoho a neplynou z nich jednoznačné závěry [39]. Hodnocení rozložení alelických četností mezi kvartily porodní váhy v naší práci odhaluje asociaci s porodní hmotností, vzhledem k nízkému zastoupení minoritní alely, a tím i extrémně vzácnému výskytu jedinců v této alele homozygotních, bude třeba výrazné rozšíření souboru pro přesvědčivou interpretaci získaných dat.
Pohlédneme li komplexně na uvedené výsledky studie, nemůžeme s určitostí jmenovat konkrétní alely genů v přímé souvislosti s hypotézami fetálního růstu. Přesto naše data nastiňují zajímavý obraz, který by mohl vypovídat o zatím nejasných mechanizmech stojících v pozadí rozvoje DM2T. Tvar křivky „U“ na obr. 1 je dán dvěma zcela odlišnými výchozími pozicemi novorozenců (nízká vs vysoká porodní hmotnost dětí geneticky různě disponovaných rodičů) a následnými rozdílnými etiopatologickými drahami. Z našich dat vyplývá, že zatímco děti s vysokou porodní hmotností mají často tendenci setrvávat v pásmu vysoké tělesné hmotnosti i v dospělosti a právě velké množství viscerálního tuku u nich může být příčinou zvýšeného rizika DM2T, děti spadající do pásma nejnižší porodní hmotnosti mají vyšší riziko diabetu na základě odlišných mechanizmů. Potenciálním nebezpečím a případnou kauzální příčinou rozvoje DM2T je u nich patrně dispozičně snížená IS (koresponduje s fetální inzulinovou hypotézou a zároveň i s hypotézou fetálního programování) a až teprve s přibývajícím věkem, a tím v mnoha případech i s přibývajícími kilogramy, se tato latentní predispozice projeví ve formě manifestního DM2T. Takovému schématu přesně odpovídá i věkové složení našich souborů: antropometricky byli hodnoceni všichni účastníci studie včetně věkově nejstarších diabetiků a vyšla asociace vysoké porodní hmotnosti s vysokými hodnotami tělesné hmotnosti, BMI a obvody pasu v dospělosti. Naproti tomu snížené hodnoty IS, které byly popsány u jedinců s nejnižší porodní hmotností, vycházejí z hodnot měřených v průběhu oGTT, tedy bez diabetiků. Věkový průměr souboru tak činí 32 let, a co je velice podstatné, průměrné BMI souboru je 23,9 kg/ m2. Bylo by proto podnětné a pro dokreslení nastíněných schémat nezbytné vyšetřit opakovaně za 15 – 20 let alespoň ty jedince stávajícího souboru, kteří spadají do kategorie nejnižší porodní hmotnosti. Jaké procento z nich se během této doby zařadí do pásma nadváhy či obezity? Projeví se nárůst hmotnosti u těchto jedinců, kteří dnes vykazují nižší IS pouze při zátěžovém testu, rozvojem dalších symptomů DM2T? Bude křivka „U“ na obr. 1 podložena dalšími případy manifestace DM2T v úseku odpovídajícím nejnižším hodnotám porodní hmotnosti?
Závěr
Význam porodní hmotnosti jako faktoru, který se může uplatňovat v predispozici k metabolickým onemocněním, je diskutován již dlouho. Zdá se, že interakce porodní hmotnosti s geny účastnými v glukózovém metabolizmu a metabolizmu lipidů je důležitou součástí mozaiky DM2T. Naše studie nalezla asociace vysoké porodní hmotnosti s vyšší tělesnou hmotností a BMI v dospělosti. Nízká porodní hmotnost byla asociována s vyššími stimulovanými hodnotami glykemie a inzulinemie a s nižší periferní inzulinovou senzitivitou vyjádřenou formou Cederholmova indexu. Genetická analýza poukazuje na 2 geny s pravděpodobným vlivem na regulaci konečné hmotnosti novorozence: Ngn3 (polymorfizmus rs41277236) a PPARα (polymorfizmus rs1800206). Porozumění zákonům, kterými se řídí rané vývojové fáze plodu, a odhalení jejich vztahu k tělesnému složení, citlivosti k inzulinu a případné predispozici k DM2T na úrovni genů – to je náročný úkol současného a budoucího výzkumu, neboť jeho postupné plnění je nutným předpokladem pro vývoj cílené farmakoterapie, která by pomohla mnoha projevům této nemoci v populaci předcházet. Z naší studie jednoznačně vyplývá, že údaje o porodní hmotnosti by měly být součástí základní anamnézy.
Studie je podporována grantem IGA MZ ČR NS/ 10209 - 3/ 2009.
Seznam zkratek
ABCC – ATP binding casette subfamily C
ADIPOQ – adipocyte - ,C1q - ,and collagen domail - containing; adiponectin
Apo E – apolipoprotein E
β2AR – β2 adrenergní receptor
β3AR – β3 adrenergní receptor
CDKAL – CDK5 regulatory subunit associated protein1 like
CDKN2A/ B – cyclin dependent kinase inhibitor 2A/ B
FABP – fatty acid binding protein
FTO – fat mass and obesity associated protein
GCK – glukokináza
HHEX-IDE – hematopoetically expressed homeobox - insulin degrading enzyme
HNF1B – hepatic nuclear factor 1β
IGF2BP – insulin like growth factor 2 binding protein
IL – interleukin
INS VNTR – variable number of tandem repeates v genu pro inzulin
INSR – inzulinový receptor
IPF – insulin promoter factor
JAZF – just another zinc finger protein; zinc finger protein 346
KCNJ – potassium channel inwardly rectifying
LRP – low density lipoprotein receptor related protein
NMB – neuromedin B
NME – protein expressed in nonmetastatic cells
MUFA – monounsaturated fatty acids
PGC1A – PPARγ coactivator 1α
PPARα – peroxisome proliferator activated receptor α
PPARγ – peroxisome proliferator activated receptor γ
PUFA – polyunsaturated fatty acids
RFLP – restriction fragments length polymorphism
SFA – saturated fatty acids
SHBG – sex hormon binding globulin
SLC30A – solute carrier family 30 (zinc transporter); člen rodiny zinkových transportérů
SREBF – sterol regulatory element binding transcription factor
SSCP – single stranded conformation polymorphism
TCF7L – transcription factor 7 like
UCP – uncoupling protein
RNDr. Daniela Vejražková, Ph.D.
www.endo.cz
e-mail: dvejrazkova@endo.czDoručeno do redakce: 4. 10. 2010
Zdroje
1. Barker DJ, Hales CN, Fall CH et al. Type 2 (non‑insulin‑dependent) diabetes mellitus, hypertension and hyperlipidaemia (syndrome X): relation to reduced fetal growth. Diabetologia 1993; 36 : 62 – 67.
2. Hales CN, Barker DJ, Clark PM et al. Fetal and infant growth and impaired glucose tolerance at age 64. BMJ 1991; 303 : 1019 – 1022.
3. Frayling TM, Hattersley AT. The role of genetic susceptibility in the association of low birth weight with type 2 diabetes. Br Med Bull 2001; 60 : 89 – 101.
4. Harder T, Rodekamp E, Schellong K et al. Birth weight and subsequent risk of type 2 diabetes: a meta‑analysis. Am J Epidemiol 2007; 165 : 849 – 857.
5. Whincup PH, Kaye SJ, Owen CG et al. Birth weight and risk of type 2 diabetes: a systematic review. JAMA 2008; 300 : 2886 – 2897.
6. Godfrey KM, Barker DJ. Fetal nutrition and adult disease. Am J Clin Nutr 2000; 71 (Suppl 5): 1344S – 1352S.
7. Meas T, Deghmoun S, Alberti C et al. Independent effects of weight gain and fetal programming on metabolic complications in adults born small for gestational age. Diabetologia 2010; 53 : 907 – 913.
8. Hattersley AT, Beards F, Ballantyne E et al. Mutations in the glucokinase gene of the fetus result in reduced birth weight. Nat Genet 1998; 19 : 268 – 270.
9. Hattersley AT, Tooke JE. The fetal insulin hypothesis: an alternative explanation of the association of low birthweight with diabetes and vascular disease. Lancet 1999; 353 : 1789 – 1792.
10. Ong KK, Dunger DB. Thrifty genotypes and phenotypes in the pathogenesis of type 2 diabetes mellitus. J Pediatr Endocrinol Metab 2000; 13 (Suppl 6): 1419 – 1424.
11. Ong KK, Ahmed ML, Emmett PM et al. Association between postnatal catch ‑ up growth and obesity in childhood: prospective cohort study. BMJ 2000; 320 : 967 – 971.
12. Stettler N, Bovet P, Shamlaye H et al. Prevalence and risk factors for overweight and obesity in children from Seychelles, a country in rapid transition: the importance of early growth. Int J Obes Relat Metab Disord 2002; 26 : 214 – 219.
13. Stettler N, Zemel BS, Kumanyika S et al. Infant weight gain and childhood overweight status in a multicenter, cohort study. Pediatrics 2002; 109 : 194 – 199.
14. Yajnik C. Interactions of perturbations in intrauterine growth and growth during childhood on the risk of adult ‑ onset disease. Proc Nutr Soc 2000; 59 : 257 – 265.
15. Durmuş B, Mook ‑ Kanamori DO, Holzhauer S et al. Growth in foetal life and infancy is associated with abdominal adiposity at the age of 2 years: the generation R study. Clin Endocrinol (Oxf) 2010; 72 : 633 – 640.
16. Ibáñez L, Ong K, de Zegher F et al. Fat distribution in non‑obese girls with and without precocious pubarche: central adiposity related to insulinaemia and androgenaemia from prepuberty to postmenarche. Clin Endocrinol (Oxf) 2003; 58 : 372 – 379.
17. Tzoulaki I, Sovio U, Pillas D et al. Relation of immediate postnatal growth with obesity and related metabolic risk factors in adulthood: the northern Finland birth cohort 1966 study. Am J Epidemiol 2010; 171 : 989 – 998.
18. Slingerland AS, Hattersley AT. Activating mutations in the gene encoding Kir6.2 alter fetal and postnatal growth and also cause neonatal diabetes. J Clin Endocrinol Metab 2006; 91 : 2782 – 2788.
19. Støy J, Edghill EL, Flanagan SE et al. Insulin gene mutations as a cause of permanent neonatal diabetes. Proc Natl Acad Sci USA 2007; 104 : 15040 – 15044.
20. Babenko AP, Polak M, Cavé H et al. Activating mutations in the ABCC8 gene in neonatal diabetes mellitus. N Engl J Med 2006; 355 : 456 – 466.
21. Edghill EL, Bingham C, Slingerland AS et al. Hepatocyte nuclear factor ‑ 1 beta mutations cause neonatal diabetes and intrauterine growth retardation: support for a critical role of HNF ‑ 1beta in human pancreatic development. Diabet Med 2006; 23 : 1301 – 1306.
22. Freathy RM, Bennett AJ, Ring SM et al. Type 2 diabetes risk alleles are associated with reduced size at birth. Diabetes 2009; 58 : 1428 – 1433.
23. Zhao J, Li M, Bradfield JP et al. Examination of type 2 diabetes loci implicates CDKAL1 as a birth weight gene. Diabetes 2009; 58 : 2414 – 2418.
24. Eriksson JG, Forsen TJ, Osmond C et al. Pathways of infant and childhood growth that lead to type 2 diabetes. Diabetes Care 2003; 26 : 3006 – 3010.
25. Pulizzi N, Lyssenko V, Jonsson A et al. Interaction between prenatal growth and high‑risk genotypes in the development of type 2 diabetes. Diabetologia 2009; 52 : 825 – 829.
26. Dabelea D, Hanson RL, Lindsay RS et al. Intrauterine exposure to diabetes conveys risks for type 2 diabetes and obesity: a study of discordant sibships. Diabetes 2000; 49 : 2208 – 2211.
27. Martin R, Saller K. Lehrbuch der Anthropologie in systematischer Darstellung. Stuttgart: G. Fischer Verlag 1959.
28. Bláha P. Antropo – ein Programm für automatische Bearbeitung antropologischer Daten. Wiss. Zeitschrift der Humboldt ‑ Universitat zu Berlin 1991; 5 : 153 – 156.
29. Cederholm J, Wibell L. Insulin release and peripheral sensitivity at the oral glucose tolerance test. Diabetes Res Clin Pract 1990; 10 : 167 – 175.
30. Radikova Z. Assessment of insulin sensitivity/ resistance in epidemiological studies. Endocr Regul 2003; 37 : 189 – 194.
31. Wang J, Cortina G, Wu SV et al. Mutant neurogenin‑3 in congenital malabsorptive diarrhea. N Engl J Med 2006; 355 : 270 – 280.
32. Edghill EL, Minton JA, Groves CJ et al. Sequencing of candidate genes selected by beta cell experts in monogenic diabetes of unknown aetiology. JOP 2010; 11 : 14 – 17.
33. Jiang FX, Mehta M, Morahan G. Quantification of insulin gene expression during development of pancreatic islet cells. Pancreas 2010; 39 : 201 – 208.
34. Danilova OV, Tai AK, Mele DA et al. Neurogenin 3 - specific dipeptidyl peptidase ‑ 2 deficiency causes impaired glucose tolerance, insulin resistance, and visceral obesity. Endocrinology 2009; 150 : 5240 – 5248.
35. Yechoor V, Liu V, Paul A et al. Gene therapy with neurogenin 3 and betacellulin reverses major metabolic problems in insulin‑deficient diabetic mice. Endocrinology 2009; 150 : 4863 – 4873.
36. Silbernagel G, Stefan N, Hoffmann MM et al. The L162V polymorphism of the peroxisome proliferator activated receptor alpha gene (PPARA) is not associated with type 2 diabetes, BMI or body fat composition. Exp Clin Endocrinol Diabetes 2009; 117 : 113 – 118.
37. Ordovas JM. Genetic links between diabetes mellitus and coronary atherosclerosis. Curr Atheroscler Rep 2007; 9 : 204 – 210.
38. Andrulionyte L, Kuulasmaa T, Chiasson JL et al. Single nucleotide polymorphisms of the peroxisome proliferator‑activated receptor‑alpha gene (PPARA) influence the conversion from impaired glucose tolerance to type 2 diabetes: the STOP ‑ NIDDM trial. Diabetes 2007; 56 : 1181 – 1186.
39. Williams PJ, Marten N, Wilson V et al. Influence of birth weight on gene regulators of lipid metabolism and utilization in subcutaneous adipose tissue and skeletal muscle of neonatal pigs. Reproduction 2009; 138 : 609 – 617.
Štítky
Diabetológia Endokrinológia Interné lekárstvo
Článek HIV lipodystrofieČlánek Prof. MU Dr. Ctirad John, DrSc. – doyen českých a slovenských lékařských mikrobiologů a imunologůČlánek Vliv saturace jódem na výskyt tyreopatií ve vybraných regionech u dospělé populace České republikyČlánek Hodnotenie aktivity 11β- hydroxysteroid dehydrogenázy typu 1 u pacientiek s reumatoidnou artritídou
Článok vyšiel v časopiseVnitřní lékařství
Najčítanejšie tento týždeň
2010 Číslo 12- Parazitičtí červi v terapii Crohnovy choroby a dalších zánětlivých autoimunitních onemocnění
- Význam hydratace při hojení ran
- Statinová intolerance
- Genetický podklad a screening familiární hypercholesterolémie
- Pleiotropní účinky statinů na kardiovaskulární systém
-
Všetky články tohto čísla
- Markery funkcie endotelu vo včasných štádiách esenciálnej hypertenzie a účinok antihypertenznej terapie
- HIV lipodystrofie
- Postavení metforminu jako antidiabetika první volby
- Plicní forma histiocytózy z Langerhansových buněk – hodnocení aktivity nemoci a léčebné odpovědi pomocí PET‑CT (indexu SUVmax Pulmo/ SUVmax Hepar). Popis vlastních zkušeností a přehled literatury
- Doporučený postup pro indikaci molekulárně genetických vyšetření v rámci diagnostiky trombofilních stavů v žilním systému
- Klinické fórum expertov: Diagnostika a liečba akútnych porfýrií. 11.– 12. júna 2010, Paríž (Francúzsko)
- Prof. MU Dr. Ctirad John, DrSc. – doyen českých a slovenských lékařských mikrobiologů a imunologů
- Marek J et al. Farmakoterapie vnitřních nemocí. 4. zcela přepracované a doplněné vydání. Praha: Grada Publishing 2010. Počet stran 777. ISBN 978- 80- 247- 2639- 7.
- Olejárová M. Biologická léčba v revmatologii. Praha: Mladá fronta 2010. Počet stran 151. ISBN 978- 80- 204- 2281- 1.
- Prof. MU Dr. RNDr. Luboslav Stárka, DrSc., osmdesátníkem
- Vliv saturace jódem na výskyt tyreopatií ve vybraných regionech u dospělé populace České republiky
- Aktivita osi hypotalamus- hypofýza- nadoblička u pacientov s reumatoidnou artritídou
- Hodnotenie aktivity 11β- hydroxysteroid dehydrogenázy typu 1 u pacientiek s reumatoidnou artritídou
- Genetické pozadie nádorov kôry nadobličiek – aktuality
- Imunoendokrinní vztahy u nadledvin
- Extrémně nízké hladiny SHBG jako důsledek polymorfizmu Pro156Leu v genu pro SHBG – kazuistiky dvou žen se syndromem polycystických ovarií
- Genetické pozadie nádorov adrenomedulárneho a extraadrenálneho chromafinného tkaniva – aktuality
- Porodní hmotnost a genetické pozadí rizika diabetes mellitus 2. typu u české populace
- Jodový deficit ve světě i v České republice – současný stav a perspektivy
- Vnitřní lékařství
- Archív čísel
- Aktuálne číslo
- Iba online
- Informácie o časopise
Najčítanejšie v tomto čísle- Extrémně nízké hladiny SHBG jako důsledek polymorfizmu Pro156Leu v genu pro SHBG – kazuistiky dvou žen se syndromem polycystických ovarií
- Plicní forma histiocytózy z Langerhansových buněk – hodnocení aktivity nemoci a léčebné odpovědi pomocí PET‑CT (indexu SUVmax Pulmo/ SUVmax Hepar). Popis vlastních zkušeností a přehled literatury
- Aktivita osi hypotalamus- hypofýza- nadoblička u pacientov s reumatoidnou artritídou
- HIV lipodystrofie
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy