-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Urologické malignity u nemocných po transplantaci ledviny
UROLOGIC MALIGNANCIES IN PATIENTS WITH KIDNEY TRANSPLANT
This paper offers an overview on a tumor pathogenesis in patients after organ transplantations. The urologic malignancies represent common tumor complications occurring in the patients after transplantations, with kidney tumors having the highest incidence. The authors of this article present general recommendations for screening malignancies and therapeutic approaches. The care about patients with tumor after the transplantation requires interdisciplinary and often individualized approach in specialized centers.
KEY WORDS:
transplantation, urologic malignancies, complication
Autori: J. Pacovsky; P. Navrátil; M. Broďák; L. Holub; J. Košina; P. Hušek
Pôsobisko autorov: Urologická klinika, FN a LF UK v Hradci Králové
Vyšlo v časopise: Urol List 2009; 7(1): 49-54
Súhrn
Tato práce podává souhrnný přehled o patogenezi nádorů u nemocných po orgánových transplantacích. Urologické malignity patří mezi často se vyskytující nádorové komplikace transplantací. Nádory ledvin jsou svou četností na prvním místě. V článku jsou popisována obecná doporučení stran screeningu malignit a přístupu k jejich léčbě. Péče o nemocné po transplantaci s malignitou vyžaduje interdisciplinární přístup ve specializovaných centrech. Velmi často tato péče vyžaduje individualizovaný přístup.
KLÍČOVÁ SLOVA:
transplantace, urologická malignita, komplikace1. ÚVOD
Transplantace ledviny se stala standardem chirurgické léčby renálního selhání u indikovaných nemocných. Úspěch transplantace je závislý na správném provedení chirurgického výkonu a zejména na další péči o nemocného. Možnosti úspěšné transplantace ledviny jsou podmíněny dlouhodobým podáváním imunosupresivní léčby.
V současnosti existuje řada protokolů, které by měly zaručit optimální imunosupresivní účinek s minimem nežádoucích účinků. Základem je použití kalcineurinových inhibitorů (CNI – cyklosporin A, tacrolimus), které mají zamezit předání signálu z cytosolu do buněčného jádra lymfocytu a tak zabránit transkripci nukleových kyselin a následně proteosyntéze. Dále se používají inhibitory savčích receptorů pro rapamycin (mammalian targets of rapamycine, mTOR inhibitory), které vlastní blokádou proteosyntézy brání klonální expanzi již aktivovaných lymfocytů. Do této skupiny patří sirolimus, everolimus, mykofenolát mofetil a kyselina mykofenolová. Ve většině stávajících protokolů jsou nedílnou součástí imunosupresivních směsí steroidy. Nejčastěji používaným je perorální prednison, který se používá jako součást udržovací terapie. V perioperačním období a při léčbě akutní celulární rejekce se používá metylprednisolon ve vysokých dávkách, který je aplikován intravenózně. V indikovaných případech je terapie doplněna monoklonálními či polyklonálními protilátkami proti povrchovým receptorům CD3 či CD20. Protilátky se používají jako indukční terapie bezprostředně před transplantací a následně časně po transplantaci nebo se používají k terapii kortikorezistentní rejekce.
Cílem použité imunosuprese je minimalizovat imunitní reakci organizmu příjemce, která vede k odmítnutí transplantovaného orgánu (rejekci). Cílené potlačení imunity s sebou nese řadu vedlejších účinků. Imunosuprese zvyšuje riziko rozvoje oportunních infekcí, a to bakteriálních, virových i mykotických. U transplantovaných nemocných se tak setkáváme s klinickou manifestací v běžné populaci raritních infekcí, které jsou pro transplantovaného pacienta velmi závažné a nezřídka mohou mít i fatální důsledky. Navíc imunosupresivní léčba modifikuje standardní klinický obraz a tak ztěžuje včasnou a správnou diagnostiku.
Díky podávané imunosupresi dochází k narušení fyziologických funkcí zajišťujících protinádorovou imunitu. To se v potransplantačním období projevuje i vyšším výskytem malignit. Nejčastěji se vyskytující jsou lymfoproliferativní onemocnění. Z orgánových tumorů se nejčastěji setkáváme s kožními malignitami, z nekožních orgánových tumorů hrozí nejvyšší riziko výskytu karcinomu vlastních ledvin [1, 2].
2. EPIDEMIOLOGIE A PATOGENEZE
2.1 Epidemiologie
Každoročně se u pacientů po transplantaci ledviny objeví maligní onemocnění s incidencí 1–7 %. Celkové kumulativní riziko vzniku nekožní malignity po transplantaci solidního orgánu je 33 % během třicetiletého období po transplantaci [3]. Za rizikové faktory vzniku malignity v potransplantačním období je považován věk nemocného, počet transplantovaných orgánů, použití CNI v imunosupresivním protokolu a narůstající doba od transplantace. Průměrná doba mezi transplantací a diagnostikou malignity u nemocných po transplantaci se udává 45–48 měsíců. Průměrný věk nemocných po transplantaci, ve kterém je malignita diagnostikována, je 55–61 roků. Pokud se malignita objeví, pak je celkové jednoleté, resp. dvouleté přežití 79 %, resp. 66 %, u nekožních malignit je to 64 %, resp. 51 % a u malignit kožních 89 %, resp. 89 % [4,5,6,7,8,9].
2.2 Transfer od dárce
K rozvoji maligního nádoru u pacienta po transplantaci ledviny může dojít třemi způsoby. Může dojít k přenosu malignity z organizmu dárce transplantovaným orgánem, může dojít k recidivě nádoru, pro který byl příjemce léčen v minulosti a do doby transplantace byl v remisi, nebo vzniká malignita v organizmu příjemce de novo [1].
Důkladné vyšetření potenciálního dárce včetně využití dostupných zobrazovacích a laboratorních technik by mělo vyloučit nebo alespoň minimalizovat přenos malignity z dárce. Incidentální mikroskopické malignity však ani touto cestou vyloučit nelze, což s sebou při-náší – byť nízké – riziko přenosu. V současnosti je reálné riziko přenosu malignity u jednoho ze 6000 dárců a riziko, že příjemce zemře na malignitu přenesenou od dárce, je 1/15 000 transplantací [1,2,10].
2.3 Preexistující malignita u příjemce
V současnosti je na čekací listině na transplantaci ledviny velké množství nemocných, kteří mají ve své anamnéze úspěšně léčenou malignitu. Ta není kontraindikací k transplantaci, přesto je třeba vědět, že existuje reálné riziko recidivy maligního onemocnění po provedené transplantaci. Celkově toto riziko dosahuje až 21 % u nádorů léčených před transplantací, u nádorů léčených po transplantaci je celkové riziko recidivy ještě vyšší, dosahuje 33 % [11]. Riziko je dáno typem léčené malignity a také dobou mezi léčbou malignity a provedenou transplantací. U nemocných léčených pro malignitu v průběhu 24 měsíců před transplantací je riziko recidivy 54 %, u nemocných léčených 24–60 měsíců před transplantací je riziko recidivy 33 % a u transplantací provedených více než 60 měsíců od dokončení onkologické léčby riziko recidivy klesá na 13 %. Nejvyšší četnost recidiv je u karcinomu prsu (23 %), karcinomu ledviny > 5 cm (27 %), sarkomů (29 %), karcinomu močového měchýře (29 %), nemelanomového kožního karcinomu (53 %) a myelomu (67 %) [12]. Na znalostech těchto statistických dat jsou založena vstupní kritéria pro zapsání nemocného na čekací listinu k transplantaci, včetně doporučených tumor-free intervalů mezi ukončením onkologické léčby a provedením transplantace, jejichž dodržení zvyšuje onkologickou bezpečnost pro nemocného (tab. 1) [10,11,13,14,48].
Tab. 1. Doporučený tumor-free interval mezi dokončením onkologické léčby a transplantací. 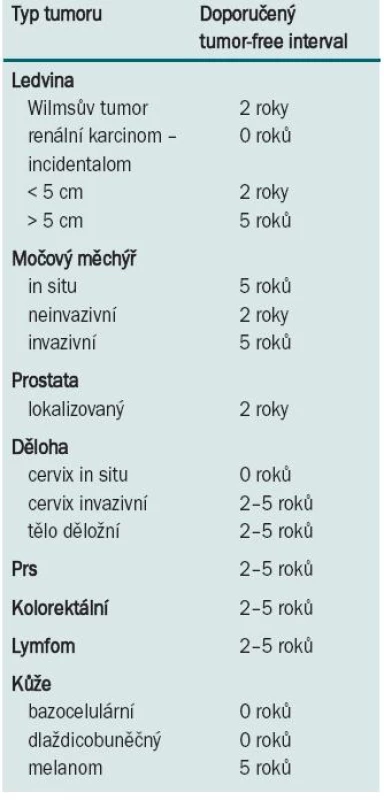
2.4 Malignita po transplantaci de novo
De novo vzniklé malignity a jejich časná diagnostika je otázkou důkladné dispenzární péče po transplantaci ledviny. Je známo, že výskyt malignit je po transplantaci vyšší než v běžné populaci. Na druhou stranu jsou určité druhy nádorů, u kterých je incidence nižší než v populaci netransplantovaných pacientů. Příkladem může být karcinom prostaty, kdy incidence karcinomů v populaci mužů po transplantaci ledviny může být i nižší a navíc se obvykle jedná o karcinomy s nižším maligním potenciálem [3,14].
2.5 Role imunosuprese v onkogenezi po transplantaci
Na vzniku malignity de novo po transplantaci ledviny se podílí řada faktorů. Imunosupresivní terapie patří mezi ty nejzávažnější. Kalcineurinové inhibitory (CNI) stimulují onkogenezi přímou indukcí transformujícího růstového faktoru beta (TGF-b), která je zcela nezávislá na hostitelském imunitním systému. Největší vliv na indukci malignit byl pozorován u antimetabolitů, mezi které se řadí azathioprin. V případě jeho využití je pozorován nejvyšší výskyt potransplantačních malignit [15]. Výskyt Kaposiho sarkomu je u pacientů léčených azathioprinem 400–500× vyšší než v běžné populaci. Imunosupresiva se uplatňují v onkogenezi navíc i ovlivněním tvorby vaskulárního endoteliálního růstového faktoru (VEGF).
Ne všechna imunosupresiva mají stejný tumorogenní účinek. Jak již bylo řečeno, největší onkogenní potenciál má azathioprin, který je následován kalcineurinovými inhibitory. Na druhou stranu existuje skupina imunosupresiv, která mají protitumorózní účinky. Jedná se o skupinu mTOR inhibitorů (mammalian target of rapamycine), která patří do rodiny imunosupresivních antibiotik. K nim se řadí sirolimus, temsirolimus a everolimus. Jejich působení je založeno na inhibici proteosyntézy. Z hlediska imunosupresivního účinku brání klonální expanzi aktivovaných T lymfocytů, a tím rozvoji akutní rejekce. Inhibitory mTOR se kromě transplantologie používají i v obecné onkologii, například v léčbě diseminovaného renálního karcinomu. Z onkologického hlediska tyto preparáty inhibují proliferaci, invazi a rozvoj metastáz u nádorových buněk, navíc dokáží indukovat jejich apoptózu [16,42,43,44]. Těchto vlastností se využívá k léčbě pacientů po transplantaci orgánů, u kterých je diagnostikován maligní tumor. V řadě protokolů je nedílnou součástí konverze imunosupresivního režimu na sirolimus, který by měl být z hlediska imunosupresivního i onkologického vhodný a bezpečný [17].
2.6 Role virů v onkogenezi
Jak již bylo řečeno, použitá imunosuprese vytváří příznivé podmínky pro rozvoj oportunních infekcí. Z hlediska onkogeneze se nejvýznamněji uplatňují lidské papiloma viry (HPV), cytomegaloviry (CMV) a virus Epstein-Barrové (EBV). Viry EBV jsou prokazatelně zodpovědné zejména za rozvoj lymfoproliferativních chorob, lidské herpetické viry (HHV) za vznik Kaposiho sarkomu a HPV za vznik dlaždicobuněčného karcinomu kůže, vulvy, vaginy a děložního čípku [3]. Právě virové infekce jsou zodpovědné za „downregulaci“ proteinu p53 a ovlivnění schopnosti adheze natural killerů (NK) na endotel. Těmito mechanizmy pak snadněji dochází k útlumu přirozené antitumorózní ochrany organizmu a rozvoji malignity u imunosuprimovaných nemocných po transplantacích.
3. NÁDOROVÉ MARKERY PO TRANSPLANTACI
Po transplantaci orgánu se situace z onkologického hlediska komplikuje ještě dalšími faktory. Nasazená imunosuprese může zkreslovat řadu příznaků a tak znesnadnit či oddálit stanovení správné diagnózy. Do tohoto složitého systému vstupuje i omezená možnost využití standardně používaných nádorových markerů. Je známo, že řada markerů ztrácí svou validitu v důsledku změněné glomerulární filtrace aminokyselin, peptidů a proteinů s krátkou molekulou. I vlastní imunosuprese může ovlivnit reaktivitu řady peptidů a bílkovin. To v konečném důsledku vede k významnému poklesu senzitivity a specificity některých nádorových markerů. Mezi často používané markery, jejichž senzitivita i specificita u pacientů po transplantaci klesá dokonce až pod 60 %, patří CEA, CA15-3, CA19-9, CA125, CA72-4, TPA a TPS. Použití těchto markerů pro screening, diagnostiku či sledování terapie je u nemocných po transplantaci naprosto zavádějící, a proto jsou nevhodné pro standardní klinické využití. Na druhou stranu u markerů běžně využívaných v urologii (PSA, b-HCG, AFP, LDH, NSE) nebyla prokázána změna senzitivity a specificity u nemocných po transplantaci. Jejich použití u této skupiny nemocných není limitováno [3,18].
4. UROLOGICKÉ MALIGNITY PO TRANSPLANTACI
Pacient po jakékoliv orgánové transplantaci může být postižen urologickou malignitou. Nejčastěji se setkává s karcinomem ledviny, prostaty, močového měchýře a varlete. U pacientů po transplantaci ledviny se může objevit i karcinom transplantované ledviny. Incidence těchto urologických malignit je po transplantacích cca 0,38–1,9 %, ve srovnání s běžnou populací je cca 10× vyšší [19,20]. Kumulativní riziko jednotlivých malignit je prezentováno v tab. 2 [4].
Tab. 2. Kumulativní incidence (%) urologických malignit v 1., 2. a 3. roce po transplantaci. 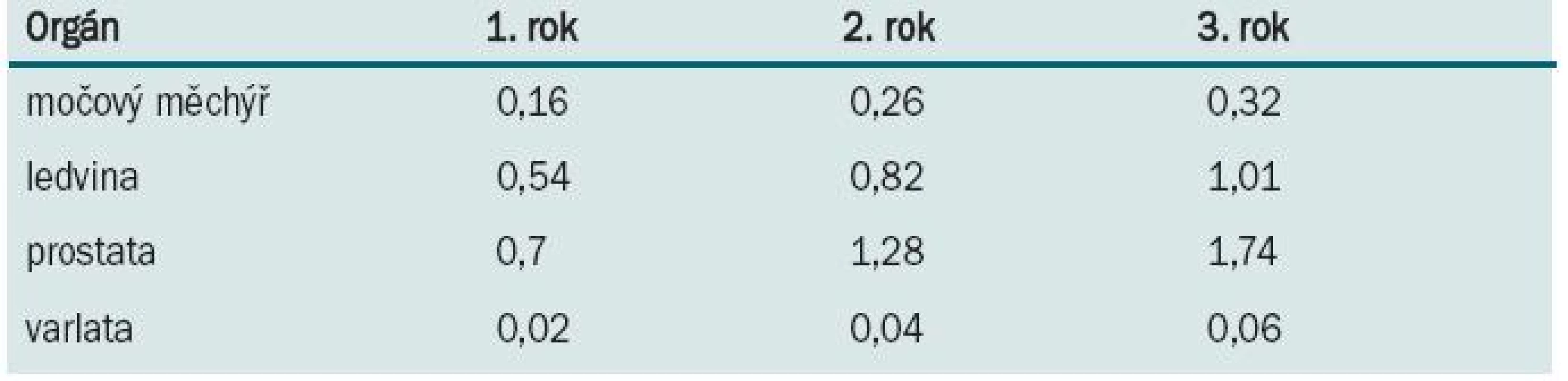
4.1 Karcinom ledviny
Karcinom ledviny se u nemocných po transplantaci ledviny vyskytuje ve dvou formách. Můžeme se setkat s karcinomem nativní ledviny nebo v transplantované ledvině. Karcinom ledviny v nativní ledvině patří k nejčastějším urologickým malignitám, které komplikují stav po transplantaci ledviny.
Pokud se v potransplantačním období objeví karcinom ledviny nativních ledvin, jedná se o absolutní indikaci k provedení radikální nefrektomie. Jedná-li se o lokalizovaný nádor, mělo by být provedení jednostranné nefrektomie dostatečným terapeutickým výkonem. V přibližně 2 % se karcinom nativní ledviny vyskytuje oboustranně, z toho důvodu se pak řada autorů kloní k provedení oboustranné nefrektomie. V obou případech však platí, že pokud jde o lokalizované onemocnění bez známek diseminace, není třeba upravovat imunosupresivní medikaci [21,22].
Jinou situací je, pokud se jedná o diseminovaný renální karcinom. V takovém případě je plně indikována oboustranná nefrektomie vlastních ledvin. Pokud je metastáza solitární nebo málo četná a resekabilní, je doporučována radikální operace se snahou o provedení radikální metastazektomie. Za této situace je indikována změna imunosuprese na sirolimus s důsledným vysazením CNI [21,22]. Pokud není metastáza renálního karcinomu resekabilní, pak lze využít možností imunoterapie stejně jako u netransplantovaných nemocných. Terapeutické využití interleukinu-2 (IL-2) však u transplantovaného nemocného s sebou přináší až 49% riziko akutní rejekce se ztrátou štěpu. Podání IL-2 u pacienta po transplantaci umožní aktivaci lymfocytů přesně opačným mechanizmem, než který se používá v indukční imunosupresivní terapii. Reakce organizmu je v tomto případě ovlivněna i dobou od transplantace. V každém případě podání IL-2 s sebou nese vysoké riziko rozvoje těžkého imunitního postižení štěpu [23,24,25,41]. Použití interferonu-a (INF-a) u nemocného po transplantaci ledviny s generalizovaným karcinomem ledviny je relativně bezpečnější. Riziko závažné akutní rejekce vedoucí ke ztrátě štěpu je udáváno mezi 20–37 % [26,27]. V současnosti se otevírá i možnost využití inhibitorů vaskulárního endoteliálního růstového faktoru (VEGF), jehož úspěšnost v léčbě diseminovaného renálního karcinomu se pohybuje kolem 30 %. Současné podání mTOR inhibitoru a inhibitoru VEGF potencuje protinádorové účinky obou preparátů. Nicméně klinické zkušenosti s využitím této kombinace u nemocných po transplantaci jsou doposud velmi malé a nelze je uvádět jako obecné doporučení [21,22].
Výskyt karcinomu transplantované ledviny není vysoký. Vzhledem k intenzitě dispenzarizace se téměř vždy jedná o malé incidentalomy. Léčbou volby je vždy nefron šetřící výkon, který zachová funkční ledvinu. Indikací k nefrektomii transplantované ledviny je nepříznivá lokalizace nádoru, multifokalita či přítomnost nádoru ve špatně funkčním štěpu [28]. V případě lokalizovaného a odstranitelného tumoru není indikována změna imunosuprese.
Samostatnou problematikou jsou uroteliální karcinomy horních močových cest – kalichů, pánviček a močovodů nativních ledvin. V případě jejich nálezu je nutné provedení oboustranné nefroure-terektomie a změna imunosuprese na sirolimus. Při pokročilém nálezu je ke zvážení i úplné vysazení imunosuprese a standardní onkologická léčba. V případě průkazu uroteliálního karcinomu močových cest transplantované ledviny je plně indikována nefrektomie postižené transplantované ledviny [4,29,30,31].
4.2 Karcinom močového měchýře
Uroteliální karcinom močového měchýře se vyskytuje s incidencí závislou na době od transplantace (3 roky po transplantaci je 3 %, 6 roků po transplantaci je 7,2 % a po deseti letech od transplantace je 17,2 %). Medián časného záchytu uroteliálního karcinomu je 58,7 měsíce od transplantace a tvoří cca 40 % všech urologických malignit u nemocných po transplantaci orgánů. Klinicky se manifestuje v 50–70 % mikroskopickou nebo makroskopickou nebolestivou hematurií nebo příznaky hyperaktivního močového měchýře až v 41 % [29,30,31,45]. Povrchový karcinom u nemocných po transplantaci ledviny recidivuje u 35 % nemocných.
Pro léčbu povrchového karcinomu močového měchýře platí některé obecné zásady, které se odlišují od léčebných možností používaných pro běžnou populaci. Endoskopická resekce patří k základním operačním technikám. Vzhledem k možnosti vezikoureterálního refluxu do transplantovaného močovodu je vhodné provedení cystografie k jeho vyloučení. Pokud je reflux přítomen, měla by se endoresekce provádět při založeném epicystostomickém drénu, který minimalizuje riziko pyelonefritidy štěpu při dlouhodobém výkonu a zejména minimalizuje riziko vzniku implantačních metastáz do horních močových cest [32].
V případě potřeby podání instilační chemoterapie je možné používat Mitomycin, Adriamycin či Epirubicin podle standardních schémat bez modifikace dávky či způsobu podání. Naopak instilace BCG vakcíny (Bacillus Calmette-Guérin) je u nemocných po transplantaci ledviny absolutně kontraindikována pro nepřijatelné riziko rozvoje tuberkulózní infekce, která může být pro nemocného s transplantovaným orgánem letální [32,33].
Pro nemocné s invazivně rostoucím karcinomem močového měchýře je nutná včasná a razantní terapie. Radikální cystektomie se zajištěním adekvátní derivace moči z transplantované ledviny je metodou volby. V takovém případě se doporučuje i současné provedení oboustranné nefroureterektomie nativních ledvin [46,47]. Pokud je indikována chemoterapie, pak její schéma je shodné se schématy u netransplantovaných nemocných, pouze je nutno modifikovat dávkování s přihlédnutím k aktuálním renálním funkcím. Radioterapie karcinomu močového měchýře je nevhodná, ne však absolutně kontraindikovaná. Radioterapie s sebou přináší riziko rozvoje radiační nefritidy, která obvykle končí nevratným poškozením štěpu a jeho selháním [34].
Z imunosuprese musí být vyloučeny CNI a je nutné převedení na sirolimus. Pokud to stav onemocnění a nemocného vyžaduje, což znamená, že existuje reálná šance na radikalitu léčby, pak si situace může vynutit i případné vysazení imunosuprese s rizikem selhání štěpu [4,29, 30,32].
4.3 Karcinom prostaty
Incidence karcinomu prostaty u nemocných je přibližně stejná jako v běžné populaci, podle některých statistik je dokonce nižší. Jedná se tedy o onemocnění časté. Na druhou stranu karcinom prostaty, který je u nemocných po transplantacích orgánů diagnostikován, je nízkého stadia a obvykle i nízkého Gleasonova skóre. Jde tedy obvykle o nízkorizikový karcinom. Příčina je spatřována v tom, že populace pacientů, kteří jsou zapsáni na čekací listinu a následně transplantováni, je mladší a je důkladně vyšetřena, včetně vyšetření urologického [4,14,35].
Léčba lokalizovaného karcinomu je shodná s léčbou nemocných, kteří nepodstoupili transplantaci. Radikální prostatektomie je léčbou volby. Názory na operační přístup se liší víceméně podle zvyklosti operatéra. V literatuře uváděný transperineální přístup jako přístup mnohem vhodnější je jinými vyvracen. Z publikovaných dat je patrné, že transperineální i retropubický přístup je vhodný a bezpečný i u nemocných po transplantaci ledviny. Z možných chirurgických technik u nemocných po transplantaci ledviny zaznívá nejvíce kritických hlasů na adresu laparoskopického přístupu. Vzhledem k potřebnému rozmístění portů a lokalizaci štěpu v pánvi je tedy laparoskopický přístup nejméně vhodný, nicméně není vyloučen [35,36,37,38].
Radioterapie karcinomu prostaty obecně nepatří mezi vhodné léčebné techniky u nemocných po transplantaci ledviny. U nemocných po transplantaci jiných orgánů je její využití bez omezení. Vzhledem k lokalizaci transplantované ledviny existuje vysoké riziko radiační nefritidy, která může vést k selhání štěpu v důsledku ireverzibilních tkáňových a cévních změn [34].
Hormonální léčba u nemocného po transplantaci není nijak omezena. Je možné využít agonistů gonadotropních hormonů, stejně tak i antiandrogenů bez zásadního vlivu na transplantovanou ledvinu [11,35].
V případě diagnostikovaného karcinomu prostaty u nemocného po transplantaci ledviny obecně není doporučována zásadní změna imunosuprese. Dle platných doporučení je vhodné udržovat hladiny CNI na dolních hranicích terapeutických hladin, není nutno vysazovat mykofenolát a ani není nutná změna imunosuprese na sirolimus [35].
Pokud je třeba provádět endoresekci prostaty, pak je vhodné tento výkon realizovat při založeném epicystostomickém drénu z důvodu eliminace rizik spojených s přetlakem perfuzní tekutiny během operačního výkonu.
4.4 Nádory varlete
Nádory varlete nepatří mezi častá onemocnění u pacientů po transplantaci orgánu. Diagnostika je shodná s nemocnými bez transplantace. Role nádorových markerů není dotčena podávanou imunosupresí [4]. Ze široké škály histologických typů maligních nádorů varlete jsou pozorovány téměř výhradně seminomy [39].
Léčebné přístupy jsou závislé na histologickém typu a rozsahu onemocnění. Pokud je třeba radioterapie, je nutné důsledné stínění transplantované ledviny z důvodu jejího ireverzibilního poškození [33]. Při podávání chemoterapie je třeba respektovat aktuální renální funkce a eventuálně eliminovat využití nefrotoxických preparátů. Chirurgický přístup k případné retroperitoneální lymfadenektomii není přítomností transplantované ledviny modifikován.
Z hlediska použité imunosuprese není nutné přerušení léčby, je však doporučována její minimalizace – snahou je převedení na nízko dávkované CNI protokoly. Měla by být vysazena přídatná terapie mykofenolátem, stejně jako steroidy. Nebyl pozorován profit z převedení na sirolimus [40].
5. ZÁVĚR
Malignity u nemocných po transplantacích jsou velmi závažnou komplikací. Obecně je jejich incidence v transplantované populaci ve srovnání s běžnou populací vyšší. Rovněž tak je maligní diagnóza pro nemocného po transplantaci závažnější. Navíc malignity u nemocného mají vyšší tendenci recidivovat. Vzhledem k tomu řada používaných nádorových markerů není u těchto nemocných validní, nelze je v běžné praxi používat. V rámci léčby zhoubného onemocnění jsme velmi často nuceni provádět změny stávajícího imunosupresivního režimu. Obvykle je nutno redukovat dávky na dolní hranici terapeutických hladin, někdy je nutno snížit dávky až pod potřebné hladiny, v extrémních případech je nutno imunosupresivní látku zcela vysadit. Mezi obecná doporučení patří, pokud je to možné, změna imunosuprese na sirolimus, který má antitumorózní účinek.
Problémem léčby malignit u nemocných po transplantaci je vysoké riziko poškození funkce transplantovaného orgánu. Důvodů je hned několik. Jednak jsme často nuceni k minimalizaci, nebo dokonce k vysazení imunosuprese. I převedení na jiný imunosupresivní režim je vždy rizikovým obdobím rozvoje akutní rejekce i dlouhodobě po úspěšné transplantaci. Dalším důvodem je zahájení onkologické léčby, která je v řadě případů sama o sobě hepatotoxická, nefrotoxická či myelotoxická.
U nemocných po transplantaci je třeba o riziku rozvoje maligního onemocnění vědět a cíleně po něm pátrat. Byla proto vypracována schémata doporučených vyšetření, která by měla vést k časné diagnostice a včasnému zahájení léčby, a tím výrazně zlepšit prognózu nemocných (tab. 3) [4]. Dále je třeba vědět, že u nemocných po transplantaci nelze využít některých standardně využívaných markerů, které v rámci sledování mohou být naprosto falešně negativní.
Tab. 3. Protokol onkologického screeningu u nemocných po transplantaci. 
Péče o transplantovaného nemocného s urologickou malignitou by měla být vždy soustředěna do specializovaného centra, neboť vyžaduje vysoce odbornou spolupráci onkologa, urologa, nefrologa a eventuálně dalšího specialisty.
MUDr. Jaroslav Pacovský
Urologická klinika
FN a LF UK v Hradci Králové
Sokolská 581
500 05 Hradec Králové
pacovsky@fnhk.cz
Zdroje
1. Viklický O. Malignity po transplantaci ledviny. In: Transplantace ledviny v klinické praxi. Praha: Grada 2008:. 314–320.
2. Robson R, Cecka JM, Opelz G et al. Prospective registry-based observational cohort study of the long-term risk of malignancies in renal transplant patients treated with mycophenolate mofetil. Am J Transplant 2005; 5 : 2954–2960.
3. Sahadevan M, Kasiske BL. Long-term posttransplant management and complications. In: Danovitch GM. Handbook of kidney transplantation. 4. ed. Philadelphia: Lipincott Wiliams & Wilkins 2005 : 240–241.
4. Kasiske BL, Snyder JJ, Gilbertson DT et al. Cancer after kidney transplantation in the United States. Am J Transplant 2004; 4 : 905–913.
5. Baccarani U, Adani GL, Montanaro D et al. De novo malignancies after kidney and liver transplantation: experience on 582 consecutive cases. Transplant Proc 2006; 38 : 1135–1137.
6. Saigal S, Norris S, Muiesan P et al. Evidence of differential risk for posttransplantation malignancy based on pretransplantation cause in patients undergoing liver transplantation. Liver Transpl 2002; 8 : 482–487.
7. Nalesnik MA. Tumors and solid organ transplantation: intersections at multiple levels. Medscape Transplantation 2003; www.medscape.com.
8. Navarro MD, Lopez-Andreu M, Rodriguez-Benot A et al. Cancer incidence and survival in kidney transplant patients. Transplant Proc 2008; 40 : 2936–2940.
9. Veroux M, Puliatti C, Fiamingo P et al. Early de novo malignancies after kidney transplantation. Transplant Proc 2004; 36 : 718–720.
10. Feng S, Buell JF, Cherikh WS et al. Organ donors with positive viral serology or malignancy: risk of disease transmission by transplantation. Transplantation 2002; 74(12): 1657–1663.
11. Penn I. Evaluation of transplant candidates with pre-existing malignancies. Ann Transplantation 1997; 2 : 14–17.
12. Kaufman HM. Malignancies in organ transplant recipients. J Surg Oncol 2006; 94 : 431–433.
13. Kahan BD, Ponticelli C, Campise M. Selection and preparation of the recipient. In: Principles and practise of renal transplantation. Londýn: Martin Dunitz Ltd 2000 : 89–143.
14. Navrátil P. Praktická urologie u nemocných v dialyzační léčbě, před a po transplantaci ledviny. Hradec Králové: Olga Čermáková 2005 : 171.
15. Kahan BD, Ponticelli C, Montagnino G. Malignancy. In: Principles and practise of renal transplantation. Londýn: Martin Dunitz Ltd 2000 : 617–642.
16. Seeliger H, Guba M, Kleespies A et al. Role of mTOR in solid tumor systems: a therapeutical target against primary tumor growth, metastases and angiogenesis. Cancer metastass reviews 2007; 26(3–4): 397.
17. Sanchez-Fructuoso A, Conesa J, Perez Florez I et al. Conversion to sirolimus in renal transplant patients with tumors. Transplant Proc 2006; 38 : 2451–2452.
18. Nägele H, Bahlo M, Klabdor R et al. Tumor marker determination after orthotopic heart transplantation. J Heart Lung Transplant 1999; 18(10): 957–962.
19. Zhou M, Zhu Y, Wang L et al. Urological malignancy as a complication of renal transplantation: a report of twelve clinical cases. Clin Transpl 2006; 395–398.
20. Besarani D, Cranston D. Urological malignancy after renal transplantation. BJU Int 2007; 100 : 502–505.
21. Fischereder M, Kretzler M. New immunosuppresive strategies in renal transplant recipients. J Nephrol 2004; 17 : 9–18.
22. Gutierrez-Dalmau A, Campistol JM. Immunosuppresive therapy and malignancy in organ transplant recipients: A systematic review. Drugs 2007; 67(8): 1167–1198.
23. Webster A, Playford E, Higgins G et al. Interleukin 2 receptor antagonists for renal transplant recipients: a meta-analysis of randomized trials. Transplantation 2004; 77 : 166–176.
24. Dwomoa A, Cockwell P, Ives NJ et al. Interleukin-2 receptor monoclonal antibodies in renal transplantation: meta-analysis of randomised trials. BMJ 2003; 326 : 789–791.
25. Buell JF, Gross TG, Woodle ES. Malignancy after transplantation. Transplantation 2005; 80(2S): 254–264.
26. Rostaing L. Acute renal failure in kidney transplant patients treated with interferon alpha 2 for chronic hepatitis C. Nephron 1996; 74 : 512–516.
27. Weimar W, Schellekens H, Lameijer LDF et al. Double-blind study of interferon administration in renal transplant recipients. Euro J Clin investigation 2003 : 217–219.
28. Holub L, Pacovský J, Navrátil P et al. Multifokální konvenční světlobuněčný karcinom v transplantované ledvině. Urolog pro praxi 2008; 9(2): 89–90.
29. Wu MJ, Lian JD, Yang CR et al. High cumulative incidence of urinary tract transitional cell carcinoma after kidney transplantation in Taiwan. Am J Kidney Dis 2004; 43 : 1091–1097.
30. Liao CH, Chueh SC, Lai MK et al. J. Transitional cell carcinoma in renal transplant recipients. Transplant Proc 2004; 36 : 2152–2153.
31. Li XB, Xing NZ, Wang Y et al. Transitional cell carcinoma in renal transplant recipients: a single center experience. Int J Urol 2008; 15 : 53–57.
32. Pirenne J. Treatment of bladder cancer in renal transplant recipient? Medscape Transplantation 2001; www.medscape.com.
33. Bastos M. BCG vaccine in a kidney transplant recipient? Medscape Transplantation 2006; www. medscape.com.
34. Goldberg ID, Garnick MB, Bloomer WD. Urinary tract toxic effect of cancer therapy. J Urol 1984; 132 : 1–8.
35. Kleinclauss F, Gigante M, Neuzillet Y et al. Prostate cancer in renal transplant recipients. Nephrol Dial Transplant 2008; 23(7): 2374–2380.
36. Campagnari JC, Ribeiro LA, Campagnari M et al. Localized prostatic cancer in patients submitted to renal transplant. International Braz J Urol 2002; 28 : 330–334.
37. Antonopoulos I, Nahlas W, Piovesan R et al. Radical retropubic prostatectomy for localized prostate cancer in renal transplant patients. Urology 2007; 72 : 1362–1365.
38. Hafron J, Fogarty JD, Wiesen A et al. Surgery for localized prostate cancer after renal transplantation. BJU International 2005; 95 : 319–322.
39. Villalona-Calero MA, Ducker T, Holasek M et al. Mangement of testicular seminoma following organ transplantation. Med Ped Oncology 1992; 25 : 242–247.
40. Abbas Y. Management of immunosuppression in a kidney transplant recipient with testicular cancer. Medscape Transplantation 2006; www.medscape.com.
41. Adu D, Cockwell P, Ives NJ et al. Interleukin-2 receptor monoclonal antibodies in renal transplantation: meta-analysis of randomised trials. BMJ 2003; 12 : 789–792.
42. Penn I. Post-transplant malignancy: the role of immunosuppression. Drug Safety 2000; 23 : 101–113.
43. Wang Z, Zhou J, Fan J et al. Sirolimus inhibits the growth and metastatic pregression of hepatocellular carcinoma. J Cancer Res Clin Oncol 2008; 11 : 201–204.
44. Schuetze SM, Baker LH, Maki RG. Sirolimus reduced tumor-related morbidity and resulted in biochemical and radiographic response in patients with progressive sarcoma. J Clin Oncol 2006; 24 : 18 s.
45. Buzzeo B, Hiesey D, Messing E. Bladder cancer in renal transplant recipients. Urology 1997; 50 : 525–528.
46. Gruessner R, Tzardis P, Matas A et al. Ileal and colon conduits in renal transplantation. Clic Transplantation 1990; 4 : 125–128.
47. Richman P, Malavaud B, Bitker MO et al. Results of 51 renal transplants with the use of bowel conduits in patients with impared bladder function: a retrospective multicenter study. Transplant Proc 1995; 27 : 2427–2429.
48. Kessler M. Excess risk of cancer in renal transplant patients. Transplant Int 2006; 19 : 908–914.
Štítky
Detská urológia Urológia
Článek Úvodní slovo
Článok vyšiel v časopiseUrologické listy
Najčítanejšie tento týždeň
2009 Číslo 1- Vyšetření T2:EGR a PCA3 v moči při záchytu agresivního karcinomu prostaty
- Lék v boji proti benigní hyperplazii prostaty nyní pod novým názvem Adafin
-
Všetky články tohto čísla
- Tři zdroje ledvin k transplantaci
- Transplantace ledvin od žijících dárců
- Urologická příprava a sledování pacienta před transplantací ledviny
- Principy transplantačního zákona
- Úvodní slovo
- Chirurgické techniky transplantace ledviny
- Urologické komplikácie po transplantácii obličky
- Urologické malignity u nemocných po transplantaci ledviny
- Co na publikované články říká profesor Patrik C. Walsh?
- Urologická onemocnění vedoucí k ledvinné nedostatečnosti a možné cesty prevence konečného stadia selhání ledvin
- GUIDELINES EAU PRO TRANSPLANTACI LEDVINY (část 1)
- Urologické listy
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Urologické komplikácie po transplantácii obličky
- Urologická onemocnění vedoucí k ledvinné nedostatečnosti a možné cesty prevence konečného stadia selhání ledvin
- Chirurgické techniky transplantace ledviny
- Tři zdroje ledvin k transplantaci
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



