-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Mechanismy navozené imunotolerance nádorových buněk u chronické lymfatické leukemie a možnosti jejich detekce metodami průtokové cytometrie
Mechanisms of immune tolerance induction of tumour cells in chronic lymphocytic leukaemia and possibilityof their detection using flow cytometry
Tumour immune tolerance or, possibly, alteration of immunity as a whole, is a frequent consequence of tumour cell interaction with cells of the immune system. The main mechanisms of immune tolerance induction include inducing a state of exhaustion in effector CD8+ T cells through interaction of the programmed cell death 1 receptor with its ligands, lower expression of MHC class II proteins on antigen presenting cells to CD4+ T cells, changes in the T regulatory cell pool, impact on tumour microenvironment and anti-apoptotic processes. The effect of therapeutic monoclonal antibodies on immune response by blockage of the programmed cell death pathway is currently the subject of clinical studies.
Key words:
immune tolerance, chronic lymphocytic leukaemia, T - regulatory lymphocytes, blockage programmed cell deathpathway, flow cytometry
Autoři: M. Novák; V. Procházka
Působiště autorů: Hematoonkologická klinika, Fakultní nemocnice / Lékařská fakulta UP Olomouc
Vyšlo v časopise: Transfuze Hematol. dnes,20, 2014, No. 2, p. 75-82.
Kategorie: Souhrnné práce, původní práce, kazuistiky
Souhrn
Imunotolerance nádoru, popřípadě alterace imunity jako celku, je častým důsledkem interakce nádorových buněk s buňkami imunitního systému. Mezi hlavní mechanismy navození imunotolerance počítáme navození stavu vyčerpání u efektorových CD8+ T-lymfocytů cestou interakce receptoru programované buněčné smrti PD-1 se svými ligandy, nižší exprese MHC proteinů II. třídy na antigen prezentujících buňkách CD4+ T-lymfocytům, změny v poolu T-regulačních lymfocytů, ovlivnění mikroprostředí nádoru a antiapoptotické děje. Ovlivnění imunitní odpovědi cestou blokády dráhy programované buněčné smrti terapeutickými monoklonálními protilátkami je v současné době předmětem klinických studií.
Klíčová slova:
imunotolerance, chronická lymfatická leukemie, T-regulační lymfocyty, dráha programované buněčné smrti, průtoková cytometrieÚvod
Výzkum vztahů mezi nádorem a hostitelským prostředím, zprostředkovaný imunokompetentními subpopulacemi, je jedním z ústředních témat současné hematoonkologie. Původní „tumorcentrický“ model, ve kterém je výsledek interakce určován téměř výhradně charakteristikami nádorové tkáně, v současné době ustupuje novému pojetí, které zohledňuje výrazný podíl imunitní komponenty hostitele v oblastech geneze nádoru, jeho růstu, prognózy a reakce na terapeutické postupy, zejména na biologickou léčbu na bázi imunoterapie. Vhodným příkladem se jeví být chronická lymfatická leukemie (CLL), která je nejčastější leukemií západní polokoule. Je charakteristická klonální proliferací nádorově transformovaných antigenně stimulovaných zralých B-lymfocytů s typickým imunofenotypem CD19+CD20+CD22-CD23+CD5+ a jejich následnou kumulací v periferní krvi a kostní dřeni, případně ve slezině a lymfatických uzlinách. Biologicky i prognosticky se CLL rozpadá na dvě podskupiny dle diferenciačního stadia maligního B-lymfocytu. Odlišujeme CLL odvozenou od pregerminálních nebo aktivovaných B-lymfocytů, které neprošly změnami v germinálním centru, nesoucích nemutovanou formu IgVH genu, a CLL s maligním klonem postgerminálních paměťových B-lymfocytů s mutovanou formou IgVH (1). Ukazuje se, že životaschopnost maligní populace z velké části závisí na permisivitě mikroprostředí nádoru, tedy na komplexu celulární komponenty (T-lymfocyty, makrofágy, stromální folikulární dendritické buňky) poskytujícím chemokiny, cytokiny a angiogenní faktory nezbytné pro přežití nádorových buněk (2). Pronádorově se rovněž uplatňuje dráha B-buněčného receptoru (B-cell receptor, BCR), kdy aktivace transkripčních faktorů cestou tyrozinových kináz (ZAP 70, Bruton tyrosine kinase, spleen tyrosine kinase, Src family kinases, phosphatidyl inositol 3-kinase) zlepšuje přežití maligních buněk (3, 4, 5). Recentní literatura také naznačuje, že CLL může být řízena autonomní signalizací BCR nezávisle na antigenní stimulaci (6). Lepší přežívání maligních B-lymfocytů rovněž vyplývá z jejich zvýšené odolností vůči apoptóze, což je dáno mimo jiné i delecemi genů pro specifické mikro-RNA, které jsou součástí deletovaných dlouhých ramen chromozomu 13 [del (13q14)] (7, 8). Imunitní mechanismy, které se podílejí na podmínění proliferace patologického klonu u CLL lze schematicky rozdělit podle místa působení na mechanismy vázané na T-regulační lymfocyty, stimulaci dráhy programované buněčné smrti cytotoxických T-lymfocytů a pravděpodobně i NK buněk, funkční defekty pomocných T-lymfocytů indukované nádorem, a konečně mechanismy vázané na MHC.
Nádorem indukované funkční defekty T-lymfocytů
Klinicky významnou interakcí mezi nádorem a imunitou je zejména funkční postižení T-lymfocytů, ústící v selhávání protinádorové imunity a snížené odolnosti vůči bakteriálním a virovým patogenům. Toto postižení je způsobeno komplexem dějů, z nichž vedoucí úlohu hraje činnost T-regulačních lymfocytů a kostimulátorů a koinhibitorů T-lymfocytů, označovaných jako B7 homology, a jejich receptorů (9). Jedná se o jev označovaný jako vyčerpání (exhausting) T-lymfocytů, které pak nejsou schopny efektivního cytotoxického působení na cílové buňky. Tento získaný stav T-lymfocytové dysfunkce je definován zvýšenou expresí markerů PD-1 (receptor programované buněčné smrti - 1, programmed death-1), CD244 a CD160 (10), sloužících jako negativní regulátory aktivace lymfocytů, a byl původně popsán v kontextu chronických virových infekcí (mezi ligandy výše uvedených markerů patří např. proteiny mediující vstup herpetických virů do buňky) (11). Defekt spočívá v nižší expresi genů pro cytoskeletální proteiny, vede k chybnému formování synapsí a tím k nefunkčnímu směrování transportu cytotoxických vehikul z efektorové buňky. Produkce F-aktinu, granzymu B ani vlastní degranulace není postižena (12). Chronická stimulace virovými antigeny vede ke ztrátě imunokompetence CD8+ T-lymfocytů, ústící v defekt cytotoxického působení, redukované produkce cytokinů a ztrátě proliferační kapacity (12). Podobné postižení imunokompetentních T-lymfocytových subpopulací je v poslední době popisováno i u nemocných s dalšími hematologickými malignitami (chronická myeloidní leukemie, akutní myeloidní leukemie, T-buněčná leukemie/lymfom dospělých) (13, 14). Funkční testy u nemocných s CLL odhalily, že markery T-lymfocytové dysfunkce (PD-1, CD244 a CD160) jsou nejsilněji exprimovány na TEM buňkách (T effector memory, CCR7-/CD45RA-) a TEMRA (CD45RA+), zatímco na naivních (CCR7+CD45+RA+) a paměťových TCM (T central memory, CCR7+/CD45RA-) je exprese významně nižší. Tyto výsledky ukazují posun v kompartmentu cirkulujících T-lymfocytů směrem k diferencovaným formám T-lymfocytů po kontaktu s antigenem, nesoucím markery vyčerpání (12). Dále byla zjištěna redukce počtu CD8+ T-lymfocytů schopných proliferace po polyklonální aktivaci a prolongace buněčného cyklu u dělících se forem (12). A konečně, experimentálně byla prokázána snížená schopnost cytotoxického působení na patologické buňky (12, 15). Na rozdíl od vyčerpání T-lymfocytů u chronických virových infekcí nebyla u pacientů s CLL pozorována ztráta schopnosti produkovat efektorové cytokiny, intracelulární koncentrace interferonu-γ (IFNγ) a faktoru indukujícího nekrózu nádoru (TNFα) byla ve srovnání se zdravými dárci dokonce zvýšená, což odpovídá vyššímu zastoupení TEM a TEMRA buněk, produkujícím vyšší množství IFNγ a TNFα než naivní T-lymfocyty a TCM (12). Byl studován i případný vliv cytomegalovirové infekce (CMV) u nemocných s CLL, přičemž defekt proliferace CD8+ T-lymfocytů i jejich cytotoxické funkce byl pozorován bez příčinné souvislosti s CMV pozitivitou. Naopak, zastoupení jednoho z markerů funkční inaktivity, PD-1, bylo zvýšené pouze u CMV negativních nemocných (12). Rozdílné působení virových a nádorových buněk na funkčnost CD8+ T-lymfocytů může odpovídat odlišnému působení vysoce afinitních virových antigenů a nízce afinitních antigenů nádorově transformovaných, tělu vlastních B-lymfocytů. Lze zvažovat i hypotézu, ve které jsou vyčerpané T-lymfocyty udržovány v mikroprostředí nádoru cíleně, neboť jej saturují pronádorově působícími cytokiny IFNγ a TNFα (16, 17). Nádorová populace tedy dokáže komplexně a efektivně potlačovat funkce T-buněčné složky imunity, a to hned na několika úrovních, počínaje redukcí počtu proliferujících T-lymfocytů, přes ovlivnění buněčného cyklu až k zásahu do transportu a směrování vlastních cytotoxických působků.
T-regulační lymfocyty a ovlivnění imunitní odpovědi
Aktivita efektorových T-lymfocytových subpopulací je řízena prostřednictvím T-regulačních lymfocytů (Treg), které jsou součástí komplexní sítě regulující adaptivní typ imunity. Role Treg v regulačních procesech je velmi komplexní a není do dnešní doby zcela objasněna. Jejich schopnost potlačovat protinádorovou imunitu je jedním ze zásadních faktorů umožňujících maligním buňkám uniknout zničení a vede k růstu tumoru (18, 19), u pacientů s některými lymfomy však vyšší zastoupení Treg pozitivně koreluje s aktivitou cytotoxických efektorových buněk a tedy s lepší prognózou (22). Ukazuje se, že minimálně některé subpopulace Treg jsou u hematologických malignit indukovatelné nádorem, konkrétně se jedná o konverzi konvenčních CD4+/CD25- T-lymfocytů na CD4/FoxP3, přičemž fyziologické B-lymfocyty schopnost konvertovat Treg postrádají (20, 21). Studium takových manipulací hostitelským organismem, zvyšujících adaptabilitu nádoru, by mohlo odhalit nové skutečnosti důležité pro hlubší poznání mechanismů evoluce nádorového růstu.
Ve světle současných znalostí rozdělujeme Treg do čtyř funkčních skupin: 1) maligní Treg, infiltrující zralé T-lymfocytové leukemie a lymfomy, typické expresí FoxP3; 2) supresorové Treg, přítomné v matrix solidních tumorů a lymfomů, charakterizované schopností potlačovat protinádorovou funkci cytotoxických CD8+ T-lymfocytů; 3) Treg s přímým antitumorovým efektem a 4) tzv. „incompetent“ Treg, přispívající k autoimunitním fenoménům u angioimunoblastického T-buněčného lymfomu (22).
Pro účely detekce Treg metodami průtokové cytometrie jsou v současné době využívány dva přístupy: první, tradiční, využívá exprese znaku FoxP3, což je 47 kDA protein z „forkhead/ wingedhelix“ rodiny transkripčních faktorů. Proteiny rodiny Fox fungují jako aktivátory i represory transkripce a jsou charakterizovány přítomností „forkhead“ domény, nezbytné pro vazbu DNA a lokalizaci v jádře (23). FoxP3 slouží jako represor transkripce promotorů genů pro cytokiny IL-2 a GM-CSF (24). Rovněž byla publikována zjištění, že FoxP3 interaguje s transkripčními faktory hrajícími klíčovou roli v expresi mnoha genů pro cytokiny, jako např. nuclear factor of activated T cells, (NFAT), acute myeloid leukemia 1/Runt-related transcription factor 1 (AML1/Runx1), a pravděpodobně i jaderný faktor-kappa B (NF-κB) (25, 26). Vnitrobuněčná lokalizace FoxP3 však komplikuje cytomerickou analýzu, objevily se proto tendence nahradit jej v analytických protokolech povrchovým markerem, který by byl snáze přístupný a zároveň umožňoval vysokou senzitivitu a specificitu stanovení Treg. Liu a kolektiv popsali metodiku identifikace Treg pomocí znaku CD127, který inverzně koreluje s expresí FoxP3 na T-regulačních lymfocytech (27). CD127 je jednou ze složek heterodimerického receptoru IL-7, který mimo CD127 dále sestává ze základní strukturní domény (common chain), sdílené dalšími receptory pro cytokiny (IL-2R, IL-4R, IL-9R, IL-15R a IL-21R). CD127 je exprimován na thymocytech, T - a B-lymfocytových progenitorech, zralých T-lymfocytech, monocytech a dalších buňkách lymfoidní a myeloidní linie. Bylo prokázáno, že receptor pro IL-7 sehrává důležitou roli v proliferaci a diferenciaci T-lymfocytů a in-vitro experimenty odhalily pokles exprese CD127 v průběhu aktivace T-lymfocytů (28, 29). Role Treg u CLL není doposud jednoznačná, nicméně počet T-regulačních lymfocytů inverzně koreluje s dobou přežití bez léčby (treatment free survival) a může sloužit jako nezávislý prognostický faktor předpovídající čas do začátku terapie u pacientů s nízkým až středním rizikem (30). Zajímavým zjištěním ukazujícím na provázanost mezi regulačními faktory imunity a malignitou je rovněž signifikantně vyšší absolutní počet Treg u pacientů s CLL komplikovanou autoimunitní cytopenií (31). Ukazuje se, že analýzy vztahů mezi T-regulačními lymfocyty, tumorem a imunitou hostitele mohou přinést nové a velmi významné informace o jejich vzájemných interakcích, a to zejména v počátečních obdobích nádorového růstu, kde pravděpodobně spolurozhodují o osudu nádorově transformovaných buněk.
Inhibice funkce cytotoxických T-lymfocytů cestou dráhy programované buněčné smrti
Na snížení imunitní odpovědi vůči tumoru se mimo Treg významně podílí interakce receptoru PD-1, exprimovaného především na B - a T - lymfocytech se svými ligandy PD-L1 (CD274, B7-H1) a PD-L2 (CD273, B7-DC), tzv. dráha programované buněčné smrti (32). PD-1 je vyznamným členem rodiny B7 homologů, jejichž kostimulační a koinhibiční funkce jsou u T-lymfocytů již dlouho známy (9). V poslední době bylo mimo receptoru PD-1(CD279, B7-H1) popsáno mnoho dalších významných homologů (B7-H2, B7-H3,B7-H3, B7-H4, B7-DC, atd.) s významnou rolí v regulaci vrozené i adaptivní imunity, včetně nádorové imunotolerance. Některé z nich účinně potlačují hostitelovu imunitu a umožňují tak nádorovým buňkám unikat cytotoxické odpovědi (33, 34, 35). U T-lymfocytů tyto interakce inhibují proliferaci, produkci cytokinů i schopnost cytotoxického působení, což bývá označováno jako vyčerpání (exhausting) (36). U hematologických malignit byl rovněž popsán vliv PD-1 na NK buňky, tedy NK vyčerpání, což může mít vliv na použití terapeutických monoklonálních protilátek působících cestou NK buňkami mediované cytotoxicity (ADCC) (37). Působení rodiny B7-H se nevztahuje pouze na přímé interakce mezi maligními buňkami a imunokompetentními efektory, ale jejich exprese na nemaligních buňkách tumoru významně ovlivňuje mikroprostředí a vytváří vhodnou niku pro přežití a růst nádorové populace (32). PD-1 pozitivní nádorové buňky jsou rovněž schopny indukovat T-regulační lymfocyty a řídit jejich expanzi a tlumivé působení, přičemž stejný efekt vykazují i PD-1 pozitivní dendritické buňky infiltrující nádor (38, 39, 40). V neposlední řadě nádorové buňky s vyšší expresí PD-1 vykazují rezistenci vůči apoptoptickým stimulům indukovaným jak Fas dráhou, tak účinkem chemoterapie (41). Dlouhodobá stimulace antigeny nádorových buněk, v tomto případě interakce receptoru PD-1 se svými ligandy, tedy způsobuje chronickou aktivaci signální dráhy PD-1 PD-1L/2L, což inhibuje fyziologickou aktivitu efektorových T-lymfocytů formou výše popsaných defektů buněčné diferenciace a cytotoxicity. Mechanismy inhibice imunokompetentních lymfocytových subpopulací, která cestou dráhy programované buněčné smrti během nádorového růstu nastává, zásadním způsobem ovlivňuje možnosti protinádorové imunity hostitele, spolu s dalšími faktory vede k imunitní toleranci nádorové tkáně a v konečném důsledku je spojena s horší terapeutickou odpovědí (42). Geny obou ligandů (PD-L1 a PD-L2) jsou umístěny v oblasti 9p24.1, tedy pod vlivem Janusovy kinázy 2 (JAK2). Experimenty na buněčných liniích Hodgkinova lymfomu a primárně mediastinálního velkobuněčného B-lymfomu prokázaly navýšení transkripce PD-L1 vlivem amplifikace JAK2 (43). Receptor PD-1 i jeho ligandy jsou vzhledem ke svému umístění na povrchu buňky ideálním cílem pro analýzu metodami průtokové cytometrie, přičemž vhodné protilátky jsou již dostupné ve formě konjugátů i pro mnohobarevná stanovení (44). Dráha programované buněčné smrti významně ovlivňuje možnosti protinádorové imunity a je schopna zásadním způsobem redukovat míru cytotoxického působení jak CD8+ T-lymfocytů, tak i NK buněk. Tato schopnost manipulovat výkonnou složkou adaptivní imunity poskytuje maligní populaci významnou konkurenční výhodu a interakce receptoru PD-1 se svými ligandy je proto oprávněně v centru zájmu mnoha výzkumných skupin, neboť lze předpokládat, že blokáda dráhy programované buněčné smrti například terapeutickou monoklonální protilátkou umožní obnovení funkce hostitelské protinádorové imunity.
MHC a „ukrytí“ leukemických buněk před imunitní odpovědí
Další modalitou ovlivnění imunitní odpovědi je snížení exprese proteinů hlavního histokompatibilního komplexu II. třídy (MHC II) na antigen prezentujících buňkách CD4 T-lymfocytům. Touto cestou dochází k nižší úrovni exprese HLA (Human Leukocyte Antigen) antigenů, ke snížení imunogenity nádorových buněk a tím k jejich „ukrytí“ před imunitní odpovědí ve formě cytotoxického působení T-lymfocytů (45). Geny pro MHC II. třídy jsou většinově umístěny v oblasti 6p12 a jsou konstitutivně exprimovány na antigen prezentujících buňkách (B-lymfocyty, dendritické buňky, monocyty), s možností indukovatelné exprese na dalších typech leukocytů. Snížení exprese genů MHC II. třídy u nemocných s difuzním velkobuněčným B-lymfomem (DLBCL) výrazně koreluje s kratším přežíváním (46). Z recentních výzkumů vyplývá, že podkladem nižší exprese těchto genů je snížení jejich transkripce, která je řízena expresí transkripčních aktivátorů kódovaných genem transkripčního aktivátoru pro MHC II. třídy (CIITA; class II, Major Histocompatibility Complex, Transactivator) respektive jeho mutovaných forem (47, 48). Lze se oprávněně domnívat, že analogický mechanismus regulace transkripce se uplatňuje i u CLL a dalších hematologických malignit (49). Na snížení imunitního dozoru nad nádorovými buňkami má dále vliv míra exprese genů Janusovy kinázy (JAK2). Amplifikace oblasti 9p24, tedy postihující gen JAK2, vede k jeho hyperexpresi a tím ke konstitutivní aktivaci JAK2, což má za následek nekontrolovanou buněčnou proliferaci a dále amplifikaci genů PD-L1 a PD-L2, tedy genů přímo ovlivňujících cytotoxickou imunitní odpověď organismu (43).
Biologické podklady regulace imunitní odpovědi u CLL
Společným jmenovatelem všech výše uvedených cest alterace imunitní odpovědi jsou primární genetické změny, předcházející nebo souběžné s růstem nádoru, zejména amplifikace genu Janusovy kinázy a pravděpodobně i zásah do mechanismů transkripčního aktivace genu pro MHC II. třídy (49), což vede k vyšší aktivitě dráhy programované buněčné smrti a tím k indukci imunoregulačních Treg, k navýšení proliferační aktivity nádorových buněk a k nižší expresi HLA (43). Nádorové buňky pak unikají imunitnímu systému především použitím „stealth mode“, tedy snížením imunogenity prostřednictvím nižší exprese HLA (23) a cestou aktivace dráhy PD-1/PD-L1 spojené s alterací funkce efektorových CD8+ T-lymfocytů, čímž dochází k navození imunologické tolerance (24). Dále se uplatňuje vliv nádorové tkáně zvyšující aktivitu CD4+ Treg, vykazujících tlumivý efekt na cytotoxické efektorové buňky, potlačení procesů apoptózy a ovlivnění mikroprostředí nádoru cestou protumorových cytokinů a chemokinů (16, 17, 41). Vyčerpání efektorových T-lymfocytů, indukované chronickou aktivací signální dráhy programované buněčné smrti, vede nejen k navození imunotole-rance nádorových buněk, ale k alteraci T-buněčné imunity jako celku, což je v konečném důsledku patrné ve vyšší incidenci a závažnějším průběhu bakteriálních a virových infekcí (50). Navýšení exprese ligandu PD-1L je prokázáno nejen u hematologických malignit, ale i u mnoha solidních tumorů, kde inhibuje pro-dukci cytokinů i aktivitu tumor infiltrujících CD4+ a CD8+ T-lymfocytů (51, 52, 53). Blokáda interakce receptoru PD-1 s ligandy (PD-L1 a PD-L2) in vitro zvyšuje úroveň imunitní odpovědi (54) a přímo se podílí na efektivitě protinádorové aktivity imunitního systému (50, 55).
Obr. 1. Schéma interakce mezi tumorem, T-lymfocytem a APC. Upraveno dle American association of cancer research. 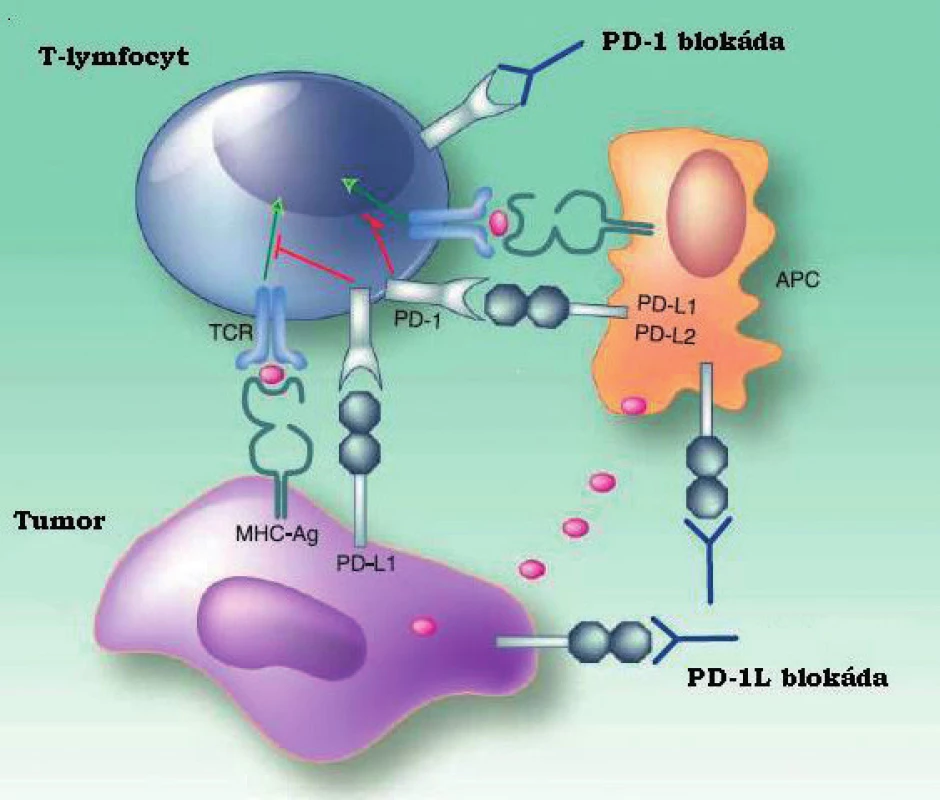
Tab. 1. Panel protilátek k analýze chronických lymfoproliferací z B-lymfocytů. Dle Euroflow 2013. 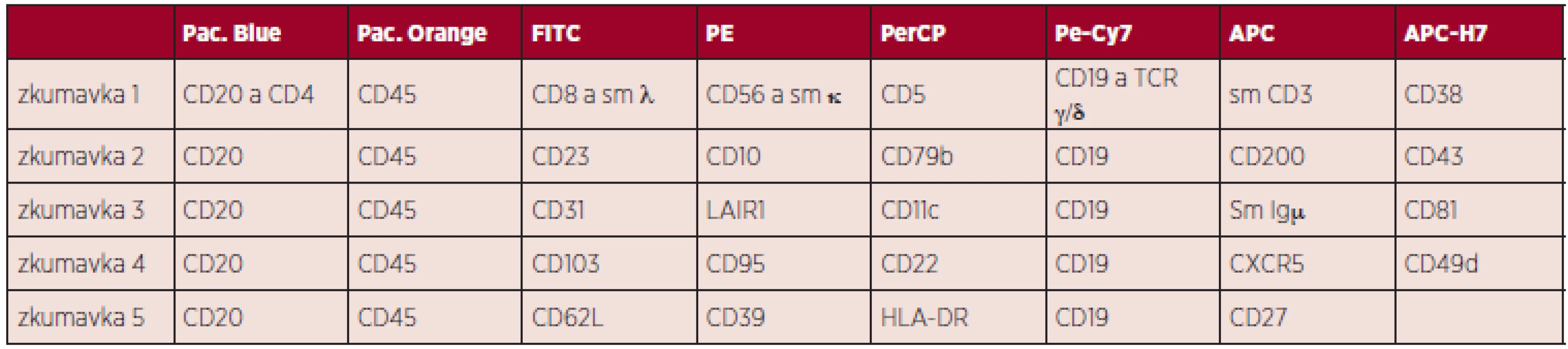
Legenda k tabulce: Pac. Blue - Pacific Blue, Pac. Orange - Pacific Orange, FITC - Fluorescein isothiocyanate, PE - R-phycoerythrin, PerCP - Peridinin chlorophyll, Pe-Cy7 - tandemový konjugát phycoerythrinu a Cy7 NHS esteru, APC - Allophycocyanin, APC-H7 - tandemový konjugát allophycocyaninu a stabilnějšího analogu Cy7 NHS esterusm - surface membrane, povrchový znak Mimo dráhu programované buněčné smrti se na regulaci T-buněčné odpovědi podílí i další mechanismy, v recentních publikacích je popsán vliv dráhy CTLA4 (cytotoxic T-lymphocyte antigen 4), která ovlivňuje proliferaci a přežívání buněk CLL cestou downregulace T-lymfocytové odpovědi, konkretně cestou ovlivnění exprese transkripčních (STAT1, NFATC2), proliferačních (c-Fos, c-Myc) a antiapoptotických (Bcl-2) faktorů (56).
Blokáda CTLA4 terapeutickými monoklonálními protilátkami je v současné době předmětem klinických studií zejména u solidních tumorů, a to se slibnými výsledky. Zajímavý je synergní protinádorový efekt souběžné blokády dráhy PD-1 a CTLA4, což demonstruje možnosti komplexního terapeutického ovlivnění imunitní odpovědi v budoucnu (57).
Od experimentů do praxe
V současné době již poměrně komplexní poznání mechanismů, dovolujících maligním buňkám unikat protinádorové odpovědi, logicky vede k vývoji nových terapeutických postupů a rutinně aplikovatelných diagnostických metod. Snahy o terapeutické ovlivnění T-regulačních lymfocytů jsou prozatím většinou ve stavu primárního výzkumu, zejména pro ne zcela vyjasněnou a velmi komplikovanou a provázanou síť působení mezi buňkami. Terapeutická modulace exprese proteinů hlavního histokompatibilního komplexu II. třídy (MHC II) by pravděpodobně vyžadovala individualizované zásahy na úrovni genomu, resp. epigenomu, což je v současné době rutinně nezvládnutelné. Velmi vhodným cílem se však ukazuje být dráha programované buněčné smrti, a to jednak pro jednoduchost interakce (jeden receptor a jeden, resp. dva, ligandy) a dále pro lokalizaci cílových struktur na povrchu buněk. Tyto skutečnosti v současné době vedou k testování terapeutické monoklonální protilátky anti-PD-1 u solidních tumorů (58) i hematologických malignit (37, 59).
Průtoková cytometrie hraje klíčovou roli jak v diferenciální diagnostice CLL, tak ve stanovení imunitní odpovědi, v případě analýz T-lymfocytových subpopulací jsou její metody zlatým standardem a jsou rutinně využívány. Diferenciálně diagnostické analýzy a sledování minimální zbytkové nemoci prodělávají v současné době přerod směrem k využití mnohobarevných panelů protilátek dle výstupů konsorcia Euroflow (60).
Unifikace laboratorního procesu včetně použitých identických sestav monoklonálních protilátek, analytického software a kalibrátorů umožňuje nejen eliminovat nepřesnosti, ale i dříve nedosažitelné druhé čtení čí konzultaci expertním pracovištěm. Na našem pracovišti již s úspěchem používáme vlastní mnohobarevný analytický protokol založený na analýze povrchových markerů CD45, CD3, CD4, CD8, CD16+CD56, CD279 (PD-1) a CD107a, zpracovaných metodikou „lyse no-wash“ z periferní krve. Za účelem detekce T-regulačních lymfocytů jsme nejprve testovali povrchovou analýzu znaku CD127, který inverzně koreluje s expresí FoxP3 na Treg (27), ale později jsme z důvodu snazší standardizace přešli na detekci intracytoplazmatických FoxP3 (markery FoxP3, CD4, CD25) pomocí komerčně dostupného kitu.
Do praktického použití se dále dostávají metody i kvantitativní průtokové cytometrie (61), které jsou na základě analýzy vazebných míst schopny poskytnout informace o reálném zastoupení cílových struktur na zájmových buňkách, což s sebou přináší nový pohled zejména na hodnocení účinnosti terapeutických monoklonálních protilátek (62).
Pokročilé analýzy subpopulací T-regulačních lymfocytů včetně jejich dynamiky a výzkum dráhy programované buněčné smrti jsou zatím doménou spíše vědecko-výzkumných pracovišť, nicméně v blízké době můžeme čekat jejich přesun do rutinní praxe.
Týká se to zejména metod detekce a kvantifikace exprese receptoru PD-1, které v případě úspěšných testů terapeutické monoklonální protilátky budou nezbytné pro přesnou indikaci terapie a sledování odpovědi na léčbu. Zásadní úlohu průtokové cytometrie lze s jistotou očekávat u indikace a monitorování terapie na bázi virovou transdukcí modifikovaných T-lymfocytů, exprimujících chimérické receptory antigenů (Chimeric antigen receptors, CARs), slibné nové terapeutické modality s kurativním potenciálem, která je v současné době ve stadiu klinických testů (63).
Zavádění osmi - a vícebarevných cytometrů, rozšiřující se spektrum fluorochromů a nové analytické metody, zejména možnost kvantifikovat expresi cílových struktur, umožňuje analyzovat širší souvislosti mezi jednotlivými imunokompetentními populacemi a maligními buňkami, posoudit jejich role v procesu regulace protinádorové odpovědi a poskytuje tak nový vhled do interakcí mezi maligními buňkami a hostitelským organismem směrem k úspěšné terapii (64, 65, 66).
Poděkování
Podpořeno grantem IGA-LF-2014-001RNDr.
Podíl autorů na přípravě rukopisu
Martin Novák: sepsání rukopisu
MUDr. Vít Procházka, Ph.D.: připomínkování a korektura rukopisu
Doručeno do redakce: 15. dubna 2014
Přijato po recenzích: 23. června 2014
RNDr. Martin Novák
Laboratoř průtokové cytometrie
Hematoonkologická klinika FN/LF Olomouc
I. P. Pavlova 6
775 20 Olomouc
e-mail: novak.m@email.cz
Zdroje
1. Damle RN, Wasil T, Fais F, et al. IgV gene mutation status and CD38 expression as novel prognostic indicators in chronic lymphocytic leukemia. Blood 1999; 94(6): 1840-1847.
2. Burger JA, Ghia P, Rosenwald A, Caligaris-Cappio F. The microenviroment in mature B-cell malignancies: a target for new treatment strategies. Blood 2009; 144(16): 3367-3375.
3. Stevenson BK, Krysov S, Davies AJ, Steele AJ, Packham G. B-cell receptor signaling in chronic lymphocytic leukemia. Blood 2011; 118(16): 4313-4320.
4. Wienster A. Emerging role of kinase targeted strategie in chronic lymphocytic leukemia. Hematology Am Soc Hematol Educ Program 2012; 2012 : 88-96.
5. Young RM, Staudt LM. Targeting pathological B cell receptor signalling in lymphoid malignancies. Nat Rev Drug Discov 2013; 12(3): 229-243.
6. Duhren - von Minden MD, Ubelhart R, Schneider D, et al. Chronic lymphocytic leukaemia is driven by antigen-independent cell-autonomous signaling. Nature 2012; 489(7415): 309-312.
7. Calin GA, Dumitru CD, Shimizu M, et al. Frequent deletions and down-regulation of micro-RNA genes miR15 and miR16 at 13q14 in chronic lymphocytic leukemia. Proc Natl Acad Sci USA 2002; 99(24): 15524-15529.
8. Zenz T, Mertens D, Kuppers R, Dohner H, Stilgenbauer S. From pathogenesis to treatment of chronic lymphocytic leukaemia. Nat Rev Cancer 2010; 10(1): 37-50.
9. Sharp AH, Freeman GJ. The B7-CD28 superfamily. Nat Rev Immunol 2002; 2 : 116-126.
10. Wherry EJ. T-cell exhaustion. Nat Immunol 2011; 12(6): 492-432.
11. Blackburn SD, Shin H, Haining WN, et al. Coregulation of CD8+ T-cell exhaustion my multiple inhibitory receptor during chronic viral infection. Nat Immunol 2009; 10(1): 29-37.
12. Riches JC, Davies JK, McClanahan F, et al. T cells from CLL patients exhibit features of T-cell exhaustion but retain capacity for cytokine production. Blood 2013; 121 : 1612-1612 .
13. Kozako T, Yoshimitsu M, Fujiwara H, et al. PD-1/PD-1L expresion in human T-cell leukemia virus type 1 carriers and adult T-cell leukemia/lymphoma patiens. Leukemia 2009; 23(2): 375-382.
14. Mumprecht S, Schurch C, Schwaller J, Solenthaler M, Ochsenbein AF. Programmed death 1 signaling on chronic myeloid leukemia-specific T cells results in T-cell exhaustion and disease progression. Blood 2009; 114(8): 1528-1536.
15. Wherry EJ, Blattman JN, Murali-Krishna K, van der Most R, Ahmed R. Viral persistence alter CD8 T-cell immunodominance and tissue distribution and results in distinct stages of functional impairment. J Virol 2003; 77(8): 4911-4927.
16. Buschle M, Campana D, Carding SR, Richard C, Hoffbrand AV, Brenner MK. Interferon gamma inhibits apoptotic cell death in B cell chronic lymphocytic leukemia. J Exp Med 1993; 177(1): 213-218.
17. Digel W, Stefanic M, Schoniger W, et al. Tumor necrosis factor induces proliferation of neoplastic B cells from chronic lymphocytic leukemia. Blood 1989;73(5):1242-1246.
18. Ahmadzadeh M, Felipe–Silva A, Heemskerk B, et al. FOXP3 expression accurately defines the population of intratumoral regulatory T cells that selectively accumulate in metastatic melanoma lesions. Blood 2008; 112 : 4953-4960.
19. Juan XL, Chen L, Li MX, et al. Elevated expresion of Foxp3 in tumor-infiltrating Treg supresses T-cell proliferation and contributes to gastric cancer progression in a COX-2-dependent manner. Clin Immunol 2010; 134 : 277-288.
20. Mittal S, Marshall NA, Duncan L, et al. Local and systemic induction of CD4+CD25+ regulatory T-cell population by non-Hodgkin lymphoma. Blood 2008; 111 : 5359-5370.
21. Ai WZ, Hou JZ, Zeiser R, et al. Follicular lymphoma B cells induce the conversion of conventional CD4+ Tcells to T-regulatory cells. Int J Cancer 2009;124 : 239-244.
22. J. Wang, Ke X. The Four types of Tregs in malignant lymphomas. Journal of Hematology & Oncology 2011; 4(50): 1-10.
23. Ziegler SF. FOXP3: of mice and men. Annu Rev Immunol 2006; 24 : 209-226.
24. Bettelli E, Dastrange M, Oukka M. Foxp3 interacts with nuclear factor of activated T cells and NF-kappa B to repress cytokine gene expression and effector functions of T helper cells. Proc Natl Acad Sci USA 2005; 102(14): 5138-5143.
25. Lopes JE, Torgerson TR, Schubert LA, et al. Analysis of FOXP3 reveals multiple domains required for its function as a transcriptional repressor. J Immunol 2006; 177(5): 3133-3142.
26. Ono M,Yaguchi H, Ohkura N, et al. Foxp3 controls regulatory T-cell function by interacting with AML1/Runx1. Nature 2007; 446(7136): 685-689.
27. Liu W, Putnam AL, Xu-yu Z, et al. CD127 expression inversely correlates with FoxP3 and suppressive function of human CD4+ T reg cells. JEM 2006; 203(7): 1701-1711.
28. Hofmeister R, Khaled AR, Benbernou N, et al. Interleukin-7: physiological roles and mechanisms of action. Cytokine Growth Factor Rev 1999; 10(1): 41-60.
29. Appasamy PM. Biological and clinical implications of interleukin-7 and lymphopoiesis. Cytokines Cell Mol Ther 1999; 5(1): 25-39.
30. Weiss L, Melchardt T, Egle A, Grabmer C, Greil R. and Tinhofer I. Regulatory T cells predict the time to initial treatment in early stage chronic lymphocytic leukemia. Cancer 2011; 117: 2163-2169.
31. Lad DP, Varma S, Varma N, et al. Regulatory T-cells in B-cell chronic lymphocytic leukemia: their role in disease progression and autoimmune cytopenias Leukemia and lymphoma 2013; 54(5): 1012-1019.
32. Wilcox RA, Feldman AL, Wada DA, et al. B7-H1 (PD-L1, CD274) suppresses host imunity in T-cell lymfoproliferative disorders. Blood 2009; 114 : 2149-2158.
33. Keir ME, Butte MJ, Freemann GJ, Sharpe AH. PD-1 and its ligands in tolerance and immunity. Annu Rev Immunol 2008; 26 : 677-704.
34. Flies DB, Chen L. The new B7s: playing a pivotal role in tumor immunity. J Immunother 2007; 30 : 251-260.
35. Yi KH, Chen L. Fine tuning the immune response through B7-H3 and B7-H4. Immunol Rev 2009; 229 : 145-151.
36. Butte MJ, Keir ME, Phamduy TB, Sharpe AH, Freemann GJ. Programmed death-1 ligand interacts specifically with the B7-1 costimulatory molecule to inhibit T cell responses. Immunity 2007; 27 : 111-122.
37. Benson DM Jr, Bakan CE, Mishra A, et al. The PD-1/PD-1L axis modulates the natural killer cell versus multiple myeloma effect: a therapeutical target for CT-011, a novel monoclonal anti-PD-1 antibody. Blood 2010; 116 : 2286-2294.
38. Yang ZZ, Novak AJ, Stenson MJ, Witzig TE, Ansell SM. Intratumotal CD4+CD25+ regulatory T-cell-mediated suppression of infiltrating CD4+ T cells in in B-cell non-Hodgkin lymphoma. Blood 2006; 107 : 3639-3646.
39. Han Y, Wu J, Bi L, et al. Malignant B cells induce the conversion of CD4CD25 T cells to regulatory T cells in B-cell non-Hodgkin lymphoma. PloS One. Publikováno elektronicky 2011; 6:e28649.
40. Rosenblatt J, Glotzbecker B, Mills H, et al. PD-1 blockade by CT-011, anti-PD-1 antibody, enthances ex vivo T-cell responses to autologous dendritic cells/myeloma fusion vaccine. J Immunother 2011; 34 : 409-418.
41. Azuma T, Yao S, Zhu G, Flies SJ, Chen L. B7-H1 is ubiquitous antiapoptotic receptor on cancer cells. Blood 2008; 111 : 3635-3643.
42. Rozali EN, Hato SV, Robinson BW, Lake RA, Lesterhuis WJ. Programmed death ligand 2 in cancer-induced immune suppression. Clinical and Developmental Immunology Publikováno elektronicky 656340. Epub 2012 Apr 29.
43. Green M, Monti S, Rodig SJ, et al. Integrative analysis reveals selective 9p22.1 amplification, increased PD-1 ligand expression, and further induction via JAK2 in nodular sclerosing Hodgkin lymphoma and primary mediastinal large B-cell lymphoma. Blood 2010; 116(17): 3268-3277.
44. Sachdeva M, Fischl MA, Pahwa R, Sachdeva N, Pahwa S. Immune exhaustion occurs concomitantly with immune activation and decrease in regulatory T cells in viremic chronically HIV-1 infected patients. J Acquir Immune Defic Syndr 2010; 54(5): 447–454.
45. Rimsza LM, Roberts RA, Miller TP, et al. Loss of MHC class II gene and protein expression in diffuse large B-cell lymphoma is related to decreased tumor immunosurveillance and poor patient survival regardless of other prognostic factors: a follow-up study from the Leukemia and Lymphoma Molecular Profiling Project. Blood 2004; 103(1): 4251-4258.
46. Rosenwald A, Wright G, Chan WC, et al. The use of molecular profiling to predict survival after chemotherapy for diffuse large-B-cell lymphoma. N Engl J Med 2002; 346(25): 1937-1947.
47. Cycon AK, Rimsza LM, Murphy SP. Alterations in CIITA constitute a common mechanism accounting for downregulation of MHC class II expression in diffuse large B-cell lymphoma (DLBCL). Exp Hematol 2009; 7(2): 184-194.
48. Steidl CH, Gascoyne R. The molecular pathogenesis of primary mediastinal large B-cell. Blood 2011; 118(10): 2659-2669.
49. Steidl CH, Shan SP, Woolcock BW, et al. MHC class II transactivator CIITA is a recurrent gene fusion partner in lymphoid cancers. Nature 2011; 471(7338): 377-383.
50. Sharpe AH, Wherry EJ, Ahmed R, Freeman GJ. The function of programmed cell death 1 and its ligands in regulating autoimmunity and infection. Nat Immunol 2007; 8 : 239-245.
51. Dong H, Strome SE, Salomao DR, et al. Tumor-associated B7-H1 promotes T-cell apoptosis: a potential mechanism of immune evasion. Nat Med 2002;8 : 793-800 [Erratum, Nat Med 2002; 8 : 1039].
52. Hino R, Kabashima K, Kato Y, et al. Tumor cell expression of programmed cell death-1 ligand 1 is a prognostic factor for malignant melanoma. Cancer 2010; 116 : 1757-1766.
53. Taube JM, Anders RA, Young JD, et al. Colocalization of inflammatory response with B7-H1 expression in human melanocytic lesions supports an adaptive resistance mechanism of immune escape. Sci Transl Med 2012; 4 : 127ra37.
54. Fife BT, Pauken KE, Eagar TN, et al. Interactions between PD-1 and PD-L1 promote tolerance by blocking the TCR-induced stop signal. Nat Immunol 2009; 10 : 1185-1192.
55. Iwai Y, Ishida M, Tanaka Y, Okazaki T, Honjo T, Minato N. Involvement of PD-L1 on tumor cells in the escape from host immune system and tumor immunotherapy by PD-L1 blockade. Proc Natl Acad Sci U S A 2002; 99 : 12293-12297.
56. Mittal AK, Chaturvedi NK, Rohlfsen RA, et al. Role of CTLA4 in the Proliferation and Survival of Chronic Lymphocytic Leukemia. PLoS ONE 2013 8(8): e70352. doi:10.1371/journal.pone.0070352.
57. Curran MA, Montalvo W, Yagita H, Allison JP. PD-1 and CTLA-4 combination blockade expands infiltrating T cells and reduces regulatory T and myeloid cells within B16 melanoma tumors. Proc Natl Acad Sci U S A 2010; 107 : 4275–80.
58. Topalian SL, Hodi FS,Brahmer JR, at al. Safety, Activity, and Immune Correlates of Anti–PD-1 Antibody in Cancer, N Engl J Med 2012; 366 : 2443-2454.
59. Westin JR, Chu F, Zhang M, et al. Safety and activity of PD1 blockade by pidilizumab in combination with rituximab in patients with relapsed follicular lymphoma: a single group, open-label, phase 2 trial. Lancet Oncol 2014; 15 : 69-77.
60. Van Dongen JJM, Lhermitte L, Böttcher S, et al. EuroFlow antibody panels for standardized n-dimensional flow cytometric immunophenotyping of normal, reactive and malignant leukocytes. Leukemia 2012; 26 : 1908-1975.
61. Maher KJ, Fletcher MA. Quantitative flow cytometry in the clinical laboratory. Clinical and Applied Immunology Reviews 2005; 5(6): 353–372.
62. Klabusay M, Sukova V, Coupek P. Different levels of CD52 antigen expression evaluated by quantitative fluorescence cytometry are detected on B-lymphocytes, CD 34+ cells and tumor cells of patients with chronic B-cell lymphoproliferative diseases. Cytometry 2007; 72B: 363–370. doi: 10.1002/cyto.b.20181.
63. Porter DL, Levine BL, Kalos M, et al. Chimeric Antigen Receptor–Modified T Cells in Chronic Lymphoid Leukemia N Engl J Med 2011; 365 : 725-733. doi: 10.1056/NEJMoa1103849.
64. Curiel TJ. Tregs and rethinking cancer immunotherapy. J Clin Invest 2007; 117(5): 1167–1174.
65. Topalian SL, Drake CG, Pardoll DM. Targeting the PD-1/B7-H1(PD-L1) pathway to activate anti-tumor immunity. Curr Opin Immunol 2012; 24 : 207-212.
66. Hallek M. Signaling the end of chronic lymphocytic leukemia: new frontline treatment strategies. Blood; 2013 : 138-150.
Štítky
Hematológia Interné lekárstvo Onkológia
Článok vyšiel v časopiseTransfuze a hematologie dnes
Najčítanejšie tento týždeň
2014 Číslo 2- Jak naučit dítě s hemofilií aplikovat injekci? V Motole pomáhají sestrám i umělé ruce
- Když se ve střevech děje něco nepatřičného...
- Nejasný stín na plicích – kazuistika
- Těžké menstruační krvácení může značit poruchu krevní srážlivosti. Jaký management vyšetření a léčby je v takovém případě vhodný?
- Jak přistupovat k akutnímu kloubnímu krvácení u pacientů s hemofilií
-
Všetky články tohto čísla
- Hodnocení exprese antigenu CD45 u pacientů s mnohočetným myelomem a jeho vliv na dobu do první progrese nebo relapsu
- Chronická myelomonocytová leukémia – prehľad súčasných diagnostických a liečebných možností
- Eliminácia rizika prenosu vírusu hepatitídy B transfúziou vo fáze možnej okultnej HBV infekcie
- Mechanismy navozené imunotolerance nádorových buněk u chronické lymfatické leukemie a možnosti jejich detekce metodami průtokové cytometrie
- Hrodek O. Early molecular response predicts outcomes in patients with chronic myeloid leukemia in chronic phase treated with frontline nilotinib or imatinib
- Hrodek O. Therapy-related acute myeloid leukemia and myelodysplastic syndromes in patients with Hodgkin lymphoma: a report from the German Hodgkin Study Group
- Hrodek O. Duration of anticoagulant therapy for deep vein thrombosis and pulmonary embolism
- Hrodek O. Pretransplant administration of imatinib for allo-HSCT in patients with BCR-ABL–positive acute lymphoblastic leukemia
- Hrodek O. Comparison of horse and rabbit antithymocyte globulin in immunosuppressive therapy for refractory cytopenia of childhood
- Hrodek O. Long-term outcome with dasatinib after imatinib failure in chronic-phase chronic myeloid leukemia: follow-up of a phase 3 study
- Hrodek O. Bone marrow fibrosis in 66 patients with immune thrombocytopenia treated with thrombopoietin-receptor agonists: a single-center, long-term follow-up
- Hrodek O. How I treat leukemia during pregnancy
- Hrodek O. What is the relevance of Ikaros gene deletions as a prognostic marker in pediatric Philadelphia-negative B-cell precursor acute lymphoblastic leukemia?
- XXVIII. olomoucké hematologické dny s mezinárodní účastí
- Přehled produkce transfuzní služby ČR za rok 2013 (transfuzní přípravky i plazma pro frakcionaci)
- Vyhlášení ceny Janssen 2014
- Autotransfuze v České republice v roce 2013
- Transfuze a hematologie dnes
- Archív čísel
- Aktuálne číslo
- Iba online
- Informácie o časopise
Najčítanejšie v tomto čísle- Chronická myelomonocytová leukémia – prehľad súčasných diagnostických a liečebných možností
- Eliminácia rizika prenosu vírusu hepatitídy B transfúziou vo fáze možnej okultnej HBV infekcie
- Hodnocení exprese antigenu CD45 u pacientů s mnohočetným myelomem a jeho vliv na dobu do první progrese nebo relapsu
- Mechanismy navozené imunotolerance nádorových buněk u chronické lymfatické leukemie a možnosti jejich detekce metodami průtokové cytometrie
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



