-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Základní principy diagnostiky a léčby sekundární peritonitidy – doporučení odborníků s podporou SIS
Basic principles of diagnosis and treatment of secondary peritonitis – recommendations of experts with the support of SIS
Secondary peritonitis is the most common cause of inflammatory acute abdomen treated at general surgery departments. Only early and correct diagnosis may improve the prognosis of these patients. The authors compiled an interdisciplinary review of the basic principles of diagnosis and treatment of secondary peritonitis, which reflects current findings supported by evidence-based medicine. The work is based on published international literature but also shares opinions and experiences of the selected specialists. The presented work in its extent is not meant to substitute an in-depth study of the issue, but to allow a basic and quick review of the topic.
Keywords:
secondary peritonitis – intraabdominal infection – recommendation
Autoři: R. Gürlich 1; V. Adámková 2
; J. Ulrych 3; M. Balík 4; A. Ferko 5; E. Havel 5; A. Jabor 6; V. Janík 7; Z. Kala 8
; I. Klementa 11; M. Kolář 9
; Z. Krška 3; P. Kysela 8; R. Lischke 10
; Č. Neoral 11; F. Vyhnánek 1; J. Zajak 10
; P. Zbořil 11; V. Třeška 12
Působiště autorů: Chirurgická klinika FNKV a 3. LF UK, přednosta: Prof. MUDr. R. Gürlich, CSc. 1; Klinická mikrobiologie a ATB centrum VFN Praha a 1. LF UK, primář: MUDr. V. Adámková 2; I. chirurgická klinika VFN a 1. LF UK, přednosta: Prof. MUDr. Z. Krška, CSc. 3; Klinika anesteziologie, resuscitace a intenzivní medicíny VFN a 1. LF UK Praha, přednosta: Doc. MUDr. M. Stříteský, CSc. 4; Chirurgická klinika FNHK a LF UK, přednosta: Prof. MUDr. A. Ferko, CSc. 5; Pracoviště laboratorních metod IKEM a 3. LF UK Praha, přednosta: Prof. MUDr. A. Jabor, CSc. 6; Radiodiagnostická klinika FNKV a 3. LF UK, přednosta: Doc. MUDr. V. Janík, CSc. 7; Chirurgická klinika LF MU FN Brno Bohunice, přednosta: Prof. MUDr. Z. Kala, CSc. 8; Ústav mikrobiologie LF UP, přednosta: Prof. MUDr. M. Kolář, Ph. D. 9; III. chirurgická klinika 1. LF UK a FN Motol, přednosta: Prof. MUDr. R. Lischke, Ph. D. 10; 1. chirurgická klinika FN Olomouc a LF UP, přednosta: Prof. MUDr. Č. Neoral, CSc. 11; Chirurgická klinika FN Plzeň a LFP UK, přednosta: Prof. MUDr. V. Třeška, DrSc. 12
Vyšlo v časopise: Rozhl. Chir., 2014, roč. 93, č. 6, s. 334-352.
Kategorie: Postgraduální vzdělávání
Práce je určena k postgraduálnímu vzdělávání lékařů.
Souhrn
Sekundární peritonitida je nejčastější zánětlivou náhlou příhodou břišní řešenou na chirurgických pracovištích. Pouze časnou a správnou diagnostikou a léčbou můžeme zlepšit osud těchto pacientů. Proto kolektiv autorů připravil mezioborový přehled základních principů diagnostiky a léčby sekundární peritonitidy, který odráží současné poznatky opřené o medicínu důkazů. Text vychází z publikovaných mezinárodních rukopisů, ale obsahuje zkušenosti a názory oslovených odborníků. Text byl společně projednán a vyjadřuje souhlasný názor všech spoluautorů. Předložený rukopis ve svém rozsahu nemůže nahradit podrobné studium, ale umožňuje základní a rychlý přehled o problematice.
Klíčová slova:
sekundární peritonitis – diagnostika – léčba – nitrobřišní infekce1. Základní pojmy
Peritonitida je definována jako zánět peritonea (pobřišnice) způsobený nejčastěji mikroorganismy nebo vzácněji toxickými látkami endogenního nebo exogenního původu.
Peritonitida je zánět pobřišnice, který se již historicky v českých zemích rozděluje na ohraničený a difuzní. V anglosaské literatuře jsou nitrobřišní onemocnění provázená peritonitidou zahrnuta do širší nosologické jednotky označované jako nitrobřišní infekce – „intraabdominal infection (IAI)“. Peritonitida a IAI však nejsou synonyma.
Primární peritonitida je difuzní zánět peritoneální dutiny infekčního původu při primárně nepostižených intraperitoneálních a retroperitoneálních orgánech. Hlavní výskyt je u imunokompromitovaných jedinců.
Sekundární peritonitida je zánět peritoneální dutiny infekčního nebo neinfekčního původu v důsledku primárního postižení intraperitoneálního nebo retroperitoneálního orgánu. Samostatnou kapitolou je pooperační peritonitida, nejčastěji vzniklá na podkladě dehiscence anastomózy nebo pahýlu trávicí trubice.
Terciární peritonitida vzniká v důsledku selhání léčby primární nebo sekundární peritonitidy s přetrvávajícími známkami infekce a/nebo zánětu.
Intraabdominální infekce (IAIs) představují široké spektrum patologických stavů, které zahrnují zánětlivá onemocnění orgánů intraperitoneálních i retroperitoneálních včetně abscesů parenchymatózních orgánů. Klinicky se rozdělují nitrobřišní infekce na nekomplikovanou nitrobřišní infekci (uIAI), kdy zánět nepřesahuje anatomické ohraničení postiženého jednoho orgánu, a komplikovanou nitrobřišní infekci (cIAI), kdy se zánět šíří za hranici orgánu do peritoneální dutiny. Komplikovanou nitrobřišní infekci pak můžeme členit na lokalizovanou formu a difuzní zánět pobřišnice. Nitrobřišní infekce můžeme rozdělovat i na infekce komunitní – community-acquired intra-abdominal infections (CAIAIs) – a infekce vzniklé u hospitalizovaných nemocných v souvislosti s poskytovanou zdravotní péčí – healthcare-acquired intra-abdominal infections (HA-IAIs).
Sepse je systémová zánětlivá reakce organismu v důsledku předpokládané nebo prokázané infekce.
Těžká sepse je sepse se známkami orgánové dysfunkce a tkáňové hypoperfuze.
Septický šok je sepse s rozvojem refrakterní hypotenze perzistující i přes adekvátní tekutinovou léčbu.
2. Etiologie
Zdrojem původců sekundární peritonitidy bývá nejčastěji endogenní flóra. Pouze vzácně jsou izolovány další mikroorganismy jako Staphylococcus aureus, Neisseria gonorrhoeae nebo Mycobacterium tuberculosis.
Četnost a spektrum mikroorganismů, které jsou nalézány u nitrobřišních infekcí, závisí na místě primárního procesu a případné alteraci slizniční mikroflóry. Narušení komenzální flóry, především anaerobní, vytváří „ekologické vakuum“, které využijí jiné mikroorganismy, potenciálně patogenní. V případě komunitních nitrobřišních infekcí lze endogenní flóru jasně definovat, zatímco u nitrobřišních infekcí klasifikovaných jako infekce spojené s poskytovanou zdravotní péčí je třeba počítat s nozokomiálními, často multirezistentními původci.
Perforace gastrointestinálního traktu je nejčastější příčinou nitrobřišních infekcí, proto znalost mikrobiálního osídlení v různých částech GIT je zásadní pro pochopení a správné zvládnutí těchto infekcí. Distálním směrem přibývá anaerobních bakterií a obrací se i poměr fakultativně aerobních (především E. coli) a anaerobních bakterií. V sestupném tračníku činí tento poměr 1 : 104. Zastoupení jednotlivých bakterií v různých částech GIT spolu s hlavními toxiny, které produkují nejvýznamnější původci, znázorňuje Tab. 1.
Tab. 1. Zastoupení mikroorganismů normální flóry gastrointestinálního traktu Tab. 1: Physiological flora of the gastrointestinal tract 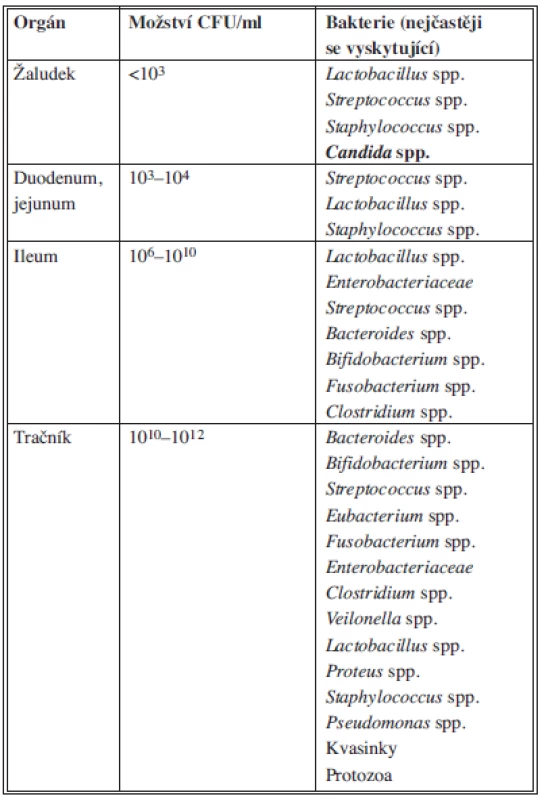
Bakteriální denzita, nalezená v peritoneální dutině při ztrátě integrity slizniční bariéry, je variabilní a závisí na úrovni poškození a komorbiditách pacienta. Při perforaci tračníku vnikne do peritoneální dutiny více než 1011 CFU/ml různých bakteriálních druhů. Paradoxně bývá kultivačně prokázáno pouze asi pět druhů, z toho tři anaerobní a dva aerobní. Izolované anaerobní bakterie mají většinou vyšší míru aerotolerance a jasně definované faktory virulence, než je tomu u zbytku anaerobní střevní mikroflóry.
Penetrující poranění jater nebo sleziny jsou velmi zřídka komplikovaná rozvojem infekce, protože jsou primárně sterilními orgány.
V případě parazitárních infekcí je riziko vzniku peritonitidy po ruptuře amébových jaterních abscesů asi 10 %, zpravidla dochází k akutní generalizované peritonitidě, méně často k lokalizovaným intraperitoneálním abscesům. Mortalita těchto infekcí se pohybuje okolo 18 %.
Kvasinky spolu se S. aureus, Pseudomonas aeruginosa nebo zástupci čeledi Enterobacteriaceae bývají izolovány z peritoneální tekutiny od pacientů podstupujících peritoneální dialýzu. Kandidová peritonitida je také pozorována po operaci nebo perforaci GIT u pacientů s imunosupresí, dlouhodobě hospitalizovaných nebo dlouhodobě užívajících antibiotika (Tab. 2).
Tab. 2. Zastoupení mikroorganismů u sekundární peritonitidy Tab. 2: Representation of microorganisms in secondary peritonitis 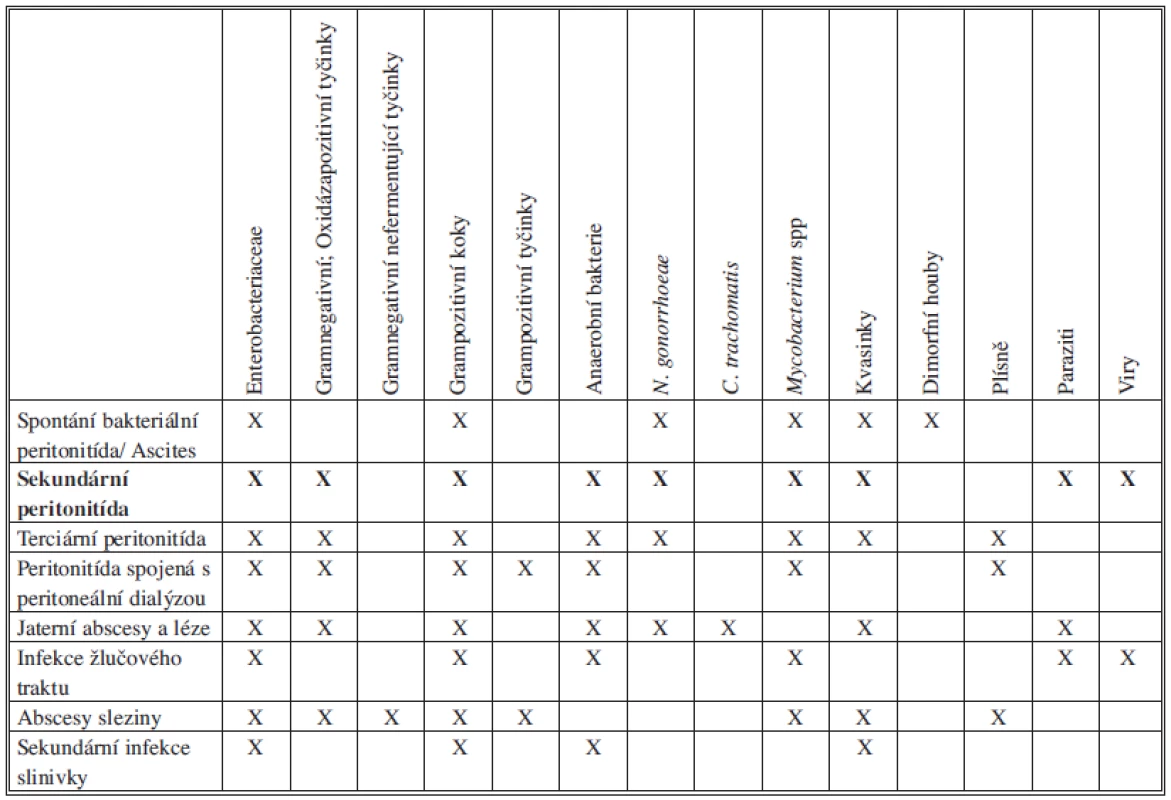
Mezi hlavní původce sekundární peritonitidy patří zástupci čeledi Enterobacteriaceae, anaerobní bakterie, grampozitivní fakultativně anaerobní bakterie tvoří asi třetinu kultivačních nálezů. Zastoupení mikrobiálních původců u komunitních a nozokomiálních peritonitid se liší citlivostí k antiinfektivům a vyšším podílem Pseudomonas aeruginosa či enterokoků (Tab. 3).
Tab. 3. Zastoupení bakterií u komunitních a nozokomiálních nitrobřišních infekcí (CIAO Study) Tab. 3: Microorganisms in community-acquired and healthcare-associated (nosocomial) IAIs 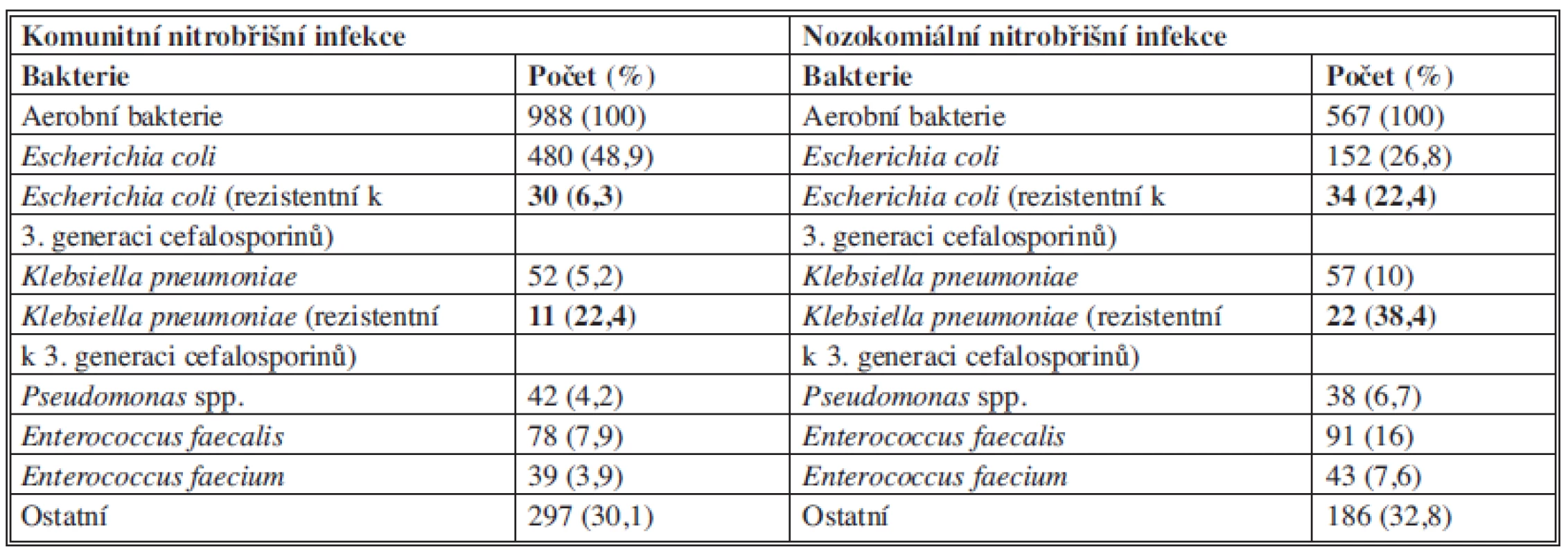
Podíl kvasinek činí asi 7 % z celkového počtu všech kultivačních záchytů, nejčastěji je izolována Candida albicans. Signifikantně vyšší je výskyt kvasinek u infekcí spojených s poskytovanou zdravotní péčí a u pacientů s perforací horního GIT.
3. Diagnostika
3.1. Klinická diagnostika sekundární peritonitidy
Správná klinická diagnostika sekundární peritonitidy vždy obsahuje podrobnou anamnézu a fyzikální vyšetření.
Anamnéza: Kompletní anamnéza včetně rodinné a osobní. Symptomy sekundární peritonitidy:
- Bolest – často první příznak, je nezbytné bolest lokalizovat, určit místo a mechanismus vzniku, její intenzitu, vývoj a charakteristiku. Cíleně se ptát na výskyt přenesené bolesti.
- Poruchy funkce gastrointestinálního traktu: nauzea, zvracení, zástava stolice a meteorismus.
- Další příznaky: urologické onemocnění (charakteristika močení), u ženy gynekologické afekce.
Fyzikální vyšetření:
- Celkové vyšetření: a) vzhled nemocného, b) poloha nemocného, c) tep, krevní tlak, dýchání, tělesná teplota, d) fyzikální vyšetření hrudníku (plíce, srdce).
- Vyšetření břicha: pohled, poklep, pohmat, poslech, vyšetření per rectum.
- Příznaky specifické pro peritonitidu: Blumbergův, Rovsingův, Plenièsův, psoatový a frenikový příznak.
Mezi hlavní příznaky sekundární peritonitidy patří: zvýšená teplota, urychlení tepu, trvalá bolest břicha, známky peritoneálního dráždění, stažení svalů, bolestivost při vyšetření per rectum.
3.2. Mikrobiologická diagnostika sekundárních peritonitid
Rychlost rozvoje klinických obtíží závisí na druhu a množství přítomných agens (infekční dávce), lokalizaci infekce, délce trvání nákazy a na imunitním stavu postiženého jedince. Úspěšnost průkazu agens a optimální terapie onemocnění závisí na správném odběru diagnosticky validního materiálu, jeho uchování, transportu a způsobu vyšetření. Následná interpretace výsledků laboratorního vyšetření speciálními mikrobiologickými metodami se vždy opírá o analýzu všech dostupných dat, tzn. výsledků základních a speciálních laboratorních vyšetření, klinických a anamnestických údajů. Obecné zásady odběru a transportu vzorků pro mikrobiologické vyšetření (Tab. 4, 5, 6).
Tab. 4. Obecné zásady odběru a transportu vzorků pro mikrobiologické vyšetření Tab. 4: Principles of collection and transport of samples for microbiological examination 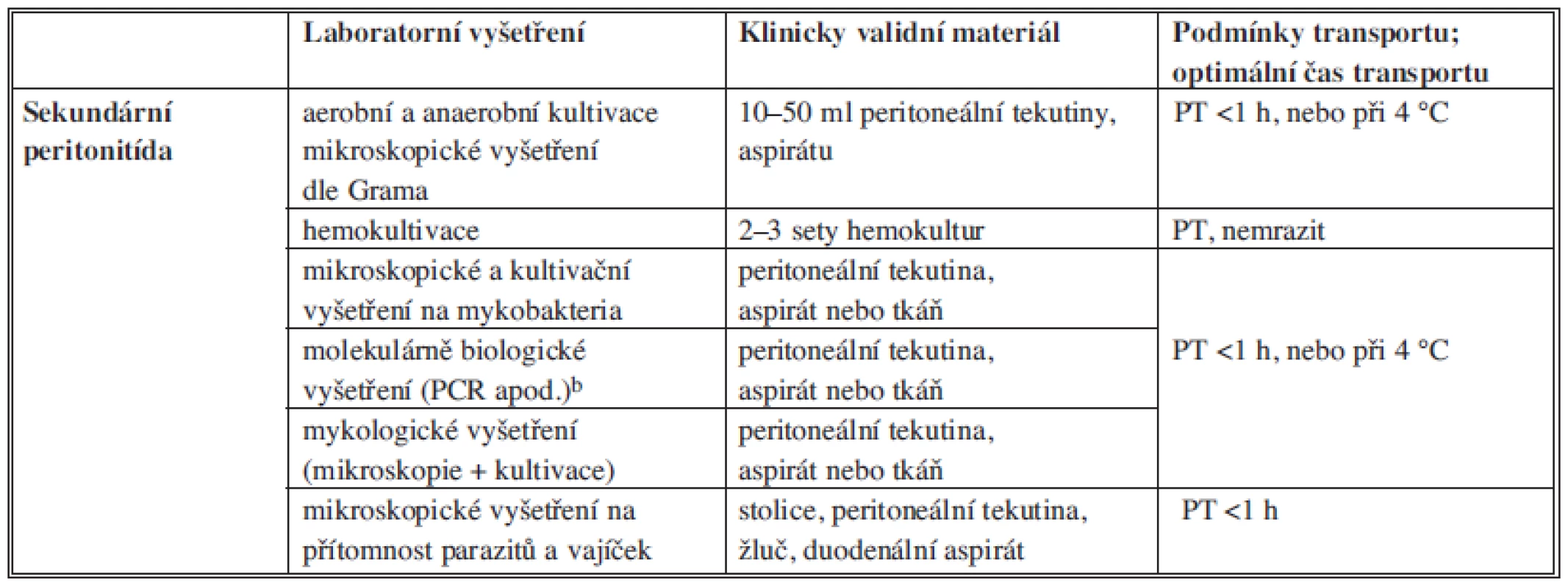
Poznámka: PT – pokojová teplota Tab. 5. Bakteriologické vyšetření materiálu z dutiny břišní Tab. 5: Bacteriological examination of material from the abdominal cavity 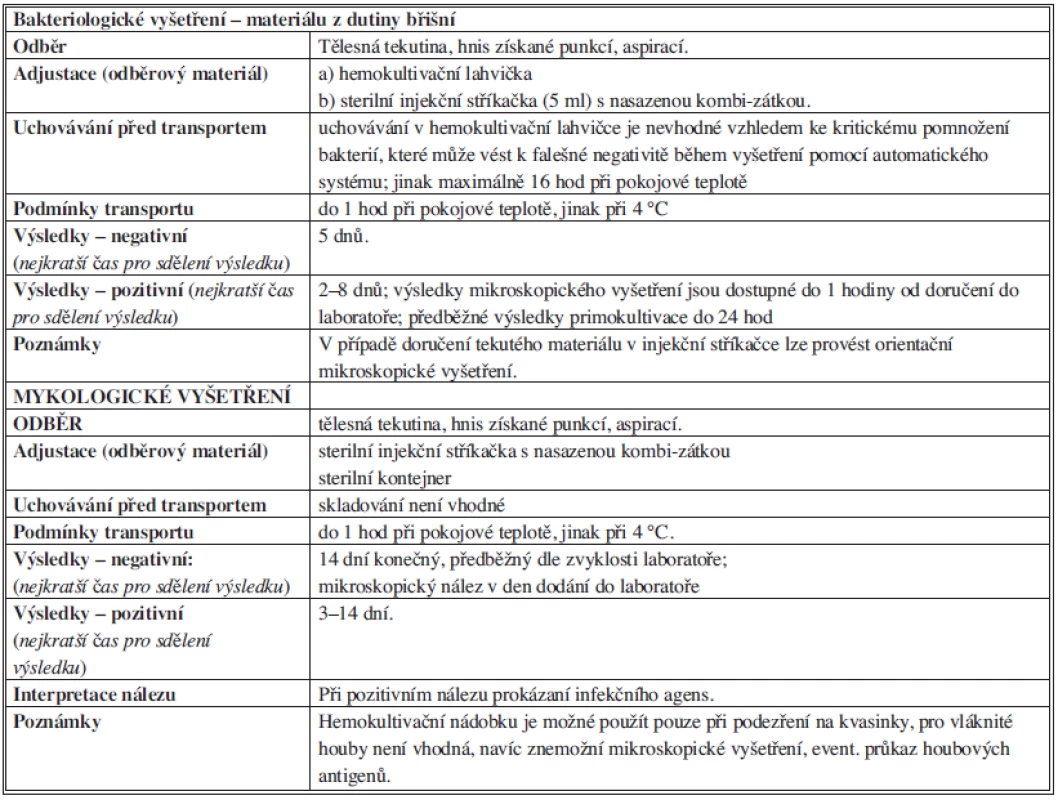
Tab. 6. Bakteriologické vyšetření hemokultury Tab. 6: Bacteriological examination of blood cultures 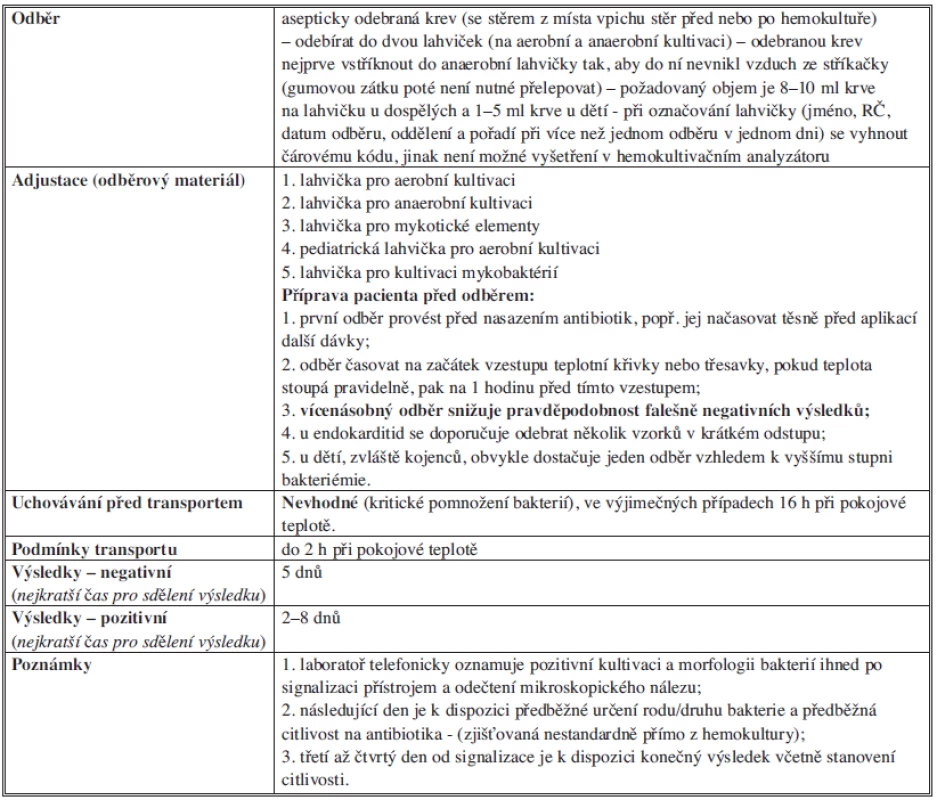
Mikrobiologický průkaz původce infekce předpokládá správný odběr klinicky relevantního vzorku biologického materiálu, který pochází přímo z místa probíhajícího infekčního procesu nebo z lokality, kam původce proniká. Odběr je třeba provést před zahájením antibiotické terapie. Indikuje-li se odběr v souvislosti se selháváním léčby, musejí být vzorky odebrány před její změnou, nebo ještě lépe po krátkodobém vysazení antibiotik, umožňuje-li to stav pacienta. Přiléhavost vzorku a požadovaného mikrobiologického vyšetření diagnóze infekce určuje jeho klinickou validitu. Odběr a transport vzorku musí probíhat za přesně stanovených podmínek; dodržení těchto podmínek zajišťuje tzv. technickou validitu vzorku. Pouze správný odběr materiálu, jeho skladování a transport do laboratoře za vyhovujících podmínek (tzv. preanalytická fáze) zaručují získání validních výsledků určitým typem diagnostické metody.
Peritoneální tekutina patří mezi velmi cenné vzorky biologického materiálu. Podaří-li se v nich prokázat mikroorganismy, bývá nález většinou signifikantní, přesto je třeba vyloučit kontaminaci při odběru. Odběr má být proveden aseptickou punkcí nebo při operaci, nikoliv cestou dlouhodobě zavedené drenáže. Vzorky musejí být odebrány přísně asepticky. Lze provést odběr do hemokultivační lahvičky, která obsahuje živné medium a usnadní pomnožení případných mikroorganismů, zvláště u pacientů, kteří jsou již léčeni antibiotiky. Výtěr nebo stěr z dutiny břišní je zcela nevhodný, protože nelze provést kompletní mikrobiologickou diagnostiku, tj. mikroskopické vyšetření, anaerobní kultivaci, popř. molekulárně biologický průkaz obtížně kultivovatelných mikroorganismů.
Reprezentativní klinický materiál od pacienta s nitrobřišní infekcí umožňuje identifikaci původců a stanovení citlivosti na antibiotika, bez ohledu na to, zda se jedná o infekci získanou v komunitě nebo ve zdravotnickém zařízení. Kromě mikrobiologického vyšetření peritoneální tekutiny může poskytnout cennou diagnostickou informaci též vyšetření hemokultury, zvláště v případě infekcí spojených s poskytovanou zdravotní péčí a u terciárních peritonitid.
Hnis z abscesových ložisek, empyém, obsah cyst a píštělí by měl být odebrán též asepticky a zajištěn proti působení vzdušného kyslíku, neboť v těchto vzorcích bývá velmi často příměs anaerobních mikroorganismů, pouhý výtěr z ložiska není dostatečný. Vždy by měl být do laboratoře zaslán dostatečný objem tekutého materiálu. Aspirát z uzavřených abscesových ložisek je třeba odebrat nejen z centra abscesu, ale i z blízkosti jeho stěny, protože se většina patogenních mikroorganismů replikuje na stěnách abscesu, nikoliv v jeho středu.
Algoritmus vyšetření vzorku v laboratoři se skládá z mikroskopického a kultivačního vyšetření, stanovení citlivosti na antibiotika/antimykotika a interpretace nálezu.
Mikroskopické vyšetření zahrnuje barvení dle Grama a Ziehl Nielsena pro detekci acidorezistentních tyčinek (tj. Mycobacterium spp.).
Kultivační vyšetření sestává z aerobní kultivace na obohacených kultivačních médiích (krevní agar, čokoládový agar, MacConkey agar, Sabouraudův agar) při 35 °C v 5–10% atmosféře CO2. V případě tekutých vzorků lze provést tzv. přímou citlivost (diskovou difuzní metodou), která je sice orientační, ale reflektuje velikost inokula v místě probíhající infekce. Jestliže jsou purulentní vzorky klinického materiálu po 48 hodinách kultivačně negativní, je třeba, v závislosti na klinickém kontextu, založit kultivaci na průkaz Mycobacterium spp. Z tohoto důvodu musejí být původní vzorky uchovány v laboratoři minimálně 48 hodin a část klinického materiálu by měla být zmražená pro případnou PCR diagnostiku. Inkubace naočkovaného materiálu by měla trvat 5 dnů, přičemž každý den se hodnotí případná pozitivita. Pro vyloučení kontaminace kultivačních půd se zakládají paralelní kultivace s tím, že jedna sada se ponechává po celou dobu bez manipulace a kontroluje se až po pěti dnech.
3.3. Radiologická diagnostika
Mezi základní vyšetřovací metody pacientů s podezřením na peritonitidu patří: 1. Rentgenové vyšetření prostým snímkem břicha vestoje nebo vleže, 2. Ultrazvukové vyšetření, 3. CT vyšetření.
3.3.1. Rentgenové vyšetření prostým snímkem břicha vestoje nebo vleže je jednou z nejdostupnějších a nejlevnějších vyšetřovacích metod. Umožňuje detekovat volný plyn v peritoneální dutině (např. při perforaci žaludečního vředu) a přítomnost kontrastních cizích těles. Porucha pasáže trávicím traktem se může projevit distenzí střevních kliček naplněných plynem a tekutým obsahem ve formě hladinek jako tzv. hydroerický příznak (např. při lokální peritonitidě indukované zánětem některého z orgánů uložených v peritoneální dutině). Vzácně mohou být na prostém snímku břicha patrné drobné kolekce plynu ve stěně břišní, střevní nebo mezi kličkami (např. při nekróze stěny střevní nebo tvořícím se abscesu).
3.3.2. Ultrazvukové vyšetření je základní vyšetřovací metodou u pacientů s podezřením na peritonitidu. Kromě dostupnosti, rychlosti, bezpečnosti a neinvazivity je spojené s významným diagnostickým přínosem. Umožňuje zobrazení zánětlivých změn orgánů dutiny břišní a jejich komplikace (např. tvořící se absces) a detekci tekutinových kolekcí v peritoneální dutině. Vzhledem k tomu, že vyšetření se provádí v reálném čase, můžeme také hodnotit střevní peristaltiku nebo použít ultrazvukovou sondu k odměřené kompresi. Výsledky ultrazvukového vyšetření jsou limitovány zejména přítomností plynu v trávicím traktu, obezitou a velmi závisí na erudici a zkušenostech vyšetřujícího.
3.3.3. CT vyšetření umožňuje na základě vysoké rozlišovací schopnosti vrstvových snímků objasnění nejasných nálezů ultrazvukového nebo rentgenového vyšetření břicha. Velkou výhodu představuje možnost postkontrastního CT vyšetření, při kterém je jodová, hydrosolubilní kontrastní látka aplikována jak perorálně, tak intravenózně. Rutinně je CT vyšetření indikované při podezření na zánětlivé nebo nádorové postižení parenchymových orgánů břicha, detekci tekutinových kolekcí event. volného plynu v dutině břišní a skrytých mezikličkových abscesů.
MR vyšetření není vzhledem k délce vyšetření, omezené dostupnosti a vyšším nákladům rutinní diagnostickou metodou pacientů s podezřením na peritonitidu.
Indikace zobrazovacích vyšetření by měla být racionální a měla by vycházet z výsledků klinického a laboratorního vyšetření. Při indikaci musí být zohledněn jak celkový stav pacienta, schopnost jeho spolupráce, časová náročnost a invazivita vyšetřovací metody, tak možnosti a dostupnost požadovaného vyšetření na daném pracovišti. Správná indikace zobrazovací metody, kvalitně provedené vyšetření a jeho popis jsou předpokladem efektivního stanovení diagnózy umožňující včasný terapeutický zákrok.
3.4. Laboratorní vyšetření u peritonitidy
Jsou standardní vyšetření modalitou v diferenciální diagnostice zánětlivých nitrobřišních stavů. K dispozici je v literatuře poměrně málo dat, evropská studie CIAO laboratorní data (kromě početní koncentrace leukocytů) vůbec nevyužívá. V řadě studií se ale hodnotí zánětlivé ukazatele (obvykle CRP, méně často prokalcitonin) a laboratorní parametry, které jsou součástí skórovacích systémů (APACHE-II, SOFA). Laboratorní vyšetření se především provádějí ze vzorku krve (v plazmě, séru), ale významný přínos může poskytnout vyšetření ascitické tekutiny nebo moči. Zatímco požadavky na vyšetření krve jsou běžné, vyšetření ascitické tekutiny vyžaduje vyšší péči o odebraný vzorek především z hlediska dodržení podmínek pro mikrobiologická vyšetření (většina biochemických vyšetření speciální podmínky zacházení se vzorkem nevyžaduje).
Vyšetření pro určení tíže zánětu a sledování dynamiky změn
Z obecného pohledu jsou indikována tato laboratorní vyšetření u peritonitidy: parametry přítomnosti a tíže zánětu s cílem monitorovat terapii, parametry charakterizující orgánové dysfunkce, vyšetření pro diferenciální diagnostiku a vyšetření určující prognózu pacienta.
Leukocyty v krvi
Početní koncentrace leukocytů je klasifikačním kritériem SIRS a je součástí některých skórovacích systémů. Leukocyty jsou sice monitorovány pravidelně u všech nemocných, ale nemají dostatečnou senzitivitu ani specifičnost pro odlišení závažných intraabdominálních infekcí, neliší se mezi přežívajícími a zemřelými pacienty, neliší se ani rozdíly v leukocytech u pooperační peritonitidy a peritonitidy z jiných příčin.
CRP (C-reaktivní protein)
Patří mezi běžné biomarkery zánětu, zvyšuje se při septických komplikacích, syndromu systémové zánětlivé odpovědi a řadě dalších stavů. Má rychlou dynamiku nárůstu koncentrací, poločas eliminace je kolem 48 hodin. Má vysokou intraindividuální variabilitu, takže je možné větší kolísání koncentrací u jednoho jedince. Také z tohoto důvodu má význam spíše pro monitorování, koncentrace nemají diferenciálně diagnostický význam; CRP nerozlišuje pacienty se SIRS a sepsí a nemá dostatečnou specifičnost pro abdominální infekci. CRP nepredikoval mortalitu u pacientů se sekundární peritonitidou, nelišil se u pacientů s pooperační peritonitidou a peritonitidou z jiných příčin. Výhodou CRP je rutinní dosažitelnost a možnost měřit u lůžka nemocného v režimu POCT (point-of-care testing).
Interleukin 6 (IL6)
Interleukin 6 může predikovat prognózu pacientů, ale lepší diskriminační efektivitu má prokalcitonin. Navíc nepatří mezi vyšetření, která by byla běžně dostupná 24 hodin denně. Změny koncentrací jsou rychlé.
Prokalcitonin v plazmě (PCT)
Prokalcitonin poskytuje hodnotnější informaci než CRP, lépe charakterizuje změny stavu pacienta. Zvýšení je typicky v septických stavech, ale také SIRS nebo těžký operační zákrok jsou důvodem pro zvýšení koncentrace prokalcitoninu. Změny koncentrace jsou rychlé, poločas eliminace je 24 hodin (udává se i 30 hodin). Prokalcitonin je u peritonitidy markerem závažnosti onemocnění a prognózy. Odlišení přežívajících a zemřelých po závažných operacích má 84% senzitivitu a 91% specifičnost a dosahuje lepších diskriminačních parametrů než CRP, TNF-alfa a IL6. PCT je obvykle zvýšen u 4kvadrantové peritonitidy. Pokles v 1. až 3. dnu (v počátečním průběhu onemocnění) znamená dobrou prognózu (84% senzitivita, 91% specifičnost). Vhodnější než jednotlivá izolovaná vyšetření prokalcitoninu mohou být dynamická sledování v čase.
TNFalfa
Zvyšuje se v rámci SIRS i sepse, ale vzhledem ke krátkému poločasu eliminace a nízkému stupni korelovanosti s prognózou pacientů nejde o rutinně využívaný parametr. U peritonitidy jsou ojedinělé zkušenosti v časném stadiu onemocnění.
4. Intenzivní péče
Zahájení antimikrobiální terapie, hemodynamická resuscitace, rychlá diagnostika a komplexní pooperační péče jsou základní úkoly intenzivní péče v managementu léčby akutní peritonitidy. Hlavním rizikem běžné klinické praxe je protrahovaný diagnostický proces s prodlevou adekvátní tekutinové a antibiotické terapie. Vzhledem k rychlému transportu bakterií z peritoneální dutiny do krve má význam odebrat krev na hemokultivační vyšetření v podobě aerobní i anaerobní kultivace.
4.1. Tekutinová terapie
Časně je zahajována na základě klinického nálezu známek centralizace oběhu, ale i preventivně při předpokládané diagnóze balancovaným krystaloidem do periferní žíly. Monitorování tekutinové léčby v podobě normalizace hodinové diurézy, periferního prokrvení, úpravy alterace vědomí, normalizace krevního tlaku a laboratorních známek v deficitu bazí a hladině laktátu může být ve většině případů dostačující. Rychlou informaci o volumové dependenci v resuscitační fázi poskytují dynamické manévry s elevací dolních končetin či manuálním zatlačení na játra přes břišní stěnu. V případě nutnosti inotropní a vasopresorické podpory je zavedení centrálního žilního katétru po úvodním bolusu 1–3 litrů tekutin a zavedení arteriálního katétru pro přímé měření krevního tlaku přínosem. Komplexní hemodynamické monitorování s měřením srdečního výdeje je vhodné u kardiálně rizikových osob a vždy tam, kdy se lékař brání pokračování tekutinové terapie z důvodu již podaného velkého objemu či obavy ze srdečního selhávání. Protrahované podávání vasopresorů namísto objemové stabilizace oběhu bez adekvátního zdůvodnění monitorováním je chybou. Objemy potřebné k navození a kontinuálnímu udržení hemodynamické optimalizace jsou značně individuální, dosahují často 5–15 litrů v prvních 24 hodinách. Rychlé potlačení infekce a adekvátní operační výkon většinou umožňují přejít do fáze mobilizace tekutin a negativní tekutinové bilance po 24, 48 až 72 hodinách od zahájení terapie. Základním infuzním roztokem je balancovaný krystaloid. Podání bolusu syntetických koloidů či roztoku albuminu nemá význam v menším úniku tekutiny do intersticiálního prostoru, kde naopak velikost molekuly a její přítomnost v intersticiu je kontraproduktivní. Použijeme-li koloidní roztok v úvodu volumové resuscitace, pak je to rescue postup z důvodu kritické potřeby rychlého doplnění intravaskulárního objemu, což krystaloidem tak rychle nedosáhneme. U nemocných s nutnou velkoobjemovou náhradou lze s výhodou použít infuzní bikarbonátový náhradní roztok pro CVVH (kontinuální venovenózní hemofiltraci).
4.2. Monitorování hemodynamiky
Statické hodnoty CVP (central venous pressure) a PAOP (pulmonary artery occluded pressure) mají cca 50% predikční hodnotu pro určení preload. Tento problém se navíc akcentuje u IAH (intraabdominal hypertension), kde dochází k jejich zkreslení směrem vzhůru.
Doporučení dosáhnout CVP 8 mmHg, resp. PAOP 12 mmHg u pacienta s IAH znamenají často pokračující hypovolemii. Lépe je tedy postupovat s pomocí funkční hemodynamiky, tj. komplexním echokardiografickým vyšetřením, a toto doplňovat o kontinuální monitorování srdečního výdeje či alespoň variace tepového objemu (SVV – stroke volume variation) některou z dostupných metod. Pomoci v rozhodování může i dynamický manévr, jako je elevace dolních končetin a sklopení horní poloviny lůžka do horizontály na 4 min. Při vzestupu SV o alespoň 15 % hodnotíme test jako pozitivní ve smyslu vhodnosti navýšení preload.
4.3. Zahájení empirické antibiotické terapie
Otázce antibiotické terapie je věnována vlastní kapitola. U pacientů, jejichž stav vyžaduje intenzivní péči, je zdůrazněno při rozhodování: časné nasazení antimikrobiální terapie ještě v průběhu diagnostické fáze, deeskalační strategie vyššími dávkami z důvodu expanze distribučního prostoru antibiotik kumulací tekutin, biliární versus nebiliární etiologie, zaměření spíše na infekci z dolního zažívacího traktu než horního, stav imunosuprese organismu, prvotní infekce či již stav s rizikem rezistentních nozokomiálních kmenů.
4.4. Diagnostika abdominální sepse
Nezbytný diagnostický proces nesmí upozadit hemodynamickou optimalizaci a nasazení empirické antibiotické terapie, které je většinou možné již po klinickém vyšetření. Největší diagnostickou výtěžnost má CT vyšetření s intravenózní aplikací rtg kontrastu, provedené až po zahájení infuzní léčby. Ani klinicky jasně diagnostikovaná peritonitida by neměla být operována bez vyloučení těžce dekompenzovaného diabetu a hyperlipidemické krize. Změření glykemie a posouzení chylozity séra je možné neprodleně na příjmové ambulanci. Odběr peritoneální tekutiny pod ultrazvukovou kontrolou je klíčový u primární peritonitidy, má ale význam i pro diagnostiku intraperitoneálního zánětu a nastavení ATB u sekundární peritonitidy. Velmi důležité jsou punkce nejasných lokalizovaných výpotků a také nekróz u pankreatitid. Vedle mikrobiologického vyšetření punktátu má význam stanovení leukocytů (<500–800/μl se spíše jedná o neinfekční výpotek), amylázy a bilirubinu (komunikace se střevem), triacylglycerolů (chylózní výpotek).
4.5. Intrabdominální hypertenze
Významná sekvestrace tekutiny do peritoneální dutiny spolu se střevní paralýzou, která intraabdominální zánětlivý proces provází, vede obvykle k vzestupu intraabdominálního tlaku (IAP). Normální IAP je okolo 5 mmHg. Intraabdominální hypertenze (IAH) je definována jako trvalé zvýšení IAP nad kritických 12 mmHg, které jsou brány jako hranice pro klinicky významné mikrocirkulační změny. IAH je klasifikována následovně:
IAH I. stupně: IAP 12–15 mmHg
IAH II. stupně: IAP 16–20 mmHg
IAH III. stupně: IAP 21–25 mmHg
IAH IV. stupně: IAP >25 mmHg
Abdominální kompartment syndrom (ACS) je definován jako trvalý vzestup IAP nad 20 mmHg ve spojitosti s nově vzniklým selháním jednoho nebo více orgánů. Přítomnost ACS zvyšuje 3–5krát letalitu, je jednou z indikací k chirurgickému otevření peritoneální dutiny a ponechání laparostomatu. To podtrhává potřebu nitrobřišní tlak měřit. IAP je standardně měřen jako tlak v močovém měchýři po instalaci 25 ml sterilního roztoku uzavřeným systémem. Po otočení kohoutu je IAP snímán tlakovým senzorem kalibrovaným na nulovou hodnotu ve střední axilární čáře a na konci exspiria. Normální IAP křivka by vedle přenosu pulzací měla mít variaci v rámci dechového cyklu. Orientační měření otevřeným systémem přes močový měchýř posuzuje výšku vodního sloupce ve svislé hadičce otevřené proti atmosféře po instalaci 25 ml sterilního roztoku, kdy za nulovou hladinu je považována úroveň symfýzy (1 mmHg = 1,36 cm H2O).
Chirurgické otevření břicha z důvodu ACS je nejefektivnějším, byť významně invazivním opatřením ke snížení nitrobřišního tlaku a nemělo by být odkládáno. Méně invazivními opatřeními pro snížení IAH jsou evakuace střevního a žaludečního obsahu, punkční evakuace nitrobřišní tekutiny, zvýšení compliance břišní stěny a zlepšení perfuzního tlaku optimalizací hemodynamiky.
4.6. Pooperační péče
Většina pacientů s abdominální sepsí je operována. Podobně jako u diagnostiky platí i u operační intervence důraz na předchozí elementární stabilizaci hemodynamiky tekutinovou léčbou a zahájení antibiotické terapie. Základní součásti pooperační péče jsou udržení optimální hemodynamiky v prevenci multiorgánového selhání, obtížné ošetřování pacientů s velkou kumulovanou retencí tekutin, péče o laparostoma, optimalizace vnitřního prostředí včetně zajištění normoglykemie, cílená antimikrobiální terapie, orgánová podpora v případě selhávání orgánů, zejména umělá plicní ventilace, včasné rozpoznání přechodu do fáze možné mobilizace retinovaných tekutin a optimalizace podmínek pro mobilizaci tekutin, adekvátní nutriční a rehabilitační podpora, prevence nozokomiální infekce a iatrogenních komplikací invazivní terapie.
Arteficiální ventilace při zvýšeném nitrobřišním tlaku vede k obnovení ventilace bazálních segmentů plic. Preferujeme režimy se spontánní dechovou aktivitou na určité hladině PEEP (obvykle více než 8 mbar) (BIPAP, APRV, SIMV, PRVC). V závislosti na predikované tíži stavu zvažujeme časnou tracheostomii, která nám umožní eliminovat výraznější kontinuální analgosedaci a její vedlejší účinky na GIT a více zapojovat vlastní dechovou aktivitu. Již během arteficiální ventilace klademe důraz na pohybovou rehabilitaci. Snížení nitrohrudního tlaku přechodem na podpůrný ventilační režim zlepšuje žilní návrat krve do srdce a podporuje tak mobilizaci tekutin, na kterou navazuje možnost definitivního odvykání od umělé plicní ventilace.
Po eliminaci infekce a drenáži peritoneální dutiny vyhasne mediátorová aktivita a dochází k regeneraci kapilární funkce s možností mobilizace retinovaných tekutin. Důležité je vystihnout daný okamžik, kdy zastavujeme přívod tekutin a případně pomáháme diuretickou terapií řešit riziko kardiálního selhávání. Kombinací diuretik a úpravou infuzní terapie zabráníme při mobilizaci tekutin vedlejším efektům, jako jsou hypernatremie, hypokalemie a kontrakční alkalóza.
5. Antibiotická terapie
Antibiotická terapie hraje klíčovou roli v managementu komplikovaných nitrobřišních infekcí, zvláště u pacientů v kritickém stavu, kteří vyžadují bezprostřední zahájení adekvátní léčby. Nevhodná úvodní antibiotická léčba jednoznačně zvyšuje riziko klinického selhání, na druhé straně nadužívání širokospektrých antibiotik má za následek selekci rezistentních bakterií a jejich šíření, což se v konečném důsledku promítne i do nákladové efektivity léčby.
Optimální strategie antibiotické terapie nitrobřišních infekcí by měla zahrnovat účinnou iniciální terapii, která bude na jedné straně klinicky efektivní, ale zároveň nepovede k nadměrné spotřebě antibiotik, a tím nebude zvyšovat selekční tlak.
Změna přístupu k antiinfekční terapii nitrobřišních infekcí odráží narůstající rezistenci nejčastějších bakteriálních původců k antibiotikům – kmeny E. coli, K. pneumoniae produkující širokospektré betalaktamázy, karbapenem rezistentní kmeny P. aeruginosa, vankomycin rezistentní enterokoky, methicilin rezistentní S. aureus, multirezistentní Acinetobacter spp. – a současný vzestup výskytu mykotických agens, která se uplatňují především u kriticky nemocných pacientů s nozokomiálními infekcemi.
Faktory zvyšující riziko selhání zahrnují: opoždění iniciální intervence, tíže stavu (APACHE II skóre >15), vysoký věk pacienta, komorbidity s orgánovou dysfunkcí, nízká hladina albuminu, špatný nutriční stav, přítomnost difuzní peritonitidy, nemožnost adekvátního chirurgického ošetření nebo kontroly drenáže, malignita a vznik infekce spojené s poskytovanou zdravotní péčí. Infekce spojené s poskytovanou zdravotní péčí mají vyšší riziko komplikací a vyšší mortalitu než infekce získané v komunitě. Jsou většinou vyvolány rezistentnějšími bakteriemi včetně nefermentujících gramnegativních tyčinek, enterokoků nebo kvasinek.
Pro léčbu infekcí biliárního traktu není nutné přidávat antibiotika s výrazným antianaerobním účinkem. U imunosuprimovaných pacientů je třeba zvažovat v patogenezi i úlohu enterokoků.
Vzestup rezistence bakterií k antibiotikům je patrný i v komunitě, hlavní problém představují bakterie produkující širokospektré betalaktamázy typu ESBL. Terapeutické možnosti ovlivnění infekcí vyvolaných ESBL pozitivními kmeny enterobakterií jsou velmi omezené. Fluorované chinolony mohou mít zachovanou účinnost proti ESBL pozitivním bakteriím, ale rezistence narůstá nejen u kmenů K. pneumoniae, ale i u E. coli. Z výše uvedených příčin vzrostla spotřeba karbapenemových antibiotik, což mělo za následek výskyt kmenů rezistentních i na tuto skupinu antibiotik. Epidemiologicky nejzávažnější jsou bakterie, které produkují enzymy degradující karbapenemová antibiotika – karbapenemázy. Rychlé šíření karbapenemázu produkujících kmenů bakterií je jednoznačným důvodem pro změnu konceptu užívání karbapenemů druhé skupiny (meropenemu, imipenemu), aby se nezvyšoval selekční tlak.
Aplikace širokospektrých antibiotik s paralelním odběrem klinicky validních vzorků na mikrobiologickou diagnostiku umožňuje následnou deeskalaci, což vede k omezení nadužívání antibiotik, snížení selekčního tlaku a nákladové efektivitě. Mezi antibiotika s širokým spektrem účinku, a přesto nižším selekčním tlakem na rozvoj rezistence patří tigecyklin a ertapenem.
Mezi kritéria pro volbu vhodného antibiotika patří rozdělení peritonitid dle původu a zdroje infekce na komunitní, infekce spojené s poskytovanou péčí (nozokomiální) a infekce biliárního traktu. Dalším kritériem pro volbu vhodného antibiotika je stav pacienta (stabilizovaný, kritický) a riziko ESBL producentů jako možných původců stavu. Mezi nejvýznamnější faktory zvyšující riziko přítomnosti ESBL pozitivním kmenů bakterií patří předchozí opakované užívání antibiotik (zvláště cefalosporinů třetí generace) a opakované hospitalizace.
a) Sekundární peritonitida komunitní extrabiliárního původu
Pro pacienta stabilizovaného, bez rizika výskytu ESBL pozitivních kmenů, přicházejícího z komunity je dostatečným antibiotickým krytím potencovaný aminopenicilin, v případě alergie na betalaktamová antibiotika ciprofloxacin v kombinaci s metronidazolem nebo kombinace klindamycinu s gentamicinem a metronidazolem, s nutností monitorování hladin gentamicinu. Pacient stabilizovaný s rizikovými faktory pro přítomnost ESBL pozitivních kmenů enterobakterií musí být zajištěn antibiotiky se spektrem účinku zahrnujícím tuto skupinu původců, tj. ertapenem nebo tigecyklin. Antimykotické krytí u stabilizovaného pacienta z komunity není doporučeno.
U pacienta v kritickém stavu s rizikovými faktory pro vznik infekce vyvolané ESBL pozitivními kmeny bakterií jsou doporučeny karbapenemy druhé skupiny v kombinaci s antimykotikem vzhledem k současnému vyššímu riziku přítomnosti kvasinek (Tab. 7).
Tab. 7. Doporučení pro empirickou terapii komunitní extrabiliární sekundární peritonitidy Tab. 7: Recommendations for antimicrobial therapy for community-acquired extrabiliary IAI. 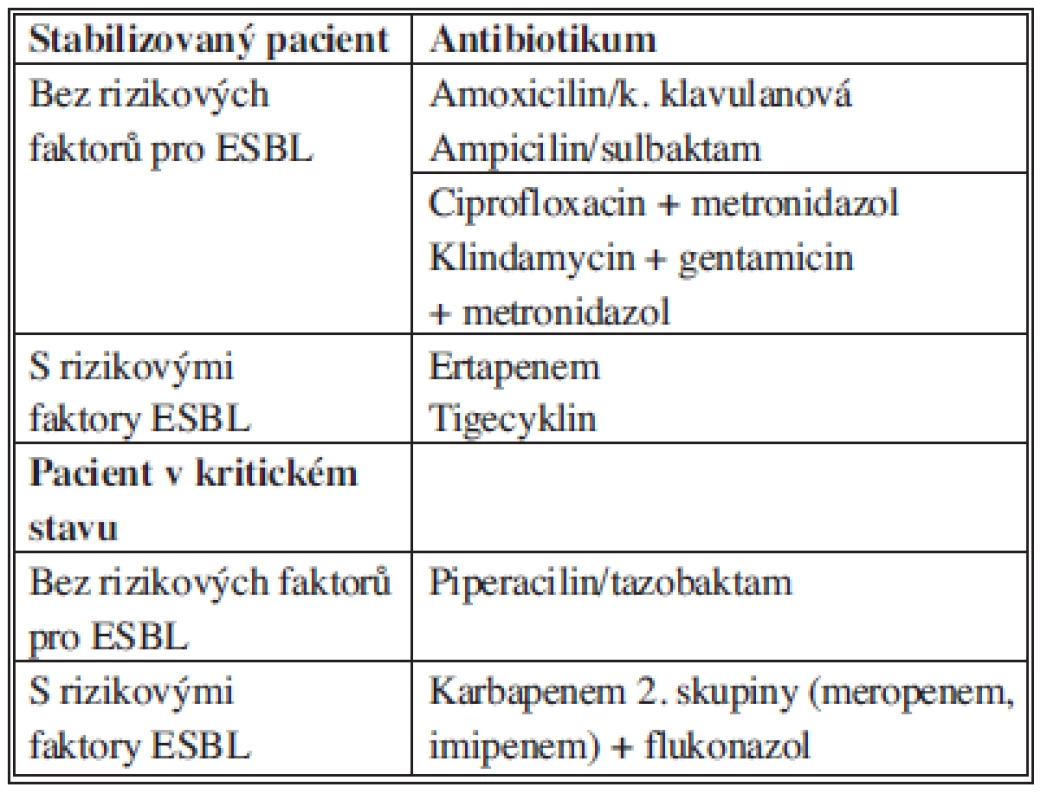
b) Sekundární peritonitida komunitní biliárního původu
Antibiotika jsou doporučená vždy pro léčbu komplikované cholecystitidy. Správná volba antibiotika, v případě biliárních infekcí, vychází kromě antibakteriálního účinku a klinického stavu především z dosažitelných koncentrací ve žluči. Avšak neexistují klinicky relevantní data, která by dokládala správné dávkování s maximálním a bezpečným průnikem antibiotik do žluče (Tab. 8).
Tab. 8. Doporučení WSES pro empirickou terapii SP biliárního původu Tab. 8: Recommendations for antimicrobial therapy for community-acquired biliary IAI 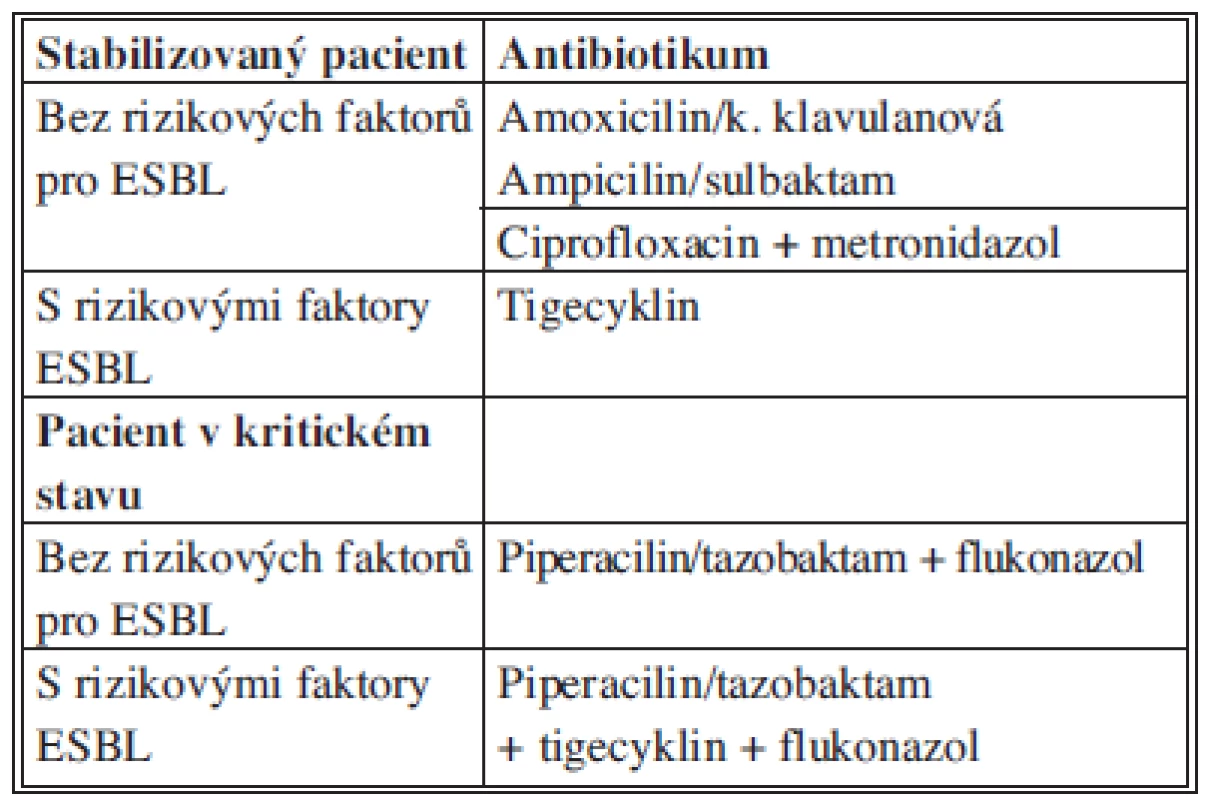
c) Nozokomiální sekundární peritonitida
Nozokomiální infekce jsou většinou vyvolané rezistentními bakteriemi, častěji se vyskytují i enterokoky, nefermentující bakterie a kvasinky, proto musí být volba antiinfektiv komplexní. Součástí kombinace by měla být vždy antimykotika. U pacientů v kritickém stavu jsou preferovány echinokandiny (caspofungin, anidulafungin, micafungin). Aminoglykosidy (gentamicin, amikacin) jsou rezervními antibiotiky pro pacienty s alergií na betalaktamová antibiotika. V případě jejich podávání je nutné monitorovat renální parametry a dosahované sérové hladiny, vzhledem k jejich nefrotoxicitě. Gramnegativní bakterie (jak enterobakterie – včetně ESBL pozitivních kmenů –, tak pseudomonády) mají v České republice zachovanou velmi dobrou citlivost na amikacin, avšak průnik amikacinu do perotineální tekutiny je nižší než gentamicinu (Tab. 9).
Tab. 9. Doporučení pro empirickou terapii nozokomiální SP Tab. 9: Recommendations for antimicrobial therapy for for hospital-acquired IAI 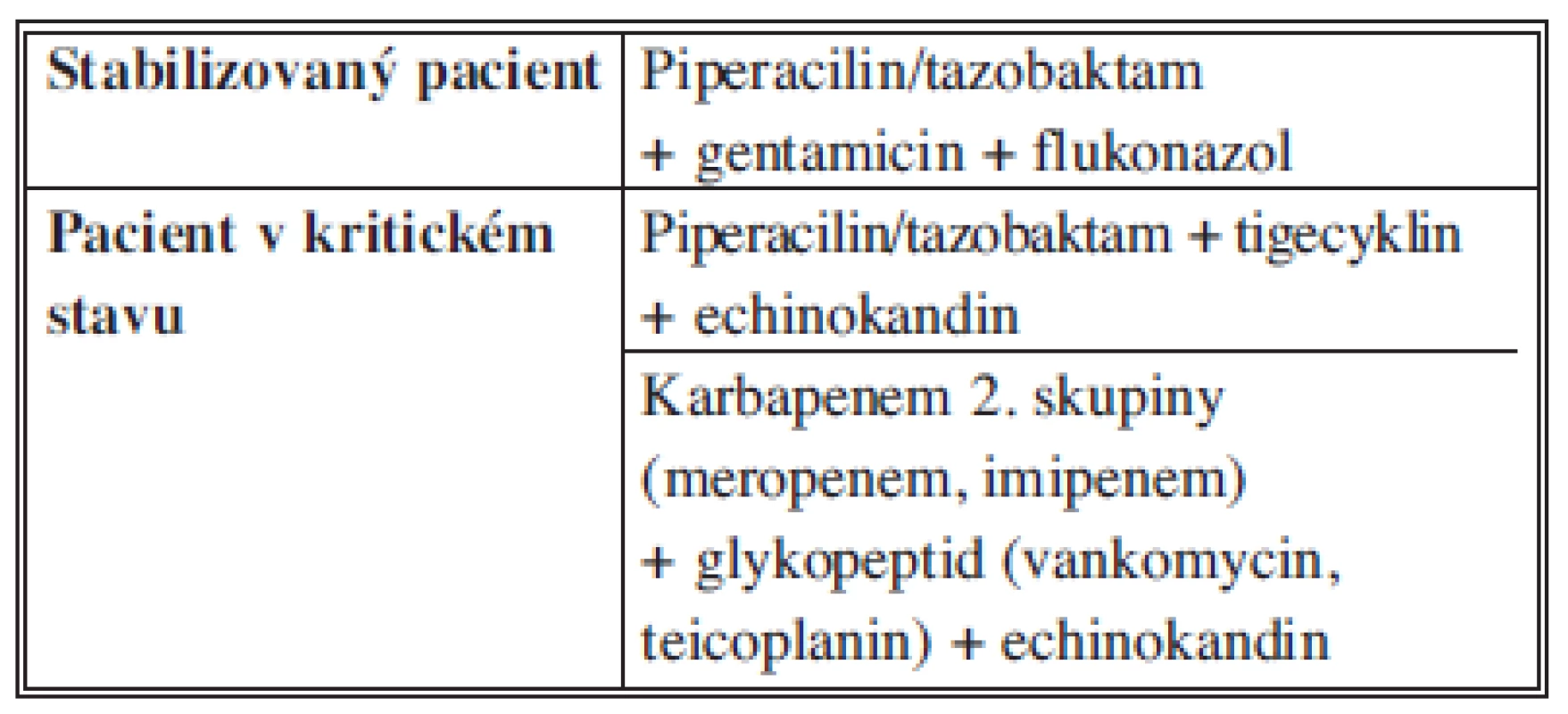
Doporučená antibiotika je nutné podávat v dostatečných dávkách (Tab. 10). Všechna uváděná doporučení, dosahované koncentrace a dávky antibiotik vycházejí ze studií prováděných s originálními přípravky, u kterých byla testována biologická dostupnost a klinická účinnost. U pacienta v kritickém stavu je třeba dosáhnout maximálních účinných koncentrací antibiotik/antimykotik v místě probíhající infekce.
Tab. 10. Dávkování doporučených antibiotik Tab. 10: Recommended dosage of antibiotics 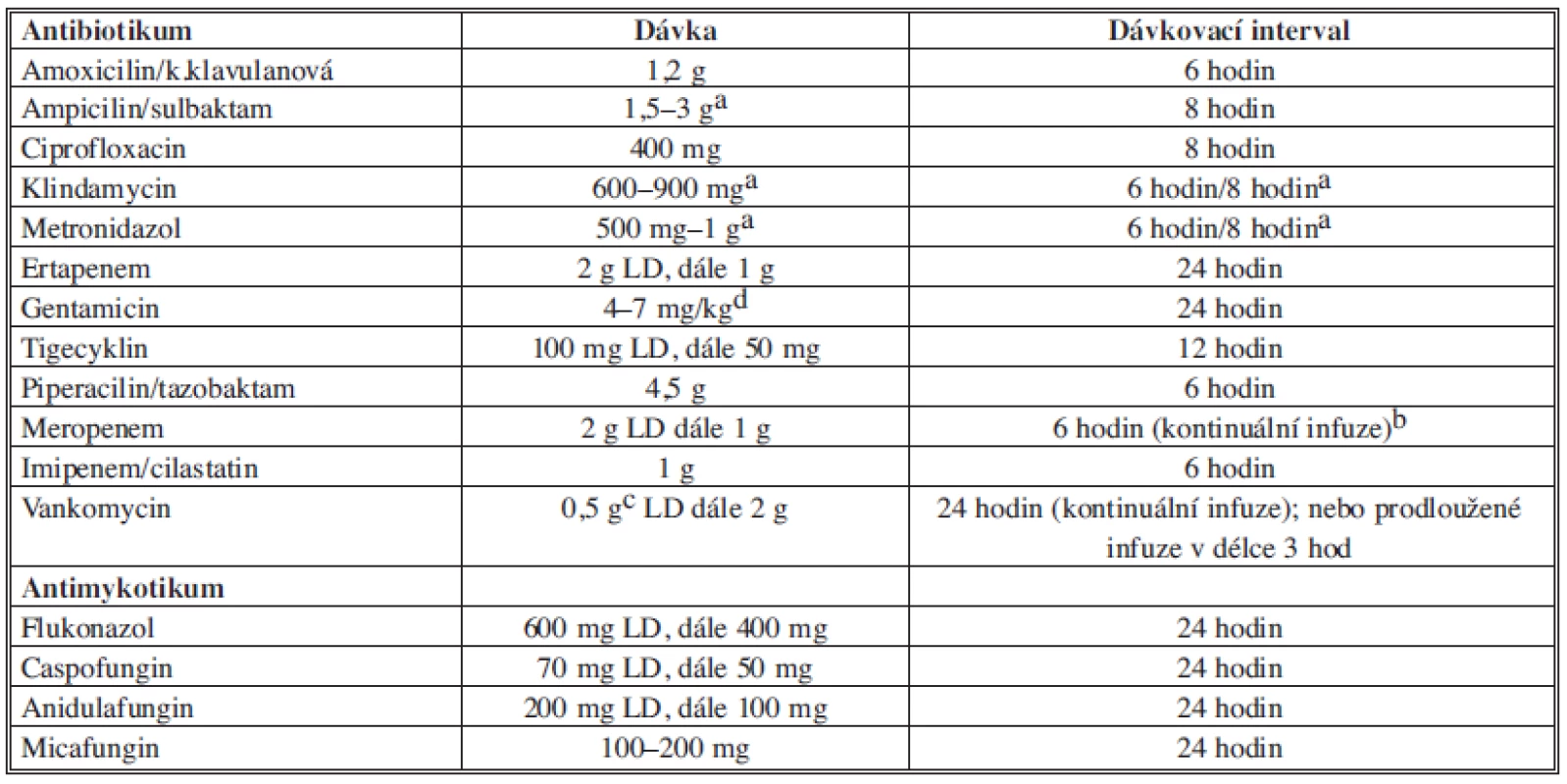
Poznámka: a dle váhy pacienta, b meropenem má stabilitu 6 hodin, proto je třeba infuzi 1g meropenemu měnit po 6 hodinách, c bolus vankomycinu v pomalé infuzi (alespoň 30 min.), d monitorování plazmatických hladin a renálních parametrů. 6. Základní principy chirurgické léčby sekundární peritonitidy
Primárním cílem chirurgické léčby je ošetření zdroje nitrobřišní infekce. Obecným principem chirurgického ošetření je eliminace zdroje infekce a zabránění další kontaminace dutiny břišní. Tato základní opatření mají zamezit rozvoji perzistující nebo recidivující sepse. Proto považujeme za kruciální provedení chirurgického výkonu co nejdříve od stanovení diagnózy. U pacientů v těžké sepsi většinou bezprostředně po nezbytné oběhové stabilizaci pacienta. Oddalování chirurgického výkonu jednoznačně zhoršuje prognózu pacienta.
Volba chirurgického výkonu obecně závisí na anatomické lokalizaci zdroje infekce, na stupni, rozsahu a trvání peritonitidy, na systémových projevech sepse a na celkovém stavu pacienta. U pacientů s nitrobřišními abscesy lze dosáhnout úspěšné eliminace zdroje infekce a redukce mikrobiálního inokula pomocí CT navigované (nebo UZ navigované) drenáže. V případě selhání tohoto nechirurgického způsobu léčby nebo v situacích, kdy není RTG navigovaná drenáž aktuálně dostupná, je indikována operace. Obecné mechanismy chirurgického ošetření zahrnují odstranění postiženého orgánu (akutní appendicitida, akutní cholecystitida), suturu nebo resekci postiženého orgánu (perforace gastroduodenálního vředu, akutní divertikulitida), debridement nekrotické tkáně (akutní pankreatitida). Významnou součástí chirurgického ošetření je i toaleta dutiny břišní s redukcí již přítomné mikrobiální kontaminace peritoneální dutiny a se snahou zabránit pokračování této kontaminace. Signifikantní redukci mikrobiálního inokula v dutině břišní můžeme dosáhnout opakovanými výplachy peritoneální dutiny. K výplachům nejsou standardně doporučovány roztoky obsahující ATB a cytotoxicky působící látky. Peroperačně zavedená drenáž dutiny břišní má za cíl eliminovat reziduální mikrobiální kontaminaci peritoneální dutiny nebo v případě, že nelze odstranit zdroj infekce v dutině břišní a hrozí pokračující kontaminace, umožnit derivaci patologického obsahu a zabránit tím rozvoji difuzní peritonitidy. Rozsah toalety a drenáže dutiny břišní závisí na rozsahu peritonitidy. Součástí operačního výkonu je i obnovení funkčních a anatomických poměrů v dutině břišní. Věčné dilema je pak rozhodnutí, zda ihned obnovit kontinuitu GIT a provést primární anastomózu, nebo provést pouze většinou dočasnou stomii. Volba rekonstrukčního výkonu s primární anastomózou by měla být obecně rezervována pouze pro pacienty v celkově dobrém stavu a limitovaným nitrobřišním postižením.
Při primární operační revizi nelze vždy zajistit dostatečnou a definitivní eliminaci zdroje infekce (zejména u pacientů s pokročilou nitrobřišní sepsí). Takoví pacienti pak vyžadují opakované operační revize. Na základě peroperačního nálezu a předpokládaného vývoje onemocnění indikuje chirurg provedení laparostomie (open abdomen) nebo k dalšímu chirurgickému ošetření zvolí některý z režimů relaparotomií (on demand relaparotomie nebo plánovaná relaparotomie).
Konkrétní doporučení chirurgického ošetření sekundárních peritonitid dle anatomického origa, stejně jako problematika laparostomií a relaparotomií, bude probrána v následujících kapitolách.
6.1. Perforace v oblasti gastroduodena
- Chirurgická léčba je metodou volby u pacientů s perforací gastroduodena (doporučení 1A).
- Primární sutura je indikována u malých perforací (1A).
- Laparoskopický výkon je bezpečnou a účinnou metodou ošetření GD perforace, pokud je prováděna zkušeným laparoskopistou (1A).
- Konzervativní postup je oprávněn pouze u selektovaných pacientů.
Konzervativní postup
Konzervativní postup je oprávněn pouze u selektovaných pacientů, kteří splňují následující kritéria (věk pod 70 let, bez známek septického šoku, bez známek difuzního peritoneálního dráždění, bez známek úniku vodné kontrastní látky při rtg vyšetření). Pokud nedojde ke zlepšení klinického stavu do 24 hod., je indikován chirurgický výkon (1A).
Konzervativní postup je založen na intenzivní symptomatické terapii včetně zavedení nazogastrické sondy, podávání antibiotik a antisekreční terapii. Věk nad 70 let, signifikantní komorbidity, anamnéza delší než 24 hod. a systémové známky sepse jsou spojeny se signifikantně vyšší mortalitou při konzervativním postupu ve srovnání s operačním výkonem.
Oddálení chirurgického výkonu o 12 hod. od začátku klinických příznaků zhoršuje prognózu nemocných.
Chirurgický výkon
Při perforaci menší než 2 cm v průměru je základním výkonem sutura s nebo bez omentoplastiky (1A). U větších defektů je vhodnější resekční výkon (1B).
Laparoskopický výkon je bezpečnou a účinnou metodou ošetření GD perforace, pokud je prováděna zkušeným laparoskopistou (1A).
Při perforaci žaludku je doporučena biopsie okraje perforace (2C).
Pro nemocné s perforací v nádoru a příznivém klinickém stavu je metodou volby onkologická resekce žaludku s lymfadenektomií. Pro nemocné s lokálně kurativním nádorem a špatným akutním stavem je metodou volby dvojdobá operace (první doba sutura, omentoplastika, v druhé době výkon dle onkologických principů). Pro nemocné s inkurabilním tumorem a špatným celkovým stavem je metodou volby jednodobá prostá sutura perforace (2C).
Perforace po ERCP
Výskyt duodenálních perforací po diagnostickém nebo terapeutickém ERCP je popisován v rozmezí 0,3 % –1,0 %. Perforace je typicky v retroperitoneální části (periampulárně po sfinkterotomii) nebo intraperitoneálně. Trhliny stěny duodena při intraperitoneální perforaci jsou často velké a vyžadují urgentní chirurgický výkon.
K nezbytným vyšetřením patří kontrastní CT vyšetření. Přítomnost plynu v retroperitoneu lineárně nekoreluje se závažností klinického stavu a s naléhavostí chirurgického výkonu. Již při podezření na perforaci musí být zahájena razantní systémová léčba včetně intravenózní resuscitace oběhu a podávání širokospektrých antibiotik. Po stanovení definitivní diagnózy má být rozhodnuto buď o konzervativním, či operačním postupu. Konzervativní postup může být zvolen při celkově stabilním stavu, bez přítomnosti známek peritoneálního dráždění, bez známek septického stavu. Součástí konzervativního řešení jsou i endoskopické metody a endoklipování perforace.
V opačném případě je metodou volby chirurgický výkon. Současně platí, že časná indikace chirurgické revize usnadňuje definitivní řešení perforace a prognózu nemocného. Naopak opožděná indikace k operaci má za následek komplikovanější řešení perforace a má horší prognózu onemocnění.
6.2. Perforace tenkého střeva
- Chirurgická léčba je metodou volby u pacientů s perforací tenkého střeva. (1A)
- Primární sutura tenkého střeva je indikována u malých perforací. (2B)
- Laparoskopický přístup je doporučován pouze v centrech, kde jsou chirurgové s bohatými zkušenostmi s laparoskopickou operativou. (2C)
Prognóza pacienta závisí na rozsahu a pokročilosti onemocnění, které vedlo k perforaci tenkého střeva, a na včasnosti chirurgické léčby. Mortalita a morbidita pacientů s peritonitidou při perforaci tenkého střeva jsou určovány nejen operační technikou, ale zejména celkovým stavem pacienta, virulencí patogenního mikroorganismu, rozsahem a trváním patologického procesu postihujícího tenké střevo před operací.
Chirurgická léčba zahrnuje široké spektrum výkonů – primární sutura, klínovitá excize, resekce postiženého segmentu tenkého střeva s primární anastomózou nebo s provedením dvouhlavňové enterostomie, derivační axiální ileostomie.
Primární sutura tenkého střeva nebo klínovitá excize je doporučována v případech jednoduché perforace s vitálními okraji tenkého střeva a s minimální nebo malou kontaminací peritoneální dutiny střevním obsahem. Při pozdní diagnóze s pokročilými zánětlivými změnami a otokem stěny tenkého střeva je primární sutura zatížena vyšším rizikem leaku s následnou pooperační peritonitidou nebo píštělí. V těchto případech je doporučeno provést orálně od primární sutury protektivní jejuno/ileostomii k derivaci střevního obsahu.
Pacienti s nádorovým postižením tenkého střeva, s nekrózou stěny nebo perforací při vaskulární lézi a s mnohočetnými perforacemi tenkého střeva jsou indikováni k resekci postiženého segmentu tenkého střeva. Rozsah resekce by měl být takový, aby odstranil celou část postiženého střeva a přitom resekční okraje střeva byly vitální a dobře prokrvené. Provedení primární anastomózy po resekčním výkonu je determinováno charakterem i rozsahem postižení tenkého střeva a možností provést anastomózu ve zdravém úseku střevní stěny. Tuto možnost je potřeba vždy pečlivě a individuálně zvážit. Nebyl prokázán rozdíl ve výskytu pooperačních leaků mezi ručně šitou anastomózou a staplerovou anastomózou. Pokud peroperační nález neumožňuje provedení resekce ve zdravé tkáni nebo jsou resekční okraje hraničně vitální nebo nelze vyloučit další progresi patologického procesu (sekundární ischemické změny střevní stěny), je vhodnější kontinuitu GIT primárně neobnovovat a zvolit derivační stomii.
V pokročilých stavech, kdy nelze bezpečně ošetřit perforaci tenkého střeva nebo při komplikovaných píštělích, je jediným řešením orálně situovaná derivační axiální jejuno/ileostomie a drenáž dutiny břišní.
6.3. Akutní apendicitida
- Metodou volby u pacientů s akutní apendicitidou je apendektomie (1A).
- Apendektomii lze provést klasicky nebo laparoskopicky (1A).
- Předoperační antibiotická profylaxe je doporučovaná u všech pacientů s akutní apendicitidou.
U pacientů s nekomplikovanou apendicitidou (bez gangrény, perforace, periapendikulárniho abscesu/infiltrátu) je možná i samostatná antibiotická léčba. Z dlouhodobého hlediska je ale méně efektivní pro časté recidivy (2–5). Navíc je mnohdy obtížné předoperačně rozlišit, zda se jedná o komplikovanou nebo nekomplikovanou apendicitidu. Samostatná antibiotická léčba může být alternativní léčbou u pacientů s nekomplikovanou apendicitidou, kteří jsou kontraindikováni k chirurgickému výkonu.
Metodou volby u pacientů s akutní apendicitidou je apendektomie (1A).
Apendektomii lze provést klasicky nebo laparoskopicky (1A).
Výhody laparoskopického přístupu jsou: méně ranných infekcí, menší pooperační bolest, kratší doba hospitalizace. Nevýhody jsou častější nitrobřišní absces, delší operační čas, vyšší náklady na operaci. Diagnostická laparoskopie redukuje riziko nepotřebných apendektomií a umožňuje stanovit příčinu obtíží.
Předoperační antibiotická profylaxe je doporučovaná u všech pacientů s akutní apendicitidou.
Pooperační antibiotická intravenózní léčba je doporučena jen v případě komplikované apendicitidy. Délka trvání antibiotické pooperační léčby je u dospělého pacienta minimálně 3 dny. Léčbu lze přerušit při poklesu zánětlivých laboratorních parametrů a horečky.
Periapendikulární absces je potřebné drénovat perkutánně pod UZ nebo CT kontrolou (1B). Konzervativní léčba periapendikulárniho infiltrátu/abscesu (antibiotická léčba + drenáž pod UZ/CT kontrolou při abscesu) přináší lepší výsledky než operační léčba. V tradičním postupu po vstřebání infiltrátu následovala apendektomie s odstupem 2–3 měsíců. Po úspěšné konzervativní léčbě komplikované apendicitidy (periapendikulární absces/infiltrát) není ale apendektomie nezbytně nutná (2B). Apendektomie u takových pacientů není potřebná u 75–90 % případů. Naopak apendektomie je doporučena po konzervativní léčbě při opakování symptomů (doporučení 2B). Při neprovedení apendektomie a přetrvávání periapendikulárního infiltrátu je ale nutné dovyšetření (kolonoskopie, CT).
6.4.1. Akutní divertikulitida tračníku
- Pacienti s nekomplikovanou akutní divertikulitidou mají být léčeni konzervativně (2C).
- Součástí konzervativní léčby je podávání antibiotik.
- Konzervativní postup s perkutánní drenáží perikolického abscesu je upřednostněn u selektované skupiny pacientů (2B).
- Závažnost akutní divertikulitidy má být stanovena na základě celkového klinického stavu a Hincheyeho klasifikace.
- Chirurgický výkon je indikován u nemocných se známkami difuzní peritonitidy a u nemocných se selháním primární konzervativní léčby (1B).
Konzervativní léčba
Nemocní s nekomplikovanou akutní divertikulitidou mají být léčeni konzervativně za podmínky intenzivní monitorace celkového stavu. Nemocní v dobrém celkovém stavu, malým perikolickým abscesem a bez známek difuzního peritoneálního dráždění (Hinchey 1) mohou být léčeni konzervativně. U pacientů s průměrem abscesového ložiska více než 4 cm má být toto ložisko perkutánně drénováno (doporučení 2B). Součástí konzervativní léčby je podávání antibiotik (Tab. 11), spasmoanalgetik (Procain 0,2 % + Algifen amp.), antipyretik, parenterální výživy do zklidnění. Není jednoznačný důkaz prospěchu podávání antibiotik u nekomplikované akutní divertikulitidy. Není důkaz zabránění komplikacím akutní nekomplikované divertikulitidy při podávání antibiotik. Přesto podání antibiotik (s gramnegativním a anaerobním spektrem) i u nekomplikované divertikulitidy doporučujeme, optimálně ve zkráceném režimu.
Tab. 11. Antibiotická léčba akutní divertikulitidy Tab. 11: Antibiotic treatment of acute diverticulitis 
Chirurgická léčba
Optimální technika je resekce střeva s anastomózou v jedné době. Přesto u nemocných s těžkou akutní divertikulitidou s generalizovanou hnisavou nebo sterkorální peritonitidou preferujeme resekci dle Hartmanna (s uzavřením distálního pahýlu a terminální kolostomií). U ostatních (příznivý celkový stav, Hinchey I-II) je vhodná resekce střeva s primární anastomózou s/anebo bez protektivní ileostomie. Samozřejmou součástí operačního výkonu je laváž dutiny břišní a čtyřkvadrantová drenáž.
Samotná laparoskopická laváž dutiny břišní s drenáží pro perforovanou divertikulitidu je ve světové literatuře doporučována u selektovaných skupin nemocných (2B). Tato technika je ve většině porovnávána s konzervativním postupem. Na českých pracovištích nejsou zkušenosti s tímto ošetřením dostatečné.
Laparoskopická resekce v akutním stadiu je možnou alternativou laparotomického přístupu u zkušených laparoskopistů.
Léčba komplikací
Perikolický absces – léčba spočívá v punkci a drenáži abscesu pod CT nebo UZ kontrolou. Doplňujeme ATB (primárně empiricky, posléze dle mikrobiologického vyšetření). Pokud nelze punkci a drenáž provést, pacienta indikujeme k operaci. Léčba spočívá v evakuaci abscesu, zadrénování a dle nálezu resekci postiženého úseku tračníku (nejčastěji dle Hartmanna). Při rozsáhlém zánětlivém infiltrátu, do kterého je zavzat zejména levý ureter, resekční výkon primárně neprovádíme, ale lokalitu ošetříme zadrénováním a provedeme derivační stomii (transverzostomii). Resekci postiženého úseku tračníku doplníme po zhojení zánětu.
Kolovezikální píštěle – vyžadují radikální chirurgické řešení, které bývá náročné. Léčba spočívá ve vyhledání a zrušení píštěle a resekci postiženého úseku tračníku. Typ operace volíme dle operačního nálezu (Hartmannova operace, resekce s primární anastomózou). Kolovezikální píštěl je řídkou komplikací.
Mechanický ileus – je způsobený zúžením sigmatu v důsledku zánětlivých změn. Léčba spočívá v resekci postiženého úseku tračníku.
6.4.2. Perforace tlustého střeva v terénu malignity
- Perforace tlustého střeva v nádoru zhoršuje prognózu krátkodobého i dlouhodobého přežití onkologického pacienta.
- Chirurgický výkon je základní léčebnou modalitou (1B).
Perforace tlustého střeva patří k závažné komplikaci malignity kolon zhoršující prognózu krátkodobého i dlouhodobého přežití. Krátkodobé přežití ovlivňují důsledky perforace tlustého střeva a rozvoj septického stavu. Z dlouhodobého hlediska dochází k perforaci kolorektální malignity v terénu lokálně pokročilého tumoru s dalším rizikem peritoneální diseminace nádorových buněk. Stadium onemocnění, vzdálenost perforace od tumoru, počet pozitivních lymfatických uzlin korelují s dobou přežití.
Proto je léčba perforace tlustého střeva v terénu malignity závažná. V současnosti převládá doporučení indikace k chirurgickému výkonu. U nemocných s difuzní peritonitidou, známkami sepse je preferována resekce dle Hartmanna, dle lokálního nálezu se snahou o RO resekci. V případě lokalizované peritonitidy, dobrého celkového stavu je možná i resekce s anastomózou v jedné době. Dle zvážení operatéra je při anastomóze vhodné provedení dekompresní ileostomie.
6.4.3. Perforace tlustého střeva při kolonoskopii
- Zkrácení intervalu mezi perforací a chirurgickým ošetřením zlepšuje výsledky léčby.
- Chirurgický výkon je základní léčebnou modalitou.
- Konzervativní léčba je možná u selektované skupiny pacientů.
Okamžité rozpoznání iatrogenní perforace při výkonu následované adekvátní terapií má nejlepší výsledky. Opakovaně publikované studie prokázaly, že zkrácení intervalu mezi perforací a chirurgickým ošetřením zlepšilo výsledky. Výsledky EBM doporučují chirurgickou revizi s primární suturou perforace, nebo resekcí postiženého úseku (1B).
Konzervativní léčba zahrnující endoskopické ošetření perforace, sledování na JIP, antibiotika, je možná, pokud je pacient stabilní, bez známek difuzní peritonitidy, za podmínky důsledné monitorace vývoje stavu. Technický rozvoj endoskopické techniky umožňuje endoskopické ošetření perforace jako součást konzervativního postupu. Pro tento postup při perforaci v současnosti není dostatek podkladů pro jednoznačné doporučení.
Laparoskopická technika ošetření perforace je bezpečná a účinná, pokud ji provádí zkušený laparoskopista (1C).
6.4.4. Potraumatická perforace tlustého střeva
- Rychlá diagnostika a chirurgické ošetření v co nejkratší době zlepšuje prognózu nemocných po traumatickém poranění trávicí trubice (1C).
- Interval mezi poraněním a chirurgickým ošetřením je signifikantním faktorem morbidity a mortality.
Trauma tlustého střeva můžeme rozdělit na tupá a perforační. Nejčastějším mechanismem tupého poranění je poranění decelerační způsobené při autonehodě mezi automobilovým pásem na jedné straně a páteří nebo okrajem pánve na straně druhé. Výsledkem může být lokální hematom stěny střeva nebo mezenteria, částečná nebo úplná lacerace stěny střeva, lokalizovaná devaskularizace stěny střeva a zhmoždění stěny střeva. Devitalizace stěny střeva může vést k pozdní perforaci.
Hlavní rizikové faktory predikující mortalitu jsou: vyšší věk, vyšší skóre „Abdominal Abbreviated Injury Scores“, závažná extraabdominální poranění, interval mezi traumatem a chirurgickým ošetřením delší než 5 hodin. Anatomická lokalizace penetrujícího poranění na tlustém střevě není nepříznivým faktorem morbidity a mortality.
Konzervativní postup je možný u neperforačních traumat bez známek peritoneálního dráždění při dobrém celkovém stavu pacienta a intenzivní kontrole vývoje klinického stavu.
Rychlost chirurgického výkonu patří k základním prognostickým faktorům morbidity a mortality. Při taktice chirurgického ošetření zvažujeme celkový stav poraněného, rozsah sterkorální peritonitidy, rozsah poranění střeva a riziko postižení cévního zásobení střeva. Následné ošetření je v rozsahu od excize okrajů perforačního otvoru s následnou suturou po resekci postiženého úseku s primární nebo sekundární anastomózou až v situaci nejtěžších devastačních poraněních ošetřených ve smyslu „damage control surgery“. Provedení derivační stomie není mandatorní. Operační pole vždy drénujeme.
7. Akutní cholecystitida
- Laparoskopická cholecystektomie je bezpečnou a efektivní metodou léčby (1A).
- Časná cholecystektomie provedená do 3 dnů (lépe akutně do 24 hodin) má nejmenší podíl konverzí a nejkratší hospitalizační dobu (1A).
- Cholecystostomie není alternativou cholecystektomie. Z akutní cholecystostomie mohou profitovat pacienti staří, kriticky nemocní a někteří další pacienti vysoce rizikoví k chirurgické cholecystektomii.
- Včasná diagnóza a okamžitá chirurgická léčba perforace žlučníku má zásadní význam pro snížení mortality a morbidity (1C).
Léčba peritonitidy způsobené akutní cholecystitidou zahrnuje v podstatě tři možnosti – cholecystektomii, cholecystostomii a léčbu antibiotickou. Tyto metody nejsou alternativami. Volba metody vyplývá ze zhodnocení celkového stavu pacienta daného tíží onemocnění žlučníku a peritonitidy a podle rizik vyplývajících z interních komorbidit. Metodou volby je cholecystektomie. U pacientů, u nichž riziko cholecystektomie převyšuje benefit, je metodou volby cholecystostomie. Pouze u pacientů, kteří nejsou v přímém ohrožení života v důsledku cholecystitidy anebo peritonitidy, ale ocitli by se v ohrožení života v důsledku operační revize, je možné volit konzervativní postup s léčbou antibiotiky.
Laparoskopická cholecystektomie je bezpečnou a efektivní metodou léčby (1A). Časná cholecystektomie provedená do 3 dní (lépe akutně do 24 hodin) má nejmenší podíl konverzí a nejkratší hospitalizační dobu. Cholecystektomie odložená o více než týden je nejvýznamnějším rizikovým faktorem pro konverzi. Rozdíl v poranění žlučovodu nebyl pozorován (1A).
Adjuvantní ATB terapie: Je jednoznačně indikovaná v případech prováděné cholecystostomie nebo perforace žlučníku. Není nutná u nekomplikované katarální cholecystitidy (bez purulentní peritonitidy, empyému nebo gangrény žlučníku), pokud je dobrý celkový klinický stav pacienta. U nekomplikované peritonitidy je obsah žlučníku většinou sterilní, proto je výhodnější odběr části stěny žlučníku na kultivační vyšetření.
Cholecystostomie: Nejsou data upřednostňující perkutánní punkční cholecystostomii před chirurgickou cholecystostomií. Primární úspěšnost perkutánní cholecystostomie se pohybuje kolem 85 %. Nejde o alternativu cholecystektomie. Z akutní cholecystostomie mohou profitovat pacienti staří, kriticky nemocní a někteří další pacienti vysoce rizikoví k chirurgické cholecystektomii. Cholecystostomie by měla být vždy, pokud to bude možné, následována laparoskopickou cholecystektomií (2C).
Perforace žlučníku: Včasná diagnóza a okamžitá chirurgická léčba perforace žlučníku má zásadní význam pro snížení mortality a morbidity (1C). Diagnóza perforace je zřídka stanovena již předoperačně. Oddálení chirurgické revize vede k významnému prodloužení hospitalizace a nárůstu mortality a morbidity.
7.1. Ascendentní cholangoitida
- Jde o život ohrožující onemocnění s rizikem úmrtí na sepsi.
- Základní léčebnou modalitou je antibiotická léčba a urgentní dekomprese a drenáž žlučových cest (1A).
- Preferenčně má být drenáž žlučových cest zajištěna cestou ERCP nebo PTD.
Jde o život ohrožující onemocnění s rizikem úmrtí na sepsi do několika hodin. Nutnou podmínkou úspěšné léčby je urgentní léčba zahrnující vhodnou antibiotickou léčbu (Tab. 8) a urgentní dekompresi a drenáž žlučových cest (1A). Urgentní drenáž žlučových cest není obvykle nutná, pokud nemá pacient žádný z následujících příznaků: známky hrozící sepse (febrilie, tachykardie nad 100/minutu při adekvátní hydrataci), koagulopatie (protrombinový čas nad 14 sekund), hladina albuminu pod 30 g/l, hladina bilirubinu do 50 μmol/l.
Existují 3 možnosti drenáže žlučových cest – endoskopická (ERCP), perkutánní (PTD) a chirurgická. Nechirurgické metody drenáže žlučových cest představují metodu volby. Nejsou data, která by upřednostňovala kteroukoliv z obou nechirurgických metod (2C). Chirurgická drenáž by tak měla být provedena jen tehdy, pokud je ERCP nebo PTD nedostupné nebo kontraindikované (2C).
8. Strategie relaparotomie
- Relaparotomie patří k technikám léčby přetrvávající nitrobřišní infekce.
- Laparostoma „open abdomen“ je metodou volby u závažných nitrobřišních stavů.
Pooperační léčebná strategie relaparotomie u sekundární peritonitidy je léčebnou technikou u nemocných s pokročilou peritonitidou s příznaky sepse. Rozhodnutí o indikaci a načasování relaparotomie je dáno zkušeností operatéra a faktory progrese nebo perzistence infekce. Dosud není konsenzus mezi chirurgy, která kritéria jsou důležitá pro rozhodnutí k provedení relaparotomie. Obecně jsou jako důležitá uváděna: 1. Difuzní kontaminace peritoneální dutiny, 2. Lokalizace zdroje infekce (tlusté střevo), 3. Leukocytóza nebo leukopenie. Metodicky jsou k pooperační revizi pro nitrobřišní sepsi uváděny 3 postupy: 1. Otevřená břišní dutina („open abdomen“), 2. Plánovaná relaparotomie, 3. On-demand relaparotomie. V současnosti není jednoznačný výsledek EBM pro preferenci jedné plánované, nebo on-demand laparotomie, upřednostňována je on-demand laparotomie.
Indikací k primárnímu založení laparostomatu (open abdomen) patří: a) závažná nitrobřišní sepse – abdominální katastrofa, b) nitrobřišní hypertenze – abdominální kompartment syndrom. Mezi jeho přednosti patří snadné provedení explorace, kontrola nitrobřišního obsahu, snížení rizika vzniku nitrobřišní hypertenze a abdominálního kompartment syndromu a ochrana fascie k následnému uzávěru břišní stěny. Nicméně prolongovaná expozice nitrobřišních orgánů může vést k dodatečným komplikacím včetně infekce, sepse a vzniku píštělí (Doporučení 1 C). Následný definitivní uzávěr laparotomie lze provést až po stabilizaci nemocného. Primární uzávěr fascie je možný za předpokladu minimálního rizika excesivního napětí nebo recidivy intraabdominálního kompartment syndromu (1 C). U nemocných s perzistujícím velkým fasciálním defektem je navržena implementace biologického materiálu (1 C). U řady nemocných je možný jen částečný uzávěr dutiny břišní, který vede ke vzniku velkých ventrálních kýl vyžadujících komplexní rekonstrukci. U těchto výkonů je doporučeno použití biologických sítěk.
Plánovaná relaparotomie (při primární operaci stanovujeme indikaci zejména v následujících případech: selhání v eradikaci zdroje infekce (reziduální infekce), difuzní pokročilá sterkorální peritonitida, hemodynamická nestabilita, nitrobřišní hypertenze, damage control laparotomie. Indikaci k relaparotomii on demand je zejména přetrvávání nitrobřišní infekce, které je řešitelné chirurgickým výkonem. K indikaci využíváme v dané situaci nejvhodnější kombinaci vyšetřovacích postupů: a) klinického vyšetření, b) laboratorních vyšetření (leukocyty, CRP, prokalcitonin), c) zobrazovacích vyšetření (US, CT).
9. Pooperační nitrobřišní infekce
- Pooperační infekční komplikace v dutině břišní představují život ohrožující stavy s vysokou morbiditou i mortalitou.
- Základem úspěšné léčby je komplexní přístup zahrnující včasnou diagnostiku, iniciální hemodynamickou resuscitaci, účinnou antimikrobiální terapii, adekvátní chirurgickou či punkční intervenci.
Včasnou diagnostiku abdominální komplikace ztěžuje přítomnost probíhající pooperační zánětové reakce, bolest operační rány a často nespecifické příznaky, z nichž prvním bývá neurčitá změna klinického stavu a pokles kapilární saturace kyslíkem měřené pulzním oximetrem. Počáteční diferenciálně diagnostická úvaha probíhá často mezi levostrannou kardiální dekompenzací, počínající pneumonií, katétrovou sepsí, urosepsí a počínající sepsí abdominální etiologie. Přetrvávající či nově vzniklá střevní paralýza je významnou indicií nitrobřišní komplikace.
Formy pooperační nitrobřišní infekce jsou absces, ohraničená a difuzní peritonitida. Hlavní příčiny pooperační břišní infekce jsou dehiscence v anastomóze na zažívacím traktu, ischemie střevní, peroperační poranění střeva, vývoj mezikličkového abscesu z kontaminace dutiny břišní peroperačně nebo nedostatečnou chirurgickou sanací peritonitidy při předchozí operaci.
Prvním krokem komplexní léčby sepse vyvolané pooperační nitrobřišní infekcí je hemodynamická optimalizace a podání antibiotik. Volba antibiotik je empirická a zohledňuje předpokládanou etiologii infekce, předchozí antibiotickou terapii a riziko ESBL pozitivních kmenů. Přehled vhodných antibiotik je uveden samostatně. Pokles diurézy a klinické známky poruchy periferního prokrvení (kožní livedo reticularis, chladná akra, pomalý kapilární návrat) jsou důvodem pro rychlé podání bolusu jednoho litru krystaloidů a další pokračování infuzní terapie podle klinické odezvy (potřebné objemy infuzní terapie k dosažení a udržení optimálního hemodynamického profilu mohou přesahovat deset litrů za 24 hodin). U kardiálně rizikových pacientů je vhodné včasné zavedení hemodynamického monitorování.
Rozsah diagnostického procesu závisí na míře nejasnosti stavu. V některých případech postačuje vyhraněný klinický nález většinou podpořený dynamikou laboratorního zánětlivého obrazu. UZ vyšetření je citlivou metodou pro diagnostiku volné tekutiny v dutině břišní a zvyšuje bezpečnost cílené diagnostické punkce nitrobřišní tekutiny, slouží i k posouzení dilatace, pohybu střevních kliček a tloušťky stěny střeva. UZ dokáže odhalit přítomnost plynu v portální žíle a v játrech. Nejvíce informací skýtá CT vyšetření břicha s intravenózním podáním kontrastu zastihující arteriální i venózní fázi vyšetření. Velké pneumoperitoneum třetí pooperační den svědčí spíše pro komplikaci než pro přetrvávající pooperační vzduch v dutině břišní. CT odhalí mezikličkový absces, posoudí prokrvení břišních orgánů a stěny střeva. Skiaskopické vyšetření s aplikací kontrastu do trávicí trubice či fistulografie slouží k diagnostice perforací střeva či dehiscencí anastomóz. Při neúspěchu zobrazovacích metod má své místo i diagnostická operační revize.
Intervence k eliminaci zdroje infekce
Léčba pooperační abdominální infekce je závislá na konkrétní příčině a klinických projevech.
Pro ohraničené abscesy je důležité zavedení drenáže. Většina perkutánních drenáží se dnes provádí pod CT kontrolou. Důležité faktory, které je třeba zvažovat při posuzování účinnosti drenáže, jsou dostatečná velikost drénu, zda je potřeba zavést drenáž podtlakovou či srkací, zda vlastnosti drénu vyhovují dané lokalizaci (např. riziko proležení drénu do střeva či poranění sleziny tuhým pig-taillem při drenáži perisplenického či subkapsulárního abscesu sleziny).
Operační revize
Rozhodnutí k chirurgické revizi je vždy individuální a obecné zásady v řešení konkrétní situace jen pomáhají. Uplatňují se i výše uvedené techniky laparostomatu a relaparotomie. Obecně platí, že částečná dehiscence anastomózy, která nevyvolává peritonitidu či systémovou reakci, nemusí být akutně operována. Enterokolitida a akutní pankreatitida jsou stavy, kde preferujeme konzervativní postup s event. perkutánní drenáží ascitu i při klinických známkách akutní peritonitidy. Reresekční výkony a prosté sutury perforací v terénu rozvinuté peritonitidy mají minimální šanci na zhojení a tyto pokusy jsou zatíženy vysokým rizikem vzniku abdominální katastrofy. Pouhé vyvedení stomie či izolované provedení dobré drenáže bez sanace střevního defektu zvyšuje šanci pacienta na přežití komplikace. Operace v terénu infikované dutiny břišní má vysoké riziko vzniku pooperační nekrotizující fasciitidy, proto je vždy zvažováno odložení kožní sutury laparotomie.
Podpůrná terapie
Zajištění plné nutriční podpory se po opakovaném inzultu stává bezpodmínečnou nutností. Kombinace dlouhodobé nutriční péče a pohybové rehabilitace je základním postupem, který snižuje důsledky akutního proteinového katabolismu a v dlouhodobém horizontu umožňuje zvětšení objemu proteinové hmoty organismu. Podtlaková terapie na dočasně všité silikonové síťce a po naložení dynamické sutury v laparostomatu umožňuje pacientovi s „otevřeným břichem“ mobilizaci z lůžka a plnou rehabilitační zátěž. Laparostoma samo o sobě není důvodem pro prodlužování arteficiální ventilace.
Ošetřování akutně neoperabilních ran se střevními defekty
Není-li střevní píštěl dobře ohraničena a trvale kontaminuje operační ránu, pak udržuje zánětlivou reakci, stimuluje proteinový katabolismus a způsobuje lokální devastaci tkání. Intenzivní ošetřování rány, časté převazy, srkavá drenáž a laváže kontaminovaných prostorů jsou předpokladem záchrany pacienta. Chybou je snaha ránu zakrývat, navazovat a převazovat pouze jedenkrát denně. Počáteční frekvence převazů bývá i jedenkrát za hodinu.
Prof. MUDr. Robert Gürlich, CSc.
přednosta Chirurgické kliniky FNKV
Šrobárova 50
100 34 Praha 10
e-mail: robert.gurlich@fnkv.cz
Zdroje
1. Sartelli M, Catena F, Ansaloni L, et al. Complicated intra-abdominal infections in Europe: preliminary data from the first three months of the CIAO Study. World J Emerg Surg 2012;7 : 15–23.
2. Sartelli M, Viale P, Catena F, at al. 2013 WSES guidelines for management of intra-abdominal infections. World J Emerg Surg 2013;3 : 1–29.
3. Bader FG, Schroeder M, Kujath P, et al. Diffuse postoperative peritonitis – value of diagnostic parameters and impact of early indications for relaparotomy. Eur J Med Res 2009;14 : 491–496.
4. Hynninen M, Wennervirta J, Leppäniemi A, Pettilä V. Organ dysfunction and long term outcome in secondary peritonitis. Langenbecks Arch Surg 2008;393 : 81–86.
5. Marshall JC, Al Naqbi A. Principles of source control in the management of sepsis. Crit Care Nurs Clin North Am 2011;23 : 99–114.
6. De Waele JJ. Early source control in sepsis. Langenbecks Arch Surg 2010;395 : 489–94.
7. Lopez N, Kobayashi L, Coimbra R. A Comprehensive review of abdominal infections. World J Emerg Surg 2011;6 : 7.
8. Golfieri R, Cappelli A. Computed tomography-guided percutaneous abscess drainage in coloproctology: review of the literature. Tech Coloproctol 2007;11 : 197–208.
9. van Ruler O, Mahler CW, Boer KR, at al. Comparison of on-demand vs planned relaparotomy strategy in patients with severe peritonitis: a randomized trial. JAMA 2007;298 : 865–72.
10. Blot S, De Waele JJ, Vogelaers D. Drugs 2012;72:e17–32.
11. OrdoĖez CA, Puyana JC. Surg Clin North Am 2006;86 : 1323–49.
12. Eckmann C, Dryden M, Montravers P, Kozlov R, Sganga G. Eur J Med Res 2011;16 : 115–26.
13. Serclová Z, Ryska O, Dytrych P, Marvan J, Marx K, et al. Fascial closure of the abdominal wall by dynamic suture after topical negative pressure laparostomy treatment of severe peritonitis – results of a prospective randomized study. Rozhl Chir 2012;91 : 26–31.
14. Solomkin JS, Mazuski JE, Bradley JS, Rodvold KA, Goldstein EJ, et al. Clin Infect Dis 2010;50 : 133–64.
15. Vyhnánek F, Adámková V, Ducháč V, Teplan V Jr, Jirásek T. Antibiotická léčba nozokomiálních nitrobřišních infekcí. Rozhl Chir 2009;88 : 503–7.
16. Weledji EP, Ngowe MN. The challenge of intra-abdominal sepsis. Int J Surg 2013;11 : 290–5.
Štítky
Chirurgia všeobecná Ortopédia Urgentná medicína
Článok vyšiel v časopiseRozhledy v chirurgii
Najčítanejšie tento týždeň
2014 Číslo 6- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Kombinace metamizol/paracetamol v léčbě pooperační bolesti u zákroků v rámci jednodenní chirurgie
- Antidepresivní efekt kombinovaného analgetika tramadolu s paracetamolem
-
Všetky články tohto čísla
- Vědecko-výzkumná činnost v české chirurgii
- Nová strategie chirurgické léčby mnohočetného nádorového postižení jater – ALPPS
- Studie morfologie r. descendens a. circumflexae femoris lateralis jako možné cévní náhrady pro rekonstrukci koronárního řečiště pomocí angio CT vyšetření
- Karcinom tlustého střeva – zhodnocení komplikací a rizik plánovaných resekčních výkonů
- Srovnání chirurgického bypassu a subintimální rekanalizace v léčbě kritické končetinové ischemie
- Primární volvulus tenkého střeva u mladého nemocného
- Kombinovaný chirurgický management infekce hemodialyzačního cévního přístupu bakteriologickým agens Clostridium perfringens
- Klostridiová myonekróza břišní stěny – kazuistika
- Zemřel profesor Zdeněk Matějovský
- Základní principy diagnostiky a léčby sekundární peritonitidy – doporučení odborníků s podporou SIS
- Rozhledy v chirurgii
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Základní principy diagnostiky a léčby sekundární peritonitidy – doporučení odborníků s podporou SIS
- Primární volvulus tenkého střeva u mladého nemocného
- Klostridiová myonekróza břišní stěny – kazuistika
- Nová strategie chirurgické léčby mnohočetného nádorového postižení jater – ALPPS
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



