-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Multioborová spolupráce při ošetření závažného krvácení komplikující průběh nekrotizující pankreatitidy – kazuistika
Multidisciplinary Cooperation in the Management of Serious Bleedings Complicating Necrotizing Pancreatitis – A Case Review
Acute necrotising pancreatitis is connected with a high complication rate. The most serious ones are hemorrhagic complications with bleeding from vascular structures erosions. Authors report a case of endovascular treatment of surgically untreatable lesion of portal vein. In this case stentgraft was successfully implanted to cover the erosion and stop the bleeding. Percutaneous transhepatic route was used.
Key words:
acute necrotising pancreatitis – bleeding – endovascular treatment – stentgraft
Autoři: J. Lacman; I. Buřič; F. Charvát; J. Mašková; Z. Fuksa *; J. Pudil **; F. Bělina **
Působiště autorů: Radiodiagnostické oddělení ÚVN Praha ; Oddělení intenzivní péče chirurgických oborů ÚVN Praha *; Chirurgická klinika 2. LF UK a ÚVN, Praha **
Vyšlo v časopise: Rozhl. Chir., 2008, roč. 87, č. 10, s. 507-511.
Kategorie: Monotematický speciál - Původní práce
Souhrn
Akutní nekrotizující pankreatitida je stále zatížena vysokou letalitou a vysokým procentem komplikací. Mezi nejzávažnější z nich patří masivní krvácení do dutiny břišní. Autoři prezentují případ endovaskulárního řešení chirurgicky neošetřitelného defektu portálního řečiště implantací stentgraftu perkutánně, transhepatální cestou.
Klíčová slova:
akutní nekrotizující pankreatitida – krvácení – endovaskulární léčba – stentgraftÚVOD
Akutní pankreatitida (AP) je závažným onemocnění slinivky břišní. Je definována jako akutní zánětlivé onemocnění pankreatu s postižením okolních tkání a vzdálených orgánů, s rozvojem multiorgánového selhání a lokálních komplikací.
Na základě klinických, morfologických a prognostických kritérií jsou rozlišovány dvě základní formy AP. Lehká forma – edematózní akutní pankreatitida – má tendenci ke spontánnímu ústupu a zhojení bez závažných sekundárních komplikací. Postihuje asi 75 % nemocných s AP a je zpravidla léčena konzervativně. Těžká forma – nekrotizující pankreatitida – je charakterizována vznikem nekróz pankreatické a peripankreatické tkáně s vývojem reaktivních akutních exsudátů, pseudocyst, pankreatického abscesu či pleurálního výpotku.
Klinický průběh nekrotizující pankreatitidy je často provázen rozvojem řady komplikací. Přidružená infekce pankreatických nekróz výrazně zvyšuje morbiditu a letalitu onemocnění až na 70–80 %. Mezi další závažné život ohrožující komplikace těžké AP je tzv. abdominální kompartment syndrom s narůstajícím nitrobřišním tlakem, obstrukce, perforace a ischemie stěny trávicí trubice. Jinou možnou komplikací může být trombóza větví portálního řečiště.
Obávanou komplikací těžké AP je akutní krvácení do volné břišní dutiny, retroperitonea, do pseudocysty nebo krvácení do trávicí trubice. Krvácení z erozí kapilár a drobných žil v okolí slinivky je v průběhu nekrotizující pankreatitidy pozorováno relativně často a zpravidla je zvládnuto konzervativní terapií. Arozí větší cévy může dojít k masivnímu krvácení, které si vynutí akutní intervenci. Při arozi a narušení stěny tepny může dojít ke vzniku a rozvoji pseudovýdutě a riziku tepenného krvácení v pozdější době. Nejčastěji je pseudo - aneuryzma lokalizováno na lienální, gastroduodenální nebo horní mezenterické arterii.
Raritní příčinou je masivní krvácení z léze hlavních větví portálního řečiště.
V kazuistickém sdělení autoři prezentují případ masivního krvácení z oblasti konfluens horní mezenterické a lienální žíly u nemocného s nekrotizující pankreatitidou a úspěšné ošetření této komplikace endovaskulárním přístupem.
KAZUISTIKA
Pacient, 35 let, byl v září 2007 přijat do spádového zdravotnického zařízení s klinickými i laboratorními známkami akutní pankreatitidy. Jednalo se o obézního (BMI 34) kuřáka bez závažné komorbidity, s abúzem alkoholu v anamnéze. Z laboratorních vyšetření při přijetí byla přítomna leukocytóza a hyperamylázemie (leu – 18,4 x 109/l, sAMS – 61,5 μkat/l). Podle skórovacího systému APACHE II se jednalo o pacienta řazeného do skupiny s predikovanou mortalitou do 10 %. Vývoj AP od počátku směřoval k nekrotizující formě onemocnění. Přes intenzivní léčbu progredovala respirační insuficience s nutností intubace a pacient byl přeložen na anesteziologicko – resuscitační oddělení. Jedenáctý den hospitalizace byl nemocný indikován k chirurgické revizi. V dalším průběhu hospitalizace byl opakovaně operován (celkem 8x) s prováděním nekrektomií a laváží břišní dutiny. Při sedmé revizi bylo chirurgem zjištěno masivní žilní krvácení ze subhepatální oblasti. Pro nemožnost exaktního chirurgického ošetření bylo krvácení dočasně zastaveno tamponádou břišní dutiny rouškami. Jako příčina krvácení bylo vysloveno podezření na defekt ve stěně portální žíly. Při osmé operační revizi následující den se rovněž nezdařilo zdroj krvácení ošetřit a byla provedena opět břišní tamponáda rouškami. Vzhledem k charakteru krvácení a nemožnosti jeho chirurgického ošetření byl nemocný konzultován s rentgenologickým pracovištěm krajské nemocnice. Intervenční radiologický výkon nebyl rentgenologem indikován s odůvodněním, že se jedná o primárně infikovaný terén, nevhodný pro endovaskulární přístup.
Po dohodě s pracovištěm se zkušenostmi v cévní chirurgii byl nemocný přeložen 38. den hospitalizace na ARO pražské nemocnice Na Homolce. Zde byla provedena multidetektorová CT angiografie břišní aorty a viscerálních tepen včetně multidetektorové CT portografie, která popsala jako velmi pravděpodobnou příčinu krvácení defekt v soutoku horní mezenterické a lienální žíly. Následující den byl nemocný po dohodě přeložen k další léčbě do Ústřední vojenské nemocnice v Praze. V den přijetí byl nemocný po přípravě a stabilizaci stavu operován. Při chirurgické revizi (v pořadí deváté) jsme postupně odstranili tamponádu břišními rouškami. V supramezokolické části břišní dutiny byla rozsáhlá dutina (velikosti 20 x 30 x 20 cm) ohraničená spodinou jater a zánětlivě infiltrovanými okolními tkáněmi. Spodinu kavity tvořila granulační tkáň s patrným masivně žilně krvácejícím defektem velikosti 1 x 1,5 cm. Při revizi jsme potvrdili defekt přední stěny v oblasti konfluens horní mezenterické a lienální žíly. Krvácení z lienální žíly jsme ošetřili opichem mediálně od defektu. Vzhledem k zánětlivě infiltrované a granulační tkáni okrajů defektu jsme se nepokusili o chirurgické řešení. Opět jsme provedli tamponádu dutiny břišními rouškami a provedli dočasnou hemostázu. Do dohodě s rentgenology byl nemocný indikován k pokusu o endovaskulární ošetření krvácení.
Radiologický invazivní výkon byl proveden na angiografickém sále radiologického oddělení za přítomnosti anesteziologa. U pacienta v celkové anestezii jsme přes pravou femorální tepnu provedli nepřímou splenoportografii diagnostickým katétrem RC1 (Cook, William Cook, Dánsko) zavedeným do a. lienalis, která nebyla diagnosticky přínosná vzhledem k předchozímu chirurgickému výkonu na lienální žíle a zřejmě i kompresí rouškami při břišní tamponádě. Proto jsme se rozhodli k transhepatální punkci portálního řečiště a provedení přímé portografie. Pod skiaskopickou kontrolou v místě 10. mezižebří vpravo v přední axilární čáře pomocí mikropunkčního biliárního setu Optimed (Bile duct initials puncture set Optimed, Medicinische Instrumente GmbH, Německo) jsme kanylovali portální řečiště a zavedli 5F sheath. Vodičem Bentson (Angiodynamics, Inc., USA) jsme pronikli přes portální žílu do horní mezenterické žíly a po tomto vodiči zavedli delší Balkin 6F sheath (Cook, William Cook Europe). Přes sheath jsme zavedli diagnostickou cévku K2 – Performa (Merit Medical, Irsko) do horní mezenterické žíly a provedli přímou splenoportografii, která však neprokázala jasný únik kontrastní látky, zřejmě v důsledku komprese a účinné tamponády břišní dutiny (Obr. 1). Teprve selektivním zavedením stejného katétru přes defekt v soutoku žil do dutiny břišní a nástřikem kontrastu jsme prokázali defekt stěny žíly a místo úniku kontrastní látky (Obr. 2).
Obr. 1. Transhepatálním přístupem provedena přímá portografie zavedeným diagnostickým 5F katétrem (šipka), únik kontrastu neprokázán Fig. 1. Direct transhepatic portography with a 5F diagnostic catheter introduced (arrow), no evidence of the contrast leakage 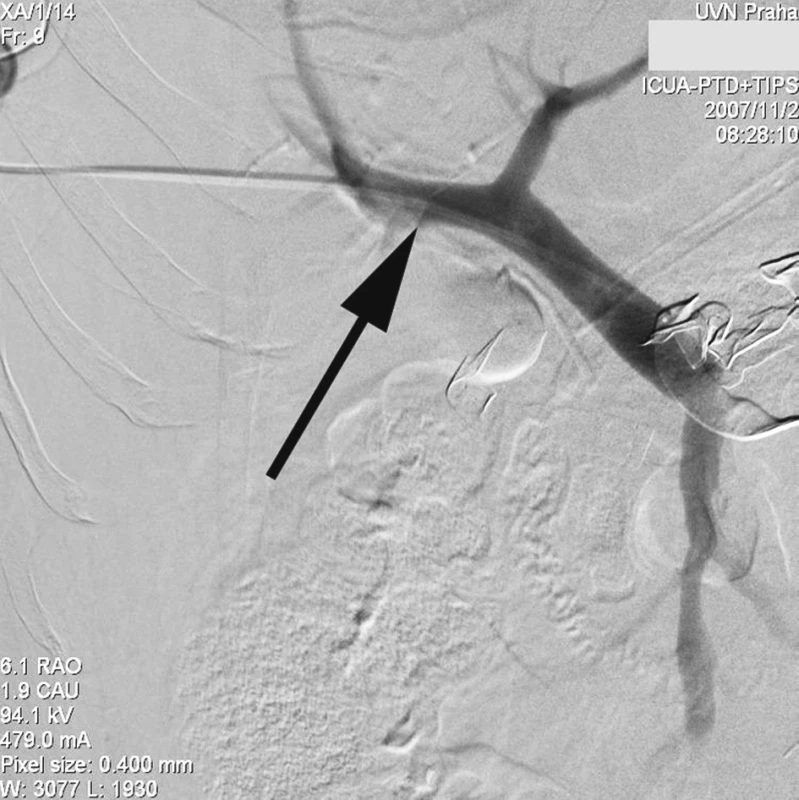
Obr. 2. Angiografie transhepatálně zavedeným katétrem (černá šipka) do místa aroze, s dobře patrným únikem kontrastní látky (bílé šipky) Fig. 2. Angiography with transhepatic introduction of the catheter (black arrow) into the arosion site with marked leakage of the contrast matter (white arrows) 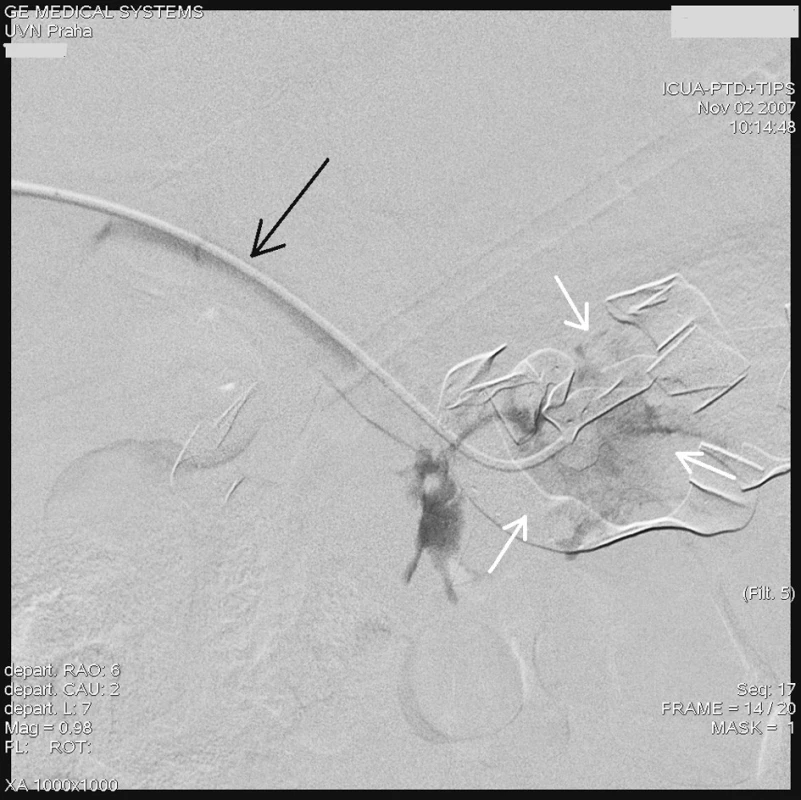
Vzhledem k charakteru a nejistému ohraničení defektu jsme neuvažovali o aplikaci lepidla či implantaci spirál. Jako jedinou možnost ošetření jsme viděli v implantaci stentgraftu (krytého stentu) a přemostění defektu cévy. Po provedení kalibrace šíře portální žíly a horní mezenterické žíly jsme se rozhodli k implantaci ilické komponenty aortálního bifurkačního stentgraftu. Zavedený 6F sheath jsme po vodiči a dilataci kanálu vyměnili za 18F sheath Gore (W. L. Gore & associates, USA) a jeho konec jsme umístili do bifurkace portální žíly. Zavedeným sheathem jsme implantovali samoexpandibilní stentgraft Excluder 16/9,5 (Stimcare, W. L. Gore & associates, SARL, Francie), jehož distální konec se rozvinul ve horní mezenterické žíle a proximální konec v portální žíle. Kontrolní angiografie neprokázala únik kontrastní látky mimo portální řečiště (Obr. 3).
Obr. 3. Kontrolní přímá portografie ukazuje zavedený stentgraft (šipky) do portální a horní mezenterické žíly bez známek úniku kontrastní látky mimo portální řečiště Fig. 3. Control direct portography – a stent (arrows) introduced into the portal and the superior mesenteric vein is depicted, no signs of the contrast leakage are detected 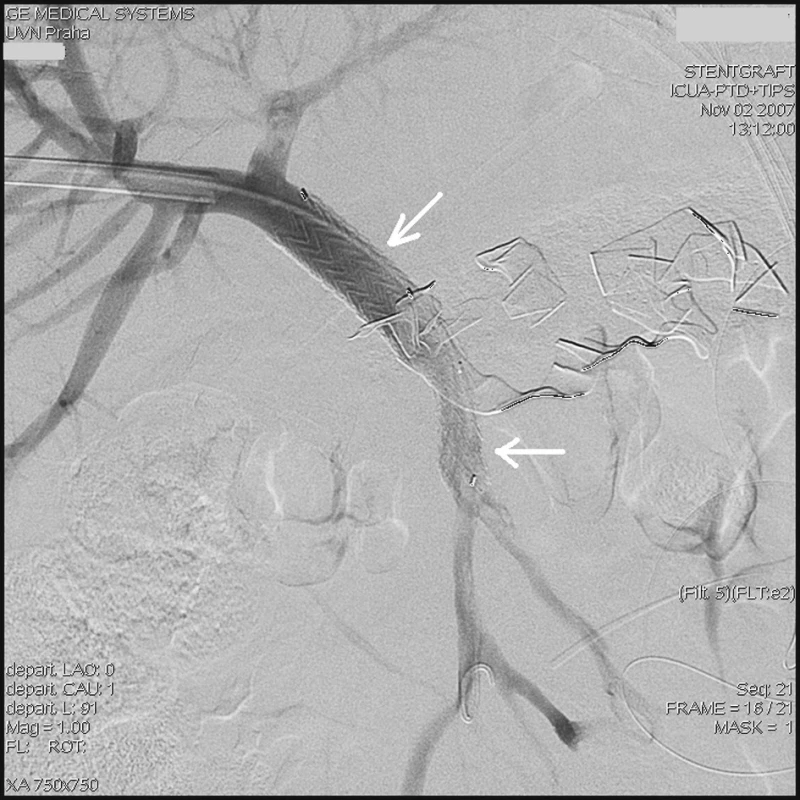
Sheath z portální žíly jsme odstranili a přístupový kanál v játrech embolizovali větším množstvím gelasponových torpéd (Gelaspon, Chauvin ankerpharm GmbH, Německo). Bezprostředně po výkonu byl nemocný převezen na chirurgický sál, kde jsme odstranili roušky z dutiny břišní a zrušili tamponádu. Břišní dutina byla bez známek pokračujícího krvácení. Na spodině kavity byl patrný defekt žilní stěny s prosvítajícím zavedeným stentgraftem (Obr. 4). Po uvolnění kožních okrajů jsme zavedli pojistné břišní drény a laparotomii jsme uzavřeli.
Obr. 4. Snímek chirurgické revize. Na spodině dutiny je v defektu žilní stěny patrný stengraft (šipka) Fig. 4. Surgical revision view. The introduced stent is visible through a venous wall defect (arrow) 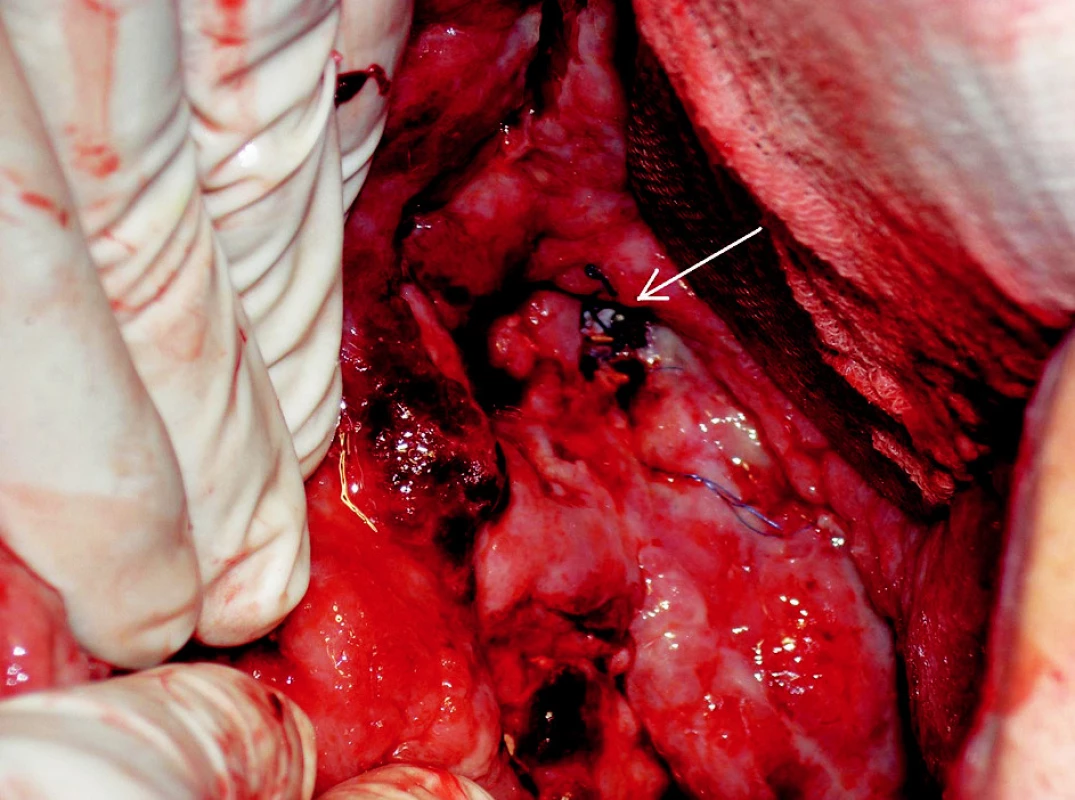
Pacient byl dále po výkonu léčen na Oddělení intenzivní péče chirurgických oborů ÚVN. V průběhu následujících dvou měsíců byly prováděny opakované endoskopické a chirurgické revize pro difuzní krvácení z granulačních tkání, duodenální píštěl a hnisavou sekreci pojistnými drény. Po celou dobu hospitalizace a léčení nemocného jsme nezaznamenali recidivu krvácení z portálního řečiště. Na kontrolním CT vyšetření 3. týdny po zavedení byl prokázán průchodný stent bez známek dislokace (Obr. 5).
Obr. 5. CT multiplanární rekonstrukce v koronární rovině a portální fázi prokazuje dobře uložený a volně průchodný stentgraft Fig. 5. CT multiplanar reconstruction in the coronary plane and portal phase depicts the correctly positioned and patent stent 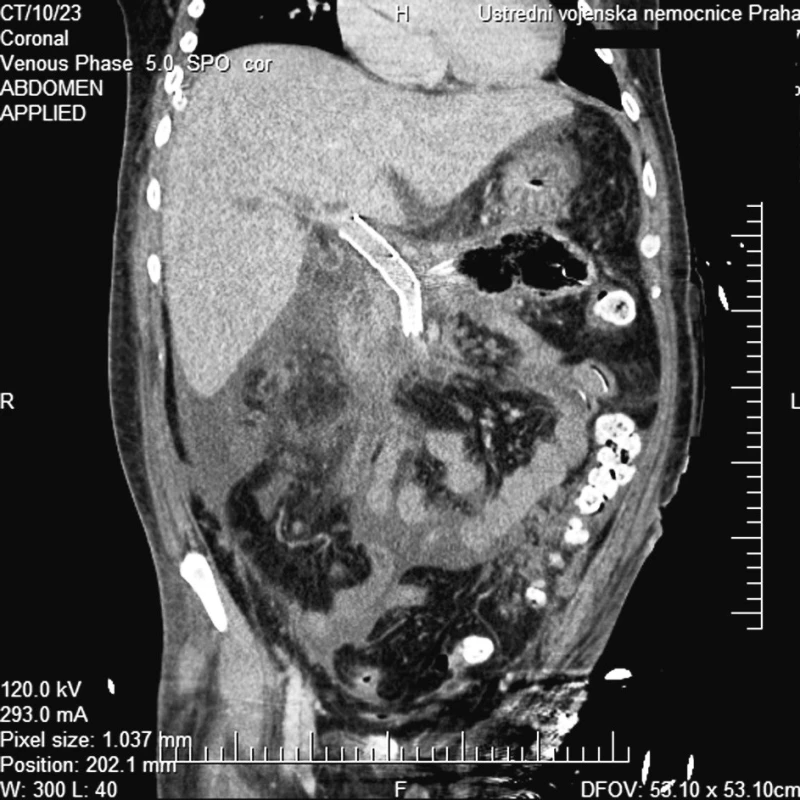
V průběhu léčby se klinický stav pacienta postupně zlepšoval. Nemocný byl extubován, postupně převeden na perorální příjem a realimentován.
63. den hospitalizace v ÚVN byl nemocný přeložen zpět do spádového zdravotnického zařízení k další léčbě a rehabilitaci. Po dalších 5 týdnech hospitalizace byl propuštěn do domácího ošetření. Při ambulantní kontrole bylo s odstupem 6 měsíců po zavedení stentgraftu provedena kontrolní CT angiografie, která prokázala průchodný stentgraft se zachovalým hepatopetálním průtokem (Obr. 6). Při ezofagogastroduodenoskopii nebyly u nemocného prokázány submukózní varixy či jiné známky portální hypertenze.
Obr. 6. CT MIP rekonstrukce v koronární rovině. Kontrolní vyšetření za 6 měsíců. Stengraft je volně průchodný s normálním hepatopetálním tokem Fig. 6. CT MIP reconstruction in the coronary plane. Control examination after 6 months. The stent is clear with normal hepatopetal flow 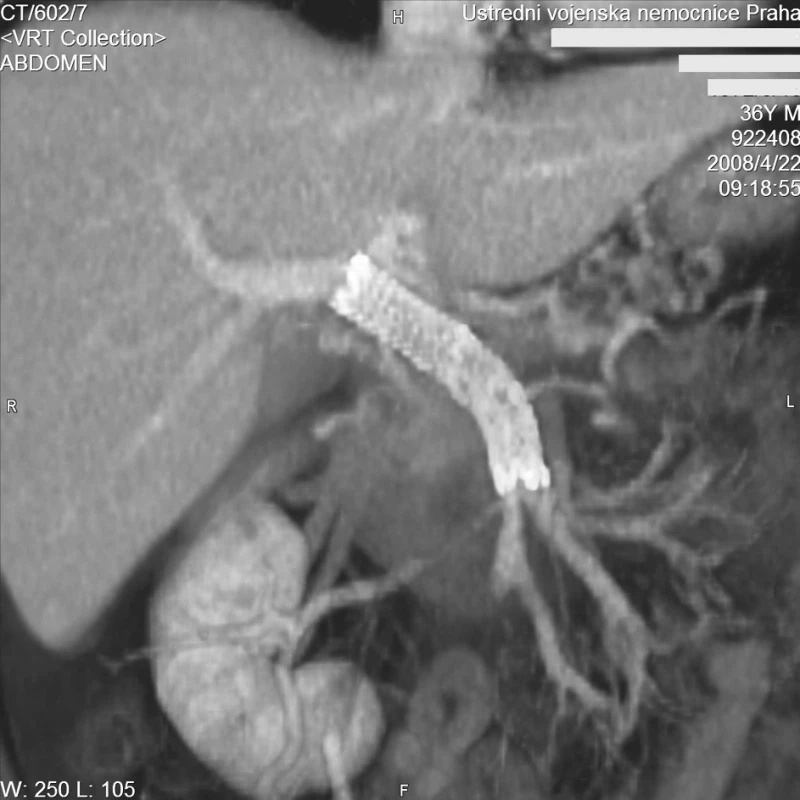
DISKUSE
Závažnou komplikací průběhu akutní nekrotizující pankreatitidy je krvácení. Vzniká autolytickým působením enzymů uvolňujících se při pankreatitidě a erozí cév v okolí žlázy.
Příčinou masivního krvácení je ve většině případů pseudoaneuryzma tepny v okolí pankreatu [1, 2, 3]. Diagnostickou metodou při známkách nitrobřišního krvácení v průběhu akutní pankreatitidy je angiografie břišní aorty a její větví [4, 5]. Umožní určit lokalizaci a charakter léze viscerálních cév a současně navázat endovaskulárním výkonem [5, 6, 7, 8, 9]. Určitou variantou řešení může být přímá perkutánní punkce patologické léze s embolizací [10]. S touto technikou nemáme vlastní zkušenosti. Většina autorů se shoduje, že metodou volby v ošetření krvácejícího pseudoaneuryzmatu je endovaskulární přístup [11, 12]. Léze portálního řešiště, jako příčina krvácení při akutní pankreatitidě, je raritní komplikací. V ojedinělém sdělení v literatuře je popisováno krvácení z portální žíly při akutní pankreatitidě, které bylo řešeno konzervativním způsobem [13].
Několik literární sdělení popisuje krvácení z portálního řečiště v průběhu chronické pankreatitidy [14, 15, 16, 17, 18]. Bylo popsáno provalení pankreatické pseudocysty do portálního řečiště či vytvoření píštěle mezi portální žílou a pankreatickým vývodem [19, 20].
Jinou popisovanou příčinou krvácení z portálního řečiště je iatrogenní poranění stěny portální žíly při zavádění transjugulární intrahepatální portosystémové spojky (TIPS). Tato komplikace byla většinou řešena přemostěním defektu stentgraftem [21, 22].
U našeho nemocného můžeme obtížně zpětně hodnotit, zda k lézi portálního řečiště a krvácení došlo v průběhu nekrotizující pankreatitidy erozí stěny cévy, či vzniklo v důsledku iatrogenního poranění při opakovaných chirurgických revizích. Je spíše důležitější, že vzniklá komplikace byla včas rozpoznána a v rámci možností pracoviště primárně adekvátně ošetřena. Provedená tamponáda břišní dutiny zjednala dočasnou hemostázu a umožnila stabilizaci nemocného. Poté bylo možné nemocného transportovat k definitivnímu ošetření na pracoviště se zkušenostmi v chirurgii pankreatu a s endo-vaskulárními metodami.
ZÁVĚR
Prognóza nemocného s nekrotizující pankreatitidou je ovlivněna především přítomností přidružených komplikací. Vedle infekce s rozvojem septického stavu a multiorgánovým selháním je další obávanou komplikací masivní krvácení při arozi cév v okolí slinivky. V kazuistickém sdělení je popsán ojedinělý případ masivního krvácení z portálního řečiště vzniklé v průběhu nekrotizující pankreatitidy, které bylo úspěšně ošetřeno endovaskulárním přístupem. Ve sdělení je popsán a zdůrazněn význam intenzivního přístupu a multioborové spolupráce v léčbě nemocného s komplikovaným průběhem nekrotizující pankreatitidy. Jen tak lze příznivě ovlivnit přetrvávající vysokou morbiditu a letalitu tohoto onemocnění.
MUDr. J. Lacman
RDG oddělení ÚVN Praha
U Vojenské nemocnice 1200
169 02 Praha 6 - Střešovice
e-mail: jiri.lacman@uvn.cz
Zdroje
1. Di Paolo, M., Marradi, I. Haemorrhagic complication of acute necrotizing pankreatitis presenting with sudden death. J. Clin. Forensic. Med., 2006; 13(5): 271–273.
2. Mendelson, R. M., Anderson, J., Marshall, M., Ramsay, D. Vascular complications of pancreatitis. ANZ J. Surg., 2005 Dec; 75(12): 1073–1079.
3. Bergert, H., Dobrowolski, F., Caffier, S., Bloomenthal, A., Hinterseher, I., Saeger, H. D. Prevalence and treatment of bleeding complications in chronic pancreatitis. Langenbecks Arch. Surg., 2004 Nov; 389(6): 504–510.
4. Ferda, J., Novák, M., Kreuzberg, B. Výpočetní tomografie. Galén, 2002.
5. Krajina, A., Peregrin, J. H. Intervenční radiologie – Miniinvazivní terapie. Hradec Králové – Olga Čermáková, 2005.
6. Abbott, G. T., McDermott, V. G., Smith, T. P. Succesfull endovascular treatment of a celiac artery pseudoaneurysm complicating pankreatitis. J. Vasc. Interv. Radiol., 1996; 7 : 103–106.
7. Appel, N., Duncan, J. R., Schuerer, D. J. E. Percutaneous stent-graft treatment of superior mesenteric and internal iliac artery pseudoaneurysms. J. Vasc. Interv. Radiol., 2003; 14 : 917–922.
8. Arepally, A., Dagli, M., Hofmann, L. V., Kim, H. S., Cooper, M., Klein, A. Treatment of splenic artery aneurysma with use of a stent-graft. J. Vasc. Interv. Radiol., 2002; 13 : 631–633.
9. Brountzos, E. N., Vagenas, K., Apostolopoulou, S. C., Panagiotou, I., Lymberopoulou, D., Kelekis, D. A. Pancreatitis-associated splenic artery pseudoaneurysm: endovascular treatment with self-expandable stent-grafts. Cardiovasc. Intervent Radiol., 2003; 26 : 88–91.
10. Araoz, P. A., Andrews, J. C. Direct percutaneous embolization of visceral artery aneurysms: techniques and pitfalls. J. Vasc. Interv. Radiol., 2000; 11 : 1195–1200.
11. Millonig, G., Graziadei, I. W., Waldenberger, P., Koenigsrainer, A., Naschle, W., Vogel, W. Percutaneous management of a hepatic artery aneurysm: bleeding after liver transplantation. Cardiovasc. Intervent Radiol., 2004 Sep-Oct; 27(5): 525–528.
12. Harman, A., Boyvat, F., Hasdogan, B., Aytekin, C., Karakayali, H., Haberal, M. Endovascular treatment of active bleeding after liver transplant. Exp. Clin. Transplant., 2007 Jun; 5(1): 596–600.
13. Ko, H. S., Anders, M., Diehl, S., Dominguez, E., Löhr, M., Düber, C. Portal vein erosion and acute abdominal hemorrhagie as a complication of acute pankreatitis. Abdominal Imaging, 2003; 28 : 700–702.
14. Takayama, T., Kato, K., Sano, H., et al. Spontaneous rupture of a pancreatic pseudocyst into the portal venous systém. AJR 1986; 147 : 935–936.
15. Takayama, T., Kato, K., Katada, N., et al. Radiological demonstration of spontaneous rupture of a pancreatic pseudocyst into the portal systém. Am. J. Gastroenterol., 1982; 76 : 55–58.
16. Procacci, C., Mansueto, G. C., Graziani, R., et al. Spontaneous rupture of a pancreatic pseudocyst into the portal vein. Cardiovasc. Intervent Radiol., 1995; 18 : 399–402.
17. Packeisen, J., Klingen, D., Grezella, F. Spontaneous rupture of a pancreatic pseudocyst into the portal vein. Z. Gastroenterol., 2001; 39 : 961–964.
18. Skarsgard, E. D., Ellison, E., Quenville, N. Spontaneous rupture of a pancreatic pseudocyst into the portal vein. Can. J. Surg., 1995; 38 : 459–463.
19. Willis, S. M., Brewer, T. G. Pancreatico-portal vein fistula. Gastroenterology, 1989; 97 : 1025–1027.
20. van Steenberg, W., Ponette, E. Pancreatico-portal fistula: a rare complication of chronic pancreatitis. Gastrointest. Radiol., 1990; 15 : 299–300.
21. Krajina, A., Hulek, P., Ferko, A., Nozicka, J. Extrahepatic portal venous laceration in TIPS treated with stent graft placement. Hepatogastroenterology, 1997 May-Jun; 44(15): 667–670.
22. Brountzos, E. N., Efthymia, A., Koskinas, I., Thanos, L., Papathanasiou, M. A., Kelekis, D. A. Intraperitoneal portal vein bleeding dutiny transjugular intrahepatic portosystemic shunt: Treatment with stent-graft placement. AJR, 2000; 174 : 132–134.
Štítky
Chirurgia všeobecná Ortopédia Urgentná medicína
Článek Apendicitída v gravidite
Článok vyšiel v časopiseRozhledy v chirurgii
Najčítanejšie tento týždeň
2008 Číslo 10- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Kombinace metamizol/paracetamol v léčbě pooperační bolesti u zákroků v rámci jednodenní chirurgie
- Antidepresivní efekt kombinovaného analgetika tramadolu s paracetamolem
-
Všetky články tohto čísla
- Karcinom žlučníku – současné možnosti chirurgické léčby léčby
- Multioborová spolupráce při ošetření závažného krvácení komplikující průběh nekrotizující pankreatitidy – kazuistika
- Strategie léčby neparazitárních benigních cyst jater
- Akútne skrótum je stav vyžadujúci chirurgickú intervenciu
- Výsledky resekční léčby pankreatu u starších a geriatrických pacientů
- Použitie alogénneho materiálu pri riešení spina bifida aperta
- Klesá počet amputací dolních končetin?
- Apendicitída v gravidite
- Torakoskopická anatomická resekce v rozsahu lobektomie
- Izolovaná intraperitoneální ruptura močového měchýře po tupém poranění břicha – kazuistika
- Novinky v morfologii žil dolní končetiny
- Diafragmatická hernia manifestovaná v neskoršom veku
- Rozhledy v chirurgii
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Strategie léčby neparazitárních benigních cyst jater
- Karcinom žlučníku – současné možnosti chirurgické léčby léčby
- Diafragmatická hernia manifestovaná v neskoršom veku
- Akútne skrótum je stav vyžadujúci chirurgickú intervenciu
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



