-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Molekulovo- genetická analýza tumorsupresorových génov PTEN a TP53 u pacientky s karcinómom endometria
Molecular - genetic analysis of tumor - suppressor genes PTEN and TP53 in a patient with endometrial carcinoma.
Molecular - genetic analysis of tumor - suppressor genes PTEN and TP53 in a patient with endometrial carcinoma. Endometrial carcinoma is the most common malignant tumor of female genitals in the developed countries. Recently, certain genes have been found to contribute to the development of endometrial carcinoma, including TP53, KRAS, b - catenin and PTEN. PTEN is as tumor - suppressor gene, mutation of which has been described in several studies of various types of tumors. PTEN was identified in 1997 on chromosome 10 (10q23.3) and encodes tyrosine phosphatase. Tumor - suppressor gene TP53 (17p13.1, coding region 2629 bp) encodes a protein consisting of 393 amino acids, and its tetramer form acts as a functional protein. We identified PTEN gene mutation and TP53 gene polymorphism in the examined endometrial tissue.
Key words:
endometrial carcinoma – tumor - suppressor gene – gene mutation – gene polymorphism
Autoři: E. Radzo 1; V. Šišovský 2; P. Sýkora 1; Vanda Repiská 1
Působiště autorů: Univerzita Komenského v Bratislave, Lekárska fakulta, Ústav lekárskej biológie a genetiky 1; Univerzita Komenského v Bratislave, Lekárska fakulta, Ústav patologickej anatómie 2
Vyšlo v časopise: Prakt Gyn 2009; 13(4): 225-227
Souhrn
Karcinóm endometria je najčastejší malígny nádor ženských pohlavných orgánov v rozvinutých krajinách. V súčasnom období boli objasnené niektoré gény, ktoré prispievajú k vývoju karcinómu endometria a medzi tieto gény patria TP53, KRAS, b - catenin a PTEN. PTEN bol označený ako tumorsupresorový gén, ktorého mutácie opisuje viacero štúdií pri rôznych typoch nádorových ochorení. Bol identifikovaný v roku 1997 na chromozóme 10 (10q23.3) a kóduje tyrozínovú fosfatázu. Tumorsupresorový gén TP53 (17p13.1, kódujúca oblasť 2 629 bp) kóduje proteín z 393 aminokyselín, pričom ako funkčný proteín pôsobí v podobe tetraméru. V skúmanom tkanive endometria sme identifikovali mutáciu v géne PTEN a polymorfizmus v géne TP53.
Kľúčové slová:
karcinóm endometria – tumorsupresorový gén – mutácia génu – polymorfizmus génuÚvod
Karcinóm endometria (CaE) je najčastejší malígny nádor ženských pohlavných orgánov v rozvinutých krajinách [1]. V súčasnom období boli objasnené niektoré gény, ktoré prispievajú k vývoju karcinómu endometria a medzi tieto gény patria TP53, KRAS, b - catenin a PTEN [2 – 7].
Tumorsupresorový gén PTEN (phosphatase and tensin homolog deleted on chromosome 10), tiež nazývaný MMAC1 (mutated in multiple advanced cancers 1) alebo TEP1 (TGFb - regulated and epithelial - cell - enriched phosphatase) bol identifikovaný v roku 1997 na chromozóme 10 (10q23.3) [8 – 9]. Kóduje tyrozínovú fosfatázu (403 AK), ktorá defosforyluje fosfatidylinozitol - 3,4,5 - trifosfát (PIP3), produkt reakcie katalyzovanej fosfatidylinozitol - 3 - kinázou (PI3K), na fosfatidylinozitol - 4,5 - bisfosfát (PIP2), a tým sa významne podieľa na regulácii aktivácie AKT/ PKB (protein kinase B) signálnej dráhy. PTEN bol označený ako tumorsupresorový gén, ktorého mutácie opisuje viacero štúdií pri rôznych typoch nádorových ochorení. Mnohé mutácie sa týkali kódujúcej sekvencie génu PTEN, z ktorých väčšina mala za následok inaktiváciu fosfatázovej aktivity tejto tyrozínovej fosfatázy. Je známe, že mutácie typu „frameshift“, príp. „nonsense“ mutácie v rámci fosfatázovej domény (AK 15 – 186) katalytickej jednotky tohto proteínu výrazne menia fosfatázovú aktivitu, čím sa tieto zmeny na úrovni DNA do istej miery podieľajú na procese malígnej transformácie bunky [10 – 11]. Okrem toho strata funkcie PTEN proteínu je pravdepodobne skorou genetickou alteráciou pri vzniku nádorov endometria, o čom svedčí jej výskyt v prekanceróznych léziách (55 %) a vo viac ako 83 % endometrioidných karcinómoch [12 – 13].
Tumorsupresorový gén TP53 (17p13.1, kódujúca oblasť 2 629 bp) kóduje proteín z 393 aminokyselín, pričom ako funkčný proteín pôsobí v podobe tetraméru. Po poškodení DNA sa p53 hromadí v jadre a spôsobuje zastavenie bunkového cyklu tým, že ako transkripčný faktor zvýši expresiu proteínu p21 [14], ktorý ako člen CIP/ KIP proteínovej rodiny inhibuje komplexy cyklín D/ CDK4 a cyklín D/ CDK6, čím zabráni hyperfosforylácii proteínu rb1 a disociácii E2F rodiny transkripčných faktorov, vďaka ktorej bunka vstupuje do S - fázy bunkového cyklu. Pri mutácii génu TP53 je výsledkom hromadenie nefunkčného proteínu v bunke, ktorý pôsobí ako dvojito - negatívny inhibítor funkčného (wild type) p53, čo vedie k množeniu poškodených buniek – nádorovému procesu [15]. Mutácie TP53 boli identifikované približne v 15 % CaE, pričom 75 % mutácií TP53 sa nachádzalo v endometriálnej intraepitaliálnej neoplázii, ktorá sa pokladá za prekurzor serózneho karcinómu (SC) [16 – 17]. V roku 1981 Lauchlan opísal sériu ôsmich CaE, päť takých, ktoré boli morfologicky čisté, a autor ich označil ako serózne karcinómy, pričom uviedol, že pri porovnaní s endometrioidnými karcinómami je prognóza pre SC karcinómy výrazne horšia, pričom mnoho pacientok zomrie v dôsledku rozsiahleho metastázovania SC so žiadnou alebo iba minimálnou inváziou do myometria [18].
Materiál a metódy
Molekulovo - genetickej analýze bolo podrobené nádorovo zmenené tkanivo endometria 66ročnej pacientky. Na základe histologického nálezu sa jednalo o endometrioidný adenokarcinóm uteru (typ I, estrogén dependentný endometrioidný karcinóm endometria – EEC), Grade II, s infiltráciou do ½ hrúbky myometria.
DNA sme izolovali z 25 mg odobratého tkaniva použitím komerčného kitu QIAamp DNA Mini Kit (Qiagen). Sledované exóny génov PTEN (exóny 1 – 9) a TP53 (exóny 2 – 11) sme amplifikovali využitím polymerázovej reťazovej reakcie (PCR) – tab.1. Jednotlivé PCR produkty sme následne sekvenovali na genetickom analyzátore ABI PRISM TM310 Genetic Analyzer s využitím ABI TM DNA sequencing kitu (Applied Biosystems).
Tab. 1. Protokol polymerázovej reťazovej reakcie (PCR). 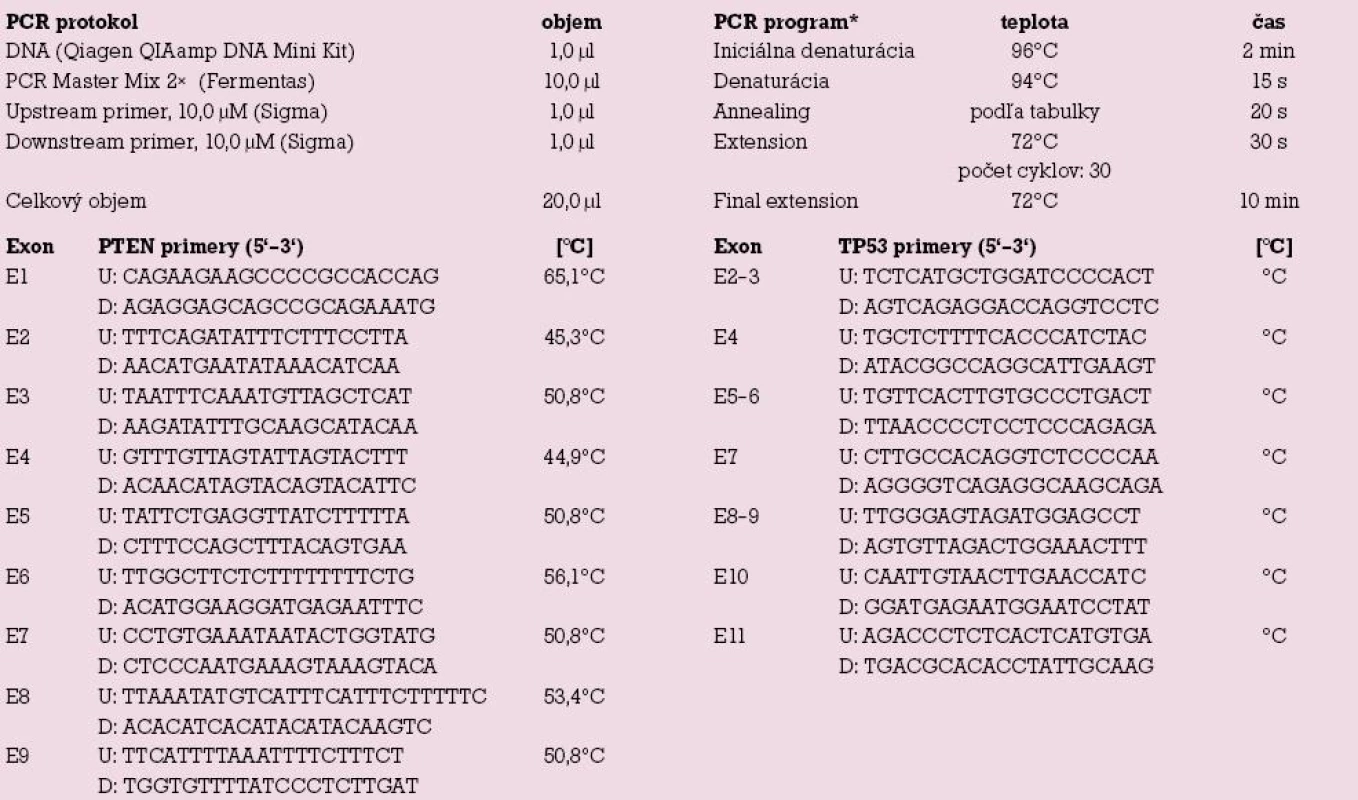
* Eppendorf Mastercycler EPgradient, U – upstream primer, D – downstream primer Výsledky a diskuzia
Priamym sekvenovaním PCR produktov sme v 5. exóne génu PTEN indentifikovali mutáciu typu „nonsense“, pričom išlo o heterozygotnú substitúciu GAA/ TAA v kodóne 157 (1 alela bola „wild type“, obr. 1). Uvedená zmena genetickej informácie vedie k predčasnému vytvoreniu „STOP“ kodónu v pozícii 157, čím sa PTEN proteín v priebehu translácie skráti o 246 AK, čo v konečnom dôsledku môže viesť k funkčnej alterácii tohto proteínu.
V 4. exóne génu TP53 sme priamym sekvenovaním PCR produktu identifikovali heterozygotný polymorfizmus (SNP) CCC/ CGC (obr. 2) v kodóne 72. Dôsledkom zmeny nukleotidov dochádza k substitúcii neutrálnej, nepolárnej a hydrofóbnej aminokyseliny prolín za zásaditú, polárnu a hydrofilnú aminokyselinu arginín. To môže viesť k zmene sekundárnej i terciárnej štruktúry proteínu p53, a tým k zmene jeho väzbovej aktivity na DNA.
Na základe vyššie uvedeného nálezu v rámci genetickej analýzy tumorsupresorových génov PTEN a TP53 môžeme konštatovať, že v skúmanom tkanive sa môže nachádzať viac histologických typov CaE, čo môže znamenať aj odlišnú prognózu tohto ochorenia.
Liu hodnotí mnohé nádory endometria ako výnimky v rámci dualistického modelu endometriálnej karcinogenézy. Tieto nádory sú v „šedej zóne“ s prekrývajúcimi sa klinickými, morfologickými, imunohistochemickými a molekulárnymi rysmi z oboch typov CaE [19].
Karcinómy endometria, endometriálne stromálne nádory a zmiešané malígne mezodermálne nádory (ZMMN) sa rozvíjajú osobitnými molekulárno - genetickými cestami. Lax vo svojej práci ďalej opisuje, že v ZMMN, ktoré sa považujú za metaplastické karcinómy, sa objavuje alterácia p53 na začiatku, ešte pred expanziou a získaním genetickej rozmanitosti počas ich progresie [20].
Kurihara et al pri skúmaní sarkómov vyššieho stupňa so signifikantnou atypiou jadra opisujú akumuláciu p53 v jadre a „missense“ mutácie v géne TP53 iba v nediferencovaných endometriálnych sarkómoch s jadrovým pleomorfizmom [21].
V rámci karcinogenézy môžeme uvažovať aj o zníženej odolnosti voči chemickému, medikamentóznemu poškodeniu tkaniva endometria. Zeng et al zistili, že aktivácia p53 zohráva esenciálnu úlohu v signálnej ceste od opravy chýb v DNA k autofágmi pôsobiacej apoptóze po chemickom poškodení DNA – 6 - thioguaninom [22].
Naďalej bude potrebné sledovať genetické alterácie v CaE, pričom výsledky genetickej analýzy môžu pomôcť porozumieť procesu karcinogenézy z hľadiska molekulárno - biologickej podstaty.
MUDr. Edward Radzo1
MUDr. Vladimir Sisovsky, PhD.2
Pavel Sykora1
Doc. RNDr. Vanda Repiska, PhD.1
1 Univerzita Komenského v Bratislave, Lekárska fakulta, Ústav lekárskej biológie a genetiky
2 Univerzita Komenského v Bratislave, Lekárska fakulta, Ústav patologickej anatómie
mudr.edwardradzo@gmail.com
Zdroje
1. Djordjević B, Stanojević Z. Endometrial carcinoma and precursor lesions. Srp Arh Celok Lek. 2007; 135(3 – 4): 230 – 234.
2. Okamoto A, Sameshima Y, Yamada Y et al. Allelic loss on chromosome 17p and p53 mutations in human endometrial carcinoma of the uterus. Cancer Res 1991; 51(20): 5632 – 5635.
3. Enomoto T, Inoue M, Perantoni AO et al. K - ras activation in neoplasms of the human female reproductive tract. Cancer Res 1990; 50(19): 6139 – 6145.
4. Fukuchi T, Sakamoto M, Tsuda H et al. Catenin mutation in carcinoma of the uterine endometrium. Cancer Res 1998; 58 : 3526 – 3528.
5. Tashiro H, Blazes MS, Wu R et al. Mutations in PTEN are frequentin endometrial carcinoma but rare in other common gynecological malignancies. Cancer Res 1997; 57 : 3935 – 3940.
6. Risinger JI, Hayes AK, Berchuck A et al. PTEN/ MMAC1 mutations in endometrial cancers. Cancer Res 1997; 57(21): 4736 – 4738.
7. Kong D, Suzuki A, Zou TT et al. PTEN is frequently mutated in primary endometrial carcinomas. Nat Genet 1997; 17(2): 143 – 144.
8. Yamada KM, Araki M. Tumor suppressor PTEN: modulator of cell signaling, growth, migration and apoptosis. J Cell Sci 2001; 114, 2375 – 2382.
9. Tamguney T, Stokoe D. New insights into PTEN. J Cell Sci 2007; 120, 4071 – 4079.
10. Leslie NR, Downes PC. PTEN function: how normal cells control it and tumour cells lose it. Biochem J 2004; 382, 1 – 11.
11. Goberdhan DCI, Wilson C. PTEN: tumour suppressor, multifunctional growth regulator and more. Hum Mol Genet 2003; 12 : 239 – 248.
12. Maxwell GL, Risinger JI, Gumbs C et al. Mutation of the PTEN tumor suppressor gene in endometrial hyperplasias. Cancer Res 1998; 58(12): 2500 – 2503.
13. Mutter GL, Lin MC, Fitzgerald JT et al. Altered PTEN expression as a diagnostic marker for the earliest endometrial precancers. J Natl Cancer Inst 2000; 92(11): 924 – 930.
14. Doll A, Abal M, Rigau M et al. Novel molecular profiles of endometrial cancer - new light through old windows. J Steroid Biochem Mol Biol 2008; 108(3 – 5): 221 – 229.
15. Bansal N, Yendluri V, Wenham RM. The molecular biology of endometrial cancers and the implications for pathogenesis, classification, and targeted therapies Cancer Control 2009; 16(1):8 – 13.
16. Lax SF, Kendall B, Tashiro H et al. The frequency of p53, K - ras mutations, and microsatellite instability differs in uterine endometrioid and serous carcinoma: evidence of distinct molecular genetic pathway. Cancer 2000; 88 : 814 – 824.
17. Tashiro H, Isacson C, Levine R et al. p53 gene mutations are common in uterine serous carcinoma and occur early in their pathogenesis. Am J Pathol 1997; 150(1): 177 – 185.
18. Lauchlan SC. Tubal (serous) carcinoma of the endometrium. Arch Pathol Lab Med 1981; 105(11): 615 – 618.
19. Liu FS. Molecular carcinogenesis of endometrial cancer. Taiwan J Obstet Gynecol. 2007; 46(1): 26 – 32.
20. Lax SF. Molecular genetic changes in epithelial, stromal and mixed neoplasms of the endometrium. Pathology 2007; 39(1): 46 – 54.
21. Kurihara S, Oda Y, Ohishi Y et al. Endometrial stromal sarcomas and related high‑grade sarcomas: immunohistochemical and molecular genetic study of 31 cases. Am J Surg Patol 2008; 32(8): 1228 – 1238.
22. Zeng X, Yan T, Schupp JE et al. DNA mismatch repair initiates 6 - thioguanine - ‑induced autophagy through p53 activation in human tumor cells. Clin Cancer Res 2007; 13(4): 1315 – 1321.
Štítky
Detská gynekológia Gynekológia a pôrodníctvo Reprodukčná medicína
Článok vyšiel v časopisePraktická gynekologie
Najčítanejšie tento týždeň
2009 Číslo 4- Ne každé mimoděložní těhotenství musí končit salpingektomií
- I „pouhé“ doporučení znamená velkou pomoc. Nasměrujte své pacienty pod křídla Dobrých andělů
- Mýty a fakta ohledně doporučení v těhotenství
- Gynekologické potíže pomáhá účinně zvládat benzydamin
-
Všetky články tohto čísla
- Úvodní slovo
- Edukační kazuistika
- Mikrobiologické vlastnosti kmenů endogenní vaginální flóry asymptomatických žen reprodukčního věku
- Kontrastní ultrazvuk (CEUS) nehmatných lézí prsu
- Dopplerometrie ductus venosus
- Prognóza žen s mikrometastázou karcinomu prsu v sentinelové uzlině
- Molekulovo- genetická analýza tumorsupresorových génov PTEN a TP53 u pacientky s karcinómom endometria
- Biologická léčba karcinomu prsu
- Tradiční peruánská medicína v léčbě neplodnosti
- Rýchla prenatálna diagnostika chromozómových aneuploidií
- Porodní plán
- Northwestern University’s Feinberg School of Medicine Northwestern Memorial Hospital – Department of Obstetrics and Gynecology Chicago, USA Termín: 5.– 26. září 2009
- 5th International Symposium on Diabetes and Pregnancy
- Praktická gynekologie
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Dopplerometrie ductus venosus
- Prognóza žen s mikrometastázou karcinomu prsu v sentinelové uzlině
- Kontrastní ultrazvuk (CEUS) nehmatných lézí prsu
- Mikrobiologické vlastnosti kmenů endogenní vaginální flóry asymptomatických žen reprodukčního věku
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



