-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Nové regulační hormony mateřského mléka
New regulation hormones of the breast milk
Consideration of adipose tissue exclusively as an energy store is a thing of the past. Adipose tissue can be considered a separate endocrine organ, with adipocytes producing a number of hormonally active substances affecting the nutritional status of individuals. Regulatory hormones of nutritional status (adiponectin, leptin, ghrelin, IGF-1, resistin, obestatin) are the subject of intense research and many of them have been identified in human breast milk (BM). From a long term point of view, these hormones may be involved in programming of the regulation of energy balance in childhood and subsequent control of body weight in adulthood. It is assumed that breastfeeding may influence the development of neuroendocrine pathways involved in the regulation of nutritional status. Regulatory hormones in BM may be one of the mechanisms that mediate protective effect of breastfeeding on the development of Obesity in adulthood. The current level of knowledge about actual clinical importance of these BM hormones for the development of infants is low. The following article provides an overview of up-to-date knowledge about regulatory hormones of BM.
Key words:
nutritional status, breast milk, adipocytes, regulatory hormones
Autoři: J. Bronský; K. Mitrová
Působiště autorů: Pediatrická klinika 2. LF UK a FN Motol, Praha
Vyšlo v časopise: Klin. Biochem. Metab., 21 (42), 2013, No. 1, p. 31-38
Souhrn
Nahlížení na tukovou tkáň pouze jako na úložiště energie je již minulostí. Tukovou tkáň lze považovat za samostatný endokrinní orgán, kterého buňky - adipocyty - produkují řadu hormonálně aktivních látek ovlivňujících nutriční stav jedince. Regulační hormony nutričního stavu (adiponektin, leptin, ghrelin, IgF-1, rezistin, obestatin) jsou předmětem intenzivního výzkumu a řada z nich byla identifikována i v mateřském mléce (MM) člověka. Z dlouhodobého hlediska se tyto hormony mohou podílet na programování regulace energetické rovnováhy u dětí a následné kontroly tělesné hmotnosti v dospělosti. Předpokládá se, že kojení může ovlivnit vývoj neuroendokrinních drah podílejících se na regulaci nutričního stavu. Regulační hormony v MM mohou být jedním z mechanismů, kterými je zprostředkován protektivní efekt kojení na rozvoj obezity v dospělosti. Současná úroveň znalostí o skutečném klinickém významu těchto hormonů MM pro vývoj kojence je nízká. Následující text přináší přehled dosavadních poznatků.
Klíčová slova:
nutriční stav, mateřské mléko, adipocyty, regulační hormonyÚvod
Mateřské mléko (MM) je díky svému jedinečnému složení a biologickým vlastnostem pro člověka nenahraditelné. Jednotlivé složky MM významným způsobem ovlivňují růst a vývoj dítěte a hrají významnou roli v regulaci postnatálního zrání a vývoje tkání a orgánových systémů. Význam kojení je v současné době již nezpochybnitelný. Poskytuje řadu výhod jak pro kojence, tak i pro kojící matku. Existují navíc důkazy, že kojení má pozitivní vliv na zdraví jedince i v dospělosti. Nejvýznamnější, vědecky prokázané benefity kojení se týkají prevence vzniku alergií, infekčních či gastrointestinálních onemocnění, stejně tak jako i jeho vlivu na růst a kognitivní funkce dítěte či spojitost s pozdějším výskytem civilizačních onemocnění [1].
Regulační hormony nutričního stavu jsou předmětem intenzivního výzkumu a řada z nich byla identifikována i v MM člověka (Tabulka 1) [2]. Z dlouhodobého hlediska se tyto hormony mohou podílet na programování regulace energetické rovnováhy u dětí a následné kontroly tělesné hmotnosti v dospělosti [3]. Předpokládá se, že kojení může ovlivnit vývoj neuroendokrinních drah podílejících se na regulaci nutričního stavu. Regulační hormony v MM mohou být jedním z mechanismů, kterými je zprostředkován protektivní efekt kojení na rozvoj obezity a dalších civilizačních onemocnění v dospělosti. Současná úroveň znalostí o skutečném klinickém významu těchto hormonů MM pro vývoj kojence je nízká. Následující text přináší přehled dosavadních poznatků.
Tab. 1. New regulatory hormones of breast milk 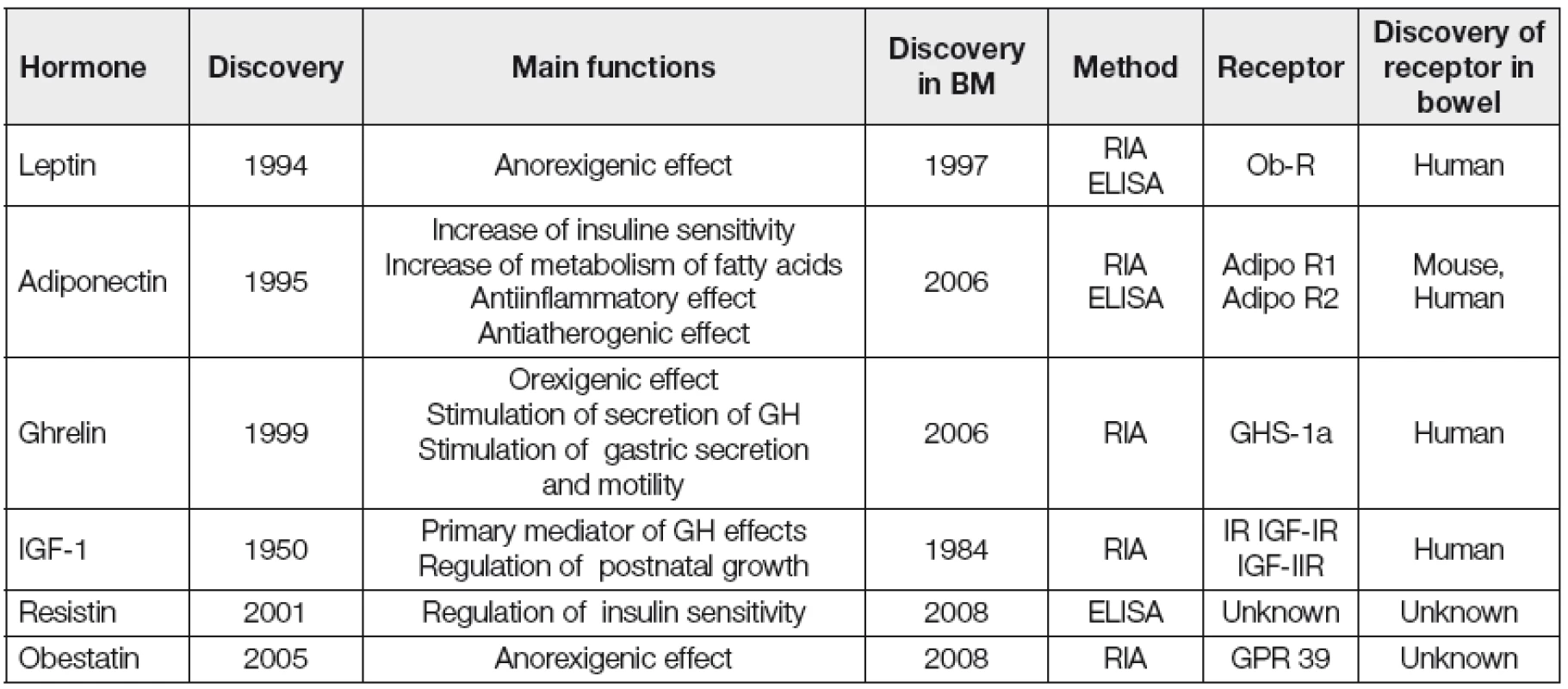
Legend: GH = growth hormone; RIA = radioimmunoassay; ELISA = enzyme-linked immunosorbent assay Adiponektin
Adiponektin (30 kDa) je predominantní sekretorický protein tukové tkáně. Zajišťuje homeostázu glukózy a lipidů, působí proti řadě rizikových faktorů spojených s obezitou a zvyšuje inzulínovou senzitivitu [4]. Při lézi endotelu se akumuluje ve stěně cév, moduluje endoteliální odpověď na zánět tím, že inhibuje fagocytózu monocytomakrofágových buněk a brání uvolnění adhezivních molekul indukovaných působením TNF-alfa [5].
Strukturálně je adiponektin příbuzný skupině cytokinových molekul. Adiponektin tvoří asi 0,01% celkové sérové bílkoviny. Jeho molekula se skládá z 247 aminokyselinových zbytků, N-terminální doména je podobná kolagenu typu VIII a C-terminální globulární doména vykazuje strukturální podobnost s C1q faktorem komplementu. Adiponektin má v krevním řečišti tendenci tvořit homotrimery a oligomerní struktury vyššího řádu. V séru je možno detekovat i samostatný C-terminální fragment. Adiponektinový gen má označení AMP1 a je umístěn na lokusu 3q27. Tento lokus je podle vědeckých výzkumů asociovaný s predispozicí k diabetes mellitus 2. typu a metabolickému syndromu [6].
Doposud bylo identifikováno několik adiponektinových receptorů [7]. Základními dvěma typy jsou AdipoR1 a AdipoR2, které mají 7 transmembránových domén, ale jsou strukturálně, topologicky i funkčně odlišné od receptorů sdružených s G-proteinem (GPCR). Jejich N terminální doména je intracelulární a C terminální doména extracelulární (narozdíl od GPCR). AdipoR1 se vyskytuje ubikvitně, ale převážně je umístěn na povrchu buněk kosterní svaloviny. Jeho gen je umístěn na lokusu 1p36. AdipoR2 je predominantně exprimován v jaterní tkáni a gen je lokalizován na 12p13. Dalším známým typem receptoru je tzv. T-cadherin, který váže hexamerní a vysokomolekulární formy adiponektinu.
AdipoR1 a AdipoR2 způsobují zvýšení aktivity ligandů AMPK, PPAR-alpha (peroxisome proliferator-activated receptor alpha) a p38 MAPK (mitogen-activated protein kinase, MAPK14). Zvyšují oxidaci mastných kyselin ve tkáních a vychytávání glukózy z krevního řečiště. AdipoR1 a AdipoR2 jsou fylogeneticky vysoce konzervované, lidský AdipoR2 je z 95,2% identický s myším proteinem. AdipoR1 a AdipoR2 sdílí vysokou strukturální homologii (u myší 66,7% identity). Adiponektin vykazuje pouze nevýrazný efekt na produkci cAMP, cGMP a hladiny intracelulárního kalcia. AdipoR1 je vysoce afinitní receptor pro globulární doménu adiponektinu, ale nízkoafinitní pro celou molekulu adiponektinu, AdipoR2 vykazuje střední afinitu pro obě formy.
Produkce adiponektinu v bílé tukové tkáni vzrůstá během diferenciace adipocytů. Hypertrofie adipocytů vyvolaná stravou s vysokým obsahem tuků způsobuje naopak snížení produkce a sekrece všech hormonů zvyšujících inzulínovou senzitivitu (včetně adiponektinu) a zvýšení hormonů přispívajících k inzulínové rezistenci [8]. Snížení syntézy a sekrece adiponektinu způsobuje zvýšený kalorický příjem zvláště za podmínek leptinové deficience či rezistence. Jeho produkce a sekrece je také stimulována IGF-1. Thiazolidindiony (antidiabetika zvyšující inzulínovou senzitivitu – agonisté PPAR gamma) stimulují expresi adiponektinového genu a zvyšují hladiny adiponektinu u obézních myší a u obézních pacientů s inzulínovou rezistencí [9].
Sérové koncentrace adiponektinu jsou zvýšené u konstitučně štíhlých jedinců a nízké u obézních. Abnormální příjem potravy a potravní chování u pacientů s poruchou příjmu potravy může vést ke změnám hladin cirkulujícího adiponektinu. U lidí byla prokázána negativní korelace mezi hladinami adiponektinu a body mass indexem (BMI), procentem tělesného tuku, koncentracemi inzulínu nalačno a hladinou triacylglycerolů v plazmě a pozitivní korelace s HDL cholesterolem. Chirurgická léčba morbidní obezity žaludeční bandáží vede ke zvýšení hladin adiponektinu v séru u diabetiků i nediabetických pacientů. Sérové koncentrace adiponektinu jsou snížené u pacientů s poruchou glukózové tolerance a DM2 a negativně korelují s hladinami plazmatické glukózy měřenými ve 2. hodině orálního glukózového tolerančního testu. Na základě experimentálních prací můžeme předpokládat, že adiponektin bude do budoucna vhodným kandidátem pro vývoj léků ovlivňujících obezitu a DM2. Sérové hladiny adiponektinu se zdají být vhodným biomarkerem pro sledování inzulínové senzitivity ve spektru pacientů s metabolickým syndromem a během terapeutické intervence u těchto stavů.
Aplikace adiponektinu, rekombinantního adiponektinu nebo léků stimulujících sekreci či působení adiponektinu může v budoucnu vést ke zlepšení inzulinové senzitivity a glukózové tolerance a k nápravě hyperglykémie spojené s obezitou. Vliv thiazolidindionů na sekreci adiponektinu může alespoň z části vysvětlit hypoglykemizující účinek těchto léků u pacientů s DM2. Adiponektin je biomarkerem spojujícím jednotlivé složky metabolického syndromu a může v lékařské praxi nalézt široké využití.
Adiponektin byl také identifikován v pupečníkové krvi, kde jeho hladiny korelují s porodní hmotností vzhledem ke gestačnímu věku, negativně korelují s hmotnostním přírůstkem v prvních 6 měsících života a jsou prediktivním faktorem přírůstku tukové tkáně v prvních 3 letech života dítěte [10]. Je známo, že sérové hladiny adiponektinu negativně korelují s množstvím tělesného tuku u dětí mezi 5. a 10. rokem života. Naopak u donošených dětí v prvních dnech života korelují sérové a plazmatické hladiny adiponektinu pozitivně s porodní hmotností a délkou, množstvím tukové tkáně novorozence a cirkulujícími hladinami leptinu. U nedonošených dětí jsou sérové hladiny adiponektinu nižší než u donošených, korelují pozitivně s tělesnou hmotností a zvyšují se s postnatálním věkem. To je pravděpodobně odrazem poporodní metabolické adaptace nedonošeného dítěte [11].
Adiponektin byl v MM poprvé popsán v roce 2006 současně naším výzkumným týmem [12] a týmem Dr. Martin [13]. Vzhledem k biologickým vlastnostem adiponektinu, jeho přítomnosti v MM a přítomnosti AdipoR1 ve sliznici tenkého střeva u myší [14] a AdipoR1 a R2 ve sliznici kolon u lidí [15], je možné, že se adiponektin v MM podílí na programování některých fyziologických funkcí kojence. Weyermann a spol. popsali vyšší hladiny adiponektinu v MM matek, jejichž děti měly nadváhu ve 2 letech věku a byly kojeny alespoň 6 měsíců [16]. Náš výzkumný tým publikoval také změny koncentrací adiponektinu v MM v průběhu 12 měsíců laktace [17].
Leptin
Leptin (16 kDa) je cytokin produkovaný buňkami tukové tkáně a jeho sérové hladiny významně korelují s množstvím tukové tkáně v organismu u dospělých i u dětí a s BMI u dětí. Leptin je hlavním signálem adipocytů, který zprostředkuje centrálnímu nervovému systému informaci vedoucí k inhibici příjmu potravy a zvýšení energetického výdeje. Objev leptinu byl publikován v roce 1994 [18], i když již v roce 1950 byla popsána genová mutace v leptinovém genu (ob gen) u myší, která vedla k rozvoji morbidní obezity a diabetu již v časném věku.
Leptin má v organismu řadu receptorů. Dlouhá forma leptinového receptoru má v intracelulární doméně 303 aminokyselinových zbytků, zatímco krátká forma jen 34. Extracelulární domény obou typů receptorů jsou shodné. Mutace v genu pro leptinový receptor (db gen) vede také ke vzniku obezity. Krátká forma leptinového receptoru se vyskytuje především v buňkách chorio-ideálního plexu a předpokládá se, že se účastní regulace transportu leptinu ze séra přes hematoencefalickou bariéru [19].
Byla popsána korelace plazmatických hladin leptinu s jeho hladinami v mozkomíšním moku. Podání rekombinantního leptinu do CNS vede ke snížení příjmu potravy a tělesné hmotnosti u leptin-deficitních myší. Periferním podáním se dosáhne obdobného efektu, ale při použití vyšších dávek. Podání leptinu jedincům s prostou obezitou nemá očekávaný efekt, neboť tito jedinci jsou hyperleptinemičtí a předpokládá se u nich leptinová rezistence [20]. Dlouhá forma leptinového receptoru je exprimována na hypothalamických neuronech, které produkují NPY. Podání leptinu inhibuje tvorbu NPY a ovlivňuje i melanokortinový systém. Také neurony produkující orexiny jsou spolu s leptinem zapojeny do hypothalamických regulačních okruhů příjmu potravy. Chronická intraperitoneální aplikace leptinu působí významné snížení exprese preproorexinové mRNA v hypothalamu. Byla publikována práce, která popisuje rozvoj řady symptomů leptinové deficience při blokádě exprese leptinového receptoru v buňkách tukové tkáně, i přesto, že hlavním místem působení leptinu je CNS [21].
Leptin se u novorozence podílí na rozvoji hypothalamických drah centrální regulace energetické rovnováhy a příjmu potravy. Studie na myších prokázaly, že působením na mozkovou tkáň v kritické vývojové periodě se leptin podílí na utváření nervových okruhů, které kontrolují příjem potravy a množství tukové tkáně v pozdějších fázích vývoje.
Leptin je přítomen v pupečníkové krvi od druhého trimestru intrauterinního života a koreluje s množstvím tukové tkáně v době porodu [22]. U člověka koncentrace leptinu v pupečníkové krvi negativně koreluje s intrauterinním růstem. Předpokládá se, že leptin se podílí na regulaci růstu plodu. Hypotrofičtí novorozenci mají při narození nižší hladiny leptinu než novorozenci s normální porodní hmotností, zatímco novorozenci hypertrofičtí mají hladiny leptinu vyšší [23]. Koncentrace leptinu v pupečníkové krvi také negativně koreluje s hmotnostním přírůstkem v prvních 6 měsících života a BMI ve 3 letech [10].
Leptin je přítomen v MM člověka [24]. Je tvořen a secernován epiteliálními buňkami prsní žlázy ve formě tukových mikrokapének [25]. Přes tyto epiteliální buňky také probíhá transport leptinu z krve do MM [26]. Koncentrace leptinu jsou vyšší v plném MM než v odstředěném MM [27], pravděpodobně proto, že leptin je vázán na tukové kapénky nebo jejich proteiny. Koncentrace leptinu je vyšší v kolostru než v přechodném MM (4-5 dnů po porodu) [28]. Receptory pro leptin byly nalezeny ve sliznici žaludku i tenkého střeva na myším modelu i u člověka [29]. Je možné, že leptin přechází z MM do krve kojence a může se podílet na krátkodobé regulaci příjmu potravy. Leptin podaný perorálně novorozeným myším byl přímo absorbován žaludeční sliznicí a vedl ke zvýšení hladin leptinu v séru. Po odstavení měly tyto myši po konzumaci stravy bohaté na tuk významně nižší hmotnost a nižší množství tělesného tuku v dospělosti, vyšší inzulínovou senzitivitu a menší chuťovou preferenci pro stravu bohatou na tuk [30]. Leptin v MM může z krátkodobého hlediska také působit u kojence jako signál sytosti [31, 32]. Koncentrace leptinu v MM pozitivně korelují se sérovými hladinami leptinu, BMI a množstvím tělesného tuku u matky [33] a s plazmatickými hladinami leptinu u dítěte [34]. Kojené děti mají v prvních měsících života vyšší sérové hladiny leptinu než děti živené náhradní kojeneckou mléčnou výživou. Sérové hladiny leptinu u kojených dětí také korelují s BMI matky [35]. Koncentrace leptinu v MM neobézních matek v 1. měsíci laktace negativně koreluje s BMI dítěte v 18 a 24 měsících života [36]. Lage a spol. nalezl leptin v komerčně dostupném kravském mléce a v přípravcích náhradní kojenecké mléčné výživy [37]. Ke stanovení však použil metodu RIA, která dle O’Connor a spol. není pro tuto analýzu vhodná vzhledem k interferenci železa, emulsifikátorů a dalších aditiv, kterými jsou tato mléka pro náhradní kojeneckou výživu suplementována [38]. Stále tedy není známo, zda je leptin v přípravcích náhradní kojenecké mléčné výživy přítomen.
Rezistin
Rezistin (12 kDa) byl objeven v roce 2001 jako jeden z adipocytokinů [39]. Účastní se regulace inzulínové senzitivity a diferenciace adipocytů. Název „rezistin“ je odvozen od jeho asociace s inzulínovou rezistencí u myší. Ovšem homologie mezi myším a lidským rezistinem je jen 64 % a u člověka je význam tohoto hormonu v regulaci inzulínové senzitivity menší. Rezistin je produkován nejen tukovou tkání, ale také v žaludku, střevě, nadledvinách, varlatech a kosterním svalstvu. Hladovění vede ke snížení tvorby rezistinové mRNA v tukové tkáni. U obézních jedinců jsou cirkulující hladiny rezistinu v krvi zvýšené, při redukci tělesné hmotnosti klesají [4]. Myši s nefunkčním genem pro rezistin mají zlepšenou glukózovou toleranci. Rezistin také snižuje příjem potravy působením na hypothalamická centra [40].
Rezistin byl nedávno identifikován v MM [41]. Icol a spol. popsali postupný pokles koncentrací rezistinu v MM v průběhu laktace. Hladiny rezistinu v MM i v séru pozitivně korelují s hladinami dalších hormonů (estradiol, progesteron, prolaktin, thyroxin, trijodothyronin, kortizol a leptin) a také s hladinami C-reaktivního proteinu (CRP). Hladiny rezistinu v séru kojenců jsou vyšší než hladiny v MM či v séru jejich matek. Koncentrace rezistinu v pupečníkové krvi korelují pozitivně s koncentracemi rezistinu v séru matek a negativně s porodní hmotností novorozence [42]. Dosud však není známo, jakou roli hraje rezistin ve vývoji plodu či kojence.
Ghrelin
Ghrelin (4 kDa) je jediný známý periferní orexigenní peptid. Skládá se z 28 aminokyselinových zbytků a je tvořen především v enteroendokrinních buňkách žaludeční sliznice a v menší míře také ve sliznici tenkého a tlustého střeva, pankreatu a dalších orgánech včetně CNS. Ghrelin stimuluje vyplavování růstového hormonu, prolaktinu a adrenokortikotropního hormonu (ACTH), má orexigenní aktivitu, ovlivňuje žaludeční motilitu a sekreci, kardiovaskulární a pankreatické funkce, metabolismus glukózy a má antiproliferativní efekt. Je považován za komplementární prvek k leptinu [43]. Ghrelin byl objeven v roce 1999 jako přirozený ligand „sirotčího” receptoru GHS1a, který je specifický pro skupinu syntetických peptidů (growth hormone secretagogues – GHS) podporujících sekreci růstového hormonu [44]. Plazmatické hladiny ghrelinu odrážejí krátkodobé změny příjmu potravy i dlouhodobé změny nutričního stavu organismu. Jsou snížené po příjmu potravy a u obézních jedinců [45], naopak zvýšené jsou při lačnění a u pacientů s mentální anorexií. Plazmatické hladiny ghrelinu u člověka negativně korelují s BMI, množstvím tělesného tuku, velikostí adipocytů, plazmatickými hladinami inzulínu, glukózy a leptinu [46]. Vzestup hladin ghrelinu bezprostředně před příjmem potravy naznačuje, že ghrelin hraje úlohu v přípravné fázi – jako metabolický signál pocitu hladu. U hlodavců zvyšuje aplikace ghrelinu tělesnou hmotnost a množství tukové tkáně prostřednictvím zvýšení příjmu potravy i snížením energetického výdeje [47].
V placentě je ghrelin přítomen především v cyto-trofoblastu, méně pak v syncytiotrofoblastu. Úloha ghrelinu v autokrinních, parakrinních i endokrinních mechanismech fetálně-maternální interakce je předmětem studií [48]. Hladiny ghrelinu vzrůstají ve třetím týdnu těhotenství a klesají v pozdních stadiích gestace. U novorozenců byla popsána přítomnost imunoreaktivního ghrelinu v pupečníkové krvi [49].
Ghrelin byl také identifikován v MM. Je tvořen buňkami mléčné žlázy, ale částečně přechází do MM i z plazmy [50]. Koncentrace ghrelinu v MM jsou dokonce vyšší než koncentrace plazmatické [51]. V MM byl také prokázán tzv. „aktivní ghrelin“ – acylovaná forma ghrelinu s plnou biologickou účinností. Jeho koncentrace v MM stoupají během laktace a korelují se sérovými hladinami ghrelinu u kojenců [52]. Byla popsána korelace mezi cirkulujícími hladinami ghrelinu a věkem, hmotností a tělesnou délkou u kojenců v průběhu časného kojeneckého období a negativní korelace s přírůstkem hmotnosti u dětí, které byly kojeny alespoň po dobu 4 měsíců, nikoliv však u dětí nekojených. U nekojených dětí krmených výhradně náhradní kojeneckou mléčnou výživou byly nalezeny vyšší sérové hladiny ghrelinu [53] a jejich pozitivní korelace s dobou mezi jídly (fasting time) v prvních 6 měsících života. Ghrelin přítomný v MM může být jedním z faktorů, jejichž prostřednictvím je regulován příjem potravy a potravní chování kojeného dítěte a následně i tělesné složení v pozdějším věku.
Obestatin
Obestatin (2,5 kDa) je nově objevený peptid odvozený od ghrelinového genu, který snižuje příjem potravy působením přes receptor GRP39 [54]. Obestatin se skládá z 23 aminokyselinových zbytků a je odvozen od ghrelinového prekurzoru preproghrelinu. Je tvořen v žaludeční sliznici, tenkém střevě a slinných žlazách [55]. Obestatin snižuje příjem potravy, tělesnou hmotnost a vyprazdňování žaludku a potlačuje střevní motilitu. Bylo rovněž popsáno, že obestatin potlačuje pocit žízně a úzkost, zlepšuje paměť, reguluje spánkový cyklus, stimuluje buněčnou proliferaci a zvyšuje exokrinní pankreatickou sekreci [56]. Plazmatické hladiny obestatinu jsou zvýšené u pacientů s mentální anorexií, u kterých by mohl být markerem krátkodobých i dlouhodobých změn nutričního stavu. Jeho úloha v regulaci příjmu potravy a mechanismus účinku nejsou dosud plně prostudovány. Pokud bude anorektický efekt obestatinu potvrzen, mohl by se stát dalším z potenciálních kandidátů pro léčbu obezity.
Obestatin byl popsán v MM v roce 2008 [57]. Aydin a spol. stanovili hladiny obestatinu u 31 kojících matek v séru, v kolostru (den 2. po porodu) a ve zralém MM (den 25.). Nalezli více než 2x vyšší koncentrace v MM (jak v kolostru tak ve zralém MM) než v séru. Není známo, zda je obestatin tvořen přímo buňkami mléčné žlázy či je secernován do MM ze séra. Fyziologický efekt tohoto hormonu v kojeneckém organismu nebyl dosud identifikován.
Inzulínu podobný růstový faktor-1 (Insulin-Like Growth Factor-1, IGF-1)
IGF jsou polypeptidové molekuly s jedním řetězcem a třemi sulfidovými můstky. IGF-1 je jednořetězcový bazický peptid tvořený 70 aminokyselinovými zbytky s molekulovou hmotností 7,65 kDa a IGF-2 je lehce kyselý peptid tvořený 67 aminokyselinovými zbytky s molekulovou hmotností 7,47 kDa. Nejpodstatnější pro zprostředkování účinku růstového hormonu (RH) je IGF-1. IGF-2 pravděpodobně sehrává významnou roli především v embryonálním a časném fetálním vývoji [58].
Důležitým rozdílem mezi IGF-1 a inzulínem je jejich odlišný poločas v krvi. Zatímco inzulín má poločas 4 minuty a jeho sekrece je pulzatilní, reaguje tedy na akutní změny metabolické situace, poločas IGF-1 je přibližně 15 hodin. To znamená, že reguluje metabolismus v dlouhodobějším horizontu. Delší poločas je zajištěn vazbou na plazmatické vazebné proteiny (IGFBP-1 - IGFBP-6). Stanovení hladiny celkového IGF-1 z jednoho krevního odběru podává validní a reprodukovatelnou informaci o jeho sekreci [59].
IGF-1 působí prostřednictvím několika typů receptorů – IR (inzulínový receptor), IGF-IR, IGF-IIR, dále několika atypických receptorů včetně receptoru podobného inzulínovému receptoru (insulin receptor-related receptor) a hybridního receptoru IR-IGF-IR. Hlavním zdrojem cirkulujícího IGF jsou játra. Lokální - autokrinní a parakrinní - působení IGF je považováno za důležitý moment v regulaci růstu a diferenciaci tkání. Z tohoto důvodu je třeba při interpretaci poznatků o IGF vždy důsledně diferencovat mezi cirkulujícími hladinami IGF a jeho tkáňovými hladinami.
Sekreci IGF-1 ovlivňují srovnatelnou měrou tři faktory: RH, výživa a cytokiny. Hladiny IGF-1 se snižují při dlouhodobém hladovění a celkově špatném nutričním stavu, ale nejsou bezprostředně ovlivněny příjmem potravy. Nízké hladiny IGF-1 byly nalezeny u dětí s celiakií, u pacientek s mentální anorexií a u dětí s cystickou fibrózou. Také aktivace imunitního systému při různých formách zánětu vede k supresi hladin IGF-1. To bylo prokázáno u pacientů v septickém stavu, při systémových onemocněních či malignitách, ale i po polytraumatu či vážném operačním zákroku. Signálem k supresi hladiny IGF-1 jsou velmi pravděpodobně cytokiny, zvláště interleukin-6. Dále je sekrece IGF-1 modulována i dalšími působky, zejména pohlavními hormony, inzulínem, kortizolem a hormony štítné žlázy [59].
Klagsburn poprvé prokázal v MM přítomnost faktoru, který stimuloval růst buněk v buněčné kultuře. Baxter a spol. v MM identifikovali IGF-1 [60]. Hladiny IGF-1 jsou několikanásobně vyšší v kolostru než ve zralém MM a snižují se během několika dnů po začátku laktace. IGF-1 hraje klíčovou roli v embryonálním a postnatálním vývoji. Hladiny IGF-1 v pupečníkové krvi korelují s porodní hmotností novorozence. U dětí s intrauterinní růstovou retardací jsou hladiny IGF-1 v pupečníku snížené ve srovnání s eutrofickými novorozenci. Děti krmené náhradní kojeneckou mléčnou výživou mají vyšší sérové hladiny IGF-1 než děti kojené [53]. U zdravých dětí v prvních 5 měsících života byla prokázána pozitivní korelace mezi hladinami IGF-1 a Z-skóre tělesné hmotnosti, BMI, tloušťkou kožní řasy nad tricepsem a věkem. V tomto období se u kojenců předpokládá utváření hormonální osy IGF-1. V poslední době byly v MM identifikovány také IGFBP [61].
Vazebné proteiny mastných kyselin (fatty acid binding proteins, FABP)
FABP (13-14 kDa) jsou přítomny v mnoha tkáních různých živočišných druhů a jsou fylogeneticky vysoce konzervované. Patří do velké skupiny tzv. „intracellular lipid binding proteins“ (iLBPs), které ovlivňují transport a metabolismus různých lipofilních ligandů v cytosolu buněk [62]. Úloha různých FABP je různá podle toho, v jaké tkáni jsou exprimovány. U savců je známo celkem 8 různých druhů FABP, všechny sdílejí identickou genovou strukturu (4 konzervované exony + 3 introny o různé délce). Předpokládá se, že se podílejí zejména na:
- vstupu mastných kyselin (MK) do buňky
- vytváření intracelulárního poolu MK pro jejich rychlé metabolické využití
- zabránění detergenčního účinku MK na intracelulární struktury
- usměrňování MK do různých metabolických drah a modulaci enzymatických aktivit
- intracelulární signalizaci a genové regulaci zprostředkované MK
- ovlivnění buněčného růstu a diferenciace
Obzvláště bohaté na FABP jsou tkáně, kde probíhá intenzivní metabolismus MK. Exprese FABP se zvyšuje při vzestupu intracelulární koncentrace MK, která vede k aktivaci nukleárních transkripčních faktorů, zejména podtypů PPAR. Je známo, že přirozenými ligandy PPAR jsou zejména MK s dlouhým řetězcem a některé eikosanoidy. FABP ve spojení se svými lipofilními ligandy (např. MK nebo xenobiotiky) mohou také vstoupit do buněčného jádra a ovlivnit buněčný cyklus [63]. V experimentu ztráta funkce AFABP (adipocytární FABP) vede na lidských buněčných liniích k rozvoji karcinomu. Aplikace EFABP (epidermální FABP) do kůže snižuje proliferaci buněk melanomu bez ovlivnění nenádorových buněk – fibroblastů. BFABP (mozkový FABP) na myším modelu potlačuje růst buněk karcinomu prsu [63]. V poslední dekádě byl zaznamenán velký pokrok ve výzkumu struktury a vazebných interakcí FABP. Nyní je pozornost obrácena zejména na mechanismy jejich genové exprese a interakce s ostatními proteiny uvnitř buňky.
AFABP je predominantním cytosolickým proteinem zralých adipocytů (cca 6% celkových buněčných proteinů), který byl v poslední době označen za významný regulátor inzulínové senzitivity a metabolismu lipidů a glukózy. U člověka je AFABP považován za biomarker obezity a metabolického syndromu [64]. Nedávno bylo zjištěno, že AFABP není výhradně cytosolickým proteinem, ale je také adipocyty secernován do krve. Jeho sérové hladiny jsou signifikantně zvýšené u obézních jedinců a pozitivně korelují s obvodem pasu, hodnotou krevního tlaku, parametry lipidového metabolismu, hladinou inzulínu nalačno a indexem inzulínové rezistence (HOMA). Navíc jsou hladiny AFABP vyšší u osob, které mají více složek metabolického syndromu. Sérové hladiny AFABP se liší u jedinců s přechodným a permanentním snížením tělesné hmotnosti. Myši s deficitem AFABP jsou chráněny před rozvojem hyperinzulinémie, hyperglykémie a inzulínové rezistence. Jejich adipocyty mají sníženou schopnost lipolýzy a uvolňují 2-3 krát méně mastných kyselin. Vyřazení genu pro AFABP vedlo u myší ke snížení rizika rozvoje aterosklerózy [65]. AFABP je také exprimován v makrofázích, kde moduluje produkci prozánětlivých cytokinů a akumulaci esterů cholesterolu. Předpokládá se indukce jeho exprese prostřednictvím oxidovaných lipoproteinů o nízké hustotě (oxLDL) a suprese statiny.
V roce 1986 byly FABP izolovány z bovinní mléčné žlázy, kde jsou v komplexu s dalšími proteiny součástí membrány tukových kapének [66]. V mléčné žláze je exprimován zejména AFABP a HFABP (srdeční FABP). V roce 1992 bylo experimentálně prokázáno, že lipidy a další faktory obsažené v kolostru indukují aktivitu FABP ve střevě novorozených prasat a stimulují časný postnatální vývoj GIT. V roce 1993 byla exprese AFABP prokázána v myší mléčné žláze. Předpokládá se, že proteiny ze skupiny FABP působí jako diferenciační faktory na buňky mléčné žlázy a podporují syntézu mléčných proteinů. Maximální exprese FABP v mléčné žláze je dosaženo v průběhu laktace. Přítomnost AFABP a EFABP v MM člověka byla poprvé prokázána naším týmem v roce 2006 [12].
Podpořeno projektem (Ministerstva zdravotnictví) koncepčního rozvoje výzkumné organizace 00064203/6001 (FN MOTOL).
Do redakce došlo 30. 7. 2012
Adresa pro korespondenci:
Doc. MUDr. Jiří Bronský, Ph.D.
Pediatrická klinika FN Motol
V Úvalu 84
150 06 Praha 5 – Motol
email: bronsky@email.cz
Zdroje
1. Rajdl, D., Racek, J., Trefil, L., Steinerová, A., Korotvička, M., Stožický, F., Rokyta, Z. Vybrané rizikové faktory aterosklerózy a kojení. Klinická Biochemie a Metabolismus, 2005, 13(1), s. 36-39.
2. Savino, F., Liguori, S. A., Fissore, M. F., Oggero, R. Breast milk hormones and their protective effect on Obesity. Int. J Pediatr. Endocrinol., 2009, article number 327505, s. 1-8.
3. Nedvídková, J., Smitka, K., Kopský, V., Hainer V. Adiponectin, an adipocyte-derived protein. Physiol. Res., 2005, 54, s. 133-140.
4. Beltowski, J. Adiponectin and resistin – new hormones of white adipose tissue. Med. Sci. Monit., 2003, 9, RA55-61.
5. Fortuno, A., Rodriguez, A., Gomez-Ambrosi, J., Fruhbeck, G., Diez, J. Adipose tissue as an endocrine organ: role of leptin and adiponectin in the pathogenesis of cardiovascular diseases. J Physiol. Biochem., 2003, 59, s. 51-60.
6. Filippi, E., Sentinelli, F., Trischitta, V., et al. Association of the human adiponectin gene and insulin resistance. Eur. J Hum. Genet., 2004, 12, s. 199-205.
7. Yamauchi, T., Kamon, J., Ito, Y. et al. Cloning of adiponectin receptors that mediate antidiabetic metabolic effects. Nature, 2003, 423, s. 762-769.
8. Kershaw, E. E., Flier, J. S. Adipose tissue as an endocrine organ. J Clin. Endocrinol. Metab., 2004, 89, s. 2548-2556.
9. Lihn, A. S., Pedersen, S. B., Richelsen, B. Adiponectin: action, regulation and association to insulin sensiti-vity. Obes. Rev., 2005, 6, s. 13-21.
10. Mantzoros, C. S., Rifas-Shiman, S. L., Williams, C. J. et al. Cord blood leptin and adiponectin as predictors of adiposity in children at 3 years of age: a prospective cohort study. Pediatrics, 2009, 123, s. 682–689.
11. Siahanidou, T., Mandyla, H., Papassotiriou, G. P. et al. Circulating levels of adiponectin in preterm infants. Arch. Dis. Child, 2007, 92, F286–F290.
12. Bronsky, J., Karpisek, M., Bronska, E. et al. Adiponectin, adipocyte fatty acid binding protein, and epidermal fatty acid binding protein: proteins newly identified in human breast milk. Clin. Chem., 2006, 52, s. 1763-1770.
13. Martin, L. J., Woo J. G., Geraghty, S. R. et al. Adiponectin is present in human milk and is associated with maternal factors. Am. J Clin. Nutr., 2006, 83, s. 1106–1111.
14. Zhou, Y., Sun, X., Jin, L., Stringfield, T., Lin, L., Chen, Y. Expression profiles of adiponectin receptors in mouse embryos. Gene Expression Patterns, 2005, 5, s. 711–715.
15. Bronsky, J., Mitrova, K., Nevoral, J., Zamecnik J. Immunoexpression of type-1 adiponectin receptor in the human intestine. Cesk. Patol., 2012, 48(3), s. 165-166.
16. Weyermann, M., Brenner, H., Rothenbacher, D. Adipokines in human milk and risk of overweight in early childhood: a prospective cohort study. Epidemiology, 2007, 18, s. 722–729.
17. Bronsky, J., Mitrova, K., Karpisek, M., et al. Adiponectin, AFABP and leptin in human breast milk during twelve months of lactation. J Pediatr. Gastr. Nutr., 2011, 52, s. 474-477.
18. Zhang, Y., Proenca, R., Maffei, M., et al. Positional cloning of the mouse obese gene and its human homologue. Nature, 1994, 372, s. 425-432.
19. Munzberg H. Leptin-signaling pathways and leptin resistance. Forum Nutr., 2010, 63, s. 123-132.
20. Bjorbaek, C. Central leptin receptor action and resistance in Obesity. J Investig. Med., 2009, 57, s. 789-794.
21. Huan, J. N., Li, J., Han, Y., Chen, K., Wu, N., Zhao, A. Z. Adipocyte-selective reduction of the leptin receptors induced by antisense RNA leads to increased adiposity, dyslipidemia, and insulin resistance. J Biol. Chem., 2003, 278, s. 45638-45650.
22. Tsai, P. J., Yu, C. H., Hsu, S. P. et al. Cord plasma concentrations of adiponectin and leptin in healthy term neonates: positive correlation with birthweight and neonatal adiposity. Clin. Endocrinol., 2004, 61, s. 88–93.
23. Koistinen, H. A., Koivisto, V. A., Andersson, S. et al. Leptin concentration in cord blood correlates with intrauterine growth. J Clin Endocrinol. Metab., 1997, 82, s. 3328–3330.
24. Casabiell, X., Pineiro, V., Tome, M. A. et al. Presence of leptin in colostrum and/or breast milk from lactating mothers: a potential role in the regulation of neonatal food intake. J Clin. Endocrinol. Metab., 1997, 82, s. 4270–4273.
25. Smith-Kirwin, S. M., O’Connor, D. M., De Johnston, J. et al. Leptin expression in human mammary epithelial cells and breast milk. J Clin. Endocrinol. Metab., 1998, 83, s. 1810–1813.
26. Bonnet, M., Delavaud, C., Laud, K. et al. Mammary leptin synthesis, milk leptin and their putative physiological roles. Reproduct. Nutr. Dev., 2002, 42, s. 399–413.
27. Houseknecht, K. L., Mcguire, M. K., Portocarrero, C. P. et al. Leptin is present in human milk and is related to maternal plasma leptin concentration and adiposity. Biochem. Biophys. Res. Commun., 1997, 240, s. 742–747.
28. Bielicki, J., Huch, R., Von Mandach, U. Time-course of leptin levels in term and preterm human milk. Eur. J Endocrinol., 2004, 151, s. 271–276.
29. Barrenetxe, J., Villaro, A. C., Guembe, L. et al. Distribution of the long leptin receptor isoform in brush border, basolateral membrane, and cytoplasm of enterocytes. Gut, 2002, 50, s. 797–802.
30. Sanchez, J., Oliver, P., Miralles, O. et al. Leptin orally supplied to neonate rats is directly uptaken by the immature stomach and may regulate shortterm feeding. Endocrinology, 2005, 146, s. 2575–2582.
31. Stocker, C. J., Cawthorne, M. A. The influence of leptin on early life programming of Obesity. Trends in Biotechnology, 2008, 26, s. 545–551.
32. Palou, A., Pic, C. Leptin intake during lactation prevents Obesity and affects food intake and food preferences in later life. Appetite, 2009, 52, s. 249–252.
33. Ilcol, Y. O., Hizli, Z. B., Ozkan, T. Leptin concentration in breastmilk human and its relationship to duration of lactation and hormonal status. Int. Breastfeeding, 2006, J 17, s. 1–21.
34. Ucar, B., Kirel, B., Bor, O. et al. Breast milk leptin concentrations in initial and terminal milk samples: relationships to maternal and infant plasma leptin concentrations, adiposity, serum glucose, insulin, lipid and lipoprotein levels. J Pediatr. Endocrin. Metab., 2000, 13, s. 149–156.
35. Savino, F., Liguori, S. A., Oggero, R. et al. Maternal BMI and serum leptin concentration of infants in the first year of life. Acta Pædiatr., 2006, 95, s. 414–418.
36. Miralles, O., Sanchez, J., Palou, A., Pic, C. A physiological role of breast milk leptin in body weight control in developing infants. Obesity, 2006, 14, s. 1371–1377.
37. Lage, M., Baldelli, R., Camina, J. P., et al. Presence of bovine leptin in edible commercial milk and infant formula. J Endocrin. Invest., 2002, 25, s. 670–674.
38. O’Connor, D., Funanage, V., Locke, R. et al. Leptin is not present in infant formulas. J Endocrinol. Invest., 2003, 26, s. 490.
39. Steppan, C. M., Bailey, S. T., Bhat, S., et al. The hormone resistin links Obesity to Diabetes. Nature, 2001, 409, s. 307–312.
40. Tovar, S., Nogueiras, R., Tung, L. Y., et al. Central administration of resistin promotes short-term satiety in rats. Eur. J Endocrinol., 2005, 153, R1–R5.
41. Ilcol, Y. O., Hizli, Z. B., Eroz, E. Resistin is present in human breast milk and it correlates with maternal hormonal status and serum level of C-reactive protein. Clin. Chem. Lab. Med., 2008, 46, s. 118–124.
42. Cho, G. J., Yoo, S. W., Hong, S. C. et al. Correlations between umbilical and maternal serum resistin levels and neonatal birth weight. Acta Obstetr. et Gynecol. Scand., 2006, 85, s. 1051–1056.
43. Shintani, M., Ogawa, Y., Ebihara, K., et al. Ghrelin, an endogenous growth hormone secretagogue, is a novel orexigenic peptide that antagonizes leptin action through the activation of hypothalamic neuropeptide Y/Y1 receptor pathway. Diabetes, 2001, 50, s. 227 – 232.
44. Kojima, M., Hosoda, H., Date, Y., et al. Ghrelin is a growth-hormone-releasing acylated peptide from stomach. Nature, 1999, 402, s. 656 – 660.
45. Tschop, M., Weyer, C., Tataranni, P. A., et al. Circulating ghrelin levels are decreased in human Obesity. Diabetes, 2001, 50, s. 707–709.
46. Bacha, F., Arslanian, S. A. Ghrelin suppression on overweight children: a manifestation of insulin resistance? J Clin. Endocrinol. Metab., 2005, 90, s. 2725-2730.
47. Tschop, M., Smiley, D. L., Heiman, M. L. Ghrelin induces adiposity in rodents. Nature, 2000, 407, s. 908–913.
48. Gualillo, O., Caminos, J., Blanco, M. et al. Ghrelin, a novel placental-derived hormone. Endocrinology, 2001, 142, s. 788–794.
49. Chanoine, J. P., Yeung, L., Wong, A., Birmingham, C. L. Immunoreactive Ghrelin in Human Cord Blood: Relation to Anthropometry, Leptin, and Growth Hormone. J Pediatr. Gastroenterol. Nutr., 2002, 35, s.: 282–286.
50. Aydin, S., Aydin, S., Ozkan, Y., Kumru, S. Ghrelin is present in human colostrum, transitional and mature milk. Peptides, 2006, 27, s. 878–882.
51. Kierson, J., Dimatteo, D., Locke, R. G. et al. Ghrelin and cholecystokinin in term and preterm human breast milk. Acta Pædiatrica, 2006, 95, s. 991–995.
52. Ilcol, Y. O., Hizli, Z. B. Active and total ghrelin concentrations increase in breast milk during lactation. Acta Pædiatr., 2007, 96, s. 1632–1639.
53. Savino, F., Fissore, M. F., Grassino, E. C. et al. Ghrelin, leptin and IGF-I levels in breastfed and formula-fed infants in the first years of life. Acta Pædiatr., 2005, 94, s. 531–537.
54. Zhang, J. V., Ren, P. G., Avsian-Kretchmer, O., et al. Obestatin, a peptide encoded by the ghrelin gene, opposes ghrelin’s effects on food intake. Science, 2005, 310, s. 996–999.
55. Ozbay, Y., Aydin, S., Dagli, A. F., et al. Obestatin is present in saliva: alterations in obestatin and ghrelin le-vels of saliva and serum in ischemic heart disease. BMB Reports, 2008, 41, s. 55–61.
56. Tang, S. Q., Jiang, Q. Y., Zhang, Y. L., et al. Obestatin: iots physiochemical characteristics and physiological functions. Peptides, 2008, 29, s. 639–645.
57. Aydin, S., Ozkan, Z., Erman, F. et al. Presence of obestatin in breast milk: relationship among obestatin, ghrelin, and leptin in lactating women. Nutrition, 2008, 24, s. 689–693.
58. Backeljauw, P., Bang, P., Clayton, P. E., et al. Dia-gnosis and management of primary insulin-like growth factor-I deficiency: current perspectives and clinical update. Pediatr. Endocrinol. Rev., 2010, 7, s. 154-171.
59. Duan, C., Ren, H., Gao, S. Insulin-like growth factors (IGFs), IGF receptors, and IGF-binding proteins: roles in skeletal muscle growth and differentiation. Gen Comp. Endocrinol., 2010, 167, s. 344-351.
60. Baxter, R. C., Zaltsman, Z., Turtle, J. R. Immunorea-ctive somatomedin-C/insulin-like growth factor I and its binding protein in human milk. J Clin. Endocrinol. Metab., 1984, 58, s. 955–959.
61. Elmlinger, M. W., Hochhaus, F., Loui, A. et al. Insulin-like growth factors and binding proteins in early milk from mothers of preterm and term infants. Horm. Res, 2007, 68, s. 124–131.
62. Storch, J., McDermott, L. Structural and functional analysis of fatty acid-binding proteins. J Lipid Res., 2009, 50, s. S126-131.
63. Schroeder, F., Petrescu, A. D., Huang, H., et al. Role of fatty acid binding proteins and long chain fatty acids in modulating nuclear receptors and gene transcription. Lipids, 2008, 43, s. 1-17.
64. Simon, I., Escote, X., Vilarrasa, N., et al. Adipocyte fatty acid-binding protein as a determinant of insulin sensitivity in morbid-obese women. Obesity, 2009, 17, s. 1124-1128.
65. Baar, R. A., Dingfelder, C. S., Smith, L. A., et al. Investigation of in vivo fatty acid metabolism in AFABP/aP2(-/-) mice. Am. J Physiol. Endocrinol. Metab., 2005, 288, E187-193.
66. Whetstone, H. D., Hurley, W. L., Davis, C. L. Identification and characterization of a fatty acid binding protein in bovine mammary gland. Comp. Biochem. Physiol. B, 1986, 85, s. 687-692.
Štítky
Biochémia Nukleárna medicína Nutričný terapeut
Článok vyšiel v časopiseKlinická biochemie a metabolismus
Najčítanejšie tento týždeň
2013 Číslo 1
-
Všetky články tohto čísla
- Význam a možnosti vyšetřování metabolismu mozku pomocí mikrodialýzy v neurointenzivní péči
- Stanovení sérových markerů v diferenciální diagnostice časného karcinomu prostaty (pilotní studie)
- Prevalence míry snížení glomelurální filtrace u pacientů s monoklonální gamapatií neurčeného významu
- Stanovení odhadu glomerulární filtrace eGFR - vývoj pokračuje
- Nové regulační hormony mateřského mléka
- Smuteční oznámení - Prof. Dr. Hermann Wisser
- Doporučení pro diagnostiku a léčbu onemocnění štítné žlázy v těhotenství a pro ženy s poruchou fertility
- Buněčnost likvoru, energetické poměry v likvorovém kompartmentu a intenzita zánětlivé odpovědi v centrálním nervovém systému
- Klinická biochemie a metabolismus
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Doporučení pro diagnostiku a léčbu onemocnění štítné žlázy v těhotenství a pro ženy s poruchou fertility
- Stanovení odhadu glomerulární filtrace eGFR - vývoj pokračuje
- Význam a možnosti vyšetřování metabolismu mozku pomocí mikrodialýzy v neurointenzivní péči
- Buněčnost likvoru, energetické poměry v likvorovém kompartmentu a intenzita zánětlivé odpovědi v centrálním nervovém systému
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



