-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Bimanu ální sekvenční motorická úloha u roztro ušené sklerózy mozkomíšní v obraze funkční magnetické rezonance: vliv fyzioterapeutických technik – pilotní studie
Bimanu al Tandem Motor Task with Multiple Sclerosis in Functi onal Magnetic Resonance Imaging: Effect of Physi otherape utic Techniques – a Pilot Study
Aim:
The aim of the study was to find out whether there is a difference in the pattern of brain activation (PBA) examined by means of functional magnetic resonance (fMRI) during a motor task in patients with multiple sclerosis (MS) and healthy probands (HP); and if it is possible to influence
clinical functions and PBA by means of neurorehabilitation (NRHB) and aerobic training (AT).Methods:
Twelve MS patients and five HP were examined twice – at the beginning and at the end of the two-month experiment. In its course, one half of the patients underwent NRHB and one half AT. We examined chosen clinical parameters and fMRI (motor task: a simple movement of each hand separately and a tandem movement of both hands).Results:
There was an improvement in postural functions (p = 0.008) in MS patients after the NRHB. The number of changes after NRHB was significantly higher (p = 0.009) in comparison to the group which underwent AT. The fMRI examination at the beginning of the experiment shows a statistically significant difference (p = 0.01) between MS and HP in the extent of the activated area in the collateral primary motor cortex hand, which carried out the movement as the second of the pair. This difference in the extent of activation between HP and MS reduced after both therapeutic programs and it was not significant after the therapy. If we understand this activation pattern as a manifestation of normal interhemispheric cooperation, then in this sense we can think of “recovery to normal”.Conclusion:
This pilot study signals that the by us considered PBA during the movement carried out by both hands differs in MS and HP. Further, it turned out that NRHB and AT influence the clinical manifestation of the disease as well as the pattern of brain activity. The results need further verification.Key words:
multiple sclerosis – rehabilitati on – aerobic exercise – functi onal magnetic resonance imaging – rehabilitati on – plasticity – central nervo us system
Autoři: K. Řasová 1,3; P. Brandejský 2; Jaroslav Tintěra 4; J. Krásenský 7; D. Zimová 6; E. Medová 6; A. Herbenová 1; H. Kalistová 3; R. Jech 3; M. Řasová 3; P. Zemanová 7; J. Zeman 8; I. Ibrahim 4; P. Martinková 9; D. Doležil 6; D. Jandová 1
Působiště autorů: Klinika rehabilitačního lékařství 3. LF UK a FN Královské Vinohrady, Praha, 2Ústav tělovýchovného lékařství 1. LF UK a VFN v Praze, 3Ne urologická klinika 1. LF UK a VFNv Praze, 4Klinika radi odi agnostiky a intervenční radi ologi e, odd. magnetické rezon 1
Vyšlo v časopise: Cesk Slov Neurol N 2009; 72/105(4): 350-358
Kategorie: Původní práce
Souhrn
Cíl:
Cílem studi e bylo zjistit, zda se liší vzorec mozkové aktivace (VMA) vyšetřené pomocí funkčního zobrazení magneticko u rezonancí (fMR) v průběhu motorické úlohy u nemocných s roztro ušeno u sklerózo u mozkomíšní (RS) a u zdravých subjektů (ZS) a zda je možné ovlivnit klinické funkce a VMA pomocí ne urorehabilitace (NRHB) a aerobního tréninku (AT).Metody:
Dvanáct nemocných s RS a pět ZS bylo vyšetřeno dvakrát – na začátku a na konci dvo uměsíčního experimentu, během nějž polovina nemocných podsto upila NRHB a polovina AT. Vyšetřeny byly vybrané klinické parametry a fMR (motorická úloha: jednoduchý pohyb každo u ruko u zvlášť a sekvenční pohyb obo u ruko u).Výsledky:
U nemocných s RS po NRHB došlo ke zlepšení posturálních funkcí (p = 0,008), množství změn v porovnání se skupino u, která prováděla AT, bylo signifikantně vyšší (p = 0,009). Vyšetření fMR na začátku experimentu ukazuje statisticky signifikantní rozdíl (p = 0,01) mezi RS a ZS v rozsahu aktivované oblasti v kontralaterální primární motorické oblasti ruky, která vykonala pohyb jako druhá v páru. Tento rozdíl v rozsahu aktivace mezi ZS a RS se po absolvování obo u terape utických programů zmenšil, a po terapii již nebyl signifikantní. Pokud chápeme tento aktivační vzorec jako projev fyzi ologické interhemisferální spolupráce, pak v této so uvislosti dochází u RS k „návratu k normě“.Závěr:
Námi uvažovaný VMA při pohybu prováděném jedno u a následně druho u ruko u u RS a ZS se liší. Dále ukázala, že NRHB a AT ovlivňují klinické projevy onemocnění i vzorec mozkové aktivity. Závěry je nutno dále ověřit.Klíčová slova:
roztro ušená skleróza mozkomíšní – ne urorehabilitace – aerobní trénink – funkční magnetická rezonance – plasticita – centrální nervový systémÚvod
Spolupráce mozkových hemisfér hraje důležitou roli při vykonávání celé řady motorických funkcí, například při koordinovaném pohybu obou horních končetin, taktilně‑motorickém učení, zrakově‑prostorových a zrakově‑percepčních dovednostech či při chování zaměřeném na dosažení cíle [1]. Její dysfunkce byla popsána u mnoha onemocnění, mimo jiné i u roztroušené sklerózy, kde může být způsobena poruchou modulační funkce corpus callosum [2–4] nebo poškozením bílé hmoty mozkové [5–7]. Má negativní dopad na neurologické funkce pacienta a jeho kvalitu života.
Námi publikované výsledky [8] ukázaly, že v některých mozkových oblastech (primární motorické oblasti, suplementární motorické oblasti a putamen) je závislost mezi pravou a levou hemisférou signifikantně větší u zdravých jedinců než u skupiny nemocných (čím je vyšší amplituda signálu v určité oblasti v levé mozkové hemisféře, tím je vyšší i v pravé, a čím je nižší v levé mozkové hemisféře, tím je nižší i v pravé). Usuzovali jsme, že je to pravděpodobně způsobeno dysfunkcí interhemisférické spolupráce u nemocných s RS. Neurorehabilitační léčba vedla k zesílení závislosti amplitudy signálu mezi pravou a levou hemisférou (rpřed = 0,434, rpo = 0,714). Síla závislosti se u nemocných s RS přiblížila (naznačen trend) zdravé populaci (r = 0,904). To jsme interpretovali jako zlepšení spolupráce mozkových hemisfér.
Současná studie byla navržena tak, aby mohla cíleněji sledovat změny interhemisferální spolupráce a potenciální změny aktivačního vzorce u fMR v souvislosti s pohybovým programem (neurorehabilitací a aerobním tréninkem). Cílem bylo zjistit, zda se liší vzorec mozkové aktivace vyšetřené pomocí fMR v průběhu vykonávání motorické úlohy u nemocných s RS a u zdravých subjektů. Dále nás zajímalo, zda a jakým způsobem je možné ovlivnit vybrané klinické funkce a vzorec mozkové aktivace v primární motorické oblasti (M1, gyrus precentralis) pomocí neurorehabilitace (NRHB) a aerobního tréninku (AT).
Metodika
Design studie
Dvanáct pacientů s RS a dvanáct zdravých dobrovolníků (vzhledem k technickým problémům jich bylo možné vyhodnotit pouze pět) bylo vyšetřeno dvakrát – a to na začátku a na konci dvouměsíčního programu. Během této doby šest pacientů absolvovalo dvakrát týdně po dobu jedné hodiny neurorehabilitační program (skupina 1)a šest aerobní trénink (skupina 2). Zdraví dobrovolníci neměnili své dosavadní zvyklosti (skupina 3).
Výběr a charakteristika pacientů
V průběhu roku 2006 bylo vybráno 12 pacientů z MS Centra Neurologické kliniky 1. LF UK a VFN v Praze, kteří splňovali daná kritéria (definitivně potvrzena diagnóza RS, maximální podobnost klinických projevů a průběhu onemocnění, remise onemocnění, EDSS 3–5, motorický deficit bez převahy cerebelárního nebo cerebrálního postižení, dominance posturálních poruch, dominance pravé ruky). Pacienti byli rozděleni na dvě skupiny následujícím způsobem: každá dvojice podobných pacientů byla náhodně rozdělena tak, že jeden z páru náležel do první skupiny a druhý do druhé skupiny. Zdravé subjekty byly vybrány tak, aby odpovídaly věkem a pohlavím danému rozložení pacientů a měly dominantní pravou ruku. Všichni účastníci studie podepsali informovaný souhlas.
Program
Neurorehabilitace: Aplikace podnětů senzomotorického učení fyzioterapeutem v přesně daných pozicích a motorických funkcích (sezení, vstávání, sedání, stání a chůze) tak, aby došlo k aktivaci motorického programu dané motorické funkce a vyvolání požadovaného pohybu [9,10].
Aerobní trénink na bicyklovém ergometru: Intenzita a délka zátěže byla určena individuálně na základě spiroergometrického vyšetření na bicyklovém ergometru EL 800, Ergoline/FRG (kontinuálně zvyšovaná zátěž v intervalech po jedné minutě až do pacientova subjektivního maxima, s hodnocením změn respiračních plynů a výpočtem vybraných parametrů) a na základě neurologického nálezu. Odvozená tréninková zátěž odpovídala přibližně 60 % individuální maximální spotřeby kyslíku. Aerobní část zahajovalo pětiminutové „rozcvičení“ na bicyklovém ergometru (s intenzitou 30 % individuální maximální spotřeby kyslíku). Pacienti začali s tréninkem po dobu 5 min a postupně, opět podle reakce na zátěž, prodlužovali dobu tréninku až na 20 min. Trénink byl zakončen 5minutovou aktivitou na bicyklovém ergometru (o intenzitě 30 % individuální maximální spotřeby kyslíku) a přerušen v případě nástupu svalové slabosti, třesu, spasticity, bolesti.
Vyšetření klinických parametrů
Zraková ostrost (LCLAT, Low-Contrast Letter Acuity Testing) [11], síla svalů (MI, Motoric Index) [12], spasticita (MAS, Modified Ashworth Scale) [13], rovnováha (BBS, Berg Balance Scale) [14], třes (T) [15], dysdiadochokinéza (DD) [16], dysmetrie (DM) [16], posturální reakce (pomocí Bobathova konceptu, PR) [17,18], kolenní zámek (vlastní test, KZ) [10], jemná motorika (NHPT, Nine Hole Peg Test) [19], chůze (TFW, Timed 25 – Foot Walk) [19] a kognitivní funkce (PASAT, Paced Auditory Serial Addition Test 3) [19] byly vyšetřeny pouze u pacientů na začátku a na konci programu nezávislým vyšetřujícím.
Funkční magnetická rezonance
Vyšetření fMR
Měření byla provedena na tomografu magnetické rezonance o velikosti pole 1.5T (Siemens Vision). K pokrytí celého mozku bylo měřeno 30 axiálních vrstev pomocí sekvence gradientního echa EPI (Echo Planar Imaging) s následujícími parametry: TE = 60 ms, TR = 3,33 s, sklápěcí úhel = 90°, FOV = 192 mm, matrix 64 × 64, velikost voxelu 3 × 3 × 3 mm3. Celé měření sestávalo ze 300 dynamických obrazů mozku zachycených v klidu a při řízeném pohybu ruky.
Motorická úloha
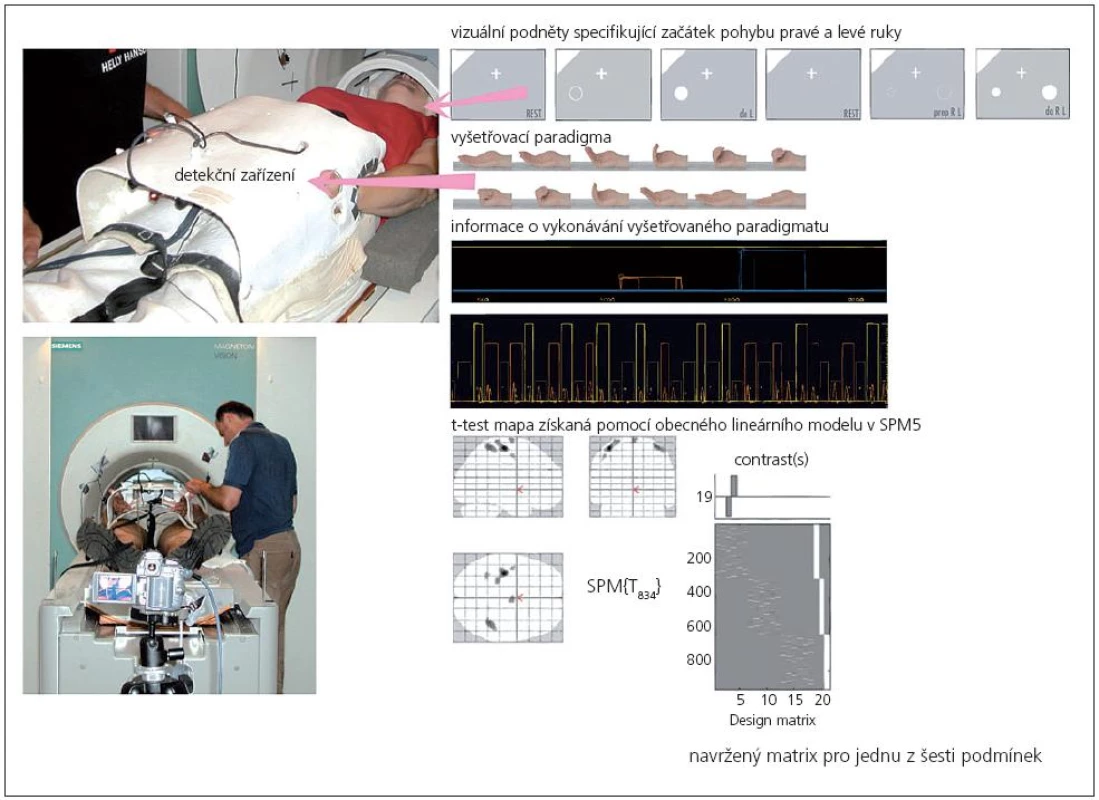
Pro fMR byl vybrán „event related“ design s aktivním pohybem, který reprezentovalo jednoduché sevření a otevření čtyř prstů v metakarpo-falangeálních kloubech (obr. 1). Během měření fMR byly použity čtyři různé typy motorické úlohy (obr. 1): pohyb pouze pravou rukou, pohyb pouze levou rukou, sekvence pravé-levé (PL) a levé-pravé (LP) ruky. Pohyb byl spouštěn vizuální informací na displeji a určoval začátek pohybu pravé a levé ruky, a začátek pohybu první ruky u sekvenčního pohybu obou horních končetin (pohyb druhou rukou následoval spontánně po ukončení pohybu první ruky). Způsob aktivace byl vybrán pseudonáhodným způsobem (počet provedení každé úlohy byl 9). Sevření a otevření trvaly přibližně 3 s. Minimální pauza mezi pohyby trvala 30 s.
Sledování motorického výkonu
Kvalita vykonávaného pohybu byla zajištěna tréninkem před vyšetřením. K výpočtu modelové hemodynamické funkce jako reakce na průběh pohybu sloužilo speciálně pro tuto studii připravené detekční zařízení (obr. 1). Detekční zařízení je tvořeno variabilním krunýřem přichyceným k pánevní oblasti ležícího pacienta, který fixuje ruce palci vzhůru tak, aby ostatní prsty mohly daný pohyb vykonat zcela volně. Pohyb je registrován optickou závorou – laserovým paprskem kolineárním s napřímeným palcem. Zařízení může zároveň sloužit ke kontrole kvality vyšetřovaného pohybu, protože zaznamenává dobu a rychlost pohybu. Pro případ, kdy by se nepodařilo vyhodnotit záznam z detekčního zařízení, bylo provedení pohybu paralelně zachycováno pomocí videorekordéru. Detekční zařízení i videorekordér byly synchronizovány s průběhem fMR experimentu.
Analýza obrazu
Celá analýza byla provedena v programuSPM5: korekce pohybových artefaktů (realignment), prostorové vyhlazení (spatial smoothing, FWHM o 8 mm) a normalizace. Statistické vyhodnocení dat bylo provedeno pomocí obecného lineárního modelu. Pro vyhodnocení bylo navrženo šest následujících podmínek: samostatná levá a pravá ruka, levá ruka jakožto navigační v sekvenčním úkolu (první z páru rukou), levá ruka jakožto tandemová (druhá z páru rukou), pravá ruka jakožto navigační v sekvenčním úkolu (první z páru rukou), pravá ruka jakožto tandemová (druhá z páru rukou). Pro každou podmínku a zkoumanou osobu byla spočítána t‑test mapa a pro její odprahování byl použit statistický práh p = 0,05 korigovaný na FDR (False Discovery Rate level). Individuální statistické mapy byly porovnány s ohledem na rozsah aktivací při konstantní statistické signifikaci „dle počtu voxelů“ (na t‑test mapě byl spočítán rozdíl počtu voxelů na statisticky významné úrovni při vstupním a výstupním vyšetření) a dále byly vypočteny statistické mapy rozdílu „v SPM“ (kontrast 1 a –1 v SPM). Také byla zhodnocena skupinová statistika.
Statistická analýza
Srovnání dvou skupin pacientů s RS, jakož i srovnání zdravé skupiny a skupiny nemocných bylo provedeno pomocí dvouvýběrového t‑testu. Párový t‑test byl použit pro posouzení změn mezi hodnotami na začátku a na konci programu v jednotlivých skupinách. Srovnání tří skupin bylo provedeno pomocí F-testu analýzy rozptylu. Výsledné p hodnoty byly korigovány na mnohonásobná porovnání pomocí Bonferroniho korekce. Výsledky signifikantní i po Bonferroniho korekci jsou v tabulkách označeny dvěma hvězdičkami, další signifikantní výsledky jsou označeny jednou hvězdičkou, tyto výsledky však vyžadují další ověření, optimálně na větším vzorku probandů.
Výsledky
Všichni pacienti i zdravé subjekty dokončili experimentální protokol. Vzhledem k problémům technického charakteru jsme byli schopni vyhodnotit fMR pouze u pěti zdravých subjektů (jejich charakteristika v tab. 1).
Tab. 1. Charakteristika skupin. 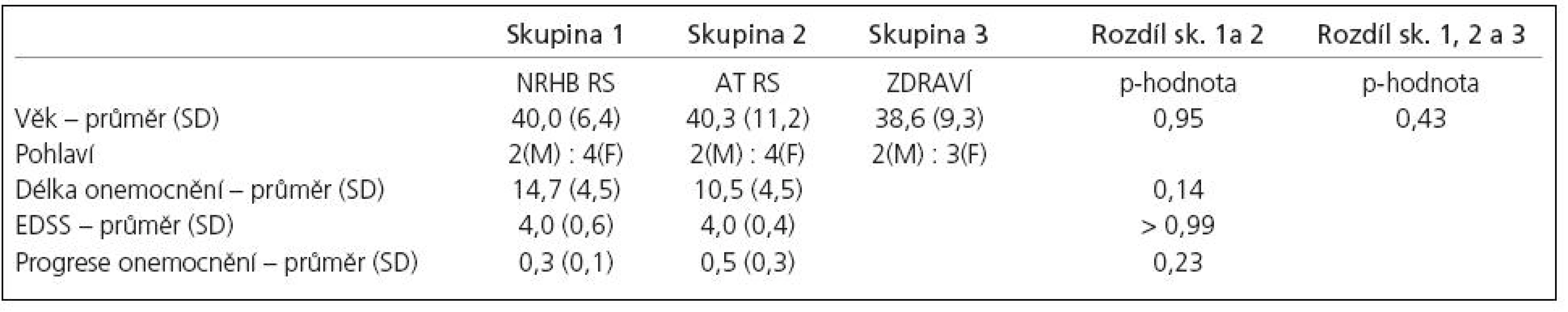
Charakteristika skupin
Stupeň neurologického postižení (EDSS) se u nemocných pohyboval od 3 do 4,5. Na začátku experimentu nebyl mezi všemi třemi skupinami prokázán žádný statistický rozdíl (tab. 1).
Klinické vyšetření
Skupina 1 se po neurorehabilitaci (průměrná doba aktivace programu pro řízený sed byla 125,8 ± 58,6 min, pro řízený stoj byla 68,3 ± 38,2 min) signifikantně zlepšila (p ≤ 0,05) ve svalové síle horních končetin, dysdiadochokinezi, kolenním zámku dolních končetin a v posturálních reakcích.
Skupina 2 se po aerobním tréninku (průměrná délka byla 15,8 ± 4,5 min, průměrná intenzita 53,3 ± 7,9 watt), signifikantně zlepšila (p ≤ 0,05) v kognitivním testu PASAT.
Množství změn bylo mezi dvěma RS skupinami signifikantně odlišné u posturálních reakcí (p = 0,008). Podrobnosti jsou dokumentovány v tab. 2.
Tab. 2. Změny vyšetřovaných klinických parametrů na začátku a na konci terapie. 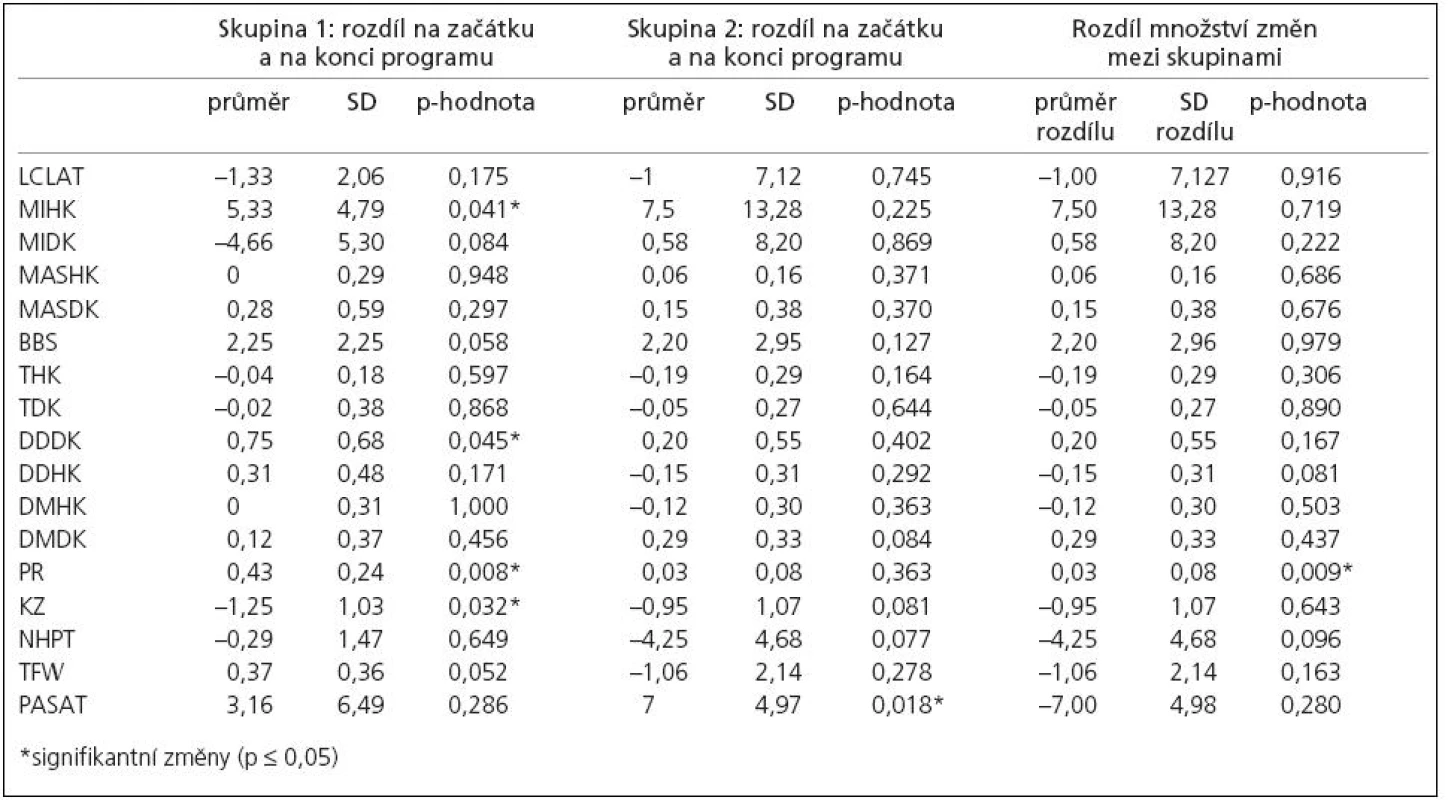
fMR
Způsob vykonání motorické úlohy se v průběhu experimentu nezměnil. U žádného vyšetřovaného nebyl zachycen tzv. zrcadlový pohyb.
Jak při jednoduché motorické úloze, tak při bimanuální sekvenční motorické úloze byla aktivována primární motorická oblast (M1) kontralaterálně, v některých případech suplementární motorická oblast (SMA). Méně často se zobrazovala primární motorická oblast ipsilaterálně a jednostranně či oboustranně cerebelum. Aktivace byla většinou rozsáhlejší u nemocných s RS (obr. 2). Po neurorehabilitaci byla aktivace některých mozkových oblastí kompaktnější (obr. 2), po aerobním tréninku se neměnila.
Obr. 2. Magneticko rezonanční obraz u vybraných probandů z každé skupiny na začátku a na konci programu. U pacienta, který absolvoval neurorehabilitaci, můžeme sledovat změnu vzorce mozkové aktivace. 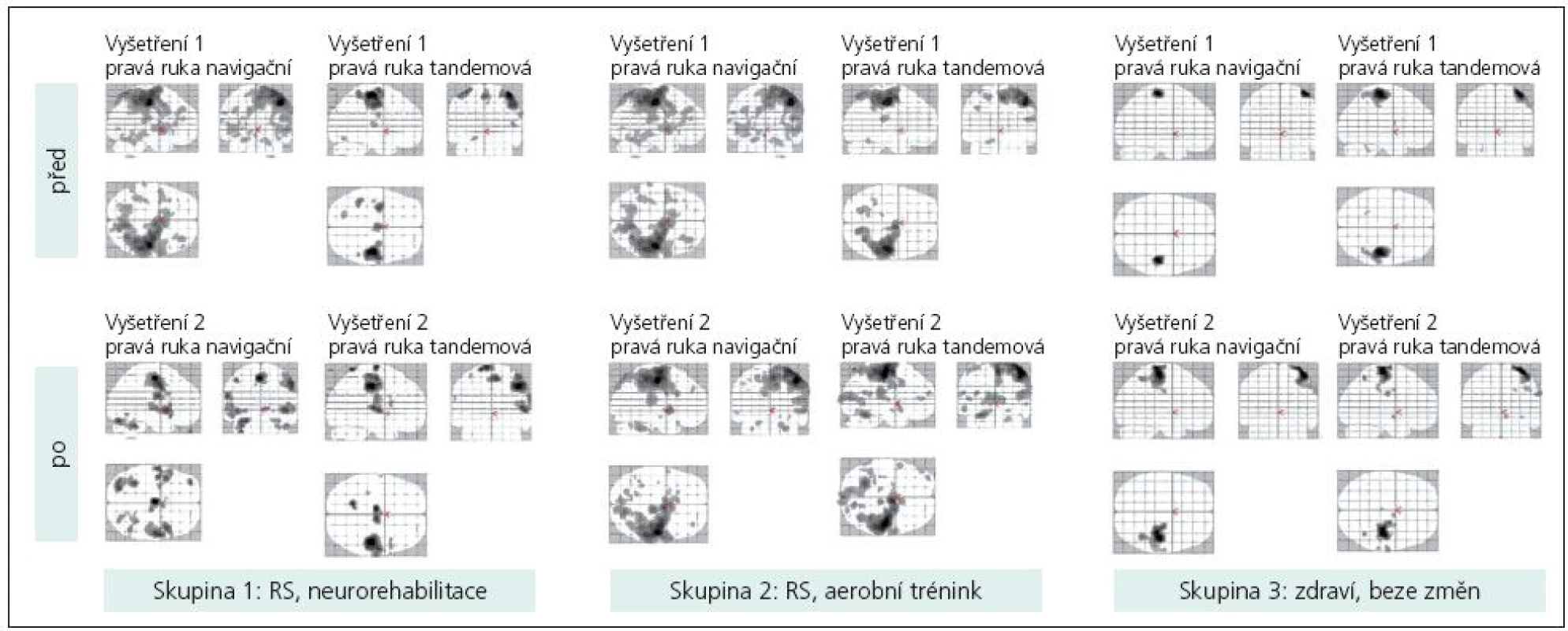
Během bimanuální sekvenční motorické úlohy (sekvence PL – pohyb je vykonán pravou rukou, kterou ihned následuje ruka levá a sekvence LP vice versa) jsme při hodnocení dle rozdílu počtu voxelů na statisticky významné úrovni (analýza SPM naznačuje podobný trend) zaznamenali typický vzorec mozkové aktivace pro „tandemovou“ ruku (jdoucí jako druhá), u něhož byl počet aktivovaných voxelů na dané statistické úrovni v M1 vyšší (minimálně 1,5krát) než pro „navigační“ ruku (jdoucí jako první).
V sekvenci LP pro pravou ruku jsme našli tento vzorec u 70 % zdravých jedinců během prvního i druhého vyšetření. Tento vzorec byl zaznamenán průměrně u 25 % všech pacientů s RS. Po dvouměsíční neurorehabilitaci se frekvence tohoto „normálního“ vzorce zvýšila, po aerobním tréninku se nepatrně snížila.
V sekvenci PL pro levou ruku jsme našli tento vzorec u 60 % zdravých jedinců při prvním vyšetření. Objevil se i u necelých 60 % pacientů s RS. Po dvouměsíční neurorehabilitaci se frekvence tohoto vzorce zvýšila, po aerobním tréninku se nijak nezměnila (tab. 3, obr. 2).
Tab. 3. Semi-kvantitativní hodnocení platnosti formule „Pro tzv. tandemovou ruku je počet aktivovaných voxelů na dané statistické úrovni v M1 oblasti minimálně 1,5krát vyšší než pro tzv. navigační ruku.“ 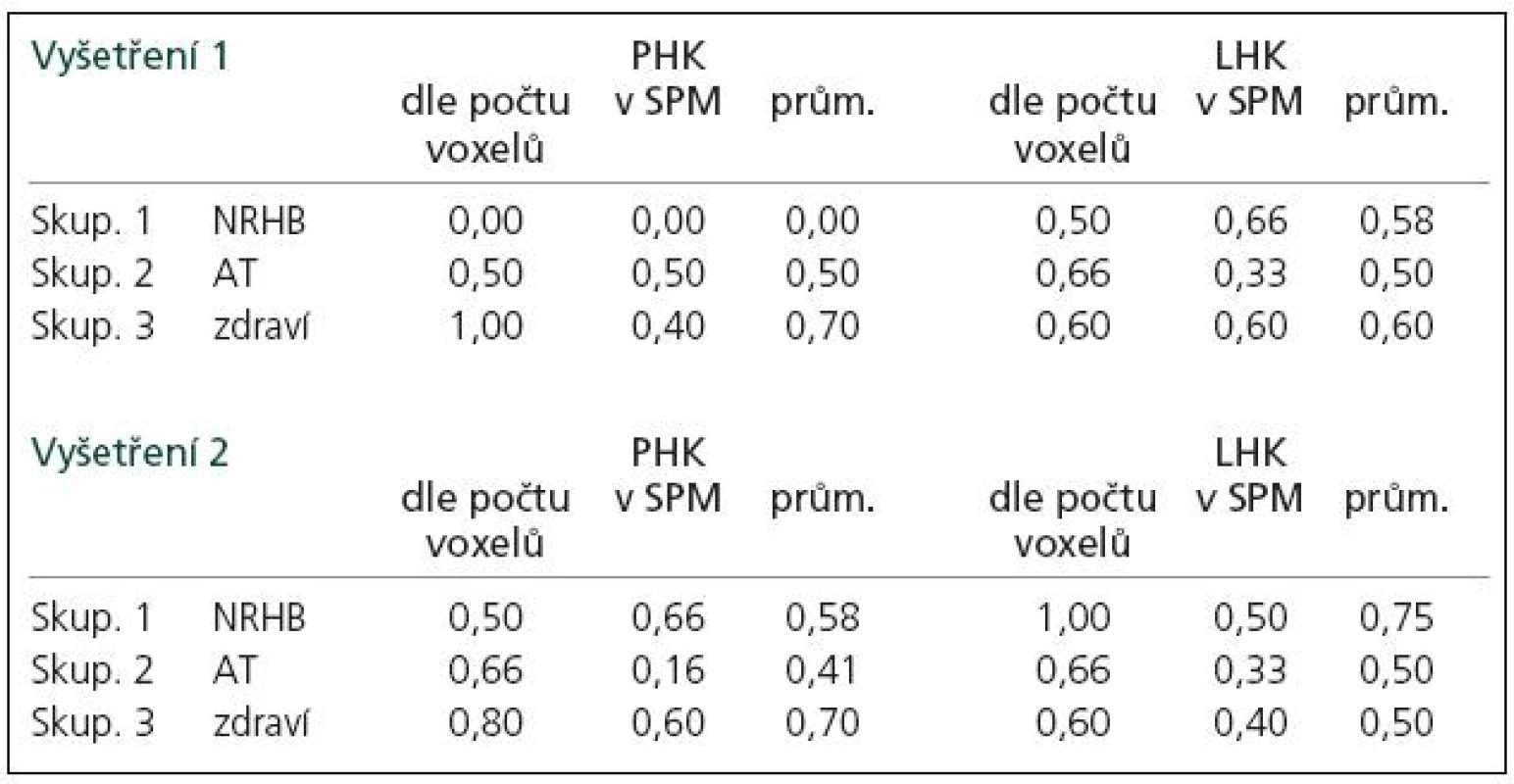
Vyšetření na začátku programu ukazuje statisticky signifikantní rozdíl mezi zdravými subjekty a pacienty s RS v rozsahu aktivované oblasti pro pravou ruku jakožto „navigační“ vůči „tandemové“ (dále pouze „rozsah aktivace“, tab. 4). Po léčbě došlo k posunu aktivačního vzorce u pacientů, kteří podstoupili neurorehabilitaci i aerobní trénink (zvýšení rozsahu aktivace u tandemové ruky), byť rozdíl rozsahu aktivace nebyl statisticky signifikantní (tab. 5). Vzhledem k tomu, že po léčbě již rozdíl mezi zdravými subjekty a pacienty s RS v rozsahu aktivované oblasti pro pravou ruku jakožto „navigační“ nebyl signifikantní (tab. 4), můžeme tento posun interpretovat jako „návrat k normě“.
Tab. 4. Proporce aktivovaných voxelů na statistické úrovni pro danou ruku ve funkci navigační u jednotlivých skupin. 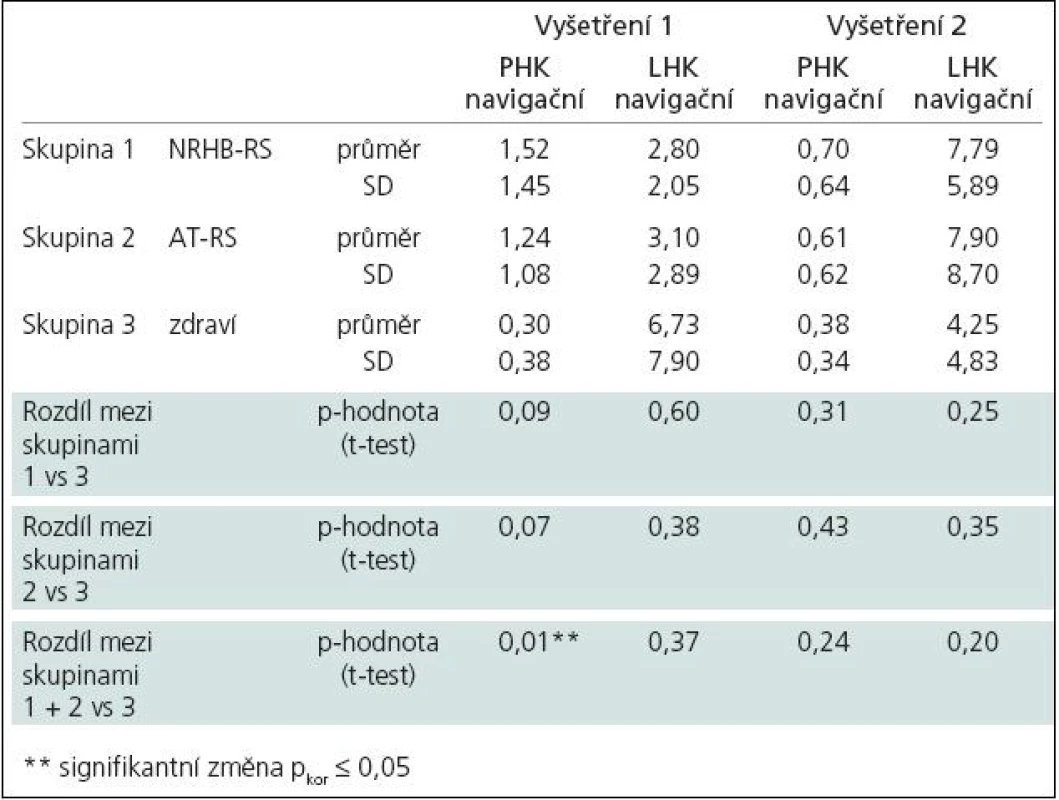
Tab. 5. Rozdíl proporce aktivovaných voxelů na statistické úrovni pro ruku navigační ku tandemové u prvního a druhého vyšetření. 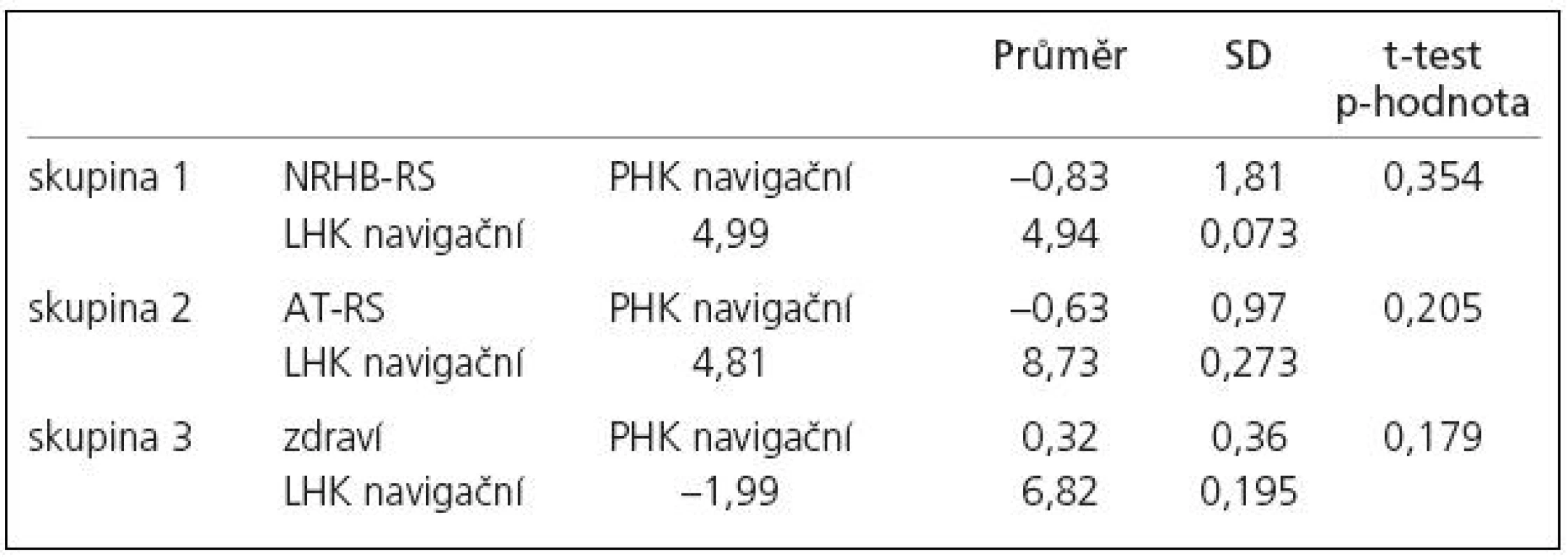
Diskuze
„Obsah“ neurorehabilitace není jednoznačně definován. Její součástí může být celá řada postupů, což působí obtíže při designování vědeckých studií. Přesto byla realizována celá řada studií, které prokázaly pozitivní efekt neurorehabilitace: u hospitalizovaných [20–22], u ambulantních [23–25] pacientů; u relabující-remitentní [26] i progresivní roztroušené sklerózy [21,22]; krátkodobý [24,27] i dlouhodobý [21–23,28] efekt, u impairmentu [24,29], disability [21,22,24,27,29], hendikepu i kvality života [21,22,24]. Vliv fyzioterapeutických konceptů sleduje jen málo studií [30,31]. Lord et al [30] i Cattaneo et al [31] porovnávají tzv. facilitační postup vycházející z Bobath konceptu, který se zaměřil na impairment, a tzv. task-oriented postup vycházející z konceptu Carr a Shepherd [32], kteří se zaměřili na ovlivnění disability. Oba postupy měly signifikantní vliv na impairment i disabilitu (p ≤ 0,05) [30], na dynamickou rovnováhu (Dynamic Gait Index); facilitační postup navíc vedl ke zlepšení statické rovnováhy hodnocené pomocí Berg Balance Scale [31]. V této studii jsme zvolili tzv. facilitační postup a pozitivně ovlivnili impairment, podobně jako v uvedených studiích. V paralelní studii bude vyhodnocen i vliv na disabilitu a kvalitu života.
Schapiro et al [33] jako první prokázali, že pohybová aktivita ve smyslu aerobního tréninku nemá negativní vliv na zdravotní stav nemocných s RS. Jeho pozitivní vliv pak byl prokázán v řadě studií [34–40]. V této studii jako první poukazujeme na pozitivní vliv aerobního tréninku na kognitivní funkce u nemocných s roztroušenou sklerózou (vezmeme‑li v úvahu množství vyšetřených parametrů, tak je výsledek nutno interpretovat jako trend ke zlepšení; ke zlepšení kognitivních funkcí, i když ne statisticky významnému, došlo i u skupiny, která podstoupila neurorehabilitaci). U seniorů [41], ale i u dětí [42] však již byla souvislost mezi fyzickou zdatností a kognitivními funkcemi prokázána. Fyzická zdatnost zpomaluje atrofii mozku u seniorů [43,44] a zlepšuje jeho funkci. Lepší fyzická zdatnost souvisí s lepším výkonem kognitivních funkcí, ale i zvýšením mozkové aktivace v oblasti gyrus frontalis inferior a gyrus frontalis medius [45].
Podle výsledků celé řady studií [46–52], ale i této práce dochází ve většině klinických fenotypů roztroušené sklerózy k rozsáhlejší motorické aktivaci než u zdravých lidí.
Možností ovlivnění mozkové aktivace tréninkem motorické funkce se zabývá celá řada studií u zdravé populace [53–55] i u lidí po cévní mozkové příhodě [56–59]. U nemocných s roztroušenou sklerózou mozkomíšní se této problematice zatím mnoho autorů nevěnuje. Morgen et al [52] uvádějí, že v souvislosti s tréninkem motorické funkce u nemocných s RS dochází ke kortikální reorganizaci motorické neuronální sítě, avšak oproti zdravé populaci v menším měřítku. Po krátkodobém tréninku (30 min) motorické dovednosti (flexe extenze palce) nedochází ve srovnání se zdravou populací ke snížení motorické aktivity v kontralaterální primární motorické oblasti, somatosenzorické oblasti a v lobulus parietalis inferior [52]. V naší předchozí práci [8], ale i této studii jsme zjistili, že v souvislosti s ovlivňováním motorických funkcí pomocí NRHB či AT dochází v některých oblastech ke zvýšení a v některých ke snížení mozkové aktivace. Neexistuje však shoda o tom, co tyto změny znamenají, ani zda je možné je vyvolat cíleně. Patrně záleží na tom, v jaké fázi motorického učení (časná kognitivní, střední, pozdní autonomní) se ten který subjekt nachází či zda šlo při tréninku o opakování stále stejné motorické dovednosti anebo nácvik různých motorických dovedností [60]. Zvolit vhodnou motorickou úlohu je obtížné. Morgen et al [52] vybrali stejnou motorickou úlohu při vyšetření fMR i při tréninku motorické funkce (jednoduchá motorická funkce), zatímco v této studii se motorická úloha při vyšetřování fMR lišila od rehabilitačního programu (komplexní pohyby v různých posturálních polohách s cílem zlepšení aktivit běžného života). V této studii jsme zařadili bimanuální sekvenční pohyb, protože jsme předpokládali, že bimanuální koordinace a složitější pohyb v kontextu s rozhodováním bude dělat pacientům obtíže, že při jeho vykonávání musí obě mozkové hemisféry spolupracovat (při bimanuální synchronní úloze musejí hemisféry také spolupracovat, ale oboustranně, zatímco při bimanuální sekvenční úloze předpokládáme jednostrannou interhemisferální konektivitu, tj. zleva doprava, pokud jde levá ruka jako první), a že navíc dojde k zapojení bílé hmoty transkalózní [2].
Ipsilaterální primární motorická oblast je u zdravých jedinců aktivována například při sekvenčním, ale i harmonickém pohybu prstů [61], u náročných pohybů jednou rukou [62,63], u jednoduchého pohybu nedominantní rukou [64,65], při provádění složitějšího motorického úkonu dominantní rukou [66], u bimanuálních pohybů [67], ale i u současného pohybu končetin, více u střídavého než stejného pohybu [68]. K ipsilaterální koaktivaci u zdravé populace pravděpodobně dochází díky dobré interhemisferální spolupráci [66–69]. V této práci jsme potvrdili, že při pohybu jednou rukou dochází u zdravých subjektů k ipsilaterální koaktivaci M1. Dále jsme zjistili, že při bimanuálním sekvenčním pohybu u zdravých subjektů dochází ke zvýšené aktivaci v M1 kontralaterální hemisféry u tandemové ruky oproti navigační ruce. To si vysvětlujeme superpozicí aktivace v kontralaterální hemisféře pro tandemovou ruku z ipsilaterální koaktivace z navigační ruky (sumací dvou časově opožděných jednoduchých pohybů končetin). Tento nález lze interpretovat jako dobrou interhemisferální spolupráci. Zvýšenou aktivitu M1 pro tandemovou ruku také pravděpodobně způsobuje to, že mozek programuje pohyb jako celek, tj. připravuje pohyb jako bimanuální sekvenční. I v tomto případě předpokládáme, že je využívána interhemisferální komunikace (informace o ukončení pohybu jedné ruky vede k nastartování pohybu druhé ruky). Další možností, která může zvýšenou aktivitu M1 způsobovat, je nelinearita (tj. porušení aditivity) na úrovni neurální, případně hemodynamické [70].
U nemocných po iktu [71–73] i u nemocných s RS [2–5,46–49,74,75] je popisována zvýšená ipsilaterální aktivace mozkových oblastí. Ta je však oproti zdravé populaci výrazně vyšší. Jde o známku kortikální reorganizace [47,49,73,75].
V souvislosti s terapeutickým programem jsme na základě našeho pilotního projektu [8] a výsledků studií Cadera et al [75] a Ericksona et al [76] předpokládali, že dojde ke zlepšení interhemisferální spolupráce, tj. že se během bimanuální sekvenční motorické úlohy bude zvyšovat ipsilaterální aktivace. To se v této práci projevilo v rozdílu rozsahu aktivace mezi navigační a tandemovou rukou, tj. došlo ke zvýšené aktivaci v M1 kontralaterální hemisféry u tandemové ruky oproti navigační ruce (přiblížení k normě). Diskutabilní je, proč jsou tyto nálezy u zdravých i nemocných subjektů výraznější během bimanuální sekvenční motorické úlohy pro sekvenci LP pro pravou ruku než pro sekvenci PL pro levou ruku. Je možné, že v tom hraje roli dominance končetin [77] nebo rozdílná funkce hemisfér (analytické funkce levé a syntetické pravé) [1]. Při hodnocení popsaného jevu dle rozdílu počtu voxelů na statisticky významné úrovni se změny po neurorehabilitaci jeví jako významnější. To je pravděpodobně způsobeno tím, že toto hodnocení spíše odráží zřetelný trend v obrazech, zatímco striktní testování rozdílu ve statistických mapách (SPM) nemuselo vždy ukázat statisticky signifikantní diferenci.
Při statistickém vyhodnocení není mezi skupinou, která podstoupila neurorehabilitaci, a skupinou, která absolvovala aerobní trénink, signifikantní rozdíl. To je pravděpodobně způsobeno velkou interindividuální variabilitou jedinců a nízkým počtem vyšetřených subjektů. Proto je potřeba data ověřit v dalším výzkumu.
Závěr
Vzorec spontánní mozkové aktivace během bimanuální sekvenční motorické úlohy u roztroušené sklerózy mozkomíšní a zdravé populace se liší. Pravděpodobně svědčí pro poruchu interhemisferální spolupráce u nemocných s RS.
Neurorehabilitace vede ke zlepšení funkce horních a dolních končetin, a především ke zlepšení posturálních reakcí. Aerobní trénink zlepšuje kognitivní funkce.
Vyšetření fMR na začátku experimentu ukazuje statisticky signifikantní rozdíl mezi RS a ZS v rozsahu aktivované oblasti v kontralaterální primární motorické oblasti ruky, která vykonala pohyb jako druhá v páru. Tento rozdíl v rozsahu aktivace mezi ZS a RS se po absolvování obou terapeutických programů zmenšil a po terapii již nebyl signifikantní. Pokud chápeme tento aktivační vzorec jako projev fyziologické interhemisferální spolupráce, pak v této souvislosti dochází u RS k „návratu k normě“.
Tato studie potvrdila dysfunkci interhemisférické spolupráce u roztroušené sklerózy a ukázala na možnost ovlivnit ji pomocí neurorehabilitace i aerobního tréninku.
Práce vznikla díky podpoře IGA MZČR 1A/8628-5, výzkumného záměru AV0Z10300504, a zásluhou zapojení obecně prospěšné společnosti CEROS do projektu Tréninkových pracovišť (projekt byl podporován Evropským sociálním fondem, státním rozpočtem České republiky a rozpočtem hlavního města Prahy).
as. PhDr. Kamila Řasová, Ph.D.
Klinika rehabilitačního lékařství
3. LF UK a FN Královské Vinohrady, Praha
Ruská 87, 10 000 Praha 10
e‑mail: kamila.rasova@centrum.cz
Zdroje
1. Lassonde M, Sa uerwein HC, Lepore F. Extent and limits of callosal plasticity: presence of disconnecti on symptoms in callosal agenesis. Ne uropsychologi a 1995; 33(8): 989 – 1007.
2. Stanćák A, Cohen ER, Seidler RD, Duong TQ, Kim S. The Size of Corpus Callosum Correlates with Functi onal Activati on of Medi al Motor Cortical Are as in Bimanu al and Unimanu al Movements. Cerebral Cortex 2003; 13(5): 475 – 485.
3. Manson SC, Palace J, Frank JA, Matthews PM. Loss of interhemispheric inhibiti on in pati ents with multiple sclerosis is related to corpus callosum atrophy. Exp Brain Res 2006; 174(4): 728 – 733.
4. Cader S, Cifelli A, Abu - Omar Y, Palace J, Matthews PM. Reduced brain functi onal reserve and altered functi onal connectivity in pati ents with multiple sclerosis. Brain 2006; 129(2): 527 – 537.
5. Pelleti er J, Habib M, Lyon - Caen O, Salamon G, Poncet M, Khalil R. Functi onal and magnetic resonance imaging correlates of callosal involvement in multiple sclerosis. Arch Ne urol 1993; 50(10): 1077 – 1082.
6. Pelleti er J, Suchet L, Witjas T, Habib M, Guttmann CR, Salamon G et al. A longitudinal study of callosal atrophy and interhemispheric dysfuncti on in relapsing - remitting multiple sclerosis. Arch Ne urol 2001; 58(1): 105 – 111.
7. Simon JH, Holtås SL, Schiffer RB, Rudick RA, Herndon RM, Kido DK et al. Corpus callosum and subcallosal - periventricular lesi ons in multiple sclerosis: detecti on with MR. Radi ology 1986; 160(2): 363 – 367.
8. Rasova K, Krasensky J, Havrdova E, Obenberger J, Seidel Z, Dolezal O et al. Is it possible to actively and purposely make use of plasticity and adaptability in the ne urorehabilitati on tre atment of Multiple Sclerosis pati ents? A Pilot Project. Clin Rehabil 2005; 19(2): 170 – 181.
9. Řasová K et al. Principy řízení pohybu a jejich aplikace v ne urorehabilitaci nemocných s roztro ušeno u sklerózo u mozkomíšní. Instruktážní film s facilitačními (terape utickými) prvky. Uni e ROSKA, Česká MS společnost 2007.
10. Řasová K. Fyzi oterapi e u ne urologicky nemocných (se zaměřením na roztro ušeno u sklerózu mozkomíšní). Praha: Ceros o.p.s. 2007.
11. Bai er ML, Cutter GR, Rudick RA, Miller D, Cohen JA, Weinstock - Guttman B et al. Low - contrast letter acuity testing captures visu al dysfuncti on in pati ents with multiple sclerosis. Ne urology 2005, 64(6), 992 – 995.
12. Deme urisse G, Demol O, Robaye E. Motor evalu ati on in vascular hemiplegi a. Eur Ne urol 1980; 19(6): 382 – 389.
13. Bohannon RW, Smith MB. Interrater reli ability of a modifi ed Ashworth scale of Muscle spasticity. Phys Ther 1987; 67(2): 206 – 207.
14. Berg K, Wo od - Da uphinee S, Willi ams JI. The Balance Scale: Reli ability assessment for elderly residents and pati ents with an acute stroke. Scand J Rehab Med 1995; 27(1): 27 – 36.
15. Fahn S, Tolosa E, Marín C. Clinical rating scale for tremor. In: Jankovic J, Tolosa E (eds). Parkinson’s Dise ase and Movement Disorders. Baltimore‑Munich: Urban & Schwarzenberg 1993 : 271 – 280.
16. Alusi SH, Worthington J, Glickman S, Findley LJ, Bain PG. Evalu ati on of three different ways of assessing tremor in multiple sclerosis. J Ne urol Ne urosurg Psychi atry 2000; 68(6): 756 – 760.
17. Corrive a u H, Gu arna F, Dutil E, Riley E, Arsena ult AB, Dro uin G. An evalu ati on of the hemiplegic subject based on the Bobath appro ach. Scand J Rehab Med 1988; 20(1): 5 – 11.
18. Davi es PM. Steps to Follow. A guide to the Tre atment of Adult Hemiplegi a. Based on the Concept of K. and B. Bobath. Berlin: Springer - Verlag 1993 : 15 – 16.
19. Morris LC. Clinical and Rehabilitati on Outcome Me asures. In: Burks JS, Johnson KP (eds). Multiple Sclerosis – Di agnosis, Medical Management and Rehabilitati on. New York: Demos 2000 : 236 – 290.
20. Carey RG, Seibert JH, Posavac EJ. Who makes the most progress in inpati ent rehabilitati on? An analysis of functi onal gain. Arch Phys Med Rehabil 1988; 69(5): 337 – 343.
21. Freeman JA, Langdon DW, Hobart JC, Thompson AJ. The impact of inpati ent rehabilitati on on progressive multiple sclerosis. Ann Ne urol 1997; 42(2): 236 – 244.
22. Freeman JA, Langdon DW, Hobart JC, Thompson AJ. Inpati ent rehabilitati on in multiple sclerosis: do the benefits carry over into the community? Ne urology 1999; 52(1): 50 – 56.
23. Solari A, Filippini G, Gasco P, Colla L, Salmaggi A, La Manti a L et al. Physical rehabilitati on has a positive effect on disability in multiple sclerosis pati ents. Ne urology 1999; 52(1): 57 – 62.
24. Rasova K, Havrdova E, Brandejsky P, Zálisová M, Fo ubikova B, Martinkova P. Comparison of the influence of different rehabilitati on programs on clinical spirometric and spiroergometric parameters in pati ents with multiple sclerosis. Mult Scler 2006; 12(2): 227 – 234.
25. Di Fabi o RP, Soderberg J, Cho i T, Hansen CR, Schapiro RT. Extended o utpati ent rehabilitati on: its influence on symptom frequency, fatigue, and functi onal status for persons with progressive multiple sclerosis. Arch Phys Med Rehabil 1998; 79(2): 141 – 146.
26. Wiles CM, Newcombe RG, Fuller KJ, Shaw S, Furnival - Doran J, Pickersgill TP et al. Controlled randomised crossover tri al of the effects of physi otherapy on mobility in chronic multiple sclerosis. J Ne urol Ne urosurg Psychi atry 2001; 70(2): 174 – 179.
27. Patti F, Ci anci o MR, Cacopardo M, Reggi o E, Fi orilla T, Palermo F et al. Effects of a short o utpati ent rehabilitati on tre atment on disability of multiple sclerosis pati ents – a randomised controlled tri al. J Ne urol 2003; 250(7): 861 – 866.
28. Khan F, Pallant JF, Brand C, Kilpatrick TJ. Effectiveness of Rehabilitati on Interventi on in persons with Multiple sclerosis: A Randomized Controlled Tri al. J Ne urol Ne urosurg Psychi atry 2008; 79(11): 1230 – 1235.
29. Romberg A, Virtanen A, Ruuti ainen J. Long‑term exercise improves functi onal impairment but not qu ality of life in multiple sclerosis. J Ne urol 2005; 252(7): 839 – 845.
30. Lord SE, Wade DT, Halligan PW. A comparison of two physi otherapy tre atment appro aches to improve walking in multiple sclerosis: a pilot randomized controlled study. Clin Rehabil 1998; 12(6): 477 – 486.
31. Cattane o D, Jonsdottir J, Zocchi M, Regola A. Effects of balance exercises on pe ople with multiple sclerosis: a pilot study. Clin Rehabil 2007; 21(9): 771 – 781.
32. Shepherd RB, Carr JH. Ne urological rehabilitati on. Disabil Rehabil 2006; 28(13 – 14): 811 – 812.
33. Schapiro RT, Petajan JH, Kosich D, Molk B, Feeney J. Role of cardi ovascular fitness in multiple sclerosis: a Pilot Study. Ne urorehabil Ne ural Repair 1988; 2 : 43 – 49.
34. Ponichtera - Mulcare JA. Exercise and multiple sclerosis. Med Sci Sports Exerc 1993; 25(4): 451 – 65.
35. Petajan JH, Gappmai er E, White AT, Spencer MK, Mino L, Hicks RW. Impact of aerobic training on fitness and qu ality of life in multiple sclerosis. Ann Ne urology 1996; 39(4): 432 – 441.
36. Mostert S, Kesselring J. Effects of a short‑term exercise training program on aerobic fitness, fatigue, he alth percepti on and activity level of subjects with multiple sclerosis. Mult Scler 2002; 8(2): 161 – 168.
37. Kileff J, Ashburn A. A pilot study of the effect of aerobic exercise on pe ople with moderate disability multiple sclerosis. Clin Rehabil 2005; 19(2): 165 – 169.
38. Schulz KH, Gold SM, Witte J, Bartsch K, Lang UE, Hellweg R et al. Impact of aerobic training on immune - endocrine parameters, ne urotrophic factors, qu ality of life and co ordinative functi on in multiple sclerosis. J Ne urol Sci 2004; 225(1 – 2): 11 – 18.
38. Newman MA, Dawes H, van den Berg M, Wade DT, Burridge J, Izadi H. Can aerobic tre admill training reduce the effort of walking and fatigue in pe ople with multiple sclerosis: a pilot study. Mult Scler 2007; 13(1): 113 – 119.
40. Rampello A, Franceschini M, Pi epoli M, Antenucci R, Lenti G, Olivi eri D et al. Effect of aerobic training on walking capacity and maximal exercise tolerance in pati ents with multiple sclerosis: a randomized crossover controlled study. Phys Ther 2007; 87(5): 545 – 559.
41. Netz Y, Tomer R, Axelrad S, Argov E, Inbar O. The effect of a single aerobic training sessi on on cognitive flexibility in late middle - aged adults. Int J Sports Med 2007;28(1): 82 – 87.
42. Verschuren O, Ketelaar M, Gorter JW, Helders PJ, Uiterwaal CS, Takken T. Exercise training program in children and adolescents with cerebral palsy: a randomized controlled tri al. Arch Pedi atr Adolesc Med 2007; 161(11): 1075 – 1081.
43. Colcombe SJ, Erickson KI, Scalf PE, Kim JS, Prakash R, McAuley E et al. Aerobic exercise training incre ases brain volume in aging humans. J Gerontol A Bi ol Sci Med Sci 2006; 61(11): 1166 – 1170.
44. Colcombe SJ, Erickson KI, Raz N, Webb AG, Cohen NJ, McAuley E, Kramer AF. Aerobic fitness reduces brain tissue loss in aging humans. J Gerontol A Bi ol Sci Med Sci. 2003; 58(2): 176 – 180.
45. Prakash RS, Sno ok EM, Erickson KI, Colcombe SJ, Voss MW, Motl RW et al. Cardi orespiratory fitness: A predictor of cortical plasticity in multiple sclerosis. Ne uro image 2007; 34(3): 1238 – 1244.
46. Lee M, Reddy H, Johansen - Berg H, Pendlebury S, Jenkinson M, Smith S et al. The motor cortex shows adaptive functi onal changes to brain injury from multiple sclerosis. Ann Ne urol 2000; 47(5): 606 – 613.
47. Reddy H, Narayanan S, Arno utelis R, Jenkinson M, Antel J, Matthews PM et al. Evidence for adaptive functi onal changes to brain injury from multiple sclerosis. Brain 2000; 123(11): 2314 – 2320.
48. Pantano P, Mainero C, Iannetti GD, Carami a F, Di Legge S, Pi attella MC et al. Contributi on of corticospinal tract damage to cortical motor re organizati on after a single clinical attack of multiple sclerosis. Ne uro image 2002; 17(4): 1837 – 1843.
49. Pantano P, Mainero C, Lenzi D, Carami a F, Iannetti GD, Pi attella MC et al. A longitudinal fMRI study on motor activity in pati ents with multiple sclerosis. Brain 2005; 128(9): 2146 – 2153.
50. Rocca MA, Gavazzi C, Mezzapesa DM, Falini A, Colombo B, Mascalchi M et al. A functi onal magnetic resonance imaging study of pati ents with secondary progressive multiple sclerosis. Ne uro image 2003; 19(4): 1770 – 1777.
51. Filippi M, Rocca MA, Falini A, Caputo D, Ghezzi A, Colombo B et al. Correlati ons between structural CNS damage and functi onal MRI changes in primary progressive MS. Ne uro image 2002; 15(3): 537 – 346.
52. Morgen K, Kadom N, Sawaki L, Tessitore A, Ohayon J, McFarland H et al. Training - dependent plasticity in pati ents with multiple sclerosis. Brain 127(11): 2506 – 2517.
53. Lotze M, Bra un C, Birba umer N, Anders S, Cohen LG. Motor le arning elicited by voluntary drive. Brain 2003; 126(4): 866 – 872.
54. Classen J, Li epert J, Wise SP, Hallett M, Cohen LG. Rapid plasticity of human cortical movement representati on induced by practice. J Ne urophysi ol 1998; 79(2): 1117 – 1123.
55. Morgen K, Kadom N, Sawaki L, Tessitore A, Ohayon J, Frank J et al. Kinematic specificity of cortical re organizati on associ ated with motor training. Ne uro image 2004; 21(3): 1182 – 1187.
56. Schaechter JD, Kraft E, Hilli ard TS, Dijkhuizen RM, Benner T, Finklestein SP et al. Motor recovery and cortical re organizati on after constraint‑induced movement therapy in stroke pati ents: a preliminary study. Ne urorehabil Ne ural Repair 2002; 16(4): 326 – 338.
57. Li epert J, Ba uder H, Wolfgang HR, Miltner WH, Ta ub E, Weiller C. Tre atment‑induced cortical re organizati on after stroke in humans. Stroke 2000; 31(6): 1210 – 1216.
58. Li epert J, Uhde I, Gräf S, Leidner O, Weiller C. Motor cortex plasticity during forced - use therapy in stroke pati ents: a preliminary study. J Ne urol 2001; 248(4): 315 – 321.
59. Nelles G, Jentzen W, Jueptner M, Muller S, Di ener HC. Arm training induced brain plasticity in stroke studi ed with seri al positron emissi on tomography. Ne uro image 2001; 13(1): 1146 – 1154.
60. Le onard CT. The Ne urosci ence of Motor Le arning. In: Le onard CT (ed). The Ne urosci ence of Human Movement. St. Lo uis: Mosby 1998 : 203 – 229.
61. Verstynen T, Di edrichsen J, Albert N, Aparici o P, Ivry RB. Ipsilateral motor cortex activity during unimanu al hand movements relates to task complexity. J Ne urophysi ol 2005; 93(3): 1209 – 1222.
62. Roland PE, Skinhøj E, Lassen NA, Larsen B. Different cortical are as in man in organizati on of voluntary movements in extrapersonal space. J Ne urophysi ol 1980; 43(1): 137 – 150.
63. Kim SG, Ashe J, Hendrich K, Ellermann JM, Merkle H,Uğurbil K et al. Functi onal magnetic resonance imaging of motor cortex: hemispheric asymmetry and handedness. Sci ence 1993; 261(5121): 615 – 617.
64. Kawashima R, Matsumura M, Sadato N, Naito E, Waki A, Nakamura S et al. Regi onal cerebral blo od flow changes in human brain related to ipsilateral and contralateral complex hand movements – a PET study. Eur J Ne urosci 1998; 10(7): 2254 – 2260.
65. Kawashima R, Roland PE, O‘Sullivan BT. Activity in the human primary motor cortex related to ipsilateral hand movements. Brain Res 1994; 663(2): 251 – 256.
66. Beltramello A, Cerini R, Puppini G, El - Dalati G, Vi ola S, Martone E et al. Motor representati on of the hand in the human cortex: an f - MRI study with a conventi onal 1.5 T clinical unit. Ital J Ne urol Sci 1998; 19(5): 277 – 284.
67. Aramaki Y, Honda M, Sadato N. Suppressi on of the non‑dominant motor cortex during bimanu al symmetric finger movement: a functi onal magnetic resonance imaging study. Ne urosci ence 2006; 141(4): 2147 – 2153.
68. Kobayashi M, Hutchinson S, Schla ug G, Pascu al - Le one A. Ipsilateral motor cortex activati on on functi onal magnetic resonance imaging during unilateral hand movements is related to interhemispheric interacti ons. Ne uro image 2003; 20(4): 2259 – 2270.
69. Aramaki Y, Honda M, Okada T, Sadato N. Ne ural correlates of the spontane o us phase transiti on during bimanu al co ordinati on. Cereb Cortex 2006; 16(9): 1338 – 1348.
70. Gu H, Stein EA, Yang Y. Nonline ar responses of cerebral blo od volume, blo od flow and blo od oxygenati on signals during visu al stimulati on. Magn Reson Imaging 2005; 23(9): 921 – 928.
71. Weiller C, Chollet F, Friston KJ, Wise RJ, Frackowi ak RS. Functi onal re organizati on of the brain in recovery from stri atocapsular infarcti on in man. Ann Ne urol 1992; 31(5): 463 – 472.
72. Marshall RS, Perera GM, Lazar RM, Kraka uer JW, Constantine RC, DeLaPaz RL. Evoluti on of cortical activati on during recovery from corticospinal tract infarcti on. Stroke 2000; 31(3): 656 – 661.
73. Small SL, Hlustik P, Noll DC, Genovese C, Solodkin A.Cerebellar hemispheric activati on ipsilateral to the paretic hand correlates with functi onal recovery after stroke. Brain 2002; 125(7): 1544 – 1557.
74. Manson SC, Wegner C, Filippi M, Barkhof F, Beckmann C, Ciccarelli O et al. Impairment of movement‑associ ated brain de activati on in multiple sclerosis: further evidence for a functi onal pathology of interhemispheric ne uronal inhibiti on. Exp Brain Res 2008; 187(1): 25 – 31.
75. Cader S, Palace J, Matthews PM. Cholinergic agonism alters cognitive processing and enhances brain functi onal connectivity in pati ents with multiple sclerosis. J Psychopharmacol. 2008 Jul 17. [Epub ahead of print].
76. Erickson KI, Colcombe SJ, Wadhwa R, Bherer L, Peterson MS, Scalf PE et al. Training‑induced plasticity in older adults: effects of training on hemispheric asymmetry. Ne urobi ol Aging 2007; 28(2): 272 – 283.
77. Aramaki Y, Honda M, Sadato N. Suppressi on of the non‑dominant motor cortex during bimanu al symmetric finger movement: a functi onal magnetic resonance imaging study. Ne urosci ence 2006; 141(4): 2147 – 2153.
Štítky
Detská neurológia Neurochirurgia Neurológia
Článok vyšiel v časopiseČeská a slovenská neurologie a neurochirurgie
Najčítanejšie tento týždeň
2009 Číslo 4- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Naděje budí časná diagnostika Parkinsonovy choroby založená na pachu kůže
- Kombinace metamizol/paracetamol v léčbě pooperační bolesti u zákroků v rámci jednodenní chirurgie
- Neuromultivit v terapii neuropatií, neuritid a neuralgií u dospělých pacientů
- Srovnání analgetické účinnosti metamizolu s ibuprofenem po extrakci třetí stoličky
-
Všetky články tohto čísla
- Editori al
- Nádory tretej mozgovej komory
- Botulotoxin v léčbě spasticity
- Po užití metod magnetické rezonance pro poso uzení cerebrovaskulární rezervní kapacity
- Přání k významnému životnímu jubileu
- Eti ologi e a epidemi ologi e purulentní meningitidy u dospělých paci entů
- Změny parametrů páteře po implantaci bederní interspinózní rozpěrky DIAM
- Analýza psychologického profilu a spánkových vide o- EEG u dětí s vývojovo u dysfázi í
- Bimanu ální sekvenční motorická úloha u roztro ušené sklerózy mozkomíšní v obraze funkční magnetické rezonance: vliv fyzioterapeutických technik – pilotní studie
- Hodnocení cerebrovaskulární rezervní kapacity po EC- IC bypassu pomocí TCD
- Elektrotaktilní stimulace jazyka: nová možnost rehabilitace posturální stability – kazuistika
- Paroxysmální kinezigenní dyskineze: případ mladé ženy s alternující hemidystoni í – kazuistika
- Získaná neuromyotonie s nevelkými centrálními příznaky s průkazem protilátek proti napěťově řízeným kaliovým kanálům – kazuistika
- Zlepšení sledovacích pohybů očí a fonace po selektivní dorzální rizotomii
- Multimodální monitorování mozku u pacientů s těžkým kraniocerebrálním traumatem a subarachnoidálním krvácením v neuro intenzivní péči
- Webové okénko
-
Analýza dat v neurologii
XVI. Zlatý standard statistického testování: t‑test
- Zpráva z kurzu mikrodialýzy v Praze
- Česká a slovenská neurologie a neurochirurgie
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Nádory tretej mozgovej komory
- Získaná neuromyotonie s nevelkými centrálními příznaky s průkazem protilátek proti napěťově řízeným kaliovým kanálům – kazuistika
- Botulotoxin v léčbě spasticity
- Paroxysmální kinezigenní dyskineze: případ mladé ženy s alternující hemidystoni í – kazuistika
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy