-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Perspektivy léčby osteoartrózy
Prospects for the treatment of osteoarthritis
Osteoarthritis (OA) is the most common joint disease. The existing treatment consists of a combination of lifestyle changes, physical therapy, pharmacotherapy, and surgical joint replacement in case of advanced disease. All pharmacological treatment was purely symptomatic. The aim of the pharmaceutical industry is to develop drugs that modify the structural breakdown of cartilage. These drugs are called DMOAD (Disease Modifying OsteoArthritis Drugs). There is no DMOAD available to date, however many of them are in the process of clinical testing.
This article aims to provide an overview of these methods. Each agent is described with an expected mechanism of action, the experimental data on animal cartilage, and clinical data when available. The author assesses the following approachess: growth factors, blockage of nitrous oxide, stem cell therapy, platelet-rich plasma (PRP) therapy focusing on the subchondral bone (bisphosphonates, strontium ranelate, zoledronate), anti-inflammatory treatment: anti-cytokine therapy, intra-articular injection of autologous conditioned serum and gene therapy. Innovative surgical techniques are listed briefly as well.Key words:
Osteoarthritis, new therapeutic approaches
Autori: K. Pavelka
Pôsobisko autorov: Revmatologický ústav Praha
Vyšlo v časopise: Čes. Revmatol., 23, 2015, No. 1, p. 14-21.
Kategória: Přehledný článek
Osteoartróza (OA) je nejčastější kloubní onemocnění. Dosavadní léčba spočívala v kombinaci režimových opatření, fyzikální léčby a farmakoterapie, v případě pokročilé nemoci pak v chirurgickém řešení náhradou kloubu. Veškerá farmakologická léčba byla ryze symptomatická. Snahou farmaceutického průmyslu je vyvinout léky, které by modifikovaly strukturální rozpad chrupavky. Tyto léky nazýváme DMOAD (Disease Modifying OsteoArthritis Drugs). Toho času není žádný DMOAD dostupný, ale řada z nich je v procesu klinického zkoušení.
Súhrn
Osteoartróza (OA) je nejčastější kloubní onemocnění. Dosavadní léčba spočívala v kombinaci režimových opatření, fyzikální léčby a farmakoterapie, v případě pokročilé nemoci pak v chirurgickém řešení náhradou kloubu. Veškerá farmakologická léčba byla ryze symptomatická. Snahou farmaceutického průmyslu je vyvinout léky, které by modifikovaly strukturální rozpad chrupavky. Tyto léky nazýváme DMOAD (Disease Modifying OsteoArthritis Drugs). Toho času není žádný DMOAD dostupný, ale řada z nich je v procesu klinického zkoušení.
Předmětem tohoto článku je právě přehled těchto metodik. U každé z nich je podán předpokládaný mechanismus účinku, experimentální data na zvíření chrupavce, a pokud jsou dostupná, tak klinická data. Autor vyhodnocuje tyto metodiky: růstové faktory, blokáda kysličníku dusného, léčba kmenovými buňkami, destičkami obohacená plazma (PRP), terapie se zaměřením na subchondrální kost (bisfosfonáty, stroncium ranelát, zoledronát), protizánětlivá léčba: anticytokinová léčba, intraartikulární aplikace autologního kondiciovaného séra a genová terapie. Ve stručnosti jsou vyjmenovány i inovativní chirurgické techniky.Klíčová slova:
Osteoartróza, nové terapeutické postupy
Osteoartróza (OA) je nejčastější kloubní onemocnění. Nejčastěji postiženým jsou klouby kolenní (24 %) a kyčelní (11 %), dalšími běžnými lokalizacemi jsou pak drobné klouby rukou, kotník a kloubní struktury na páteři (1). OA je progresivní onemocnění, které může vést k destrukci kloubní chrupavky a celého kloubu a jediným řešením pak je náhrada kloubu alloplastikou. Např. u koxartrózy dojde k potřebě endoprotézy u 24 % pacientů během 6 let od prvních příznaků (2).
Etiopatogeneze OA není zcela jasná, ale jisté je, že jde o komplexní, multifaktoriální proces, kde se uplatňují jak systémové faktory, které vytváří určitou predispozici, tak faktory lokální, které lze také nazvat biomechanické. Mezi systémové faktory patří genetické abnormality, obezita, reprodukční faktory, stárnutí, hypermobilita a přítomnost dalších onemocnění (zánětlivá revmatická onemocnění, krystaly indukované nemoci, endokrinopatie, metabolická onemocnění). Mezi biomechanické faktory patří abnormální tvar kloubu (dysplazie), trauma, opakované přetěžování při zaměstnání či sportu.
Kloubní hyalinní chrupavka je unikátní tkáň, která zajišťuje schopnost kloubů jednak odolávat velkým funkčním nárokům při pohybu (absorpce nárazů), ale na druhé straně je i dostatečně pevná oproti střižným silám. Základem je kvalitní tzv. extracelulární matrix (ECM), která je stále odbourávána a nově tvořena chondrocyty. Jakákoliv změna okolí chondrocytů, jako např. mechanické faktory, může aktivovat anabolické funkce chondrocytů, které mohou reparovat poškození tkání (3). Pod vlivem růstových faktorů v časných stadiích OA však produkují chondrocyty defektní proteoglykany a abnormální typy kolagenů jako je např. kolagen 1 a kolagen 3. Časem je ale homeostáza chrupavky porušena a převládne katabolismus. Chondrocyty (autokrinní cestou) a synoviocyty (parakrinní cestou) uvolňují proteinázy např. metaloproteinázy (MMP) a agrekanázy (ADAMTS) a prozánětlivé cytokiny včetně IL-1, které pak zpětně aktivují proteinázy, které degradují chrupavku. Odlišné biochemické složení chrupavky pak zhoršuje její biomechanické vlastnosti. Dochází k fragmentaci chrupavky, uvolňování jejich částeček a vzniku sekundárního zánětu. Následují změny subchondrální kosti, růst osteofytů a později postižení všech měkkých kolem kloubních tkání. OA je onemocněním celého kloubu jako orgánu, nikoliv pouze kloubní chrupavky.
Terapie osteoartrózy
Cíle léčby OA jsou následující: zmenšit kloubní bolest a ztuhlost, zachovat nebo zlepšit funkci kloubu a schopnost chůze, zlepšit na zdraví závislou kvalitu života a zpomalit nebo zastavit progresi destrukce kloubu. Terapii OA lze rozdělit na nefarmakologickou, farmakologickou a chirurgickou (tab. 1). Základními prostředky nefarmakologické léčby je edukace pacienta, dlouhodobé cvičení a rehabilitace, prostředky fyzikální léčby a používání protetických a asistenčních pomůcek. Mezi farmakologické způsoby léčby s evidencí o účinnosti patří analgetika, nesteroidní antirevmatika (podávaná systémově i lokálně), silné i slabé opioidy, intraartikulární aplikace glukokortikoidů a kyseliny hyaluronové a dále pak aplikace tzv. pomalu působících léků u OA tzv. SYSADOA, kam patří glukosamin, chondroitin sulfát, diacerein a piascledin. Mezi chirurgické metody s evidencí o účinnosti patří náhrady kloubů a osteotomie u koxartrózy. Evidence o účinnosti artroskopických metodik (laváž, debridement) není jednoznačná.
Tab. 1. Možnosti léčby osteoartrózy 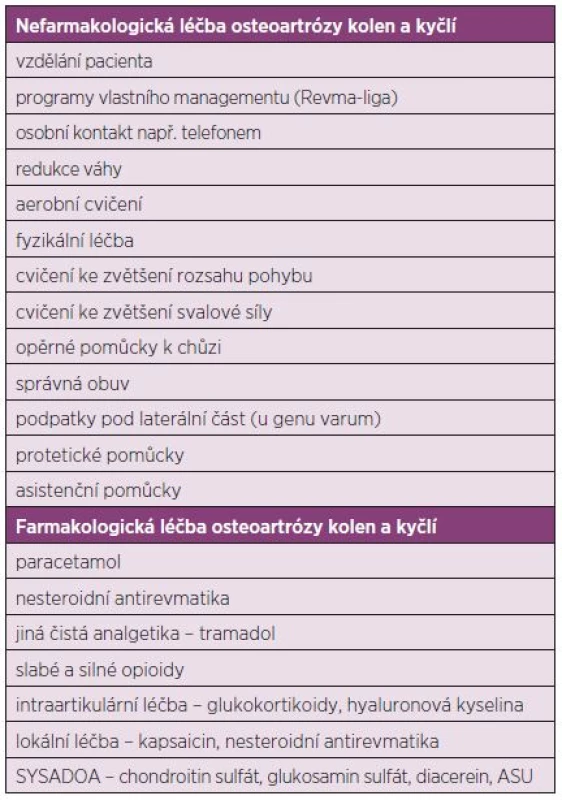
Všechny výše uvedené způsoby léčby lze považovat za symptomatické, zatím se nepodařilo prokázat jednoznačně o žádném léku, že je strukturu modifikující a splňuje kritéria pro DMOAD (disease modifying drug of OA). Bylo sice publikováno několik studií s glukosaminem, chondroitin sulfátem diacereinem a piascledinem, které nacházely signifikantní vliv léku na zpomalení zužování chrupavky (4, 5, 6, 7), ale rozdíly byly většinou velmi malé a pravděpodobně klinicky nevýznamné. Nepodařilo se také prokázat snížení počtu nutných endoprotéz. Je proto možné prohlásit, že DMOAD není t. č. dostupný. Existuje tedy velká medicínská potřeba získat nové léky, které budou mnohem účinnější při ovlivnění strukturální progrese OA.
Nové způsoby léčby
Vývoj léků modifikujících rozvoj OA tzv. DMOAD je jednou z největších výzev současného bazálního i klinického výzkumu a investic farmaceutických firem. Nové studie by se měly soustředit na několik důležitých priorit. První je jistě výběr vhodných nových zobrazovacích technologií pro hodnocení destrukce chrupavky, jako je MRI nebo některé další techniky jako jsou např. kombinace SPECT/CT nebo PET/MRI. Studie by měly mít správný design, dostatečnou statistickou sílu a používat vhodná kritéria účinnosti. Zařazováni by měli být pacienti s podobným fenotypem OA a větší pravděpodobností progrese onemocnění.
Zkoušených terapeutických postupů u OA je celá řada, ale mezi nejvíce perspektivní patří růstové faktory, blokátory kysličníku dusného (NO), aplikace mezenchymálních kmenových buněk, aplikace plazmy obohacené destičkami (platelet-rich plasma – PRP), modulátory kostního metabolismu, aplikace autologního kondicionovaného séra (Orthokine), biologická anticytokinová léčba, genová terapie, micro RNA a inovativní chirurgické techniky (tab. 2).
Tab. 2. Nové terapeutické alternativy v léčbě OA – v procesu klinického zkoušení. 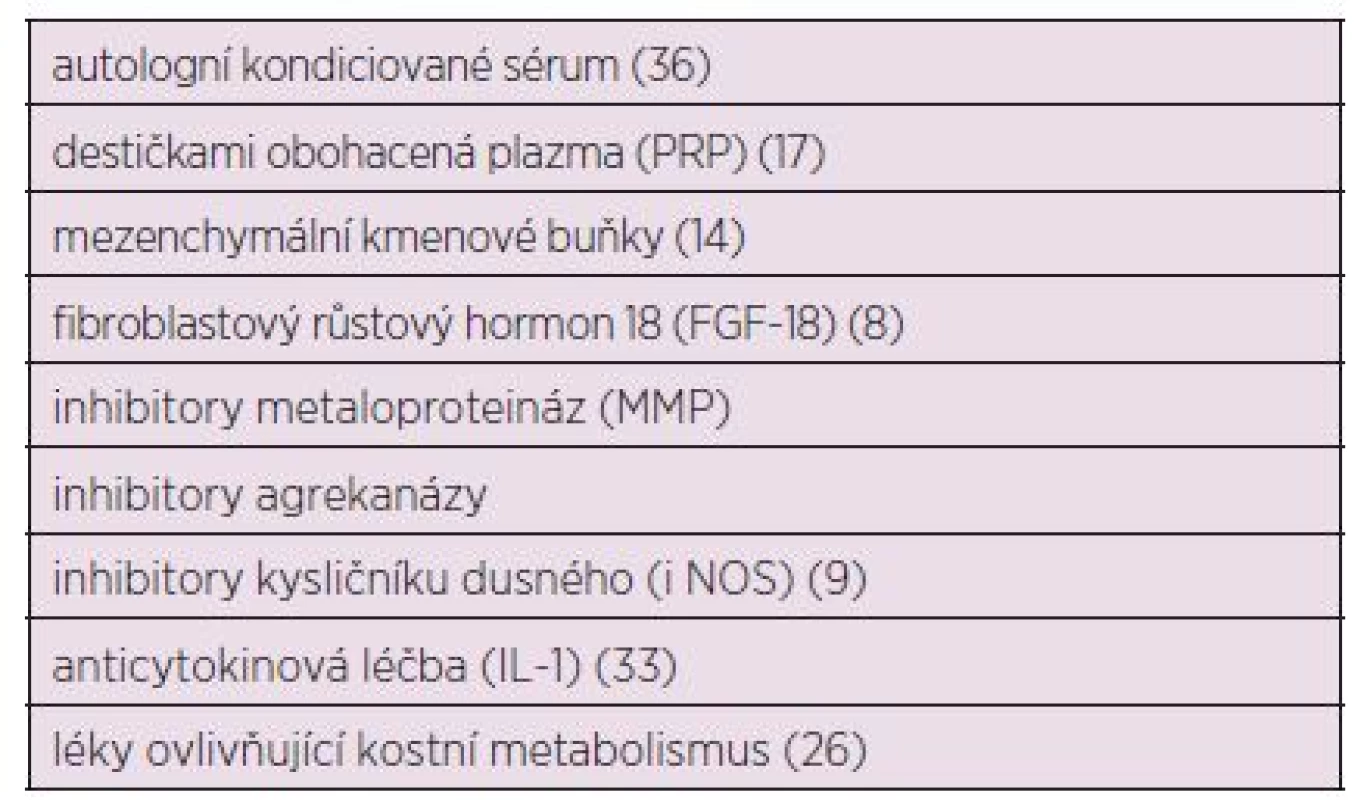
DMOAD ovlivňující katabolické a anabolické děje v chrupavce
Růstové faktory
Z růstových faktorů ovlivňujících reparaci chrupavky se klinicky zkouší kostní morfogenní protein BMP-7 a růstový faktor fibroblastů (FGF-18). BMP 7 byl účinný na zvířecích modelech OA a rovněž tak na humánních chondrocytech in vitro (8). Iniciální studie fáze I prokázala dobrou snášenlivost. Další studie fáze I. ještě nebyly publikovány, zásadní studie k průkazu účinnosti fáze II u akutních poškození chrupavky právě probíhá.
Blokáda kysličníku dusného
Kysličník dusný (NO) přispívá k degeneraci chrupavky. Selektivní inhibice i NOS vedla k zpomalení experimentální OA. Nicméně nedávno dokončená randomizovaná, kontrolovaná studie v délce 2 let s orálním inhibitorem i NOS (cindunistat) byla negativní, když nebyl zjištěn lepší symptomatický účinek léku než placeba a rovněž tak žádný efekt na zpomalení rentgenové progrese OA (9).
Léčba kmenovými buňkami
Dospělá kloubní chrupavka má velmi omezenou schopnost regenerace a to především pro svoji avaskulární strukturu. Jedním z perspektivních směrů léčby s cílem regenerovat chrupavku je aplikace kmenových buněk. Nahradit defekt chrupavky tkání se stejnými mechanickými a biologickými vlastnostmi je však komplikované. Za prvé je nutné docílit správné integrace povrchů chrupavky a za druhé je nutné zajistit adekvátní mikroprostředí a správné signály pro kmenové buňky, aby si uchovaly svůj chondrogenní potenciál.
Kmenové buňky se dají rozdělit na kmenové buňky embryonální a kmenové buňky z dospělých tkání, což jsou progenitorové buňky v diferencovaných tkáních, jako jsou např. mezenchymální kmenové buňky (mesenchymal stem cells – MSC). MSC buňky mohou představovat perspektivní léčbu pro OA a to pro svůj potenciál diferencovat se v různé linie, imunosupresivní aktivitu a omezenou imunogenicitu. Zdrojem kmenových buněk je kostní dřeň a tuková tkáň. MSC buňky je snazší izolovat z tukové tkáně než z kostní dřeně a navíc mají největší chondrogenní potenciál (10). Nebyl zatím nalezen žádný specifický marker, který by určoval, jestli se budou diferencovat v chondrocyty, osteoblasty nebo adipocyty. MSC jsou definovány jejich plastickými, adherentními schopnostmi a jejich fenotypem (pozitivní pro CD 73, CD 90, CD 105 a negativní pro hematopoetické markery jako je CD 11b, CD 19, CD 34, CD 45 a HLA DR) (11). Jsou hypoimunogenní, protože exprimují nízké hladiny HLA třídu I antigenu a žádné HLA třída II antigenu. MSC mohou přispívat k regeneraci chrupavky dvojím mechanismem. Prvním mechanismem je, že se pod vlivem okolních faktorů jako jsou růstové faktory (TGFβ, FGB, BMP), transkripčních faktory (SOX 9, RUNX-2) a fyzikálních parametrů diferencují v chondrocyty. MSC umístěné do trojdimenzionální sítě mohou produkovat chrupavku. Druhým mechanismem účinku MSC buněk je jejich protizánětlivý, antiapoptotický, antifibrotický, pro angiogenní a imunosupresivní účinek.
Koncept terapeutické účinnosti MSC buněk byl ověřen na řadě modelů experimentální, zvířecí OA (12).
V humánní medicíně se zpočátku MSC buňky podávaly formou transplantace, později byla zavedena technika intraartikulární aplikace MSC, která je určitě méně invazivní metodou. MSC byly zkoušeny především v malých otevřených studiích, např. Davatchi popsal redukci bolesti po i.a. aplikaci MSC u čtyř pacientů se středně závažnou gonartrózou (13), Emadenin pak popsal skupinu 6 pacientů i.s. injekcí MSC pocházejících z kostní dřeně (14). Větší skupinu 18 pacientů s gonartrózou a aplikací i.a. MSC z tukové tkáně publikoval Koh (15). V této studii byla tato metodika s MSC buněk kombinována s artroskopickým zákrokem a PRP. Došlo k signifikantnímu poklesu WOMAC skóre. Šlo ale o retrospektivní studii, bez kontrolní skupiny, takže dosavadní výsledky je nutné hodnotit jako předběžné. V současné době probíhá několik studií fáze I. a II. Metodiku intraartikulární aplikace MSC buněk je nutné považovat za perspektivní, ale je nutné vyčkat výsledků randomizovaných, klinických studií.
Destičkami obohacená plazma (Platelet Rich Plasma – PRP)
Autologní PRP je plazma z pacientovi vlastní krve, ve které je koncentrace destiček nad bazálními hodnotami. Důvodem pro používání PRP je fakt, že destičky obsahují hodně růstových faktorů, včetně TGFβ, destičkového růstového faktoru (PDGF) vaskulárního endoteliálního růstového faktoru (VEGF), dále pak cytokinů, chemokinů a dalších mediátorů (16). Existuje představa, že tyto faktory mohou zrychlovat přirozený reparační proces chrupavky. TGFβ a PDGF mohou také stimulovat proliferaci MSC. Destičkové faktory mohou také inhibovat syntézu IL-1 a snižovat intenzitu synoviálního zánětu. Růstové faktory mohou také regulovat endogenní syntézu kyseliny hyaluronové. Nicméně přesný mechanismus účinku PRP není znám.
První studie s aplikací PRP byly provedeny především u sportovních úrazů a úrazů z přetížení jako jsou léze chrupavky, tendinitidy a akutní ruptury rotátorové manžety (17).
Dnes přibývá studií s aplikací PRP u OA, jako perspektivní a levné metody. Byla uveřejněna celá řada malých studií bez řádné, randomizované skupiny. Některé používaly jako kontrolní skupinu hyaluronovou kyselinu (HK), jiné placebo. Rovněž protokoly nebyly standardní, některé používaly čerstvou PRP, jiné naopak zmraženou. Nejasnou otázkou je také, jaký má být počet a frekvence injekcí a kteří pacienti jsou optimální pro tuto léčbu. Nedávno byla dokončena prospektivní studie, do které bylo zařazeno celkem 150 pacientů (18). Do jedné skupiny bylo zařazeno 50 pacientů, kteří dostávali PRP, do druhé skupiny pak 50 pacientů s kyselinou hyaluronovou o nízké molekulové hmotnosti (LWHA) a 50 pacientů s kyselinou hyaluronovou o vysoké molekulové hmotnosti (HWHA). Po 2 měsících léčby byla PRP stejně účinná jako LWHA a více účinná než HWHA. PRP byla účinnější než LWHA u skupiny mladších pacientů s časnou OA. Byly publikovány celkem 3 randomizované, kontrolované studie s PRP, přičemž 2 srovnávaly PRP s kyselinou hyaluronovou a jedna PFRP a placebo. Studie Filarda trvala 12 měsíců a bylo do ní zařazeno 109 pacientů (19). Nebyl zjištěn signifikantní rozdíl v účinnosti mezi PRP a HK. Studie Sanchize byla krátkodobá v délce trvání 24 týdnů (20). Primárním kritériem účinnosti byl pokles bolesti o 50 % a tohoto kritéria bylo dosaženo o 14,1 % častěji po PRP než po HK. Nicméně ve všech sekundárních kritériích účinnosti nebyl mezi oběma kritérii žádný rozdíl. Ve studii Patela bylo zařazeno 76 pacientů, kteří dostávali v jedné skupině jednu injekci PRP i.a., ve druhé skupině 2 inj. PRP v třítýdenním odstupu a třetí skupina měla placebo. Obě skupiny, které dostávaly PRP se zlepšily oproti placebu po 2 týdnech a toto zlepšení přetrvávalo až do 6. měsíce (21). Všechny provedené studie byly s cílem ovlivnit symptomy, zatím nebyla provedena žádná studie se zaměřením na ovlivnění struktury chrupavky.
Terapie se zaměřením na subchondrální kost
Velká část výzkumu OA v posledních letech byla věnována kloubní hyalinní chrupavce, a poměrně málo problematice subchondrální kosti. Nicméně několik zvířecích modelů ukázalo, že subchondrální kostní destička se ztlušťuje, ještě před rozvojem destrukce chrupavky. Zvířecí modely pak ukázaly zajímavý bifazický průběh poruch subchondrální osifikace když po iniciální ztrátě se hustota kostní tkáně v pozdních stadiích zvětšuje, což je patrné na rentgenovém snímku jako skleróza. Důvodem po toto chování může být zvýšená angiogeneze a subchondrální zánět (se zvýšenou porozitou) a katabolický efekt na kost, následovaný anabolickou fází a tvorbou sklerózy později (22). Tyto poznatky se staly racionálním důvodem pro terapeutické studie s preparáty ovlivňujícími kostní metabolismus u OA.
První zkoušenou skupinou léků u OA byly bisfosfonáty. Preklinické studie a zvířecí modely OA byly sice úspěšné (23), ale výsledky klinických studií s bisfosfonáty přinesly smíšené výsledky. V dvojslepé studii s 284 pacienty došlo po risedronátu oproti placebu k poklesu skóre WOMAC, ale nebyl žádný signifikantní rozdíl při ovlivnění šířky kloubní štěrbiny (24). Naopak v další dvouleté randomizované kontrolované studii nebyl nalezen žádný vliv ani na symptomy, ani na šířku kloubní štěrbiny (25).
Jiným mechanismem účinku působí stroncium ranelát (SrRan), který jednak inhibuje kostní resorpci a jednak zvyšuje kostní remodelaci (obr. 1). SrRan ovlivňuje nejen subchondrální osteoblasty, ale přímo chondrocyty, když in vitro stimuloval formování chrupavky (26). Při hodnocení rentgenogramů bederní páteře ve studii se SrRan u osteoporózy bylo zjištěno, že dochází k menší tvorbě osteofytů na obratlových tělech. Tyto nálezy a poznatky z experimentálních modelů se staly důvodem pro provedení velké, randomizované, kontrolované, tříleté studie se SrRan, která dostala jméno SEKOIA (27). Primárním cílem studie SEKOIA bylo prokázat zpomalující vliv léčby SrRan na šířku kloubní štěrbiny. K hodnocení byla použita validizovaná radiologická technika, tzn. postero-anteriorní snímek s upevněním končetiny v rámu s fixovaným úhlem. Pacienti dostávali buď SrRan 1 g denně, nebo 2 g denně nebo placebo. V obou skupinách léčených SrRan došlo oproti placebu ke zpomalení zužování šířky kloubní štěrbiny. Pacienti léčení 2 g SrRan denně měli i signifikantní pokles skóre WOMAC. Substudie části pacientů, kteří byli hodnoceni pomocí MRI, ukázala příznivý vliv SrRan na objem chrupavky a redukci tzv. lézí kostní dřeně (BML – bone marrow lesions). I když byl výsledek primárního kritéria, tzn. zužování kloubní štěrbiny pozitivní, numericky je rozdíl velmi malý (0,13 mm) a je otázkou, jaká je klinická relevance tohoto nálezu. Indikace OA pro SrRan je t.č. vyhodnocována EMA. Otázkou zůstává i bezpečnostní profil SrRan.
Obr. 1. Stronciumranelát – důvody podávání u OA Osteoblasty a chondrocyty mají stejný embryonální původ – v mezenchymu Stronciumranelát by mohl působit prostřednictvím receptorů citlivých na vápník (CaSR) exprimovaných chondrocyty (stimulace syntézy mezibuněčné hmoty). 
Dalším preparátem, který by mohl mít potenciál v léčbě OA, je zoledronát. Nedávno dokončená studie s jednou infuzí zoledronátu prokázala oproti placebu redukci množství otoku kostní dřeně (BML) (28).
Teoreticky velmi zajímavým preparátem pro léčbu OA by mohl být inhibitor RANKL denosumab, který zpomaloval destrukci chrupavky u RA. U OA ale nebyl denosumab zatím zkoušen.
Inhibitory katepsinu K mohou patřit mezi perspektivní DMOAD. V preklinických modelech byla ovlivněna subchondrální kost a efektem bylo menší poškození kloubní chrupavky (30). Klinická studie zatím provedena nebyla.
Dalším potenciálním DMOAD je kalcitonin. V jedné randomizované, kontrolované studii orální kalcitonin zlepšoval Lequesnův index, zatímco žádný efekt nebyl na bolest (29). Nasální forma kalcitoninu zlepšovala kvalitu života v jedné studii, ale limitací studie byla absence kontrolní skupiny (30). Problémy s toxicitou však činí další perspektivy kalcitoninu u OA velmi nepravděpodobnou.
Substituce vitaminem D neprokázala ani redukci bolesti ani vliv na objem chrupavky na MRI v dvouleté studii u OA (31).
Protizánětlivá léčba
Anticytokinová léčba
Opakovaně bylo prokázáno, že zánět hraje důležitou roli v progresi OA. Nejdůležitější jsou cytokiny IL - 1 a TNFα, přičemž IL-1β má pravděpodobně u OA větší roli než TNFα. IL-1 beta především stimuluje tkáně k produkci MMP, které degradují chrupavku. IL-1 je proto logickým cílem biologické léčby. Jednou z prvních možností byla aplikace IL-1 Ra, která sice neznamenala příliš efektivní potlačení IL-1β, nicméně pod názvem anakinra byla registrována pro použití u revmatoidní artritidy. Aplikace IL-1 Ra vedla k ochraně chrupavky na zvířecích modelech OA. Prvotní otevřené studie s i.a. aplikací anakinry u gonartrózy byly rovněž pozitivní. V randomizované, kontrolované studii v délce 12 týdnů však nebyl žádný rozdíl v ovlivnění bolesti mezi IL-1 Ra a placebem (32). Dalším preparátem, který byl zkoušen u OA, je monoklonální protilátka proti funkčnímu IL-1 receptoru AMG 108. V klinické studii však nebyl AMG účinnější než placebo (33). I když většina dosavadních studií s inhibicí IL-1 nebyla úspěšných, probíhá zkoušení dalších substancí, jako je účinná monoklonální protilátka proti IL-1 beta gevokizumabu u erozivní OA rukou, a dále pak studie s jednou i.a. aplikací canakinumabu u gonartrózy.
Bylo provedeno několik studií s aplikací infliximabu a adalimumabu především u erozivní OA rukou. Poslední velká, randomizovaná, kontrolovaná studie s adalimumabem v délce 1 roku u erozivní OA rukou neprokázala větší účinnost než placebo (34). Lze shrnout, že anti TNF léčba není pravděpodobně u OA účinná.
U erozivní OA rukou byly zkoušeny i další protizánětlivé léky, které se jinak používají u RA. Konkrétně jde o glukokortikoidy, methotrexát a antimalarika, výsledky však byly negativní.
Intraartikulární aplikace autologního kondiciovaného séra (Orthokine)
Metodika intraartikulární aplikace autologního kondiciovaného séra (ACS) spočívá v odběru krve pacientovi a její inkubaci ve speciálních skleněných zkumavkách. Dochází zde k indukci syntézy různých protizánětlivých cytokinů, jako je IL-1 Ra, IL-4, IL-10 a IL-13. Metodika ACS byla účinná v řadě otevřených studií, ale rigorózní randomizované, placebem a aktivním komparátorem kontrolované studie byly provedeny dvě, a to s kontroverzními výsledky. První studie neprokázala žádné rozdíly v ovlivnění symptomů (WOMAC, VAS, KOOS) mezi ACS a placebem (35). Druhá studie byla provedena v Německu a bylo do ní zařazeno 376 pacientů, kteří byli randomizováni do tří skupin: Orthokin, hyaluronová kyselina (HK) a placebo (fyziologický roztok). Měření byla prováděna v týdnu 7, 13 a 26 a studie hodnocena metodou ITT. Orthokin byl ve všech časových intervalech účinnější než placebo a HK. Mezi HK a placebem nebyl statisticky významný rozdíl. Rozdíl mezi ACS a HK přetrvával ještě 2 roky po skončení léčby (36). Definitivní důkaz je nutné přinést v další studii. Je také nutné prokázat vliv ACS na strukturální progresi OA.
Genová terapie
Artróza je kloubní onemocnění. Biologie kloubů však způsobuje, že je velmi obtížné docílit transferu léky bílkovinné povahy, jako jsou např. biologika. Genová terapie je velmi atraktivní v tom, že jediná může vyřešit tento problém. Principem je dlouhodobá exprese protizánětlivých cytokinů a růstových faktorů přímo v kloubu po přenosu genetické informace. Genová terapie byla zkoušena u revmatoidní artritidy i osteoartrózy, přičemž OA se zdá být vhodnější indikací. Při této léčbě je nutné jednak identifikovat vhodný cíl a dále vybrat adekvátní vektor, který provede efektivně přenos genetické informace. Jde však o nesmírně komplikovaný proces, který zakladatel této léčby Ch. Evans nazval mučící cesta ke klinice (tortuous path into the clinic). Prvním cílem, který byl zkoušen byl IL-1 Ra. Byl klonován IL-1 Ra cDNA do derivátu viru myší leukémie. Při transferu do kolen experimentálních zvířat s OA zvyšoval lokální produkci IL-1 Ra (37). Možná účinnost genové terapie na experimentálních modelech OA byla prokázána ve velkém množství studií, ale jen minimum studií v klinické medicíně bylo dokončeno a pouze tři protokoly dosáhly fáze II. klinického zkoušení a pouze dva protokoly v současné době probíhají (38) (tab. 3). Obě používají allogení chondrocyty, které exprimují TGFβ. Evans a spol. v současné době vyvíjejí in vivo genovou terapii, která používá rekombinantní virus sc AAV k transferu IL-1 Ra cDNA do OA kloubů.
Tab. 3. Genová terapie osteoartrózy (podle Evans CH, et al. Trans Res 2013;161(4):205-216). 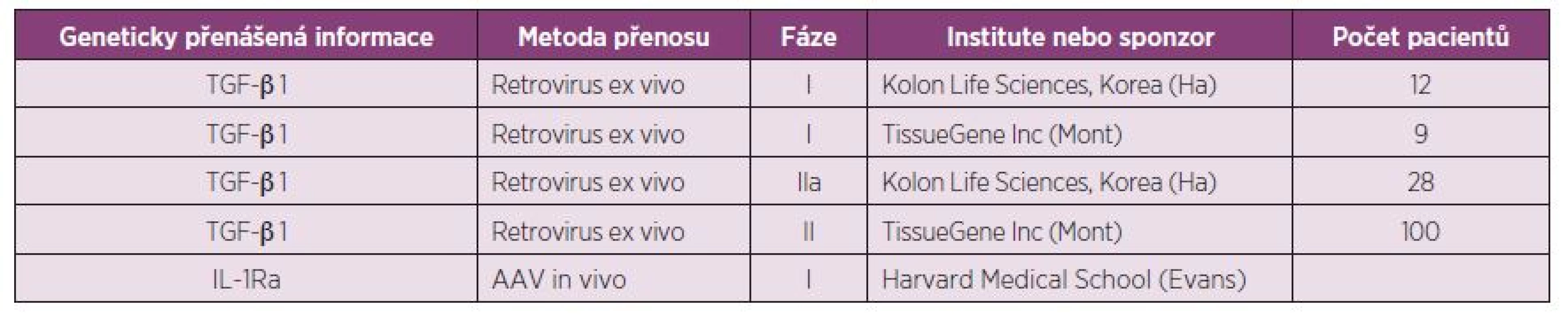
Inovativní chirurgické metodiky
Chirurgické metodiky lze rozdělit na skupinu, která obětuje kloub (alloplastika, artrodéza) a skupinu, která se snaží zachránit chrupavku (cartilage repair procedures). První skupina může být kontroverzní pro mladé pacienty. Mezi druhou skupinu řadíme: transfer osteochondrálního autograftu (mosaic plastika), transplantace solidního (masivního) aloštěpu, implantace autologních chondrocytů a autologní matrix-indukovaná chondrocytogenéza (AMIC). Existuje řada pozitivních studií, jejichž výsledky na dlouhodobý průběh OA je však nutné potvrdit.
Závěr
Osteoartróza je onemocnění celého kloubu (synovium, kost, tuk, chrupavka sval) a mnoha faktorů (biologických, biomechanických). Porozumění biomechanickým a molekulárním dějům především v časné fázi OA může definovat celou řadu cílů jak pro biologickou léčbu (synovitida, kostní remodelace, angiogenéza), tak pro biomechanické korekce (ortézy, osteotomie, rehabilitace). Po letech stagnace jsme možná blíže objevu skutečných DMOAD.
Adresa pro korespondenci:
Prof. MUDr. Karel Pavelka, DrSc.
Revmatologický ústav a Revmatologická klinika 1. LF UK
Na Slupi 4
128 50 Praha 2
tel.: 234 075 244
e-mail: pavelka@revma.cz
Zdroje
1. Dawson J, Linsell L, Zondervan K, et al. Epidemiology of hip and knee pain and its impal on overall health status in older adults. Rheumatology 2004; 43 : 497–504.
2. Kastelein M, Luijsterburg PA, Belo JN, et al. Six-year course and prognosis of nontraumatic knee symptoms in adults in general practice: a prospective cohort study. Arthritis Care Res 2011; 63(9): 1287–94.
3. Goldring MB. Chondrogenesis, chondrocyte differentiation and articular cartilage metabolism in health and osteoarthritis. Ther Adv Musculosceletal Dis 2012; 4 : 269–285.
4. Pavelka K, Gatterova J, Olejarova M, et al. Glucosamine sulphate use and delay of progression of knee osteoarthritis. Arch Intern Med 2002;162 : 2113–23.
5. Kahan A, Uebelhards D, De Vathaire F. Long-term effects of chondroitin sulphates on knee OA. The study on OA progression, prevention, a two year, radnomized, double blind, placebo controlled trial. Arthritis Rheum 2009; 60 : 524–33.
6. Dougados M, Nguyen M, Berdah L et al. Evaluation of the structure – modifying effects of diacerein in hip osteoarthritis: ECHODIAH, a three year ,placebo controlled trial. Evaluation of the chondromodulating effect of diacerein in OA of the hip. Arthritis Rheum 2001; 44 : 2539–47.
7. Maheu E, Cadet C, Marty M et al. Evaluation of the structure modifying effect of avocado-soybean unsaponifiables (ASU) in hip osteoarthritis. Results of ERADIAS study. A 3 year prospective, randomized, double blind, placebo controlled trial. Osteoarthritis cartilage 18: (Suppl 2)s. 560.
8. Gavenis K, Heussen N, Schmidt-Rohlfing B. Effects of low concentration BMP 7 on human osteoarthritic chondrocytes: comparison of different applications. J Biomater Appl 2012; 26 : 845–859.
9. Helio le Gravenerd MP, Clemmer RS, Redifer P, et al. A 2 year randomised, double blind, placebo controlled, multicentre study of oral selective i NOS inhibitor, cindunistat (SD-6010) in patients with symptomatic osteoarthritis of the knee. Ann Rheum Dis 2013; 72 : 187–195.
10. Estes BT, Diekman BO, Gimble JM, et al. Isolation of adipose –derived stem cells and thein induction to a chondrogenic phenotype. Nat Protoc 2010; 5 : 1294–1311.
11. Johnson K, Zhu S, Trembley MA, et al. A stem cell –based approach to cartilage repair. Science 2012; 336 : 717–721.
12. Alfageh H, Norhamdan MY, Chua KH, et al. Cell based therapy for osteoarthritis in a sheep model: gross and histological assessment. Med J. Malaysia 2008; 63: Suppl. 37–38.
13. Emadedin M, Aghdami N, Taghiyar L, et al. Intra-articular injection of autologous mesenchymal stem cells in six patients with knee osteoarthritis. Arch Iran Med 2012; 15(7): 422–428.
14. Koh YG, Jo SB, Kwon OR, et al. Mesenchymal stem cell injections improve symptoms of knee osteoarthritis. Arthroscopy 2013; 29(4): 748–755.
15. Pietrzak WS, An YH, Kang QK, et al. Platelet-rich and platelet-poor plasma: development of an animal model to evaluate hemostatic efficacy. J Craniofac Surg 2007; 18(3): 559–567.
16. Anitua E, Andia I, Ardanza B, et al. Autologous platelets as a source of proteins for healing and tissue regeneration. Tromb Haemost 2004; 91(1): 4–15.
17. Taylor DW, Petera M, Hendry M, Theodoropoulos JS. A systematic review of the use of platelet-rich plasma in sports medicine as a new treatment for tendon and ligament injuries. Clin J Sport Med 2011; 21(4): 344–352.
18. Kon E, Mandelbaum B, Buda R, et al. Platelet-rich plasma intra-articular injection versus hyaluronic acid viscosupplementation as treatments for cartilage pathology: from early degeneration to osteoarthritis. Arthroscopy 2011; 27(11): 1490–1501.
19. Filardo G, Kon E, Di Martino A, et al. Platelet-rich plasma vs hyaluronic acid to treat knee degenerative pathology: study design and preliminary results of a randomized controlled trial. BMC Musculoskelet Disord 2012; 13 : 229.
20. Sanchez M, Fiz N, Azofra J, et al. A randomized clinical trial evaluating plasma rich in growth factors (PRGF-Endoret) versus hyaluronic acid in the short term treatment of symptomatic knee osteoarthritis. Arthroscopy 2012; 28(8): 1070–1078.
21. Patel S, Dhillon MS, Aggarwal S, et al. Treatment with platelet-rich plasma is more effective than placebo for knee osteoarthritis: a prospective, double-blind, randomized trial. Am J Sports Med 2013; 41(2): 356–364.
22. Mapp PI, Walh DA, et al. Mechanism and targets of angiogenesis and nerve growth in osteoarthritis. Nat Rev Rheumatol 2012; 8 : 390–398.
23. Pelletier JP, Troncy E, Bertaim T, et al. Treatment with tiludronic acid helps reduce the development of experimental osteoarthritis lesions in dogs with anterior cruciate ligament transection followed by reconstructive surgery: a 1-year study with quantitative magnetic resonance imaging. J Rheumatol 2011; 38(1): 118–128.
24. Carbone LD, Nevitt MC, Wildy K, et al. The relationship of antiresorptive drug use to structural fundings and symptoms of knee osteoarthritis. Arthritis Rheum 2004; 50(11): 3516–3525.
25. Spector TD, Conaghan PG, Buckland-Wright JC, et al. Effect of risedronate on joint structure and symptoms of knee osteoarthritis: results of the BRISK radnomized, controlled trial (ISRCTN01928173). Arthritis Res Ther 2005; 7(3): R625–633.
26. Henrotin Y, Labasse A, Zheng SX, et al. Strontium ranelate increases cartilage matrix formation. J Bone Miner Res 2001; 16(2): 299–308.
27. Reginster JY, Badurski J, Bellamy N, et al. Efficacy and safety of strontium ranelate in the treatment of knee osteoarthritis: results of a double-blind, randomised placebo-controlled trial. Ann Rheum Dis 2013; 72(2): 179–186.
28. Laslett LL, Dore DA, Quinn SJ, et al. Zoledronic acid reduces knee pain and bone marrow lesions over 1 year: a randomised controlled trial. Ann Rheum Dis 2012; 71(8): 1322–1328.
29. Manicourt DH, Azria M, Mindeholm L, et al. Oral salmon calcitonin reduces Lequesne´s algofunctional index scores and decreases urinary and serum levels of biomarkers of joint metabolism in knee osteoarthritis. Arthritis Rheum 2006; 54(10): 3205–3211.
30. Esenyel M, Icagasioglu A, Esenyel CZ. Effects of calcitonin on knee osteoarthritis and quality of life. Rheumatol Int 2013; 33(2): 423–427.
31. McAlindon T, LaValley M, Schneider E, et al. Effect of vitamin D supplementation on progression of knee pain and cartilage volume loss in patients with symptomatic osteoarthritis: a randomized controlled trial. JAMA 2013;3 09(2):155–162.
32. Chevalier X, Goupille P, Beaulieu AD, et al. Intraarticular injection of anakinra in osteoarthritis of the knee: a multicenter, randomized, double-blind, placebo-controlled study. Arthritis Rheum 2009; 61(3): 344–352.
33. Cohen SB, Proudman S, Kivitz AJ, et al. A randomized, double-blind study of AMG 108 (a fully human monoclonal antibody to IL-1R1) in patients with osteoarthritis of the knee. Arthritis Res Ther 2011; 13(4): R125.
34. Verbruggen G, Wittoek R, Vander Cruyssen B, et al. Tumour necrosis factor blockade for the treatment of erosive osteoarthritis of the interphalangeal finger joints: a double blind, randomised trial on structure modification. Ann Rheum Dis 2012; 71(6): 891–898.
35. Yang KG, Raijmakers NJ, van Arkel ER, et al. Autolgous interleukin-1 receptor antagonist improves function and symptoms in osteoarthritis when compared to placebo in a prospective randomized controlled trial. Osteoarthritis Cartilage 2008; 16(4): 498–505.
36. Baltzer AW, Moser C, Jansen SA, et al. Autologous conditioned serum (Orthokine) is an effective treatment for knee osteoarthritis. Osteoarthritis Cartilage 2009; 17(2): 152–160.
37. Fernandes J, Tardif G, Martel-Pelletier J, et al. In vivo transfer of interleukin-1 receptor antagonist gene in osteoarthritic rabbit knee joints: prevention of osteoarthritis progression. Am J Pathol 1999; 154(4): 1159–1169.
38. Evans CH, Ghivizzani SC, Robbins D.: Arthritis gene therapy and its tortuous path into the clinic. Translational Res 2013; 161 : 205–216
Štítky
Dermatológia Detská reumatológia Reumatológia Chirurgia všeobecná Ortopédia Praktické lekárstvo pre dospelých
Článok vyšiel v časopiseČeská revmatologie
Najčítanejšie tento týždeň
2015 Číslo 1- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Kombinace metamizol/paracetamol v léčbě pooperační bolesti u zákroků v rámci jednodenní chirurgie
-
Všetky články tohto čísla
- Perspektivy léčby osteoartrózy
- Účinnost a bezpečnost intraartikulární aplikace depotních glukokortikoidů u revmatických onemocnění
- Editorial
- Systémový lupus erythematodes – kazuistika neobvyklého případu s krvácivými projevy
- Jozef Rovenský et al.: Gerontorevmatologie
- Polymorfismus C677T genu pro methylentetrahydrofolát reduktázu je spojen se změnou léčebné odpovědi na methotrexát v populaci revmatoidní artritidy Východočeského regionu
- Česká revmatologie
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Účinnost a bezpečnost intraartikulární aplikace depotních glukokortikoidů u revmatických onemocnění
- Perspektivy léčby osteoartrózy
- Systémový lupus erythematodes – kazuistika neobvyklého případu s krvácivými projevy
- Polymorfismus C677T genu pro methylentetrahydrofolát reduktázu je spojen se změnou léčebné odpovědi na methotrexát v populaci revmatoidní artritidy Východočeského regionu
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



