-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Masivní gastrointestinální krvácení u pacientky s Wegenerovou granulomatózou – kazuistika
Massive gastrointestinal bleeding in a female patient with Wegener‘s granulomatosis – case report
Wegener‘s granulomatosis (WG) is a systemic necrotizing vasculitis of unknown etiology characterized by the involvement of the upper airways, lungs, and kidneys. Acute massive gastrointestinal bleeding as a manifestation of WG is very rare with only few reports published so far – often with a fatal outcome. We describe a case of a young woman originally admitted to hospital with renal and upper airway involvement, who later developed a life-threatening lower gastrointestinal bleeding. The source of the bleeding was not revealed by standard examination methods. Since it is often very difficult or even impossible to find the real source of the bleeding, many patients undergo explorative surgery with extensive resection of small or large intestine. In such cases, the administration of recombinant Human factor VIIa can be an organ - and life-saving procedure as was also shown in our patient.
Key words:
Wegener‘s granulomatosis, NovoSeven, gastrointestinal bleeding
Autori: D. Frausová; M. Brejníková; H. Šafránková; Z. Hrušková; V. Tesař
Pôsobisko autorov: Klinika nefrologie 1. LF UK a VFN Praha
Vyšlo v časopise: Čes. Revmatol., 17, 2009, No. 4, p. 214-217.
Kategória: Kazuistiky
Súhrn
Wegenerova granulomatóza (WG) je systémová nekrotizující vaskulitida neznámé etiologie charakterizovaná zejména postižením ORL oblasti, plic a ledvin. Akutní masivní krvácení do zažívacího traktu jako projev Wegenerovy granulomatózy je velmi vzácné a dosud bylo publikováno jen nemnoho takových případů – často s fatálními následky. My předkládáme případ mladé ženy přijímané s iniciálním postižením ledvin a anamnézou projevů v ORL oblasti, u které došlo k rozvoji akutního život ohrožujícího krvácení do dolního gastrointestinálního traktu. Zdroj krvácení se standardními vyšetřovacími metodami nepodařilo nalézt. Obtížná a často nemožná diagnostika přesného zdroje krvácení vede v těchto případech obvykle k probatornímu chirurgickému výkonu s resekcí značné části tenkého či tlustého střeva. Orgán a život zachraňujícím výkonem může v takovém případě být podání rekombinantního faktoru VII, jak jsme dokumentovali i my na osudu naší pacientky.
Klíčová slova:
Wegenerova granulomatóza, NovoSeven, gastrointestinální krváceníÚvod
Wegenerova granulomatóza (WG) je systémová nekrotizující vaskulitida neznámé etiologie charakterizovaná zejména postižením horních cest dýchacích, plic a ledvin. I když může být postižen kterýkoliv orgánový systém, postižení gastrointestinálního traktu je relativně vzácné (1).
Postižení gastrointestinálního traktu u nekrotizujících vaskulitid (polyarteritis nodosa, mikroskopická polyangiitida, Wegnerova granulomatóza, Churg-Strauss syndrom) může mít řadu projevů – vředové léze žaludku a duodena, tenkého i tlustého střeva případně komplikované krvácením, náhlá příhoda břišní s peritonitidou jako důsledek perforace střeva, střevní infarkty a okluze, akutní appendicitida, cholecystitida, pankreatitida. Zejména peritonitida, perforace střeva, ischemické postižení a okluze střeva jsou zatížené zvýšenou mortalitou.
Pomocným vodítkem pro diagnózu onemocnění je přítomnost protilátek proti cytoplazmě neutrofilních leukocytů (ANCA) v plazmě, obvykle podtypu c (s cytoplazmatickým typem fluorescence) – proti proteinkináze 3 z primárních granul neutrofilních leukocytů. Pacienti dle klasické definice jsou ANCA pozitivní v 90 % případů, a proto se WG (spolu s mikroskopickou polyangiitidou a syndromem Churga a Straussové) řadí mezi tzv. ANCA-asociované vaskulitidy (AAV). Vedle pomoci při určení diagnózy má titr ANCA význam pro hodnocení aktivity nemoci a určení agresivity terapie. Limitované formy Wegenerovy granulomatózy postihují omezený počet orgánů a nemusejí být provázeny ANCA pozitivitou.
Standardním léčebným postupem generalizované formy WG je podávání kombinované imunosupresivní terapie kortikoidy a cyklofosfamidem, v situaci orgánového selhávání jsou indikovány výměnné plazmaferézy.
K diagnostice zdroje krvácení v dolní části GIT využíváme endoskopické metody (koloskopie, enteroskopie), angiografii a. mesenterica, případně scintigrafii. Při endoskopickém vyloučení zdroje krvácení v horních partiích gastrointestinálního traktu jsou dalšími diagnostickými možnostmi koloskopie, mesenterická angiografie nebo scintigrafie. Všechny tyto metody mají své limity vzhledem k možnosti zcela nepředvídatelných zdrojů krvácení a často neobjasní zdroj krvácení. V této situaci je jednou z možností provedení totální kolektomie (chirurgického výkonu) „naslepo“ s event. peroperačním endoskopickým vyšetřením tenkého střeva s nadějí na odstranění krvácejícího zdroje.
V roce 1999 schválila FDA podávání aktivovaného rekombinantního faktoru VII (rFVIIa, NovoSeven) pacientům s hemofilií a inhibitory koagulace k léčbě krvácivých komplikací. Od té doby se tento preparát stále častěji využívá off-label v nejrůznějších klinických situacích ke kontrole refrakterního život ohrožujícího krvácení u pacientů bez hemofilie (2). V České republice je postup v řešení život ohrožujícího krvácení shrnut v konsensuálním stanovisku odborných společností. Podání preparátu NovoSeven je vázáno na indikaci hematologa a anesteziologa.
My uvádíme případ takového život ohrožujícího gastrointestinálního krvácení u pacientky s nově diagnostikovanou AAV, u které byl úspěšně podán rekombinantní aktivovaný faktor VII.
Popis případu
24letá pacientka dosud zcela zdravá, s negativní rodinnou anamnézou byla přijímaná pro akutní renální insuficienci (hladina urey 10 mmol/l kreatininu 290 μmol/l) s aktivním močovým sedimentem (mikroskopická hematurie, proteinurie), pozitivními zánětlivými parametry (hladina C-reaktivního proteinu 220 mg/l).
V krátkém předchorobí udávala progredující únavu a artralgie, které se rozvíjely po přeléčeném infektu horních cest dýchacích, opakované epistaxe, všimla si tvroby krust v dutině nosní, prodělala otitis media. Rozvoj příznaků byl „odstartován“ nekomplikovaným porodem druhého dítěte – potíže se objevily do 1 měsíce po porodu. Časový interval mezi vznikem příznaků a přijetím do nemocnice činil 1 měsíc.
Během těhotenství nebyly zaznamenány patologické laboratorní výsledky (proteinurie) ani zvýšený krevní tlak.
Z nálezů získaných v místě prvního kontaktu byl negativní rentgenový snímek plic, echokardiografie, ve fyzikálním nálezu byly nápadné vaskulitické změny na kůži obličeje a periferii končetin, normální ASLO. Vzhledem k dominující renální problematice byla přeložena na naše pracoviště.
V diferenciálně diagnostické rozvaze zde figurovaly na prvním místě postinfekční glomerulonefritida a rychle progredující glomerulonefritida (RPGN), případně alergická tubulointersticiální nefritida vzhledem k anamnéze užívání antibiotik.
Ve vstupních laboratorních odběrech byla zaznamenána další progrese renálních funkcí, hypoalbuminémie, hypochromní normocytární anémie, elevace C-reaktivního proteinu.
Možnost provést základní imunologické vyšetření statimově (ANCA protilátky, anti-GBM protilátky – protilátky proti bazální membráně glomerulů) napomohla rychlému stanovení diagnózy. Vysoký titr c-ANCA protilátek (vyšší než 100 U/ml, norma 0–5) potvrdil podezření na diagnózu Wegenerovy granulomatózy s RPGN.
Negativní rentgenový snímek s němým klinickým obrazem vyloučily ev. plicní hemoragii a tím pulmorenální syndrom.
Ihned byla zahájena standardní terapie onemocnění – kortikosteroidy (methylprednisolon 500 mg ve třech po sobě následujících dnech) s následným přechodem na perorální prednison v dávce 50 mg (1 mg/kg) a byla podána první dávka intravenózního cyklofosfamidu (12,5 mg/kg).
Třetí den hospitalizace pacientka po vertikalizaci zkolabovala, v krevním obraze jsme zaznamenali pokles hemoglobinu na hladinu 63 g/l, klinicky se objevila enteroragie. Horní endoskopie neodhalila zdroj krvácení. Po substituci krevními transfuzemi klinický stav stabilizován, koagulační parametry byly v normě.
Vzhledem k suspekci na vaskulitické postižení gastrointestinálního traktu a rychlé progresi renální insuficience byly zahájeny výměnné plazmaferézy v denním režimu.
Laboratorní i klinický stav pacientky se dále komplikoval. Pro progresi známek hyperhydratace a další nárůst renálních parametrů jsme byli nuceni přistoupit k zahájení hemodialyzační léčby.
V odstupu 3 dnů od první epizody enteroragie došlo k recidivujícím masivním odchodům koagulované krve z konečníku. V rámci diagnostiky zdroje krvácení byla provedena koloskopie, angioCT břišní aorty, byl přivolán chirurg, konzultován intervenční angiolog.
Při koloskopickém vyšetření (pro špatnou přehlednost při přítomnosti koagul jen orientační) bylo patrné masivní krvácení ze sliznice tračníku, dalším nálezem byly necharakteristické papilózní hyperplazie na sliznici levého tračníku, cékum a Bauhinská chlopeň nebyly pro množství koagul přehledné.
Možný zdroj krvácení podle nálezu na angioCT vyšetření břišní aorty byl v orální kličce jejuna. Intervenční angiolog ale endovaskulární výkon neindikoval vzhledem k suspektnímu difuznímu krvácení bez jednoznačně ošetřitelného zdroje. Chirurgický konziliář ze stejného důvodu neindikoval výkon chirurgický. Proto jsme postupovali dále konzervativně.
Přes takto masivní krvácení reagovala pacientka hypertenzní reakcí vyžadující podávání dvojkombinace parenterálních antihypertenziv (urapidil, nitrát). Klinicky byly ale patrné známky centralizace a rozvíjejícího se šokového stavu s pocitem žízně, zimy, chladné periferie, bledé kůže, počínajícího neklidu.
Během této druhé epizody krvácení (16 hodin) bylo celkem podáno 10x TU erymas, 6 TU mražené plazmy, 2 trombokoncentráty. Hladina hemoglobinu přes tuto masivní substituci nedosáhla nad hladinu 60 g/l. Stav jsme hodnotili jako život ohrožující krvácení se selháním standardních postupů a po konzultaci s hematologem bylo indikováno podání rekombinantního aktivovaného faktoru VII (preparát NovoSeven) v iniciální dávce 120 μg/kg a 90 μg/kg v odstupu 4 hodin. Podání bylo spojeno se subjektivní úlevou a objektivní stabilizací klinického stavu. Substituce krevními deriváty byla nutná ještě dva následující dny (celkem 6x TU erymas, 1x trombokoncentrát ze separátoru, 2 TU mražené plazmy).
Následující den byla doplněna enteroskopie, na které byly popsány 4 vtažené defekty s bílou spodinou v jejunu, byly odebrány vzorky k histologickému vyšetření. Makroskopicky byla sliznice křehká s drobnými sufuzemi.
Překvapivě se histologický nález významněji nelišil od normy, vaskulitické změny nebyly zastiženy.
Kontrolní koloskopické vyšetření bylo provedeno s odstupem 1 měsíce jen s makroskopickými známkami slizniční atrofie.
Součástí terapie základního onemocnění byly výměnné plazmaferézy (celkem provedeno 6 plazmaferéz).
Přechodné zhoršení renálních funkcí si vyžádalo 3 hemodialýzy.
15. den byla pacientka přeložena na standardní nefrologické oddělení a 25. den byla propuštěna do domácího a ambulantního ošetřování. V současné době (po roce) je ambulantně léčena udržovací imunosupresivní terapií a základní onemocnění je v remisi. Přetrvává renální insuficience s kreatininem 150 μmol/l GF 0,9 ml/s.
Diskuse
I když se může nekrotizující vaskulitida u pacientů s WG manifestovat v jakémkoli orgánu, případů WG projevujících se masivním gastrointestinálním krvácením bylo dosud publikováno velmi málo (1, 3, 4, 5, 6). Obecně se uvádí, že postižení zažívacího traktu se vyskytuje u 10–24 % pacientů s WG (3).
Dostupná data jsou omezená na malé soubory pacientů, pitevní nálezy a kasuistiky – např. Fauci a Wolff (7) publikovali soubor 18 pacientů s WG, z nichž pouze jeden měl postižení zažívacího traktu (zjištěno post mortem). Lie (8) vyhodnotil histologické nálezy 216 pacientů s WG a nalezl postižení gastrointestinálního traktu u 14 pacientů (6,5 %). V práci z roku 2005 (9) bylo v souboru 62 pacientů se systémovou vaskulitidou a současně gastrointestinálním postižením 6 pacientů s diagnostikovanou WG.
Navíc z post mortem studií vyplývá, že postižení zažívacího traktu není často klinicky diagnostikováno – pacienti jsou asymptomatičtí nebo jsou příznaky imunosupresivní léčbou maskovány.
Pokud se GI postižení manifestuje, může být obraz velmi variabilní – nejčastěji je zmiňována bolest břicha, dyspeptické obtíže – nauzea, zvracení, průjem, krvácivé projevy (hematemeza, melena, enteroragie), alterace jaterních testů, ascites (tab. 1). Život ohrožující může být potom rozvoj závažných komplikací (tab. 2). Nejčastěji postiženým úsekem zažívacího traktu bývá tenké střevo.
Tab. 1. Projevy postižení gastrointestinálního traktu u WG. 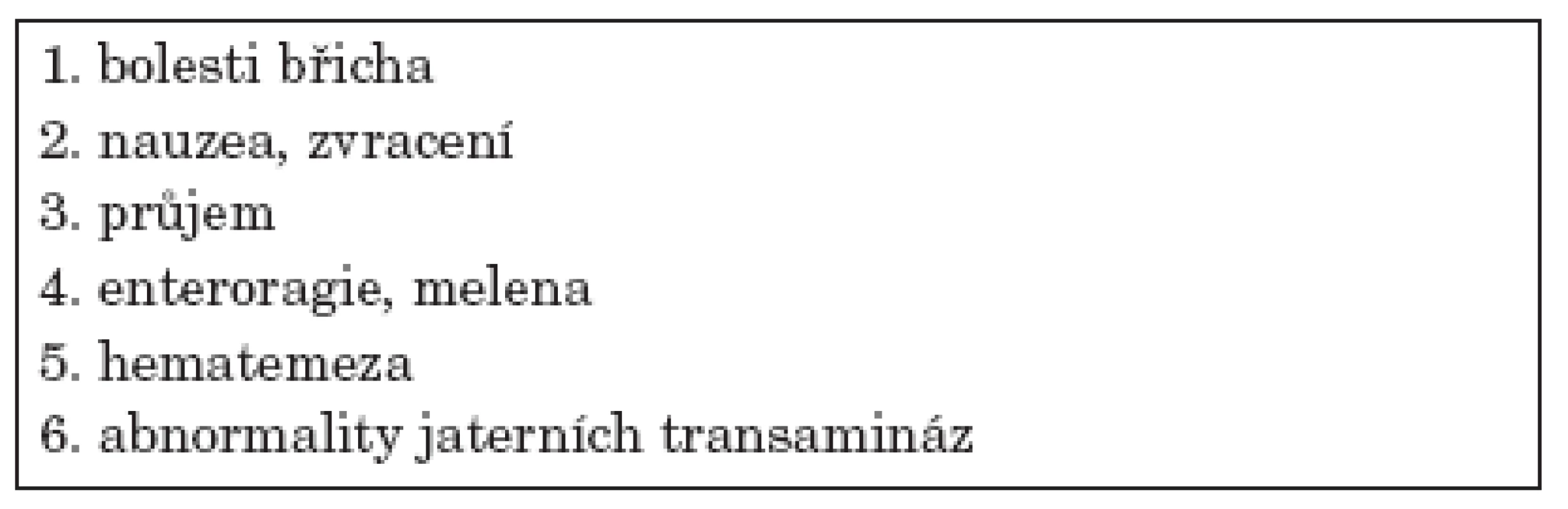
Tab. 2. Komplikace postižení gastrointestinálního traktu uWG 
Diferenciální diagnostika krvácení do GIT u pacientů s vaskulitidou je velmi obtížná. Protože jsou pacienti s vaskulitidou často léčeni vysokými dávkami kortikosteroidů, je třeba pro volbu kauzálního léčebného postupu rozhodnout, zda se jedná o projev aktivity onemocnění či komplikaci imunosupresivní terapie.
Klinické projevy vaskulitického GI postižení mohou navíc napodobovat nespecifický střevní zánět (Crohnova choroba), infekční zánět (tyfus, střevní tuberkulóza, CMV infekce), případně ischemickou enterokolitidu. Radiologické nálezy (difuzní nebo mnohočetné zesílení střevní stěny, ileozní stav nebo pneumoperitoneum při perforační příhodě, ascites, porucha mesenteriální cirkulace) nejsou specifické a etiologii objasnit nepomohou (10).
Výše uváděné příčiny jsme se snažili vyloučit i v našem případě. Jak bylo zmíněno, radiodiagnostické metody příčinné souvislosti přesně neodhalily.
Histologický průkaz vaskulitických lézí ve střevě byl prokázán u 24 % vyšetřených případů (5), jiné práce uvádějí průkaz vaskultických změn v mnohem menším procentu případů (1 pacient ze souboru 65 pacientů v práci Camilleriho a spol. (6), 3 pacienti z 62 případů v práci Pagnouxe a spol. (9)). Ve většině vyšetřených bioptických vzorcích byly prokázány pouze nespecifické akutní nebo chronické zánětlivé infiltráty často se slizničními vředy. Podobně u naší pacientky jsme histologicky vaskulitické změny ve střevě neprokázali.
Postižení tenkého či tlustého střeva, které si vyžádá chirurgický výkon, je spojeno s vyšší mortalitou (pětileté přežití 56 % vs. 82 % u neoperovaných pacientů) (9). V publikovaných kazuistikách masivního krvácení do zažívacího traktu byl výkon spojen s resekcí značné části střeva či byl osud pacienta fatální (5).
V iniciální fázi léčby je jistě prostor pro konzervativní postup s podáváním a substitucí „tradičními“ krevními deriváty a transfuzními přípravky se současným zajištěním diagnostického algoritmu k odhalení zdroje krvácení. Pokud je zdroj krvácení nalezen a je možné jej chirurgicky ošetřit, je terapeutický postup směřován k chirurgickému výkonu.
V případě, že se nepodaří zdroj krvácení jednoznačně odhalit, je vyloučena možnost endovaskulárního stavění krvácení. Pokud krvácení pokračuje, máme možnost pacienta zatížit probatorním chirurgickým výkonem – obyčejně se jedná o výkon z vitální indikace u oběhově nestabilního pacienta spojený s rizikem dalších komplikací, zejména rozvojem syndromu multiorgánové dysfunkce. Navíc peroperačním nálezem je často difuzní postižení/ krvácení sliznice, které si vyžádá resekci značného úseku střeva. Možnost záchrany orgánu má významný vliv pro další osud pacienta vč. kvality života. Syndrom krátkého střeva s nutností domácí parenterální výživy, ke kterému může takový chirurgický výkon vést, je závažný stav. To jsme vzali v úvahu i u naší pacientky.
Podání aktivovaného faktoru VII je v takových případech selhání standardních postupů orgán i život zachraňujícím výkonem, jak jsme dokumentovali i my na našem případě.
MUDr. Frausová D.
Klinika nefrologie 1. LF UK a VFN Praha
U Nemocnice 2
128 00 Praha 2
e-mail fraus@centrum.cz
Zdroje
1. Coward RA, Gibbons CP, Brown CB, Raftery AT, Parsons MA, Shortland JR. Gastrointestinal haemorrhage complicating Wegener‘s granulomatosis. Br Med J (Clin Res Ed) 1985; 291 : 865–866.
2. Shander A, Goodnough LT, Ratko T., Matuszewski KA, Cohn S, Diringer M, et al. Consensus Recommendations for the off-label use of recombinant human factor VIIa (NovoSeven®) Therapy. Pharmacy & Therapeutics 2005; 30(11): 644–655.
3. Deger SM, Sahin T, Vural C, Aygencel G, Kerem M, Onal B, et al. Wegener‘s granulomatosis with massive gastrointestinal hemorrhage due to jejunal and colonic involvement: Report of a case. Surgery today 2008; 38(2): 166–9.
4. Strivens RL, Bateman A, Arden NK and Edwards, CJ. Intestinal perforation and jejunal haemorrhage due to Wegener‘s granulomatosis. Clinical and Experimental Rheumatology 2005; 23 (1): 124–124.
5. Steele CH, Bohra S, Broe P, Murray FE. Acute upper gastrointestinal haemorrhage and colitis: an unusual presentation of Wegener‘s granulomatosis. Eur J Gastroenterol Hepatol 2001; Aug; 13(8): 993–5.
6. Camilleri M, Pusey CD, Chadwick VS, Rees AJ. Gastrointestinal manifestation of systemic vasculitis. Q J Med 1983; Spring; 52(206): 141–149.
7. Fauci AS, Wolff SM. Wegener‘s granulomatosis: studies in eighteen patients and a review of the literature. Medicine (Baltimore) 1973; Nov; 52(6):535–561.
8. Lie JT. Wegener‘s granulomatosis: histologic documentation of common and uncommon manifestations in 216 patients. Vasa 1997; 26 : 261–270.
9. Pagnoux C, Mahr A, Cohen P, Guillevin L. Presentation and outcome of gastrointestinal involvement in systemic necrotizing vasculitides: analysis of 62 patients with polyarteritis nodosa, microskopic polyangiitis, Wegener‘s granulomatosis, Churg-Strauss syndrome, or rheumatoid arthritis-associated vasculitis. Medicine (Baltimore) 2005; Mar; 84(2): 115–28.
10. Deniz K, OzŖeker HS, Balas S, Akpýnar E, Sökmensüer C. Intestinal involvement in Wegener‘s granulomatosis. J Gastrointestin Liver Dis 2007; Sep; 16(3): 329–31
Štítky
Dermatológia Detská reumatológia Reumatológia
Článek OBSAH ROČNÍKU 17/2009
Článok vyšiel v časopiseČeská revmatologie
Najčítanejšie tento týždeň
2009 Číslo 4- První zkušenosti s léčbou psoriázy bimekizumabem v české reálné praxi – kazuistika z FNUSA
- Na český trh přichází biosimilar adalimumabu s prokázanou terapeutickou ekvivalencí
- Nehoňte nemocné s mMCC od čerta k ďáblu!
-
Všetky články tohto čísla
- Sérová hladina kyseliny hyaluronové – prediktivní biomarker rentgenové progrese osteoartrózy kloubů rukou
- Leflunomid v současném algoritmu léčby revmatoidní artritidy
- Anti-PM-Scl protilátky u myositid
- Proteíny tepelného šoku – dôležitá súčasť imunitnej odpovede
- Masivní gastrointestinální krvácení u pacientky s Wegenerovou granulomatózou – kazuistika
- VIII. Slapské symposium Měřín 28. – 30. května 2009
- OBSAH ROČNÍKU 17/2009
- Česká revmatologie
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Anti-PM-Scl protilátky u myositid
- Proteíny tepelného šoku – dôležitá súčasť imunitnej odpovede
- Leflunomid v současném algoritmu léčby revmatoidní artritidy
- Sérová hladina kyseliny hyaluronové – prediktivní biomarker rentgenové progrese osteoartrózy kloubů rukou
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



