-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Vliv neuroprotekce na mozkové metabolické parametry při karotické endarterektomii
Autoři: Jan Mraček 1; Irena Holečková 1; Pavel Lavička 1; Jan Mork 1; David Štěpánek 1; Petra Štruncová 1; Václav Červený 2
Působiště autorů: Univerzita Karlova v Praze, Lékařská fakulta v Plzni, Neurochirurgické oddělení FN 1; Univerzita Karlova v Praze, Lékařská fakulta v Plzni, Anesteziologicko-resuscitační klinika FN 2
Vyšlo v časopise: Čas. Lék. čes. 2011; 150: 489-493
Kategorie: Původní práce
Souhrn
Východisko:
Primárním cílem práce bylo zhodnotit dopady neuroprotekce podané při karotické endarterektomii na metabolické mozkové parametry. Sekundárním cílem bylo zjistit zda eventuální změny mozkového metabolismu mají vliv na výsledný klinický stav.Materiál a metoda:
Sledovaný soubor obsahuje 35 nemocných, kteří podstoupili karotickou endarterektomii s preventivním podáním kombinované neuroprotekce (Sendai koktejl: Manitol, Phenhydan, Solumedrol, Tokoferol; Cerebrolysin; 100% O2, střední arteriální tlak 100 mm Hg, celková anestezie). Zhodnocen byl vliv neuroprotekce na tyto mozkové metabolické parametry: S100B protein, glykémie, laktát, pH, saturace jugulárního bulbu – SvjO2. Parametry mozkového metabolismu byly nabírány z homolaterální vena jugularis interna v průběhu operace před uvolněním cévních svorek. Výsledný klinický stav byl hodnocen prostřednictvím NIHSS (National Institutes of Health Stroke Scale). Kontrolním souborem bylo 35 nemocných operovaných bez neuroprotekce. Výsledky sledovaných parametrů v obou souborech byly zhodnoceny, porovnány a statisticky zpracovány.Výsledky:
Ve sledovaném souboru byly zjištěny signifikantně vyšší hladiny S100B proteinu (medián 0,117 vs. 0,088; p < 0,0182), laktátu (medián 1,92 vs. 1,020; p < 0,0006), glykémie (medián 9,5 vs. 8,2; p < 0,0243) a SvjO2 (medián 0,79 vs. 0,65; p < 0,0001). Hodnoty pH se v obou souborech signifikantně nelišily. NIHSS se v obou souborech po operaci nezměnilo.Závěr:
Podání neuroprotekce před karotickou endarterektomií ovlivnilo některé parametry mozkového metabolismu, a to jak pozitivně tak i negativně, avšak bez dopadu na výsledný klinický stav.Klíčová slova:
neuroprotekce, karotická endarterektomie, celková anestezie, mozkový metabolismus.ÚVOD
Karotická endarterektomie (CEA) je účinná operace v primární i sekundární prevenci mozkového infarktu za předpokladu, že morbidita a mortalita (MM) operace na pracovišti nepřesahuje doporučovanou úroveň (1). Komplikace CEA lze rozdělit na neurologické, interní a chirurgické. Za neurologickou MM je z velké části zodpovědná peroperační ischemická cévní mozková příhoda (iCMP) způsobená embolizací nebo hypoperfuzí. Snahou operačního týmu je minimalizovat riziko vzniku peroperační iCMP, resp. hloubku neurologického deficitu, pokud k iCMP dojde. Vznik iCMP po operaci, jejímž cílem je právě vzniku ischemické příhody zabránit, je vždy frustrující komplikací.
Jednou z možností jak snížit následky peroperační iCMP je užití neuroprotektivních opatření. Neuroprotekce je definována jako strategie působící proti škodlivým biochemickým a molekulárním dějům, které, pokud zůstanou neovlivněny, vedou k ischemickému poškození mozku (2). Přes prokazatelný pozitivní vliv neuroprotekce na zmenšení rozsahu ischémie u zvířecího modelu dosud nebyl prokázán statisticky signifikantní léčebný efekt neuroprotekce ve III. fázi klinického testování (3). Za hlavní příčinu neúspěchu neuroprotekce u nemocných s akutním mozkovým infarktem je považováno příliš dlouhé terapeutické okno (3, 4). Účinnost neuroprotekce v preklinickém výzkumu byla prokázána při podání do 6 hodin od vzniku příznaků iCMP. Největšího efektu však bylo dosaženo při podání před vznikem příhody (5). Toto zjištění vedlo ke vzniku nového konceptu tzv. profylaktické neuroprotekce (6). Preventivní používání neuroprotektiv před rizikovými výkony z pohledu vzniku iCMP (typickým příkladem je právě CEA), by mohlo nemocným přinést benefit.
Výskyt peroperační iCMP při CEA je však velmi nízký. Ve velkých sestavách se pohybuje v intervalu od desetin procenta až po jednotlivá procenta. K posouzení vlivu neuroprotekce na výskyt iCMP by proto bylo nezbytné hodnotit soubory obsahující řádově tisíce pacientů. Tak vysokých počtů při prospektivním sledování lze metodicky dosáhnout pouze v mezinárodních multicentrických studiích. Dosud nebyla podobná studie publikována. Již ze samotné definice neuroprotekce je zřejmé, že vzniku vlastní iCMP předchází změny na biochemické úrovni (mozkový metabolismus). V naší studii proto hodnotíme vliv neuroprotekce na mozkové metabolické parametry a souvislost s eventuálními následnými klinickými konsekvencemi.
SOUBOR NEMOCNÝCH A POUŽITÉ METODY
Do prospektivní studie byli zařazeni nemocní, u kterých byla provedena elektivní CEA pro symptomatickou stenózu vnitřní krkavice (ACI). Vstupními kritérii byl stav po prodělané tranzitorní ischemické atace (TIA) nebo dokonané malé iCMP s minimálním reziduálním neurologickým deficitem (National Institutes of Health Stroke Scale – NIHSS < 3), nález na počítačové tomografii (CT) bez známek čerstvé hypodenzity, symptomatická stenóza ACI přesahující 50 % dle CT angiografie a podepsaný informovaný souhlas. Do studie nebyli zařazeni nemocní, u kterých by aktuální klinický stav, insuficience kolaterálního cévního řečiště nebo aktuální stav mozkové tkáně mohly ovlivnit hodnocené parametry (operace do 14 dnů od vzniku iCMP, neurologická nestabilita, závažný reziduální neurologický deficit, kontralaterální okluze ACI, čerstvá hypodenzita na CT).
V uvedeném období byla provedena CEA u 35 nemocných s využitím preventivní kombinované neuroprotekce (tab. 1). Neuroprotektivní strategie zahrnovala podání Sendai koktejlu (20% Manitol 150 ml, Phenhydan 500 mg, Solumedrol 1g – vše i.v. + Tokoferol 300 mg i.m.) a Cerebrolysinu 50 ml i.v. v úvodu do celkové anestezie, ventilaci 100% 02 (Fi02 = 1) a elevaci středního arteriální tlaku (MAP) na hodnotu 100 mm Hg v období zasvorkování tepen. Do neuroprotektivní strategie patřilo i použití standardní neuroanestezie využívané při CEA (TIVA – totální intravenózní anestezie): kontinuální i.v. podávání 1% Propofolu (3–10 mg/kg/h) a opakované bolusy relaxancia a opioidu (Atracurium 0,1–0,15 mg/kg, Sufentanyl 5–10 microg).
Tab. 1. Kombinace použitých neuroprotektivnich strategií 
Operace byly prováděny mikrochirurgickou technikou s peroperační elektrofyziologickou monitorací nervových funkcí (elektroencefalografie, oboustranné somatosenzorické evokované potenciály nervus medianus).
Kontrolním souborem bylo 35 nemocných operovaných bez aplikace uvedených neuroprotektivních opatření v cervikálním bloku.
Primárním cílem práce bylo sledování hodnot metabolických mozkových parametrů (S100B protein, glykémie, laktát, pH, saturace jugulárního bulbu – SvjO2), které byly získávány v průběhu operace punkcí homolaterální vnitřní jugulární žíly. Náběr žilní krve byl proveden před uvolněním cévních svorek.
Sekundárním cílem bylo zjistit, zda eventuální změny mozkového metabolismu mají vliv na výsledný klinický stav, který byl hodnocen prostřednictvím NIHSS před operací a po operaci.
Sledované parametry byly vyhodnoceny a výsledky v obou souborech porovnány a statisticky zpracovány. Statistická analýza byla provedena s užitím software Statistica 9.0.
VÝSLEDKY
Ve sledovaném dvouletém období byla CEA s využitím neuroprotekce provedena u 35 nemocných (25 mužů, 10 žen) ve věku 44–77 let (medián 65). Devět nemocných mělo před operací lehký reziduální neurologický deficit (NIHSS 1–3), ostatní měli normální neurologický nález. U kontrolního souboru (24 mužů, 11 žen, věk 48–84, medián 69) byla provedena operace bez neuroprotekce ve stejném dvouletém období. Deset nemocných mělo před operací lehký reziduální neurologický deficit (NIHSS 1–3), ostatní měli normální neurologický nález.
Statisticky významné rozdíly hodnot metabolických parametrů byly prokázány u S100B proteinu, laktátu, glykémie a SvjO2. Nevýznamné rozdíly byly zjištěny v případě pH.
Ve sledovaném souboru ve srovnání se souborem kontrolním byly zjištěny signifikantně vyšší hladiny S100B proteinu (min. 0,018, medián 0,117, max. 0,335 vs. min. 0,022, medián 0,088, max. 0,262; p < 0,0182), laktátu (min. 0,050, medián 1,92, max. 3,540 vs. min. 0,670, medián 1,020, max. 3,580; p < 0,0006), glykémie (min. 5,1, medián 9,5, max. 17,6 vs. min. 4,8, medián 8,2, max. 16,0; p < 0,0243) a SvjO2 (min. 0,56, medián 0,79, max. 0,97 vs. min. 0,51, medián 0,65, max. 0,83; p < 0,0001 (graf 1, 2, 3 a 4).
V obou souborech nebyla zaznamenána žádná peroperační iCMP, předoperační a pooperační NIHSS se nelišilo u žádného nemocného. Nebyl prokázán statisticky signifikantní rozdíl mezi sledovaným (neuroprotekce) a kontrolním souborem v předoperačním ani pooperačním neurologickém stavu (NIHSS 0 – 74% vs. 71% , NIHSS 1 – 17% vs. 17% , NIHSS 2 – 3% vs. 9%, NIHSS 3 – 6% vs. 3%). Zjištěné rozdíly v hodnotách mozkových metabolických parametrů neovlivnily výsledný klinický stav.
DISKUZE
K provedení prezentovaného výzkumu jsme měli dva důvody. Jednak to byl velmi nízký výskyt symptomatických peroperačních iCMP (0,5%) a nízká frekvence zavádění peroperačního shuntu (2,75%) v našem dosavadním souboru CEA. Shunt zavádíme na našem pracovišti výrazně méně často, než se uvádí v literatuře (6–16 %) (7–9). Dosažené výsledky si vysvětlujeme pozitivním vlivem uvedené kombinace neuroprotektivních opatření a celkové anestezie, které užíváme standardně a dlouhodobě (10).
Druhou motivací k zahájení výzkumu byla idea nového konceptu profylaktické neuroprotekce, která vykazuje větší benefit neuroprotekce při aplikaci před začátkem iCMP (6). Kombinace TIVA s baterií preventivních neuroprotektivních opatření, jejichž podání je celkovou anestezií podmíněno, je typickým příkladem uvedeného konceptu.
Neuroprotektivní účinnost všech postupů použitých v naší studii byla prokázána stejně jako u všech dosud používaných neuroprotektiv, pouze v experimentálních studiích a klinických studiích fáze jedna a dva (11–15). Větší šanci na úspěch má kombinace (koktejl) různých neuroprotektivních přípravků působících na několika etážích patofyziologické ischemické kaskády (4). Největší neuroprotektivní efekt zjistil Cheng při podání přípravku ještě před vznikem vlastní příhody (5). Náš způsob kombinující několik neuroprotektivních strategií (farmakologických, fyzikálních) aplikovaných profylakticky před potenciálním vznikem iCMP oba uvedené požadavky naplňuje. Celkovou anestezii považujeme za nezastupitelnou součást použitých neuroprotektivních opatření, která je navíc podmínkou podání celé baterie opatření (umožňuje FiO2 = 1). V literatuře se uvádí dostatek spolehlivých důkazů o profylaktickém působení neuroanestezie (16).
Pacienti sledovaného a kontrolního souboru neměli signifikantně rozdílnou demografickou charakteristiku ani vstupní neurologický obraz a timing operace. Všichni nemocní byli po operaci nepřetržitě 24 hodin sledováni na neurochirurgické JIP, kde bylo hodnoceno i první NIHSS. V tomto období jsme byli schopni spolehlivě detekovat nejenom iCMP, ale i symptomaticky drobné TIA a jiné projevy potenciálně související s peroperační hypoperfuzí nebo mikroembolizací (psychická alterace, zmatenost, delirium, kognitivní poruchy). Přes zmíněné důkladné klinické sledování nebyla zaznamenána žádná z uvedených příhod, NIHSS se po operaci v obou souborech nezměnilo a nelišilo.
S výjimkou nemocných po velké iCMP, operujeme všechny nemocné se symptomatickými stenózami krkavice co nejdříve po proběhlé příhodě podle současných platných guidelines (1). Timing operací nebyl v žádném případě cíleně odkládán, aby vyhověl vstupním kritériím studie. Dlouhý časový odstup operací od proběhlých příhod je dán pozdním odesíláním nemocných z neurologických pracovišť a nezařazením skupiny nemocných paradoxně správně operovaných do 14 dnů od iCMP.
Markery metabolismu mozkové tkáně byly stanoveny z krve získané v průběhu operace punkcí vnitřní jugulární žíly před uvolněním cévních svorek. V tomto období, kdy je homolaterální mozková hemisféra zásobena více či méně suficientním kolaterálním oběhem, lze nejpravděpodobněji očekávat potenciální hypoperfuzi s negativním dopadem na metabolismus mozku.
Vyšší hladiny S100B proteinu byly překvapivě prokázány v souboru s neuroprotekcí (p < 0,0182) (graf 1). S100B protein je kalcium vážící protein, který je v posledních letech používán jako marker závažnosti poškození mozku. Jeho biologický poločas není známý (17). Lavička et al. uvádějí, že k normalizaci hodnot S100B proteinu u nemocných s lehkým mozkovým poškozením dochází během tří dnů (18). Abychom měli jistotu, že hladina S100B proteinu není ovlivněna primární iCMP, nebyli do studie zařazeni nemocní operovaní do 14 dnů a nemocní po větší ischemické příhodě. Ve studii jsme nezjistili souvislost mezi hladinou S100B proteinu a časovým intervalem od proběhlé iCMP (timingem operace). Hladiny S100B proteinu byly sice ve sledovaném souboru signifikantně vyšší (p < 0,0182), ale ve většině případů (83 %) se pohybovaly na horní hranici normy (0,001–0,14 microg/l). Extracerebrální zdroje S100B proteinu (placenta, tuková tkáň kostí při zlomenině) se v naší studii nemohly uplatnit.
Graf 1. S100B protein Signifikantně vyšší hodnoty ve sledovaném souboru (p < 0,0182) 
Překvapivé je zjištění, že ve sledovaném souboru byla pozorována i signifikantně vyšší hladina laktátu (p < 0,0006), přestože součástí podané neuroprotekce byl interval vdechování 100% kyslíku při řízené ventilaci (graf 2). Nabídka kyslíku v arteriální krvi převyšovala jeho spotřebu více než při fyziologických podmínkách (19). Laktát vzniká spalováním cukrů při nedostatku kyslíku (anaerobní glykolýza), jeho vzestup je dokladem omezené oxidativní fosforylace. Vzestup laktátu by se dal vysvětlit hypoxií, systémovou hypotenzí nebo větší krevní ztrátou (20). V úvodu do anestezie, v jejím průběhu ani při vlastní operaci však nebyla zaznamenána žádná z uvedených příhod. Hladina laktátu stejně jako ostatních metabolických parametrů byla navíc získávána na konci fáze, kdy byl nemocný ventilován 100% O2. Vzestup laktátu nebyl doprovázen laktátovou acidózou (poklesem pH).
Graf 2. Laktát Signifikantně vyšší hodnoty ve sledovaném souboru (p < 0,0006) 
Ve sledovaném souboru byla zjištěna i signifikantně vyšší hladina glukózy (p < 0,0243), (graf 3). V této souvislosti je významné, že nebyl mezi oběma skupinami zjištěn rozdíl ve výskytu diabetes mellitus (DM) a nebyl ani prokázán vztah výskytu DM a zvýšené glykémie. Metabolismus glukózy, laktátu a kyslíku spolu úzce souvisí. Hyperglykémie zvyšuje rozsah ischemického ložiska a vede k metabolickému posunu směrem k anaerobní glykolýze, jejímž důsledkem je vzestup laktátu (12). Hyperglykémie je z pohledu patofyziologie mozkové ischémie jednoznačně škodlivým faktorem (21). Udává se, že zvýšená glykémie je ve více než 50% průvodním jevem mozkového infarktu (stresová hyperglykémie) (13). Toto vysvětlení však v naší studii nelze uplatnit, neboť žádný z nemocných neprodělal peroperační iCMP. Na druhé straně vyšší hladina glukózy ve vzorku krve z jugulární žíly může souviset s nižším metabolickým obratem glukózy (CMRGl) při nižších energetických nárocích mozku ovlivněného neuroprotekcí. Tuto interpretaci podporuje i zjištěná signifikantně vyšší SvjO2 u sledovaného souboru (p < 0,0001), kterou lze vysvětlit nižší spotřebou kyslíku (snížený mozkový metabolický obrat kyslíku – CMRO2) nebo jeho zvýšenou dodávkou (graf 4). Na obou uvedených mechanismech se pravděpodobně podílela podaná neuroprotekce. Průměrná spotřeba kyslíku v mozku (O2ER – oxygen extraction ratio) byla ve sledovaném souboru nižší než v souboru kontrolním (21 % vs. 33 %).
Graf 3. Glykémie Signifikantně vyšší hodnoty ve sledovaném souboru (p < 0,0243) 
Graf 4. Saturace v jugulárním bulbu Signifikantně vyšší hodnoty ve sledovaném souboru (p < 0,0001) 
Zjištěné hodnoty metabolických markerů lze považovat za kontroverzní. Některé posuzované parametry mozkového metabolismu byly neuroprotekcí ovlivněny pozitivně, jiné negativně (tab. 2). Překvapivě vyšší hladina S100B proteinu a laktátu ve sledovaném souboru hovoří jednoznačně v neprospěch neuroprotekce. Také vyšší hodnoty glukózy byly zjištěny ve sledovaném souboru. Přestože hyperglykémie akceleruje patofyziologické změny v ischemickém ložisku a v experimentu zvětšuje objem infarktu, lze ji také považovat za projev nižších metabolických potřeb mozku a z tohoto úhlu pohledu interpretovat tuto skutečnost i jako pozitivní vliv neuroprotekce. Vyšší SvjO2 u sledovaného souboru je pak jednoznačně pozitivním vlivem neuroprotekce.
Tab. 2. Vliv neuroprotekce na hodnocené parametry 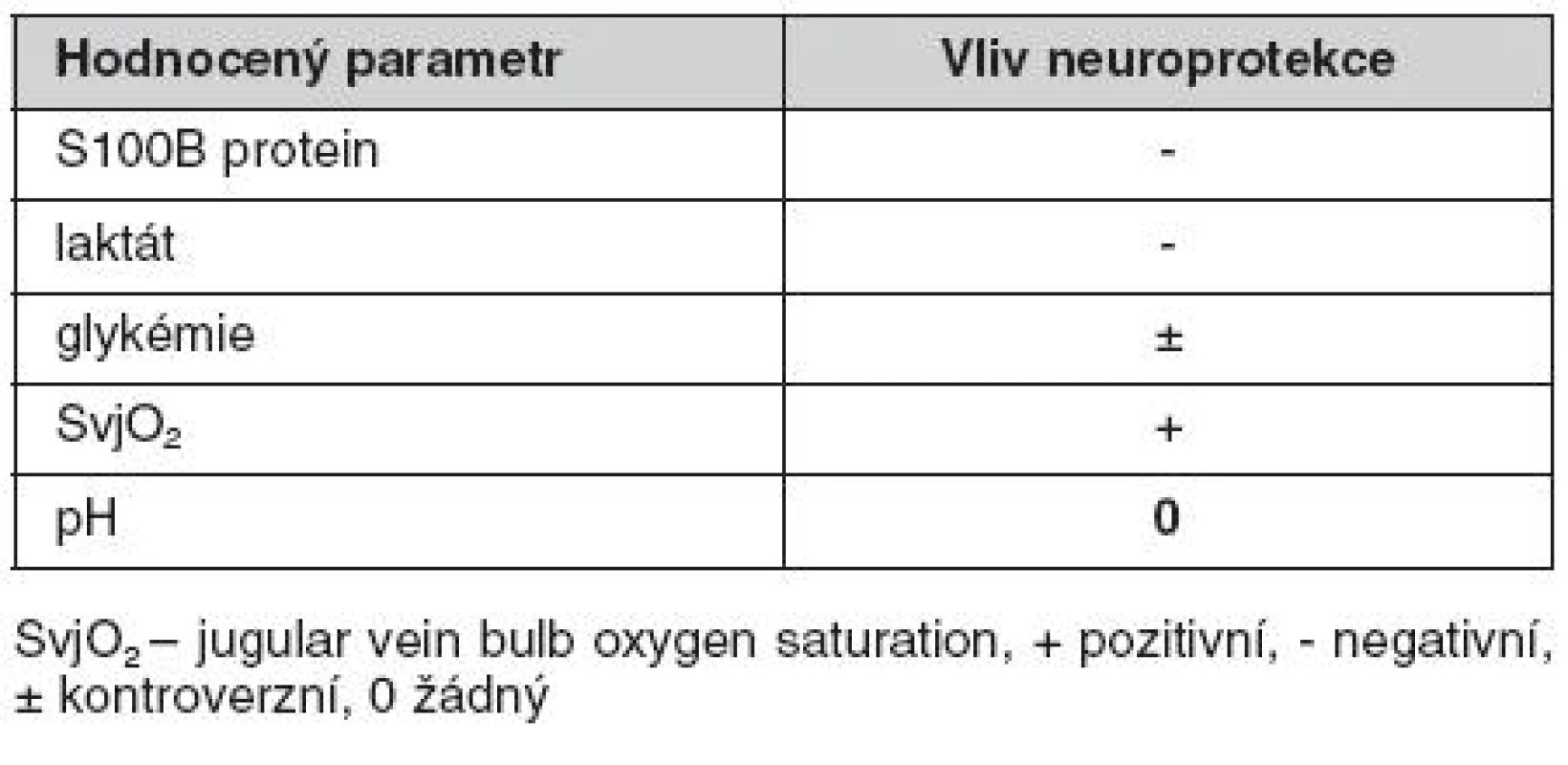
V naší studii jsme se snažili zjistit vzájemnou souvislost mezi zjištěnými hodnotami metabolických markerů. Statisticky signifikantní korelace mezi zvýšenou hladinou S100 beta proteinu, glykémie a laktátu však nebyla prokázána.
ZÁVĚR
Dopady kombinace neuroprotektivních strategií před CEA na sledované cíle jsou kontroverzní. Neuroprotekce použitá v naší studii ovlivnila některé parametry mozkového metabolismu jak ve smyslu pozitivním, tak negativním, avšak bez vlivu na výsledný klinický stav. Neprokázali jsme statisticky signifikantní korelaci mezi hodnotami jednotlivých hodnocených metabolických parametrů.
Naše neočekávané zklamání z nejednoznačných výsledků tak odpovídá všeobecné deziluzi z neúspěchu neuroprotekce v klinických studiích. Podle posledních guidelines European Stroke Organisation (ESO) v současnosti není žádné doporučení léčby neuroprotektivy u pacientů s ischemickým iktem (třída I, úroveň A). V nejbližší době nelze očekávat, že by se indikace použití neuroprotekce stala součástí „evidence based medicine“. Terapeutické postavení neuroprotekce u akutní iCMP je dosud založeno na experimentálních studiích. S ohledem na uvedené skutečnosti je při použití neuroprotektiv třeba brát v úvahu poměr přínosu a nákladů (cost/ benefit).
Přestože neuroprotektiva v léčbě akutní iCMP u lidské populace dosud selhávají, je třeba pokračovat v dalším klinickém výzkumu a nevyhýbat se publikaci i negativních výsledků.
Zkratky
- ACI – arteria carotis interna
- CEA – karotická endarterektomie
- CMP – cévní mozková příhoda
- CMRGl – cerebrální metabolickým obrat glukózy
- CMRO2 – cerebrální metabolický obrat kyslíku
- CT – počítačová tomografie
- DM – diabetes mellitus
- ESO – European Stroke Organisation
- FiO2 – fraction of inspired oxygen
- iCMP – ischemická CMP
- JIP – jednotka intenzivní péče
- MM – morbidita a mortalita
- NIHSS – National Institutes of Health Stroke Scale
- O2ER – oxygen extraction ratio
- SvjO2 – saturace jugulárního bulbu
- TIA – tranzitorní ischemická ataka
- TIVA – total intravenous anesthesia
ADRESA PRO KORESPONDENCI:
MUDr. Jan Mraček
Neurochirurgické oddělení FN
Alej Svobody 80, 304 60 Plzeň
fax: +420 377 103 963,
e-mail: mracek@fnplzen.cz
Zdroje
1. The European Stroke Organisation (ESO) Executive Comittee and the ESO Writing Committee. Guidelines for management of ischemic stroke and transient ischaemic attack 2008. Cerebrovasc Dis 2008; 25 : 457–507.
2. Ginsberg MD. Neuroprotection for ischemic stroke: past, present and future. Neuropharmacology 2008; 55(3): 363–389.
3. Ginsberg MD. Current status of neuroprotection for cerebral ischemia: synoptic overview. Stroke 2009; 40 : 111–114.
4. Savitz SI, Fisher M. Future of neuroprotection for acute stroke: in the aftermath of the SAINT trials. Ann Neurol 2007; 61 : 396–402.
5. Cheng YD, Al-Khoury L, Zivin JA. Neuroprotection for ischemic stroke: two decade of success and failure. NeuroRx 2004; 1 : 36–45.
6. Savitz SI, Fisher M. Prophylactic neuroprotection. Current Drug Targets 2007; 8 : 846–849.
7. Beneš V. Ischémie mozku. Chirurgická a endovaskulární léčba. Praha: Galén 2003.
8. Kim GE, Cho YP, Lim SM. The anatomy of the circle of Willis as a predictive factor for intra-operative cerebral ischemia (shunt need) during carotid endarterectomy. Neurol Res 2002; 24(3): 237–240.
9. Astarci P, Guerit JM, Robert A, Elkhoury G, Noirhomme P, Rubay J, et al. Stump pressure and somatosensory evoked potentials for predicting the use of shunt during carotid surgery. Ann Vasc Surg 2007; 21(3): 312–317.
10. Mraček J, Richtr P, Bludovský D, Holečková I. Karotická mikroendarterektomie. Čas Lék čes 2003; 9 : 541–544.
11. Mraček J. Farmakologická neuroprotekce u akutní ischemické cévní mozkové příhody. Cesk Slov Neurol N 2011; 74/107(1): 22–28.
12. Kalvach P, et al. Mozkové ischémie a hemoragie. 3. vydání: Praha: Grada Publishing 2010.
13. Kalita Z, et al. Akutní cévní mozkové příhody. Praha: Maxdorf Jessenius 2006.
14. Yuan Z, Liu W, Liu B, Schnell A, Liu KJ. Normobaric hyperoxia delays and attenuates early nitric oxide production in focal cerebral ischemic rats. Brain Res 2010; 1352 : 248–254.
15. Chalmers J, Macmahon S, Anderson C, Neal B, Rodgers A. Clinical manual on blood pressure and stroke prevention (second edition) . London: Science Press 2000.
16. Bayona NA, Gelb AW, Jiang Z, Wilson JX, Urquhart BL, Cechetto DF. Propofol neuroprotection in cerebral ischemia and its effects on low-molecular-weight antioxidants and skilled motor tasks. Anestesiology 2004; 100(5): 1151–1159.
17. Zimmer DB, Cornwall EH, Landar A, Song W. The S100 protein family: history, function, and expression. Brain Res Bull 1995; 37(4): 417–429.
18. Lavička P, Pikner R, Kormunda S, Topolčan O, Bosman R, Chytra I, et al. Význam stanovení S100B proteinu u pacientů s izolovaným poraněním hlavy. Cesk Slov Neurol N 2007; 70/103(5): 521–526.
19. Frackowiak RS, Lenzi GL, Jones T, Heather JD. Quantitative measurement of regional cerebral blood flow and oxygen metabolism in man using O2 and positron emission tomography: theory, procedure, and normal values. J Comput Assist Tomogr 1980; 4(6): 727–736.
20. Chytra I, Pradl R, Bosman R, Pelnář P, Kasal E, Žídková A. Esophageal Doppler-guided fluid management decreases blood lactate levels in multiple-trauma patients: a randomized controlled trial. Crit Care 2007; 11(1): R24.
21. Lindsberg PJ, Roine RO. Hyperglycemia in acute stroke. Stroke 2004; 35 : 363–364.
Štítky
Adiktológia Alergológia a imunológia Anestéziológia a resuscitácia Angiológia Audiológia a foniatria Biochémia Dermatológia Detská dermatológia Detská gastroenterológia Detská gynekológia Detská chirurgia Detská kardiológia Detská nefrológia Detská neurológia Detská onkológia Detská otorinolaryngológia Detská pneumológia Detská psychiatria Detská rádiológia Detská reumatológia Detská urológia Diabetológia Endokrinológia Farmácia Farmakológia Fyzioterapia Gastroenterológia a hepatológia Genetika Geriatria a gerontológia Gynekológia a pôrodníctvo Hematológia Hygiena a epidemiológia Hyperbarická medicína Chirurgia cievna Chirurgia hrudná Chirurgia plastická Chirurgia všeobecná Infekčné lekárstvo Intenzívna medicína Kardiochirurgia Kardiológia Logopédia Mikrobiológia Nefrológia Neonatológia Neurochirurgia Neurológia Nukleárna medicína Nutričný terapeut Obezitológia Oftalmológia Onkológia Ortodoncia Ortopédia Otorinolaryngológia Patológia Pediatria Pneumológia a ftizeológia Popáleninová medicína Posudkové lekárstvo Praktické lekárstvo pre deti a dorast Protetika Psychológia Rádiodiagnostika Rádioterapia Rehabilitácia Reprodukčná medicína Reumatológia Sestra Sexuológia Súdne lekárstvo Stomatológia Telovýchovné lekárstvo Toxikológia Traumatológia Urgentná medicína Urológia Laboratórium Domáca starostlivosť Foniatria Algeziológia Zdravotníctvo Dentální hygienistka Student medicíny
Článok vyšiel v časopiseČasopis lékařů českých
Najčítanejšie tento týždeň
- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Nejasný stín na plicích – kazuistika
-
Všetky články tohto čísla
- Perspektivy péče o zdraví a zdravotnictví
- Spolek lékařů českých v Praze
- Strategické prvenství slizničního imunitního systému v obraně a toleranci
- Häcker HO, Stapf KH (Hrsg.): DORSCH PSYCHOLOGISCHES WÖRTERBUCH
- Vliv neuroprotekce na mozkové metabolické parametry při karotické endarterektomii
- Celostátní sjezd Společnosti lékařské genetiky ČLS JEP a 44. výroční cytogenetická konference
- Problematika rozmístění a použití automatizovaných externích defibrilátorů v České republice
- Plánované akce odborných složek ČLS JEP
- Důstojnost člověka a lékařská etika
- Příprava 8. rámcového programu Evropské unie – priorita Health (Evropská komise připravuje návrh zaměření biomedicínského výzkumu s výhledem do roku 2020)
- O Nobelových cenách, ale nejen o nich Nad knihou Erlinga Norrbyho: „Nobel Prizes-Life Sciences“ (World Scientific Publishing Co.Pte. Ltd., Singapore, 2010)
- Extraezofageální refluxní choroba – mezioborový konsenzus
- Hygiena ženy III - Druhá polovina 17. století a 18. století
- 45. česko-slovenské dny dětské neurologie (Plzeň, 26.–28. května 2011)
- XXXIII. pracovní dny sekce radiofarmacie (Rožnov pod Radhoštěm, 1. až 3. června 2011)
- XXX. dny mladých internistů České a Slovenské republiky (Olomouc, 2. až 3. června 2011)
- XXV. olomoucké hematologické dny s mezinárodní účastí (OHD) – krátké ohlédnutí od historie po současnost
- MAX LUDWIG HENNING DELBRÜCK
- Časopis lékařů českých
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Hygiena ženy III - Druhá polovina 17. století a 18. století
- Důstojnost člověka a lékařská etika
- Strategické prvenství slizničního imunitního systému v obraně a toleranci
- Extraezofageální refluxní choroba – mezioborový konsenzus
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



