-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Trombofilní stavy v těhotenství
Thrombophilic conditions during pregnancy
The risk of venous thromboembolic events is high during pregnancy due to both the physiologic changes of pregnancy and the additional impact of inherited or acquired thrombophilias. The women with thrombophilia are at increased risk not only of pregnancy-related venous thromboembolism (VTE), but also other pregnancy-related complications, including early and late miscarriage, intrauterine growth retardation, placental abruption and pre-eclampsia. Depending on the type of thrombophilia, personal and family history of VTE and history of complications during pregnancy, prophylactic treatment with low molecular weight heparin or unfractionated heparin is recommended. For women with thrombophilia and history of complications during pregnancy, a combination of low dose aspirin and heparin can increase the probability of live birth. On the other hand, pregnant women on prophylactic or therapeutic anticoagulation require individualized delivery plans addressing the obstetric, anaesthetic and thrombotic concerns.
Keywords:
pregnancy – thrombophilia – prophylaxis – anaesthetic management
Autoři: J. Mannová 1; M. Penka 2; P. Štourač 3
Působiště autorů: Anesteziologicko-resuscitační oddělení, Nemocnice Havlíčkův Brod 1; Oddělení klinické hematologie, Fakultní nemocnice Brno a Lékařská fakulta Masarykovy univerzity, Brno 2; Klinika dětské anesteziologie a resuscitace, Fakultní nemocnice Brno a Lékařská fakulta Masarykovy univerzity, Brno 3
Vyšlo v časopise: Anest. intenziv. Med., 27, 2016, č. 6, s. 380-389
Kategorie: Anestezie v gynekologii a porodnictví - Přehledový článek
Souhrn
Zvýšené riziko hluboké žilní trombózy v těhotenství je dáno jak fyziologickými změnami během gravidity, tak přidruženými rizikovými faktory. Vrozené i získané trombofilní stavy riziko trombembolických komplikací (VTE) v graviditě významně zvyšují. Samotná míra rizika záleží na typu trombofilního stavu, osobní a rodinné anamnéze hluboké žilní trombózy u rodičky. U těhotných s trombofilií je i vyšší riziko těhotenských komplikací, mezi ně patří časné a pozdní ztráty těhotenství, růstová retardace plodu, placentární abrupce a preeklampsie. Na základě předchozí anamnézy výskytu hluboké žilní trombózy, těhotenských komplikací a typu trombofilie jsou doručována profylaktická opatření spočívající v antikoagulační terapii a v rámci profylaxe těhotenských komplikací i podávání nízko dávkované ASA. Cílem této terapie je snížit riziko hluboké žilní trombózy a tím potenciálně velmi nebezpečné plicní embolie a u těhotenských komplikací zvýšit pravděpodobnost narození živého dítěte. Na druhou stranu rodička se zavedenou antitrombotickou terapií je náročnější z hlediska anesteziologické péče a je třeba s tím počítat při vedení porodu a i z hlediska plánování vhodné porodnické anestezie a analgezie.
Klíčová slova:
těhotenství – trombofilie – profylaxe – anesteziologický managementÚVOD
Hluboká žilní trombóza v těhotenství se vyskytuje přibližně v 1 případě na 1 000 těhotenství. Více než 50 % žilních trombóz je diagnostikováno v prvních 20 týdnech gravidity, ale za nejrizikovější období se považuje období porodu a první tři týdny po něm. S hlubokou žilní trombózou je spojeno riziko plicní embolie, která patří mezi nejobávanější komplikace v těhotenství, protože představuje nejčastější příčinu úmrtí rodičky ve vyspělých zemích [1–3]. Z tohoto důvodu je problematice trombembolické nemoci (VTE) v těhotenství věnována významná pozornost.
Během těhotenství dochází k fyziologickým změnám, které vedou ke zvýšenému riziku hluboké žilní trombózy. Stoupá prokoagulační aktivita, naopak klesá fibrinolytická aktivita, zpomaluje se průtok krve žilním řečištěm. V průběhu porodu dochází také k poranění pánevních cév. Na zvýšení prokoagulační aktivity se podílí vzestup koncentrace fibrinogenu, faktorů V, VIII, IX a X vedoucí ke zvýšené tvorbě trombinu. Naopak snížení fibrinolytické aktivity je dáno zvýšením aktivity inhibitoru aktivátoru plazminogenu a snížením aktivity tkáňového aktivátoru plazminogenu. Stáza žilní krve je navozena progesteronem indukovanou dilatací žil, kompresí žil zvětšenou dělohou a útlakem levé ilické žíly pravou ilickou arterií. Zpomalení průtoku žilním řečištěm začíná již v 1. trimestru, následně stoupá a je nejvyšší v 36. týdnu. K endoteliálnímu poranění pánevních cév dochází i při fyziologickém vaginálním porodu, ale je samozřejmě vyšší v případě operačního řešení či traumatu [1–7].
Všechny tyto změny v těhotenství vedou k tomu, že relativní riziko hluboké žilní trombózy je u těhotných asi pětkrát až sedmkrát vyšší. V období po porodu toto riziko ještě narůstá, v prvních šesti týdnech je asi 15–35násobné, následně riziko VTE klesá a vyrovnává se s rizikem ostatních žen [1, 4, 8–10].
Riziko trombembolických komplikací v těhotenství je ještě navýšeno vyšším věkem rodičky nad 35 let, u obézních žen, komplikovaným protrahovaným porodem, operačním porodem, infekčními komplikacemi a v důsledku trombofilního stavu [1, 3, 4, 11].
VROZENÉ A ZÍSKANÉ TROMBOFILIE
Nejznámější a nejčastěji diagnostikované trombofilní stavy jsou stavy vrozené (Leidenská mutace – FVL, protrombinová mutace, deficity inhibitorů koagulace) a získané (antifosfolipidový syndrom, lupus antikoagulans). Riziko pro ženu s trombofilním stavem spočívá jednak ve vyšším riziku hluboké žilní trombózy během těhotenství, ale také v možných těhotenských komplikacích.
Vrozené trombofilie
Nejčastějším diagnostikovaným vrozeným trombofilním stavem je Leidenská mutace faktoru V, která je způsobena záměnou argininu na 506. pozici glutaminem, což následně vede k rezistenci faktoru V vůči aktivovanému proteinu C. U homozygotů s touto mutací je riziko hluboké žilní trombózy 35násobně vyšší, někteří autoři udávají až 80–100násobné zvýšení rizika. U heterozygotů je riziko žilní trombózy asi 3–12násobné, v průměru asi 8násobné [12–14]. Leidenská mutace se vyskytuje u 3–5 % evropské populace, ale například v židovské populaci je její výskyt až 31% [12].
Druhou nejčastější vrozenou trombofilií je mutace 20210 v genu pro protrombin, kdy dochází k záměně guaninu za adenin, což způsobuje vyšší stabilitu protrombinové mRNA a vede ke zvýšeným hladinám plazmatického protrombinu. Tato mutace se objevuje u 2–6 % populace v Evropě a vede ke zvýšení rizika VTE u homozygotů až 26krát, u heterozygotů je udáváno relativní riziko 6násobné. Z diagnostikovaných žilních trombóz v těhotenství, pokud je zjištěna trombofilie, je právě 44 % spojeno s Leidenskou mutací a asi 17 % s protrombinovou mutací [15].
Další tři nejčastější vrozené trombofilní stavy jsou způsobeny defekty inhibitorů koagulace – antitrombinu, proteinu C a proteinu S. Deficit antitrombinu byl popsán jako první z vrozených trombofilních stavů, jeho dědičnost je autosomálně dominantní. Rozlišovány jsou dva typy:
- typ I – kvantitativní redukce funkčně normálního antitrombinu,
- typ II – kvalitativní, kdy je produkován abnormální protein.
První typ kvantitativního deficitu je častější a je zjišťován u 80 % symptomatických pacientů. V humánní genové databázi mutací je popsáno 235 různých mutací antitrombinového genu [2]. Relativní riziko hluboké žilní trombózy u deficitu antitrombinu je zvýšeno přibližně 17krát, u typu I až 25–50krát [2,3]. V případě proteinu C jsou rozlišovány mutace vedoucí ke kvantitativnímu (typ I) a kvalitativnímu (typ II) deficitu. Ve většině případů se jedná o deficit prvního typu. Prevalence výskytu deficitu proteinu C je v populaci kolem 0,2–0,3 % a je detekována u 3–5 % pacientů s VTE [2, 3, 4]. Relativní riziko žilní trombózy je u těchto pacientů zvýšeno asi 5krát, přičemž rozmezí zvýšení rizika podle typu deficitu je 2–10násobné [2]. Většina deficitů proteinu S je vrozená, rozlišovány bývají tři typy deficitu (kvantitativní, kvalitativní a snížení volného proteinu S), jejich výskyt v Evropě je udáván do 0,2 %, vyšší výskyt je u populací v Asii. Zvýšení rizika VTE u pacientů s deficitem proteinu S je udáváno asi 1–5násobné [12, 13, 16, 17].
Diskutovaná bývá i role genové mutace MTHFR vedoucí v některých případech ke zvýšeným hladinám homocysteinu, ale vyšší riziko hluboké žilní trombózy v těhotenství nebylo potvrzeno [15].
I když zvýšená rizika VTE jsou popisována u všech trombofilních stavů, za nejvíce rizikové jsou považovány Leidenská mutace a protrombinová mutace, především v homozygotní formě. U těchto mutací je relativní riziko žilní trombózy zvýšeno 8–100násobně u těhotných žen s trombofilií. Homozygotní mutace FVL a FII patří mezi nejrizikovější a někdy jsou označovány jako tzv. silné trombofilní stavy. Na druhou stranu i těhotné s nejčastějšími mutacemi – heterozygotní Leidenská mutace a heterozygotní protrombinová mutace mají relativní riziko stále vysoké. Heterozygotní podoba hereditárních deficitů antitrombinu, proteinu C a proteinu S je spojována se středním zvýšením relativního rizika (tab. 1) [13, 18–19].
Pokud je ale relativní riziko přepočteno na riziko absolutní, zůstává riziko hluboké žilní trombózy v populaci těhotných s trombofilií relativně nižší, asi na úrovni středního rizika, ovšem ani to nemá být podceňováno vzhledem k závažnosti komplikací – především plicní embolie (tab. 1). Například pro nejčastější Leidenskou mutaci, kdy je relativní riziko trombózy u pacientky s homozygnotní formou Leidenské mutace 35–100násobně vyšší ve srovnání s těhotnou bez této mutace, zůstává absolutní riziko výskytu hluboké žilní trombózy na střední úrovni. Pokud bereme v úvahu výskyt VTE u těhotných v průměru 1–1,4 : 1 000, absolutní riziko vychází na 4,8 % (1,4–16,8 %). Při přepočtu relativního rizika u většiny ostatních vrozených trombofilních stavů absolutní riziko zůstává relativně nízké, kolem 0,5–1,2 %.
Na druhou stranu zahrnuje toto kalkulované absolutní riziko u těhotných s trombofilními stavy pouze ženy bez pozitivní rodinné anamnézy VTE. Pozitivní rodinná anamnéza výskytu hluboké žilní trombózy v rodině zvyšuje riziko VTE významně, a to až 2–4násobně. Studie zjišťující riziko VTE u gravidních žen v rodinách s pozitivní anamnézou toto zvýšení rizika potvrzují. Například podle těchto rodinných studií v případě rodičky s homozygotní formou Leidenské mutace, kde přepočtené absolutní riziko bylo střední, v případě pozitivní rodinné anamnézy je zvýšeno – ze 4,8 % (1,4–16,8 %) až na 14 % (6,3–25,8 %). Podobně u nejčastěji diagnostikované heterozygotní Leidenské mutace faktoru V a protrombinové mutace absolutní riziko narůstá z 1,2 % na 3,2 % u Leidenské mutace a z 1,0 % na 2,6 % u protrombinové mutace (viz tab. 1).
Tab. 1. Riziko VTE u asymptomatických trombofilních stavů u v těhotenství 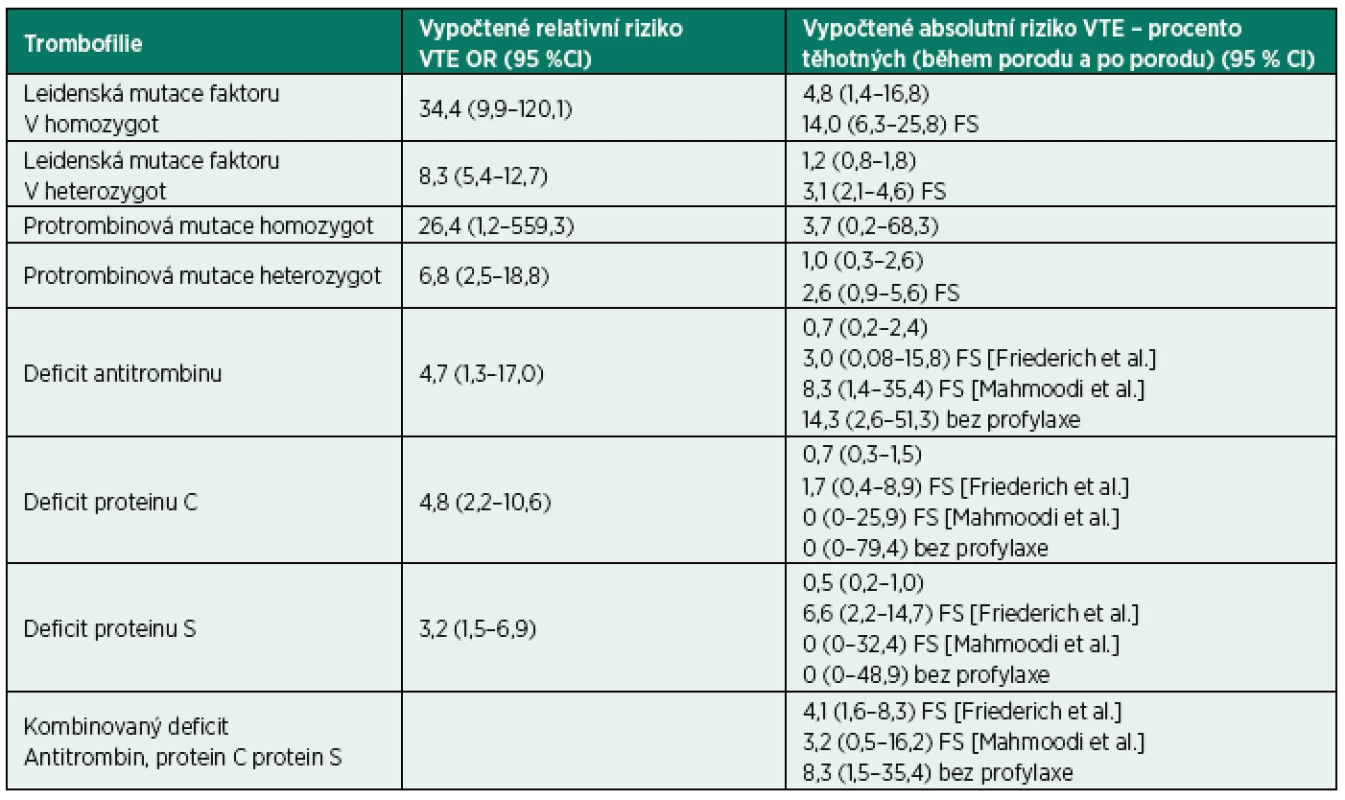
[podle Bates et al., 2016] FS Family Studies (podle Bates et al., počítané absolutní riziko je derivováno z OR podle Robertson et al. při výpočtu použita VTE incidence kombinovaná – předporodní až 6. týdnu po porodu: 1,4 na 1000 těhotenství) S významným zvýšením rizika hluboké žilní trombózy je nutné počítat i v případě kombinovaných mutací. U 12 % pacientů s heterozygotní Leidenskou mutací faktoru V byla zjištěna mutace protrombinu G20210A a naopak u 23 % heterozygotů s protrombinovou mutací byla diagnostikována přítomnost mutace FVL. Celkem tedy asi u 2,2 % pacientů s hlubokou žilní trombózou se vyskytuje kombinace heterozygotní mutace FVL s heterozygotní mutací protrombinu a tato část populace je zatížena přibližně 20% zvýšením relativního rizika hluboké žilní trombózy [20].
Těhotenské komplikace u žen s vrozeným trombofilním stavem
Kromě toho, že všechny vrozené trombofilní stavy jsou spojeny s vyšším rizikem výskytu hluboké žilní trombózy, v těhotenství jsou rovněž spojovány s častějším výskytem těhotenských komplikací. U žen s trombofilií bývají popisované opakované ztráty těhotenství – jak časné, tak pozdní. Mezi další komplikace spojované s trombofilním stavem rovněž patří růstová retardace plodu, intrauterinní úmrtí plodu, předčasné narození nedonošeného dítěte, placentární abrupce a preeklampsie. Nejvyšší riziko z hlediska těhotenských komplikací představuje Leidenská mutace faktoru V a protrombinová mutace, vedoucí zejména k pozdním těhotenským komplikacím, jako jsou ztráty plodu, růstová retardace plodu, preeklampsie a abrupce placenty [21–23]. Role ostatních trombofilií je méně jasná, deficit proteinu S vede k častějším ztrátám plodu v pozdějších fázích těhotenství. Deficit antitrombinu je spojován s opakovanými ztrátami a abrupcí placenty. Ve studiích sledujících průběh těhotenství u žen s diagnostikovanou trombofilií (např EPCOT – European Prospective Cohort on Thrombophilia Study) je u všech trombofilií popisován trend ke zvýšenému riziku předčasného porodu či ztráty plodu [15]. Role jednotlivých trombofilií ve spojení s výše uvedenými těhotenskými komplikacemi je ale nadále studována. Výsledky observačních studií ukazují na různá spojení jednotlivých mutací a deficitů inhibitorů koagulace s různými typy těhotenských komplikací, přičemž jiné zase toto spojení jednoznačně nepotvrzují [15, 21–25]. Řadě studií je vytýkán malý vzorek populace, rozdílná diagnostická kritéria a velká chybovost, ale přesto tyto studie vesměs vždy poukazují na spojení trombofilií s časnou a pozdní ztrátou těhotenství, závažnou preeklampsií a již méně intrauterinní růstovou retardací plodu a abrupcí placenty [26]. Přesné spojení jednotlivých trombofilních stavů s konkrétním typem komplikací bude i nadále předmětem dalších studií. Do jaké míry se těhotné ženy s trombofilním stavem mají obávat rizika těhotenských komplikací, ukazuje tabulka 2 [21]. Obecně se však dá říci, že toto riziko není zase až tak vysoké. Například riziko ztráty plodu u žen s nejčastější Leidenskou mutací faktoru V je až o 52 % vyšší než u žen bez této mutace, ale pokud je toto riziko převedené v absolutní, zůstává relativně nízké 4,2 %, tedy jen mírně vyšší než u těhotných žen bez Leidenské mutace, kde je udáváno riziko 3,2 % [12, 21]. Míra rizika u všech trombofilních stavů vždy záleží na typu trombofilie a druhu těhotenských komplikací, rovněž jako na předchozí anamnéze a případně zavedených profylaktických opatření.
Tab. 2. Trombofilie a těhotenské komplikace 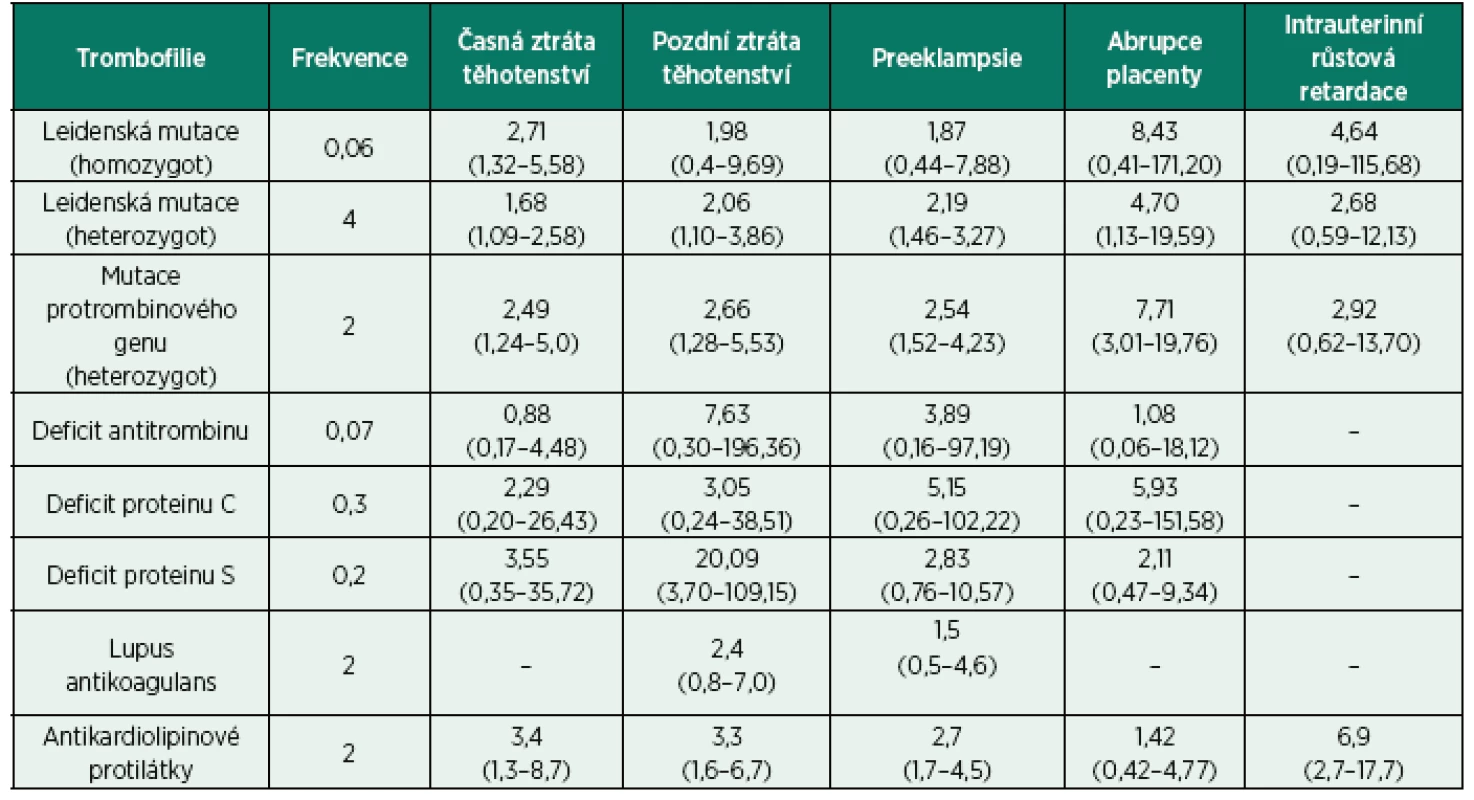
[podle Simcox et al., 2015] Získané trombofilní stavy
Antifosfolipidový syndrom tvoří poměrně složitou diagnostickou jednotku, která je jednoznačně spojena se zvýšeným rizikem hluboké žilní trombózy a těhotenských komplikací. Nejobávanější variantou je potom katastrofický antifosfolipidový syndrom.
Pro diagnózu antifosfolipidového syndromu je třeba přítomnost klinických a sérologických známek tohoto onemocnění. Mezi sérologická kritéria potvrzující diagnózu antifosfolipidového syndromu patří přetrvávající nález pozitivních protilátek lupus antikoagulans (LA) a/nebo IgG nebo IgM pozitivita antikardiolipinových protilátek (aCL) a/nebo vysoký titr IgG nebo IgM protilátek proti beta-2-glykoproteinu 1 (anti-beta2 GP). Pro diagnózu je důležitý opakovaný průkaz těchto protilátek v minimálním časovém odstupu 12 týdnů, neboť jejich dočasné zvýšení může být pozorováno i u některých infekčních stavů a v souvislosti s podáním některých léků. Mezi klinické známky antifosfolipidového syndromu jsou řazeny opakující se trombózy a/nebo opakující se ztráty těhotenství, a to ztráta plodu po 12. týdnu nebo 3 potraty v anamnéze. U žen s opakovanými ztrátami těhotenství je u 10–20 % prokázána přítomnost antifosfolipidových protilátek [21]. Protilátky proti beta-2-glykoproteinu jsou spojovány s pozdními ztrátami plodu a venózní trombózou, antikardiolipinové protilátky s časnými i pozdními ztrátami těhotenství a preeklampsií, pozitivní lupus antikoagulans se všemi s placentou spojenými typy komplikací (ztráty těhotenství, růstové retardace plodu, abrupce placenty, preeklampsie). Při přítomnosti antifosfolipidových protilátek je zjišťována snížená hladina annexinu A5 – placentárního antikoagulačního proteinu s následnou akcelerací prokoagulačního stavu [21]. Patofyziologie antifosfolipidového syndromu je nadále zkoumána, za spouštěcí faktor se považuje prodělaná infekce, za vlastní příčinu těhotenských komplikací nelze považovat jen zvýšenou formaci trombů v uteroplacentárním krevním řečišti. V patofyziologickém mechanismu se zdůrazňuje i úloha trofoblastu a aktivace komplementu [21,27]. Katastrofický antifosfolipidový syndrom se vyskytuje v méně než v 1 % případů, ale jedná se o velmi závažný stav, kdy četné trombózy vedou až k multiorgánové dysfunkci. Během těhotenství se může specificky manifestovat placentární trombózou, HELLP syndromem nebo myometriální trombózou [28].
PROFYLAKTICKÁ OPATŘENÍ U TĚHOTNÝCH S TROMBOFILIÍ
Vzhledem k výše popsaným rizikům všech trombofilních stavů je věnována pozornost možnosti profylaktických opatření. V následujícím textu je shrnuto doporučení pro profylaxi komplikací u trombofilních stavů. Daný souhrn vychází z doporučení české hematologické společnosti – Návrh antitrombotické profylaxe a péče o trombofilní stavy v gynekologii a porodnictví (doporučení pro klinickou praxi – sekce pro trombózu a hemostázu České hematologické společnosti) vydané u příležitosti XII. Pařízkových dní v roce 2006 [29], text tohoto doporučení byl jen minimálně aktualizován v souvislosti s recentními informacemi. Formulace těchto doporučení je v konsenzu se zahraniční literaturou a doporučeními, ať již evropských nebo amerických hematologických a gynekologických společností, i když na jednotlivých národních úrovních existují určité odchylky.
Těhotná bez diagnózy trombofilie
Těhotná s hlubokou žilní trombózou v anamnéze bez prokázané trombofilie: doporučena profylaxe LMWH nebo mini - až střednědávkovaný UHF od 20. týdne gravidity, eventuálně jen sledování v průběhu těhotenství a u všech rodiček peripartální a poporodní podání profylaktických dávek LMWH.
Těhotná s vrozenou trombofilií
Těhotná s diagnózou trombofilie bez hluboké žilní trombózy v anamnéze: u všech doporučena poporodní profylaxe LMWH, doba aplikace minimálně 7 dní, optimálně 6 týdnů, peripartální profylaxe LMWH u rizikových pacientek (obezita, věk > 35 let, imobilizace pacientky, kouření, pozitivní rodinná anamnéza, Leidenská mutace – heterozygot). V rámci zahraničních doporučení u trombofilních stavů se přihlíží k pozitivní rodinné anamnéze, kdy tyto pacientky s prokázaným trombofilním stavem jsou děleny do několika podskupin [13, 26]:
- a) asymptomatická žena, homozygot pro Leidenskou mutaci nebo protrombinovou mutaci 20210A s pozitivní rodinnou anamnézou VTE – profylaxe během porodu i poporodní 6 týdnů, eventuálně i antepartální profylaxe s profylaktickými nebo intermediálními dávkami LMWH;
- b) asymptomatická žena, heterozygot pro Leidenskou mutaci, protrombinovou mutaci nebo deficit proteinu C nebo proteinu S s pozitivní rodinnou anamnézou VTE – před porodem vyšší klinická bdělost, poporodní profylaxe 6 týdnů s profylaktickými nebo středními dávkami LMWH. Po porodu je možné podávání antagonistů K vitaminu kromě žen s deficitem proteinu C nebo S;
- c) asymptomatická žena, homozygot pro Leidenskou mutaci nebo protrombinovou mutaci bez pozitivní rodinné anamnézy – poporodní profylaxe 6 týdnů s profylaktickými nebo středními dávkami LMWH nebo antagonisty vitaminu K s cílovým INR 2,0–3,0;
- d) asymptomatická žena s ostatními typy trombofiií bez pozitivní rodinné anamnézy profylaxe poporodní nemusí být indikována, pokud nejsou současně přítomny žádné další rizikové faktory. Na zvážení je poporodní profylaxe u asymptomatické rodičky s deficitem antitrombinu [13, 26].
Tato doporučení z hlediska evidence based medicine mají sílu 2B–2C.
Těhotná s diagnózou trombofilie s hlubokou žilní trombózou v anamnéze u předchozích těhotenství: od 20. týdne gravidity doporučeno podání profylaktických dávek LMWH, peripartálně středně dávkovaný LMWH a poporodní perorální antikoagulační terapie kumariny.
Těhotná s diagnózou trombofilie a těhotenskými komplikacemi:
- a) u pacientek s rekurentními aborty (více než tři) antiagregační terapie (acetylsalicylová kyselina –ASA – 100 mg) po celou dobu těhotenství a od 8. týdne gravidity profylaktická dávka LMWH;
- b) u žen s anamnézou preeklampsie, HELLP syndromu, abrupcí placenty, intrauterinního úmrtí plodu nebo těžkou růstovou retardací plodu (IUGR) od počátku těhotenství ASA 100 mg, od 20. týdne LMWH v profylaktické až střední dávce a častější sledování plodu pomocí UZ technik a od 30. týdne gravidity po 3 týdnech.
Těhotná se získanou trombofilií
Těhotná s diagnózou antifosfolipidového syndromu:
- a) bez anamnézy hluboké žilní trombózy nebo ztráty plodu – ASA 100 mg po celou dobu gravidity;
- b) s anamnézou dvou či více časných potratů – ASA 100 mg od počátku gravidity, od 12. týdne profylaktické dávkování LMWH, či středně dávkovaný LMWH;
- c) s anamnézou pozdních těhotenských ztrát nebo pozdních těhotenských komplikací (preeklampsie, HELLP, abrupce placenty) – ASA po celou dobu gravidity + od 20. týdne gravidity LMWH v terapeutických dávkách;
- d) s anamnézou hluboké žilní trombózy – adjustované dávky LMWH nebo UHF + ASA po celou dobu těhotenství.
Jako nejvíce sporné z hlediska tohoto doporučení se jeví, stejně jako v zahraničních zdrojích, podávání antikoagulancií v předcházení těhotenským komplikacím, zejména pozdním, u těhotných s vrozeným trombofilním stavem. Ve všech guidelines je zdůrazňováno podrobné informování rodičky, zvážení každého jednotlivého případu individuálně, stanovení individuálního rizika těhotné a na základě domluvy s těhotnou ženou volba strategie postupu, jež může zahrnovat antikoagulační terapii i samotné podávání ASA při plné informovanosti rodičky. Na druhou stranu podání antikoagulační terapie je považováno za bezpečné při nedostatku jiných možností profylaxe.
Podobně je i navrhován postup u antitrombotické profylaxe hluboké žilní trombózy u trombofilních stavů, které jsou zatíženy nižším rizikem trombózy a u trombofilních stavů u žen bez anamnézy VTE s přihlédnutím k rodinné anamnéze. Vzhledem k tomu, že není jistota ohledně optimální profylaktické strategie, všechny ženy by měly mít možnost na základě osobních preferencí a hodnot participovat na rozhodnutí ohledně volby antitrombotické terapie s přihlédnutím k jejímu potenciálnímu benefitu (redukce riziko VTE) a případným rizikům (riziko krvácení, lokální kožní reakce, ovlivnění potenciální volby analgezie při porodu, obava z injekcí). V případě přání pacientky, která má nižší riziko VTE v těhotenství, je možné volit méně agresivní antikoagulační terapii, než je doporučena, ale její případné úplné nepodání je možné jen u pacientek, které plně akceptují vysoké riziko VTE v případě odmítnutí této profylaktické terapie.
Doporučované léčebné režimy podávání LMWH jsou následující:
- profylaktické podávání LMWH
- nadroparine (Fraxiparin) 0,3 ml s. c. á 24 hod.
- enoxaparine (Clexan) 40 mg s.c. á 24 hod.
- středně dávkovaný LMWH
- nadroparine (Fraxiparin) 0,3 ml s. c. á 12 hod.
- enoxaparine (Clexan) 40 mg s. c. á 12 hod.
- adjustované nebo plná terapeutická dávka
- nadroparine (Fraxiparin) 100 j/kg s. c. á 12 hod.
- enoxaparine (Clexan) 1 mg/kg s. c. á 12 hod.
V doporučených léčebných režimech LMWH byl vynechán dalteparin (Fragmin), který se objevuje v textech zahraničních doporučení, ale který není v současné době v České republice k dispozici.
Při výběru antikoagulační léčby během těhotenství: warfarin prochází utero-placentární bariérou a pro vyvolání možné embryopatie není v těhotenství podáván. Nízkomolekulární hepariny (LMWH) jsou upřednostňovány před nefrakcionovaným heparinem (UHF) pro jejich dobrou efektivitu a nízké riziko heparinem indukované trombocytopenie. Navíc prolongované podávání nefrakcionovaného heparinu je spojeno s rizikem osteoporózy.
Pokud jde o farmakokinetiku podávaných heparinů v těhotenství, těhotné v důsledku změn v souvislosti s těhotenstvím (zvýšená renální clearence, zvětšený plazmatický objem, prokoagulační stav) potřebují vyšší dávky UHF i LMWH, aby dosáhly profylaktických či terapeutických hladin. Vrcholová aktivita anti-Xa byla zjištěna u těhotných žen, u žen po porodu nižší. U závažnějších případů trombofilních stavů proto bývá volena vyšší než profylaktická dávka, často střední dávkování LMWH nebo UHF. Doporučené cílové anti-Xa hladiny jsou stejné – 0,1–0,3 u profylaktického podávání a 0,6–1,0 u terapeutického podávání.
Podávání nových antikoagulancií – přímých inhibitorů trombinu nebo inhibitorů faktoru Xa (rivaroxaban, apixaban) není doporučeno pro profylaxi ani léčbu VTE u těhotných a kojících žen [30].
Při předcházení těhotenským komplikacím u trombofilních stavů u žen s diagnostikovaným antifosfolipidovým syndromem se doporučuje kombinace podávání nízkodávkované kyseliny acetylsalicylové – ASA (100 mg) s hepariny [27, 31]. Indikace této terapie vychází z výsledků studií (Rai et al., 1997 a Kutteh et al., 1996), v nichž bylo prokázáno, že při terapii ASA s heparinem je vyšší pravděpodobnost narození živého dítěte ve srovnání s podáváním samotného aspirinu (Rai 71 % vs. 41 %, Kutteh 80 % vs. 44 %) [32, 33]. Tyto výsledky byly následně potvrzené i studií z roku 2006 (Goel et al.) [34]. Pro interpretaci výsledků je důležité, že obě skupiny žen měly podobnou frekvenci předchozích potratů. Podstatný rozdíl byl zjištěn v pravděpodobnosti narození živého dítěte, což je důvod, pro který je tato terapie ASA + LMWH indikována. Za úspěšnost kombinace heparinu v nízkých dávkách s ASA oproti ASA samotné se považuje protizánětlivé působení heparinu a jeho antikomplementová aktivita [27, 35]. V terapii katastrofického antifosfolipidového syndromu jsou zkoušeny hepariny, ASA s výměnou plazmy, intravenózní imunolobuliny a trombolýza. Eculizumab – humánní monoklonální protilátka proti komplementu – proteinu C se zdá být slibnou možností terapie [28, 36].
V prevenci těhotenských komplikací u žen s vrozeným trombofilním stavem se vyšlo z analogie s profylaktickou terapií u antifosfolipidového syndromu, kde existují silné důkazy pro kombinovanou terapii ASA + LMWH v případě opakovaných ztrát těhotenství [26, 31]. Stejně jako u antifosfolipidového syndromu se i u vrozených trombofilních stavů využívá kombinace nízkodávkované ASA s nízkomolekulárními hepariny. Přičemž podávání LMWH v těhotenství je považováno za bezpečné (Greer and Nelson-Piercy, 2005; Greer, 2009) [31, 37, 38], ale podle evidence based medicine zahájení této terapie nízkomolekulárními hepariny je sporné, zejména v případě pozdních těhotenských komplikací, pro nedostatek důkazů z dostatečně silných randomizovaných kontrolovaných studií. Terapie kombinací LMWH + ASA je často akceptována v případě časných těhotenských ztrát, kdy je asociace mezi trombofilním stavem a potraty vcelku jasná a byla potvrzena mnoha studiemi [15, 26]. U pozdních komplikací je podávání antikoagulancií stále kontroverzní a je nadále předmětem studií, v nichž je porovnávána účinnost kombinace LMWH s ASA oproti podávání samotné ASA.
Například v guidelines americké společnosti je v případě těhotenských komplikací doporučeno pouze podávání samostatné ASA a autoři se vyslovují proti zahájení antikoagulační terapie nízkomolekulárními hepariny [26].
Naopak, zastánci antikoagulační terapie zdůrazňují, že při podávání LMWH se kromě jeho antikoagulačního účinku využívá také inhibiční vliv LMWH na aktivaci komplementu, přímý účinek na trofoblast, jako je redukce apoptózy a zvýšení endometriální angiogenese a modulace imunitního systému [21]. Větší počet prací se zabýval přínosem terapie ASA + LMWH u vrozených trombofilních stavů a pozdních ztrát těhotenství [31]. Indikace terapie LMWH + ASA se u těchto stavů opírá zejména o následující studie. Brenner et al. v r. 2000 demonstrovali potenciální úspěšnou roli LMWH v prevenci těhotenských komplikací u žen s trombofilií [39]. Následně Gris et al. publikovali v roce 2004 studii, kdy u žen s trombofilií a předchozí pozdní ztrátou těhotenství, kterým byl podáván enoxaparin 40 mg/D, byla signifikantě vyšší míra narození živého dítěte (86 % vs. 29 % – retrospektivně) [40]. Rozdíl byl prokázán u žen s mutací faktoru V i II, stejně jako v případě deficitu proteinu S. LIVE-ENOX – multicentrická randomizovaná studie srovnávala dva způsoby podávání enoxaparinu 40 mg jedenkrát nebo dvakrát denně [41]. Oba způsoby podávání byly shledány rovnocennými s vysokou mírou pravděpodobnosti narození živého dítěte (84 % vs. 78 %). Celkem v několika prospektivních kontrolovaných studiích byla opět demonstrována účinnost antitrombotické terapie u žen s trombofilním stavem a pozdními ztrátami těhotenství (Carp et al. 2003, Gris et al. 2004 NOHA study, Brenner et al. 2005 LiVE-ENOX study, Folkeringa et al. 2007) [40–43]. Co je vyčítáno těmto studiím je limitovaný počet žen, heterogenita přijímacích kritérií, suboptimální design. A pak následující tři recentní studie neshledaly žádný benefit z antitrombotických intervencí (Clark et al. 2010, Kaandorp et al. 2010, HABENOX Visser et al. 2011) [44–46]. Je nutné ale poznamenat, že tyto studie zahrnovaly ženy s nevysvětlitelnou ztrátou těhotenství a většina z nich neměla prokázaný trombofilní stav, žen s trombofilií bylo pouze 6 %. Následně velká italská observační multicentrická studie zabývající se efektem LMWH s ASA u 1011 těhotných žen (416 mutace F5 nebo F2), potvrdila efekt LMWH na rozdíl od nízko dávkované samotné ASA [47].
V současné době je tedy přijímán názor, že LMWH v kombinaci s nízkodávkovaným aspirinem mohou být účinné v terapii komplikací u žen s trombofilií, ale LMWH není efektivní u žen se ztrátami plodu bez prokázaného trombofilního stavu.
AKTIVNÍ DIAGNOSTIKA TROMBOFILNÍCH STAVŮ
Další otázkou je, zda aktivně diagnostikovat trombofilní stavy, tedy vyhledávat rodičky s potenciální diagnózou trombofilie. Vždy při aktivním vyhledávání pacientů s potenciální trombofilií je třeba vzít v úvahu, jaká je pravděpodobnost záchytu trombofilního stavu u dané osoby a zároveň praktický dopad zjištěných laboratorních výsledků. Rutinní testování těhotných se nedoporučuje, ale vyšetření ženy před plánovaným těhotenstvím s vysokou pravděpodobností trombofilie se jeví jako racionální opatření. Mezi osoby s vysokou pravděpodobností záchytu trombofilie patří nemocní s pozitivní rodinnou anamnézou, se záchytem trombofilního stavu u rodinných příslušníků, s anamnézou opakovaných trombóz, trombóz v nezvyklé lokalizaci, tepenné trombózy před 35. rokem věku, rekurentním spontánním potratem nebo předčasným porodem, žilní trombózou vzniklou před 45. rokem nebo VTE při účinné antikoagulační léčbě [48]. U těchto žen se vyšetření na výskyt možných trombofilních stavů skutečně zdá racionálním opatřením, které umožní včasnou diagnostiku trombofilního stavu před započetím těhotenství nebo na jeho počátku a podle dalších přidružených rizik zároveň možnost zvolení profylaktických opatření ve vztahu k riziku VTE a případných těhotenských komplikací v průběhu těhotenství. Na druhé straně v současných zahraničních guidelines preventivní testování žen s anamnézou těhotenských komplikací se vyšetřování na potenciální trombofilii nedoporučuje. Výjimkou jsou ženy s opakovanými ztrátami těhotenství (3 a více potratů před 10. týdnem), kterým se doporučuje screening antifosfolipidových protilátek [26].
ANESTEZIOLOGICKÝ MANAGEMENT U PACIENTKY S ANTIKOAGULAČNÍ TERAPIÍ
U žen s trombofilním stavem a zavedenou antitrombotickou terapií je třeba počítat s náročnější přípravou k porodu jak z porodnického, tak anesteziologického hlediska. Na jedné straně je rodička ohrožena závažným krvácením při porodu při antikoagulační léčbě, na druhou stranu ale dlouhodobější vysazení antitrombotické terapie ohrožuje rodičku vysokým rizikem trombembolických komplikací. Na přípravě ženy s antikoagulační terapií k porodu by se proto měl podílet multidisciplinární tým (porodník-hematolog-anesteziolog). Z porodnického hlediska bývá upřednostňována indukce porodu nebo plánovaný císařský řez podle zvyklostí pracoviště. Anesteziolog by měl s rodičkou konzultovat volbu porodnické analgezie a anestezie. Obávanou anesteziologickou komplikací je vznik epidurálního hematomu po epidurální anestezii či analgezii, jeho udávaná četnost je nízká, méně než jeden případ na 150 000 porodnických anestezií, nicméně jedná se o natolik závažnou komplikaci s možností trvalého neurologického deficitu, že musí být riziko této komplikace minimalizováno [49].
Každá rodička s trombofilním stavem a antitrombotickou terapií by měla být řádně poučena o průběhu porodu a připravena podle následujících doporučení [13, 50, 51]:
- Všechny ženy s antikoagulační terapií by měly mít individualizovaný plán porodu, který zohledňuje podávání antikoagulancií s ohledem na porodnickou a anesteziologickou problematiku.
- Všechny těhotné ženy s antikoagulační terapií by měly být poučeny o přerušení aplikace antikoagulancia v případě započetí spontánního porodu.
- Pokud je porod plánován, podávání terapeutických dávek LMWH by mělo být přerušeno nejméně 24 hodin před očekávaným porodem a před aplikací epidurální anestezie či analgezie. V případě profylaktických dávek LMWH stačí přerušení 10–12 hodin před epidurální anestezií a analgezií.
- V případě intravenózního podávání UHF by přerušení aplikace mělo být nejméně 4–6 hodin před plánovaným porodem a epidurální analgezií. Před podáním epidurální analgezie by měla být zkontrolována hodnota aPTT s ujištěním, že došlo k normalizaci této hodnoty. V případě podávání terapeutických dávek UHF subkutánní cestou by poslední dávka měla být podána nejméně 12 hodin před plánovaným porodem a epidurální analgezií, výhodnější je ale přerušení podávání subkutánního UHF již 24 hodin před porodem, rovněž s kontrolou normalizace hodnot aPTT. Guidelines jednotlivých společností se liší v případě doporučované délky přerušení podávání UHF před epidurální analgezií u rodičky s profylaktickými dávkami UHF. Pokud je to možné, profylakticky podávaný nefrakcionovaný heparin by měl být přerušen 8–10 hodin před plánovanou epidurální analgezií.
- Profylaktické dávky LMWH by měly být opět zahájeny 6–12 hodin po porodu (ne dříve než 4 hodiny po odstranění epidurálního katétru, 6 hod. po vaginálním porodu a 12 hod. po císařském řezu), pokud nejsou známky krvácení u rodičky a v případě, že se jednalo o nekomplikovanou punkci epidurálního prostoru. Podávání profylaktických dávek UHF může být zahájeno po 8 hodinách od odstranění epidurálního katétru.
- Terapeutické dávky LMWH mohou být zahájeny za 24 hodin po porodu a ne dříve než 24 hodin od odstranění epidurálního katétru, pokud nejsou známky krvácení u rodičky a punkce epidurálního prostoru byla nekomplikovaná.
V případě akutního porodu rodičky s antikoagulační terapií by neuroaxiální anestezie neměla být indikována. Tam, kde je nejistota u doby aplikace poslední dávky antikoagulancia, je možné zvážit rychlé stanovení hladin heparinu a na základě těchto výsledků volit anesteziologický a porodnický management [50]. Pokud to možné není, je třeba upřednostnit celkovou anestezii a jiné typy analgezie [13].
ZÁVĚR
Diagnostikované trombofilní stavy jsou jak vrozené (Leidenská mutace – FVL, protrombinová mutace, deficity inhibitorů koagulace), tak získané (antifosfolipidový syndrom, lupus antikoagulans). O zvýšeném riziku hluboké žilní trombózy u těhotných žen musíme uvažovat u všech trombofilních stavů. V závislosti na závažnosti trombofilního stavu, osobní a rodinné anamnéze hluboké žilní trombózy jsou doporučovány u těhotných žen profylaktická antitrombotická opatření. Kromě vyššího rizika hluboké žilní trombózy jsou gravidní ženy s trombofilním stavem zatíženy i vyšším rizikem těhotenských komplikací. U rodiček s antikoagulační terapií je třeba počítat s náročnější péčí během porodu a přizpůsobit tomu porodnický i anesteziologický management. Diagnostika a terapie hluboké žilní trombózy a plicní embolie v těhotenství bude námětem následujícího článku.
Autoři prohlašují, že nemají střet zájmů.
Do redakce došlo dne 10. 9. 2016.
Do tisku přijato dne 25. 9. 2016.
Adresa pro korespondenci:
MUDr. Jitka Mannová, Ph.D.
Anesteziologicko-resuscitační oddělení
Nemocnice Havlíčkův Brod
Husova 2624,
580 22 Havlíčkův Brod
e-mail: j.mann@seznam.cz
Zdroje
1. Bourjeily, G., Paidas, M., Khalil, H. et al. Pulmonary embolism in pregnancy. Lancet, 2010, 375, p. 500–512.
2. Stone, S. E., Timothy, A., Morris, M. D. Pulmonary embolism during and after pregnancy. Crit. Care Med., 2005, 33, Suppl 10.
3. Greer, I. A. Pregnancy Complicated by Venous Thrombosis. N. Engl. J. Med., 2015, 373, p. 540–547.
4. Greer, I. A. Thrombosis in pregnancy: updates in diagnosis and management. Hematology, 2012, p. 203–207.
5. James, A. H. Venous Thromboembolism in Pregnancy. Arteriocler. Thromb. Vasc. Biol., 2009, 29, p. 326–331.
6. Gherman, R. B., Goodwin, T. M., Leung, B. et al. Incidence, clinical characteristics, and timing of objectively diagnosed venous thromboembolism during pregnancy. Obstet. Gynecol., 1999, 94, p. 730–734.
7. Marik, P. E., Plante, L. A. Venous Thromboembolism Disease and Pregnancy, N. Engl. J. Med., 2008, 359, p. 2025–2033.
8. James, A. H., Tapson, V. F., Golddhaber, S. Z. Thrombosis during pregnancy and the postpartum period. Am. J. Obstet. Gynecol., 2005, 193, p. 216–219.
9. Kamel, H., Navi, B. B., Sriram, N. et al. Risk of a thrombotic event after the 6-week post-partum period. N. Engl. J. Med., 2014, 370, p. 1307–1315.
10. Khan, K. S, Wojdyla, D., Say, L. et al. WHO analysis of causes of maternal death: a systematic review. Lancet, 2006, 367, p. 1066–1074.
11. Simpson, E. L., Lawrenson, R. A., Nightingale, A. L. et al. Venous thrombembolism in pregnancy and the puerperium: incidence and additional risk factors from a London perinatal database. Br. J. Obstet. Gyneacol., 2001, 108, p. 56–60.
12. Dawood, F. Pregnancy and Thrombophilia. J. Blood Disorders Transf., 2013, 4, 164.
13. Bates, S. M., Middeldorp, S., Rodger, M., James, A. H., Greer, I. A. Guidance for the treatment and prevention of obstetric-associated venous thrombembolism. J. Thromb. Thombolysis, 2016, 41, p. 92–128.
14. Kjellberg, U., Andersson, N. E., Rosen, S. et al. APC resistance and other haemostatis variables during pregnancy and purperium. Thromb. Haemost., 1999, 81, p. 527–531.
15. Battinelli, E. M., Marshall, A., Connors, J. M. The Role of Thrombophilia in Pregnancy Review article. Thrombosis, 2013, ID 516420 : 1–9.
16. Clark, P., Brennand, J., Conkie J. A. et al. Activated protein C sensitivity, protein C, protein S and coagulation in normal pregnancy. Thromb. Haemost., 1998, 79, p. 1166–1170.
17. Rosendaal, F. R. Risk factors for venous thrombotic disease. Thromb. Haemost. 1999, 82, p. 610–619.
18. Friederich, P.W., Sanson, B.J., Simioni, P. et al. Frequency of pregnancy-related venous thrombembolism in anticoagulant factor-deficient women: implications for prophylaxis. Ann. Int. Med., 1996, 125, p. 955–960.
19. Mahmoodi, B. K., Brouwer, J. L. P., Ten Kate, M. K. et al. A prospective cohort study on the absolute risks of venous thrombembolism and predictive value of screening asymptomatic relatives of patients with hereditary deficiencies of protein S, protein C and antithrombin. J. Thromb. Haemost., 2010, p. 1193–1200.
20. Emmerich, J., Rosendaal, F. R., Cattaneo, M. et al. Combined Effect of Factor V Leiden and Prothrombin 20210A on the Risk of Venous Thrombembolism. Thromb. Haemost., 2001, 86, p. 809–816.
21. Simcox, L. E., Ormesher, L., Tower, C., Greer, I. A. Thrombophilia and Pregnancy Complications. Int. J. of Mol. Sci., 2015, 16, p. 28418–28428.
22. Rey, E., Kahn S. R., Davis, M. et al. Thrombophilic disorders and fetal loss: a meta-analysis. Lancet, 2003, 361, p. 901–908.
23. Robertson, I., Wu, O., Langhorne, P. Thrombophilia in pregnancy: a systematic review. Br. J. Hematol., 2006, 132, p. 171–196.
24. Davenport, W. B., Kutteh, W. Inherited Thrombophilias and Adverse Pregnancy Outcomes. A Review of Screening Patterns and Recommendations. Obstet. Gynecol. Clin. N. Am., 2014, 41, p. 134–144.
25. Roque, H., Paidas, M. J., Funai, E. F. et al. Maternal thrombophilias are not associated with early pregnancy loss. Thrombosis and Haemostasis, 2004, 2, p. 290–295.
26. Shannon, M., Bates, M. D., Greer, I. A. et al. VTE, Thrombophilia, Antithrombotic Therapy and Pregnancy Antithrombotic Therapy and Prevention of Thrombosis 9th ed: American College of Chest Physicians Evidence-Based Clinical Practice Guidelines. CHEST, 2012, Suppl., e691S–736S.
27. Keeling, D., Mackie, I., Moore, G. W. et al. Guidelines on the investigation and management of antiphospholipid syndrome. Br. J. Haematol. 2012, 157, p. 47–58.
28. Gomez-Puerta, J. A., Espinosa, G., Cervera, R. Catastrophic Antiphospholipid Syndrome Diagnosis and Management in Pregancy. Clin. Lab. Med., 2013, 33, p. 391–400.
29. Dulíček, P., Penka, M., Binder, T. et al. Návrh antitrombotické profylaxe a péče o trombofilní stavy v gynekologii a porodnictví. Doporučení pro klinickou praxi, 2006. Dostupné na www: www.thrombosis.cz.
30. Tang, A.-W., Greer, I. A. A systematic review on the use of the new anticoagulants in pregnancy. Obstet. Med., 2013, 6, p. 64–71.
31. Greer, I. A., Brenner, B., Gris, J. Antithrombotic treatment for pregnancy complications which path for the journey to precision medicine. Br. J. Haematology, 2014, 165, p. 585–599.
32. Rai, R., Cohen, H., Dave, M. et al. Randomized controlled trial of aspirin and aspirin plus heparin in pregnant women with recurrent miscarriage associated with phospholipid antibodies (or antiphospoholipid antibodies.). British medical Journal, 1997, 314, p. 253–257.
33. Kutteh, W. H. Antiphospholipid antiobody associated recurrent pregnancy loss: treatment with heparin and low-dose aspirin is superior to low-dose aspirin alone. Am. J. Obstet. Gynecol., 1996, 174, p. 1584–1589.
34. Goel, N., Tuli, A., Choudhry, R. The role of aspirin versus aspirin and heparin in cases of recurrent abortions with raised anticardiolipin antibodies. Medical Science Monitor, 2006, 12, p. CR132–136.
35. Lockshin, M. D. Anticoagulation in management of antiphospholipid antibody syndrome [APS] in pregnancy. Clin. Lab. Med., 2013, 33, p. 367–376.
36. Jesús, G. R., Rodrigues, G., Jesús, N. R. et al. Pregnancy Morbidity in Antiphospholipid Syndrome: What Is the Impact of Treatment? Curr. Rheumatol. Rep., 2014, 16, p. 403.
37. Greer, I. A., Nelson-Piercy, C. Low-molecular-weight heparins for thromboprophylaxis and treatment of venous thromboembolism in pregnancy: a systematic review of safety and efficacy. Blood, 2005, 106, p. 401–407.
38. Greer, I. A. Low molecular weight heparin for pregnancy complications. Thrombosis Research, 2009, 123, Suppl. 3, S22–S25.
39. Brenner, B., Hoffmann, R., Blumenfeld, A. et al. Gestational outcome in thrombophilic women with recurrent pregnancy loss treated by enoxaprin. Thrombosis and Haemostasis, 2000, 83, p. 693–697.
40. Gris, J. C., Mercier, E., Quéré, I. et al. Low-molecular-weight heparin versus low-dose aspirin in women with one fetal loss and a constitutional thrombophilic disorder. Blood, 2004, 103, p. 3695–3699.
41. Brenner, B., Hoffman, R., Carp, H. et al. Efficacy and safety of two doses of enoxaprin in women with thrombophilia and recurrent pregnancy loss: the LIVE-ENOX study. J. Thrombosis and Haemostasis, 2005, 3, p. 227–229.
42. Carp, H., Dolitzky, M., Inbal, A. Thrombophylaxis improves the live birth rate in women with consecutive recurrent miscarriages and hereditary thrombophilia. J. Thrombosis and Haemostasis, 2003, 1, p. 433–438.
43. Folkeringa, N., Brouwer, J. L., Korteweg, E. J. et al. Reduction of high fetal loss rate by anticoagulant treatment during pregnancy in antithrombin, protein C or protein S deficient women British. J. of Haematology, 2007, 136, p. 656–661.
44. Clark, P., Walker, I. D., Langhorne, P. et al. Scottish Pregnancy Intervention Study (SPIN) study: multicenter, randomized controlled trial of low-molecular-weight heparin and low-dose aspirin in women with recurrent miscarriage. Blood, 2010, 115, p. 4162–4167.
45. Kaandorp, S. P., Goddijn, M., van der Post, J. A. et al. Aspirin plus heparin or aspirin alone in women with recurrent miscarriage. N. Eng. J. Medicine, 2010, 362, p. 1586–1596.
46. Visser, I., Ulander, V. M., Helmerhorst, F. M. et al. Thromboprophylaxes for recurrent miscarriage in women with or without thrombophilia. HABENOX: a randomized multicentre trial. Thrombosis and Haemostasis, 2011, 105, p. 295–301.
47. Tormene, D., Grandone, E., De Stefano, V. et al. Obstetric complication and pregnacy-related venous thrombembolism: the effect of low-molecular-weight heparin on their prevention in carriers of factor V Leiden or prothrombin G 20210A mutation. Thrombosis and Haemostasis, 2012, 107, p. 477–484.
48. Kessler, P. Trombofilní stavy. Interní medicína pro praxi, 2006, 9, p. 374–378.
49. Rupeen, W., Derry, S., McQuay, H. et al. Incidence of epidural hematoma, infection, and neurologic injury in obstetric patients with epidrual analgesia/anesthesia. Anesthesiology, 2006, 105, p. 394–399.
50. Royal College of Obstetricians and Gynecologists Green-top Guideline No. 37b. Thromboembolic disease in pregnancy and the puerperium: acute management, 2015. Dostupné na www: https://www.rcog.org.uk/en/guidelines-research-services/guidelines/gtg37b/
51. Shaikh, N., Ummunnisa, F., Aboobacker, N. et al. Peripartum pulmonary embolism: Anesthetic and surgical considerations. J. Obstet. Gynecol., 2013, 3, p. 158–164.
52. Horlocker, T. T., Wedel, D. J., Roswlingson, J. C. et al. Regional anesthesia in patient receiving antithrombotic or thrombolytic therapy. Regional Anest. and Pain Med., 2010, 35, p. 64–74.
Štítky
Anestéziológia a resuscitácia Intenzívna medicína
Článek ZAJÍMAVOSTI, TIPY A TRIKYČlánek Jmenný a věcný rejstřík
Článok vyšiel v časopiseAnesteziologie a intenzivní medicína
Najčítanejšie tento týždeň
2016 Číslo 6- Realita liečby bolesti v paliatívnej starostlivosti v Nemecku
- MUDr. Lenka Klimešová: Multiodborová vizita je kľúč k efektívnejšej perioperačnej liečbe chronickej bolesti
- Metamizol v liečbe pooperačnej bolesti u opioid-tolerantnej pacientky – kazuistika
- e-Konzilium.cz — Masivní plicní embolie při tromboembolické nemoci
- DESATORO PRE PRAX: Aktuálne odporúčanie ESPEN pre nutričný manažment u pacientov s COVID-19
-
Všetky články tohto čísla
- Monitorování hloubky celkové anestezie
- Manažment septickej diseminovanej intravaskulárnej koagulopatie pomocou antitrombínu a heparínu a význam tromboelastometrie v diagnostike heparínovej rezistencie
- Blokáda druhé a třetí větve trigeminu s ultrazvukovou asistencí u geriatrických pacientů
- Regionální anestezie a léky ovlivňující hemokoagulaci – co přináší nejnovější doporučení?
- Preventivní imobilizace krční páteře v přednemocniční neodkladné péči o pacienty s úrazem: aktuální pohled na problematiku
- Trombofilní stavy v těhotenství
- Kritická obstrukce dýchacích cest způsobená masou v mediastinu během celkové anestezie řešená pomocí ECMO a tracheobronchiálního stentu
- Statistika v biomedicínském výzkumu I
-
ATESTAČNÍ OTÁZKY OBORU ANESTEZIOLOGIE A INTENZIVNÍ MEDICÍNA
Péče o pacienta po anestezii - Linezolid, inhibice monoaminoxidázy a klinické konsekvence
- Doporučení pro péči u traumatického poranění mozku, 4. vydání
-
Docent MUDr. Václav Fessl, CSc.
(1932–2016) - ZAJÍMAVOSTI, TIPY A TRIKY
- Jmenný a věcný rejstřík
- Anesteziologie a intenzivní medicína
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Monitorování hloubky celkové anestezie
- Trombofilní stavy v těhotenství
- Regionální anestezie a léky ovlivňující hemokoagulaci – co přináší nejnovější doporučení?
- Preventivní imobilizace krční páteře v přednemocniční neodkladné péči o pacienty s úrazem: aktuální pohled na problematiku
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



