-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Toxická epidermální nekrolýza
Toxic epidermal necrolysis
Toxic epidermal necrolysis is a rare, acute and life-threatening disorder manifested by extensive separation of the epidermis and mucosal surfaces. It is a serious adverse response to administered drugs, mostly antibiotics, anticonvulsants or NSAIDs. First described by Scottish dermatologist Alan Lyell in 1956, it is also known as Lyell’s syndrome. Mortality of the disease is high, therefore its early diagnosis is crucial and immediate initiation of appropriate patient care necessary. It is a rare disease with a very low incidence and serious prognosis, which is a considerable hindrance to undertaking large randomized clinical studies. It is therefore difficult to evaluate the effectiveness of various therapeutic options. As the most promising so far appears the administration of intravenous immunoglobulins, apparently reaching improvement in the clinical condition of the patient, with a good tolerances and minimal side adverse effects. New experimental techniques endeavour to seek a way to the therapy through targeted influencing of granulysin as the major cytotoxic mediator.
Key words:
adverse drug reaction – corticosteroids – cyclosporine A – granulysin – intravenous immunoglobulins – interdisciplinary team care – keratinocyte apoptosis – medical history – Nikolsky´s sign – plasmapheresis – SCORTEN score – Stevens-Johnson syndrome – toxic epidermal necrolysis
Autoři: Dina Odarčenková; Milan Kvapil
Působiště autorů: Interní klinika 2. LF UK a FN Motol Praha
Vyšlo v časopise: Vnitř Lék 2016; 62(1): 62-69
Kategorie: Kazuistiky
Souhrn
Toxická epidermální nekrolýza je vzácné, akutní, život ohrožující onemocnění projevující se rozsáhlým odlučováním epidermis a slizničních povrchů. Jde o závažnou nežádoucí reakci na podávané léky, nejčastěji antibiotika, antikonvulziva či nesteroidní antirevmatika. Jako první ji popsal skotský dermatolog Alan Lyell v roce 1956, proto je též nazývána Lyellův syndrom. Mortalita tohoto onemocnění je vysoká, proto je klíčová včasná diagnostika a neodkladné zahájení adekvátní péče o pacienta. Jedná se o vzácné onemocnění s velmi malou incidencí a závažnou prognózou, což značně ztěžuje provedení velkých randomizovaných klinických studií. Je tedy obtížné hodnotit efektivitu jednotlivých terapeutických možností. Jako nejperspektivnější se prozatím jeví nitrožilní podávání imunoglobulinů se zřejmým zlepšením klinického stavu pacienta, dobrou tolerancí a minimálními vedlejšími nežádoucími účinky. Nové experimentální postupy se snaží hledat cestu terapie cíleným ovlivněním granulyzinu jakožto hlavního cytotoxického mediátoru.
Klíčová slova:
anamnéza – apoptóza keratinocytů – cyklosporin A – granulyzin – hodnocení SCORTEN – intravenózní imunoglobuliny – interdisciplinární péče – kortikosteroidy – Nikolského fenomén – plazmaferéza – poléková reakce – Stevensův-Johnsonův syndrom – toxická epidermální nekrolýzaÚvod
Toxická epidermální nekrolýza (TEN) je akutní, život ohrožující onemocnění postihující pokožku a povrchové vrstvy sliznic. Je to onemocnění vzácné, jeho odhadovaná incidence se pohybuje od 0,4 do 1,9 případů na milion obyvatel ročně [1]. Výrazně vyšší výskyt byl prokázán u imunokompromitovaných nemocných, především pacientů nakažených virem HIV, u nichž je incidence TEN odhadována na 1 případ na 1 000 pacientů, tedy přibližně 1 000krát vyšší než u běžné populace. Onemocnění se může vyskytovat v každém věku, dokonce byl popsán i jeden případ postižení plodu, nicméně většinou se vyskytuje u starších pacientů. Ti mohou mít relativně vyšší riziko rozvoje TEN, neboť užívají více léků. Z prozatím nevysvětlených příčin jsou častěji postiženy ženy, a to v poměru 1,5 : 1 oproti mužům [2].
Poprvé bylo onemocnění popsáno skotským dermatologem Alanem Lyellem v roce 1956, proto je též nazýváno Lyellův syndrom. Později ale byli 2 z jeho původně 4 popisovaných pacientů reklasifikováni na diagnózu stafylokokového syndromu opařené kůže. Tzv. Stevensův-Johnsonův syndrom (SJS) byl zmíněn už v roce 1922 u 2 dětských pacientů 2 americkými lékaři – Albert Mason Stevens a Frank Chambliss Johnson.
Klasifikace
Klasifikace toxické epidermální nekrolýzy stále zůstává kontroverzním tématem, neboť patogenetické mechanizmy jeho vzniku nejsou ještě přesně objasněny. Dnes rozlišujeme 2 varianty téhož onemocnění, které se liší rozsahem postižení kožního povrchu. Při rozsahu kožních lézí do 10 % tělesného povrchu hovoříme o Stevensově-Johnsonově syndromu (SJS), nad 30 % o toxické epidermální nekrolýze (TEN – Lyellův syndrom), ostatní tvoří přechodné formy mezi SJS a TEN.
Ne zcela jasný je vztah tohoto onemocnění k erythema multiforme (EM). U erythema multiforme se může jednat o parainfekční kožní hypersenzitivní reakci, může jít ale také o reakci polékovou, případně o paraneoplazii v širším smyslu. Při EM minor, které je běžnější, dochází ke vzniku cihlově červených skvrn či papul velikosti čočky, které se šíří do okolí červeným navýšeným valem. Střed obvykle vklesává za tvorby puchýře a léze tak dostávají typický terčovitý obraz. Predilekčními oblastmi vzniku jsou extenzorové plochy končetin, dlaně a chodidla. Při EM major jsou kromě akrálních částí těla postiženy i slizniční povrchy. Etiologie EM minor i major je spojena s infekcí virem Herpes simplex či Mycoplasma pneumoniae. Některé práce označují EM major za totožné onemocnění jako Stevensův-Johnsonův syndrom, jiné poukazují na velmi pravděpodobně odlišnou etiologii a odlišnou predilekční lokalizaci lézí. Klasifikace těchto kožních onemocnění tedy není ještě zcela jasná [3].
Vyvolávající příčiny
V naprosté většině případů je onemocnění toxickou epidermální nekrolýzou způsobeno hypersenzitivní reakcí na podávané léky (až 95 %). Jedná se o potenciálně život ohrožující polékovou reakci. Mezi léky s vysokým rizikem patří antikonvulziva jako karbamazepin, fenytoin, fenobarbital a lamotrigin. Na rozdíl od nich je riziko při užívání kyseliny valproové jen malé. Dále je to nevirapin – inhibitor reverzní transkriptázy užívaný k léčbě AIDS, antibiotika – především kotrimoxazol a další sulfonamidy, sulfasalazin, alopurinol a některá nesteroidní antirevmatika (oxikamy) [4]. Zvýšené riziko bylo zaznamenáno i u aminopenicilinů, cefalosporinů a chinolonů. TEN se většinou rozvíjí mezi 7 dny až 8 týdny po podání léku, s maximem vzniku do 2 týdnů. Pokud ale lék podáváme opakovaně, může dojít k reakci již po několika hodinách. Po prvních 8 týdnech užívání nového léku by už ke vzniku TEN nemělo dojít [5]. Vzácně může být TEN způsobena infekcí Mycoplasma pneumoniae, virem Herpes simplex, reaktivací Cytomegaloviru či podáním kontrastní látky. Stále však existují případy onemocnění, u nichž se vyvolávající příčinu nepodaří odhalit. Roli může hrát i zvýšená genetická vnímavost, neboť byla prokázána zvýšená incidence HLA-B12 genotypu u pacientů postižených TEN. Dále byla zkoumána možná významná souvislost mezi přítomností konkrétních HLA alel a reakcí po podání alopurinolu (HLA-B 5801) a karbamazepinu (HLA-B 1502), prozatím ale pouze u čínské populace [6]. Kromě zmíněných alel byla publikována možná souvislost i s dalšími, např. HLA-B 3101. Riziko vzniku TEN/SJS tedy není spojeno pouze s expozicí rizikovým lékům, ale velmi pravděpodobně i s určitou genetickou predispozicí.
Klinický obraz
Kožním lézím většinou předcházejí prodromální příznaky připomínající běžnou virózu – horečka, nechutenství, bolest hlavy, kašel, myalgie, může se objevit diskrétní makulopapulózní exantém a pruritus kůže. Po několika dnech následuje akutní kožní fáze s tvorbou růžových až červených makul a papul, které mohou zpočátku imitovat polékový exantém. Rychle se ale šíří a mají tendenci ke splývání do nepravidelných tvarů různé velikosti. Kožní léze se většinou nejdříve objevují na trupu, šíří se na krk a proximální části horních končetin, poté i na další části těla. Ovlasená část hlavy bývá postižena zřídkakdy. S postupující nekrózou celé šíře epidermis dostávají léze šedivý nádech. Nekrotická epidermis se odlučuje od přilehlé dermis, vzniklý prostor je vyplněn tekutinou za tvorby bul a puchýřů. Měkké buly se lehce strhávají a vznikají tak kožní eroze a různě rozsáhlé kožní defekty. Odlučující se cáry kůže jsou připodobňovány k vlhkému cigaretovému papírku. Kůže je velmi citlivá na dotyk. Typickým příznakem je pozitivní Nikolského fenomén, při němž zdánlivě normální epidermis může být snadno odloučena smýkavým třením či tlakem od základních vrstev kůže v důsledku nedostatečné adheze epidermálních buněk. Tekutinu v puchýři lze tedy tlakem prstu posouvat do okolí, kožní bulu lze rozšířit do stran. TEN patří mezi nejzávažnější onemocnění ze skupiny tzv. burn-like syndromů, které imitují popálení. Velmi podobně může vypadat syndrom opařené kůže vyvolaný bakteriálním toxinem Staphylococcus aureus, který cirkuluje v krvi a může způsobit vznik povrchových intraepidermálních puchýřů. Naproti tomu při TEN je nekrózou postižena celá šíře epidermis.
Současně s kůží jsou u více než 90 % pacientů postiženy i sliznice. Nejčastěji je to sliznice dutiny ústní, která bývá postižena v 70–100 % případů. Vznikají tam bolestivé ulcerace, které mohou vést k dysfagii i dysfázii. K postižení oční spojivky dochází v 50–78 % případů, k postižení urogenitálního traktu ve 40–63 %. U žen může dojít ke vzniku erozivní vulvovaginitidy, u mužů erozivní balanitidy, u obou pohlaví pak ke vzniku erozí uretry. Méně často mohou být postiženy i sliznice gastrointestinálního traktu, nejčastěji jícnu, ale i střeva. Vzácné je i postižení respiračního ústrojí, trachey a bronchů, které může vést k dyspnoi a hypoxemii a může vyústit až v syndrom dechové tísně (ARDS) či bronchiolitis obliterans. Postižení sliznic se většinou mírně opožďuje za postižením kůže, obvykle v rozmezí 1 dne až 2 týdnů.
Bylo popsáno i postižení ledvinných glomerulů a proximálních tubulů ledvin vedoucí k akutní tubulární nekróze a k akutnímu renálnímu selhání. V moči pak byly detekovány enzymy renálních tubulů a mikroalbuminurie, nicméně mezi jejich výší a tíží TEN nebyla prokázána přímá korelace. Pravděpodobně zde hrají roli nefrotoxické cytokiny účastnící se patogenetických mechanizmů TEN, které jsou spojovány s destrukcí buněk ledvinných tubulů, glomerulární bariéry a mezangiálních buněk. Nelze ale opominout ani další faktory, jako hypovolemie a nízký srdeční výdej, které se na akutním renálním selhání mohou taktéž podílet.
Patogeneze
Podkladem klinických projevů toxické epidermální nekrolýzy je apoptóza keratinocytů epidermis, která je zprostředkovaná exocytózou příslušných mediátorů T-lymfocyty. Histopatologický obraz časných fází TEN zahrnuje přítomnost nekrotických keratinocytů odtržených od dermoepidermální junkce. Nekrotických keratinocytů následně přibývá, dochází k odlučování celé šíře epidermální vrstvy za tvorby subepidermálních puchýřů. V imunopatogenezi TEN hrají nejdůležitější roli cytotoxické T-lymfocyty, které byly v převaze nalezeny v tekutině z kožních bul, stejně jako perivaskulárně v povrchové části dermis. Mechanizmus jejich aktivace je stále ještě předmětem zkoumání. Svojí roli hrají ale i další buňky imunitního systému, jejichž vzájemná interakce nakonec vede k uvolnění mediátorů zánětu a adhezivních molekul.
Diskrepance mezi relativně chudým kožním zánětlivým infiltrátem a výraznou masou apoptotických keratinocytů vedla ke zkoumání cytotoxických proteinů a cytokinů, které by mohly zánětlivou reakci amplifikovat. Po aktivaci Tc-lymfocytů dochází k jejich exocytóze a uvolnění obsahu cytotoxických granul. Za hlavní mediátor je v současné době považován granulyzin, menší roli mají také perforin a granzym B. Tyto mediátory následně působí na buněčné membrány cílových buněk epidermis (keratinocytů), které poškodí a způsobí tak iontovou nestabilitu vedoucí nakonec k buněčné apoptóze. Byla prokázána elevace granulyzinu v séru pacientů s TEN ještě před vznikem kožních či slizničních lézí, naopak u pacientů s běžnými kožními polékovými rekcemi byla hladina granulyzinu zvýšena jen v minimu případů. Stanovení hladiny granulyzinu v séru by tedy mohlo představovat určitý příslib časné diagnostiky TEN v budoucnu. Koncentrace granulyzinu v tekutině z kožních bul také pozitivně korelovala se závažností projevů onemocnění, u TEN byla vyšší nežli u SJS.
FasL je transmembránový protein, který je exprimován na povrchu cytotoxických T-lymfocytů a NK buněk. Po navázání na cílový receptor FasR aktivuje intracelulární kaspázy vedoucí ke kontrolované buněčné smrti. Navíc může být FasL uvolněn z povrchu imunitních buněk metaloproteinázami za vytvoření solubilního FasL, který si stále zachovává schopnost vázat se na svůj cílový receptor FasR a indukovat apoptózu. Byla prokázána zvýšená exprese FasR keratinocytů u pacientů postižených toxickou epidermální nekrolýzou. Zdá se, že tento mechanizmus hraje v patogenezi TEN důležitou roli, představuje poslední krok v indukci apoptózy. Na cílené inhibici cesty FasL-FasR je založena léčba monoklonálními imunoglobuliny.
Dále byla zkoumána role dalších cytokinů a mediátorů, jako je např. TNFα, který je secernován monocyty a makrofágy. Váže se na buněčný receptor, který má taktéž schopnost aktivace kaspázové kaskády vedoucí k apoptóze cílové buňky. Hladiny TNFα jsou zvýšeny v tekutině z kožních bul, v kůži i séru. Jeho přesná úloha nicméně ještě není zcela známa, je diskutován i jeho antiapoptotický účinek.
Diagnostika
Diagnostika SJS a TEN je v současné době založena na klinickém obrazu a fyzikálním vyšetření pacienta. Byla zkoumána i možná detekce sérových markerů, která by diagnostiku mohla usnadnit. Jako nejperspektivnější se jeví stanovení hladiny granulyzinu v séru imunochromatografickou metodou. Bylo zjištěno, že pokud byl tento test proveden 2–4 dny před vznikem slizničních erozí, měl až 80% senzitivitu a téměř 96% specificitu při stanovení následného rozvoje SJS/TEN. Tento test je tedy příslibem možné brzké diagnostiky TEN do budoucnosti, v současné době ale není rutinně k dispozici. Definitivní diagnóza může být stanovena pouze na základě odběru bioptického vzorku kůže s jeho histologickým vyšetřením a zobrazením subepidermálních puchýřů a apoptotických keratinocytů v celé šíři epidermis. V praxi se ale běžně neprovádí a hlavním vodítkem ke stanovení správné diagnózy zůstává klinický obraz onemocnění. Pokud se rozhodneme pro histologické vyšetření, měli bychom odebrat 2 bioptické vzorky – jeden pro zpracování s klasickým barvením hematoxylinem a eozinem, druhý s možným využitím imunofluorescenčních metod. Při diferenciální diagnostice je potřeba odlišit především syndrom opařené kůže. Ten je způsoben exotoxinem Staphylococcus aureus a na rozdíl od TEN postihuje pouze povrchové vrstvy epidermis a málokdy jsou současně postiženy i sliznice.
Mortalita, komplikace
Mortalita je u toxické epidermální nekrolýzy vysoká, proto je klíčová včasná diagnostika a neodkladné zahájení adekvátní péče o pacienta. Prvořadý význam má okamžité přerušení podávání léků, které TEN mohly způsobit. Pokud má pacient rozsáhlou chronickou medikaci, pátráme vždy po lécích, které byly do medikace přidány nově v posledních dnech a týdnech. Další péče o pacienta by se pak měla odehrávat na jednotce intenzivní péče nebo přímo v popáleninovém centru. Mortalita Stevensova-Johnsonova syndromu se pohybuje mezi 1–5 %, mortalita toxické epidermální nekrolýzy pak stoupá až na 25–30 % [7]. Nejčastější příčinou smrti jsou infekční komplikace vedoucí k bakteriemii, sepsi a multiorgánovému selhání. Mezi typická agens patří nejen bakterie jako Pseudomonas aeruginosa, Acinetobacter baumannii, koaguláza-negativní Staphylococcus, Staphylococcus aureus (MSSA, MRSA), ale také kvasinky a plísně. Mezi známky poukazující na rozvoj septického stavu u pacienta s TEN patří kolísání tělesné teploty (febrilie i nízká teplota), tendence k hypotenzi, změny dechové frekvence, oligurie, labilní hodnoty glykemie a v neposlední řadě poruchy vědomí.
Pacienti s TEN ztrácejí obnaženými kožními plochami velké množství tekutin, je narušena i termoregulační funkce kůže. Dalšími komplikacemi mohou být krvácení z gastrointestinálního traktu, vznik plicní embolie či plicního edému, i infarkt myokardu.
Prognóza, následky
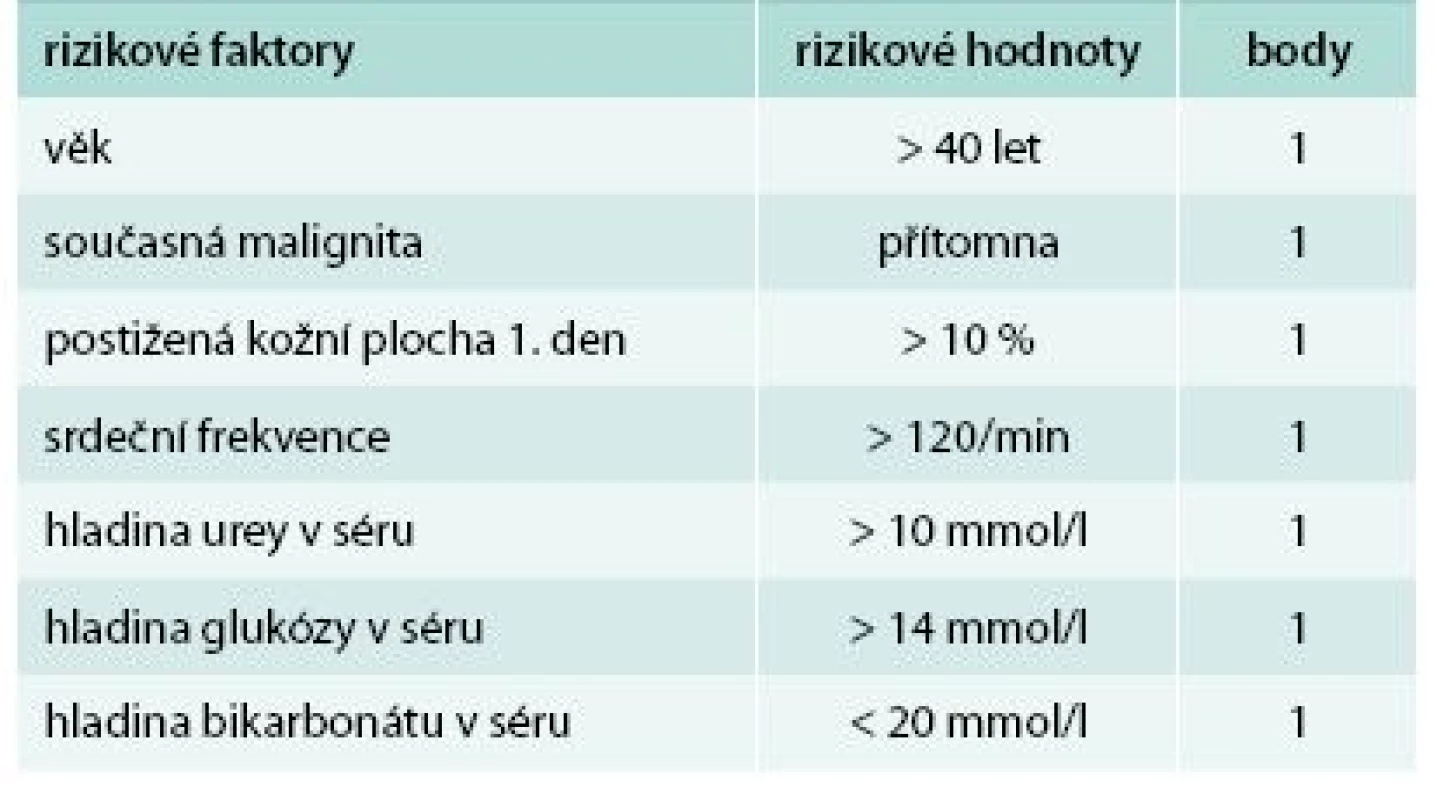
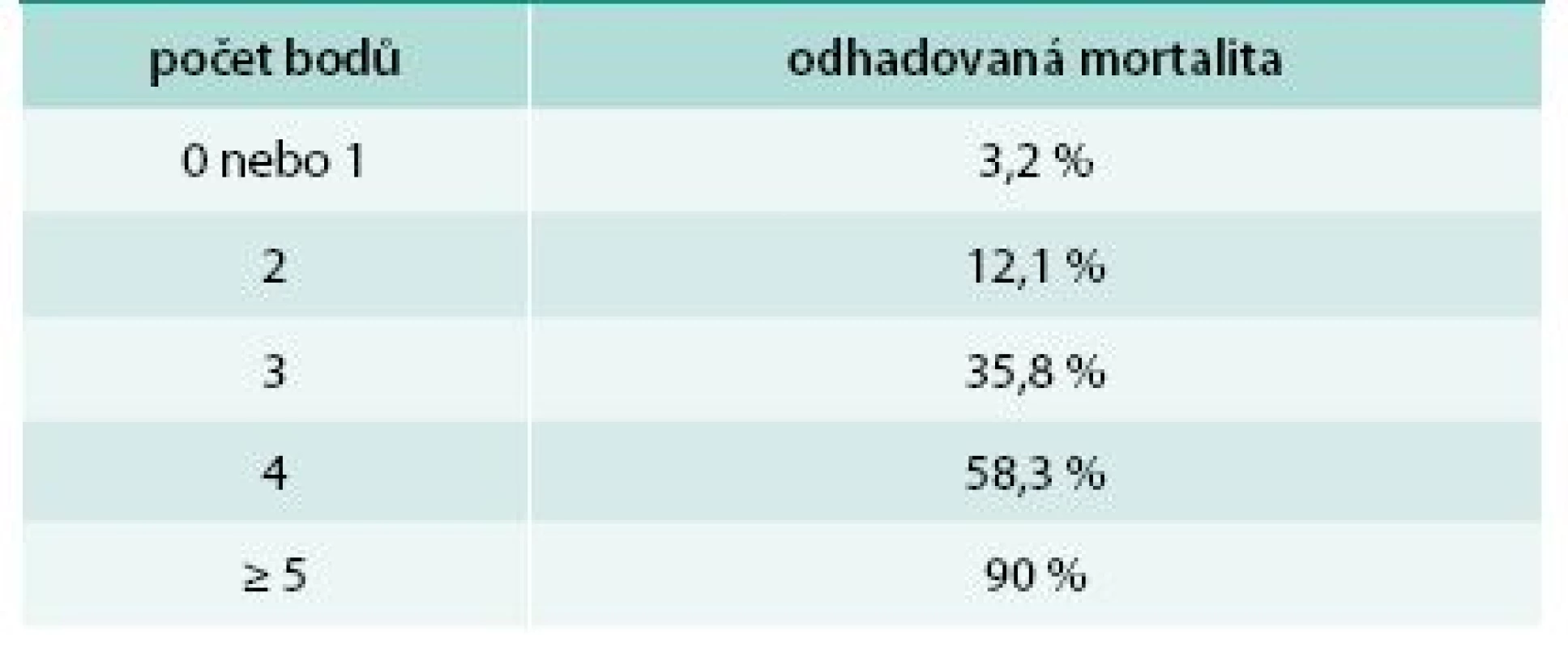
Ke zhodnocení závažnosti onemocnění a možnému odhadu prognózy a mortality bylo vytvořeno hodnocení SCORTEN (Severity of Illness Score for Toxic Epidermal Necrolysis, tab. 1 a tab. 2). To přiděluje jeden bod za každý rizikový faktor, kterými jsou: věk > 40 let, srdeční frekvence > 120/min, současná malignita, postižení > 10 % kožního povrchu již 1. den, urea v séru > 10 mmol/l, glukóza v séru > 14 mmol/l a bikarbonát < 20 mmol/l. Mortalita pacientů s 0 nebo 1 bodem je 3,2 %, se 2 body 12,1 %, se 3 body 35,8 %, se 4 body 58,3 % a s ≥ 5 body až 90 % [8]. Skóre by se mělo hodnotit vždy minimálně 1. a 3. den po přijetí pacienta k hospitalizaci.
Pacienti, kteří přežijí akutní fázi toxické epidermální nekrolýzy, jsou ohroženi řadou možných následků, které vznikají u více než poloviny všech nemocných. Proto by péče o pacienty postižené SJS/TEN měla být interdisciplinární. Nejčastější je oční postižení popisované u 20–79 % pacientů. Zahrnuje nejčastěji syndrom suchého oka (sicca syndrom), dále fotofobii, pocity přítomnosti písku v oku, srůsty očních víček, jizvení rohovky, subkonjunktivální fibrózu, snížení zrakové ostrosti až úplnou slepotu. Vzhledem k těmto očním komplikacím je nutné včasné vyšetření všech pacientů s TEN očním lékařem. Vhodné je preventivní zvlhčování očí očními kapkami, v indikovaných případech i použití lokálních antibiotik či kortikosteroidů.
Časté je také následné postižení kůže, jako dyspigmentace – hyperpigmentace i hypopigmentace, jizvení kůže, onycholýza a onychodystrofie, prořídnutí vlasové pokrývky hlavy. Mezi následky vznikající v dutině ústní patří snížená tvorba slin až xerostomie, zvýšená kyselost slin či zánětlivé postižení dásní. Součástí péče o pacienty s TEN by tedy měla být i péče o hygienu dutiny ústní, vyplachování úst antiseptiky několikrát denně. U žen může dojít k zúžení poševního vchodu, vzniku slizničních adhezí genitálu a následné dyspareunie, proto je vhodné vyšetření žen gynekologem s případnou včasnou adheziolýzou. Stejně tak je u mužů vhodné vyšetření urologem, neboť hrozí vznik uretrálních erozí s následnou možnou strikturou močové trubice.
Pacienti s anamnézou toxické epidermální nekrolýzy by se měli přísně vyvarovat veškerých léků, které by TEN mohly vyvolat. Je třeba věnovat pozornost i možným zkříženým reakcím, ke kterým může dojít např. při podání karbamazepinu, fenytoinu a fenobarbitalu. Pacienti po TEN vyvolané aromatickými antikonvulzivy by se tedy měli vyhnout podání jakéhokoli léku z této skupiny. Stejně tak pacienti po TEN vyvolané betalaktamovým antibiotikem by se měli vyvarovat veškerým dalším antibiotikům z této skupiny, včetně cefalosporinů a karbapenemů.
Lokální terapie
Terapie toxické epidermální nekrolýzy vyžaduje komplexní přístup. Základem je včasný transport pacienta do specializovaného zdravotnického zařízení, na jednotku intenzivní péče či přímo do popáleninového centra. Nezbytné je okamžité přerušení podávání všech léků, které by mohly nemoc způsobit. Co nejdříve po převozu pacienta by měly být opatrně odstraněny devitalizované tkáně epidermis a eroze překryty neadherentním krytím a obvazy. Důležitá je zejména ochrana exfoliované plochy před mechanickou traumatizací, vysycháním a vznikem infekce. Každá takováto plocha má potenciál ke spontánní reepitelizaci, které ale může bránit patologické pomnožení mikroorganizmů v ráně. Výhodné je využití metody vlhkého hojení ran. Vzhledem k velké bolestivosti je nezřídka nutné provádět převazy a ošetřování postižených ploch v celkové anestezii. Měli bychom se ale vyvarovat příliš častým převazům, které reepitelizaci mohou zpomalovat. Samozřejmostí je ošetřování postižených ploch v aseptických podmínkách. Po stabilizaci stavu je možné ke krytí defektů použít autotransplantáty dermoepidermálními štěpy z nepostižených okrsků kůže, vzácněji jsou využívány prasečí xenografty, lidské alogenní transplantáty či syntetické kožní náhrady.
U pacientů s velmi rozsáhlým postižením kůže se nyní zkoumá možná transplantace a aplikace pupečníkových mezenchymových buněk, které mají výhodný imunomodulační efekt.
Celková podpůrná terapie
Kromě lokálního ošetřování postižených ploch je neméně důležitá celková terapie podpůrná. Jejím základem je dostatečná tekutinová resuscitace a následná péče o vyrovnanou bilanci tekutin. Stejně jako u popálenin jsou i zde ztráty tekutin obnaženou plochou značné. Parenterální přívod tekutin by měl udržet diurézu 50–80 ml za hodinu. Dále je nutné udržovat onkoticko-osmotickou rovnováhu, pravidelně kontrolovat iontogram a případně hradit chybějící ionty. Do resuscitace lze jistě zahrnout přirozené koloidy a – jsou-li potřeba – i koloidy syntetické. Pacienti s TEN jsou velmi náchylní k rozvoji infekčních komplikací, z tohoto důvodu je nutná pravidelná mikrobiologická monitorace nejen exfoliovaných kožních ploch, ale i krevního řečiště, močového traktu a dýchacích cest. Profylaktická antibiotická terapie není doporučována, pouze by zvýšila riziko infekce rezistentními kmeny bakterií. Periferní žilní vstup by měl být co nejdále vzdálen od postižených okrsků kůže a pokud to není nezbytně nutné, volíme pouze minimální počet invazivních vstupů. Pro zajištění průchodnosti močové trubice a přesné měření bilance tekutin je vhodné zavedení permanentního močového katétru.
Součástí komplexní léčby je i tlumení bolestí a dostatečná nutrice pacienta. Je doporučováno včasné zahájení enterální výživy. Pokud jsou přítomny rozsáhlé bolestivé ulcerace v dutině ústní, je vhodné zavést nazogastrickou sondu a pokračovat v enterální výživě touto cestou. V případě nutnosti lze enterální výživu doplnit o výživu parenterální. Energetická potřeba je u TEN pouze mírně nad bazální úrovní, na rozdíl od pacientů s popáleninami, u nichž jsou metabolické nároky velmi vysoké. Důležitá je i prevence stresového vředu podáváním inhibitorů protonové pumpy a nízkomolekulární heparinizace. Teplota okolního vzduchu v místnosti, kde je pacient ošetřován, by měla být mezi 30 a 32 °C, lze tak redukovat další energetické ztráty při produkci tepla.
Důležitá je i prevence očního postižení pravidelným zvlhčováním očí kapkami či umělými slzami, aplikací lokálních antibiotik (např. erytromycinu) a lokálních kortikosteroidů, případně i včasnou adheziolýzou srůstů. Ústa by měla být denně vyplachována antiseptiky, s pravidelnou péčí o chrup.
Specifická imunomodulační terapie
Specifická terapie, jejíž účinnost by byla prokázána velkými kontrolovanými klinickými studiemi, dnes bohužel neexistuje. Na použití podpůrné systémové imunomodulační terapie zahrnující podávání systémových kortikosteroidů, intravenózních imunoglobulinů, cyklosporinu či provedení plazmaferézy nejsou dnes zcela jednotné názory. Systémová léčba parenterálně podávanými kortikosteroidy byla po dlouhou dobu léčbou první volby, nicméně v dnešní době je jejich používání při léčbě TEN považováno za kontroverzní [9]. Kortikosteroidy mají protizánětlivý a imunosupresivní efekt, ovlivňují periferní leukocyty i funkci mnohých zánětlivých mediátorů, snižují expresi leukocytárních adhezních molekul, inhibují funkci antigen prezentujících buněk. Prvotní studie poukazovaly na pozitivní efekt této léčby, pozdější však prokázaly zvýšené riziko vzniku infekcí, delší hojení ran a s tím související prodlouženou dobu hospitalizace a zvýšenou mortalitu. Přesná doporučení pro léčbu kortikosteroidy neexistují, k jejich vytvoření zde prozatím chybí větší prospektivní randomizovaná studie, jejíž provedení je vzhledem k malému počtu pacientů postižených TEN obtížné. Pokud se rozhodneme pro léčbu kortikosteroidy, je výhodné podávat je co nejdříve již v prvních dnech po stanovení diagnózy parenterálně ve vysokých dávkách, co nejkratší dobu, např. ve formě pulzní terapie dexametazonem. Lze je podávat kupříkladu v dávkách 1,5 mg na kg tělesné hmotnosti a den, 3 po sobě následující dny. Poté je nutná postupná pomalá detrakce dávek [10]. Je důležité kontrolovat případný rozvoj sekundární hyperglykemie či hypertenze.
Zájem o použití intravenózně podávaných imunoglobulinů (IVIG) jako možné léčby TEN se rozvinul po objevu, že monoklonální IVIG mohou in vitro inhibovat FasL-FasR indukovanou apoptózu keratinocytů. Od tohoto prvotního objevu zkoumalo léčbu IVIG mnoho studií, nicméně jejich výsledky nejsou zcela přesvědčivé. Některé klinické studie prokázaly sníženou mortalitu pacientů léčených IVIG, jiné v porovnání s podpůrnou terapií ukázaly mortalitu přibližně totožnou. Velká randomizovaná prospektivní studie léčby imunoglobuliny, stejně jako léčby kortikosteroidy, prozatím chybí. Výhodou IVIG je jejich nízká toxicita a dobrá tolerance pacientem [11]. Větší benefit z léčby mají především pacienti, jimž je podávána vyšší celková dávka IVIG > 2 g/kg tělesné hmotnosti pacienta, obvykle 3 g/kg, podávané v pomalých infuzích [12]. Mezi nežádoucí účinky patří především vznik hyperviskózního syndromu s vyplývajícími komplikacemi jako např. infarkt myokardu, cévní mozková příhoda, či anafylaktická reakce.
Cyklosporin A je účinné imunosupresivum, které je využíváno při transplantacích orgánů i kostní dřeně a při léčbě některých autoimunitních onemocnění. Inhibuje některé imunitní buňky včetně lymfocytů a makrofágů, mechanizmem jeho působení je zastavení syntézy interleukinu 2 [13]. Může inhibovat apoptózu keratinocytů, zabránit tak progresi onemocnění a urychlit reepitelizační proces, proto je mu věnována pozornost i při léčbě TEN. Ve fázi zkoumání a klinických studií je také použití lokálního cyklosporinu jako možné prevence očního postižení.
U pacientů nereagujících na výše uvedenou léčbu ani podpůrnou terapii lze využít provedení plazmaferézy. Plazmaferéza umožňuje snížení obsahu patogeneticky aktivních komponent obsažených v plazmě pacienta, při léčbě TEN tedy převážně odstranění vyvolávajícího léku, jeho cytotoxických metabolitů a zánětlivých mediátorů z cirkulující plazmy. V průběhu plazmaferézy se nejprve pacientova odebraná krev mísí s antikoagulačním roztokem a poté vstupuje do speciálního přístroje – separátoru, v němž dochází k oddělení plazmy a buněčných elementů. Ty jsou pak spolu s náhradním roztokem – plazmou zdravého dárce či směsí koloidních a krystaloidních roztoků, navráceny do oběhu pacienta. Je také možné využití speciálních filtrů s póry různé velikosti, které v plazmě selektivně zachytí proteiny s velkou molekulovou hmotností, jako některé zánětlivé cytokiny. Tato metoda však není účinná tak jako klasická plazmaferéza, neboť molekulová hmotnost mnohých zánětlivých mediátorů je příliš malá [14].
Mezi cílenou terapii patří i léčba TNFα inhibitory – infliximabem, či GCSF (granulocyte colony-stimulating factor), u nichž však prozatím chybí dostatek publikovaných dat a léčených pacientů.
Závěr
Toxická epidermální nekrolýza je akutní život ohrožující onemocnění, se kterým se většina lékařů ve svých ordinacích a ambulancích setká velmi vzácně. Prognóza je však závažná a mortalita vysoká, proto je nezbytná včasná diagnostika [15]. Ve většině případů se jedná o hypersenzitivní reakci na podávané léky. Z tohoto důvodu je kromě fyzikálního vyšetření klíčový pečlivý odběr anamnézy včetně dotazu na případné nežádoucí reakce po podaných léčivech v minulosti. Při podezření na vznik tohoto onemocnění má prvořadý význam okamžité přerušení užívání léků, které ho mohly způsobit. Pouze neodkladné zahájení adekvátní péče, která by se měla odehrávat na jednotce intenzivní péče nebo v popáleninovém centru, může zvýšit šanci pacienta na přežití a snížit riziko případných komplikací a zdravotních následků.
Kazuistika
83letý pacient hospitalizován na Interní klinice FN Motol Praha v prosinci roku 2013.
Osobní anamnéza
Diabetes mellitus 2. typu, pacient užívá perorální antidiabetika, bez známých orgánových komplikací, ischemická choroba srdeční – st. p. infarktu myokardu roku 1983, chronická renální insuficience 2. stupně dle KDOQI klasifikace, arteriální hypertenze na terapii, st. p. vytvoření aortorenálního bypassu, benigní hyperplazie prostaty, st. p. cholecystektomii.
Užívané léky
Amlodipin (Agen 5 mg), perindopril (Prenessa 4 mg), bisoprolol (Concor 2,5 mg), ASA (Anopyrin 100 mg), omeprazol (Helicid 20 mg), metformin (Siofor 500 mg), finasterid (Androfin 5 mg), doxazosin (Doxazosin 4 mg). Poslední 2 dny před hospitalizací sulfametoxazol + trimetoprim (Biseptol).
Alergie
Kotrimoxazol!
SA, abúzus
Ve starobním důchodu, žije s manželkou, nekuřák, alkohol – 1 pivo denně.
Nynější onemocnění při přijetí
Pacient přichází k vyšetření na Interní kliniku pro suspektní alergickou reakci na kotrimoxazol (Biseptol). Pacient udává, že alergickou reakci po Biseptolu měl v minulosti již 2krát. Naposledy před 3 lety, kdy se vytvořily puchýře s následným sloupnutím kůže, popisovaný rozsah odpovídá přibližně 10 % kožního povrchu. Tehdy byl ošetřován jen ambulantně. Přesto mu nyní před 2 dny antibiotikum bylo podáno ambulantním urologem jako zajištění při cystoskopii – ta byla prováděna z důvodu slabšího proudu moči. Již krátce po podání začátek reakce – zarudnutí kůže na dolních končetinách, zádech a obličeji, kůže svědí, pálí, bolí, hlavně na zádech (obr. 1–5). Cítí se unavený, dýchá se mu dobře, veškeré jiné obtíže neguje. Dnes se pro zhoršování kožních projevů dostavil na Oddělení urgentního příjmu FN Motol, kde podány krystaloidy, metylprednisolon (250 mg Solumedrolu) i.v. a antihistaminikum i.v. (1 amp Dithiadenu). Následně pacient odeslán k hospitalizaci na Interní kliniku.
Obr. 1. – 5. Typický obraz toxické epidermální nekrolýzy. Dokumentace z fyzikálního vyšetření pacienta. 
Fotografie z archivu autorky Fyzikální vyšetření
Při příjmu TK 156/65 mm Hg, P 110/min. Na zádech, prsou, podbřišku a na stehnech patrny tvořící se plošné puchýře, na vnitřní straně paží drobně skvrnitý exantém. Přítomen otok a zarudnutí víček, spojivky zarudlé, výrazná purulentní sekrece, zasychající krusty. Následně dochází k postupné progresi kožního nálezu do plošných puchýřů a erodovaných ploch, při překladu pacienta již o celkovém rozsahu 25 %. Záda celoplošně erytematózní, několik mapovitých erozí, plihlé čiré puchýře, pozitivní přímý i nepřímý Nikolského fenomén. Eroze velikosti dlaně i na zevní straně stehen, dále na šourku (obr. 1–5). Rty s krustami a ragádami. Při překladu TK 149/71 mm Hg, P 52/min.
Oční vyšetření
Obě oči jsou slepené výrazným séropurulentním sekretem, po jemném očištění víček a řas borovou vodou patrna macerovaná kůže okrajů víček s hyperemií. Dále víčka s erytémem, vpravo na horním víčku je patrna drobná exkoriace, taktéž vlevo na horním víčku při vnitřním koutku exkoriace, tarzální spojivky jsou hyperemické, bulbární spojivka klidná, jen nepatrně hyperemická, fluoresceinem se nebarví. Rohovka je intaktní. Závěr: Blefaroconjunctivitis l. utr. Dop.: lokálně dexametazon + tobramycin (Tobradex gtt) 3krát denně do obou očí, na okraje víček tobramycin (Tobrex ung) 3krát denně, hlenohnisavou sekreci lze očistit borovou vodou.
ORL vyšetření
Dutina ústní i hltan s klidnou bledou sliznicí, bez slizničních eflorescencí. Dále vyšetření včetně fibrolaryngoskopie bez nálezu patologie, bez slizničních lézí.
Průběh hospitalizace
83letý pacient byl přijat pro akutní alergickou reakci po podání kotrimoxazolu, který byl, i přes anamnézu opakované alergické reakce v minulosti, podán urologem jako zajištění při cystoskopii. Již vstupně byly podány kortikoidy a antihistaminika parenterálně, v této léčbě jsme pokračovali i během hospitalizace. Bolesti tlumeny opiáty, pacient intenzivně hydratován, prevence tromboembolické nemoci nízkomolekulárním heparinem. Pro progresi lokálního kožního nálezu byl konzultován dermatolog, který stav uzavřel jako Stevensův-Johnsonův syndrom s přechodem do toxické epidermální nekrolýzy. Vzhledem k závažnosti stavu a pravděpodobné progresi kožního nálezu doporučil překlad na lůžko kliniky popáleninové medicíny. Renální funkce stabilní v chronickém pásmu 2.–3. stupně poruchy GFR. Vzhledem k plánovanému ošetření v celkové anestezii na Klinice popáleninové medicíny byly ke korekci hraniční koagulace podány 2 mražené plazmy. Krevní obraz bez výrazného poklesu v červené krevní řadě, bez leukocytózy, vstupně elevované CRP i bez antibiotické terapie se spontánním poklesem. Glykemie po podání kortikoidů bez elevace, bez sekundární hypertenze, naopak pro tendenci k hypotenzi byla postupně vysazena užívaná antihypertenziva. Bylo doplněno oftalmologické a ORL konzilium. Po předchozí telefonické domluvě pacient následně hned den poté přeložen na Kliniku popáleninové medicíny jiné pražské nemocnice. Tam pak týden hospitalizován na JIP oddělení, po stabilizaci stavu přeložen na standardní lůžko. Byla zvolena konzervativní terapie s postupnou detrakcí kortikoidní léčby, během níž došlo k dobré spontánní reepitelizaci kožních i slizničních erozí. Během hospitalizace na JIP prováděny převazy v analgezii jednou za 3 dny, v lokální terapii využit mastný tyl a Bactigras. Pravidelně lokálně aplikovány umělé slzy, s kontrolou oftalmologem. Pacient propuštěn po 22 dnech hospitalizace v dobrém klinickém stavu, léze zhojeny až na drobnou zbytkovou plošku na pravém stehně velikosti 3 cm2.
MUDr. Dina Odarčenková
dina.odarcenkova@fnmotol.cz
Interní klinika 2. LF UK a FN Motol,
Praha
www.fnmotol.cz
Doručeno ro redakce 19. 5. 2015
Přijato po recenzi 29. 9. 2015
Zdroje
1. Schwartz RA, McDonough PH, Lee BW. Toxic epidermal necrolysis – Part I. Introduction, history, classification, clinical features, systemic manifestations, etiology, and immunopathogenesis. J Am Acad Dermatol 2013; 69 : 173.e1–13; quiz 185–186. Dostupné z DOI: <http://dx.doi.org/10.1016/j.jaad.2013.05.003>>.
2. Hussain W, Craven NM. Toxic epidermal necrolysis and Stevens-Johnson syndrome. Clin Med (Lond) 2005; 5(6): 555–558.
3. Tomasini C, Derlino F, Quaglino P et al. From erythema multiforme to toxic epidermal necrolysis. Same spectrum or different diseases? G Ital Dermatol Venereol 2014; 149(2): 243–261.
4. Knowles S, Shear NH. Clinical risk management of Stevens-Johnson syndrome/toxic epidermal necrolysis spectrum. Dermatol Ther 2009; 22(5): 441–451.
5. Mockenhaupt M. The current understanding of Stevens-Johnson syndrome and toxic epidermal necrolysis. Expert Rev Clin Immunol 2011; 7(6): 803–813.
6. French LE. Toxic epidermal necrolysis and Stevens-Johnson syndrome: our current understanding. Allergol Int 2006; 55(1): 9–16.
7. Schwartz RA, McDonough PH, Lee BW. Toxic epidermal necrolysis – Part II. Prognosis, sequelae, diagnosis, differential diagnosis, prevention, and treatment. J Am Acad Dermatol 2013; 69(2): 187.e1–16; quiz 203–204. Dostupné z DOI: <http://dx.doi.org/10.1016/j.jaad.2013.05.002>.
8. Harr T, French LE. Toxic epidermal necrolysis and Stevens-Johnson syndrome. Orphanet J Rare Dis 2010; 5 : 39. Dostupné z DOI: <http://dx.doi.org/10.1186/1750–1172–5-39>.
9. Castelain F, Humbert P. Toxic epidermal necrolysis. Curr Drug Saf 2012; 7(5): 332–338.
10. Michaels B The role of systemic corticosteroid therapy in erythema multiforme major and Stevens-Johnson syndrome – a review of past and current opinions. J Clin Aesthet Dermatol 2009; 2(3): 51–55.
11. Huang YC, Li YC, Chen TJ. The efficacy of intravenous immunoglobulin for the treatment of toxic epidermal necrolysis: a systemic review and meta-analysis. Br J Dermatol 2012; 167(2): 424–432.
12. Teo L, Tay YK, Liu TT et al. Stevens-Johnson syndrome and toxic epidermal necrolysis: efficacy of intravenous immunoglobulin and a review of treatment options. Singapore Med J 2009; 50(1): 29–33.
13. Nešpor D, Lipový B, Gregorová N. Cyklosporin A v terapii toxické epidermální nekrolýzy. Dermatol praxi 2011; 5(3): 156–159.
14. Narita YM, Hirahara K, Mizukawa Y et al. Efficacy of plasmapheresis for the treatment of severe toxic epidermal necrolysis: Is cytosine expression analysis useful in predicting its therapeutic efficacy? J Dermatol 2011; 38(3): 236–245.
15. Beder DS. Toxic epidermal necrolysis. Lancet 1998; 351(9113): 1417–1420.
Štítky
Diabetológia Endokrinológia Interné lekárstvo
Článek Prieskum „3P (Pacient – Pulz – Prognóza) pri srdcovom zlyhávaní“ so zameraním na srdcovú frekvenciuČlánek Změny v prognóze a v léčbě Waldenströmovy makroglobulinemie: přehled literatury a vlastní zkušenostiČlánek Moudře a pomalu – editorialČlánek Korespondence ke článkuČlánek Z odborné literaturyČlánek Lyellův syndrom – editorial
Článok vyšiel v časopiseVnitřní lékařství
Najčítanejšie tento týždeň
2016 Číslo 1- Parazitičtí červi v terapii Crohnovy choroby a dalších zánětlivých autoimunitních onemocnění
- Rizikové období v léčbě růstovým hormonem: přechod mladých pacientů k lékařům pro dospělé
- Nech brouka žít… Ať žije astma!
- Intermitentní hladovění v prevenci a léčbě chorob
- Monoklonální protilátky v léčbě hyperlipidemií
-
Všetky články tohto čísla
- Prieskum „3P (Pacient – Pulz – Prognóza) pri srdcovom zlyhávaní“ so zameraním na srdcovú frekvenciu
- Změny v prognóze a v léčbě Waldenströmovy makroglobulinemie: přehled literatury a vlastní zkušenosti
- Genetické změny u Waldenströmovy makroglobulinemie
- Studie SPRINT. Randomizovaná studie porovnávající intenzivní kontrolu systolického tlaku s kontrolou standardní
- Raritná diagnostika infekčnej endokarditídy po transplantácii obličky
- Moudře a pomalu – editorial
- Vzácný případ mobilního aterosklerotického plátu ve femorální tepně s vysokým embolizačním potenciálem
- Nebezpečné okurky – Leyllův syndrom
- Toxická epidermální nekrolýza
- Toxická epidermální nekrolýza – editorial
- Korespondence ke článku
- EASD Postgraduate Course of Clinical Diabetes and its Complications, Prague 2015
- Poslední rozloučení s panem profesorem MUDr. Vratislavem Schreiberem, DrSc.
- Z odborné literatury
- Lyellův syndrom – editorial
- Význam vyšetrovania alanínaminotransferázy u darcov krvi pre redukciu rizika prenosu hepatitíd B a C hemoterapiou
- Vnitřní lékařství
- Archív čísel
- Aktuálne číslo
- Iba online
- Informácie o časopise
Najčítanejšie v tomto čísle- Toxická epidermální nekrolýza
- Změny v prognóze a v léčbě Waldenströmovy makroglobulinemie: přehled literatury a vlastní zkušenosti
- Význam vyšetrovania alanínaminotransferázy u darcov krvi pre redukciu rizika prenosu hepatitíd B a C hemoterapiou
- Genetické změny u Waldenströmovy makroglobulinemie
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy