-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Histiocytární sarkom
Histiocytic sarcoma
Histiocytic sarcoma is a neoplasm arising from the histiocytes. Histiocytic neoplasms are among the rarest malignancies of lymphatic tissues. Occurs in less than 1% of all malignancies affecting lymph nodes and soft tissues [1,2]. The exact incidence of histiocytic sarcoma has not been described so far. In this article, we report three patients with HS, who were treated at the departement of Internal medicine, haematology and oncology, Faculty Hospital Brno. Despite the fact that all these patients had the same disease, the treatment effects differ depending on the stage of the disease at the time of diagnosis.
Key words:
histiocytes – histiocytic sarcoma – lymphatic tissue
Autori: E. Létalová 1; M. Moulis 2; M. Klincová 4; R. Koukalová 3; Z. Řehák 3; F. Folber 1; Z. Adam 1; J. Mayer 1
Pôsobisko autorov: Interní hematologická a onkologická klinika Lékařské fakulty MU a FN Brno, pracoviště Bohunice, přednosta prof. MUDr. Jiří Mayer, CSc. 1; Ústav patologie Lékařské fakulty MU a FN Brno, pracoviště Bohunice, přednosta doc. MUDr. Josef Feit, CSc. 2; Oddělení nukleární medicíny Masarykova onkologického ústavu, Brno, přednosta prim. MUDr. Zdeněk Řehák, Ph. D. 3; Interní oddělení Nemocnice Boskovice, p. o., Boskovice, přednosta prim. MUDr. Luděk Pluháček, Ph. D. 4
Vyšlo v časopise: Vnitř Lék 2013; 59(12): 1117-1122
Kategória: Kazuistika
Súhrn
Histiocytární sarkom se řadí mezi neoplazie vycházející z histiocytů. Histiocytární neoplazie patří mezi nejvzácnější nádorová onemocnění postihující lymfatické tkáně. Představují méně než 1 % nádorů vyskytujících se v lymfatických uzlinách a měkkých tkáních [1,2]. Přesná incidence histiocytárního sarkomu nebyla dosud nikým popsána. V článku zmiňujeme kazuistiky 3 pacientů s touto diagnózou, kteří byli léčeni na Interní hematologické a onkologické klinice FN Brno. Ač se jedná o jednu diagnózu, výsledky léčby se u jednotlivých pacientů velmi liší v závislosti na míře postižení organizmu v době stanovení diagnózy.
Klíčová slova:
histiocyty – histiocytární sarkom – lymfatická tkáňÚvod
Histiocytární sarkom (HS) je nozologická jednotka, jejíž definice podléhala v posledních desetiletích změnám. Před desítkou let to bývala podstatně častější diagnóza. Posléze WHO klasifikace definovala přesněji, pomocí CD antigenů a dalších buněčných znaků, nádory z kategorie T lymfomů, které dříve dle svých morfologických charakteristik spadaly do kategorie histiocytárního sarkomu. Zpřesnění diagnostiky B a hlavně T lymfomů vedlo ke zmenšení incidence pravých histiocytárních sarkomů. Pro jejich vzácnost je s touto jednotkou daleko méně zkušeností než s lymfomy. Jejich léčbu neanalyzují žádné klinické studie. Informace o biologickém průběhu a léčbě HS je nutné sbírat z popisů jednotlivých případů či popisů menších souborů nemocných. V posledních 10 letech byly na Interní hematologické a onkologické klinice léčeni pouze 3 pacienti s touto vzácnou diagnózou. Cílem následujícího popisu případů je sdílet zkušenosti s léčbou této vzácné nemoci.
Popis případů
Kazuistika č. 1
S diagnózou HS jsme se setkali u muže narozeného v roce 1941. V době stanovení diagnózy mu bylo 67 let. Z předchorobí stojí za zmínku, že muž před stanovením diagnózy HS trpěl diabetem 2. typu, pro který užíval léky, a dále se léčil s vysokým krevním tlakem. Tento muž si v období Vánoc roku 2007 nahmatal bulku v levé axile. Po vánočních svátcích v lednu roku 2008 byl vyšetřen v okresní nemocnici. Podstoupil CT vyšetření krku, hrudníku, břicha a pánve se závěrem nadhraniční mediastinální a retroperitoneální lymfadenopatie a podezření na adenom levé nadledviny. Následně byla provedena excize lymfatické uzliny z levé axily. Histologicky diagnóza prvním čtením z 15. 2. 2008 uzavřena jako Hodgkinův lymfom. Klinické stadium zhodnoceno jako III A (levá axila, mediastinum a retroperitoneum). Ke druhému čtení byl vzorek lymfatické uzliny zaslán do Ústavu patologie FN Brno. Závěr prvního čtení přehodnocen a diagnóza uzavřena jako histiocytární sarkom. Byla provedena stagingová vyšetření (sonografie uzlin – negativní, trepanobiopsie kostní dřeně – negativní, PET vyšetření z března roku 2008 – negativní). Klinické stadium onemocnění při stanovení diagnózy přehodnoceno na I A. Na oblast excize lymfatické uzliny z levé axily byla indikována radioterapie v kurativní dávce 50 Gy. Radioterapie byla dokončena v červenci roku 2008. Kontrolní PET/CT z listopadu roku 2008 bez nálezu patologie. V současné době pacient dochází k pravidelným dispenzárním kontrolám. Doposud byla vždy kontrolní vyšetření (sonografie axily, PET/CT) negativní. Po 4 letech od stanovení diagnózy je pacient bez známek onemocnění.
Kazuistika č. 2
Diagnózu HS jsme stanovili také 45leté ženě narozené v roce 1964. Pacientka byla endokrinology sledována od roku 2006 pro strumu. V létě roku 2010 si nahmatala lymfatickou uzlinu (LU) na krku. Byla provedena exstirpace krční LU, histologický nález byl však negativní. V listopadu roku 2010 si všimla jednostranně zvětšené krční mandle vpravo. V prosinci roku 2010 byla provedena exstirpace a histologickým vyšetřením v Ústavu patologie FN Brno byla potvrzena diagnóza histiocytárního sarkomu. V lednu roku 2011 (obr. 1) jsme provedli vyšetření nutná ke stanovení rozsahu onemocnění včetně PET/CT. Nalezli jsme pozitivní ložiska v oblasti krčních lymfatických uzlin vpravo a ve štítné žláze. Trepanobiopsie kostní dřeně neprokázala známky maligního onemocnění. Klinické stadium jsme uzavřeli jako II EA a zahájili podávání systémové chemoterapie CHOP. Po 3 cyklech chemoterapie došlo podle kontrolního PET/CT k vymizení ložisek, avšak v oblasti krku byla nadále patrna vyšší metabolická aktivita. Proto jsme v dubnu roku 2011 zahájili radioterapii na oblast krku v dávce 40 Gy. Kontrolní CT krku z července roku 2011 popisovalo mírné zvětšení krčních LU vpravo (12 × 13 mm a 10 × 12 × 7 mm). Následovala mobilizace cyklofosfamidem a granulocytárními růstovými faktory a sběrem periferních kmenových buněk. Na kontrolním PET/CT v srpnu roku 2011 bylo patrno zlepšení krční lymfadenopatie ve srovnání s předchozím nálezem, avšak nadále přetrvávala zvýšená metabolická aktivita v oblasti měkkých tkání krku a ve štítné žláze. Endokrinolog doporučil její odstranění. Totální tyroidektomie byla provedena v okresní nemocnici v říjnu roku 2011. Histologicky byl zachycen papilární karcinom v levém laloku štítné žlázy v terénu chronické lymfocytární tyreoiditidy, avšak bez patrné invaze přes pouzdro štítné žlázy. Kontrolní PET/CT vyšetření z února roku 2012 (obr. 2) bylo negativní, pacientka je v kompletní remisi obou onemocnění.
Obr. 1. PET/CT nález leden roku 2011 v době stanovení diagnózy. Obrázek vztahující se ke kazuistice č. 2. U pacientky je patrná významná kumulace radioaktivní glukózy v tkáních na pravé straně krku svědčící pro vysokou metabolickou aktivitu tkáně. 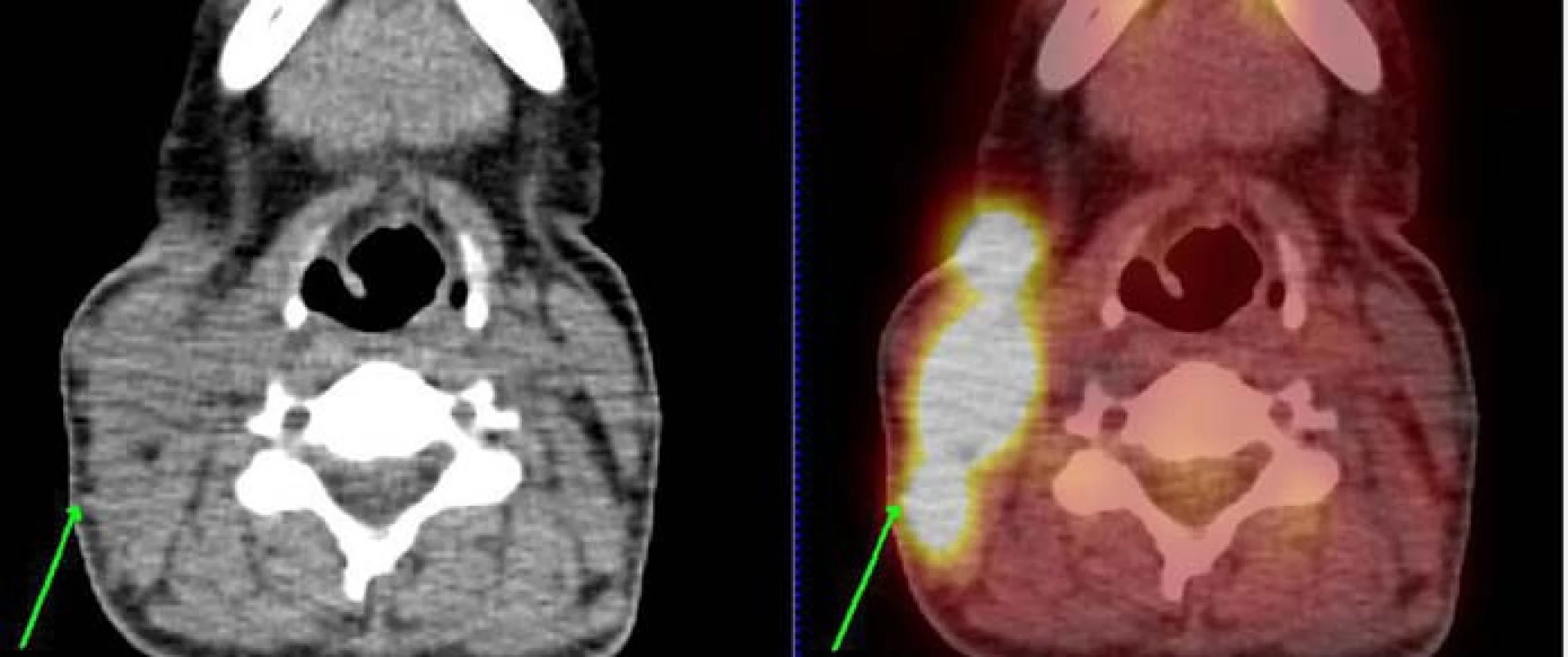
Obr. 2. PET/CT v únoru roku 2012 (4 měsíce po totální tyroidektomii, 6 měsíců po ukončení systémové protinádorové terapie). Obrázek vztahující se ke kazuistice č. 2. V měkkých tkáních již bez průkazu patologického vychytávání radioaktivní glukózy. 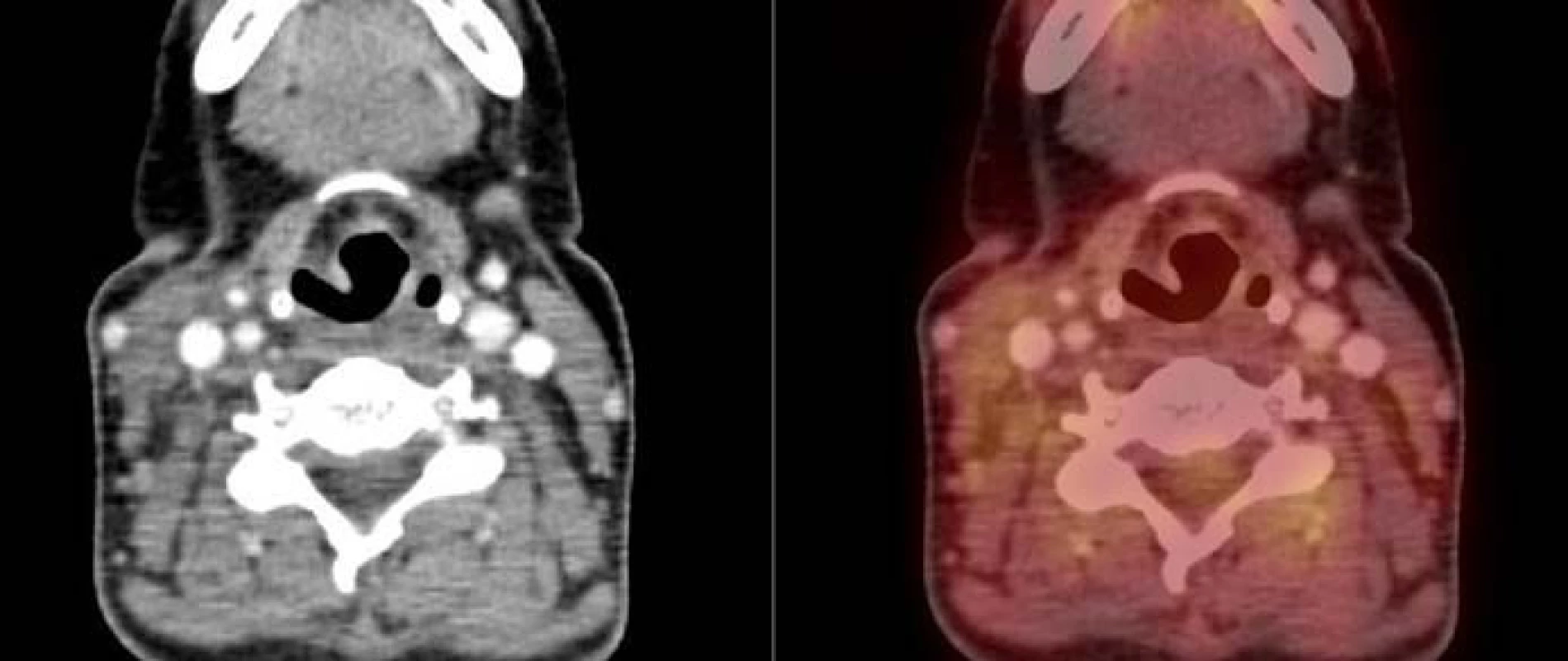
V tomto případě se tedy jednalo o nádorovou duplicitu histiocytárního sarkomu a papilárního karcinomu štítné žlázy.
Kazuistika č. 3
Třetím pacientem, kterému byl diagnostikován HS, byl 56letý muž, narozený v roce 1951. V roce 2007 byl pro anémii a trombocytopenii nejasné etiologie klinickým onkologem indikován k provedení diagnostické splenektomie. Histologicky jsme diagnózu uzavřeli jako histiocytární sarkom. Stagingovým vyšetřením bylo potvrzeno pokročilé onemocnění (postižení jater, sleziny). V kostní dřeni z trepanobiopsie byla patrna normální trilineární hematopoéza, bez postižení maligním onemocněním. Léčbu jsme zahájili chemoterapeutickým režimem CHOP. Podali jsme 2 cykly, následně 4krát CHOEP. Následovala mobilizace periferních kmenových buněk (PKB) kombinací etoposidu, cyklofosfamidu a granulocytárních růstových faktorů a jejich následný sběr. V prosinci roku 2007 byla provedena autologní transplantace periferních kmenových buněk po přípravném režimu HD BEAM. Po ukončení léčby bylo v březnu roku 2008 provedeno kontrolní CT vyšetření a vyšetření kostní dřeně z trepanobiopsie. Kontrolní PET vyšetření bylo provedeno v květnu roku 2008 (obr. 3). Všechna tato vyšetření se zcela negativním nálezem svědčila pro kompletní remisi onemocnění.
Obr. 3. Kontrolní PET vyšetření po léčbě, retroperitoneum, květen roku 2008, nález zcela negativní – kazuistika č. 3. 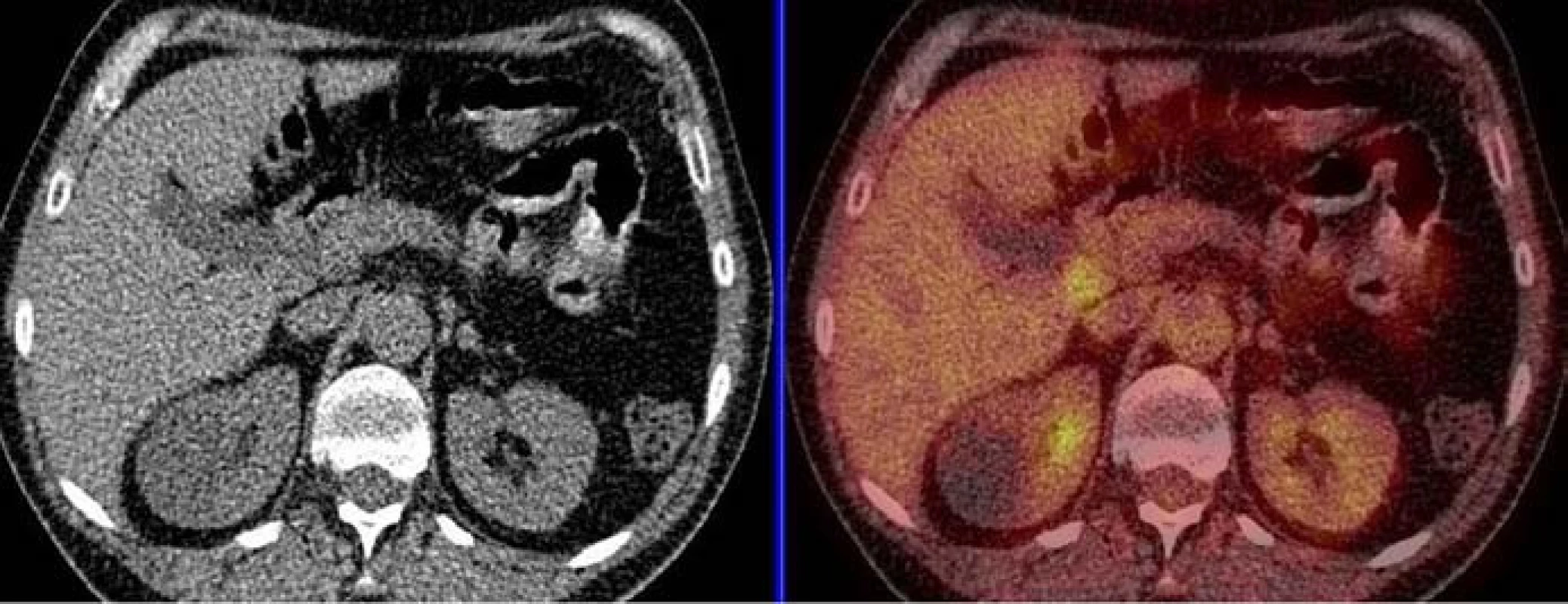
V červenci roku 2008 jsme při plánované kontrole v krevním obraze zachytili leukocytózu a z biochemických parametrů nápadnou elevaci LD. Vyslovili jsme podezření na relaps onemocnění. Abdominální sonografie odhalila mnohočetná ložiska v jaterní tkáni. Kontrastní CT břicha však bylo bez známek recidivy onemocnění. Histologické vyšetření kostní dřeně popisovalo pouze hemofagocytózu, bez známek malignity. PET vyšetřením v srpnu roku 2008 (obr. 4) byla zachycena zvýšená metabolická aktivita v játrech a v lymfatických uzlinách v retroperitoneu. V srpnu roku 2008 byla provedena biopsie jaterní tkáně s histologickým závěrem infiltrace jaterní tkáně atypickými histiocyty, nález koreluje s diagnózou histiocytárního sarkomu (obr. 5–7). Klinické stadium onemocnění v srpnu roku 2008 stanoveno jako II EA.
Obr. 4. Relaps onemocnění – srpen roku 2008, zvýšená metabolická aktivita v játrech a lymfatických uzlinách retroperitonea – kazuistika č. 3. 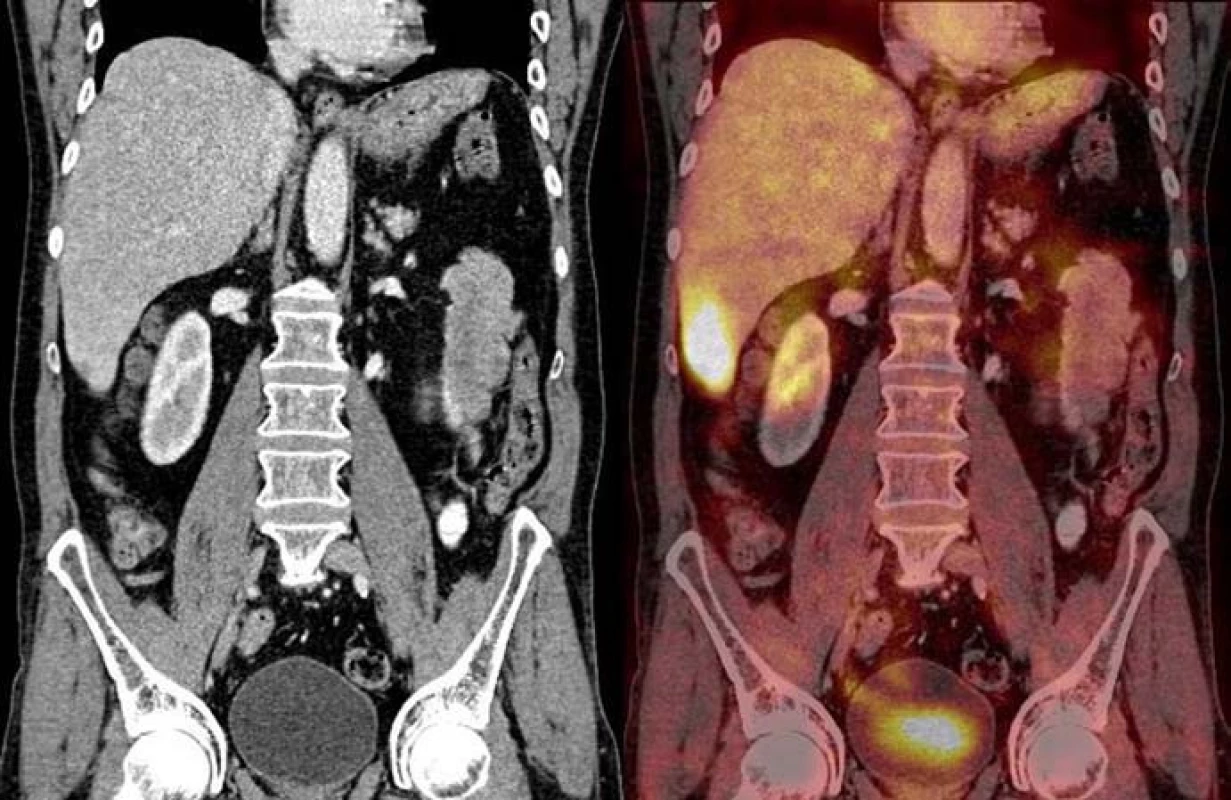
Obr. 5. Histiocytární sarkom sleziny (barvení hematoxylin-eozin). Na snímku je patrné, že struktura sleziny je setřená difúzní nádorovou infiltrací, která ložiskově nekrotizuje (vpravo nahoře). 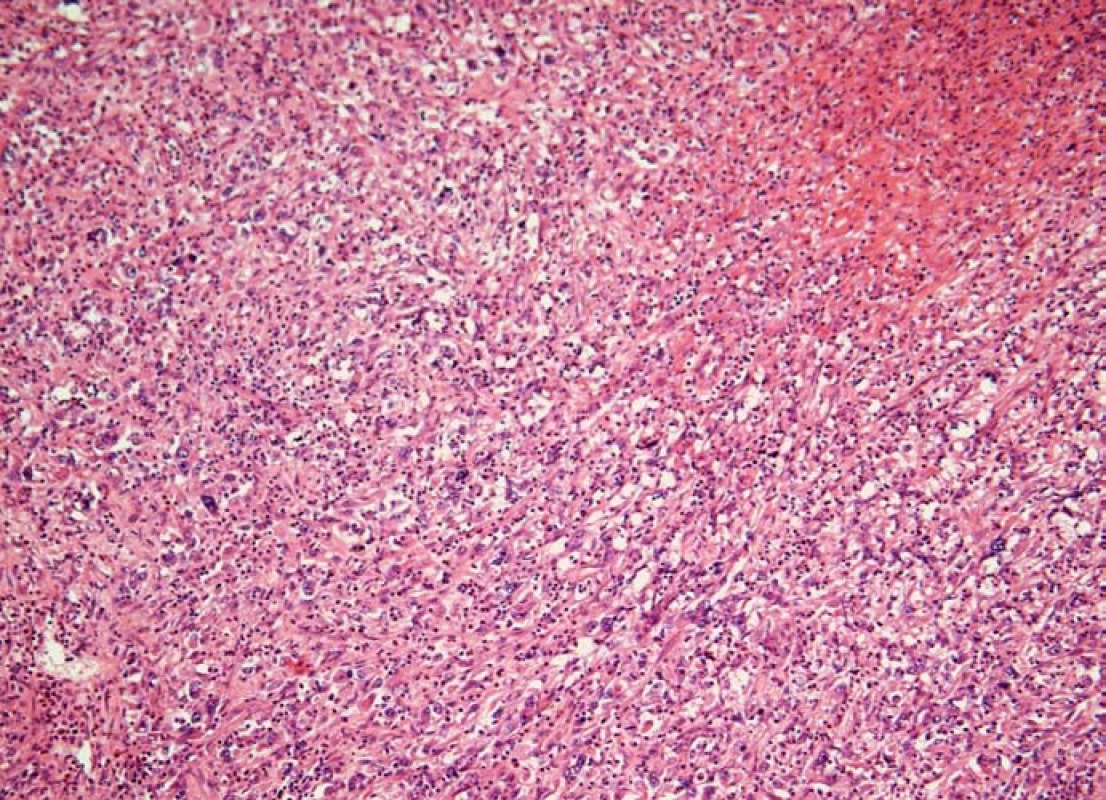
Obr. 6. Histiocytární sarkom sleziny (hematoxylin-eozin). Nádorový infiltrát tvoří polymorfní buňky histiocytárního typu s mitotickou aktivitou. Jádra nádorových buněk jsou vezikulární se zřetelnými nukleoly, cytoplazma je poměrně objemná, eozinofilní. Reaktivní pozadí infiltrátu tvoří malé lymfocyty, nenádorové histiocyty, eozinofily a neutrofily. 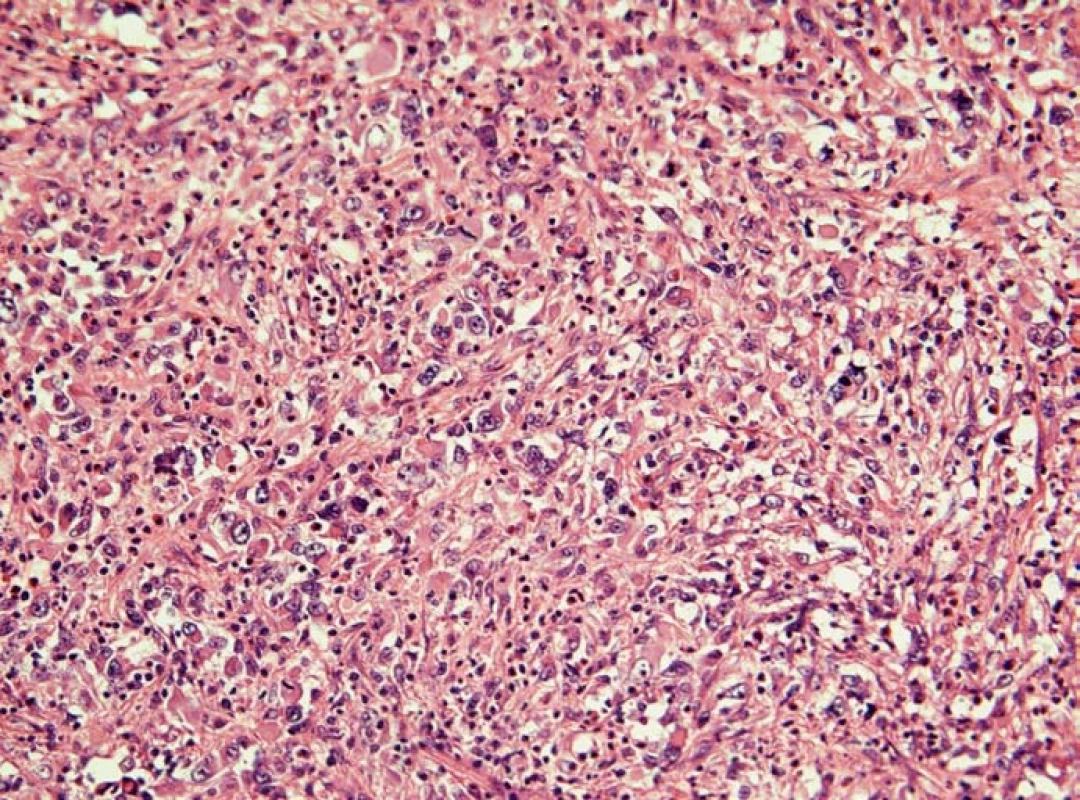
Obr. 7. Histiocytární sarkom sleziny (imuno CD68). Nádorové histiocyty jsou pozitivní v imunohistochemickém průkazu lyzosomálního markeru CD68. 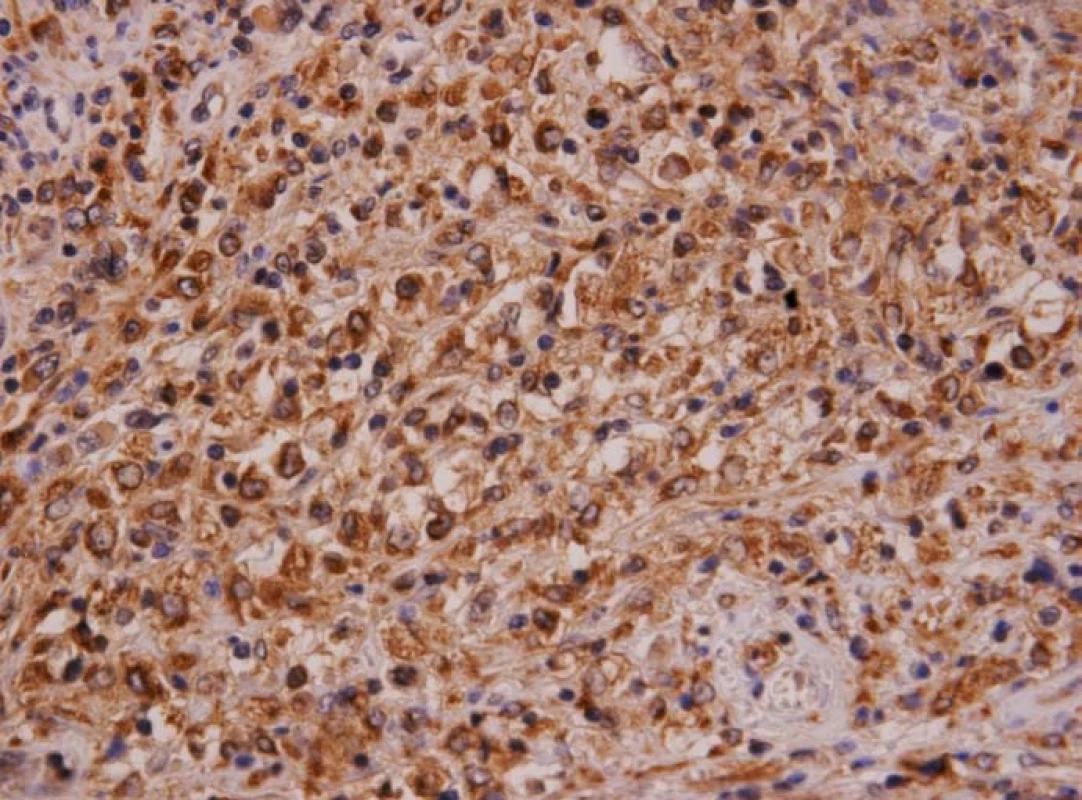
Od 13. 8. 2008 jsme zahájili systémovou chemoterapii záchranným platinovým režimem ESHAP s výhledem alogenní transplantace kostní dřeně. Avšak období dřeňového útlumu po podání 1. cyklu platinového režimu bylo komplikováno rozvojem febrilní neutropenie s nutností hospitalizace. V dalším průběhu došlo i přes léčbu k rychlé progresi onemocnění, kterou jsme potvrdili klinicky a pomocí břišní sonografie, podle které došlo k nárůstu velikosti a počtu ložisek v jaterní tkáni. V krevním obraze dominovala trombocytopenie. Na konci září roku 2008 jsme změnili léčebný přístup na paliativní a zahájili jsme terapii kladribinem. Nadále progredovala anémie, trombocytopenie, přidala se nádorová kachexie. Od října roku 2008 jsme podávali pulzní metylprednisolon, následovala terapie prednisonem v dávce 40 mg/den. Vzhledem k další rychlé progresi onemocnění neodpovídající na léčbu jsme zvolili symptomatický přístup. Pacient umírá na bronchopneumonii a progresi nádorového onemocnění v prosinci roku 2008, tedy 18 měsíců od stanovení diagnózy.
Diskuze
Histiocytární sarkom je velmi vzácné onemocnění. Informace o HS lze získat pouze z popisů případů, nikoliv z klinických studií. Údaje o incidenci HS jsme v literatuře nenašli.
Epidemiologie
Histiocytární sarkom se nejčastěji vyskytuje u dospělých, medián věku 52 let [2–4]. V literatuře jsou popsány ojedinělé případy výskytu HS v dětském věku [5,6–10].
Data o prevalenci onemocnění v souvislosti s věkem, rasou či geografickým rozložením dosud nebyla nikým publikována.
V literatuře jsme se setkali s případy HS asociovaného s dalšími malignitami, jako např. koincidence HS s mediastinálním tumorem ze zárodečných buněk (např. s maligním teratomem) [11], lymfomy s myelodysplazií a leukemií [2–4,12]. V jedné z našich kazuistik (v textu výše) popisujeme koincidenci histiocytárního sarkomu s papilárním karcinomem vycházejícím ze štítné žlázy.
Etiologie
Etiologie histiocytárního sarkomu je nejasná. Jedná se o nádorové onemocnění vycházející z histiocytů a nesoucí jejich histologické, imunohistochemické a molekulární znaky. Znaky typické pro B - a T-lymfocyty chybějí.
Histiocyty a makrofágy jsou odvozeny z monocytů kostní dřeně (KD). Tyto vznikají z kmenové hemopoetické buňky. Monocyty po přestupu z KD cirkulují v periferní krvi a následně migrují přes cévní stěnu do tkání, kde vyzrávají a plní svou úlohu v obraně těla, a to jednak vylučováním pro - a protizánětlivých cytokinů, jednak odstraňováním částic mikroorganizmů a odumřelých tkání [13,14]. Histiocyty jsou tedy necirkulující buňky, někdy označované termínem „tkáňové makrofágy“.
Běžně se vyskytují v orgánech, jako je slezina, lymfatické uzliny, kostní dřeň, ale také v játrech (kde nesou specifické označení Kupfferovy buňky), v plicích (alveolární mikrofágy), v lamina propria střeva a v mozkové tkáni (mikroglie). Společným znakem je exprese povrchového antigenu CD163 a CD68 (antigenní marker lysozomů). Hrají důležitou roli v obranyschopnosti těla proti nitrobuněčným mikroorganizmům a nádorům. Jejich funkce spočívá v rozpoznání a ničení apoptotických buněk [15], odstraňování částic mikroorganizmů a odumřelých tkání a vylučování pro - a protizánětlivých cytokinů [13,14].
Histologický nález
Morfologie
Struktura orgánů postižených histiocytárním sarkomem je kompletně nebo jen parciálně setřená difuzní nádorovou infiltrací tvořenou nekohezivními velkými buňkami (více než 20 µm). V uzlinách, játrech nebo slezině můžeme nalézt také sinusoidální distribuci nádorových buněk. Populace nádorových buněk může být monomorfní nebo častěji pleomorfní. Jednotlivé nádorové buňky mají obvykle velká okrouhlá nebo oválná vezikulární jádra, často excentricky uložená, avšak mohou být přítomny také vřetenobuněčné (sarkomatoidní) úseky. Běžně jsou přítomny také mnohojaderné buňky. Cytoplazma nádorových buněk je obvykle objemná a eozinofilní, někdy jemně vakuolizovaná.
U některých buněk můžeme pozorovat pěnitou cytoplazmu. Občas je patrna cytofagocytóza (např. hemofagocytóza) [17].
Mitotická aktivita je přítomna, počet mitóz je v jednotlivých případech variabilní. Jsou častá ložiska nekrózy nádorového infiltrátu. Nenádorové reaktivní pozadí tvoří malé lymfocyty, plazmatické buňky, benigní histiocyty, eozinofily a neutrofily v různém početním zastoupení.
Občas se nádorové buňky ztrácejí v denzním zánětlivém infiltrátu včetně hojných neutrofilů, takže infiltrát napodobuje zánětlivou lézi. Tento znak je běžný zejména u histiocytárního sarkomu postihujícího centrální nervový systém [16,20,21].
Ultrastrukturálně jsou jádra nádorových buněk nepravidelné kontury, mohou být bizarního tvaru a mají jedno nebo více velkých jadérek. Cytoplazma se vyznačuje přítomností hojných lysozomů a fagozomů. Birbeckova granula, desmozomy nebo buněčná spojení chybějí [20,21].
Lokalizace postižení a klinické příznaky
Histiocytárním sarkomem může být postižen kterýkoliv orgán těla, nejčastěji však lymfatické uzliny, kůže, játra, slezina, kosti a zažívací trakt. V kostech HS vytváří lytická ložiska nebo se může jednat o difuzní postižení kostní dřeně, jehož pozdějším projevem je pancytopenie. Kožní manifestace onemocnění je různorodá – od nespecifické vyrážky přes solitární kožní léze až po nesčetné kožní tumory na trupu a končetinách. V případě střevní lokalizace je často prvním příznakem choroby obstrukční ileus. Přítomna může být též hepatosplenomegalie [2–4].
I u lokalizované formy onemocnění mohou být vyjádřeny systémové příznaky, kterými jsou horečka či váhový úbytek [2,22,23]. Onemocnění bývá často diagnostikováno až v pokročilém klinickém stadiu.
Diagnostika
Diagnózu histiocytárního sarkomu stanovíme na základě korelace histologického obrazu a imunohistochemických metod.
Histochemicky nádorové histiocyty vykazují silnou pozitivitu nespecifické esterázy a část také kyselé fosfatázy. Chloracetátesteráza je negativní, stejně jako myeloperoxidáza, která může být v některých případech sporadicky pozitivní [21].
Imunohistochemicky prokazujeme v nádorových buňkách přítomnost jednoho nebo více histiocytárních markerů, tj. CD163, CD68 a lysozymu. Pozitivita CD68 a lysozymu je granulární cytoplazmatická a paranukleární v oblasti Golgiho zóny, pozitivita CD163 je membránová a cytoplazmatická. Nádorové histiocyty většinou exprimují také CD45, CD45RO a HLA-DR, často je pozitivní i CD4. Specifické B buněčné a T buněčné markery chybějí. Negativní jsou markery Langerhansových buněk (CD1a, langerin), folikulárních dendritických buněk (CD21, CD23, CD35) a myeloidní markery (CD33, CD13, myeloperoxidáza) [18,20,21]. Proliferační aktivita dle Ki67 kolísá v jednotlivých případech v závislosti na mitotické aktivitě v rozmezí 5–50 % (medián 15 %) [21].
Podobný histologický obraz má anaplastický lymfom, avšak na rozdíl od HS vždy exprimuje CD30 znak a je buď ALK pozitivní, nebo negativní [19]. Zřídka může být HS zaměněn s karcinomem či maligním melanonem. Karcinom lze odlišit přítomností keratinů a maligní melanom specifickými znaky melanocytární diferenciace jako S100 protein, ale také HMB-45, transkripční faktor asociovaný s melanocyty a MELAN-A [17].
Při pátrání po etiologii onemocnění se před odběrem bioptického vzorku v závislosti na lokalizaci postižení ze zobrazovacích metod nabízí využití ultrazvukového (USG) vyšetření lymfatických uzlin, břicha, USG s kontrastní látkou SONOVUE, kontrastní CT vyšetření (hlavy, krku, hrudníku, břicha, pánve) a PET (pozitronová emisní tomografie) či kombinace PET/CT. K definitivnímu stanovení diagnózy, jak zmíněno výše, je však třeba histologické vyšetření bioptované tkáně.
V rámci vstupních vyšetření provádíme vyšetření krevního obrazu a sedimentace erytrocytů, koagulačních parametrů protrombinového času, aktivovaného parciálního tromboplastinového času a hladiny fibrinogenu, biochemické vyšetření krve včetně stanovení hodnoty laktátdehydrogenázy a CRP a sérologické vyšetření krve. Pokud není kontraindikace, provedeme v rámci určování stadia onemocnění vyšetření kostní dřeně z trepanobiopsie.
Léčba
Pro léčbu histiocytárního sarkomu neexistují žádná doporučení, která by byla podpořena výsledky klinických studií. V literatuře lze nalézt pouze jednotlivé popisy případů.
Podle našich zkušeností, jak je zřetelné ze 3 výše popsaných případů, se jedná o prognosticky divergentní kategorii. V některých případech stačí k dosažení kompletní remise onemocnění méně agresivní léčba, v jiných případech je nemoc rezistentní na jakékoliv léčebné postupy.
Prognóza
Vzhledem k tomu, že se jedná o vzácné onemocnění, přesné údaje o prognóze v literatuře nenajdeme. Z našich zkušeností víme, že se jedná o agresivní nádorové onemocnění, celková doba přežití se pohybuje v rozmezí od několika měsíců po několik let.
Závěr
Histiocytární sarkom je agresivní nádorové onemocnění s odlišnou prognózou v závislosti na stadiu onemocnění v době stanovení diagnózy. Za zásadní z hlediska léčebného a především prognostického považujeme časné odhalení nemoci a stanovení diagnózy, ideálně v době, kdy se ještě jedná o lokalizované postižení. Naše zkušenost ukazuje, že k diagnostice, sledování léčebné odpovědi a zachycení relapsu onemocnění je přínosné PET/CT vyšetření.
Jak je zřetelné ze 3 výše popsaných případů, k dosažení remise v případě lokalizovaného onemocnění stačí méně agresivní terapeutické přístupy. V případě pokročilé nemoci se často jedná o onemocnění nespolehlivě reagující na léčbu anebo časně relabující či o onemocnění k léčbě zcela rezistentní s velmi špatnou prognózou.
Poděkování
Za důsledné vedení a cenné připomínky při psaní tohoto článku děkuji panu profesoru MUDr. Zdeňku Adamovi, CSc. Za pomoc s grafickou úpravou článku děkuji panu Mgr. Michalu Hodovskému.
Podpořeno MZ ČR – RVO (MOÚ, 00209805) a RVO (FNBr, 65269705).
MUDr. Eva Létalová
www.fnbrno.cz
e-mail: eva_letalova@email.cz
Doručeno do redakce: 26. 1. 2013
Přijato po recenzi: 7. 9. 2013
Zdroje
1. Favara BE, Feller AC, Pauli M et al. Contemporary classification of histiocytic disorders. Tho WHO Committee On Histiocytic/Reticulum Cell Prolifarations. Reclassification Working Group of the Histiocyte Society. Med Pediatr Oncol 1997; 29 : 157–166.
2. Pileri SA, Grogan TM, Harris LN et al. Tumors of histiocytes and accessory dendritic cells. An immunohistochemical approach to classification from the International Lymphoma Study Group based on 61 cases. Histopathology 2002; 41 : 1–29.
3. Hornick JL, Jaffe ES, Fletcher CD. Extranodal histiocytic sarcoma: clinico-pathologic analysis of 14 cases of a rare epithelioid malignancy. Am J Surg Pathol 2004; 28 : 1133–1144.
4. Vos JA, Abbondanzo SL, Barekman CL et al. Histiocytic sarcoma: a study of five cases including the histiocyte marker CD163. Mod Pathol 2005; 18 : 693–704.
5. Wood C, Wood GS, Deneau DG et al. Malignant histiocytosis X. Report of rapidly fatal case in an elderly man. Cancer 1984; 54 : 347–352.
6. Copie-Bergman C, Wotherspoon AC, Norton AJ et al. True histiocytic lymphoma. A morphologic, immunohistochemical and molecular genetic study of 13 cases. Am J Surg Pathol 1998; 22 : 1386–1392.
7. Hanson CA, Jaszcz W, Kersey JH et al. True histiocytic lymphoma: histopathologic, immunophenotypic and genotypic analysis. Br J Haematol 1989; 73 : 187–198.
8. Kamel OW, Gocke CD, Kell DL et al. True histiocytic lymphoma: a study of 12 cases based on current definiton. Leuk Lymphoma 1995; 18: 81–86.
9. Ralfkiaer E, Delsol G, O’Connor NT et al. Malignant lymphomas of true histiocytic origin, a clinical, histological, immunophenotypic and genotypic study. J Pathol 1990; 160 : 9–17.
10. Vos J, Abbondanzo SL, Barekman CL et al. Histiocytic sarcoma: a study of five cases including the histiocyte marker CD163. Mod Pathol 2005; 18 : 693–704.
11. Nichols CR, Roth BJ, Heerema N et al. Hematologic neoplasia associated with primary mediastinal germ-cell tumors. N Engl J Med 1990; 322 : 1425–1429.
12. Feldman AL, Minniti C, Santi M et al. Histiocytic sarcoma after acute lymphoblastic leukaemia: a common clonal origin. Lancet Oncol 2004; 5 : 248–250.
13. Gordon S. The macrophage: past, present and future. Eur J Immunol 2007; 37 (Suppl 1): S9–S17.
14. Gordon S, Tylor PR. Monocyte and macrophage heterogeneity. Nat Rev Immunol 2005; 12 : 953–964.
15. Greer JP. Wintrobe’s clinical hematology. 2nd ed. Philadelphia: Lippincott Williams & Wilkins 2009.
16. Cheuk W, Walford N, Lou J et al. Primary histiocytic lymphoma of the central nervous system: a neoplasm frequently overshadowed by a prominent inflammatory component. Am J Surg Pathol 2001; 25 : 1372–1379.
17. Greer JP. Wintrobe’s clinical hematology. 2nd ed. Philadelphia: Lippincott Williams & Wilkins 2009.
18. Soria C, Orradre JL, Garcia-Almagro D et al. True histiocytic lymphoma (monocytic sarcoma). Am J Dermatol 1992; 14 : 511–517.
19. Wilson MS, Weiss LM, Gatter KC et al. Malignant histiocytosis: a reassessment of cases previously reported in 1975 based upon paraffin section immunophenotyping studies. Cancer 1990; 66 : 530–536.
20. Swerdlow SH, Campo E, Harris NL. Classification of tumours of haematopoietic and lymphoid tissues. Lyon: IARC Press 2008.
21. Medeiros LJ, Miranda RN, Vega F et al. Diagnostic pathology: Lymph nodes and Spleen with Extranodal lympthomas. Philadelphia: Lippincott Williams & Wilkins 2011.
22. Cattoretti G, Villa A, Vezzoni P et al. Malignant histiocytosis. A phenotypic and genotypic investigation. Am J Pathol 1990; 36 : 1009–1019.
23. Wilson MS, Weiss LM, Gatter KC et al. Malignant histiocytosis. A reassessment of cases previously reported in 1975 based on paraffin section immunophenotyping studies. Cancer 1990; 66 : 530–536.
Štítky
Diabetológia Endokrinológia Interné lekárstvo
Článok vyšiel v časopiseVnitřní lékařství
Najčítanejšie tento týždeň
2013 Číslo 12- Parazitičtí červi v terapii Crohnovy choroby a dalších zánětlivých autoimunitních onemocnění
- Rizikové období v léčbě růstovým hormonem: přechod mladých pacientů k lékařům pro dospělé
- Intermitentní hladovění v prevenci a léčbě chorob
- Statinová intolerance
- Monoklonální protilátky v léčbě hyperlipidemií
-
Všetky články tohto čísla
- Indikátory zánětu u pacientů s koronární aterosklerózou – editorial
- Komentář ke studii EDGE – editorial
- Pozice tiotropia v nových léčebných doporučeních pro chronickou obstrukční plicní nemoc – editorial
- Prospektivní, multicentrická, neintervenční studie na zhodnocení současné léčby pacientů s diabetes mellitus 2. typu, nedostatečně kompenzovaných monoterapií metforminem – KOMETA CZ
- Účinnost a bezpečnost vildagliptinu jako léku druhé volby ve srovnání s jinými perorálními antidiabetiky u pacientů s diabetes mellitus 2. typu: české výsledky v rámci celosvětové prospektivní kohortové studie EDGE
- Indikátory zápalu u pacientov s koronárnou aterosklerózou – úloha usCRP v diagnostike a predikcii prognózy ochorenia
- Současný pohled na onemocnění jater u srdečního selhání
- Pozice tiotropia v nových léčebných doporučeních pro chronickou obstrukční plicní nemoc
- Súčasnosť a budúcnosť farmako-artériotromboprofylaxie v klinickej praxi. Odporúčania Angiologickej sekcie Slovenskej lekárskej komory
- Doporučené postupy v léčbě starších pacientů s diabetes mellitus v ČR
- Doporučení KDIGO pro léčbu zvýšeného krevního tlaku u chronického onemocnění ledvin
- Zánětlivá borreliová dilatační kardiomyopatie
- Závažná rizika spojená s užíváním natrium-fosfátových projímadel
- Histiocytární sarkom
- Effects of the angiotensin receptor blocker Valsartan (Valsacor®) on arterial pressure, indices of myocardial diastolic function and global longitudinal strain in patients with uncontrolled arterial hypertension
- Mechanizmus pleiotropního účinku sulodexidu
- Rifaximin v léčbě jaterní encefalopatie
- Vnitřní lékařství
- Archív čísel
- Aktuálne číslo
- Iba online
- Informácie o časopise
Najčítanejšie v tomto čísle- Současný pohled na onemocnění jater u srdečního selhání
- Rifaximin v léčbě jaterní encefalopatie
- Histiocytární sarkom
- Závažná rizika spojená s užíváním natrium-fosfátových projímadel
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



