-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Možnosti diagnostiky heparinem indukované trombocytopenie v České republice
Diagnosis of heparin-induced thrombocytopenia in the Czech Republic
Heparin-induced thrombocytopenia is a prothrombotic adverse effect induced by platelet-activating antibodies against complexes of platelet factor 4 and heparin. Diagnosis rests on a clinical assesment of disease probability and laboratory testing. In this review, I describe some approaches to the evaluation of patients with suspected heparin-induced thrombocytopenia. In conclusion I draw attention to some of the reserves in the diagnostic approaches to this potentially fatal disorder in the Czech Republic.
Key words:
heparin-induced thrombocytopenia – heparin – diagnostic procedure – rapid testing – immunoassay – functional tests
Autoři: J. Gumulec
Působiště autorů: Ústav klinické hematologie FN Ostrava, přednosta prim. MUDr. Jaromír Gumulec
Vyšlo v časopise: Vnitř Lék 2012; 58(7 a 8): 128-134
Kategorie: 60. narozeniny prof. MUDr. Miroslava Penky, CSc.
Souhrn
Heparinem indukovaná trombocytopenie je protrombotický nežádoucí účinek vzniklý aktivací destiček protilátkami proti komplexu destičkový faktor 4 a heparin. Diagnostika spočívá v klinickém hodnocení pravděpodobnosti a v laboratorním vyšetřování. V tomto přehledném článku popisuji některé přístupy k hodnocení pacientů s možnou heparinem indukovanou trombocytopenií. V závěru upozorňuji na některé rezervy v diagnostice tohoto potenciálně fatálního onemocnění v ČR.
Klíčová slova:
heparinem indukovaná trombocytopenie – heparin – diagnostické postupy – rychlé testování – imunologické testy – funkční testyÚvod
Heparinem indukovaná trombocytopenie (HIT) je život ohrožující, protilátkami podmíněný nežádoucí účinek heparinu, který se obvykle objevuje 5.–14. den od zahájení jeho aplikace. Zpravidla bývá navozený protilátkami imunoglobulinové třídy G (IgG) [1,2] namířenými proti komplexu destičkového faktoru 4 (PF4) s nefrakcionovaným heparinem (UFH) nebo nízkomolekulárním heparinem (LMWH) [3]. Výsledkem je aktivace destiček vedoucí ke generaci trombinu s rizikem vzniku trombotických komplikací [1,4]. Včasná diagnóza, přerušení podávání heparinu a zahájení antikoagulace alternativním neheparinovým antitrombotikem je nezbytné pro prevenci dalších komplikací [5,6].
Diagnóza HIT má být postavena na základě hodnocení klinického obrazu a detekce HIT protilátek schopných aktivace destiček [5]. HIT se typicky projevuje poklesem počtu krevních destiček o více než 50 % a často trombózou – nejčastěji žilní (HITT) vzniklou v době rozvíjející se nebo již existující trombocytopenie – zpravidla 5.–14. den léčby UFH nebo LMWH [6–8]. Tíže trombocytopenie koreluje s rizikem trombotických komplikací [8]. Méně častými projevy HIT jsou kožní nekrózy v místě podkožní aplikaci heparinů, anafylaktoidní reakce (horečka, svědění, tachykardie, hypertenze, dušnost, kardiopulmonální zástava) po jejich nitrožilní, bolusové aplikaci a/nebo hemoragická nekróza nadledvin [6].
V případě opakovaného podání heparinů během jediného měsíce (sporadicky až tří měsíců) se může symptomatologie HIT projevit dříve – třeba již 1. den opakované aplikace heparinů [8]. Uběhne-li ale od poslední aplikace některého z heparinů delší období (zpravidla 100 dní, medián 50 dní při stanovení funkčními testy s propranými destičkami, resp. 80 dní při použití komerčních enzyme immunoassay – EIA) HIT protilátky obvykle klesnou na nedekovatelný titr [9]. V těchto situacích po reexpozici heparinu (UFH nebo LMWH) trvá nejméně 5 dní, než začnou B-lymfocyty generovat protilátky nové [10]. Platí tedy, že se nové HIT protilátky po opakované expozici heparinů u těchto pacientů neobjevují ani rychleji ani častěji, protože v případě HIT neexistuje typická anamnestická odpověď proti komplexu PF4/heparin [9–11].
Pravidla diagnostiky HIT
Trombocytopenie je v každodenní klinické praxi velmi častý jev a má mnoho různých příčin. Pro standardizované hodnocení pravděpodobnosti, že aktuální trombocytopenie je projevem HIT nebo HITT, lze v klinické praxi používat 4Ts skórovací systém (tab. 1). Skóre 0–3 body znamená, že pravděpodobnost pozitivity laboratorních testů (resp. HIT) je nízká (0–1,6 %), že další testování není nutné a že heparin může být pacientovi podáván dále [8,12]. Skóre 4–5 bodů představuje střední (8–29 %) a skóre 6–8 bodů vysokou (21–100 %) pravděpodobnost HIT a je důvodem pro další laboratorní testování [13]. Kombinace klinického hodnocení pomocí 4Ts systému a laboratorního testování HIT protilátek umožňuje vůbec nejcitlivější hodnocení pravděpodobnosti, že jde skutečně o HIT [14]. Kromě toho lze používat tzv. HEP (HIT Expert Probability) skórovací systém, který pravděpodobně umožní větší shodu mezi hodnotícími lékaři a lepší korelaci s výsledky laboratorního testování než skórovací systém 4Ts [15].
Tab. 1. 4Ts skórovací systém. 
†Greifswald, Německo (GW): rozvoj ve dnech 5–14 (spíše než 5–10); pokles destiček během 1. dne (při podání heparinu v posledních 100 dnech). ‡GW: vznik po 14 dnech. §Kožní nekróza v místě aplikace heparinu. ¶Progrese představuje objektivně dokumentovaný nárůst velikosti trombu (obvykle prodloužení hluboké trombózy podle ultrazvuku); rekurence představuje nově vzniklý tromboembolus v původně postižené oblasti (obvykle nový defekt perfuze u pacienta s předchozí plicní embolizací). **Dle GW suspektní, neověřená trombóza není v diagnostických kritériích obsažena. ††Označení existence jiné příčiny trombocytopenie jako možné nebo jisté je na rozhodnutí ošetřujícího lékaře. Laboratorní diagnostika HIT spočívá:
- v průkazu protilátek navázaných na komplex PF4/heparin a
- v průkazu na heparinu závislé aktivace krevních destiček pacientovým sérem (obsahujícím HIT protilátky).
Klasické aktivační testy jsou Serotonin Release Assay (SRA) [16–19] a heparinem indukovaná aktivace destiček (HIPA) [20]. Citlivost těchto testů při záchytu klinicky významných protilátek je stejně vysoká (přibližně 99 %) jako citlivost polyspecifických IgG/A/M a IgG specifických EIA [3]. Tyto laboratorní testy proto mají vysokou negativní prediktivní hodnotu a mohou být využívány k vyloučení HIT, je-li jejich výsledek spolehlivě negativní [8]. Diagnostická specificita pro HIT je nejvyšší u funkčních testů používajících proprané destičky (95–99 %), u polyspecifických IgG/A/M EIA kolísá mezi asi 50 a 75 % a u IgG specifických EIA mezi asi 55 a 90 % [21]. Senzitivita rychlých gelových imunologických testů využívajících částice potažené komplexem PF4/heparin (Pa-GIA Diamed®) kolísá mezi zmiňovanými funkčními a imunologickými testy (asi 95–99 %) [14,22]. Kromě vysoké citlivosti je jejich výhodou relativně dobrá dostupnost a možnost mít výsledek během 1 hod [14]. Skutečnost, že tento test zachycuje kromě IgG – imunoglobulinová třída patognomická pro HIT [1,2] i klinicky nevýznamné IgA a IgM, snižuje jeho specificitu [21,23,24]. Konvenční test optické agregace destiček indukované heparinem podezřelým z rozvoje HIT má senzitivitu i specificitu pro detekci HIT protilátek omezenou [5,18,25].
Síla reakce EIA testů přímo koreluje s pravděpodobností HIT, takže platí, že HIT je nejpravděpodobnější, je-li optická denzita (OD) nad 1,0 a nepravděpodobná při OD pod 0,4 [19,22,26–29]. Interpretace výsledku OD v rozmezí 0,4–1,0 je mnohem méně jasná a velmi závislá na výsledku klinického hodnocení. Výskyt falešné pozitivity výsledků EIA je nejvyšší při OD v tomto rozmezí a je navozena nepatognomickými IgM a IgA protilátkami (je-li pro testování použit set na polyspecifické IgG/A/M) nebo IgG protilátkami, které nejsou schopny aktivovat destičky [23]. S výhodou lze v této situaci využít konfirmační procedury u komerčně dostupných anti-PF4/heparin EIA (GTI PF4 Enhanced®) přidáním nadbytku heparinu (100 j./ml), který vede k inhibici tvorby komplexů protilátka-PF4/heparin, a tím zvyšuje specificitu testu. Výsledek EIA je považován za pozitivní, je-li OD bez nadbytku heparinu > 0,4 a inhibice heparinem je > 50 % [29,30].
V současnosti pravděpodobně nejcitlivějším a nejspecifičtějším diagnostickým postupem je algoritmus navržený Greinacherem (obr. 1) [8].
Obr. 1. Diagnostický algoritmus stanovení pravděpodobnosti HIT s využitím klinického hodnocení, IgG EIA a senzitivních funkčních testů. 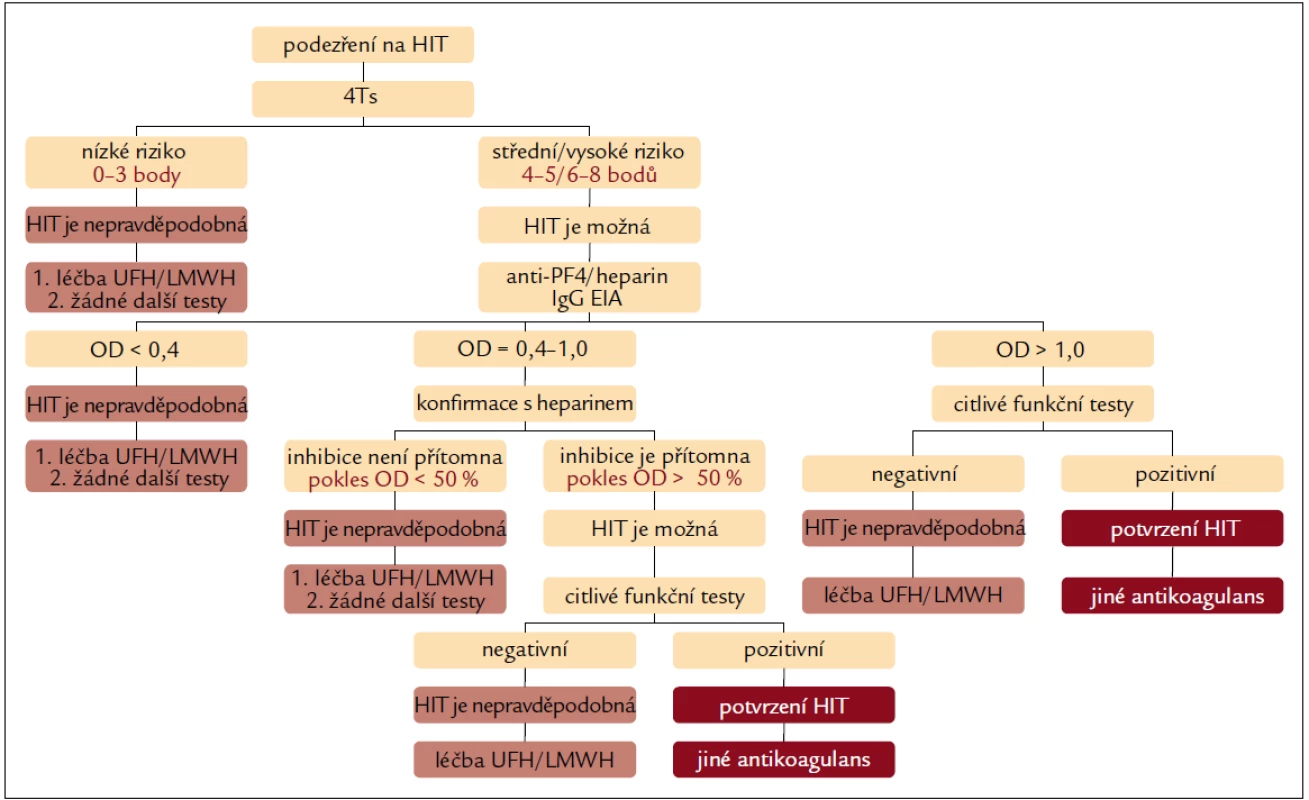
Podle tohoto algoritmu není nutné další laboratorní testy provádět u pacientů s nízkou pravděpodobností HIT (4Ts = 0–3, pravděpodobnost HIT 0–1,6 %). U pacientů se střední/vysokou pravděpodobností HIT (4Ts = 4–5/6–8) je HIT možná a je na místě doplnit senzitivní, IgG specifické EIA testy. Je-li EIA negativní (OD < 0,4), HIT je velmi nepravděpodobná a UFH/LMWH může být nadále podáván [8,19,26,27]. Je-li EIA slabě pozitivní (OD = 0,4–1,0), přítomné protilátky nejsou s nejvyšší pravděpodobností schopné aktivovat destičky. V této situaci je indikován konfirmační krok s přidáním heparinu. Není-li reaktivita protilátek přidaným heparinem inhibována (pokles iniciální hodnoty OD je < 50 %), HIT je velmi nepravděpodobná a léčba UFH nebo LMWH může probíhat dále. Je-li pokles OD ≥ 50 %, je indikováno provedení citlivých funkčních testů (SRA nebo HIPA). Je-li hodnota OD > > 1,0, jde velmi pravděpodobně o protilátky schopné aktivovat destičky. To je ale třeba potvrdit doplněním citlivých funkčních testů (SRA nebo HIPA). Pozitivní výsledek funkčních testů HIT definitivně potvrdí a v léčbě jsou indikována alternativní antikoagulancia, je-li výsledek negativní, je možné vrátit se k terapii UFH nebo LMWH. Opakované klinické hodnocení má podpořit konečné potvrzení, nebo vyloučení diagnózy HIT. Protože EIA bývá pozitivní 5.–10. den léčby heparinem (tj. v době, kdy destičky začínají klesat) je nekoncepční automaticky opakovat testování pacientů s negativní vstupní EIA [9,11,31–33].
Diagnostický algoritmus dle Pouplarda et al má ve srovnání s uvedeným postupem výhodu lepší dostupnosti a rychlosti provedení s využitím skórovacího systému 4Ts a rychlého screeningového testování gelovou imunologickou metodou H/PF4 PaGIA Diamed® (obr. 2) [14].
Obr. 2. Diagnostický algoritmus stanovení pravděpodobnosti HIT s využitím klinického hodnocení 4Ts a rychlého laboratorního testu H/PF4 PaGIA Diamed<sup>®</sup>. 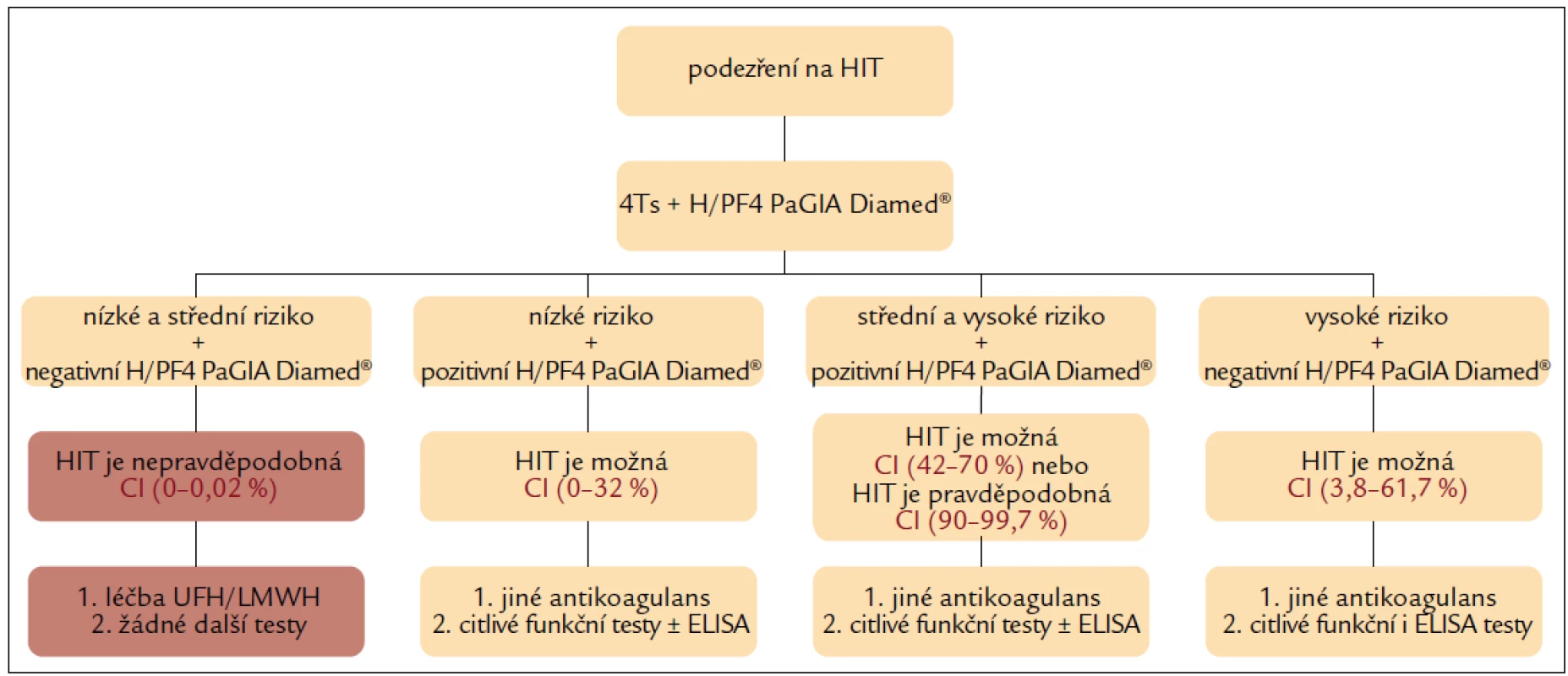
Na rozdíl od předchozího přístupu je v Pouplardově algoritmu zařazeno screeningové laboratorní testování (s využitím gelového testu) i ve skupině pacientů s nízkou pravděpodobností HIT dle 4Ts (přestože negativní prediktivní hodnota 4Ts byla u této skupiny pacientů 100 %). Podle tohoto doporučení není nutné další laboratorní testy provádět u pacientů s nízkou (4Ts = 0–3) ani střední (4Ts = 4–5) pravděpodobností HIT, pokud je výsledek H/PF4 PaGIA Diamed® negativní. Negativní prediktivní hodnota gelového testu je v obou těchto skupinách pacientů 100 %. HIT je tedy nepravděpodobná a heparin může být podáván dále. Pozitivní výsledek gelového testu ve všech třech skupinách znamená, že HIT je možná nebo pravděpodobná a definitivní potvrzení, nebo vyloučení umožní jedině citlivé funkční, event. i imunologické testy. Je-li výsledek H/PF4 PaGIA Diamed® negativní u pacientů s vysokým rizikem HIT (4Ts = 6–8), diagnóza HIT je stále pravděpodobná (asi 16 %), protože interval spolehlivosti je velmi široký – CI 95 % (3,8–61,7 %). Pro potvrzení HIT je nutné u těchto nemocných doplnit citlivější a specifičtější funkční a imunologické testy [14].
Návrh diagnostického algoritmu pro situace s omezenou dostupností specifických imunologických a/nebo funkčních testů
Kombinace obou přístupů může:
- zlepšit dostupnost standardizovaného diagnostického algoritmu v každodenní klinické praxi,
- snížit závislost na hůře dostupných specifických imunologických a funkčních testech,
- zkrátit dobu od vzniku podezření na HIT do doby jejího vyloučení,
- omezit počet případů, kdy je nutno podávat alternativní antikoagulans, event. zkrátit dobu jeho přechodného podávání do doby definitivního vyloučení HIT a
- snížit náklady (obr. 3 a 4).
Obr. 3. Diagnostický algoritmus kombinující oba přístupy – část A. screening. 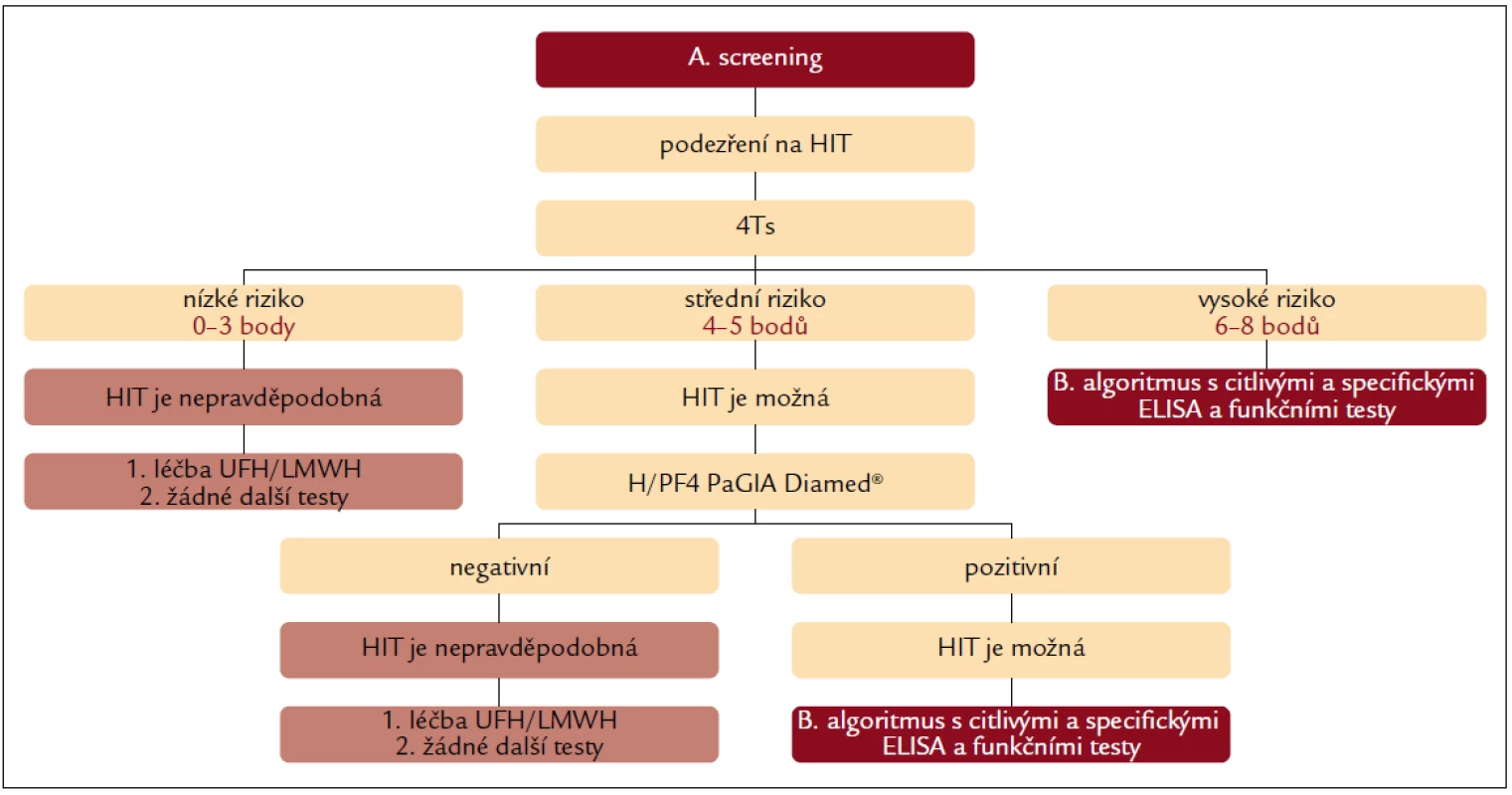
Obr. 4. Diagnostický algoritmus kombinující oba přístupy – část B, s vysoce citlivými a specifickými imunologickými a funkčními testy. 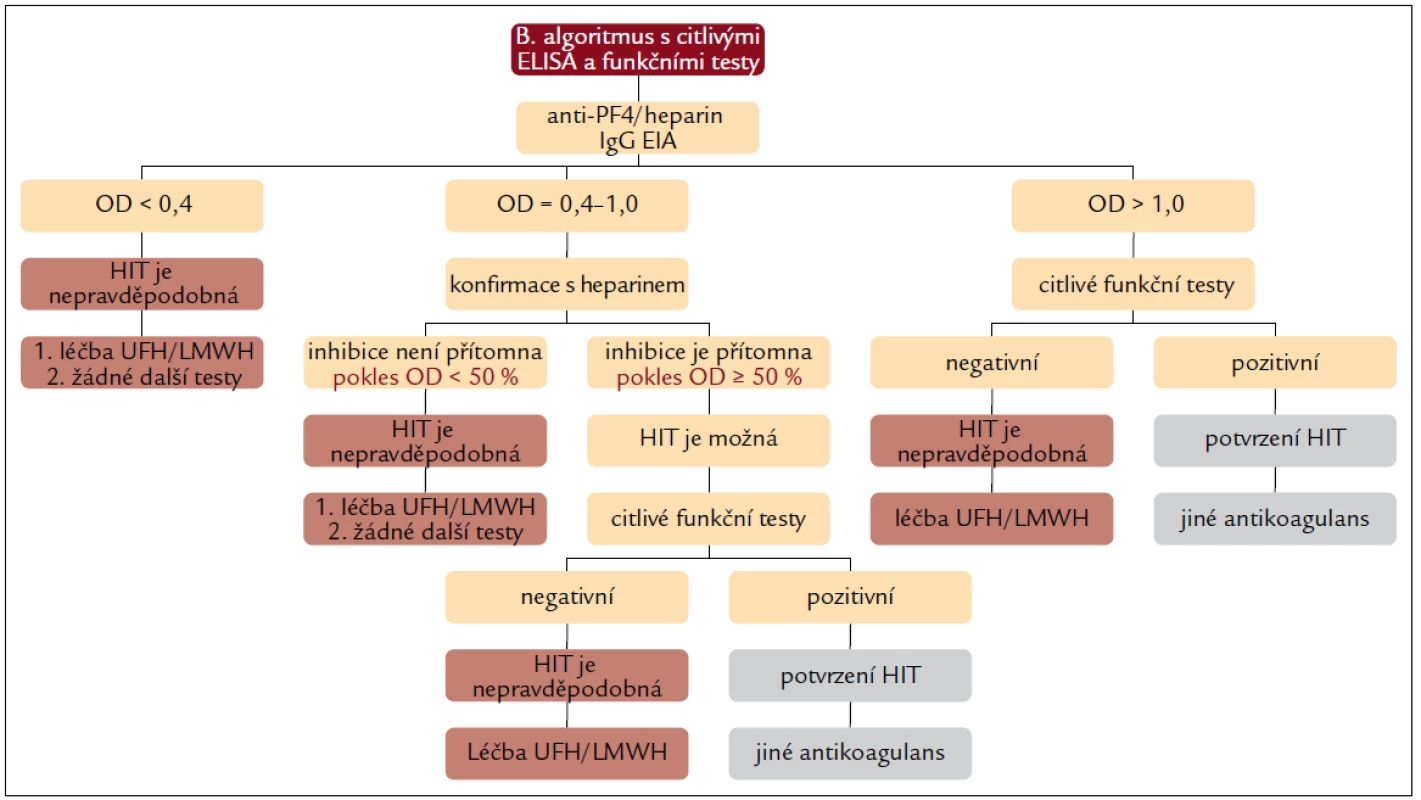
Prvním krokem je klinické hodnocení dle 4Ts. Pacienti s nízkou pravděpodobností (0–3 body) HIT nemusí být dále testováni žádným z testů, protože negativní prediktivní hodnota 4Ts je v této skupině pacientů velmi vysoká (asi 100 %) [12,14]. Podle různých zdrojů jde průměrně o 35 % pacientů s podezřením na HIT (záleží na zkušenostech s používáním skórovacího systému 4Ts, počet pacientů v této rizikové skupině kolísá mezi 23 a 64 %). Riziko HIT je v této skupině nízké (nejvýše 1,6 %), a proto je možné pokračovat v antikoagulační léčbě UFH nebo LMWH (pro srovnání riziko krvácivých komplikací alternativní antikoagulace 10–20 %) [12,14].
U pacientů se střední pravděpodobností HIT (4–5 bodů, cekem asi 54 % pacientů s podezřením na HIT, kolísá mezi 28 a 60 %) [12,14] je HIT možná a přínosné je provedení dobře dostupného a rychlého laboratorního testování s využitím H/PF4 PaGIA Diamed® [14]. Negativní výsledek testu snižuje pravděpodobnost HIT z 10,9 na 0,6 %, HIT je tedy v případě negativního testu nepravděpodobná a v terapii UFH nebo LMWH lze pokračovat bez dalšího laboratorního testování [14]. Pozitivní výsledek gelového testu zvyšuje pravděpodobnost HIT z 1,9 na 58,2 % [14] a pro potvrzení, nebo vyloučení HIT je nutné provedení vysoce senzitivních a specifických imunologických a funkčních testů (obr. 4). Rozhodnutí o tom, lze-li po stanovení střední pravděpodobnosti HIT dle 4Ts léčbu UFH nebo LMWH pouze pozastavit nebo je nutné ji přerušit a nahradit alternativním antikoagulans, závisí:
- na konkrétní klinické situaci,
- na dostupnosti výsledku screeningového testu (H/PF4 PaGIA Diamed®) a
- v případě pozitivního výsledku screeningového testu na dostupnosti výsledků specifických imunologických a funkčních testů.
U pacientů s vysokou pravděpodobností HIT dle klinického hodnocení (6–8 bodů, celkem asi 11 % pacientů s podezřením na HIT, kolísá mezi 5 a 18 %) [12,14] nepřináší provádění screeningového gelového testu žádnou výhodu, protože i při negativním výsledku je pravděpodobnost HIT významná – 16 %, CI 95 % (3,8–61,7 %) [14]. Pro vyloučení, nebo potvrzení HIT je tedy vždy nutné provést specifické imunologické a funkční testy. Vzhledem k míře rizika a omezené dostupnosti výsledků zmiňovaných imunologických a funkčních testů bude až na naprosté výjimky nutné přerušit léčbu UFH nebo LMWH a nahradit ji léčbou alternativním antikoagulans.
Část B diagnostického algoritmu kopíruje doporučení Greinachera [8] (podrobný komentář viz výše) s tím rozdílem, že „šetří“ indikaci hůře dostupných specifických anti-PF4/heparin EIA IgG a funkčních testů SRA nebo HIPA ve skupině pacientů ve středním riziku HIT s negativním výsledkem screeningového gelového testu (asi 81 % pacientů středního rizika) [14].
Nové testy pro diagnostiku HIT dostupné v ČR
Stic Expert® HIT (Stago) je rychlý imunologický test určený pro kvalitativní detekci protilátek třídy IgG proti komplexům PF4/polyanion v lidském séru. Ve spojení s klinickým hodnocením pravděpodobnosti pomocí 4Ts je negativní prediktivní hodnota 100 % a díky specifickému záchytu pouze IgG protilátek (bez IgA, resp. IgM) je specificita testu 93 %. Výsledek může být dostupný za méně než 12 min [34]. Ve srovnání s rychlým gelovým testem H/PF4 PaGIA Diamed® má výhodu větší specificity (zachycuje pouze IgG protilátky) a použití není limitováno na uživatele systému gelové centrifugace pro screening nepravidelných erytrocytárních protilátek. Vysoká specificita a dobrá dostupnost testu může přispět ke snížení počtu falešně pozitivních výsledků a zbytečnému převádění pacientů z UFH/LMWH na alternativní antikoagulant [35].
Asserachrom® HPIA – IgG (Stago) je imunologický test (ELISA) detekující protilátky třídy IgG proti komplexu PF4/heparin na povrchu mikrotitračních destiček. Podle výrobce je senzitivita testu 100 %, negativní prediktivní hodnota 100 % a specificita 92,7 %. Z příbalového letáku ani z dostupné literatury není jasné, je-li u tohoto testu možný, event. v klinické studii nebo klinické praxi vyzkoušený konfirmační krok s inhibicí vazby protilátek na komplex PF4/heparin za přítomnosti nadbytku heparinu.
Zimutest HIA MonoStrip IgG (Diagnostica) je imunologický test (ELISA) určený pro stanovení heparin dependentních protilátek třídy IgG v lidské plazmě. Pokud je požadováno, mohou být pozitivní vzorky konfirmovány inhibováním vazby protilátek PF4/heparin za přítomnosti heparinu. Vazba heparin dependentních protilátek na destičku je v prostředí s nadbytkem heparinu inhibována (pokles OD ≥ 50 %) ve většině případů. Podle přímého srovnání testu s IgG anti-PF4/heparin EIA (GTI PF4 Enhanced®) je negativní prediktivní hodnota obou testů 100 %, implementace konfirmačního kroku s nadbytkem heparinu zvyšuje pozitivní prediktivní hodnotu obou testů, vede však ke snížení negativní prediktivní hodnoty testu HIA MonoStrip IgG [36]. Specificita testu je 90 % [37].
Heparinem indukovaná agregace destiček – impendanční vyšetření vzorku plné krve na přístroji Multiplate je funkční test, modifikace známého testu optické agregometrie. Z dostupné literatury vyplývá srovnatelná senzitivita a specificita se SRA [38,39], výsledky je však třeba ověřit dalšími studiemi.
Rezervy v diagnostice HIT v ČR
Podle vlastních zkušeností z pracovišť, na kterých jsem působil, vidím následující rezervy v diagnostice heparinem indukované trombocytopenie v ČR:
- Nejspíše kvůli stále přetrvávajícímu rezervovanému přístupu k nejrůznějším skórovacím schématům není v klinické praxi rutinně využíván žádný standardizovaný systém klinického hodnocení (ani 4Ts, ani HEP skóre). S tím souvisí limity ve standardizaci indikace laboratorního testování.
- Z rychlých imunologických testů byl podle mých informací v klinické praxi dostupný jen H/PF4 PaGIA Diamed®, a to jen na několika málo pracovištích využívajících systém gelové centrifugace v imunohematologii.
- Vysoce citlivé a monospecifické IgG ELISA testy byly donedávna omezeně dostupné a teprve nyní se nabídka zvětšuje. Konfirmační krok s nadbytkem heparinu neprovádí podle mých informací rutinně žádné pracoviště v ČR.
- Z funkčních testů je nejlépe dostupný test heparinem indukované agregace destiček s využitím optické agregometrie, jen na některých pracovištích jsou při diagnostice využívány citlivé destičky od vybraného dárce. Teprve nyní s rozšiřující se dostupností přístroje Multiplate se začíná používat impendanční agregometrie.
- Vysoce senzitivní funkční testy typu SRA a HIPA jsou dle mých informací v ČR velmi špatně dostupné, a proto většinou pracovišť nevyužívané.
- V ČR neexistuje doporučený postup diagnostiky (a terapie) HIT.
- V ČR neexistuje ani referenční laboratoř pro HIT ani systém externí kontroly kvality, resp. systém mezilaboratorního srovnávání.
- V ČR neexistuje registr pacientů s HIT.
Závěr
Heparinem indukovaná trombocytopenie je život ohrožující imunologický nežádoucí účinek terapie hepariny. Pro diagnostiku je třeba zhodnotit klinickou pravděpodobnost HIT, podle které lze stanovit strategii laboratorní diagnostiky (imunologické a funkční testy). Přestože jde o závažnou nežádoucí reakci velmi často podávaného léku, existuje v klinické praxi v ČR podle mého názoru příliš mnoho rezerv v její diagnostice. Tato skutečnost je daná řadou objektivních důvodů. Lze předpokládat, že nové a lépe dostupné diagnostické možnosti přispějí k odstranění některých z těchto limitů. S ohledem na nízký výskyt HIT však nelze očekávat významné zlepšení péče o pacienty s HIT bez vytvoření sítě kooperujících pracovišť soustředěných kolem referenčního centra. Vytvoření databáze pacientů a banky vzorků séra a/nebo plazmy by pak umožnilo další vývoj v této oblasti (systém mezilaboratorního srovnávání, testování nových diagnostických/terapeutických postupů, vědecké aktivity apod.).
prim. MUDr. Jaromír Gumulec
www.fno.cz
e-mail: jaromir.gumulec@fno.cz
Doručeno do redakce: 21. 5. 2012
Zdroje
1. Kelton JG, Sheridan D, Santos A et al. Heparin-induced thrombocytopenia: laboratory studies. Blood 1988; 72 : 925–930.
2. Lindhoff-Last E, Nakov R, Misselwitz F et al. Incidence and clinical relevance of heparin-induced antibodies in patients with deep vein thrombosis treated with unfractionated or low-molecular-weight heparin. Br J Haematol 2002; 118 : 1137–1142.
3. Greinacher A, Juhl D, Strobel U et al. Heparin-induced thrombocytopenia: a prospective study on the incidence, platelet-activating capacity and clinical significance of antiplatelet factor 4/heparin antibodies of the IgG, IgM, and IgA classes. J Thromb Haemost 2007; 5 : 1666–1673.
4. Chong BH, Murray B, Berndt MC et al. Plasma P-selectin is increased in thrombotic consumptive platelet disorders. Blood 1994; 83 : 1535–1541.
5. Warkentin TE, Chong BH, Greinacher A. Heparin-induced thrombocytopenia: towards consensus. Thromb Haemost 1998; 79 : 1–7.
6. Warkentin TE, Greinacher A, Koster A et al. American College of Chest Physicians. Treatment and prevention of heparin-induced thrombocytopenia: American College of Chest Physicians Evidence-Based Clinical Practice Guidelines (8th ed.). Chest 2008; 133 (6 Suppl): 340S–380S.
7. Arepally GM, Ortel TL. Clinical practice. Heparin-induced thrombocytopenia. N Engl J Med 2006; 355 : 809–817.
8. Greinacher A. Heparin-induced thrombocytopenia. J Thromb Haemost 2009; 7 (Suppl 1): 9–12.
9. Warkentin TE, Kelton JG. Temporal aspects of heparin-induced thrombocytopenia. N Engl J Med 2001; 344 : 1286–1292.
10. Greinacher A, Kohlmann T, Strobel U et al. The temporal profile of the anti-PF4/heparin immune response. Blood 2009; 113 : 4970–4976.
11. Lubenow N, Kempf R, Eichner A et al. Heparin-induced thrombocytopenia: temporal pattern of thrombocytopenia in relation to initial use or reexposure to heparin. Chest 2002; 122 : 37–42.
12. Lo G K, Juhl D, Warkentin TE et al. Evaluation of pretest clinical score (4 T‘s) for the diagnosis of heparin-induced thrombocytopenia in two clinical settings. J Thromb Haemost 2006; 4 : 759–765.
13. Warkentin TE. Heparin-induced thrombocytopenia: pathogenesis and management. Br J Haematol 2003; 121 : 535–555.
14. Pouplard C, Gueret P, Fouassier M et al. Prospective evaluation of the ‚4Ts‘ score and particle gel immunoassay specific to heparin/PF4 for the diagnosis of heparin-induced thrombocytopenia. J Thromb Haemost 2007; 5 : 1373–1379.
15. Cuker A, Arepally G, Crowther MA et al. The HIT Expert Probability (HEP) Score: a novel pre-test probability model for heparin-induced thrombocytopenia based on broad expert opinion. J Thromb Haemost 2010; 8 : 2642–2650.
16. Sheridan D, Carter C, Kelton JG. A diagnostic test for heparin-induced thrombocytopenia. Blood 1986; 67 : 27–30.
17. Pouplard C, Amiral J, Borg JY et al. Differences in specificity of heparin-dependent antibodies developed in heparin-induced thrombocytopenia and consequences on cross-reactivity with danaparoid sodium. Br J Haematol 1997; 99 : 273–280.
18. Pouplard C, Amiral J, Borg JY et al. Decision analysis for use of platelet aggregation test, carbon 14-serotonin release assay, and heparin-platelet factor 4 enzyme-linked immunosorbent assay for diagnosis of heparin-induced thrombocytopenia. Am J Clin Pathol 1999; 111 : 700–706.
19. Schenk S, El-Banayosy A, Morshuis M et al. IgG classification of anti-PF4/heparin antibodies to identify patients with heparin-induced thrombocytopenia during mechanical circulatory support. J Thromb Haemost 2007; 5 : 235–241.
20. Greinacher A, Michels I, Kiefel V et al. A rapid and sensitive test for diagnosing heparin-associated thrombocytopenia. Thromb Haemost 1991; 66 : 734–736.
21. Warkentin TE, Sheppard JA, Moore JC et al. Laboratory testing for the antibodies that cause heparin-induced thrombocytopenia: how much class do we need? J Lab Clin Med 2005; 146 : 341–346.
22. Alberio L, Kimmerle S, Baumann A et al. Rapid determination of anti-heparin/platelet factor 4 antibody titers in the diagnosis of heparin-induced thrombocytopenia. Am J Med 2003; 114 : 528–536.
23. Juhl D, Eichler P, Lubenow N et al. Incidence and clinical significance of anti-PF4/heparin antibodies of the IgG, IgM, and IgA class in 755 consecutive patient samples referred for diagnostic testing for heparin-induced thrombocytopenia. Eur J Haematol 2006; 76 : 420–426.
24. Warkentin TE. New approaches to the diagnosis of heparin-induced thrombocytopenia. Chest 2005; 127 (2 Suppl): 35S–45S.
25. Warkentin TE. Platelet count monitoring and laboratory testing for heparin-induced thrombocytopenia. Arch Pathol Lab Med 2002; 126 : 1415–1423.
26. Shaheed G, Malkovska V, Mendoza J et al. PF4 ENHANCED assay for the diagnosis of heparin-induced thrombocytopenia in complex medical and surgical patients. Crit Care Med 2007; 35 : 1691–1695.
27. Zwicker JI, Uhl L, Huang WY et al. Thrombosis and ELISA optical density values in hospitalized patients with heparin-induced thrombocytopenia. J Thromb Haemost 2004; 2 : 2133–2137.
28. Warkentin TE, Sheppard JI, Moore JC et al. Quantitative interpretation of optical density measurements using PF4-dependent enzyme-immunoassays. J Thromb Haemost 2008; 6 : 1304–1312.
29. Whitlatch NL, Perry SL, Ortel TL. Anti-heparin/platelet factor 4 antibody optical density values and the confirmatory procedure in the diagnosis of heparin-induced thrombocytopenia. Thromb Haemost 2008; 100 : 678–684.
30. Warkentin TE, Sheppard JI. No significant improvement in diagnostic specificity of an anti-PF4/polyanion immunoassay with use of high heparin confirmatory procedure. J Thromb Haemost 2006; 4 : 281–282.
31. Warkentin TE, Levine MN, Hirsh J et al. Heparin-induced thrombocytopenia in patients treated with low-molecular-weight heparin or unfractionated heparin. N Engl J Med 1995; 332 : 1330–1335.
32. Warkentin TE, Sheppard JA, Moore JC et al. Studies of the immune response in heparin-induced thrombocytopenia. Blood 2009; 113 : 4963–4969.
33. Warkentin TE, Roberts RS, Hirsh J et al. An improved definition of immune heparin-induced thrombocytopenia in postoperative orthopedic patients. Arch Intern Med 2003; 163 : 2518–2524.
34. Sachs UJ, von Hesberg J, Santoso S et al. Evaluation of a new nanoparticle-based lateral-flow immunoassay for the exclusion of heparin-induced thrombocytopenia (HIT). Thromb Haemost 2011; 106 : 1197–1202.
35. Cuker A. Heparin-induced thrombocytopenia (HIT) in 2011: an epidemic of overdiagnosis. Thromb Haemost 2011; 106 : 993–994.
36. Bakchoul T, Giptner A, Bein G et al. Performance characteristics of two commercially available IgG-specific immunoassays in the assessment of heparin-induced thrombocytopenia (HIT). Thromb Res 2011; 127 : 345–348.
37. Pouplard C, Leroux D, Regina S et al. Effectiveness of a new immunoassay for the diagnosis of heparin-induced thrombocytopenia and improved specificity when detecting IgG antibodies. Thromb Haemost 2010; 103 : 145–150.
38. Morel-Kopp MC, Aboud M, Tan CW et al. Whole blood impedance aggregometry detects heparin-induced thrombocytopenia antibodies. Thromb Res 2010; 125: e234–e239.
39. Morel-Kopp MC, Tan CW, Brighton TA et al. ASTH Clinical Trials Group. Validation of whole blood impedance aggregometry as a new diagnostic tool for HIT: results of a large Australian study. Thromb Haemost 2012; 107 : 575–583.
Štítky
Diabetológia Endokrinológia Interné lekárstvo
Článok vyšiel v časopiseVnitřní lékařství
Najčítanejšie tento týždeň
2012 Číslo 7 a 8- Parazitičtí červi v terapii Crohnovy choroby a dalších zánětlivých autoimunitních onemocnění
- Intermitentní hladovění v prevenci a léčbě chorob
- Rizikové období v léčbě růstovým hormonem: přechod mladých pacientů k lékařům pro dospělé
- Statinová intolerance
- Monoklonální protilátky v léčbě hyperlipidemií
-
Všetky články tohto čísla
- Jubilant prof. Miroslav Penka, CSc.
- Profesor Miroslav Penka – jeden z běžců Maratónu pro hemofilii
- CZEMP – děcko prof. Penky
- Profylaxe a léčba antifosfolipidového syndromu – současné možnosti, úskalí a perspektivy do budoucna
- Změny kalcium-fosfátového metabolizmu při chronických nefropatiích
- Terapeutický přístup ke krvácení v souvislosti se „starými“ a „novými“ antikoagulans
- Možnosti diagnostiky heparinem indukované trombocytopenie v České republice
- Pokrok v oblasti mnohočetného myelomu a vývoj souvisejícího laboratorního zázemí
- Jak v ambulantní péči neprošvihnout rozvíjející se kritické poruchy hemostázy
- Frekvence nových trombofilních mutací antitrombinu (SERPINC1) (IVS +141G>A), glykoproteinu GPVI (Ser219Pro) a cytochromu CYP4V2 (Lys259Gln) u zdravých osob středního věku v oblasti středních Čech
- Megakaryopoéza a geneze destiček
- Získaná hemofilie A
- Současné možnosti diagnostiky a léčby myelomové kostní nemoci v klinické praxi
- Vysokodávková léčba a přípravné režimy před transplantací krvetvorných buněk
- Refeeding syndrom u mladého pacienta s anxiózně-depresivní poruchou
- K životnímu jubileu prof. MUDr. Miroslava Součka, CSc.
- Detekce KRAS a jeho mutace v biopsii pokročilého kolorektálního karcinomu při koloskopii
- Syndróm nepokojných nôh u dialyzovaných pacientov
- Tuhosť aorty zvyšuje centrálny aortový tlak u pacientov s hypertenziou
- Jak definovat osoby s vysokým rizikem pankreatického karcinomu
- Veľkosť LDL lipoproteínových partikúl u pacientov s náhlou mozgovocievnou príhodou
- Trojkombinační léčba chronické hepatitidy C
- Chronický zánět a metabolický syndrom
- Požadavky na předoperační vyšetření z pohledu anesteziologa
- Fixní kombinace v léčbě hypertenze
- Farmakoterapie hypertenze po transplantaci srdce
- Snížení srdeční frekvence u srdečního selhání: změny funkce levé komory a kvalita života v podstudiích SHIFT
- Antagonisty aldosterónu v liečbe chronického srdcového zlyhávania
- Manažment stabilnej anginy pectoris a iných foriem chronickej kardiovaskulárnej artériovej choroby
- Antiaterogénny účinok HDL subpopulácií u jedincov s novodiagnostikovanou končatinovocievnou artériovou chorobou
- Konečné stadium chronického onemocnění ledvin a metabolická acidóza
- Chronické ochorenie obličiek a vápniková homeostáza bunky
- Ischemické a neischemické příčiny elevace ST segmentu u pacientů s bolestí na hrudi: Systematický přehled literatury
- Koncentrace sodíku v dialyzačním roztoku – důležitý, ale opomíjený parametr hemodialýzy u nemocných s chronickým selháním ledvin
- Solit nebo nesolit při ledvinových chorobách? Ne více než quantum satis!
- Oxidačný stres a antioxidačné systémy u hemodialyzovaných chorých
- Infarkt myokardu v mladom veku – naše výsledky a skúsenosti
- Významné životné jubileum profesora MUDr. Miroslava Mydlíka, DrSc.
- Vzťah mikroalbuminúrie a obezity u zdravých mladistvých – predbežné výsledky štúdie „Rešpekt pre zdravie“
- Kontrastová nefropatie a možnosti její prevence
- Farmakogenetické aspekty liečby orálnymi antidiabetikami
- Vnitřní lékařství
- Archív čísel
- Aktuálne číslo
- Iba online
- Informácie o časopise
Najčítanejšie v tomto čísle- Infarkt myokardu v mladom veku – naše výsledky a skúsenosti
- Požadavky na předoperační vyšetření z pohledu anesteziologa
- Megakaryopoéza a geneze destiček
- Ischemické a neischemické příčiny elevace ST segmentu u pacientů s bolestí na hrudi: Systematický přehled literatury
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



