-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Význam fenofibrátu v liečbe aterogénnej dyslipoproteinémie
The significance of fenofibrate in the therapy of atherogenic dyslipoproteinaemia
There are accepted the lipid levels goals in all world, which are needed to achievement in primary and secondary prevention. Despite efficacy of current standards of care (including achievement of LDL‑C, blood pressure and blood sugar goals), patients with atherogenic dyslipidemia (DLP) (high TG levels, low HDL‑C, high apolipoprotein B and small dense LDL‑particles), which is common in patients with diabetes melitus (DM), metabolic syndrome or cardiovascular diseases (KVD), remain exposed to a high residual risk of major cardiovascular events and microvascular complications. Statin therapy does not adequately address vascular risk asociated with elevated triglycerides (TG) and low HDL‑C levels. As ACCORD lipid trial last time shows, the addition of lipid‑modifying activity of fenofibrate to statin therapy benefited only certain subgroups of patients at increased cardiometabolic risk.
Key words:
fenofibrate – atherogenic dyslipoproteinaemia – small dense LDL particles – residual risk
Autori: M. Kučera; S. Oravec; I. Očadlík
Pôsobisko autorov: II. interná klinika Lekárskej fakulty UK a FNsP Bratislava, Slovenská republika, prednosta prof. MUDr. Andrej Dukát, CSc., FESC
Vyšlo v časopise: Vnitř Lék 2010; 56(8): 865-870
Kategória: 50. narozeniny prof. MUDr. Jindřicha Špinara, CSc., FESC, člena redakční rady časopisu Vnitřní lékařství
Súhrn
Celosvetovo je akceptovaný princíp cieľových hodnôt lipidov, ktoré treba v primárnej a sekundárnej prevencii dosahovať. Napriek komplexnej a cielenej starostlivosti (cielové hodnoty LDL‑cholesterolu, krvného tlaku a glykémií) zostávajú pacienti s aterogénnou dyslipidémiou (DLP) (vysoké triacylglyceroly, nízky HDL‑cholesterol, vysoký apolipoproteín B a malé denzné LDL častice), ktorá je bežná u pacientov s diabetes mellitus (DM), metabolickým syndrómom alebo kardiovaskulárnymi ochoreniami (KVO), vystavení vysokému riziku kardiovaskulárnych príhod a mikrovaskulárnych komplikácií. Statínová liečba úplne neodstráni vaskulárne riziko spojené s vysokými triacylglycerolmi (TG) a nízkymi hladinami HDL‑cholesterolu (HDL‑C). Ako ukázala naposledy publikovaná štúdia ACCORD lipid, lipidy‑modifikujúci účinok fenofibrátu, môže mať význam v kombinácii so statínom len u presne definovanej skupiny pacientov s vysokým kardiometabolickým rizikom. Účinnosť tejto kombinácie na klinické príhody však zatiaľ nie je známa.
Kľúčové slová:
fenofibrát – aterogénna dyslipoproteinémia – malé denzné LDL častice – reziduálne rizikoÚvod
Ischemická choroba srdca (ICHS) je v rozvinutých krajinách najčastejšou príčinou úmrtí. Predpokladá sa, že nárast kardiovaskulárnych (KV) ochorení bude ďalej pokračovať so stárnutím populácie. Dyslipoproteinémia je jedna z primárnych príčin aterosklerózy a KV ochorení, a preto len účinné intervencie v diagnostike a liečbe dyslipoproteinémií ako integrálna súčasť komplexnej stratégie, môže zabezpečiť efektívnu prevenciu kardiometabolických ochorení [1].
Pri voľbe hypolipidemika sa riadime charakterom dyslipoproteinémie a výsledkami intervenčných štúdií. Najviac dôkazov pre priaznivé ovplyvnenie kardiovaskulárnej morbidity a mortality existuje pre statíny [2,3], ktoré by mali byť u väčšiny osôb základom hypolipidemickej liečby. Fibráty sa využívajú v liečbe izolovanej hypertriacylglycerolémie väčšej než 7 mmol/l v prevencii pankreatitídy a v kombinovanej liečbe so statínmi k ovplyvneniu reziduálneho rizika, reprezentovaného zvýšením triacylglycerolov a znížením HDL‑C [4]. Dobrým vodítkom pre voľbu liečby môže byť hladina apolipoproteínu B (apo B) (u pacientov s vysokými koncentráciami apo B je vhodné zahájiť liečbu statínmi). Kombinovaná liečba statíny + fibráty predstavuje dnes pri správnej indikácii a aplikácii významný spôsob liečby dyslipoproteinémií so znižovaním vysokého kardiovaskulárneho rizika. Aj keď pre kombinovanú liečbu máme zatiaľ menej dôkazov z intervenčných štúdií, možno predpokladať priaznivý dopad na prognózu KV ochorení cez komplexnejšie ovplyvnenie lipoproteínového spektra. V súčasnej dobe už prebiehajú štúdie, ktoré by mali efektivitu tejto kombinovanej liečby v prevencii KV dokázať.
V tejto prehľadovej práci zhrnieme doterajšie významné výsledky, ktoré poukázali, že fenofibrát moduluje lipoproteínové spektrum a vedie k poklesu aterogénnych malých denzných LDL častíc.
Lipidy – modulujúce účinky fenofibrátu
Tretia generácia fibrátov zastúpená fenofibrátom bola syntetizovaná v roku 1975 a v tom istom roku bol fenofibrát predstavený pre klinické používanie vo Francúzku [5].
Fibráty, a predovšetkým ich zástupca fenofibrát, komplexne ovplyvňujú parametre lipidového spektra na mnohých úrovniach (napr. stimulácia aktivity lipoproteínovej lipázy, inhibícia aktivity pečeňovej acetyl‑koenzým A reduktázy, ovplyvnenie expresie apolipoproteínov), ale molekulárny mechanizmus týchto zmien dlho nebol známy. Zmena nastala v roku 1990, kedy boli objavené receptory PPAR (peroxisome proliferator‑activated receptors). Jedná sa o jadrové receptory, ktoré existujú v troch izoformách – α, β (δ) alebo γ – a exprimujú sa najmä v tkanivách, kde prebieha katabolizmus voľných mastných kyselín (pečeň, kostrové svaly, srdce a obličky), ale aj v cievnom endoteli, hladkej svalovine ciev a penových bunkách [6,7]. Vo forme dimérov sa viažu na signálnu sekvenciu DNA a regulujú expresiu príslušných génov zasahujúcich do metabolizmu lipidov a lipoproteínov (tab. 1). Dochádza k zníženiu (apo CIII), či zvýšeniu (apo AI, apo AII) expresie génov pre apolipoproteíny, ku zvýšeniu oxidácie mastných kyselín v mitochondriách pečeňových a svalových buniek a ku zvýšeniu aktivity lipoproteínovej lipázy [8]. Okrem iného fenofibrát zvyšuje koncentráciu nedávno objaveného apolipoproteínu AV [9], ktorý inhibuje de novo syntézu mastných kyselín a prispieva k znižovaniu triacylglycerolov. Výsledkom tohto molekulárneho mechanizmu sú potom rozmanité účinky fenofibrátu na metabolizmus lipoproteínov. V klinických štúdiách fenofibrát znižoval hladiny TG o 25–50 %, LDL‑cholesterol (LDL‑C) o 6–35 %, celkový cholesterol o 15–25 % a zvyšoval hodnoty HDL‑cholesterolu (HDL‑C) o 5–15 % v závislosti od vstupných hodnôt TG a LDL‑C [10,11]. Kvantita týchto zmien je individuálna a závisí od typu dyslipoproteinémie, použitej dávky lieku a compliance pacienta [7]. Fenofibrát aktivuje PPARα receptory o 40 % viac ako bezafibrát alebo klofibrát [12].
Zvýšenie hladín HDL‑C závisí od lipoproteínového fenotypu a počiatočných hodnôt. Fibráty zvyšujú HDL‑C až o 5–10 % [13]. Úloha jednotlivých subpopulácií HDL nie je zatiaľ presne objasnená. Väčšina prác uvádza, že protektívne sú veľké HDL 2, ale tiež tie úplne najmenšie diskoidné. Liečba fenofibrátom zvyšuje najmenšiu HDL 3 subfrakciu, ktorá je zodpovedná za odstraňovanie cholesterolu z periférnych buniek [11].
Fenofibrát zvyšuje aktivitu a koncentráciu paraoxonázy 1 u pacientov so zníženým HDL‑C, čo môže vysvetľovať účinok liečby na zníženie oxidácie LDL [14].
Dve veľké klinické štúdie s gemfibrozilom a bezafibrátom nepotvrdili ich signifikantný vplyv na pokles LDL‑C, hoci redukujú LDL‑C v závislosti od hyperlipoproteinémie do 10–20 % [15,16]. Fenofibrát znižuje LDL‑C v závislosti od jeho počiatočnej koncentrácie účinnejšie než gemfibrozil [17].
Fibráty tiež redukujú VLDL, VLDL remnanty a IDL pri hladovaní, aj po jedle. Obdobie po jedle má dôležitý význam pre aterogenitu u hyperlipoproteinemických pacientov a úzko koreluje s oxidatívnym stresom a endotelovou dysfunkciou [18]. Nedávne štúdie poukazujú, že liečba fibrátom vedie k 45% poklesu hypertriacylglycerolémie nalačno, aj po jedle u hypertriacylglycerolemických pacientov s metabolickým syndrómom, najmä vďaka zníženiu veľkých a stredných VLDL častíc [19]. Apolipoproteín B ako hlavná zložka LDL a lipoproteínov obsahujúcich triacylglyceroly sa znižuje po užívaní fenofibrátu [20].
Táto lipidy modifikujúca aktivita napovedá, že fenofibrát je pravdepodobne účinný pri aterogénnej dyslipoproteinémii v rámci diabetes mellitus alebo metabolického syndrómu, ako je demonštrované v klinických štúdiách [19,21,22].
Fenofibrát a malé denzné LDL častice
Hypertriacylglycerolémia pri metabolickom syndróme je spojená s generovaním malých denzných LDL častíc. Hoci pri metabolickom syndróme hodnoty LDL‑cholesterolu bývajú obyčajne normálne alebo iba ľahko zvýšené, LDL častice majú abnormálne zloženie a ich počet býva zvýšený [23]. Malé LDL III nesú menej cholesterolu než LDL II a LDL I, preto pri ich zvýšenej koncentrácii v krvi môže byť normálna koncentrácia LDL‑cholesterolu, ale predsa je u pacientov vysoké kardiovaskulárne riziko. Tieto LDL III sú pravidelným nálezom u pacientov s metabolickým syndrómom a diabetes mellitus 2. typu. Potvrdilo sa, že osoby, ktoré majú koncentráciu LDL III presahujúcu hranicu 1,0 g/l, majú vysoké aterogénne riziko [24].
Často ale býva zvýšený apolipoproteín B (apo B), ktorý je vedľa bežne stanovovaných lipidových parametrov (celkový cholesterol, LDL‑C, non HDL‑C) najpresnejším ukazovateľom rizika KV ochorení, ako ukázali viaceré intervenčné aj prospektívne štúdie [25]. Ak každá potenciálne aterogénna lipoproteínová častica (VLDL, IDL, LDL) s rozličným obsahom cholesterolu obsahuje jednu molekulu apoB, zvýšené koncentrácie apoB s nízkymi hladinami celkového cholesterolu a LDL‑C môžu nepriamo odzrkadlovať zvýšenú prevalenciu malých denzných LDL častíc [26]. Zvlášť cenný je tento ukazovateľ u pacientov s hypertriacylglycerolémiou, s diabetes mellitus, s metabolickým syndrómom a všade tam, kde možno predpokladať prítomnosť malých denzných LDL častíc, ktoré sú najaterogénnejšie [27]. Koncentrácie apo B > 1,2 g/l sú známkou výrazne zvýšeného KV rizika [4]. Stanovenie apo B je už bežne dostupné na väčšine pracovísk a pomáha pri presnejšom odhade KV rizika. Štúdia Interheart na 15 000 pacientoch v 52 štátoch taktiež dokázala, že pomer apoB/apoA1 je silným prediktorom koronárnej choroby srdca [28].
Fenofibrát reštrukturalizuje lipoproteínové spektrum ako nalačno, tak aj po jedle zo všetkých fibrátov najviac. Útlm syntézy apo CIII a zvýšenie aktivity lipoproteínovej lipázy stimuláciou PPARa receptorov vedú k zníženiu koncentrácie malých denzných LDL častíc: sú syntetizované menšie častice VLDL chudobnejšie na apo CIII a TG a tie sú v krvnom obehu katalizované na väčšie a menej aterogénne LDL 1 a LDL 2 [7]. Boli realizované mnohé štúdie, ktoré sledovali účinok fenofibrátu u pacientov s diabetes mellitus na koncentráciu lipoproteínov, ale nie na zastúpenie lipidov a štruktúru lipoproteínov. Viaceré sledovania však potvrdzujú, že liečba fenofibrátom signifikantne podporuje posun od malých silne proaterogénnych LDL subpopulácií k veľkým LDL subpopuláciám [19,29–31], ktoré sú najmenej aterogénne, ak aterogénne vôbec sú. Aj u pacientov bez diabetes mellitus sa zaznamenal benefit liečby fenofibrátom na modifikáciu aterogénneho lipoproteínového profilu [32].
V roku 1999 bola realizovaná prvá randomizovaná, dvojito zaslepená a placebom kontrolovaná štúdia u diabetikov, ktorá sledovala vplyv fenofibrátu na zmenu štruktúry lipoproteínov [33]. 32 pacientov s diabetes mellitus 2. typu užívalo 12 týždňov mikronizovaný fenofibrát (Lipanthyl Micro®) 200 mg ráno vs placebo. Vstupné hodnoty lipidov boli v oboch skupinách podobné, v priemere: celkový cholesterol 7,5 mmol/l, LDL‑C 4,7 mmol/l, TG 3,1 mmol/l, HDL‑C 1,2 mmol/l a 52% zastúpenie mali malé denzné LDL častice (LDL III) s koncentráciou 192 mg/100 ml. LDL subfrakcie boli sledované gradientovou ultracentrifugačnou metódou. Liečba mikronizovaným fenofibrátom viedla k signifikantným zmenám vo všetkých lipoproteínových triedach, ale najmä dokázala modifikovať aterogénnu dyslipoproteinémiu u diabetikov na neaterogénnu (LDL I +64 %, p < 0,05; LDL II +53 %, p < 0,05; LDL III –51 %, p < 0,001), čoho výsledkom bolo, že LDL III obsahoval 28 % z celkového cholesterolu (p < 0,001).
S prihliadnutím na rozmanité pleiotropné účinky fenofibrátu a jeho protizápalové účinky spôsobené poklesom hs‑CRP (high sensitive C reactive protein) a Lp‑PLA2 (s lipoproteínom asociovaná fosfolipáza A2), viedli v DIACOR štúdii (Diabetes and Combined Lipid Therapy Regimen) u pacientov s DM 2. typu k redukcii veľkých VLDL častíc a v menšej miere aj malých denzných LDL častíc [34,35].
Reziduálne kardiovaskulárne riziko
Napriek komplexnej a cielenej starostlivosti (dosiahnutie cieľových hodnôt LDL‑C, TG, krvného tlaku a glykémií) zostávajú pacienti s aterogénnou dyslipoproteinémiou (obr. 1), ktorá je bežná u osôb s diabetes mellitus, metabolickým syndrómom alebo KV ochorením vo vysokom makrovaskulárnom a mikrovaskulárnom riziku [36]. KV riziko pretrváva aj napriek efektívnemu znižovaniu LDL‑cholesterolu, ktorý je primárnym cieľom hypolipidemickej liečby [37]. V štúdii SAFARI (Effectiveness and Tolerability of Simvastatin Plus Fenofibrate for Combined Hyperlipidemia) pridanie fenofibrátu (160 mg/deň) k simvastatínu (20 mg/deň) viedlo k signifikantnému poklesu hladín TG a vzostupu HDL‑C (p < 0,001), ale predovšetkým k posunu od aterogénneho lipoproteínového profilu (typ B) k neaterogénnemu lipoproteínovému profilu (typ A) v porovnaní so skupinou liečenou len simvastatínom (p < 0,001) [38]. Zatiaľ však chýbajú klinické štúdie, ktoré by jednoznačne potvrdili, že pacienti s metabolickým syndrómom profitujú z kombinovanej liečby statin + fibrát viac ako len z monoterapie. Nedávno publikované výsledky štúdie ACCORD (The Action to Control Cardiovascular Risk in Diabetes) nedokázali významný účinok pridania fenofibrátu k statínu u pacientov s diabetes mellitus 2. typu na zníženie KV príhod. Kombinácia fenofibrátu a simvastatínu neredukovala významnejšie riziko fatálnych KV príhod, nefatálneho infarktu myokardu alebo nefatálnej cievnej mozgovej príhody v porovnaní len so samotným simvastatínom [39]. Preto tieto výsledky nepodporujú rutinné využívanie kombinovanej terapie fenofibrát + statín v redukcii KV rizika u väčšiny vysoko rizikových pacientov s diabetes mellitus 2. typu. Zníženie KV príhod o 31 % bolo dokázané len u predom definovanej podskupiny s TG ≥ 2,3 mmol/l + HDL‑C ≤ 0,1 mmol/l, čo však vzhľadom k veľkosti tejto podskupiny nedosiahlo štatistickej významnosti. Preto pridanie fibrátu k statínu na základe doterajších štúdií môže mať benefit u pacientov s diabetes mellitus 2. typu v prípade významnej hypertriacylglycerolémie a nízkeho HDL‑C, ktoré pretrvávajú aj napriek statínovej liečbe.
Obr. 1. Aterogénna dyslipoproteinémia je asociovaná s vysokým KV rizikom. 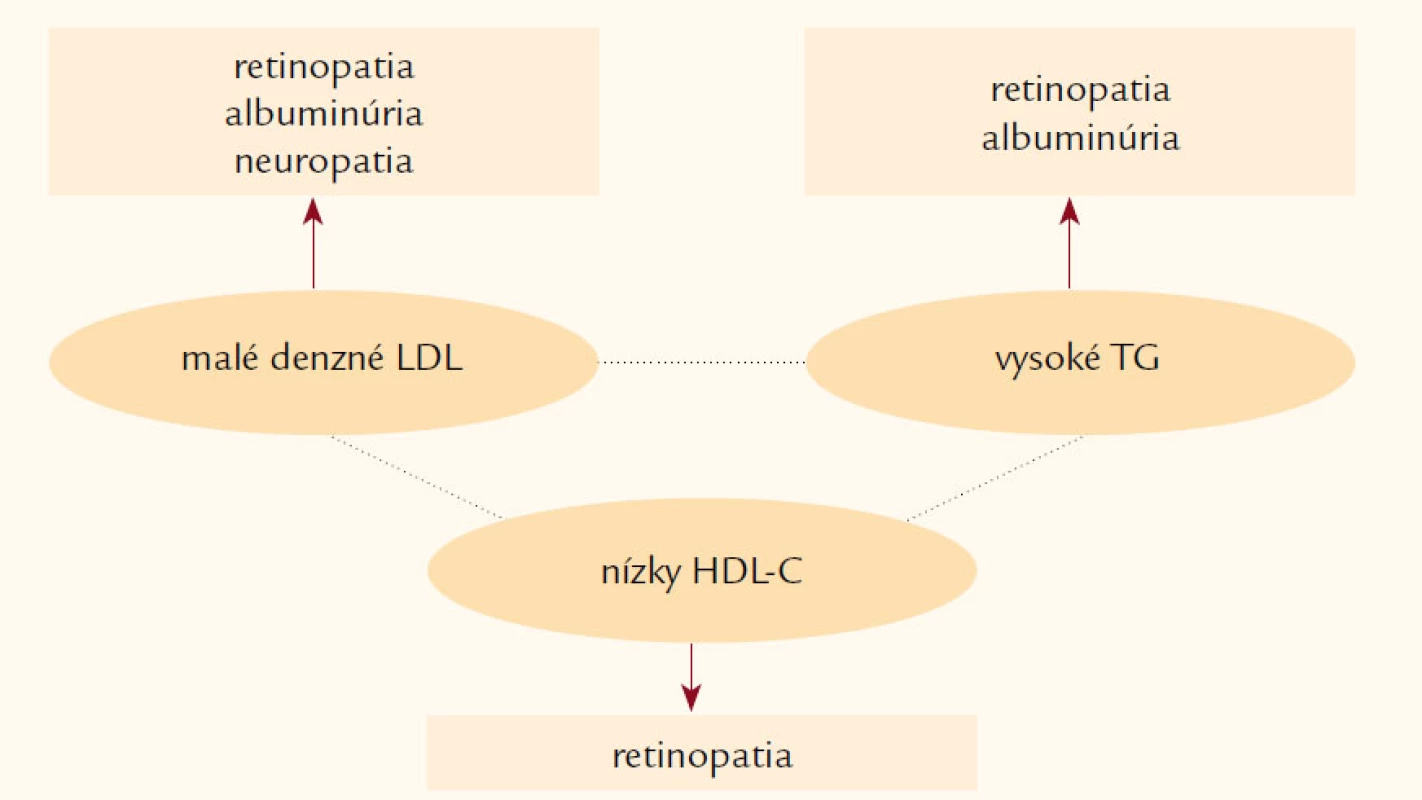
Kombinovaná liečba (statín + živice,statín + ezetimib) i agresívna monoterapia vysokými dávkami statínov sú používané v liečbe kombinovanej hyperlipoproteinémie. Na druhej strane však zostanú niektoré parametre neovplyvnené (alebo budú ovplyvnené nedostatočne), aj keď vieme, že v štúdiách ARBITER 2 (Arterial Biology for the Investigation of the Treatment Effects of Reducing Cholesterol) alebo VA‑HIT (The Veterans Affairs High‑Density Lipoprotein Intervention Trial) viedlo ich úspešné ovplyvnenie k ďalšiemu prínosu „nad rámec LDL‑C“ [15,40]. Kombinácia statín + fibrát má teda svoju budúcnosť predovšetkým pre komplexnejšie ovplyvnenie lipidového spektra. Dôvody pre možnú kombinovanú hypolipidemickú liečbu uvádzame v tab. 2.
K ovplyvneniu reziduálneho rizika u pacientov s aterogénnou dyslipoproteinémiou je potrebný komplexný prístup. Po zahájení systematickej a odborne vedenej intervencie životného štýlu by mala nasledovať farmakologická liečba k dosiahnutiu cieľovej hodnoty LDL‑C, ktorý je základným a primárnym cieľom liečby dyslipoproteinémií (DLP). Potom by mala nasledovať snaha ovplyvniť aterogénnu dyslipoproteinémiu (zvýšené triacylglyceroly a nízky HDL‑C). Svoje miesto v primárnej prevencii u pacientov s hraničným LDL‑C a v sekundárnej prevencii u pacientov s metabolickým syndrómom a diabetes mellitus majú aj hodnotenie apoB, apoB/apoA1 ako pravdepodobné, respektíve nepriame ukazovatele aterogenity.
Dnes však máme jasné dôkazy z početných štúdií, že aj významná redukcia LDL‑C, krvného tlaku a glykémií neodstráni úplne reziduálne KV riziko. Preto nevyhnutne potrebujeme nové diagnosticko‑liečebné stratégie zamerané na aterogénnu dyslipoproteinémiu u miliónov pacientov s diabetes mellitus a metabolickým syndrómom.
Záver
Terapia DLP kombináciou dvoch alebo viacerých hypolipidemík predstavuje moderný smer v liečbe porúch tukového metabolizmu a je nevyhnutná k jeho normalizácii a k redukcii reziduálneho vaskulárneho rizika. Základným stavebným kameňom väčšiny kombinácií budú v súčasnosti statíny. Fibráty môžu k zavedenej liečbe statínmi priniesť ďalší aditívny účinok, preto pre kombinovanú liečbu statínom a fibrátom teda dôvody sú. Je pravda, že pre terapiu zmiešanej DLP pri metabolickom syndróme či diabetickej DLP je menej dôkazov z intervenčných štúdií. Okrem toho klinickým štúdiám s fibrátmi, ktoré boli doposiaľ publikované, sa vyčíta, že sú zamerané skôr na hodnotenie lipidogramu ako na presvedčivé dôkazy o ich efekte na ovplyvnenie kardiovaskulárnej morbidity a mortality. Bezpečnosť a efektivitu kombinácie statínu a fibrátu popísali štúdie SAFARI (Effectiveness and tolerability of simvastatin plus fenofibrate for combined hyperlipidemia) či FIELD (Fenofibrate Intervention and Event Lowering in Diabetes), kde však nevhodný výber pacientov (pacienti s prakticky normálnymi hodnotami HDL‑C a TG) spôsobil štatisticky nevýznamný efekt fenofibrátu na celkový počet kardiovaskulárnych príhod, čo potvrdila subanalýza uvedenej štúdie minulý rok [41]. Prof. Jean‑Charles‑Fruchart, prezident nezávislej akademickej nadácie Residual Risk Reduction Initiative (R3i) povedal: „V posledných dvoch rokoch sa R3i sústredila na hypotézu, že reziduálne kardiovaskulárne riziko u pacientov liečených statínom je spojené s prítomnosťou aterogénnej dyslipoproteinémie“ [36]. Tento rok očakávaná štúdia ACCORD lipid potvrdzuje ako túto hypotézu, tak aj prínos kombinovanej liečby – pridanie fenofibrátu ku statínu pre redukciu tohto vysokého reziduálneho kardiovaskulárneho rizika. Prínos pridania fenofibrátu však bol preukázaný len u vopred definovanej skupiny diabetikov 2. typu s aterogénnou dyslipoproteinémiou, nie v celom súbore diabetikov zaradených do štúdie. Práve prebiehajúce štúdie AIM‑HIGH (Atherothrombosis Intervention in Metabolic syndrome with low HDL/High triglycerides and Impact on Global Health outcomes) a HPS‑THRIVE (Heart Protection Study 2 Treatment of HDL to Reduce the Incidence of Vascular Events) poskytnú ďalšie dôležité informácie pre odporúčanie kombinovanej hypolipidemickej liečby v redukcii reziduálneho KV rizika.
Doručeno do redakce: 21. 6. 2010
MUDr. Marek Kučera
www.nspr.sk
e‑mail: marekucera@gmail.com
Zdroje
1. Grundy SM, Becker D, Luther TC et al. Third Report of the National Cholesterol Education Program (NCEP) Expert Panel on Detection, Evaluation and Treatment of High Blood Cholesterol in Adults (Adult Treatment Panel III) final report. Circulation 2002; 106 : 3143–3421.
2. Baigent C, Keech A, Kearney PM et al. Cholesterol treatment Trialist (CTT) Collaborators. Efficacy and safety of cholesterol lowering treatment: prospective meta‑analysis of data from 90,056 participants in 14 randomized trials of statins. Lancet 2005; 366 : 1267–1278.
3. Nissen SE, Nicholls SJ, Sipahi I et al. Effect of very high‑intensity statin therapy on regression of coronary atherosclerosis: the ASTEROID trial. JAMA 2006; 295 : 1556–1565.
4. Vaverková H, Soška V, Rosolová H et al. Doporučení pro diagnostiku a léčbu dyslipidemií v dospělosti, vypracované výborem České společnosti pro aterosklerózu. Vnitř Lék 2007; 53 : 181–197.
5. Keating GM, Ormord D. Micronised fenofibrate: an update review of its clinical efficacy in the management of dyslipidaemia. Drugs 2002; 62 : 1909–1944.
6. Doležal T. Nová léková forma fenofibrátu Lipanthyl Supra. Intern Med 2001; 10 : 473–476.
7. Soška V. Jaderné receptory PPARα. Vnitř Lék 2006; 52 : 628–631.
8. Vu‑Dac N, Schoonjans K, Kosykh V et al. Fibrates increase human apolipoprotein A‑II expression through activation of the peroxisome proliferator‑activated receptor. J Clin Invest 1995; 96 : 741–750.
9. Vu‑Dac N, Gervois P, Jakel H et al. Apolipoprotein A5, a crucial determinant of plasma triglyceride levels, is highly responsive to peroxisome proliferator‑activated receptor alpha activators. J Biol Chem 2003; 278 : 17982–17985.
10. Keech A, Simes RJ, Barter P et al. FIELD study investigators. Effects of long term fenofibrate therapy on cardiovascular events in 9795 people with type 2 diabetes mellitus (the FIELD study): a randomised controlled trial. Lancet 2005; 366 : 1849–1861.
11. Sasaki J, Yamamoto K, Ageta M. Effects of fenofibrate on high density lipoprotein particle size in patients with hyperlipidaemia: a randomised, double‑blind, placebo‑controlled, multicentre, crossover study. Clin Ther 2002; 24 : 1614–1626.
12. Chapman MJ. Fibrates in 2003: therapeutic actions in atherogenic dislipidaemia and future perspectives. Atherosclerosis 2003; 171 : 1–13.
13. Frick MH, Elo O, Haapa K et al. Helsinki Heart Study: primary prevention trial with gemfibrozil in middle‑aged men with dyslipidemia. Safety of treatment, changes in risk factors, and incidence of coronary heart disease. N Engl J Med 1987; 317 : 1237–1245.
14. Phuntuwate W, Suthisisang C, Koanantakul B et al. Effects of fenofibrate therapy on paraoxonase1 status in patients with low HDL‑C levels. Atherosclerosis 2008; 196 : 122–128.
15. Rubins HB, Robins SJ, Collins D et al. Gemfibrozil for the secondary prevention of CAD in men with low levels of high‑density lipoprotein cholesterol: Veterans Affairs High‑Density Lipoprotein Cholesterol Intervention Trial Study Group. N Engl J Med 1999; 341 : 410–418.
16. Steiner G. Fibrates and coronary risk reduction. Atherosclerosis 2005; 182 : 199–207.
17. Schonfeld G. The effects of fibrates on lipoproteins and hemostatic coronary risk factors. Atherosclerosis 1994; 111 : 161–174.
18. Kolovou GD, Anagnostopoulou KK, Daskalopoulou SS et al. Clinical relevance of postprandial lipaemia. Curr Med Chem 2005; 12 : 1931–1945.
19. Rosenson RS, Wolf DA, Huskin AL et al. Fenofibrate therapy ameliorates fasting and postprandial lipoproteinaemia, oxidative stress, and the inflammatory response in subjects with hypertriglyceridemia and the metabolic syndrome. Diabetes Care 2007; 8 : 1945–1951.
20. Gami AS, Montori VM, Erwin PJ et al. Systematic review of lipid lowering for primary prevention of coronary heart disease in diabetes. BMJ 2003; 326 : 528–529.
21. Ikewaki K, Tohyama J, Nakata Y et al. Fenofibrate effectively reduces remnants, and small dense LDL, and increases HDL particles number in hypertriglyceridemic men – a nuclear magnetic resonance study. J Atheroscler Thromb 2004; 11 : 278–285.
22. Ooi TC, Cousins M, Ooi DS et al. Efects of fibrates on postprandial remnant like particles in patients with combined hyperlipidaemia. Atherosclerosis 2004; 172 : 375–382.
23. Fábryová Ľ. Manažment aterogénnej dyslipidémie pri metabolickom syndróme. Via Practica 2007; S4 : 13–18.
24. Soška V. Lipoproteiny. In: Soška V (ed). Poruchy metabolizmu lipidu. Praha: Grada Publishing 2001 : 21–29.
25. Barter PJ, Ballantyne CM, Carmena R et al. Apo B versus cholesterol in estimating cardiovascular risk and in guiding therapy: report of the thirty‑person/ten country panel. J Intern Med 2006; 259 : 247–258.
26. Vaverková H, Karásek D, Novotný D et al. Apolipoprotein B versus LDL‑cholesterol: association with other risk factors for atherosclerosis. Clin Biochem 2009; 42 : 1246–1251.
27. Brunzell JD. Increased ApoB in small dense LDL particles predicts premature coronary artery disease. Arterioscler Thromb Vasc Biol 2005; 25 : 474–475.
28. Yusuf S, Hawken S, Ounpuu S et al. Effect of potentially modifiable risk factors associated with myocardial infarction in 52 countries (the INTERHEART STUDY): case‑control study. Lancet 2004; 364 : 937–952.
29. Guerin M, Bruckert E, Dolphin PJ et al. Fenofibrate reduces plasma cholesteryl ester transfer from HDL to VLDL and normalises the atherogenic dense LDL profile in combined hyperlipidaemia. Arterioscler Thromb Vasc Biol 1996; 16 : 763–772.
30. Frost RJ, Otto C, Geiss HC et al. Effest of atorvastatin versus fenofibrate on lipoprotein profiles, low‑density lipoprotein subfraction distribution, and hemorheologic parametres in type 2 diabetes mellitus with mixed hyperlipoproteinemia. Am J Cardiol 2001; 87 : 44–48.
31. Hiukka A, Leinonem E, Jauhiainem M et al. Long‑term effects of fenofibrate on VLDL and HDL subspecies in participants with Type 2 diabetes mellitus. Diabetologia 2007; 50 : 2067–2075.
32. Griffin B, Caslake M, Gaw A et al. The effect of hypolipidaemic drugs on subfractions of plasma low density lipoprotein. Atherosclerosis 1990; 85 : 93.
33. Feher MD, Caslake M, Foxton J et al. Atherogenic lipoprotein phenotype in type 2 diabetes: reversal with micronised fenofibrate. Diabetes Metab Res Rev 1999; 15 : 395–399.
34. Rosenson RS, Huskin AL, Wolff DA et al. Fenofibrate reduces fasting and postprandial inflammatory responses among hypertriglyceridemia patients with the metabolic syndrome. Atherosclerosis 2008; 198 : 381–388.
35. Rosenson RS. Fenofibrate reduces lipoprotein associated phospholipase A2 mass and oxidative lipids in hypertriglyceridemic subjects with the metabolic syndrome. Am Heart J 2008; 155 : 499.e9–499.e16.
36. Fruchart JC, Sacks FM, Hermans MP et al. The Residual Risk Reduction Initiative: a call to action to reduce residual vascular risk in dyslipidaemic patients. Diab Vasc Dis Res 2008; 5 : 319–335.
37. LaRosa JC, Grundy SM, Waters DD et al. Treating to New Targets (TNT) Investigators. Intensive lipid lowering with atorvastatin in patients with stable coronary disease. N Engl J Med 2005; 352 : 1425–1435.
38. Grundy SM, Vega GL, Yuan Z et al. Effectiveness and tolerability of simvastatin plus fenofibrate for combined hyperlipidemia (the SAFARI trial). Am J Cardiol 2005; 95 : 462–468.
39. The ACCORD Study Group. Effects of combination lipid therapy in type 2 diabetes mellitus. N Engl J Med 2010; 362 : 1563–1574.
40. Taylor AJ, Sullenberger LE, Lee HJ et al. Arterial biology for the ARBITER 2: a double‑blind, placebo controlled study of extended release niacin on atherosclerosis progression in secondary prevention patients treated with statins. Circulation 2004; 110 : 3512–3517.
41. Scott R, O’Brien R, Fulcher G et al. Effects of fenofibrate treatment on cardiovascular disease risk in 9 795 individuals with type 2 diabetes and various components of the metabolic syndrome (FIELD study). Diabetes Care 2009; 32 : 493–498.
Štítky
Diabetológia Endokrinológia Interné lekárstvo
Článok vyšiel v časopiseVnitřní lékařství
Najčítanejšie tento týždeň
2010 Číslo 8- Parazitičtí červi v terapii Crohnovy choroby a dalších zánětlivých autoimunitních onemocnění
- Intermitentní hladovění v prevenci a léčbě chorob
- Rizikové období v léčbě růstovým hormonem: přechod mladých pacientů k lékařům pro dospělé
- Statinová intolerance
- Monoklonální protilátky v léčbě hyperlipidemií
-
Všetky články tohto čísla
- Jak a proč změnily staré léky prognózu nemocných s primárním lymfomem CNS? – editorial
- Problematika primárních lymfomů centrálního nervového systému – editorial
- Zmeny hladín NT‑proBNP u pacientov s fibriláciou predsiení v závislosti od srdcového zlyhávania
- Primární lymfomy centrálního nervového systému
- Péče o nemocné na umělé plicní ventilaci z pohledu lékaře internisty
- Úspěšná léčba angiomatózy thalidomidem a interferonem α. Popis pěti případů a přehled léčby angiomatózy a proliferujících hemangiomů
- Imunoglobulin G4 pozitivní cholangitida
- K významnému životnímu jubileu prof. MUDr. Jindřicha Špinara, CSc., FESC,
- K životnímu jubileu prof. MUDr. Jindřicha Špinara, CSc., FESC
- Rizikový profil hypertonika
- Komplexní léčba kardiovaskulárního rizika. Zaměřeno na telmisartan
- Charakteristiky a osud pacientov s akútnym srdcovým zlyhávaním v aktuálnej klinickej praxi
- Anémie při chronickém srdečním selhání
- Terapie implantabilními kardiovertery-defibrilátory (ICD) na prahu 3. tisíciletí
- Význam fenofibrátu v liečbe aterogénnej dyslipoproteinémie
- Fibrilace síní v době katétrové ablace
- Rychlost aortální pulzové vlny u nemocných s metabolickým syndromem a hypertenzí léčených sartany
- Transplantace srdce – minulost, současnost a výhled do budoucna
- Šobrův den, XXV. konference o hyperlipoproteinemiích
- Vnitřní lékařství
- Archív čísel
- Aktuálne číslo
- Iba online
- Informácie o časopise
Najčítanejšie v tomto čísle- Péče o nemocné na umělé plicní ventilaci z pohledu lékaře internisty
- Terapie implantabilními kardiovertery-defibrilátory (ICD) na prahu 3. tisíciletí
- Anémie při chronickém srdečním selhání
- Zmeny hladín NT‑proBNP u pacientov s fibriláciou predsiení v závislosti od srdcového zlyhávania
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy





