-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Je hyperhomocysteinemie stále jen zajímavý, ale diagnosticky nevýznamný nález?
Hyperhomocysteinemia – is it still the only interesting but diagnostically unsignificant finding?
After „metabolic prologue“ the authors describe 4 cases of the patients at whom the high level of homocystein in serum was detected within hospitalisation at intensive care unit of Hospital Na Homolce. There are the cases of typical homocysteinurie with hereditary deficit of cystathionin-beta-synthase enzyme recognized only after a passed myocardial infarct. The next there were a myocardial infarct within suspect pernicious anaemia, an acute pulmonary embolism with till the time not diagnosed pernicious anaemia and finally a deep flebothrombosis with diagnosed pernicious anaemia but insufficiently treating for allergic reaction. The important homocysteinemie, which is occurred at all these patients, was as a result of an important deficit of cobalamin in remethyl reaction removing homocystein from plasma. The inclusion of homocystein examination into the routine diagnostic process could be fecund first of all in the patients with cardiovascular handicap; without changes of lipid spectrum and risk factors.
Key words:
homocysteine – hyperhomocysteinemia – homocystinuria – vitamin B12 deficiency – folate deficiency – risk factors – atherosclerosis
Autoři: J. Hyánek 1; J. Matoušková 2; P. Kmoníček 2; P. Formánek 2; V. Kožich 5; J. Zeman 6; M. Orendáč 5; M. Janošík 6; P. Lepší 2; K. Kopřiva 2; L. Dubská 1; J. Dvořáková 1; H. Veselá 1; K. Kupka 4; B. Malec 4; H. Pejznochová 1; R. Hoffmann 1; J. Balasz 1; V. Martiníková 1; M. Vodičková 1; J. Pola 3; V. Maťoška 1; K. Koubek 2
Působiště autorů: oddělení klinické biochemie, metabolická a hematologická ambulance Nemocnice Na Homolce, Praha, přednosta prof. MUDr. J. Hyánek, DrSc. 1; koronární jednotka intenzivní péče kardiologického oddělení Nemocnice Na Homolce, Praha, přednosta prof. MUDr. P. Niederle, DrSc. 2; interní oddělení Nemocnice, Tanvald, přednosta prim. MUDr. J. Pola 3; Ústav nukleární medicíny 1. lékařské fakulty UK a VFN, Praha, přednosta prof. MUDr. T. Šámal, DrSc. 4; Ústav dědičných metabolických poruch 1. lékařské fakulty UK, Praha, přednosta prof. MUDr. M. Elleder, DrSc. 5; Klinika dětí a dorostu 1. lékařské fakulty UK a VFN, Praha, přednosta doc. MUDr. J. Hoza, CSc. 6
Vyšlo v časopise: Vnitř Lék 2005; 51(4): 462-470
Kategorie: Kazuistiky
Souhrn
Po nezbytném vysvětlujícím metabolickém úvodu popisují autoři 4 kazuistiky pacientů, kteří byli detekováni na jednotkách intenzivní péče Nemocnice Na Homolce s vysokou hladinou homocysteinu v plazmě. Jedná se o případ klasické homocystinurie s dědičným deficitem enzymu cystathionin-β-syntázy, která se rozpoznala až po prodělaném infarktu myokardu. Dále se jednalo o infarkt myokardu při suspektní perniciózní anémii, dále o akutní embolii plicnice s dosud nediagnostikovanou perniciózní anémií a konečně o hlubokou žilní trombózu s diagnostikovanou perniciózní anémií, ale nedostatečně léčenou pro alergickou reakci; u všech těchto pacientů se vyvinula výrazná hyperhomocysteinemie následkem těžkého deficitu kobalaminu pro remetylační reakci odstraňující homocystein z plazmy. Zařazení stanovení homocysteinu do rutinního vyšetřovacího spektra je diagnosticky přínosné především u pacientů s kardiovaskulárním postižením bez změn lipidového spektra, u kterých nejsou přítomny jiné rizikové faktory.
Klíčová slova:
homocystein – hyperhomocysteinemie – homocystinurie – deficit vitaminu B12 – deficit folátu – rizikové faktory – aterosklerózaMotto: „HHC je nový ekogenetický a nezávislý rizikový faktor s metabolickými důsledky ještě zcela neprozkoumanými.“
Úvod
Zvýšený cholesterol představuje již déle než půl století nejsnáze prokazatelný rizikový faktor podporující vznik kardiovaskulárních onemocnění (KVO) a jeho snižováním bylo dosaženo jejich výrazného poklesu. Ne však v takovém rozsahu, jak se předpokládalo. I v našich zemích byl s velkým očekáváním sledován pokles („downing“) průměrné hladiny cholesterolu v krvi např. po dramatických ekonomických změnách roku 1989 (z 6,3 na 5,9 mmol/l), ale přesto i v roce 2002 KVO z 52,8 % zůstávají hlavní příčinou mortality i morbidity [31]. Téměř u poloviny akutních infarktů myokardu nacházíme nezvýšenou hladinu celkového cholesterolu; a tak zůstává cholesterol jen jedním z nejvíce sledovaných, ale pouze jediným ze 32 rizikových faktorů aterosklerózy (ATS) uznávaných WHO [26,35,36]. Nám pak nezbývá, než hledat jiné patognomonické příčiny, vyhodnocovat další možné metabolické mechanizmy a dokazovat praktický význam nových rizikových faktorů pro vznik KVO a ATS [1,3, 26,34,36].
Při studiu dědičných metabolických poruch metabolizmu methioninu (Met) jsme se už před 30 lety setkávali s klasickou homocystinurií (KH) a naši neléčení dětští pacienti umírali do 30 let věku na tromboembolické cévní komplikace [11,25]. Bližší poznání metabolických změn u KH bylo příčinou odhalení etiologické souvislosti mezi zvýšenou hladinou homocysteinu a tromboembolickými cévními komplikacemi a akcelerace aterosklerotických změn u cévních onemocnění [33]. McCulleyho toto poznání přivedlo dokonce k odvážné „homocysteinové teorii“ vzniku ATS [23].
Zvýšení neesenciální aminokyseliny homocysteinu (Hcy) v plazmě – hyperhomocysteinemie (HHC) při remetylačních nebo transsulfuračních poruchách (obr. 1) má celou řadu nepříznivých toxických účinků prokazatelných in vitro; pro klinické posuzování však zde uvádíme jen známé účinky in vivo: a) přímý účinek Hcy na endoteliální buňky (deformace, exfoliace, indukce cytoadhezivních molekul a interleukinů aj); Hcy poškozuje elastin a hladkou svalovinu intimy, zvyšuje produkci kolagenu; b) Hcy vyvolává změny koagulačních bílkovin zvyšujících prokoagulační aktivitu; c) Hcy svojí velmi reaktivní SH-skupinou zvyšuje oxidační stres, a tím i oxidaci a thiolaci cholesterolu a dalších lipidů; d) výrazně snižuje fibrinolýzu především u jedinců se zvýšeným Lp(a) (obr. 2). Vlivem zvýšeného Hcy (už nad 20 μmol/l) se modifikuje postranní řetězec lipoproteinu (a), jehož glykoproteinová molekula sdílí podobnou homologní strukturu s plazminogenem a soutěží s ním o jeho tkáňový aktivátor (tPA); váže se na plazminem změněný povrch fibrinu, a tak zabraňuje probíhající fibrinolýze [2]. Je to snad právě ten dlouho hledaný spojovací článek mezi aterogenezou a trombogenezou [10]?
Obr. 1. Metabolické schéma přeměny methioninu; reakce č. 5 představuje složitý enzymový systém methionin syntházy a její reduktázy.Reakce č. 9 je katalyzována cystathionin-beta-syntázou (CBS). Reakce č. 8 označuje metylentetrahydrofolát reduktázu (MTHFR). 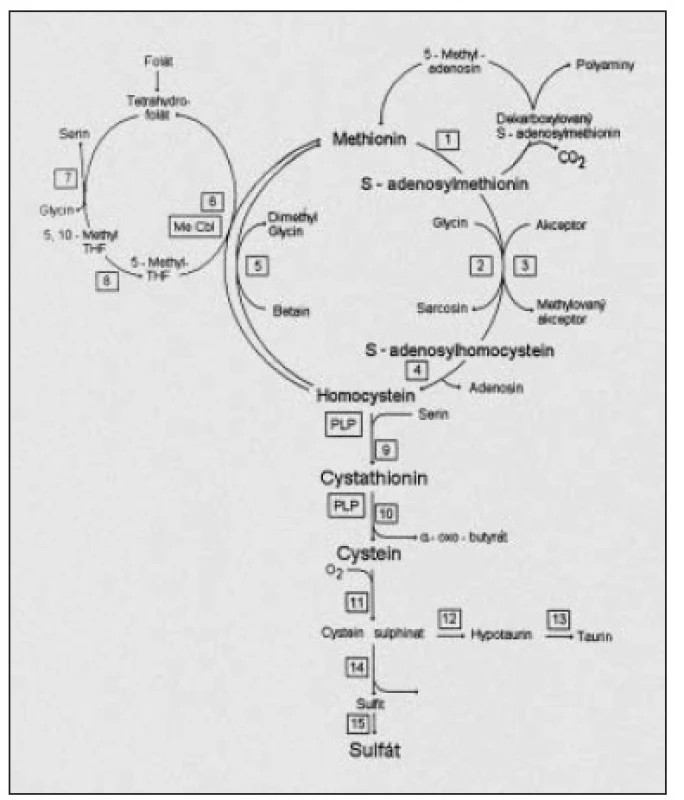
Obr. 2. Schéma inhibice fibrinolýzy účinkem zvýšeného homocysteinu na Lp(a), který pak kompetitivně inhibuje syntézu plazminu [2]. ![Schéma inhibice fibrinolýzy účinkem zvýšeného homocysteinu na Lp(a), který pak kompetitivně inhibuje syntézu plazminu [2].](https://www.prelekara.sk/media/cache/resolve/media_object_image_small/media/image/5ffa2cb2adc76c9a9d4eb01e4c191c28.jpg)
Odbourávání Hcy probíhá v endoteliálních buňkách výlučně cestou remetylace, která je závislá na dostatečných hladinách vitaminu B12 (kobalaminu) a folátu, ale také riboflavinu a pyridoxinu [27,28] (obr. 1). Nezvratná transsulfurace, která nastává při nadbytku Hcy, zatím nebyla v endoteliích prokázána [29]. Proto je kardiovaskulární aparát mnohem vnímavější k toxickým účinkům HHC než jiné tkáně [3,18,24,30]. Při dědičném či získaném nedostatku těchto tzv. „kritických“ vitaminů enzymové systémy nepracují dostatečně efektivně; Hcy zůstává v krvi zvýšený delší dobu a tkáně jsou tak déle vystaveny jeho toxickým účinkům. Pro správné posouzení a diferencování hladiny homocysteinu v plazmě je třeba znát především ledvinnou funkci (filtrace, kreatininemie), hladiny kritických vitaminů (folát, kobalamin, pyridoxin, riboflavin) a přítomnost dědičně podmíněné enzymové insuficience 5,10-etylentetrahydrofolát reduktázy (MTHFR) (genová mutace C677T).
10 let intenzivně sledovaný výskyt HHC u pacientů v Nemocnici Na Homolce, která je orientována především na kardiovaskulární pacienty, ukazuje, že nejčastější příčinou HHC je ledvinná insuficience, dále pak deficit vitaminu B12 (hlavně u populace starší 60 let) a konečně enzymový deficit MTHFR [13]. Tento enzymový deficit se vyskytuje u 10 až 15 % naší populace, avšak v nemocniční populaci až ve 43 % [16,22].
HHC z deficitu B12 vzniká z mnoha příčin, nejčastěji při sníženém přívodu v potravě, zhoršené absorpci, deficitním receptoru intrinsic faktoru v ileu, při deficitním transportu transkobalaminu II a konečně při snížené inkorporaci kobalaminu do buněk [9,19,20,27,28]. Deficit folátu je nejčastěji způsobován: a) nedostatečným příjmem listové zeleniny, ve které je kyselina listová nejvíce obsažena, b) špatnou přípravou listové zeleniny, při níž se varem či konzervací zničí až 90 % kyseliny listové, c) dědičným enzymovým deficitem MTHFR – enzymu odpovědného za syntézu substrátu – metyltetrahydrofolátu. Tento je jedinou využitelnou formou cirkulujícího folátu v organizmu nezbytnou pro složitou remetylační reakci methionin syntázy a její reduktázy (obr. 1) [27,28].
Výsledky našich předchozích grantových studií zaměřených na detekci zvýšených hladin Hcy u 11 500 pacientů (1993–2003) ukázaly překvapivě vysokou frekvenci HHC v nemocniční populaci [13]. Respektujíc rozdělení podle Kanga et al – mírná HHC (15–30 μmol/l) byla nalézána ve frekvenci 1 : 3,40; střední (moderate) HHC (30–100 μmol/l) 1 : 45,3 a těžká (> 100 μmol/l) 1 : 760 [16]. Tento alarmující nález nás přinutil k zavedení dostupné rutinní metody stanovení celkového homocysteinu k vyšetření všech pacientů s kardiovaskulárním rizikem už v rámci předoperačního vyšetření nebo před invazivním zákrokem. Tak se nám podařilo kromě stovek mírných HHC zachytit nejenom vysokou hladinu Hcy > 200 μmol/l u pacienta s KH [12], ale i několik těžkých HHC u pacientů se zřetelným deficitem kobalaminu (< 75 pmol/l). Je zvlášť poučné, že jsme tyto pacienty nalézali na JIP s infarktem myokardu nebo plicní embolií bez zvýšeného cholesterolu v krvi. Tato pozorování považujeme za velmi poučná a jelikož je HHC ve srovnání se západními zeměmi u nás jen výjimečně publikována [32], předkládáme tyto kazuistiky k uvážení s cílem přesvědčit internisty, kardiology, neurology a ostatní lékaře, že zvýšený Hcy je významným, přínosným a diagnosticky vděčným laboratorním nálezem, i když ne zcela zatím úspěšně vysvětlitelným.
Metody stanovení
Stanovení celkového homocysteinu (tHcy) v plazmě (= souhrn všech forem homocysteinu po redukci) bylo provedeno na automatickém analyzátoru Synchron LX 20 (Beckman Coulter) homogenní enzymatickou metodou (Carolina, Liquid Chemistries Corp. HCY, kat. č. CC202) [6]. Toto vyšetření je zařazeno do spektra rutinních vyšetření na jednotkách intenzivní péče vedle rutinních biochemických analýz včetně lipidového spektra, stanovovaného na tomtéž analyzátoru.
Zátěžový test s L-methioninem (100 mg/kg hmotnosti) pro diferencování HHC byl prováděn nalačno a za 6 hod po požití substance rozpuštěné v inertním čaji.
Vitamin B12 MEIA byl stanoven na Abbott Axsym; folát v séru chemiluminiscenční EIA na analyzátoru Immulite (DPC); vitamin B6 HPLC na Gold Beckman sety Chromsystems. Rutinní stanovení biochemických markerů v plazmě byla prováděna na analyzátoru Synchron LX 20 Beckman COULTER; u rutinních markerů hematologických byl použit analyzátor Advia 120 Bayer; hemokoagulační vyšetření Protein C, S a APCR provedena na analyzátoru Electra 200. Stanovení Met a ostatních volných aminokyselin proběhlo na automatickém analyzátoru aminokyselin AAA 339 Mikrotechna. Stanovení kyseliny metylmalonové (MMA) v krvi bylo prováděno metodou GCMS na přístroji Finnigan MAT 210.
Určení trombofilních mutací: pro gen 677C<T MTHFR – provedeno dle Frosst et al [8]; leidenská mutace v genu faktoru V a mutace G2021A v genu pro protrombin II byly stanoveny FRET - analýzou. Stanovení deficitu vstřebávání vitaminu B12 bylo provedeno standardním Schillingovým testem – vyšetřením 24hodinové močové exkrece perorálně podaného vitaminu B12 označeného 57Co. U pozitivních nálezů pak bylo potvrzeno přesnějším vyšetřením retence radioaktivního vitaminu B12 v těle po jeho perorálním podání pomocí celotělového detektoru.
Výsledky
Kazuistika I
U 48letého muže, hospitalizovaného pro akutní infarkt myokardu spodní stěny, byla na koronární jednotce nalezena vysoká hladina tHcy 205 μmol/l. Z přijímacího dekurzu: nevýznamná rodinná anamnéza, nikdy nestonal; v dětství provedena operace vrozené katarakty (!); až dosud zdravý kuřák (20 cigaret/den), asi 1 hod před přijetím pocítil krutou retrosternální bolest s vegetativním doprovodem, přivezen na koronární jednotku, kde byla na EKG nalezena typická Pardeeho vlna na spodní stěně, provedena direktní PTCA ACD s implantací stentu s nutností podání ReoPro i.c. a následně i i.v. Pro embolizaci trombotických hmot do periferie ACD; tepna zprůchodněna. Dále provedena PTCA RIVP a PTCA RPLD se založením stentu. Po výkonu přetrvávaly elevace ST na spodní stěně. Fyzikální nález v mezích normy; základní laboratorní vyšetření uvedena v tab. 1. EKG: při příjmu Pardeeho vlna na spodní stěně, zrcadlové změny I a VL; dále typický vývoj s vytvořením úzkého qII, III, aVF s ještě lehce naznačenou elevací ST II, III, aVF a s negativnímT III. ECHO kardio: nevelká porucha kinetiky ve smyslu hypokinezy v posterobazální oblasti, dobrá EF kolem 60 %. Lehká porucha diastolického plnění LK. RTG S + P: bez patologického nálezu.
Tab. 1. Laboratorní hodnoty základních parametrů u kazuistik s hyperhomocysteinemií. 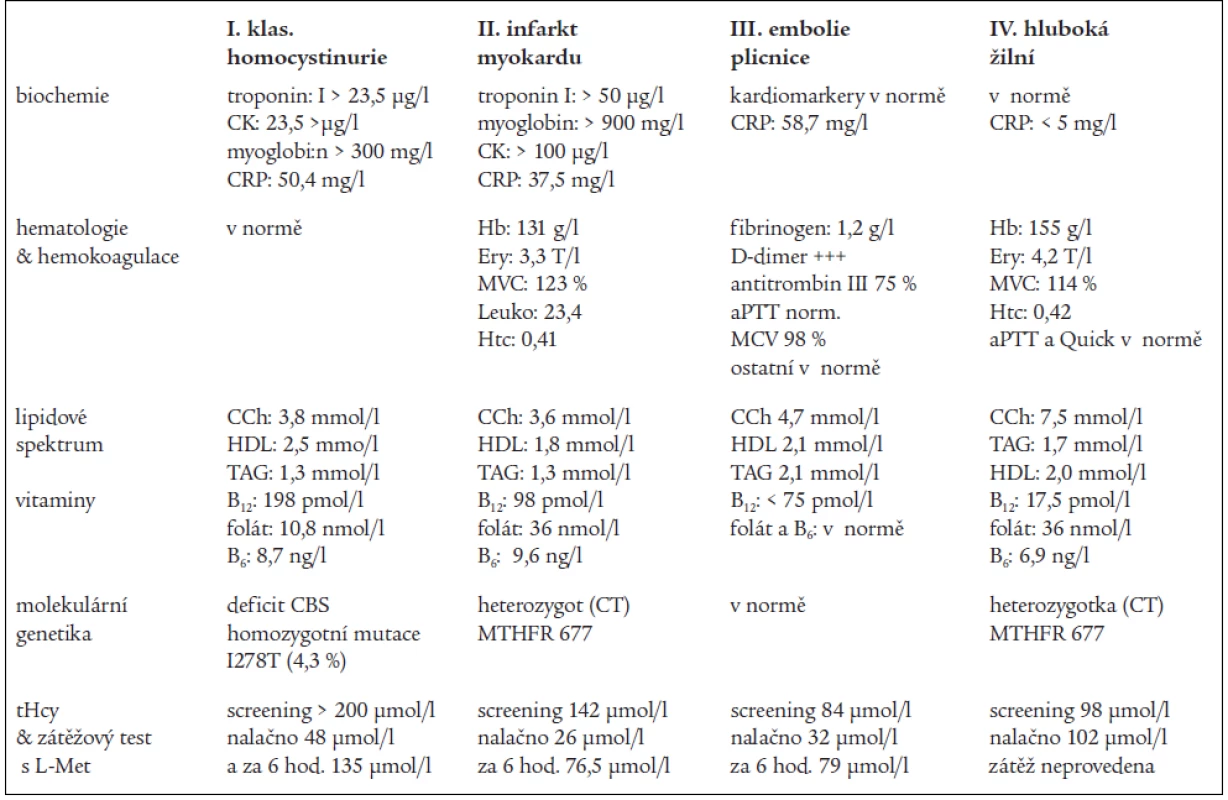
Propuštěn ve stabilizovaném stavu.
Medikace: Ticlid 1–0–1 po dobu 4 týdnů, Anopyrin (100 mg) 0–1–0, Vasocardin 1/2–0–1/2, Gopten 1–0–0, NTG s.l.d.
Metabolická vyšetření: za 6 týdnů po propuštění z koronární jednotky bylo doplněno vyšetření vitaminů a proveden zátěžový test s L-Met. Výsledek byl výrazně pozitivní (tHcy 112 μmol/l, Met 123 μmol/l) – suspektní pro homozygota KH (obr. 3). Hodnoty vitaminů uvádí tab. 1. Vyšetření enzymové aktivity CBS v kultuře kožních fibroblastů potvrzuje jen 4,3% aktivitu, tj. výrazně sníženou s nálezem homozygotní mutace I278T (genotyp c.833 T-C), responzivní na pyridoxin. U matky probanda hladina tHcy v mezích normy (10,2 μmol/l). Otec pro biochemické i genetické vyšetření nedostupný. Rodokmen zachycuje obr. 3.
Obr. 3. Rodokmen pacienta s klasickou homocystinurií a infarktem myokardu doplněný o výrazně pozitivní výsledek zátěžového testu s L-methioninem. 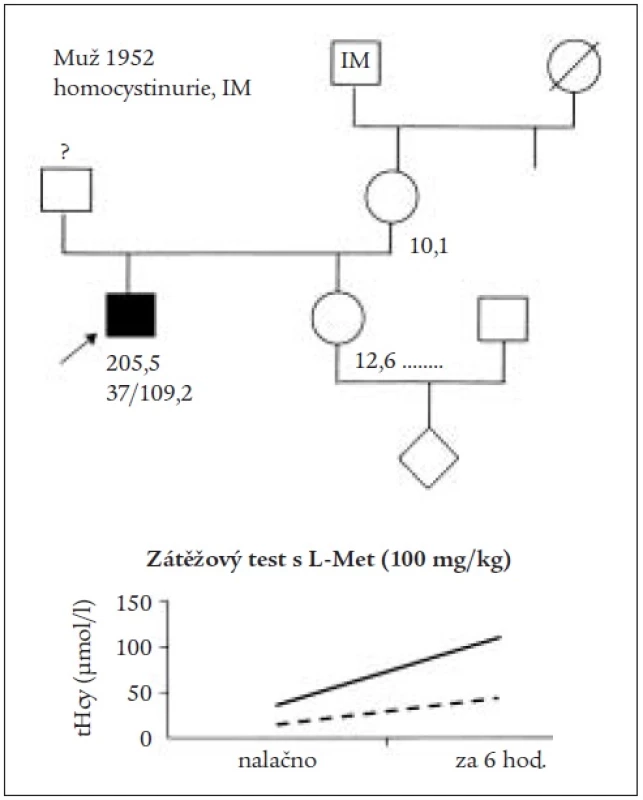
V metabolické ambulanci Ústavu dědičných metabolických poruch 1. LF UK Praha byl pacient naveden na nízkomethioninovou dietu za použití směsi aminokyselin bez Met M-AM3 (Scientific Hospital Supplies) v dávce 3krát 5 g/den doplňovanou megadávkou (500 mg/den) vitaminu B6 spolu a 10 mg folátu/den. Dosaženo snížení hladiny tHcy na 22,5 μmol/l a Met na 43 μmol/l.
Po prostudování zdravotních záznamů z archivu dětského a praktického lékaře je nutno doplnit předchozí anamnézu pacienta ještě o tyto pro KH typické pozitivní nálezy: a) oční (ve věku 8 let) – oboustranná afakie po operaci ektopie očních čoček; pacient má správné brýle a je schopen vykonávat jakékoliv zaměstnání, b) neurologické (ve věku 28 let) – pro drobné psychomotorické záchvaty (Epi-ekvivalenty) léčen 2 roky Sodantonem při lehce abnormním záznamu EEG s výskytem nízké vlny theta, c) interní (ve věku 30 let) – astenický habitus, dolichostenomelie, arachnodaktylie; prekolapsové stavy v.s. vegetativní etiologie; TK 110/70 mm Hg, pulz 72/min; výrazně neurovegetativní osobnost; suspektní Marfanův syndrom(!).
Komentář: Lékař ošetřující dospělého pacienta s infarktem myokardu a enormně vysokým homocysteinem by měl vědět, že dobře léčení pacienti s dědičnou metabolickou poruchou jako např. klasickou homocystinurií se dnes už dožívají dospělého věku, nebo že homocystinurie mají i mírnou klinickou formu, pro kterou byla anamnéza tohoto pacienta typická.
Kazuistika II
54letý muž, kuřák s pozitivní rodinnou anamnézou. Pro silné parasternální bolesti, slabost, pocení přivolaný lékař diagnostikuje akutní infarkt myokardu přední stěny na EKG ověřený typickou Pardeeho vlnou; přeložen na koronární jednotku NNH k provedení přímé PTCA na RIA. Zavedeny 3 stenty, aplikováno ReoPro (abciximab). Průběh Q–infarktu byl bez komplikací. EKG ukazovalo přetrvávající Pardeeho vlnu; EF 55 %. Biochemie: kardiomarkery silně pozitivní (tab. 1). Selektivní screening tHcy 142,5 μmol/l, lipidové parametry v normě, vitamin B12 jen 82 pmol/l(!), MCV 123 % dokazuje makrocytózu; ostatní viz tab. 1.
MMA zřetelně zvýšená 1,7 μmol/l. Zátěžový test s L-Met silně pozitivní (obr. 4). Analýza mutace pro gen MTHFR 677C>T svědčí pro heterozygota. Vyšetření Schillingovým testem dokládá deficit resorpce – 24hodinová močová exkrece 57Co vitamin B12 = 1,3 % podané aktivity. Žaludeční biopsie provedená za měsíc po propuštění prokazuje biopticky hypertrofickou gastritis s intestinální metaplazií a upřesňuje diagnózu perniciózní anémie. Suplementace vitaminem B12 1 000 μg/týdně, zahájená mezitím obvodní lékařkou, normalizuje v průběhu měsíce jak makrocytózu, tak HHC i MMA. Protože při dalším ambulantním monitorování hladin vitaminů dochází při léčbě k poklesu hladiny folátu, kardiologická a kobalaminová léčba doplněna o dávku 5 mg folátu/týdně. Rodokmen dokládá výraznou rodinnou kardiovaskulární zátěž ze strany matky (obr. 4).
Obr. 4. Rodokmen pacienta s hyperhomocysteinemií z deficitu vitaminu B<sub>12</sub> pri akutním infarktu myokardu. Vpravo pozitivní výsledek zátežového testu pacienta s L-methioninem za 6 hod. 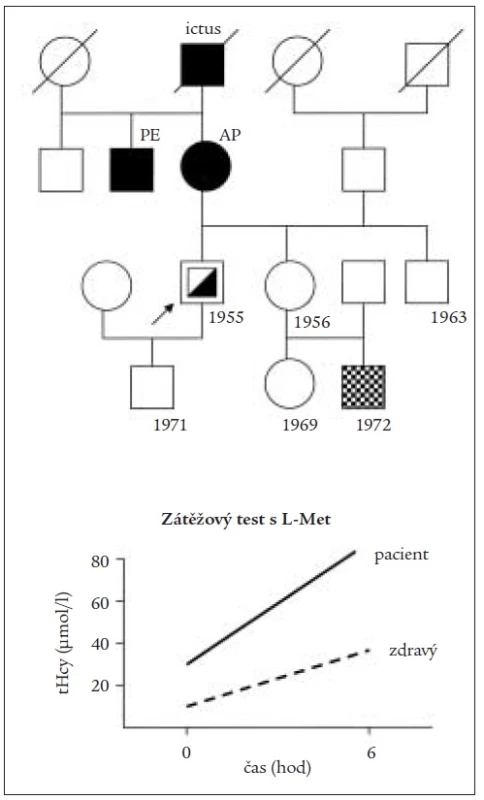
Komentář: Makrocytóza spolu s vysokým homocysteinem by měla vést lékaře k podezření na deficit kobalaminu a z jeho chronického nedostatku indukované hyperhomocysteinemie.
Kazuistika III
47letý muž, aktivní sportovec, kuřák (5–10 cigaret/den), rodinná anamnéza bezvýznamná. Pro rychle se vyvíjející dušnost v posledních 4 dnech a parasternální bolesti vysloveno podezření na infarkt myokardu. Přeložen na kardiologickou JIP, kde byla diagnostikována masivní embolizace plicnice s přetížením pravé komory; na CT-angio-plicnice (kraniokaudální scanování): patrno rozšíření plicnice na asi 55 mm. V kmenech obou pulmonálních arterií patrny hypoechogenní hmoty denzity okolo 30 HU – emboly, které jsou již z části obtékány kontrastní látkou, emboly se též propagují do lobárních a segmentálních větví oboustranně, přičemž lobární větve jsou vyplněny téměř kompletně. ECHOkardio: pokročilá plicní hypertenze (ACT 40 ms); dilatace pravé komory (34 mm) a paradoxní pohyb septa – nález podporuje diagnózu plicní embolie. Krevní plyny: pH 7,54; hypoxemie (6,8 kPa), hypokapnie (2,7 kPa); hyposaturace (90,6 %). TK 119/80 mm Hg; TF 74/min. 2. den pobytu provedena trombolýza – Actilysa 100 mg/2 hod i.v., následovala 2denní kontinuální heparinizace dle aPPT, pak převeden na Warfarin. Po celou dobu byl oběhově stabilní. Laboratorní nálezy ukazuje tab. 1. Potvrzena zvýšená hladina tHcy 72 μmol/l nalačno i po zátěži při normální hladině Met (obr. 5); zvýšená MMA 1,7 μmol/l; lipidové spektrum v normě (!).Výrazné snížení vitaminu B12 (< 75 pmol/l) při vysoké hladině folátu a pyridoxinu. Výsledek Schillingova testu nehodnotitelný pro interferenci s plicním scanem; test opakován za 1 týden s výsledkem močové exkrece 57Co pouze 1,8 %! Gastroskopie potvrzuje chronickou gastritis; doloženy pozitivní protilátky proti parietálním buňkám. Po i.m.podání 5krát 300 μg vitaminu B12 je kromě kardiologické léčby podáván METAVIT – (Biomedica Praha – směs pro metabolizmus Hcy kritických vitaminů v sirupu: folát, B12 , B6 , B2) 1 lžíce/den. Monitorování tHcy, folátu, B12 a B6 ukazuje normální hodnoty, makrocytóza vymizela.
Obr. 5. Rodokmen a pozitivní výsledek zátežového methioninového testu u pacienta s embolií plicnice a hyperhomocysteinemií z deficitu kobalaminu. 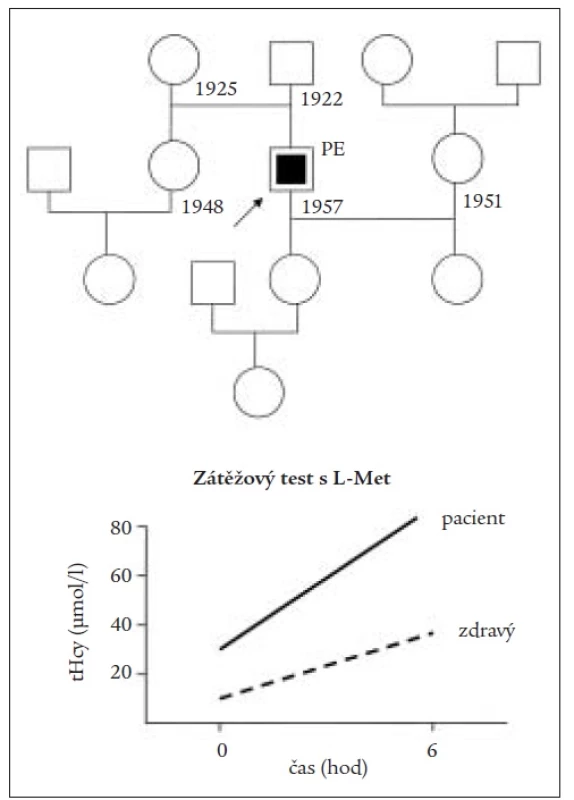
Komentář: Závažná tromboembolická příhoda bez zvýšení celkového cholesterolu (CCh) by měla indikovat hledání dalších rizikových faktorů, jakým je např. vysoký homocystein.)
Kazuistika IV
54letá žena s výraznou rodinnou tromboembolickou zátěží byla zachycena selektivním screeningem na homocystein v cévní ambulanci, kde byla vyšetřována pro hlubokou žilní trombózu PDK; tato se vyvinula v 6. měsíci po hysterektomii; warfarinizována (3 mg) a při dalších kontrolách nalezena makrocytóza, vysloveno podezření na perniciózní anémii, ale protože byla warfarinizována (3 mg/den), nebyla biopsie žaludeční sliznice provedena; gastroskopie s normálním nálezem. Zahájena léčba injekčně podávaným vitaminem B12 (1000 μg), ale pro alergickou vyrážku léčba přerušena. V ambulanci pro profesionální dermatózy (VFN Praha) potvrzena přecitlivělost na nikl a ev. další těžké kovy, proto od další injekční léčby B12 upuštěno. V metabolické ambulanci nalezen deficit vitaminu B12 17,5 pmol/l (!); protilátky proti parietálním buňkám pozitivní; výrazná HHC 98 μmol/l; vysoká MMA 0,8 μmol/l. MCV 114 %, heterozygotka pro MTHFR mutaci; ostatní viz tab. l. Schillingův test ukazuje jen 2,7 % absorbovaného množství 57Co. Po zajištující antialergické léčbě (Zyrtec 10 mg/den) podáno perorálně 50 μg/den cyanokobalaminu (Milgamma) bez alergizujících účinků. Dávka zvyšována až na 200 μg/d. Do 1 měsíce vymizela makrocytóza, HHC i MMA. Mírná alergická reakce však přetrvává. Dcera pacientky je rovněž heterozygotka pro MTHFR mutaci. Rodokmen uvádí obr. 6.
Obr. 6. Rodokmen pacientky s hlubokou žilní trombózou a hyperhomocysteinemií. 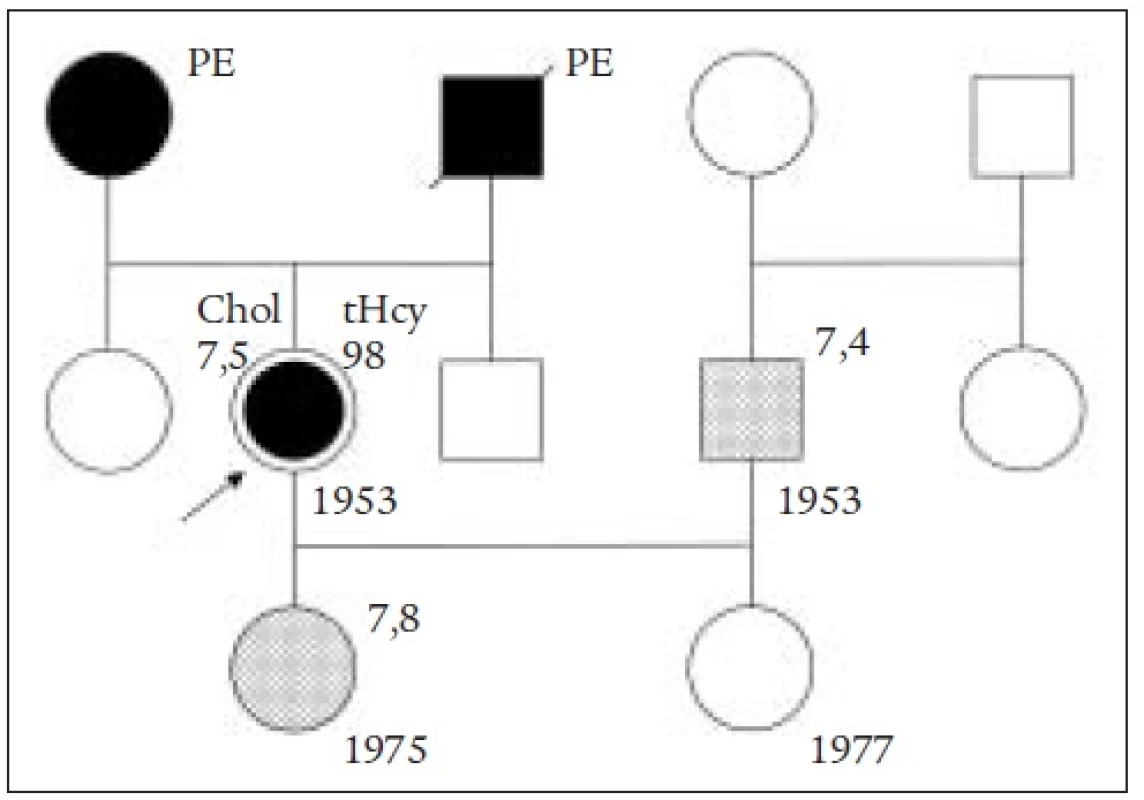
Komentář: Nevysvětlená příčina hluboké žilní trombózy u heterozygotky MTHFR spolu s makrocytózou a suspektní perniciózní anémií si žádala stanovení Hcy, kterým by se vysvětlily obě příčiny vzniku HHC a jejího toxického působení.
Diskuse
Při současném stadiu poznání se zvýšená hladina Hcy považuje za diagnostický marker deficitní remetylace, z níž rezultuje snížená metylace DNA, mDNA, neurotransmiterů, fosfolipidů, biogenních aminů aj [14,27,28]. Snížená metylace může zasahovat svým nepříznivým účinkem nejenom do patogenezy KVO a defektů neurální trubice (NTD), ale také urychlovat rozvoj demence, působí kolagenové poruchy a zasahuje do metabolizmu nádorového bujení [5].
Shora uvedené vybrané kazuistiky sebrané v průběhu posledních 2 let jsou názorným příkladem užitečnosti a diagnostického významu rutinního stanovení hladiny tHcy v krvi jako markeru signalizujícího kardiovaskulární či tromboembolické postižení [1,3,12,17,25,29]. Zvláště užitečné je vyšetření hladiny Hcy u pacientů, u kterých jsou lipidové markery typické pro ATS negativní. U popisovaných pacientů byly hladiny CCh normální a rodinná anamnéza nevýznamná. Pouze kouření u obou mužů bylo známým rizikovým faktorem, který ale potencuje i rozvoj HHC [24]. Zdálo by se, že infarkt nebo embolie uhodily nečekaně z plného zdraví, což ale není pravda. Zvýšená hladina Hcy v krvi trvala již 15–20 let a svým toxickým účinkem poškozovala všechny mezenchymální tkáně včetně endoteliální výstelky. U pacienta s homocystinurií působilo poškozování již od útlého dětství; typický marfanoidní habitus, bilaterální operace očních čoček měly u vzdělaného lékaře vzbudit alespoň podezření na homocystinurie a odeslat pacienta ke genetikovi nebo do metabolické ambulance [11,17,25,27].
Predikovat infarkt nebo tromboembolickou příhodu bez stanovení Hcy nebylo u našich pacientů možné, neboť nemocní nikdy žádné potíže typické pro ICHS až do kritického okamžiku tromboembolické příhody nevykazovali. Vysvětlení zvýšené hladiny Hcy u našich pacientů je snadné: výrazný a zřejmě dlouhotrvající deficit vitaminu B12 – koenzymu klíčové remetylační reakce methionin–syntházy a její reduktázy (obr. 1) [9]. Dlouhodobý nedostatek vitaminu B12 dokazovala i vysoká hladina MMA, která je u nás málo indikována, zatímco ve skandinávských zemích doporučována jako potvrzující vyšetření deficitu kobalaminu spolu s tHcy. Deficit vstřebávání B12 byl u všech našich pacientů potvrzen Schillingovým testem; jeho provedení v modifikaci celotělového počítače považujeme za velmi efektivní a přínosné pro odlišení alespoň těch nejčastějších metabolických poruch provázených sníženým kobalaminem a folátem. Dědičné metabolické poruchy provázené megaloblastickou anémií musíme při neúspěchu ponechat odborníkům, protože přímá stanovení transcobalaminu II a frakce kobalaminů C, F, E, G jsou pro nás zatím obtížně dostupná.
Oceňujeme, že od 70. let minulého století už není věnována zvýšená pozornost jen energetickému příjmu potravy ve smyslu nadvýživy nebo podvýživy, ale objevuje se nový prvek tzv. „funkčního významu“ přijímaných potravin – vitaminů skupiny B [4,9,15,24,30]. Úspěch podávání folátu nebo folátem obohacených potravin těhotným s cílem snížení výskytu NTD v posledním desetiletí výrazně urychlil zahájení fortikace potravin s cílem následného snížení homocysteinemie [21]. Tím bylo dosaženo i snížení tromboembolických komplikací jak u cerebro - tak u kardiovaskulárních onemocnění, což prokazuje Framighamská studie u seniorů [18]. Studie vyvolala entuziasmus pro tuto preventivní činnost, který však dosud nepřináší jednoznačné pozitivní výsledky. Metabolické pozadí této skutečnosti, která se moderně nazývá „folátová nutrigenomika“ nebo „ekogenetika“, je totiž mnohem složitější [19,20]. Uplatňuje se především v metylaci 5-cytosinu a 5-uracilu a udržení vhodných metylačních poměrů v lidském genomu. Při její poruše se může manifestovat různě intenzivně a na různých orgánech. Intenzivní studium patogenezy HHC ukazuje, že Hcy je až ten následný článek celého řetězu metabolických a genetických reakcí, jenž mohou toxické účinky Hcy někdy potencovat, jindy naopak inhibovat [5,7]. Deficitní mutovaná MTHFR se významně uplatňuje hlavně u homozygotních nosičů (TT), pokud mají nízkou hladinu folátu v krvi.
Pro lékaře však znamená nález výrazně zvýšené hyperhomocysteinemie(> 30 μmol/l) vždy významný rizikový faktor, který je negativně prognosticky důležitý hlavně tam, kde jsou lipidové rizikové faktory negativní. Stanovení tHcy však musí být potřebným pacientům dostupné rutinní lacinou metodou proveditelnou v každé okresní laboratoři (viz naše metodika). Definitivní rozhodnutí o významnosti snižování homocysteinemie přinese až výsledek celopopulační studie folátem a kobalaminem fortifikované stravy probíhající druhým rokem v USA [21].
S léčebným podáním kritických vitaminů, které hladinu homocysteinu výrazně snižují a jsou cenově dostupné, bychom podle dosavadních dobrých zkušeností však neměli podle našich zkušeností váhat [4,13,15,18,21].
Podpořeno grantem IGA MZCR č. NA 6497-3.
Seznam zkratek používaných v textu:
ACD – arteria coronaria dextra; AP – angina pectoris; CBS – cystathionin-betasyntáza; CCh – celkový cholesterol; Co – kobalt; CRP – C–reaktivní protein; FBG – fibrinogen; Hcy – homocystein; tHcy – celkový homocystein (total homocysteine); HHC – hyperhomocysteinemie; ICHS – ischemická choroba srdeční; L-Met - L–methionin; Lp(a) – lipoproteien a; KH – klasická homocystinurie; KVO – kardiovaskulární onemocnění; MMA – kyselina metylmalonová; MS – methionin syntáza; MTRR – reduktáza methionin syntázy; MTHFR – 5,10-metylentetrahydrofolát-reduktáza; NNH – Nemocnice Na Homolce; NTD – defekty neurální trubice (neural tube defect); PE – plicní embolie; PGA – pteroylglutamát; PTCA – perkutánní transluminální koronární angioplastika; WHO – Světová zdravotnická organizace; TAG – triacylglyceroly; tPA – tkáňový aktivátor plazminogenu
prof. MUDr. Josef Hyánek, DrSc.
www.homolka.cz
e-mail: josef.hyanek@homolka.cz
Doručeno do redakce: 11. 5. 2004
Přijato po recenzi: 22. 6. 2004
Zdroje
1. Chambers J. Homocysteine and vascular disease. Euromedlab Barcelona 2003, 50.
2. Chapman MJ, Huby T, Nigon J. Lipoprotein( a) implication in atherogenesis. Atherosclerosis 1994; 110 : 69–72.
3. Clarke R, Lewington S. Homocysteine and prediction of coronary heart disease and stroke. Klin Biochem Metab 2003; 11(32): 132–135.
4. Constans J, Blonn DA, Resplandy F et al. Three months supplementation of hyperhomocysteinemic patients with folic acid and vitamin B6 improves biological markers of endothelial dysfunction. Brit J Haematol 1999; 107 : 776–778.
5. Dong C, Yoon W, Goldschmidt-Clermont PJ. DNA Methylation and Atheroslerosis. J Nutr 2002; 132 : 2406S – 2409S.
6. Dubská L, Hyánek J, Pejznochová H et al. Stanovení celkového homocysteinu homogenní enzymatickou metodou na analyzátoru Synchron LX20, Beckman Coulter. Klin Biochem Metab 2003; 11(32): 231–234.
7. Friso S, Choi SW, Girelli D et al. A common mutation in the 5,10-methylenetetrahydrofolate reductase gene affects genomic DNA methylation through an interaction with folate status. Proc Natl Acad Sci USA 2002; 99 : 5606–5611.
8. Frosst P, Blom HJ, Milos R et al. A candidate genetic risk factor for vascular diseases: a common mutation in methylentetrahydrofolate reductase. Nature Genet 1995; 10 : 111–113.
9. Green R, Miller JW. Folate deficiency beyond megaloblastic anemia: hyperhomocysteinemia and other manifestations of dysfunctional folate status. Semin Hematology 1999; 36 : 47–64.
10. Harpel PC, Chang VT, Boirth W et al. Homocysteine and other sulfhydryl compounds enhance the binding of Lp(a) to fibrin: a potential biochemicallink between thrombosis, atherogenesis and sulfhydryl compound metabolism. Proc Nat Acad Sci USA 1992; 89.
10193–10197.
11. Hyánek J, Kavka J, Seemanová E. Homocystinurie. Čs Pediat 1972; 27 : 394–398.
12. Hyánek J, Matoušková J, Kmoníček P. Selektivním screeningem detekovaná homocystinurie až po Q–infarkt myokardu na koronární jednotce. Cor et Vasa 2003; 45(9): 459–462.
13. Hyánek J. Hyperhomocysteinemie a její diagnostický význam u pacientů na jednotkách intenzivní péče. Grant č. NA 6497–3, IGA MZČR, 2003.
14. James SJ, Melnyk S, Pogribna M et al. Evaluation in S-Adenosylhomocysteine and DNA Hypomethylation: Potential Epigenetic Mechanism for Homocysteine-related Pathology. J Nutr 2002; 132(Suppl): 2361S–2366S.
15. Joosten E, v. den Berg A, Riezler R et al. Metabolic evidence thet deficiencies of vitamin B-12 (cobalamin), folate, and vitamin B-6 occur commonly in elderly people. Am J Clin Nutr 1993; 58 : 468–476.
16. Kang SS,Wong PW, Bock HG et al. Intermediate hyperhomocysteinemia resulting from compound heterozygozity of methyltetrahdyrofolate reductase mutations. Am J Hum Genet 1991; 48 : 546–551.
17. Kožich V, Kraus J, Hyánek J. Homocystein, geny a vitaminy: souvislost s kardiovaskulárním onemocněním a komplikacemi v těhotenství. DMEV 1999; 3 : 113–120.
18. Lindebaum J, Rosenberg IH, Wilson P et al. Prevalence of cobalamin deficiency in the Framingham elderly. J Clin Nutr 1994; 60 : 2–11.
19. Lucoc M. Is folic acid the ultimate functional food component for disease prevention? BMJ 2004; 328 : 211–214.
20. Lucoc M. Folic acid: nutritional biochemistry, molecular biology and role in disease processes. Mol Genet Metab 2000; 71 : 121–128.
21. Malinow MR, Bostom AG, Krauss RG. Homocyst(e)ine, diet and cardiovascular diseases: a statement for health care professionals from Nutrition Comittee American Heart Association. Circulation 1999; 99 : 178–182.
22. Matalon R, Rady S, Szucs K et al. Polymorphismus MTHFR and MTRR in Czech Patients with Cardiovascular Diseases and Stroke. Čes Slov Pediatrie 2003, 58 : 403–404.
23. McCulley KS, Radsgale BD. Production of atherosclerosis by homocysteinemia. Am J Pathol 1970; 61 : 1–8.
24. Nygaard O, Vollset SE, Refsum H. Total plasma homocysteine and cardiovasular risk profile. J Amer Med Ass 1995; 274 : 1526–1533.
25. Orendáč M, Kožich V, Zeman J et al. Klinický obraz homocystinurie z deficitu cystathionin-beta-syntházy u devatenácti českých a slovenských pacientů. Čas Lék Čes 2000; 139 : 500–507.
26. Ravnskov U, Pollmeer U. Mythhos Cholesterin: die Zehn Grösten Irtümer. Stuttgart: S Hirzel Verlag 2002.
27. Scriver CR, Beaudet AL, Sly WS et al. The metabolic and genetic bases of inherited disease. New York: McGraw Hill 1995.
28. Selhub J. Homocysteine metabolism. Ann Rev Nutr 1999; 19 : 217–246.
29. Stanger O, Herrmann W, Pietrzik K et al. Koncensus der D.A.CH. – Liga Homocystein über der rationallen kardiovaskularen und trombotischen Erkrankungen-Richtlinien und Empfehlungen. J Kardiol 2003; 10(5): 190–199.
30. Škodová Z, Píša Z, Poledne R et al. Je nedávný pokles cholesterolemie v ČR průkazný? Čas Lék Čes 1996; 135 : 589–593.
31. Švehlová M, Štěpánková L, Kaupcová P et al. Trombóza portální žíly u pacienta s hyperhomocysteinemií. Vnitř Lék 2002; 48(7): 671–674.
32. Ueland J et al. The Hordaland Homocysteine Studies. Lipids 2001; 36: S33–S39.
33. Wilcken DEL, Wilcken B. The pathogenesis of coronary artery disease: possible role of methionine metabolism. J Clin Invest 1976; 57 : 1079–1082.
34. Worthley SG et al. Coronary artery disease: pathogenesis and acute coronary syndrome. Mt Sinai J Med 2001; 68 : 167–181.
35. Familial Hypercholesterolemia. Report of WHO Consultations. WHO Press, 1998.
36. Harmonized Clinical Guidelines on Prevention of Atherosclerotic Vascular Disease. Executive Summary IAS 2003.
Štítky
Diabetológia Endokrinológia Interné lekárstvo
Článek Kombinovaný aerobní trénink
Článok vyšiel v časopiseVnitřní lékařství
Najčítanejšie tento týždeň
2005 Číslo 4- Parazitičtí červi v terapii Crohnovy choroby a dalších zánětlivých autoimunitních onemocnění
- Intermitentní hladovění v prevenci a léčbě chorob
- Rizikové období v léčbě růstovým hormonem: přechod mladých pacientů k lékařům pro dospělé
- Statinová intolerance
- Monoklonální protilátky v léčbě hyperlipidemií
-
Všetky články tohto čísla
- Epidemiologická analýza pacientů podstupujících trvalou kardiostimulaci
- Význam monitorování hladin α−fetoproteinu u chronických infekcí viry hepatitidy B a C
- Rehabilitace po infarktu myokardu a revaskularizaci u starších nemocných
- Rehabilitace pro infarktu myokardu a revaskularizaci
- Kombinovaný aerobní trénink
- Kmenové buňky v kardiologii, opatrnost na prvním místě!
- Hyperhomocysteinemie jako rizikový faktor: fakt nebo fikce?
- Jaké jsou znalosti našich lékařů o rizikových faktorech ischemické choroby srdeční? Porovnání se stavem v roce 1991
- Epidemiologická analýza pacientů podstupujících trvalou kardiostimulaci na Interní kardiologické klinice Fakultní nemocnice Brno, pracoviště Bohunice
- Klinický význam mírně zvýšených hodnot α−fetoproteinu v séru u pacientů s chronickou hepatitidou C a B
- Rehabilitace po infarktu myokardu a revaskularizaci u starších nemocných
- Vliv kombinovaného aerobního tréninku na změny autonomní modulace u nemocných po akutním infarktu myokardu
- Pleurální výpotek v interní praxi
- Molekulární patofyziologie pozdních komplikací diabetes mellitus – genetická predispozice k rozvoji diabetických komplikací
- Transplantace kmenových buněk v kardiologii
- Aortální stenóza, skleróza a ateroskleróza
- Je hyperhomocysteinemie stále jen zajímavý, ale diagnosticky nevýznamný nález?
- Neobvyklý způsob neinvazivní objektivizace ischemie myokardu chladovou zátěží
- Vyučování etiky na lékařské fakultě: cesta od deskriptivní etiky k mravním normám
- Postavení výuky interní propedeutiky (a oboru vnitřního lékařství obecně) v době stále pokračující specializace v oblasti interní medicíny
- Poršová-Dutoit I. Mužský hypogonadismus. Nedostatečná funkce mužských pohlavních žláz
- Novák M. Sonografická diagnostika náhlých příhod břišních
- Vnitřní lékařství
- Archív čísel
- Aktuálne číslo
- Iba online
- Informácie o časopise
Najčítanejšie v tomto čísle- Klinický význam mírně zvýšených hodnot α−fetoproteinu v séru u pacientů s chronickou hepatitidou C a B
- Pleurální výpotek v interní praxi
- Aortální stenóza, skleróza a ateroskleróza
- Je hyperhomocysteinemie stále jen zajímavý, ale diagnosticky nevýznamný nález?
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



